REGISTRO DOI: 10.69849/revistaft/fa10202411101304
Giovanna Maria Benetti1,
Nayara Carolina Duarte1,
Rodrigo Vieira Canuto Marques1,
Orientadora: Renata Sanches1
RESUMO
Recentemente encontramos o mundo em estado de pandemia causada pelo vírus SARS-CoV-2, ocasionado a chamada COVID-19, a qual causou grande impacto em diversos aspectos e instâncias. Consequentemente, com o passar do tempo pesquisadores entraram em campo para entender mais sobre etiologia, imunidade, profilaxia, dentre outros avanços para enfrentar e entender a nova efemeridade que abrange o mundo. Diante de diversas análises, estudos, pesquisas, cada vez mais a COVID-19 se encontra correlacionada com outras doenças, tanto em agravamento de quadros clínicos, surgimentos e propensões das mais variadas possibilidades. A pesquisa presente dispõem em atenção a contribuição da COVID-19 no avanço de indivíduos com a propensão de doenças crônicas tais como: Diabete Mellitus, Asma, Alzheimer.
Palavra-Chave: COVID-19, SARS-CoV-2, Doenças Crônicas.
ABSTRACT:
Recently we found the world in a state of pandemic caused by the SARS-CoV-2 virus, caused by the so-called COVID-19, which caused a great impact in several aspects and instances. Consequently, over time researchers entered the field to understand more about etiology, immunity, prophylaxis, among other advances to face and understand the new ephemerality that covers the world. In view of various analyses, studies, research, COVID-19 is increasingly found to be correlated with other diseases, both in worsening clinical conditions, emergencies and propensities of the most varied possibilities. This research focuses on the contribution of COVID-19 to the advancement of individuals prone to chronic
Diseases: Diabetes Mellitus, Asthma, Alzheimer’s.
INTRODUÇÃO
A propagação global da COVID-19, causada pelo novo vírus SARS-CoV-2, desencadeou uma crise de saúde pública sem precedentes, impactando profundamente a sociedade e os sistemas de saúde em todo o mundo [1]. Desde o seu surgimento na cidade de Wuhan, na China, em dezembro de 2019, a doença evoluiu rapidamente, levando a Organização Mundial da Saúde a declarar uma pandemia em março de 2020 [2].
O cenário emergencial ocorreu com aumento exponencial de casos e mortes, desafiando a capacidade de resposta dos governos e das instituições de saúde [2]. Onde em março de 2020, a estimativa era de existirem 760.040 casos e 40.842 mortes, contudo em setembro de 2020, este mesmo número teve um aumento excessivo para 32.925.668 casos confirmados e 995.352 mortes [1].
Com este contexto, é fundamental compreender não apenas a origem e a propagação do vírus, mas também os aspectos clínicos, genéticos e epidemiológicos da COVID [3], para o desenvolvimento de estratégias eficazes de prevenção, diagnóstico e tratamento. No que se refere a pandemia evidenciou a importância da saúde pública e da vigilância sanitária na proteção da população e no controle de surtos e epidemias [4].
Diante desse panorama, esta revisão de literatura visa analisar a resposta imune do hospedeiro frente à infecção pelo SARS-CoV-2, mostrando características genéticas, estruturais do vírus, relatando estratégias de detecção e diagnóstico da COVID-19 em pacientes com doenças crônicas [5], como a doença de Alzheimer que possui uma condição neurodegenerativa progressiva e irreversível marcada pela perda extensiva de sinapses e morte neuronal nas áreas cerebrais responsáveis pelas funções cognitivas, diabetes mellitus que compromete a utilização eficiente da glicose no sangue, caracterizada pela hiperglicemia devido a falhas na secreção da insulina ou à deficiência de sua ação; e a asma, doença que por sua vez limita o fluxo aéreo, a inflamação das vias aéreas e uma hiperresponsividade, o qual pode levar a sintomas graves como falta de ar e tosse. [6, 7, 8, 9]. Assim com o impacto da pandemia nas políticas de saúde pública, trazer melhoria na qualidade de vida desses indivíduos [4, 10].
Por fim, a presente pesquisa visa contribuir para o avanço do conhecimento científico sobre a COVID-19 [11] e suas implicações para a saúde pública [4], fornecendo subsídios para a elaboração de políticas e práticas de saúde mais eficazes e centradas no paciente [12]. Espera-se que os resultados apresentados subsidiem a tomada de decisão dos profissionais de saúde e dos gestores públicos, envolvendo a proteção da população e o enfrentamento de futuras emergências sanitárias [4,10].
MÉTODOS
Para a realização deste artigo foram analisados 50 artigos de pesquisas bibliográficas. Com base nos artigos científicos nacionais, internacionais, para a extração de informações das quais favorecessem a pesquisa.
SURGIMENTO DO SARS-CoV-2 E SEU IMPACTO MUNDIAL
Recentemente o mundo enfrentou uma crise, após a descoberta de um vírus pré-existente, se tratando de uma enfermidade respiratória aguda grave (SARS), causada pelo membro da família coronavírus (CoV) [4]. O SARS-CoV-2 é um dos sorotipos de coronavírus que foi responsável pela COVID-19 (Corona Virus Disease 2019) [13].
Em dezembro de 2019, a Organização Mundial da Saúde (OMS) foi acionada devido a uma recorrência de pneumonia de causa desconhecida na China [1]. A crise foi atribuída devido ao hábito alimentar dos chineses, que também estão presentes em outros países, onde há consumo de carnes frescas de animais, sejam eles silvestres ou domésticos [14].
A China é retratada então como o epicentro, devido à contaminação dos mercados onde os alimentos não possuíam a devida refrigeração e embalagem [14]. O animal investigado, sendo o causador com base no sequenciamento genético do vírus, se dá ao morcego ou pangolim [1, 14].
Com o súbito aumento de números de casos em diversos países, a OMS em janeiro de 2020 declarou emergência de saúde pública internacional, [1] decretando estado de pandemia, com isso todos os países deveriam realizar planos de contingência para minimizar os danos e os números de infecções propriamente ditos. A velocidade da contaminação e a própria gravidade do vírus, podem ser observados pelos números fornecidos os quais em março de 2020, possuímos uma estimativa que existiam 760.040 casos e 40.842 mortes, contudo em setembro de 2020, este mesmo número teve um aumento excessivo para 32.925.668 casos confirmados e 995.352 mortes [1]. Com o aumento inesperado de infectados e mortos, o epicentro da doença foi alternando rapidamente entre os países [1, 4].
A taxa de letalidade foi considerada, cerca de dez vezes maior que a influenza sazonal. Os dados apresentados com o cenário emergencial, envolve a saúde pública e a vigilância sanitária [4].
A manifestação clínica que envolve a Covid-19 se trata da febre, variando de 44% a 89% dos casos, tosse e fadiga [1, 15]. Às vezes ocorre o comprometimento das vias respiratórias, podendo evoluir para uma dispneia crônica ou aguda [4], que nada mais é do que a falta de ar que conhecemos ao praticarmos exercícios físicos, contudo dispneia nesse caso é encontrada em tarefas simples do dia-a-dia. Podendo ser apresentado também distúrbios no paladar (anosmia) e olfato (disgeusia) com frequência variando de 19,4% a 88% [15].
Apresentam também a síndrome do desconforto respiratório agudo (SDRA) [4], sendo uma condição na qual no pulmão há acúmulo de fluidos, impedindo que seja liberado oxigênio para os órgãos gerando uma lesão pulmonar, contudo com o avanço desse quadro temos a falência múltiplas de órgãos levando ao óbito, podendo estar relacionada com a sepse ou uma lesão aguda no miocárdio [4].
A presença dessas manifestações clínicas com um ou mais sintomas, depende da interação do hospedeiro com o vírus, sendo assim dependente exclusivamente da resposta imune do hospedeiro [4], o qual será decisivo para a predisposição da progressão acelerada e grave da doença.
ASPECTOS ETIOLÓGICOS DO SARS-CoV-2
O coronavírus foi descrito pela primeira vez em 1960 [1], sendo um dos maiores vírus constituído de ácido ribonucleico(RNA) [11, 16].
Figura 1 – Estrutura do vírus SARS-CoV-2.
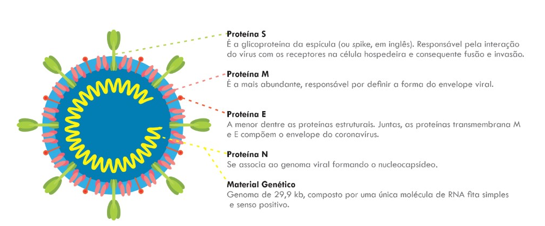
Adaptado de Felício LV, et al. A emergência de um novo coronavírus zoonótico [15].
A figura 1 ilustra os vírions são partículas esféricas envelopadas, que possuem:
- Proteína Spike (S), que se trata de espículas glicoproteicas dispostas em sua superfície, devido a esse aspecto fica similar a uma coroa, chamada em latim de corona, liga a receptores das células humanas que permite a entrada viral na célula do hospedeiro;
- Proteína M, responsável por definir o aspecto do envelope viral, sua interação com a proteína S, é fundamental para a incorporação aos novos vírions;
- Proteína E, é expressa dentro da célula infectada durante o ciclo de replicação, sabendo disso sabemos que a proteína M e E juntas compõem o envelope do vírus;
- Proteína N, é a única que se liga ao genoma viral formando o nucleocapsídeo [15, 16].
O SARS-CoV-2 pertence ao grupo 0-COV, como o MERS-CoV e o SARS-CoV, apresentando uma similaridade genômica de aproximadamente 50% e 80% [1]. O receptor do SARS-CoV e do SARS-CoV-2 é bastante semelhante, sendo que o modo de entrada na célula hospedeira é pela ligação de suas proteínas S com os receptores da enzima conversora de angiotensina 2 (ECA2) na célula hospedeira, sendo um receptor altamente expresso em uma ampla variedade de células humanas [1, 15].
Figura 2 – Ações da angiotensina.
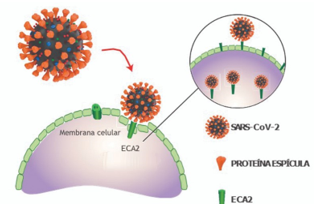
Adaptado de Brandão SCS, et al. COVID-19 grave: entenda o papel da imunidade, do endotélio e da coagulação na prática clínica [17].
APÓS A ENTRADA DO SARS-CoV-2 NO ORGANISMO
O envelope viral se funde com a membrana citoplasmática do hospedeiro, permitindo sua entrada no citosol da célula através da endocitose pela célula-alvo. Ao chegar ao endossomo, o ácido ribonucleico (RNA), onde são encaminhadas ao complexo de Golgi através do compartimento intermediário RE-Golgi [1, 4]. Assim, as vesículas que contêm as partículas virais se fundem com a membrana citoplasmática, permitindo sua liberação por brotamento [4].
O período de incubação médio da COVID-19 está em torno de 1 a 14 dias [15]. As manifestações clínicas dão início por volta do 4 dia após a exposição [15, 16], com variações, sendo que quanto mais longo período o mesmo pode favorecer a ameaça de uma propagação [1].
O SARS-CoV-2 não é caracterizado por uma patogenicidade de alta virulência, ou seja, à capacidade do vírus ou bactéria de se disseminar no corpo causando doenças, contudo, ele se alastrou rapidamente por diferentes continentes, sendo transmitido de pessoa para pessoa [4]. No caso da COVID-19, a transmissão do vírus é realizada através da fala, tosse, espirro e gotículas respiratórias que contenha o vírus [1, 4], podendo permanecer em superfícies como aço e plástico por até 72 horas, dessa forma ambientes fechados e aglomerados favorecem a propagação do vírus [4].
Entre os coronavírus já identificados, o SARS-CoV-2 é o sétimo a ser reconhecido como causador de doenças em seres humanos [1, 16], sendo o terceiro a desencadear uma epidemia [1], após o surgimento da síndrome respiratória aguda grave (SARS-CoV) e da síndrome respiratória do Oriente Médio (MERS-CoV), que resultaram em sintomas severos nas vias aéreas e altas taxas de mortalidade. Já os outros que são considerados endêmicos (HKU1, OC43, 229E e NL63) [ 1, 16], manifestam sintomas leves similares aos de um resfriado comum e responsáveis por aproximadamente 10% das doenças respiratórias sazonais que não estão relacionadas à gripe [1].
Tabela 1 – Estágios da doença SARS-CoV-2 em humanos.
Estágio 1 Estágio 2 Estágio 3 Estágio 4 Período de incubação Paciente assintomático Com ou sem vírus detectável. Período de contágio. Paciente sintomático não grave Com vírus detectável. Período de contágio. Paciente sintomático com deterioração respiratória grave. Com vírus detectável com alta carga Período de resolução Paciente assintomático Com ou sem vírus detectável.
Adaptado de Alvarado AI, et al. Etiología y fisiopatología del SARS-CoV-2 [16].
Os estágios relacionados a COVID-19, podem ser associados com a intensidade da resposta imune [17]. Quando temos uma resposta inflamatória apropriada, os pacientes não evoluem de estágio, tendo uma solução para a infecção propriamente dita, contudo, se temos uma resposta exagerada, o que deveria gerar uma solução acaba fazendo com que o estágio evolua [16, 17]. Onde os estágios são normalmente caracterizados por:
- Estágio 1 – presença de febre, tosse seca, fadiga, podendo apresentar também mialgia, anosmia, dentre outros.
- Estágio 2 – temos dispneia, taquipneia, queda da saturação de oxigênio e infiltrado pulmonar em exames por imagem.
- Estágio 3 – apresentam sinais de choque circulatório, falência respiratória e disfunção de múltiplos órgãos [17].
IMUNIDADE CONTRA O SARS-CoV-2
O nosso sistema imunológico age na defesa contra agentes infecciosos, podendo agir mediante reações iniciais sendo a imunidade inata e reações que são mais tardias como a imunidade adaptativa [17]. A ação da resposta inata é de forma rápida, porém é inespecífica, sua resposta será iniciada a partir da entrada do antígeno na célula, contudo a resposta inata é de extrema importância para ativar a resposta adaptativa, onde sua característica principal é a especificidade, além de gerar células de memória [18].
A imunidade inata possui uma função importante para a defesa em combate contra o SARS-CoV-2 [4], com os receptores de reconhecimento de padrões (PRRs), fazendo o reconhecimento dos padrões moleculares associados a patógenos (PAMPs) [11]. Os PRRs mais conhecidos são os Toll-like (TLR), NOD-like (NLR), RIG-I-like (RLR) [4, 11]. Dependendo do receptor que receber o estímulo, distintas respostas podem ser geradas, independente da via de ativação, o reconhecimento do antígeno gera a produção de citocinas pró-inflamatórias e mediadores químicos [4], com o intuito de fornecer uma resposta antiviral efetiva.
Os componentes que envolvem a imunidade adaptativa variam referente a infecção viral [18]. Após a entrada do patógeno na célula alvo, peptídeos virais são apresentados pela via de complexo principal de histocompatibilidade (MHC) ou pelo sistema antígeno leucocitário humano (HLA) de classe I, ativando assim os linfócitos T CD8+ que exercem uma função citotóxica gerando a morte celular por apoptose da célula que foi invadida [4].Os linfócitos CD8+ representam cerca de 80% do total de células inflamatórias que se presentes no interstício pulmonar, em pessoas infectadas com o vírus SARS-CoV-2, onde desempenham um papel vital na eliminação de células infectadas e na indução de lesão imunológica [11].
A apresentação desses antígenos podem ser mediadas por células presentadoras de antígenos (APCs) via MHC de classe II, que ativa a T CD4+ que promove a produção de anticorpos específicos para vírus através da ativação de células B dependentes de T [11]. A T CD4+ estimula a liberação de IL-12, que se trata de uma citocina que co-estimula a produção de linfócitos Th1 [4]. A IL-12, juntamente com o IFN-α, amplificando a expressão do MHC classe I e a ativação de células Natural Killer (NK), possibilitando a ação dos mecanismos antivirais e a eliminação das células contaminadas pelo SARS-CoV-2 [4].
Simultaneamente, ocorre uma intensa liberação de citocinas, que recrutam neutrófilos e monócitos para o local da infecção, bem como estimulam diversas outras citocinas e quimiocinas pró-inflamatórias, como IL-1, IL-6, IL-8, IL-21, fator de necrose tumoral (TNF)-β [4, 11].
As células dos linfócitos T CD4+ e as CD8+ desempenham um papel significativo, equilibrando o combate contra patógenos e o risco de desenvolvimento de autoimunidade ou inflamação avassaladora [11].
Ainda que o organismo desenvolva uma resposta imune contra o SARS-CoV-2, em certos casos, os pacientes podem rapidamente progredir para estágios mais graves, como a síndrome do desconforto respiratório agudo (SDRA) [4]. Um grupo de pacientes em estado crítico que evolui para SDRA a qual manifesta uma condição caracterizada por uma “tempestade de citocinas”, chamada também de síndrome de liberação citocinas (RSC), sendo a principal morbidade de pacientes críticos com a COVID-19 [1].
A RSC, também conhecida como hipercitocinemia, desencadeia uma resposta hiperinflamatória no hospedeiro, responsável pela disfunção orgânica observada nesses pacientes, a hiperativação imunológica ocorre quando as células efetoras, especialmente as células NK e os linfócitos T CD8+ [4], não conseguem eliminar as células infectadas e seus antígenos, resultando na persistência desses elementos, levando à produção excessiva de citocinas pró-inflamatórias como IFN-α, IFN-γ, IL-1β, IL-6, IL-12, IL-18, IL-33, TNF-α, fator de crescimento transformador (TGF)-β [4, 14].
Embora o mecanismo exato que leva à hipercitocinemia não seja completamente compreendido, sabe-se que essa condição resulta em danos pulmonares e nos vasos sanguíneos [4]. Isso desencadeia a produção de exsudato, inchaço e fibrose, culminando em uma inflamação pulmonar intensa, que pode levar à SRDA e a uma grave desregulação imunológica [4].
Outro aspecto observado em pacientes graves foi a elevação dos níveis de citocinas IL-6, IL-10 e TNF-α durante a terceira fase da doença, seguida de uma redução desses níveis durante a recuperação [4]. O papel dessas citocinas no processo inflamatório indica que pacientes que precisam de internação na UTI apresentam níveis significativamente mais altos de IL-6, IL-10 e TNF-α, além de uma menor quantidade de linfócitos T CD4+, T CD8+ e linfócitos T reguladores (Treg) [4].
Cerca de 85% dos pacientes internados na UTI por Covid-19 apresentaram linfopenia, sendo o baixo nível de linfócitos no sangue comum em infecções virais, a linfopenia é observada também no sítio anatômico de infecção [4]. Possivelmente resultante do sequestro de linfócitos para o foco pulmonar, os quais, quando ativados, produzem excessivamente citocinas pró-inflamatórias que causam a RSC, mas que eventualmente morrem durante o processo infeccioso [4].
Após a RSC, o hospedeiro fica “à deriva” em relação ao SARS-CoV-2 e outros microrganismos, exemplo das infecções bacterianas [4]. É importante considerar que, além da baixa contagem de linfócitos T CD4+, o comprometimento do parênquima pulmonar promovido pelo processo inflamatório acentuado, o qual contribui para a suscetibilidade às infecções subjacentes [4].
RT-PCR FRENTE AO DIAGNÓSTICO LABORATORIAL DO SARS-CoV-2
Conforme a Organização Mundial de Saúde (OMS) e pela Food and Drug Administration (FDA), o padrão ouro reconhecido é o ensaio RT-PCR (reação de transcriptase reversa seguida de reação em cadeia da polimerase) que identificam sequências específicas no genoma do SARS-CoV-2 [1, 5, 19].
A RT-PCR é realizada por testes de amplificação de ácido nucleico (NAAT), que possui o foco na sequência genômica específica do vírus, como a proteína do envelope, a glicoproteína de superfície [5]. A técnica é denominada por teste de amplificação do ácido nucleico (NAAT), tendo o seu alvo as sequências de material genético específico [1, 5].
Existem diversas combinações de sequências, resultando em diferentes níveis de sensibilidade e especificidade, mesmo com uma alta sensibilidade e especificidade, é possível que esses testes apresentem resultados falsos negativos [1].
Resultado falso negativo é comum quando a amostra não é adequada ou representativa [1], quando o exame é realizado dentro da sua janela imunológica durante a progressão da doença, ou quando a amostra é danificada durante o transporte/manuseio [1, 19].
Figura 3 – Resultado dos métodos diagnósticos nos estágios da infecção por SARS-CoV-2
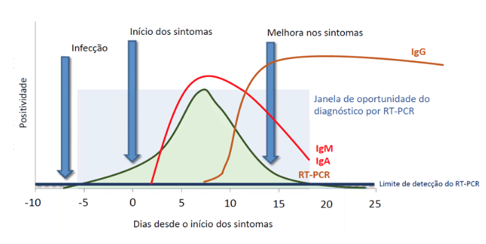
Adaptado de Nogueira, et al. Diagnóstico laboratorial da COVID-19 no Brasil [19]
As amostras para análises podem ser obtidas por:
- Aspirado nasofaríngeo (ANF);
- Swab nasal e oral;
- Secreção respiratória do trato inferior (escarro, lavado traqueal ou lavado broncoalveolar) [19].
SOROLOGIA DIAGNÓSTICO LABORATORIAL DO SARS-CoV-2
O teste sorológico possui papel importante, por serem considerados uma estratégia indireta para diagnóstico de infecções virais, por possuírem como alvo as infecções virais e anticorpos produzidos pelo organismo durante a infecção, a produção de anticorpos específicos varia em relação ao estágio da doença [18]. O teste é realizado com Kits de diagnósticos sorológicos específicos para a COVID-19, que detectam os anticorpos IgA, IgM e o IgG, estes que começam a ser produzidos a partir do sétimo dia dos sintomas da doença [5]. Sendo realizado nesse período para ser considerado o tempo da janela imunológica, onde requer que a produção de anticorpos seja o suficiente para ter a quantidade de anticorpo suficiente para detecção.
Tabela 2 – Anticorpos específicos.
IgM IgA IgG Detectado a partir do 5º dia após os sintomas. Detectados precocemente (antes do IgM). Detectado a partir do 10º dia após os sintomas. Resposta imune inicial do corpo. Maior sensibilidade. Resposta mais específica do sistema imunológico.
Adaptado de Figueiredo SA, et al. Diagnóstico de COVID-19 em laboratórios de análises clínicas [5].
Figura 4 – Níveis de anticorpos produzidos a partir da curva de infecção da SARS-CoV-2.
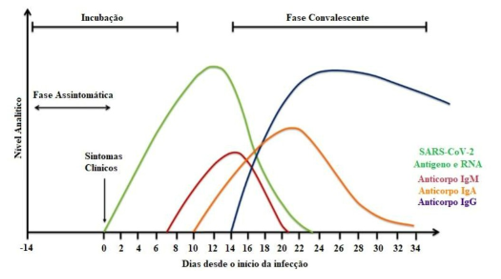
Adaptado de Figueiredo SA, et al. Diagnóstico de COVID-19 em laboratórios de análises clínicas [5].
Possuímos alguns testes sorológicos que podem ser realizados como podemos analisar na tabela 3:
Tabela 3 – Métodos de análise sorológica.
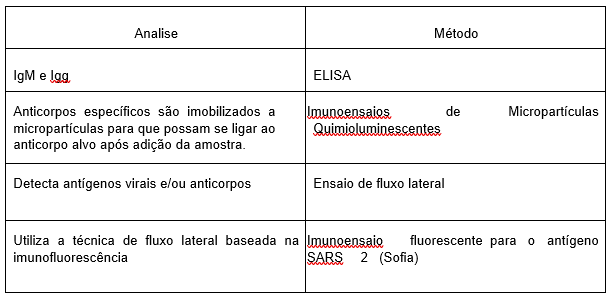
Adaptado de Figueiredo SA, et al. Diagnóstico de COVID-19 em laboratórios de análises clínicas [5].
O teste padrão-ouro para COVID-19 e a liberação dos resultados podem levar tempo. Para otimizar esse processo, é importante considerar não apenas o histórico do paciente, mas também exames complementares, como os de imagem, bioquímicos e hematológicos [5].
DOENÇAS CRÔNICAS
No mundo o número de pessoas afetadas por doenças crônicas cresce cada vez mais [20]. Essas doenças se manifestam lentamente ao decorrer da vida, as quais podem ser classificadas como: doenças crônicas não transmissíveis (DCNT) e as transmissíveis [20].
Contudo, a maioria dos pacientes só descobre o diagnóstico quando os sintomas começam a aparecer, consequentemente a patologia já está instalada e com efeitos irreversíveis [20]. As DCNTs são responsáveis por altos índices de óbitos no país, superando a taxa de mortalidade por doenças infecciosas e parasitárias [3].
A existência da DNTs está relacionada com diversos fatores que se integram entre si, contudo, fatores genéticos ou os fatores comportamentais como a alimentação, sedentarismo, o uso de drogas, acabam sendo os principais indicadores [3]. No quadro de COVID-19, as DCNTs se tornam as principais comorbidades dos pacientes, sendo responsável pelo agravamento da condição, aumento do período de internação [21].
ASMA E SUAS ALTERAÇÕES
A asma é uma síndrome respiratória crônica que afeta o trato respiratório inferior; doença é caracterizada pela limitação do fluxo aéreo, a inflamação das vias aéreas e uma hiperresponsividade, o qual pode levar a sintomas graves como falta de ar e tosse [22]. Ela pode resultar em mudanças permanentes nos brônquios, sendo associada à produção excessiva de muco [22]. As infecções virais, mediadas por ACE2 e TMPRSS2, frequentemente exacerbam a asma, o rinovírus e o coronavírus desempenham papeis significativos [23, 24]. Essas infecções provocam desequilíbrios na função imunológica e aumentam a produção de muco, o que pode levar a obstrução das vias aéreas e a produção de interferons tipo I, tornando os asmáticos mais vulneráveis a complicações [25]. Com relação à COVID-19, esperava-se que pacientes asmáticos tivessem maior suscetibilidade e gravidade, devido a uma resposta imune antiviral deficiente e à tendência para exacerbações virais. No entanto, não há evidências claras de que asmáticos apresentem maior risco ou piores desfechos relacionados à COVID-19 [9,26].
FATORES DE RISCO PARA COVID-19 EM INDIVÍDUOS ASMÁTICOS.
Os estudos avaliaram a relação da COVID-19 em pacientes asmáticos; uma base de dados com mais de um milhão de pacientes testados para COVID-19, foi constatado que, os asmáticos têm menor risco de infecção por COVID-19, mas um risco semelhante de hospitalização e mortalidade de infectados [27,28,29]. Também foi avaliado que o COVID-19 tende a ser menos grave em pacientes asmáticos, pois sugere que a inflamação tipo 2, menor expressão de ACE2, beta agonistas de curta duração e o uso de corticosteroides inalatórios podem reduzir a suscetibilidade à doença; mas podendo variar conforme fatores como idade, gravidade da asma e tipo de tratamento [27, 30, 31].
PROGNÓSTICO DE INDIVÍDUO COM ASMA EM RELAÇÃO A COVID-19.
O prognóstico de indivíduos com asma frente à COVID-19 tem sido alvo de diversos estudos. Embora os pacientes asmáticos sejam considerados parte do grupo de risco para infecções respiratórias, as evidências atuais sugerem que a asma, em si, pode não ser um fator de risco significativo para evolução grave da COVID-19. No entanto, o prognóstico varia de acordo com a gravidade da asma, Em uma análise de 935 pacientes com asma e COVID-19 positivo, foi constatado que a asma está associada a um tempo prolongado de incubação, sugerindo um impacto significativo na gravidade do tratamento necessário para esses pacientes controle da doença e presença de comorbidades [24,26,29]. Pacientes com asma leve ou bem controlada, especialmente aqueles sob tratamento com corticosteróides inalatórios, não parecem ter maior risco de complicações graves [32]. Já indivíduos com asma grave, não controlada ou que apresentam outras condições de saúde, como obesidade e doenças cardiovasculares, podem enfrentar um prognóstico mais problemático. É essencial que pacientes asmáticos mantenham o uso regular de seus medicamentos e sigam as orientações médicas para minimizar complicações em caso de infecção por COVID-19 [32].
ANÁLISE DE TERAPIAS BIOLÓGICAS, USO DE MEDICAMENTOS, RESPOSTAS IMUNES, EXPRESSÃO DE ACE2 NA COVID-19 E ASMA.
As terapias biológicas vêm sendo cada vez mais empregadas no tratamento de doenças como asma e COVID-19, devido à sua capacidade de respostas modulares imunes específicas. No contexto da asma, os medicamentos biológicos, como os anticorpos monoclonais, apresentam eficácia em reduzir a inflamação crônica ao direcionar componentes do sistema imunológico, como a IgE,certos aspectos da resposta imune tipo 2 e as citocinas (IL-4, IL-13) junto ao acúmulo de eosinófilos, podem fornecer efeitos protetores contra COVID-19 assim como corticosteróides inalados, imunoterapia com alérgeno (AIT) que está envolvidas na resposta alérgica [ 24, 33]. Já na COVID-19, a proteína ACE2 (enzima conversora de angiotensina 2) e TMPRSS2 (protease transmembrana serina 2 ) que desempenham um papel crucial, pois é o receptor que o vírus SARS-CoV-2 usa para infectar células humanas [23, 24, 34, 31]. Estudos indicam que a expressão do ACE2 é alterada em pacientes asmáticos, mas as implicações dessa alteração ainda estão sendo investigadas [24, 28]. O uso de medicamentos imunomoduladores também tem sido treinado no combate ao COVID-19, com o objetivo de controlar a tempestade de citocinas e mitigar respostas imunes desreguladas, que são comuns em casos graves [35, 33, 36 e 37]. Desta forma, tanto na asma quanto na COVID-19, as terapias biológicas e medicamentos imunomoduladores podem oferecer abordagens promissoras para reduzir a gravidade das respostas inflamatórias e melhorar os resultados clínicos [24, 34].
ALZHEIMER E SUA ETIOLOGIA
A Doença de Alzheimer (DA), descrita pelo neuropatologista Alois Alzheimer em 1907, é uma condição neurodegenerativa progressiva e irreversível que predominantemente afeta idosos [6].
Histopatologicamente, a DA é marcada pela perda extensiva de sinapses e morte neuronal nas áreas cerebrais responsáveis pelas funções cognitivas, como o córtex cerebral, hipocampo, córtex entorrinal e estriado ventral [7]. As principais características incluem depósitos de fibrilas amiloides nas paredes dos vasos sanguíneos, placas senis, acúmulo de filamentos anormais da proteína tau, perda de neurônios e sinapses, ativação da glia e processos inflamatórios [7].
POTENCIAIS MECANISMOS DE DOENÇA DE ALZHEIMER INDUZIDA PELO SARS-CoV-2
A infecção pelo SARS-CoV-2 está associada a sintomas neurológicos devido à sua capacidade de atravessar a Barreira Hematoencefálica (BHE) e a barreira do Líquido Cefalorraquidiano (LCR), embora protejam o Sistema Nervoso Central (SNC), também podem servir como vias de entrada para o vírus, especialmente em áreas não totalmente protegidas [38].
A presença do vírus no SNC resulta em lesões no Sistema Nervoso Central e Periférico, exacerbadas por uma resposta inflamatória caracterizada por um aumento nas citocinas, como interleucinas e TNF-alfa, que danificam a BHE [38]. Além disso, o SARS-CoV-2 pode causar sequelas cognitivas de longo prazo, levando potencialmente a doenças neurodegenerativas, como a doença de Alzheimer [39].
Pacientes com COVID-19 frequentemente apresentam sintomas neurológicos, e aqueles que sobrevivem à infecção podem enfrentar sequelas duradouras [39]. A inflamação sistêmica severa, conhecida como “tempestade de citocinas”, pode agravar esses efeitos ao aumentar a permeabilidade da BHE, intensificando a neuroinflamação e contribuindo para o desenvolvimento de condições neurodegenerativas [39]. Análises de tecidos cerebrais de pacientes falecidos revelam danos irreversíveis causados pelo vírus [39].
O desenvolvimento de DA pode estar relacionado à resposta imune exacerbada ao SARS-CoV-2, incluindo a “tempestade de citocinas” que compromete a barreira hematoencefálica. A infecção pode afetar os astrócitos, essenciais para o suporte neuronal, ativar a microglia, exacerbando a neurodegeneração [39].
SARS-CoV-2 E DIABETES
Imagine que, em tempos de pandemia, além do desafio de combater um vírus invisível, como o COVID-19, o corpo de milhões de pessoas enfrenta uma batalha interna ainda mais silenciosa: o descontrole da glicose no sangue. A interseção entre essas duas condições pode potencializar riscos e complicações graves, criando um cenário de alerta para quem convive com o Diabetes Mellitus. Para entender essa ameaça, é importante saber como nosso corpo processa a glicose. Durante a digestão, a maior parte dos alimentos é convertida em glicose, transportada pelo sangue para fornecer energia às células do corpo. No entanto, as células não conseguem absorver a glicose sozinhas, necessitando da insulina, produzida no pâncreas, que se liga à superfície celular [40], permitindo, por fim, a absorção da glicose. O Diabetes Mellitus é uma doença crônica que compromete a utilização eficiente da glicose no sangue, caracterizada pela hiperglicemia devido a falhas na secreção da insulina ou à deficiência de sua ação [8,41]. As variações nos níveis glicêmicos podem resultar em hiperglicemia leve ou grave (causando poliúria, polidipsia e desidratação) [40,42], o que leva a complicações a longo prazo, como problemas cardiovasculares (ataques cardíacos) [41], acidentes vasculares cerebrais, retinopatia, nefropatia e neuropatia diabética [41,42,43], que são irreversíveis [40], entre outras manifestações. O DM é dividido em: Tipo 1 (requer administração regular de insulina), Tipo 2 (necessita de cuidados com o estilo de vida [40, 44] e, em alguns casos, administração de fármacos) e Gestacional (e/ou outras causas) [42]. O diagnóstico é realizado por meio de exames laboratoriais, como a Glicemia em Jejum (alterações da tolerância à glicose plasmática), Teste Oral de Tolerância à Glicose (TOTG), Hemoglobina Glicada (HbA1c, que, acima de 70%, indica maior probabilidade de hospitalização) [40,44,45], medida de autoanticorpos [8], avaliação da reserva pancreática de insulina, entre outros exames para análise, diagnóstico e monitoramento da doença [45].
O Diabetes Mellitus impacta a infecção por SARS-CoV-2, sendo uma das principais causas de morbidade e um fator de risco para complicações graves da COVID-19 (como pneumonia e sepse) [46,47]. Pacientes com diabetes recém-diagnosticada apresentam maior risco de mortalidade em comparação com aqueles com diagnóstico pré-existente. Na infecção causada pelo SARS-CoV-2, o pâncreas é afetado, resultando em hiperglicemia devido à ativação anormal e superexpressão da enzima conversora de Angiotensina 2 (ACE2) [48]. A glicação desta enzima, provocada pela hiperglicemia crônica ou diretamente pelo SARS-CoV-2, pode desencadear uma resposta inflamatória exacerbada, contribuindo para hiperinflamação ou hipercoagulabilidade [49,50]. Portanto, é fundamental manter um bom controle glicêmico, reduzindo o risco de complicações graves associadas ao SARS-CoV-2 [40,44, 46,].
CONSIDERAÇÕES FINAIS
A pandemia de COVID-19 trouxe impactos profundos em diversas áreas da saúde, mas seu efeito sobre pacientes com doenças crônicas, como Diabetes Mellitus, Asma e Alzheimer, foi devastador. O vírus não apenas expôs vulnerabilidades já conhecidas desses indivíduos, como também agravou suas condições, aumentando significativamente o risco de complicações graves e até fatais.
No caso do Diabetes Mellitus, ficou evidente que o descontrole glicêmico provocado pelo SARS-CoV-2 pode intensificar a resposta inflamatória, levar à hiperglicemia grave e potencializar o risco de complicações, como pneumonia e sepse. Pacientes com diabetes recém-diagnosticados apresentaram taxas de mortalidade mais altas em comparação com aqueles que já conviveram com a doença, o que revela a gravidade dessa combinação. Além disso, a infecção pode impactar diretamente o pâncreas, exacerbando ainda mais os problemas metabólicos.
Para indivíduos com Asma, a expectativa inicial era de que o risco fosse elevado, mas estudos revelaram que as respostas imunológicas e o tratamento com corticosteróides podem, em alguns casos, mitigar os efeitos graves da COVID-19. No entanto, o cenário ainda exige cautela, especialmente para aqueles com formas mais graves de doença ou que não seguem tratamentos adequados.
Já no caso de pacientes com Alzheimer, a COVID-19 mostrou-se capaz de acelerar o processo neurodegenerativo devido à resposta inflamatória sistêmica grave. A “tempestade de citocinas” e o comprometimento da barreira hematoencefálica agravaram os danos neurológicos, evidenciando o quanto essas populações foram detectadas de atenção especial e estratégias de cuidado mais eficazes.
Diante desse cenário alarmante, é crucial que a comunidade científica e os sistemas de saúde intensifiquem a busca por novos métodos e tratamentos que atendam às necessidades específicas desses pacientes. A COVID-19 nos mostrou que, para enfrentar as pandemias de eficiência e minimizar os impactos sobre indivíduos com doenças crônicas, é necessário desenvolver estratégias inovadoras que combinem o tratamento da infecção com o manejo adequado das comorbidades.
A criação de terapias personalizadas, que levem em contato com a interação entre o vírus e as doenças crônicas, é essencial. Métodos mais eficientes de controle glicêmico, abordagens terapêuticas que protegem o sistema respiratório e estratégias que reduzem os danos neurológicos são alguns dos caminhos que precisam ser explorados. Além disso, o fortalecimento de políticas públicas externas para a prevenção e manejo dessas condições em cenários de crises sanitárias é urgente e indispensável.
A pandemia deixou uma lição clara: a inovação científica e a adaptação das práticas de saúde são cruciais para enfrentar crises futuras. Somente com uma abordagem mais integrada e com tratamentos que atendam às particularidades de cada condição possível reduzirão o impacto de doenças como Diabetes, Asma e Alzheimer, não apenas durante pandemias, mas de maneira contínua, garantindo uma melhor qualidade de vida para esses pacientes.
REFERÊNCIAS
1 Souza ASR, Amorim MMR, Melo AS de O, Delgado AM, Florêncio ACMC da C, Oliveira TV de, et al. General aspects of the COVID-19 pandemic. Rev Bras Saude Mater Infant [Internet]. 2021Feb;[acesso em 2024 maio 02 21:29–45. Disponível em: https://doi.org/10.1590/1806-9304202100S100003
2 Zhang JJ , Dong X , Cao YY , et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. [Internet]. 2020; [acesso em 2024 abril 16]; 75 : 1730 – 1741. Disponível em: https://onlinelibrary.wiley.com/doi/10.1111/all.14238
3 Araújo HV, Farias I de O, Reis BCC. A importância da mudança do estilo de vida em pacientes portadores de doenças crônicas não transmissíveis: uma revisão de literatura. REAMed [Internet]. 9jul.2022 [acesso em 2024 maio 02];12:e10359. Disponível em: https://acervomais.com.br/index.php/medico/article/view/10359
4 Brito SBP, Braga IO, Moraes MM, Cunha CC, Leão SC, Takenami I. Immunopathological mechanisms involved in SARS-CoV-2 infection. J Bras Patol Med Lab [Internet]. 2020 [acesso em 2024 abril 01]; 56:e3352020. Disponível em:https://doi.org/10.5935/1676-2444.20200056
5 Figueiredo SA, Paula FB de A. Diagnóstico de COVID-19 em laboratórios de análises clínicas. RSD [Internet]. 13 de janeiro de 2022 [acesso em 2024 maio 02];11(1):e49511125286. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/2528
6 Fontenele ARB, Cunha KRF, Brandão RN, Carreiro LEAR, Neto AL de C, Gonçalves FM da S, Fontinele A da S, Lustosa TRA, Fortes AKMR, Barbosa NS. Impactos da Covid-19 na qualidade de vida de pessoas com Alzheimer: uma revisão integrativa. REAS [Internet]. 10jan.2023 [acesso 1 out.2024];23(1):e11563. Disponível em: https://acervomais.com.br/index.php/saude/article/view/11563
7 Sereniki A, Vital MABF. A doença de Alzheimer: aspectos fisiopatológicos e farmacológicos. Rev psiquiatr Rio Gd Sul [Internet]. [acesso em 2024 abril 03] 2008;30(1). Disponível em: https://doi.org/10.1590/S0101-81082008000200002
8 Gross JL, Silveiro SP, Camargo JL, Reichelt AJ, Azevedo MJ de. Diabetes Melito: Diagnóstico, Classificação e Avaliação do Controle Glicêmico. Arq Bras Endocrinol Metab [Internet] [acesso em 2024 abril 15]; 2002Feb;46(1):16–26. Disponível em: https://www.scielo.br/j/abem/a/vSbC8y888VmqdqF7cSST44G/
9 Morais-Almeida M, Pité H, Aguiar R, Ansotegui, Bousquet J. Asthma and the Coronavirus Disease 2019 Pandemic: A Literature Review. Int Arch Allergy Immunol [Internet]. 2020;181(9):680-688. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7316650/
10 Sonia Mehta, MD, Vitreoretinal Diseases and Surgery Service, Wills Eye Hospital, Sidney Kimmel Medical College at Thomas Jefferson University. Retinopatia diabética [Internet]. Manual MSD Versão para Profissionais de Saúde; abr 2022 [acesso em 2024 abril 15]. Disponível em: https://www.msdmanuals.com/pt-br/casa/distúrbios-oftalmológicos/doenças-da-retina/retinop atia-diabética
11 Li G, Fan Y, Lai Y, et al. Coronavirus infections and immune responses. J Med Virol [Internet]. 2020[acesso em 2024 abril 19]; 92(4):424-432. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7166547/
12 Abrams, Elissa M et al. “Asthma and COVID-19.” CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne vol. 192,20 [Internet]. 2020; [acesso em 2024 abril 16]. Disponível em: https://ncbi.nlm.nih.gov/pmc/articles/PMC7241883/
13 dos Reis MAO de M, Correa BC, Moura CVB, Oliveira FERL, Nascimento MS, Pinto RT, Batista SR, Gomes VS, Martins WSO, Soares GFG. Impactos na saúde mental por distanciamento e isolamento sociais pela COVID-19: uma perspectiva brasileira e mundial. REAS [Internet]. 24fev.2021 [acesso em 2024 abril 29];13(2):e6535. Disponível em: https://acervomais.com.br/index.php/saude/article/view/6535
14 PERROTA, Ana Paula. “Serpentes, morcegos, pangolins e ‘mercados úmidos’ chineses: Uma crítica da construção de vilões epidêmicos no combate à Covid-19 [Internet]. 2020 [acesso em 2024 abril 29]; 1-6. Disponível em: https://ppgcs.ufrrj.br/wp-content/uploads/2020/04/PERROTA-Serpentes-morcegos-pangolins FI.pdf
15 Felício LV, Rossi CC, Pereira MF. A emergência de um novo coronavírus zoonótico: SARS-CoV-2 e a pandemia da COVID-19. SAPIENS [Internet]. 12º de março de 2021[acesso em 2024 abril 29];2(2):21-38. Disponível em: https://revista.uemg.br/index.php/sps/article/view/5271
16 Alvarado AI, Bandera AJ, Carreto BLE, et al. Etiología y fisiopatología del SARS-CoV-2 [Internet]. 2020 [acesso em 2024 abril 29]; 5-9. Disponível em: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=96667
17 Brandão SCS, Godoi ETAM, Ramos J de OX, Melo LMMP de, Sarinho ESC. COVID-19 grave: entenda o papel da imunidade, do endotélio e da coagulação na prática clínica. J vasc bras [Internet]. 2020 [acesso em 2024 abril 30] ;19:e20200131. Disponível em: https://www.scielo.br/j/jvb/a/j7v6NtBNvGSGGTDz38wnRxm/?lang=pt#
18 Santos AAR, Paula KKO de, Marasco BFD, Castilho DG. Diferentes aspectos da resposta imune em COVID-19. RSD [Internet]. 8 de novembro de 2021[acesso em 2024 abril 30] ;10(14):e423101422531. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/22531
19 Nogueira, Joseli Maria & Silva, Líllian. Diagnóstico laboratorial da COVID-19 no Brasil. Revista Brasileira de Análises Clínicas [Internet].2020 [acesso em 2024 maio 02]; 52. Disponível em:https://www.researchgate.net/publication/347282740_Diagnostico_laboratorial_da_COVID-1 9_no_Brasil
20 Berghetti L, Danielle MBA, Winter VDB, Petersen AGP, Lorenzini E, Kolankiewicz ACB. Transición del cuidado de pacientes con enfermedades crónicas y su relación con las características clínicas y sociodemográficas . Rev Latino-Am Enfermagem [Internet]. 2023 Jan [acesso em 2024 abril 03];31:e4013. Disponível em: https://doi.org/10.1590/1518-45.6594.4013
21 Malta DC, Gomes CS, Barros MB de A, Lima MG, Almeida W da S de, Sá ACMGN de, et al.. Doenças crônicas não transmissíveis e mudanças nos estilos de vida durante a pandemia de COVID-19 no Brasil. Rev bras epidemiol [Internet]. 2021 [acesso em 2024 maio 02];24:e210009. Disponível em: https://www.scielo.br/j/rbepid/a/rhTGSqRDbs94Wh8CmjggYTb/?lang=pt#
22 Shi L, Xu J, Xiao W, et al. Asthma in patients with coronavirus disease 2019: A systematic review and meta-analysis. Ann Allergy Asthma Immunol [Internet]. 2021; [acesso em 2024 abril 16]; 126(5):524-534. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7889465/
23 Peters MC, Sajuthi S, Deford P, et al. COVID-19-related Genes in Sputum Cells in Asthma. Relationship to Demographic Features and Corticosteroids [Internet]. 2020 Dec [acesso em 2024 abril 16]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32348692/
24 Mahdavinia M, Foster KJ, Jauregui E, et al. Asthma prolongs intubation in COVID-19. J Allergy Clin Immunol Pract [Internet]. 2020; [acesso em 2024 abril 16]; 8(7):2388-2391.Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7224651/
25 Martinez FD. Asthma in the Time of COVID-19. Am J Respir Crit Care Med [Internet]. 2021; [acesso em 2024 abril 16]; 203(7):785-786. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8017572/
26 Wu X, Xu Y, Jin L, Wang X, Zhu H, Xie Y. Association of Preexisting Asthma and Other Allergic Diseases With Mortality in COVID-19 Patients: A Systematic Review and Meta-Analysis [Internet]. 2021; [acesso em 2024 abril 16]; 8:670744. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8264065
27 Wang L, Foer D, Bates DW, Boyce JA, Zhou L. Risk factors for hospitalization, intensive care, and mortality among patients with asthma and COVID-19. J Allergy Clin Immunol [Internet]. 2020; [acesso em 2024 abril 16]; 146(4):808-812. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7387277/
28 Sunjaya AP, Allida SM, Di Tanna GL, Jenkins CR. Asthma and COVID-19 risk: a systematic review and meta-analysis. Eur Respir J [Internet]. 2022; [acesso em 2024 abril 16]; 59(3):2101209. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34385278/
29 Sitek AN, Ade JM, Chiarella SE, et al. Outcomes among patients with COVID-19 and asthma: A systematic review and meta-analysis. Allergy Asthma Proc [Internet]. 2021; [acesso em 2024 abril 16]; 42(4):267-273. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34187619/
30 Izquierdo JL, Almonacid C, González Y, et al. The impact of COVID-19 on patients with asthma. Eur Respir J [Internet]. 2021; [acesso em 2024 abril 16]; 57(3):2003142. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7651839/
31 Pecoraro V, Cuccorese M, Trenti T. Genetic polymorphisms of ACE1, ACE2, IFTM3, TMPRSS2 and TNFα genes associated with susceptibility and severity of SARS-CoV-2 infection: a systematic review and meta-analysis [Internet]. 2023; [acesso em 2024 setembro 29]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/37055652/
32 Kim SH, Ji E, Won SH, et al. Association of asthma comorbidity with poor prognosis of coronavirus disease 2019. World Allergy Organ J [Internet]. 2021; [acesso em 2024 abril 16];14(8):100576. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8364802/
33 Nelli Morgulchik, Foteini Athanasopoulou, Edmundo Chu, Yoriko LameNacila Kamaly 2021. Potential therapeutic approaches for targeted inhibition of inflammatory cytokines following COVID-19 infection-induced cytokine storm [Internet]. 2023; [acesso em 2024 setembro 29]. Disponível em: https://doi.org/10.1098/rsfs.2021.0006
34 Lommatzsch M, Stoll P, Virchow JC. COVID-19 in a patient with severe asthma treated with Omalizumab. Allergy [Internet]. 2020; [acesso em 2024 abril 16]; 75(10):2705-2708. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7323189/
35 Terry PD, Heidel RE, Dhand R. Asthma in Adult Patients with COVID-19. Prevalence and Risk of Severe Disease. Am J Respir Crit Care Med [Internet]. 2021; [acesso em 2024 abril 16]; 203(7):893-905. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8017581/
36 Liu S, Zhi Y, Ying S. COVID-19 and Asthma: Reflection During the Pandemic. Clin Rev Allergy Immunol [Internet]. 2020; [acesso em 2024 abril 16]; 59(1):78-88. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8830198/
37 Antonella Fara, Zan Mitrev, Rodney Alexander Rosalia† and Bakri M. Assas. Cytokine storm and COVID-19: a chronicle of pro-inflammatory cytokines [Internet]. 2023; [acesso em 2024 setembro 29]. Disponível em: https://doi.org/10.1098/rsob.200160
38 Lima IN, Yamamoto CY, Luz J de S, Souza TC de, Pereira KF. Perda de memória associada à infecção viral por SARS-CoV-2: Revisão de literatura. RSD [Internet]. 24 de março de 2022 [acesso em 2024 abril 05];11(4):e49011427609. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/27609
39 Nanyang Liu, Xuefan Jiang, Hao Li3.The viral hypothesis in Alzheimer’s disease: SARS-CoV-2 on the cusp: Review article. ARTICLES [Internet]. 15 de março de 2023 [acesso em 2024 abril 09]; 15:10. Disponível em: https://doi.org/10.3389/fnagi.2023.1129640
40 Erika F. Brutsaert, MD, New York Medical College. Manual MSD Versão para Profissionais de Saúde: Diabetes mellitus e distúrbios do metabolismo de carboidratos; set 2022 [acesso em 2024 abril 15]. Disponível em: https://www.msdmanuals.com/pt-br/profissional/dist%C3%BArbios-end%C3%B3crinos-e-me tab%C3%B3licos/diabetes-mellitus-e-dist%C3%BArbios-do-metabolismo-de-carboidratos/di abetes-melito-dm#v988026_pt
41 Erika F. Brutsaert, MD, New York Medical College. Manual MSD Versão para Profissionais de Saúde: Diabetes mellitus (DM) e distúrbios do metabolismo da glicose no sangue [Internet]; set 2022 [acesso em 2024 abril 15]. Disponível em: https://www.msdmanuals.com/pt-br/casa/dist%C3%BArbios-hormonais-e-metab%C3%B3lic os/diabetes-mellitus-dm-e-dist%C3%BArbios-do-metabolismo-da-glicose-no-sangue/diabete s-mellitus-dm#:~:text=No%20diabetes%20tipo%201%20(antigamente,produz%20pouca%20 ou%20nenhuma%20insulina.
42 Erika F. Brutsaert, MD, New York Medical College. Manual MSD Versão para Profissionais de Saúde: Diabetes mellitus e distúrbios do metabolismo de carboidratos: Complicações do diabetes mellitus [Internet]; [acesso em 2024 abril 15]. Disponível em: https://www.msdmanuals.com/pt-br/profissional/dist%C3%BArbios-end%C3%B3crinos-e-me tab%C3%B3licos/diabetes-mellitus-e-dist%C3%BArbios-do-metabolismo-de-carboidratos/co mplica%C3%A7%C3%B5es-do-diabetes-mellitus?query=Diabetes%20mellitus%20(DM
43 Frank O’Brien, MD, Washington University in St. Louis. Nefropatia diabética: Doença renal em estágio terminal [Internet]. Manual MSD Versão para Profissionais de Saúde; abr 2022 [acesso em 2024 abril 15]. Disponível em: https://www.msdmanuals.com/pt-br/profissional/distúrbios-geniturinários/doenças-glomerular es/nefropatia-diabética
44 IDF Diabetes Atlas.( 10ª edição) [Internet]; IDF – International Diabetes Federation; 2021 [acesso em 2024 abril 17]. Disponível em: https://diabetesatlas.org/idfawp/resource-files/2021/07/IDF_Atlas_10th_Edition_2021.pdf
45 Gross JL, Silveiro SP, Camargo JL, Reichelt AJ, Azevedo MJ. Diabetes Melito: Diagnóstico, Classificação e Avaliação do Controle Glicêmico. Arq Bras Endocrinol Metab [Internet]. 2002Feb [acesso em 2024 abril 15]; 46(1):16–26. Disponível em: https://www.scielo.br/j/abem/a/vSbC8y888VmqdqF7cSST44G/#ModalTabletab01
46 Organização Pan-Americana da Saúde. Histórico da pandemia de COVID-19. [Internet];[s.d.]. [acesso em 2024 abril 17]. Disponível em: https://www.paho.org/pt/covid19/historico-da-pandemia-covid-19
47 García-Pachón E, Zamora-Molina L, Soler-Sempere MJ, et al. Asthma and COPD in Hospitalized COVID-19 Patients. Asma y EPOC en pacientes hospitalizados por COVID-19. Arch Bronconeumol [Internet]. 2020; [acesso em 2024 abril 16]; 56(9):604-606. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7261473/
48 Branco ACCC, Sato MN, Alberca RW. The Possible Dual Role of the ACE2 Receptor in Asthma and Coronavirus (SARS-CoV2) Infection. Front Cell Infect Microbiol [Internet]. 2020;[acesso em 2024 abril 16]; 10:550571. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7538685/
49 Nogueira, Joseli Maria & Silva, Líllian. Diagnóstico laboratorial da COVID-19 no Brasil. Revista Brasileira de Análises Clínicas [Internet].2020 [acesso em 2024 maio 02]; 52. Disponível em:https://www.researchgate.net/publication/347282740_Diagnostico_laboratorial_da_COVID-1 9_no_Brasil
50 Bandeira F. Protocolos Clínicos em Endocrinologia e Diabetes. (4ª edição) [Internet]; Grupo GEN: Guanabara Koogan; 2021 [acesso em 2024 abril 17]. 630- 633p. Disponível em:https://integrada.minhabiblioteca.com.br/reader/books/9788527737647/epubcfi/6/10%5B %3Bvnd.vst.idref%3Dcopyright%5D!/4/24/1:33%5B0-0%2C40%5D
1Centro Universitário das Faculdades Metropolitanas Unidas – FMU
