REGISTRO DOI: 10.69849/revistaft/ar10202412310926
Nathalia Souza Paixão¹; Érica Rocha Mondeck²; Lucas de Araujo Mendes³; Orientador: Maria Raquel Manhani⁴; Coorientador: Vanessa Aparecida Soares⁵.
RESUMO
A imobilização enzimática é uma técnica de grande relevância industrial, uma vez que aumenta e melhora propriedades de estabilidade, seletividade e atividade de biomoléculas, além de permitir a reutilização das mesmas. Com isso, destaca-se a imobilização da enzima lipase, devido à sua importância na indústria, pois ela tem capacidade de catalisar diversas reações e ser aplicada em variados processos. Nesse sentido, o uso de suportes para a imobilização dessa enzima se torna fundamental. Este estudo buscou explorar a diversidade de suportes de baixo custo produzidos a partir de resíduos agroindustriais, com o objetivo de compreender a evolução das pesquisas sobre este tema, bem como evidenciar a importância do reaproveitamento desses resíduos. Os resultados apontaram que as pesquisas têm avançado gradativamente, com destaque para os métodos de imobilização por ligação covalente e adsorção física. As condições ideais de operação situam-se entre 35°C e 60°C e pH de 6 a 10, sendo o pH neutro (7) o mais utilizado. Além disso, o glutaraldeído foi frequentemente empregado para ativar os suportes nos estudos analisados.
Palavras-chave: lipase, imobilização, suportes, resíduos agroindustriais, ligação covalente e adsorção física
ABSTRACT
Enzyme immobilization is a technique of great industrial relevance, since it increases and improves the stability, selectivity and activity properties of biomolecules, in addition to allowing their reuse. Therefore, the immobilization of the lipase enzyme stands out due to its importance in industry, since it has the capacity to catalyze several reactions and be applied in various processes. In this sense, the use of supports for the immobilization of this enzyme becomes essential. This study sought to explore the diversity of low-cost supports produced from agro-industrial waste, with the objective of understanding the evolution of research on this subject, as well as highlighting the importance of reusing these wastes. The results indicated that research has gradually advanced, with emphasis on immobilization methods by covalent bonding and physical adsorption. The ideal operating conditions are between 35°C and 60°C and pH of 6 to 10, with neutral pH (7) being the most commonly used. Furthermore, glutaraldehyde was frequently used to activate the supports in the studies analyzed.
Key-words: lipase, immobilization, supports, agro-industrial waste, covalent bonding, physical adsorption.
1. INTRODUÇÃO
O setor agropecuário é uma das principais atividades socioeconômicas da humanidade, e através dele são gerados grandes volumes de resíduos agroindustriais (EMBRAPA, 2020). De acordo com o relatório da Embrapa (2022), em 2020 o agronegócio contribuiu para 26,6% do PIB do Brasil. Além disso, o relatório enfatiza esse volume através dos dados, como a plantação de cana de açúcar que já ocupa mais de 1% do território brasileiro e a produção de soja que representou 35% dos produtos mais exportados em 2020 (EMBRAPA, 2022).
Todos esses dados mostram que, no país, a grande quantidade de produtos agroindustriais produzidos gera resíduos, estes que por sua vez podem ser de interesse no campo da ciência, como as áreas de bioquímica, química e biologia, para o desenvolvimento de pesquisas e aplicações, como aponta o estudo de Chia et al. (2015), no qual, bagaço de cana-de-açúcar foi usado para gerar suportes de hidrogel, denominados beads, que são importantes para imobilizar enzimas.
Ainda nesse sentido, esses tipos de resíduos são compostos por materiais lignocelulósicos, cuja concentração pode variar de acordo com o amadurecimento da planta, condições climáticas e fertilidade do solo (Souza; Santos, 2023).
A imobilização de enzimas é um procedimento que tem como objetivo ancorá-las em uma estrutura sólida, como uma resina ou um suporte inativo, sem comprometer sua capacidade catalítica (Diniz, 2023). A imobilização apresenta diversas vantagens, dentre elas a de mais destaque é que a imobilização aumenta a estabilidade sob as condições do processo e melhora a reutilização das biomoléculas durante os ciclos catalíticos (Zhang et al., 2015).
Existem diversas técnicas de imobilização, dentre elas, o aprisionamento, encapsulamento, adsorção, ligação covalente e ligação cruzada (Sheldon, 2007). Ao considerar a natureza de cada estrutura das células, não existe uma técnica que seja aplicável em todas as destinações, por isso, é importante o estudo para escolher o processo mais simples e menos oneroso, que atenda às necessidades da molécula e que apresente boa estabilidade e conservação da atividade (Mender, 2012).
Diversos materiais são usados como suportes para imobilização de enzimas, podendo ser divididos como inorgânicos, orgânicos ou compostos. O objetivo dos suportes é proteger a estrutura da enzima contra condições dispostas no ambiente ou reação que possa prejudicá-las, dessa forma, o suporte ajuda a enzima a conservar sua atividade catalítica (Sheldon, 2013).
Os suportes necessitam de algumas características para uma efetiva imobilização de enzimas, dentre elas, apresentar estabilidade química e térmica, ser insolúvel, ter alta afinidade com a proteína, dispor de grupos funcionais reativos, apresentar boa reutilização e, sempre que possível, ter baixo custo. Assim, ao relacionar os métodos de imobilização e o uso dos suportes, a escolha do material do suporte é relevante devido à significativa influência que esses materiais podem exercer sobre as características do sistema biocatalítico (Zdarta et al., 2018).
Diante do exposto, a presente pesquisa buscou analisar os estudos voltados para imobilização da enzima lipase em suportes gerados a partir de resíduos agroindustriais, considerando os últimos cinco anos, a fim de gerar uma tabela comparativa que permite identificar os principais aspectos e condições para cada tipo de suporte de acordo com o resíduo aplicado.
2. MATERIAL E MÉTODOS
O presente estudo é pautado em revisão de literatura que, de acordo com Garcia (2016) é “o estado da arte do assunto que está sendo pesquisado”. Esse tipo de revisão é fundamental para a investigação presente, Gil (2002) afirma que o desenvolvimento de uma pesquisa é baseado em um material já elaborado, tais como artigos científicos e livros.
Portanto, para esse fim, recorreu-se às bases de dados Google Scholar, Periódicos CAPES, SciELO, Banco Digital de Teses e Dissertações, PubMed e SciFinder, por congregar em periódicos internacionais e nacionais. Foram selecionadas as fontes publicadas a partir do ano de 2020. O levantamento foi realizado no período de Abril a Outubro de 2024, por meio dos descritores “resíduos agroindustriais”, “enzima”, “imobilização”, “suportes” e “lipase”, em português e inglês. Junto dos operadores booleanos “OR” e “AND”. Esse tipo de busca nos permitiu chegar a mais de 500 resultados, sendo escolhidos, desses, dez artigos para estudo.
Nessas pesquisas, o objetivo principal foi encontrar estudos que apresentassem métodos de imobilização de enzima lipase em suportes formados a partir de resíduos agroindustriais, nos permitindo compreender a evolução dos estudos e uso de diferentes suportes, sobretudo, enfatizando os resíduos utilizados, visto que analisar isso permite a compreensão da destinação desses rejeitos. Além disso, a enzima lipase foi alvo do estudo, pois, ela é de grande interesse industrial devido a quantidade de reações catalisadoras e sua aplicação em diferentes processos (Sharma; Chisti; Banerjee, 2001; Colla; Reinehr; Costa, 2012).
Para tanto, visando à consulta de um conteúdo já publicado sobre o tema citado anteriormente, e usando os bancos de artigos também já pontuados, selecionaram-se pesquisas mais recentes a partir da leitura dos resumos e identificação das palavras chave, o que permitiu averiguar a similaridade da linha de pesquisa voltada para a imobilização de enzimas e gerar uma tabela comparativa.
3. REFERENCIAL TEÓRICO
3.1 Resíduos agroindustriais
A agroindústria, parte importante da economia do Brasil, é, de acordo com Vaz Júnior (2020) “o conjunto de atividades relacionadas à transformação de matérias-primas da agricultura, pecuária, aquicultura ou silvicultura”. Estas atividades somadas, tem se mostrado importante para o PIB brasileiro, de acordo com Barbosa e Brisola (2024), as tecnologias implementadas nessa área desde a década de 90 transformaram as formas de produção, fazendo do agronegócio em um “sistema produtivo altamente competitivo e eficiente”, como discorrem os autores, e isso refletiu e tem refletido no PIB do país.
A Agência IBGE Notícias revelou, em 2023, um crescimento de 2,9% no PIB do Brasil, e deste aumento a parte de agropecuária teve uma taxa de 15,1% de avanço, frente a indústria e serviços que foram representados por 1,6% e 2,4% respectivamente. Ainda na mesma notícia, é comentado que a alta no agronegócio foi resultado do ganho de produtividade na agricultura.
Nesse sentido, é importante considerar que todas as atividades desse setor, além do produto final, gera também os chamados resíduos agroindustriais. Segundo Vaz Júnior (2020), dados apontam que “o volume de resíduos secos de biomassa vegetal atinge o equivalente a 140 Gt”. O autor ainda afirma que essa quantidade seria um problema ambiental grave, isso se não houvesse as diversas alternativas de uso desses resíduos, dentre as quais está a aplicação dos mesmos para a geração de suportes para a imobilização de enzimas.
3.2 Materiais lignocelulósicos
Os materiais lignocelulósicos são as fontes renováveis mais fartamente encontradas na natureza. Esses materiais são oriundos de madeiras, gramíneas, resíduos agrícolas e florestais e resíduos sólidos municipais. (Pérez et al., 2002.) De acordo com Vassilev et al. (2012), nos resíduos de madeira podem ser encontrados caules, cascas, serragem, briquetes e outros de diferentes espécies de madeira, já nos resíduos agrícolas, destacam-se gramíneas e flores, palhas, hastes, fibras, cascas e caroços de materiais como a bananeira, cana-de-açúcar, feijão, milho, arroz, coco, castanha de caju, café, trigo e etc, cada qual com sua variedade e utilidade.
A lignocelulose é uma estrutura sintetizada por células vegetais, é especialmente composta de celulose e hemicelulose, ambos carboidratos poliméricos, e, a lignina, um polímero aromático. As composições percentuais desses componentes estão diretamente relacionadas com a espécie das plantas, o tecido vegetal e as influências ambientais (Brandt et al., 2013). De forma geral, os materiais lignocelulósicos são compostos por cerca de 10 a 25% de lignina, 20 a 30% de hemicelulose e 40 a 50% de celulose (Anwar et al. 2014).
A celulose é o componente com maior predominância na estrutura lignocelulósica, composta por grandes quantidades de unidades de glicose. É classificada como uma cadeia polimérica linear de unidade de D-anidro glicose interligadas com ligações β-1,4-glicosídicas nos átomos de carbono C1 e C4. As cadeias de celulose são acondicionadas em microfibrilas, que são firmadas por meio de ligações de hidrogênio. A celulose composta por cadeias com distribuição molecular organizada é conhecida como celulose cristalina, já as com disposição aleatória, são conhecidas como celulose amorfa. A celulose cristalina apresenta maior resistência contra a degradação em consequência da alcalinidade e atividades de agentes oxidantes e micróbios, além disso, a estrutura cristalina é mais hidrofóbica, já que os conjuntos de hidroxila dentro da parte cristalina das moléculas de celulose estão adequados de forma compacta, deste modo, não são acessíveis às moléculas de água ou outros produtos. Por isso, a celulose cristalina apresenta maior resistência contra a degradação e também é colaboradora para a resistência à flexibilidade e tração das fibras de lignocelulose (Brandt et al., 2013; Brodeur et al., 2011; Hendriks et al., 2009; Saha et al., 2015;).
A hemicelulose é um carboidrato complexo que abrange diferentes polímeros como pentoses, hexoses e ácidos açucarados. As hemiceluloses diferem da celulose em razão de serem compostas por diferentes unidades de açúcar, além disso, são mais hidrofílicas e suscetíveis à hidrólise ácida e alcalina comparado à celulose, em virtude da estrutura amorfa e ramificada. As fibrilas de celulose são ligadas umas às outras por meio da hemicelulose, essa estrutura certifica maior rigidez à rede de celulose-hemicelulose-lignina. (BRANDT et al., 2013; HENDRIKS et al., 2009; SAHA et al., 2015;).
A lignina é um polímero complexo constituído por álcoois aromáticos ligados de diferentes maneiras, em ordem de abundância destaca-se: álcoois coniferílico, sinapílico e p-cumárico. A lignina permite um maior reforço estrutural (rigidez), impermeabilização e ainda, defesa a ataques físicos ou biológicos. Em consequência da sua posição e estrutura, está ligada tanto à celulose quanto à hemicelulose, promovendo uma proteção ao redor desses componentes. (BRANDT et al., 2013; IQBAL et al., 2013; JIANG et al. 2010).
3.3 Imobilização de enzimas
A imobilização enzimática é uma técnica que permite fixar as enzimas em um suporte sólido insolúvel no meio reacional (Jesionowski et al., 2014). Essa é uma das soluções mais simples para o problema de solubilidade que afeta esses biocatalisadores, além disso, é essencial para melhorar propriedades como estabilidade, seletividade, atividade enzimática, redução da inibição e, ainda, permitir sua reutilização. (Mateo et al., 2007)
Existem diversos métodos para a imobilização de enzimas, no entanto, não há um método universal que possa ser aplicado em todas as enzimas. É importante selecionar a técnica mais barata e simples que desenvolva adequada atividade e estabilidade durante a operação (Mendes et al., 2011). Dentre os estudos, existem variadas técnicas para imobilização (Figura 1), tais como, a adsorção, encapsulamento, aprisionamento, ligação cruzada e ligação covalente. As interações desenvolvidas e a especificidade dos materiais de suporte são responsáveis por diferenciar os métodos. Para tanto, a escolha dos materiais de suporte é de suma importância, pois pode gerar impacto nos métodos e condições do sistema de biocatálise (Sheldon, 2007; Zdarta et al., 2018).
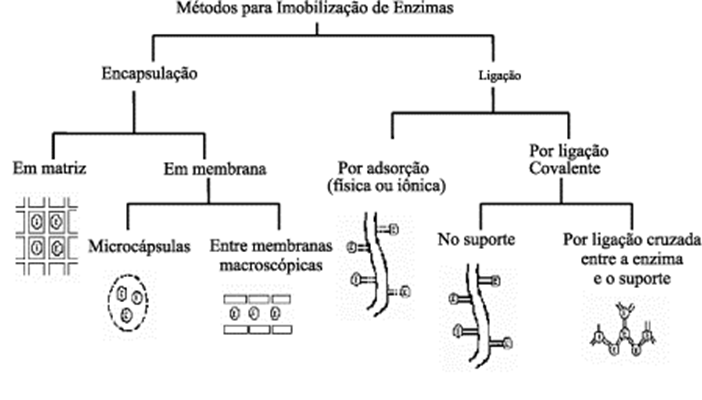
Fonte: Dalla-Cecchia, Nascimento e Soldi (2004)
Nos parágrafos seguintes, serão brevemente discutidas as diferentes técnicas de imobilização, de forma geral, podem ser divididas em adsorção, ligação covalente, aprisionamento ou encapsulação e reticulação (Sheldon, 2007).
A adsorção física é uma técnica simples que permite a imobilização em superfície sólida em condições suaves, ela ocorre através de interações hidrofóbicas, como as ligações de hidrogênio, forças de Van der Waals e ligações iônicas. As vantagens dessa técnica são a facilidade e baixo custo, a possibilidade de reutilização do suporte, além de poucas alterações estruturais da enzima. Como desvantagem é possível notar a interação aleatória da enzima-suporte e a dessorção por alterações no meio reacional (Cao, 2006; Zhou, 2012).
A imobilização por ligação covalente é um dos métodos mais populares em razão da elevada estabilidade, suportando possíveis condições extremas de pH, temperatura e outros fatores. Essa técnica é usada para fixar enzimas em uma matriz sólida por meio da formação de ligações covalentes entre a enzima e uma matriz (Rodrigues et al., 2021).
A imobilização por meio da encapsulação é definida como a retenção física da enzima confinada em uma matriz sólida porosa, geralmente formada por polímeros entrecruzados, como a gelatina, alginato de cálcio, agarose, entre outros. A vantagem desse método é que ele permite a estabilidade estrutural das enzimas, já que é possível haver imobilização síncrona de um ou mais tipos de proteínas (Zubiolo, 2013).
Já para a imobilização de enzimas através da reticulação ou também conhecida como cross-linking, pode ser realizada de forma que as enzimas são ligadas diretamente entre si a partir de um agente de reticulação, como o glutaraldeído, ou seja, sem um tipo de suporte. O resultado da ligação de moléculas de enzimas por meio de reagentes bifuncionais se torna insolúvel e precipita, assim, um agregado sólido com atividade catalítica é formado. Este método apresenta a vantagem de ter uma execução enzimática focada no catalisador e grande estabilidade (Fernandes et al., 2010; Sheldon; Van Pelt, 2013; Queissada; Silva, 2020).
3.4 Enzima lipase
A lipase, enzima de grande interesse industrial devido a quantidade de reações catalisadoras que ela realiza, tais como: hidrólise total ou parcial de triacilgliceróis (TAG) e reações de esterificação, transesterificação e interesterificação de lipídios (Sharma; Chisti; Banerjee, 2001; Colla; Reinehr; Costa, 2012). Podem ser aplicadas em diferentes processos, como: hidrólise de gorduras (como a do leite), melhoria de aroma e sabor, reações de transesterificação e hidrólise (Sharma; Chisti; Banerjee, 2001; Colla; Reinehr; Costa, 2012)
Fisiologicamente, as lipases hidrolisam os triglicerídeos em diglicerídeos, monoglicerídeos e ácidos graxos livres e glicerol, estando presentes em processos digestivos, tais como metabolismo, enquanto em plantas ela atua nos tecidos de reserva de energia (Sharma; Chisti; Banerjee, 2001).
3.5 Suportes de imobilização
Os suportes usados para imobilização são estruturas utilizadas para prender ou fixar enzimas, conservando-as em fase sólida ao interagirem com substratos ou moléculas em uma solução (Rodríguez-restrepo; Orrego, 2020; Sheldon; Van Pelt, 2013).
De acordo com Mendes et al. (2011), o ótimo desempenho de uma enzima está relacionado com o uso do suporte, por isso o estudo acerca dos suportes é de suma importância, já que podem afetar de forma positiva ou negativa a performance do processo.
Os suportes podem ser divididos em inorgânicos, orgânicos ou compostos. Para os inorgânicos, a sílica é o material mais usado, por apresentar uma ótima resistência às condições químicas, térmicas e mecânicas. Já para os suportes orgânicos, são muito usados para imobilização de enzimas, os polissacarídeos pouco solúveis em água, como o amido, agarose, quitosana e celulose (Sheldon; Van Pelt, 2013; Zdarta et al., 2018). Também podem ser classificados de acordo com a estrutura, sendo esta em gel, porosa ou não porosa (Souza et al., 2017).
Os suportes orgânicos são muito utilizados na imobilização de enzimas, pois apresentam menor custo em relação aos sintéticos e facilidade de degradação, além de possibilitarem a reutilização de materiais para compor suas estruturas, dessa forma, são menos danosos ao meio ambiente (Mendes et al., 2011; Queissada; Silva, 2020).
Para a escolha do suporte é importante compreender que a seleção da matriz está diretamente associada ao tipo de processo e enzima que será utilizada no complexo biocatalítico (Zdarta et al., 2018). Por isso, existem algumas características que são necessárias aos materiais empregados como suportes para uma eficiente imobilização enzimática, esses atributos são descritos por Zdarta et al. (2018), em que a estabilidade química e térmica, afinidade com as enzimas, recuperação e reutilização, disponibilidade e preço, presença de grupos funcionais reativos, entre outros, são descritos como as principais características para os materiais de suporte.
4. RESULTADOS E DISCUSSÃO
A partir da coleta dos artigos para o levantamento bibliográfico a respeito da imobilização de lipase em suportes de baixo custo, na Tabela 1 é possível verificar a síntese feita dos estudos publicados nos últimos cinco anos, em ordem cronológica.
Tabela 1 – Compilado dos estudos sobre imobilização de lipase em resíduos agroindustriais
Título/Autor Ano de publicação Método de mobilização Resíduo utilizado Condições favoráveis para o desempenho da enzima Principais resultados Imobilização covalente de lipase em palito residual de erva mate (Ilex Paraguariensis A. St.-Hil.) (RIGO, 2020) 2020 Ligação covalente Palito residual de erva-mate A temperatura ótima reacional foi de 40°C. Solvente hexano ou tampão nitrato de amônia pH 10. Suporte ativado com APTS/glutaraldeído e metaperiodato de sódio. 225,5 e 162,7% de rendimento em relação a atuação da enzima livre, e possibilidade de 8 e 5 ciclos de utilização com atividade residual de 65,62% e 52%. Síntese de carvões ativados a partir de resíduos da agroindústria e sua aplicação na imobilização de lipase (BRITO, 2020) 2020 Adsorção e ligação covalente Bainhas do palmito de pupunha e do bagaço do malte O desempenho da lipase mostrou-se ideal entre 30-50 °C, dependendo do método de imobilização.. As temperaturas mais altas favorecem a atividade de derivados, os quais foram imobilizados em carvão ativado funcionalizado. Reuso de pelo menos cinco vezes consecutivas. Imobilização de lipases em carvões ativados obtidos a partir do caroço de tamarindo e sua aplicação na síntese de butirato de butila (GONÇALVES, 2020) 2020 Adsorção e ligação covalente Caroço de tamarindo Temperatura de 35°C. Carvão com glutaraldeído pH de 7,0 e outros carvões em pH de 8,0. Incubação de até 4h sem alteração da atividade da lipase. Rendimento superior a 60% na síntese do butirato de butila em relação a retenção da atividade hidrolítica, e estabilidade de reuso. Otimização do tratamento do bagaço de caju com divinilsulfona visando sua utilização como suporte para imobilização da lipase do tipo A de Candida antarctica. (LIMA, 2020) 2020 Ligação Covalente Bagaço de Caju 3 mL/g de DVS; 5 mM de solução tampão; pH-3; temperatura de 30°C dentro de um tempo de 12 h Por definição de parâmetros foi possível obter estabilidade térmica, condições otimizadas para imobilização e síntese de compostos aromáticos Imobilização de lipase em epicarpo de coco babaçu para aplicação como biocatalisador (SANCHES, 2021) 2021 Adsorção física Fibra de epicarpo de coco babaçu Temperatura de 30°C e 50ºC, pH=7,0 remoção de lignina e impurezas, análise por FTIR confirmou a eficácia do tratamento. Imobilização da Enzima Candida rugosafoi Síntese de triglicerídeos dietéticos catalisada por lipase de rhizopus oryzae imobilizada em pó de sabugo de milho por adsorção física (PACHECO, 2020) 2021 Adsorção física Pó de sabugo de milho Temperatura de 41ºC e pH de 7,75 O rendimento da imobilização, considerando a razão entre a atividade teoricamente imobilizada e a atividade oferecida na imobilização, foi de 90,8%.
O biocatalisador imobilizado manteve 70,19% da atividade inicial, enquanto o de forma livre, 56,71%, em temperatura de 41°C. Estabilidade térmica da enzima imobilizada.Produção de oleato de decila utilizando a lipase de Geotrichum candidum (SANTOS, 2021) 2021 Adsorção física Casca de arroz (fenil-sílica de casca de arroz) As condições ótimas para a produção do emoliente foram estabelecidas para 17 % (m/v) de biocatalisador e a temperatura de reação de 50 °C. O suporte de sílica de casca de arroz modificada com o grupo fenil apresentou uma maior hidrofobicidade (52,70 μg de corante/m2) e apresentou uma melhor atividade do derivado (13,69 0,02 U/g de suporte) para os ensaios de imobilização. Produção de ésteres industriais empregando biocatalisadores heterogêneos preparados por imobilização lipase em partículas de biossílicas funcionalizadas. (GAMA, 2021) 2021 Imobilização por ativação interfacial sílica extraída da casca de arroz Meio isento de solvente; 45°C; 330 minutos (para a produção de oleato de cetila); Hidrofobicidade do suporte. Conversão de 92% para a síntese de oleato de cetila (éster cosmético) e 85% para ésteres decílicos (biolubrificantes) a partir de ácidos graxos livres de óleo de soja e óleo de fritura; Estabilidade operacional ( 88% de sua atividade original conservada); Os ésteres produzidos apresentaram características físico-químicas próximas dos biolubrificantes comerciais Imobilização da lipase de Candida antarctica do tipo B usando como suporte fibra de coco verde pré-tratada por explosão a vapor (DINIZ, 2023) 2023 Ligação covalente Biomassa de fibra de coco Temperatura de 60°C e pH 7,0. Suporte sinalizado com APTES (3-aminopropiltrietoxisilano) e ativado com glutaraldeído. Dessorção realizada com NaCl (1M) e Triton X-100 (1,0% (v/v)). Condição 1(Enzima incorporada após recobrimento com glutaraldeído): Atividade recuperada em torno de 150%. Boa resistência térmica. Condição 2 (Enzima incorporada antes do recobrimento com glutaraldeído): atividade recuperada de 125%.Boa resistência térmica.Maior resistência a dessorção devido a formação de bases de Schiff. Utilização de beads de celulose como suporte para imobilização da lipase de Candida rugosa: caracterização bioquímica e cinètica
(AGRA et al. , 2023) 2023 Ligação covalente Beads de celulose Atividades enzimáticas do biocatalisador a partir da hidrólise do azeite de oliva em diferentes pHs (6 a 8) e temperaturas (40-60 oC). A atividade enzimática máxima obtida (cerca de 2900 U g-1) foi obtida em pH 7,0 e temperatura entre 40-50°C. A constante de desativação térmica (Kd) com valor de 0,1122h-1, o que corresponde a um tempo de meia vida equivalente a 6,17 h. O suporte mostrou maior estabilidade à lipase de Candida rugosa, pois a atuação do biocatalisador ocorreu em temperaturas um pouco mais elevadas, quando comparada a lipase livre.
Pode-se constatar que nos dez artigos apresentados anteriormente, os principais métodos de imobilização foram: ligação covalente e adsorção física, havendo situações em que ambos foram utilizados. A adsorção física, isola as enzimas, principalmente por ligações como: Ligação de hidrogênio, Van der Waals e ligações iônicas. Neste método, é possível verificar que para imobilização enzimática, não se faz necessário a ativação do suporte, pois essa técnica permite, através das ligações citadas, uma menor modificação na estrutura enzimática, porque a enzima se ajusta de maneira confortável buscando o melhor instante energético para sua estabilização. O processo de inativação do suporte diminui o custo de aplicação desta técnica.
O método de imobilização enzimática é uma alternativa, em relação à utilização de enzimas solúveis, tendo um custo de produção significativamente menor, uma vez que melhora sua estabilidade, sua atividade e da estrutura tridimensional. A terminologia isolada ou imobilizada, refere-se a biomolécula, a qual em meio solúvel se encontra encapsulada, ou, protegida por aparatos insolúveis que permitem um confinamento adequado para proteger a estrutura tridimensional de sofrer desnaturação, por intermédio de um ambiente hostil. (SOUZA et al. 2017) A aplicação desta metodologia a sistemas analíticos agrega para a maior robustez de um determinado método, uma vez que, permite maior resistência a variações de parâmetros fundamentais como: Temperatura, pressão, pH e tempo de processo, por exemplo.
A imobilização por ligação covalente é a conexão da enzima ao seu respectivo suporte de ativação, por intermédio de ligações covalentes. Atrás somente das ligações de hidrogênio, a força de interação entre as moléculas envolvidas, permite uma estabilização térmica do processo, diminuindo a variação da temperatura, uma importante variável da reação e do processo como um todo.
As forças de interação, a princípio, alteram a superfície do suporte reacional, partindo de reações de ativações enzimáticas, onde grupos funcionais específicos do suporte são modificados, para gerar intermediários reativos, que ativam a enzima que está acoplada ao suporte.
Os tipos de fibras utilizados foram:palito residual de erva-mate, bainhas do palmito de pupunha e do bagaço do malte, caroço de tamarindo, fibra de epicarpo de coco babaçu, pó de sabugo de milho, casca de arroz (fenil-sílica de casca de arroz), biomassa de fibra de coco e beads de celulose, todos são de origem lignocelulósica.
Em relação aos parâmetros físicos químicos as condições ótimas para a atuação das enzimas nesses suportes foram, temperaturas entre 35°C e 60°C, pH entre 6 e 10, sendo em grande parte pH neutro (ou seja, 7). Além disso, ainda seguindo uma comparação dos estudos, foi constatado que em todas as imobilizações houve mais de um uso de utilização do sistema suporte-enzima, mostrando que as fibras dos suportes, somadas aos métodos de imobilização, permitiram a atividade enzimática da enzima lipase em diversos ciclos. Ademais, um aspecto interessante identificado é que, o glutaraldeído foi utilizado para ativar o suporte em mais de um estudo.
5. CONSIDERAÇÕES FINAIS
A partir da análise dos artigos, foi possível identificar que os métodos foram evoluindo de forma gradativa, prevalecendo as seguintes formas de imobilização enzimática: ligação covalente e a adsorção física. Algumas pesquisas combinaram ambas as técnicas.
Ainda nesse sentido, explorando as diferentes técnicas, observou-se que o método de adsorção física isola as enzimas por meio de ligações como de hidrogênio, Van der Waals e iônicas, não havendo a necessidade de ativar o suporte, o que caracteriza a preservação da estrutura enzimática, resultando em menor custo e maior estabilidade para a enzima, visto que ela se adequa ao suporte.
O método de imobilização por ligação covalente conecta a enzima no suporte por meio de ligações covalentes, conferindo estabilidade térmica ao processo, minimizando as variações de temperatura durante a reação. As interações entre as moléculas envolvidas modificam a superfície do suporte, criando intermediários reativos que ativam a enzima.
Além disso, as pesquisas apresentaram uma similaridade em relação às condições de operação, uma vez que as circunstâncias ótimas de atuação para esses sistemas foram temperaturas entre 35°C e 60°C e pH entre 6 e 10, sendo o pH neutro (7) o mais comum. Ademais, observou-se o uso do glutaraldeído para ativação do suporte nos diferentes estudos.
Desta forma, pode-se considerar que a combinação dos métodos de imobilização somada a suportes adequados e condições ótimas de operação, permite melhorar a eficiência e durabilidade dos processos enzimáticos.
6. REFERÊNCIAS
ALBUQUERQUE, B. L. et al. Utilização de beads de celulose como suporte para imobilização da lipase de Candida rugosa: caracterização bioquímica e cinética. In: Anais do XXIV Congresso Brasileiro de Engenharia Química-Cobeq 2023. p. 1-6. 2023.
ANWAR, Z.; GULFRAZ, M.; IRSHAD, M. Agro-industrial lignocellulosic biomass a key to unlock the future bio-energy: a brief review. Journal of Radiation Research and Applied Sciences. v. 7, n. 2, p. 163-173, 2014. Disponível em:https://www.sciencedirect.com/science/article/pii/S1687850714000119. Acesso em: 23 out. 2024.
BARBOSA, V. C. R.; BRISOLA, M. V. Além dos campos: as prospecções tecnológicas sustentáveis da EMBRAPA para o agronegócio brasileiro. Revista de Economia e Sociologia Rural, v. 62, n. 3, p. e270441, 2024.
BRANDT, A. et al. Deconstruction of lignocellulosic biomass with ionic liquids. Green chemistry, v. 15, n. 3, p. 550-583, 2013.
BRITO, M. J. P. Síntese de carvões ativados a partir de resíduos da agroindústria e sua aplicação na imobilização de lipase. Universidade estadual do sudoeste da Bahia – UESB, 4 mar. 2020.
BRODEUR,G. et al. Chemical and Physicochemical Pretreatment of Lignocellulosic Biomass: A Review. Enzyme Research, Tallahassee, p.1-17, 2011.
CAO, L. Carrier-bound immobilized enzymes: principles, application and design. John Wiley & Sons, 2006.
CHIA, P. X. et al. Hydrogel beads from sugar cane bagasse and palm kernel cake, and the viability of encapsulated Lactobacillus acidophilus. E-Polymers, v. 15, n. 6, p. 411-418, 2015.
COLLA, L. M.; REINEHR, C. O. COSTA, J. A. V. Aplicações e produção de lipases microbianas. Revista de ciências exatas aplicadas e tecnológicas da Universidade de Passo Fundo. v. 4 n. 2, 2012. Disponível em: https://seer.upf.br/index.php/ciatec/article/view/2408. Acesso em: 23 out. 2024
DINIZ, D. S. Imobilização da lipase de Candida Antarctica do tipo B usando como suporte fibra de coco verde pré-tratada por explosão a vapor. Trabalho de Conclusão de Curso. Universidade Federal do Rio Grande do Norte. Repositório Institucional UFRN. 2023.
DALLA-VECCHIA, R.; NASCIMENTO, M. G.; SOLDI, V. Aplicações sintéticas de lipases imobilizadas em polímeros. Química Nova, v. 27, p. 623-630, 2004.
EHNINGER, A. L.; NELSON, D. L.; COX, M. M. Princípios de Bioquímica São Paulo: Sarvier, 1995.
EMBRAPA. Empresa Brasileira de Pesquisa Agropecuária. Embrapa em números. Embrapa, 2022.
FERNANDES, K. F.; LIMA, C. S.; LOPES, F. M. Técnicas de imobilização de enzimas. Revista Processos Químicos, v. 4, n. 7, p. 53-58, 2010.
GONÇALVES, G. R. F. Imobilização de lipases em carvões ativados obtidos a partir do caroço de tamarindo e sua aplicação na síntese de butirato de butila. Universidade Estadual do Sudoeste da Bahia – UESB, 23 set. 2020.
GARCIA, E. Pesquisa bibliográfica versus revisão bibliográfica: uma discussão necessária. Línguas & Letras, v. 17, n. 35, 2016.
GIL, A. C. Como elaborar projetos de pesquisa. 4. ed. São Paulo: Atlas, 2002.
HENDRIKS, A. T. W. M.; ZEEMAN, G. Pretreatments to enhance the digestibility of lignocellulosic biomass. Bioresource Technology, v. 100, n. 1, p. 10-18, 2009.
IQBAL, H. M. N.; KYAZZE, G.; KESHAVARZ, T.. Advances in the valorization of lignocellulosic materials by biotechnology: an overview. BioResources, v. 8, n. 2, p. 3157-3176, 2013.
JESIONOWSKI, T.; ZDARTA, J.; KRAJEWSKA, B.. Enzyme immobilization by adsorption: a review. Adsorption, v. 20, p. 801-821, 2014.
JIANG, G.; NOWAKOWSKI, D. J.; BRIDGWATER, A. V. A systematic study of the kinetics of lignin pyrolysis. Thermochimica Acta, v. 498, n. 1-2, p. 61-66, 2010.
MATEO, C. et al. Improvement of enzyme activity, stability and selectivity via immobilization techniques. Enzyme and microbial technology, v. 40, n. 6, p. 1451-1463, 2007.
MENDES, A. A. et al. Aplicação de quitosana como suporte para a imobilização de enzimas de interesse industrial. Química Nova, v. 34, p. 831-840, 2011.
MENDES, A. A. et al. Evaluation of immobilized lipases on poly-hydroxybutyrate beads to catalyze biodiesel synthesis. International Journal of Biological Macromolecules, v. 50, n. 3, p. 503-511, 2012.
PACHECO, B. J. S. et al. Síntese de triglicerídeos dietéticos catalisada por lipase de Rhizopus oryzae imobilizada em pó de sabugo de milho por adsorção física. 2020.
PÉREZ, J. et al. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. International Microbiology, v. 5, p. 53-63, 2002.
PIB cresce 2,9% em 2023 e fecha o ano em R$ 10,9 trilhões. Agência IBGE Notícias. 2024.Disponível em: https://agenciadenoticias.ibge.gov.br/agencia-sala-de-imprensa/2013-agencia-de-noticias/releases/39303-pib-cresce-2-9-em-2023-e-fecha-o-ano-em-r-10-9-trilhoes. Acesso em: 01 set. 2024.
QUEISSADA, D. D.; SILVA, J. A. Imobilização enzimática em suportes orgânicos e inorgânicos: vantagens e desvantagens. Holos Environment. v. 20, n. 2, p. 271-286, 2020.
RIGO, D. Imobilização covalente de lipase em palito residual de erva-mate (Ilex paraguariensis A. St.-Hil.). Universidade Regional Integrada do Alto Uruguai e das missões Uri Erechim, 1 abr. 2020.
RODRÍGUEZ-RESTREPO, Y. A.; ORREGO, C. E. Immobilization of enzymes and cells on lignocellulosic materials. Environmental Chemistry Letters, v. 18, p. 787-806, 2020.
RODRIGUES, R.l C. et al. Stabilization of enzymes via immobilization: Multipoint covalent attachment and other stabilization strategies. Biotechnology Advances, v. 52, p. 107821, 2021.
SAHA, P. et al. A brief review on the chemical modifications of lignocellulosic fibers for durable engineering composites. Polymer Bulletin, v. 73, p. 587-620, 2016.
SANCHES, G. J. L. Imobilização de lipase em epicarpo de coco babaçu para aplicação como biocatalisador.Trabalho de Conclusão de Curso. UFMA. 2021.
SANTOS, L. F. S. et al. Produção de oleato de decila utilizando a lipase de Geotrichum candidum. Dissertação. UNIFAL. 2021.
SHARMA, R.; CHISTI, Y.; BANERJEE, Y. C. Production, purification, characterization and applications of lipases. Biotechnology Advances, v. 19, p. 627-662, 2001.
SOUZA, L. T. A. et al. Imobilização enzimática: princípios fundamentais e tipos de suporte. Capítulo de livro: Biotecnologia aplicada à agroindústria. Editora Blucher. 2017.
SHELDON, R. A. Enzyme immobilization: the quest for optimum performance. Advanced Synthesis & Catalysis, v. 349, n. 8‐9, p. 1289-1307, 2007.
SHELDON, R. A.; VAN PELT, S. Enzyme immobilization in biocatalysis: why, what and how. Chemical Society Reviews, v. 42, n. 15, p. 6223-6235, 2013.
SOUZA, O.; SANTOS, I. E. Importância dos resíduos agropecuários na alimentação animal. Boletim Pecuário, 2002.
VASSILEV, S. V. et al. An overview of the organic and inorganic phase composition of biomass. Fuel, v. 94, p. 1-33, 2012.
VAZ JUNIOR, S. Aproveitamento de resíduos agroindustriais: uma abordagem sustentável. SIDALC. 2020.
ZHANG, Yifei; GE, Jun; LIU, Zheng. Enhanced activity of immobilized or chemically modified enzymes. AcS catalysis, v. 5, n. 8, p. 4503-4513, 2015.
ZDARTA, J. et al. A general overview of support materials for enzyme immobilization: characteristics, properties, practical utility. Catalysts, v. 8, n. 2, p. 92, 2018.
ZHOU, Z. et al. Improved activity and stability of lipase immobilized in cage-like large pore mesoporous organosilicas. Microporous and Mesoporous Materials, v. 154, p. 133-141, 2012.
ZUBIOLO, C. Imobilização por encapsulação de lipase de Aspergillus niger em matriz sol-gel obtida a partir de farinha de sementes de abóbora. Dissertação. Repositório Institucional UFS. 2013.
¹E-mail: n.paixao@aluno.ifsp.edu.br;
²E-mail: e.mondeck@aluno.ifsp.edu.br;
³E-mail: lcsamendes@gmail.com;
⁴E-mail: raquelmanhani@ifsp.edu.br;
⁵E-mail: soavan@ifsp.edu.br.
