IDENTIFICATION OF ADVERSE EVENTS AFTER VACCINATION AGAINST COVID-19
REGISTRO DOI: 10.69849/revistaft/th102501091205
Adélia Maria do Carmo Rodrigues1
Yngrid Nathalia Ramos de Queiroz2
Maria Clara de Queiroz Caluête2
Valdemir Moreira dos Santos Junior3
Maria Aparecida Barbosa Andrade3
Alice Henriques Lima3
Bruna Larissa Barbosa de Lira3
Carlos Renato de Morais Nunes3
David Souto Maior Vasconcelo3
João Alfredo de Souza Silva3
Luane Silva Carvalho3
Leticia Farias de Macedo3
Ester Batista de Oliveira Santos3
Caroline Santos Pereira3
César Augusto Ferreira Rodrigues3
Maria do Socorro Ramos de Queiroz4
Resumo
O desenvolvimento da vacina para conter os danos da pandemia do coronavírus obteve sucesso após várias pesquisas, e em janeiro de 2021, foram aprovadas de forma emergencial no Brasil. O descumprimento do plano de vacinação, uma das maiores preocupações do ministério da saúde, se dá, na maioria das vezes, pelo surgimento de Eventos Adversos Pós Vacinal (EAPV). Esse estudo teve como objetivo identificar EAPV em indivíduos no pós-vacinal contra a Covid-19. Tratou-se de uma pesquisa transversal e descritiva, com abordagem quantitativa, ocorrida no período de setembro de 2021 a julho de 2022. Durante decretos estaduais que determinavam o isolamento social o formulário foi enviado através da ferramenta Google Forms. Todas as análises foram realizadas com o auxílio do software estatístico RStudio. Participaram 349 pessoas e na avaliação dos EAPV referente a 1ª e 2ª dose contra a Covid -19, 237 (67.91%) pessoas revelaram ter apresentado, sendo as maiores queixas com relação a vacina Astrazeneca. Quanto a 3ª dose, 128 (47.05%) também confirmaram presença de eventos, sendo mais citados pelos que fizeram uso da Pfizer e da Astrazeneca. Todos os registros foram do tipo não grave (EANG), tendo como reação adversa local mais comum a dor ou sensibilidade na região da aplicação (Dor, Eritema e Rubor) e como reação adversa sistêmica a fadiga, a febre, ou a dor corporal. Os resultados deste estudo demonstraram a frequente ocorrência dos EAPV em decorrência da vacina contra a Covid -19. Dado justificado porque na avaliação da relação das manifestações clínicas com a presença de EAPV pós 1ª, 2ª e 3ª doses foi apresentado resultados significativos (p=0.00). Para aliviar as manifestações clínicas locais e/ou sistêmicas o grupo farmacológico mais utilizado foi Analgésicos/Antitérmico (n=114; 32.66%). Portanto, esse trabalho fomenta sobre a importância dos registros dos EAPV decorrentes das vacinas contra COVID-19, demonstrando que são seguras para a população.
Palavras-chave: Covid-19; Vacinas; Reações adversas pós vacinal.
1 INTRODUÇÃO
O coronavírus (CoV), identificado inicialmente no final de 2019 em Wuhan, China, rapidamente se disseminou por todos os continentes, aumentando de forma expressiva o número de infectados e ocasionando milhares de mortes no mundo. Em março de 2020, a Organização Mundial de Saúde (OMS) declarou que o mundo vivia uma pandemia de Covid -19, e desde então, foi visto um quadro sanitário sem precedentes nos últimos 100 anos (Couto; Barbieri; Matos, 2021).
Dessa forma, sendo considerado uma emergência de saúde pública de interesse internacional, a busca pelo desenvolvimento de uma vacina foi atenuada em todo o mundo, isso foi possível a partir do sequenciamento genético do vírus SARS-CoV-2, que abriu caminhos para a pesquisa científica em busca da imunização. Devido ao grande impacto da pandemia em escala mundial, novas plataformas de tecnologia de vacina foram utilizadas para acelerar as pesquisas, onde a primeira candidata a uma vacina entrou em testes clínicos em humanos em meados de março de 2020 (Lima; Almeida; Kfouri 2021). No mesmo ano, as primeiras vacinas foram autorizadas para uso emergencial em alguns países europeus e nos Estados Unidos e no dia 17 de janeiro de 2021, a Agência Nacional de Vigilância Sanitária (ANVISA) autorizou o uso de duas vacinas no Brasil (Castro, 2021).
Dentre as vacinas utilizadas pelo Plano Nacional de Imunizações (PNI), está a Coronavac, produzida pelo Instituto Butantan/Sinovac Biotech Ltda. Outras vacinas também utilizadas no Brasil foram a de Oxford/AstraZeneca/FioCruz, a vacina da Pfizer/BioNtech e a da Janssen/Johnson & Johnson (FIOCRUZ, 2021a).
Uma preocupação do Ministério da Saúde no controle do PNI são pessoas que receberam a primeira dose não retornarem no período agendado para a segunda, terceira ou quarta dose, não concluindo o esquema vacinal contra o SARS-CoV-2, motivo declarado a evento adverso pós-vacinal. De acordo com a OMS, Evento Adverso Pós-Vacinal (EAPV) é qualquer ocorrência médica indesejada que surge após a vacinação, e não está necessariamente relacionado com o uso de uma vacina ou outro imunobiológico. Também pode ser qualquer evento indesejável ou não intencional, sintoma, doença ou um achado laboratorial anormal (FIOCRUZ, 2021b; OMS, 2021).
Diante do contexto foi necessário avaliar os principais eventos adversos que surgiram pós vacinação contra a Covid -19 e correlacioná-los com possíveis fatores que influenciaram, buscando contribuir no esclarecimento da ocorrência desses eventos e na importância da conclusão do esquema vacinal.
2 FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
2.1 Pandemia da COVID-19
O CoV, inicialmente isolado em 1937, ficou conhecido em 2002 e 2003 por causar uma síndrome respiratória aguda grave no ser humano denominada SARS. Na época, a epidemia foi responsável por muitos casos de infecções graves no sistema respiratório inferior, acompanhado de febre e, frequentemente, de insuficiência respiratória. No entanto, foi rapidamente controlada e somente alguns países como China, Canadá e Estados Unidos foram afetados pelo vírus. Dezoito anos após os primeiros casos do SARS-CoV, este CoV, nomeado de SARS-CoV-2, foi responsável pela rápida propagação e disseminação da doença a nível nacional e internacional. Segundo a OMS, em 31 de dezembro de 2019, em Wuhan, na China, foram descritos os primeiros casos de pneumonia causado por um agente desconhecido e reportados às autoridades de saúde, obtendo o sequenciamento do genoma viral em 7 de janeiro de 2020. No Brasil, o registro do primeiro caso ocorreu em 26 de fevereiro de 2020 no estado de São Paulo, e em março do mesmo ano, três meses após sua descoberta, a OMS declarou uma pandemia de Covid -19 (Brito et al., 2020).
O diagnóstico definitivo do coronavírus é feito com a coleta de materiais respiratórios (aspiração de vias aéreas ou indução de escarro). O diagnóstico laboratorial para identificação do vírus é realizado por meio das técnicas de proteína C reativa em tempo real e sequenciamento parcial ou total do genoma viral. Os casos graves devem ser encaminhados a um hospital de referência para isolamento e tratamento. Os casos leves devem ser acompanhados pela Atenção Primária em Saúde e instituídas medidas de precaução domiciliar. O espectro clínico da infecção por coronavírus é muito amplo, podendo variar de um simples resfriado até uma pneumonia grave. O quadro clínico inicial da doença é caracterizado como uma síndrome gripal. As pessoas com Covid -19 geralmente desenvolvem sinais e sintomas, incluindo problemas respiratórios leves e febre persistente, em média de 5 a 6 dias após a infecção (período médio de incubação de 5 a 6 dias, intervalo de 1 a 14 dias) (Brasil, 2021).
A partir da experiência da China, que aplicou medidas severas de restrição da circulação de pessoas em toda a província de Hubei, ficou demonstrada a efetividade do distanciamento social rigoroso. Essa medida, combinada com testagem em massa, isolamento dos casos e rastreamento intensivo de contatos, interrompeu a cadeia de transmissão, controlando o surto (Ximenes et al., 2021). Durante a pandemia, o Brasil enfrentou diversas dificuldades econômicas, sanitárias e políticas, mesmo com a adoção de medidas sanitárias o país teve duas grandes ondas de infecções. Segundo a OMS entre 3 de janeiro de 2020 à 14 de outubro de 2022, foram confirmados no Brasil 34.746.462 casos de Covid 19 com 687.144 óbitos, Incidência/100mil hab de 16534,4 e com relação as vacinas registrou-se 532.761.102 doses de vacinas aplicadas (CONASEMS, 2022).
2.2 Implantação das vacinas como meio de prevenção para a saúde
Segundo a ANVISA, as vacinas são medicamentos imunobiológicos que contêm uma ou mais substâncias antigênicas que, quando inoculadas, são capazes de induzir imunidade específica ativa, a fim de proteger contra, reduzir a severidade ou combater a (s) doença (s) causada (s) pelo agente que originou o (s) antígeno (s). O desenvolvimento das vacinas, é considerado uma das mais bem-sucedidas e rentáveis medidas de saúde pública, no sentido de prevenção de doenças. Desde a última metade do século 20, doenças que antes eram bastante comuns, tornaram-se raras no mundo atual, devido à imunização generalizada ocorrida nos últimos anos, e consequentemente centenas de milhões de vidas foram salvas e bilhões de dólares poupados em saúde pública (Brasil, 2020).
A primeira vacina foi descoberta por Edward Jenner em 1796, após 20 anos de estudos e experimentos com a varíola bovina. Na Inglaterra do século XVIII, a varíola era uma doença viral responsável por cerca de 10% dos óbitos totais e um terço das mortes era registrado entre as crianças. Classificada como uma das doenças mais devastadoras da história da humanidade, foi considerada erradicada pela OMS em 1980, após realização de um programa de vacinação em massa de ordem mundial (APS et al., 2018).
Dessa forma, a utilização de vacinas baseia-se na capacidade de memória, capacidade de aprender com o processo e agir de maneira mais rápida e eficaz em infecções posteriores do organismo, ou seja, os antígenos presentes nas vacinas mimetizam uma infecção natural ativando o sistema imune, quando ocorre um segundo contato com esses antígenos as células de memória do sistema imune adaptativo conseguem identificá-lo rapidamente e agem com grande eficácia, impedindo multiplicação exacerbada do patógeno. Assim, as vacinas tem o objetivo de proteger o indivíduo de uma doença ou tornar sinais clínicos mais brandos por meio da imunidade (Chagas et al., 2019). De acordo com o Centers for Disease Control and Prevention (CDC) existem dois tipos básicos de vacinas: as viva-atenuadas, que são compostas por microrganismos vivos e as inativadas compostas por patógenos inteiros mortos ou por parte deles, essas estimulam com menor intensidade o sistema imune quando comparadas ao primeiro tipo (CDC, 2016).
A utilização de vacinas passou por diversas crises devido a falhas no desenvolvimento e manutenção dos produtos e a partir disso foram sendo criadas leis e normas para regularizar seu uso. Em 1962, os fabricantes passaram a apresentar “evidência substancial” sobre eficácia e segurança dos produtos a serem comercializados e após muito avanço foi criado o Conselho Internacional para Harmonização de Requisitos Técnicos para Produtos Farmacêuticos para Uso Humano (ICH, sigla em inglês). A partir de 1986, o Programa Nacional de Compensação de Lesões por Vacinas foi introduzido para proteger os fabricantes de vacinas de processos judiciais. No Brasil, a ANVISA foi criada em 26 de janeiro de 1999, por meio da Lei nº 9.782, com o intuito de promover a proteção da saúde da população por intermédio do controle sanitário da produção e do consumo de produtos e serviços submetidos à vigilância sanitária, inclusive dos ambientes, dos processos, dos insumos e das tecnologias a eles relacionados (Brasil, 1999). Em 1973 foi desenvolvido o PNI, que segue e disponibiliza todas as exigências da OMS em relação ao calendário de vacinação de toda população (Stávale et al., 2020).
2.3 Desenvolvimento da vacina da Covid -19
Em casos de doenças bacterianas, se as medidas de prevenção não forem suficientes, podem ser tratadas por antibióticos. As doenças virais, quando contraídas não são tão facilmente tratadas e é por esse motivo que o uso das vacinas antivirais é um método de grande importância no controle dessas doenças (Andrade et al., 2003). As vacinas virais exigem o uso de células hospedeiras a fim de que os vírus possam se multiplicar. Podem ser divididas em: atenuadas, onde o vírus se mantém ativo, porém incapaz de causar doenças, como na vacina da caxumba; inativadas, onde o vírus é inativado por agentes químicos ou físicos, como a vacina da hepatite A; ou oriundas de subunidades, que contém apenas fragmentos dos vírus, como a vacina do HPV (Silva; Nogueira, 2020).
Em janeiro de 2020, o material genético do CoV, o SARS-CoV-2, foi sequenciado e publicado no meio acadêmico, permitindo então que as buscas para uma vacina fossem iniciadas e em março de 2020 a primeira proposta de vacina entrou em fase de testes em humanos (Silva; Nogueira, 2020). Devido ao caráter emergencial, novas plataformas de tecnologia de vacina foram utilizadas para acelerar as pesquisas (Lima; Almeida; Kfouri, 2021). Ainda no mesmo ano, as primeiras vacinas foram autorizadas para uso emergencial em alguns países europeus e nos Estados Unidos e no dia 17 de janeiro de 2021, a ANVISA autorizou o uso emergencial de duas vacinas no Brasil, mostrando agilidade inédita (Castro, 2021).
Existem diversas vacinas que foram desenvolvidas e estão sendo utilizadas na população. No Brasil, entre as vacinas utilizadas pelo PNI, está a Coronavac, produzida pelo Instituto Butantan/Sinovac Biotech Ltda, por meio da plataforma de tecnologia utilizando o vírus inativado, que alcança eficácia global de 50,38%, e redução de 100% nos casos moderados e graves e nas hospitalizações, após as duas doses. Outra vacina também utilizada no Brasil é a de Oxford/AstraZeneca/FioCruz, desenvolvida através do vetor viral não replicante, possuindo eficácia de 82,4% contra infecções sintomáticas, após as duas doses. A vacina da Pfizer/BioNtech foi a primeira a ser registrada após a conclusão da última fase de testes, em dezembro de 2020, no Reino Unido, baseada na tecnologia do RNAm, alcançando 95% de eficácia após as duas doses. Foi também incorporada ao PNI, a vacina desenvolvida pela Janssen/Johnson & Johnson, que utiliza a mesma tecnologia da vacina de Oxford, do vetor viral não replicante, possuindo eficácia global de 66% e 85% em casos mais graves, sendo administrada em apenas uma dose (FIOCRUZ, 2021a).
2.4 Evento Adverso Pós Vacinação (EAPV)
As vacinas são produtos biológicos com excelente perfil de segurança. Segundo Chagas et al., (2019), uma vacina ideal deve proporcionar uma imunidade eficaz e prolongada, conferir imunidade ao feto, ter preço acessível, ser estável, se adaptar a vacinação de populações e não apresentar reações adversas. Entretanto as vacinas, assim como qualquer fármaco, são passíveis de causarem esse tipo de reação.
O tipo de vacina irá interferir diretamente em sua eficácia de modo que, vacinas inativadas estimulam com menor intensidade o sistema imune quando comparadas às vacinas viva-atenuadas, todavia, quanto mais estimularem o sistema imune, mais reações adversas às vacinas podem causar (CDC, 2016).
As reações adversas estão relacionadas às respostas diretamente advindas do fármaco ou produto ao qual foi submetido. Porém, além do uso da vacina propriamente dita, diversos fatores podem influenciar no aparecimento de sinais e sintomas pós vacinais e podem estar relacionados aos chamados eventos adversos, que são definidos como qualquer ocorrência médica desfavorável que pode ocorrer durante ou logo após o uso/administração de um medicamento, mas que não necessariamente está relacionado com o fármaco (Chagas et al., 2019).
No caso da ocorrência de eventos adversos relacionados às vacinações devem ser imediatamente notificados, investigados e esclarecidos para que não se coloque em risco a segurança geral da população, como também o programa de imunizações. Embora nenhuma vacina esteja totalmente livre de provocar eventos adversos, os riscos de complicações graves causadas pelas vacinas são muito menores que os das doenças contra as quais elas conferem proteção (Brasil, 2020a).
De acordo com Gregório (2021), os EAPV são considerados como efeitos não favoráveis ao paciente, seja por alguma reação não esperada ao medicamento (intoxicação), por uma ineficácia total ou parcial ou até devido a um erro de uso ou de administração.
No Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação, os EAPV podem ser classificados em (Brasil, 2021):
- Evento Adverso Grave (EAG): evento clinicamente relevante que requeira hospitalização; possa comprometer o paciente, ou seja, que ocasione risco de morte ou que exija intervenção clínica imediata para evitar o óbito; cause disfunção significativa e/ou incapacidade permanente; resulte em anomalia congênita ou ocasione o óbito;
- Evento Adverso Não Grave (EANG): qualquer outro evento que não preencha critério de EAG;
- Erro de imunização (programático): evento evitável, que pode causar ou levar ao uso inadequado de imunobiológicos e/ou danos ao paciente (Brasil, 2021).
Segundo a Fundação Oswaldo Cruz, caso esses eventos sejam realmente causados pela vacina, são estabelecidos três fatores básicos para a investigação (FIOCRUZ, 2021b):
• Relacionados à vacina: incluem o tipo, a cepa, o meio de cultura dos microrganismos, o processo de inativação ou atenuação, adjuvantes, estabilizadores ou substâncias conservadoras, lote da vacina;
• Relacionados aos vacinados: englobam idade, gênero, número de doses e datas das doses anteriores da vacina, eventos adversos às doses prévias, doenças concomitantes, doenças alérgicas, autoimunidade, deficiência imunológica;
• Relacionados à administração: referem-se a agulhas e seringas, ao local de inoculação e à via (intradérmica, subcutânea ou intramuscular) (FIOCRUZ, 2021b).
Os EAPVs podem ser classificados de acordo com a gravidade, quanto ao local de manifestação: local ou sistêmico e também quanto a expectativa de sua ocorrência em:
• EAPV Esperados: incluem febre, dor e edema locais, convulsões febris, anafilaxia, entre outros.
• EAPV Inesperados: são decorrentes de problemas ligados a qualidade do produto, como contaminação de lote, ou teor de toxina indevido, causando reações febris e sintomas semelhantes a sepse (FIOCRUZ, 2021b).
Com o avanço da vacinação contra a Covid -19 no mundo, os primeiros relatos de possíveis EAPVs surgiram na Europa e se referiram à vacina AstraZeneca/Oxford, na qual, pesquisas relacionaram o aparecimento de eventos trombóticos após a aplicação dessa marca de vacina. Mas, apesar dos eventos apresentados, nenhuma relação causal foi efetivamente comprovada, de modo que as vacinas continuam sendo consideradas seguras pelos órgãos que as aprovaram (Gregório, 2021). Após o início da aplicação dessas vacinas, os eventos causados por elas mais relatados incluem dor no local da injeção, febre, fadiga, cefaleia, dor muscular, calafrios e diarreia. Os efeitos colaterais menos comuns relatados para algumas vacinas contra a Covid -19 incluíram reações alérgicas graves, como anafilaxia, sendo, no entanto, extremamente rara. Estudos mostraram que, em sua grande maioria, os indivíduos mais acometidos por eventos relacionados às vacinas, são aqueles mais jovens, com idade entre 18 e 59 anos (OMS, 2021).
3 METODOLOGIA
3.1 Tipo de estudo e população
O referido estudo consistiu numa pesquisa transversal e descritiva, com abordagem quantitativa que aconteceu no período de setembro de 2021 a julho de 2022, após a aprovação do Comitê de Ética de Pesquisa realizada em Seres Humanos, da Universidade Estadual da Paraíba, sob número do parecer 5.267.336.
A população foi composta por pessoas que foram vacinadas de diferentes faixas etárias residentes em Campina Grande-PB e correspondeu a uma amostragem não probabilística por conveniência, sendo incluídos pessoas maiores de 18 anos.
3.2 Instrumentos e procedimentos de coleta de dados
Foi utilizado um formulário para a coleta de dados, a fim de obter informações detalhadas. A variável dependente do estudo foi a presença de eventos adversos pós-vacinal contra a Covid -19. As variáveis independentes foram divididas em sociodemográficas (gênero, idade e estado civil); presença de comorbidades e farmacoterapia utilizada para tratar os possíveis sintomas. Durante os decretos estaduais que determinavam o isolamento social o formulário foi enviado através da ferramenta Google Forms.
3.3 Procedimentos de análise dos dados
Para análise e organização dos dados da pesquisa foi utilizada a estatística descritiva, com apresentação de frequências simples, absolutas e percentuais para as variáveis categóricas. Para os testes de associação entre a presença de eventos adversos e as variáveis independentes foi utilizado o teste Qui-quadrado (X2) nos casos onde as frequências esperadas foram menores que 5 (Siegel, 2006), considerando o nível de significância de 5% (p>0,05). Todas as análises foram realizadas com o auxílio do software estatístico R (R CORE TEAM, 2017)
4 RESULTADOS E DISCUSSÃO
Participaram do estudo 349 pessoas, sendo a maior participação do gênero feminino (n=230; 65.90%); a maioria apresentou faixas etárias de 18-25 anos (n=150; 42.99%), estudantes (n=164; 46.99%), solteiros (n=164; 46.99%) e sem comorbidades (n=280; 80.23%) (TABELA 1).
Tabela 1 – Variáveis sociodemográficas da amostra em estudo e comorbidades apresentadas.
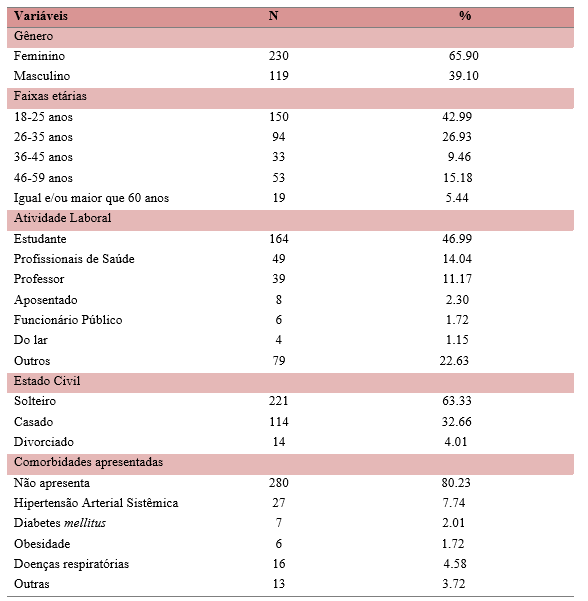
Fonte: Dados da Pesquisa, 2022.
Esses dados corroboraram com a metodologia proposta nesse estudo, porque de acordo com o isolamento social foi disponibilizado um questionário para coleta de dados, através do Google Forms e os jovens têm mais acesso a esse tipo de ferramenta.
Na avaliação dos EAPV referente a 1ª e 2ª dose contra a Covid-19, 237 (67.91%) pessoas revelaram ter apresentado, sendo as maiores queixas com relação a vacina Astrazeneca (TABELA 2).
Tabela 2 – Número de doses aplicadas, tipos de imunobiológicos e número de manifestações clínicas apresentadas pela amostra emestudo.
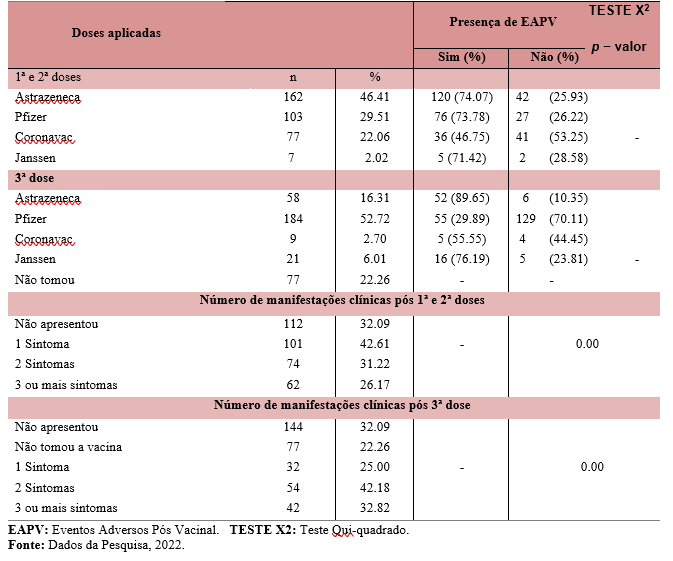
Fonte: Dados da Pesquisa, 2022.
A vacina Astrazeneca, apresentou também maior incidência em outros estudos, no estado de Minas Gerais, uma pesquisa teve como objetivo analisar os eventos adversos pós-vacinação contra o SARS-CoV-2 (Covid -19), foram 940.013 doses de vacinas administradas, destas, a maioria dos casos (69%), foi em decorrência do imunobiológico do laboratório AstraZeneca (Silva, 2021). Um dos fatores que pode estar envolvido com esses resultados é a metodologia que a vacina foi desenvolvida, através do vetor viral não replicante, as respostas causadas por essas vacinas são muito semelhantes às induzidas naturalmente por patógenos (Teixeira, 2021).
Quanto a 3ª dose, 128 (47.05%) também confirmaram presença de eventos, sendo mais citados pelos que fizeram uso da Pfizer e Astrazeneca. As manifestações clínicas variaram entre 1 e 3 sintomas. A maior incidência de eventos em relação a vacina Pfizer também pode estar relacionado a maior aplicação desta durante as doses de reforço. Além disso, é possível observar o grande número de pessoas que ainda não tomaram a terceira dose, fator preocupante para a saúde pública, pois a ausência da dose de reforço pode aumentar a morbimortalidade (Orrico, 2022).
Os resultados deste estudo demonstraram que foi frequente a ocorrência dos EAPV em decorrência da vacina contra a Covid-19. Dado justificado porque na avaliação da relação das manifestações clínicas com a presença de EAPV pós 1ª, 2ª e 3ª doses foi apresentado resultados significativos (p=0.00).
De acordo com a classificação da Fundação Oswaldo Cruz todos os registros foram do tipo EANG, tendo como reação adversa local mais comum a dor ou sensibilidade na região da aplicação (Dor, Eritema e Rubor) e como reação adversa sistêmica a fadiga, a febre, ou a dor corporal (FIOCRUZ, 2021b). Todos os dados obtidos neste estudo corroboraram com a literatura que mostrou a maior incidência EAPV do tipo EANGs e também as mesmas manifestações clínicas.
Ainda são escassos estudos que avaliam a presença de EAPV contra a Covid -19, no entanto Rodrigues e Dalri (2019) realizaram um estudo de EAPV contra Influenza em idosos no Brasil e as manifestações clínicas locais se caracterizaram por dor, calor, eritema ou rubor, edema, com porcentagens acima de 32%, corroborado com as que foram registradas nessa pesquisa.
Segundo o Ministério da Saúde os EANG ocorrem de forma ordinária e ocasionam majoritariamente manifestações clínicas leves e moderadas no local ou próximo ao local de administração da vacina. Também, devem ser cuidadosamente monitorados, pois podem sinalizar algum problema potencialmente maior em relação à vacina ou à imunização, ou, ainda, ter impacto sobre a aceitabilidade da imunização em geral (Brasil, 2021).
O Brasil possui um Sistema de Vigilância de EAPV implementado em todos os municípios, o que permite acompanhar o impacto da vacina e a sua segurança, mesmo quando utilizada em um grande número de pessoas, durante um longo período de tempo. Os dados de EAPVs notificados são usados para ajustar as políticas públicas sobre o uso das vacinas, a fim de otimizar o seu impacto, permitindo também o acompanhamento com segurança durante o seu uso (Brasil, 2021). O grande problema é porque os casos de sintomas leves, na maioria das vezes não são informados às salas de vacinas das Unidades Básicas de Saúde ou de outros serviços de saúde.
No plano vacinal do Brasil estão disponíveis quatro imunobiológicos contra a doença para uso na população adolescente e na população adulta e dois para uso na população pediátrica. Todos oferecidos à população possuem autorização de uso pela ANVISA e passam por um rígido processo de avaliação de qualidade pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS) da Fundação Oswaldo Cruz, instituição responsável pela análise de qualidade dos imunobiológicos adquiridos e distribuídos pelo Sistema Único de Saúde (SUS) (Brasil, 2021).
As vacinas contra a Covid -19, passaram por todas as fases de estudos pré-clínicos e estudos clínicos (fase I, II e III), estando atualmente na fase IV de avaliação clínica, a fase pós-implantação. Apenas nesta fase é possível a identificação de eventos adversos raros (entre 1 evento a cada mil doses a 1 evento a cada 10 mil doses) e muito raros (menos de 1 evento a cada 10 mil doses) sendo, portanto, fundamental o monitoramento de EAPV. As vacinas estão entre os medicamentos mais seguros para o uso humano. No entanto, como qualquer outro medicamento, não estão isentas de riscos, podendo causar eventos adversos, sendo a maioria deles sem gravidade (Brasil, 2021).
A vigilância dos eventos adversos associados às vacinas Covid -19 está descrita no Protocolo de Vigilância Epidemiológica e Sanitária de Eventos Adversos Pós-Vacinação e no Manual de Vigilância Epidemiológica de Eventos Adversos Pós Vacinação. Os eventos adversos detectados pelos serviços de saúde são notificados pelos profissionais da saúde no sistema on-line e-SUS notifica, através do preenchimento de fichas com dados relacionados ao paciente e ao evento apresentado. Essas fichas são investigadas e encerradas pelas Vigilâncias de Eventos Adversos Pós-Vacinação (VEAPV) das coordenações municipais e estaduais de imunizações, com revisão e suporte por parte do Ministério da Saúde (Brasil, 2021).
Para aliviar as manifestações clínicas locais e/ou sistêmicas o grupo farmacológico mais utilizado foi Analgésicos/Antitérmico (n=114; 32.66%) e (n=225; 64,20%) não fizeram uso de nenhum medicamento.
Sabe-se que a prática da automedicação se mostra muito comum atualmente, entretanto, uma preocupante consequência da automedicação são as intoxicações medicamentosas e as interações, além de diversos problemas que o uso inadequado pode causar (Xavier, 2021). Ainda não se tem muitas informações relacionadas as interações entre as vacinas da Covid -19 e medicamentos, porém é comum o uso de analgésicos e antitérmicos para alívio de sintomas comuns pós vacinação. De acordo com Valdoleiros (2021) o uso de anti-inflamatórios esteroidais não deve ser incentivado, devido a capacidade de diminuição de resposta imunológica, podendo interferir no efeito da vacina.
É importante que campanhas sejam realizadas para informar a população a respeito dos possíveis EAPV tanto relacionados a vacina contra a Covid -19 e as demais contempladas pelo PNI e também acerca da conclusão do esquema vacinal que garante a imunidade proporcionada pelas vacinas.
5 CONSIDERAÇÕES FINAIS
Através desse trabalho, foi possível identificar os eventos adversos em indivíduos pós-vacinal contra a Covid -19. Diante dos fatos, notou-se que foi frequente o aparecimento desses eventos, entretanto tratam-se de reações não graves que correspondem a manifestações clínicas comuns a aplicação de vacinas tais como: reação adversa local mais comum a dor ou sensibilidade na região da aplicação (Dor, Eritema e Rubor) e como reação adversa sistêmica a fadiga, a febre, ou a dor corporal. Também foi possível observar o perfil sociodemográfico dos participantes, assim como, observar os diferentes tipos de respostas das vacinas utilizadas e os grupos farmacológicos representados pelos Analgésicos/Antitérmico que foram os mais utilizados para aliviar as manifestações clínicas locais e/ou sistêmicas.
É necessário que as reações adversas pós vacinação sejam notificadas, contribuindo para uma melhor compreensão e esclarecimento dos eventos causados, visto que a fase da farmacovigilância é de suma importância uma vez que busca aprimorar o conhecimento da relação benefício-risco desses produtos e minimizar os efeitos nocivos à população.
Além disso, conclui-se que o esclarecimento quanto a segurança e eficácia da imunização é de imprescindível, visto que os riscos de complicações graves causadas pelas vacinas são muito menores do que os das doenças contra as quais elas conferem proteção.
REFERÊNCIAS
ANDRADE, R. V. da et al. Vacinas: Novos Desafios Farmacêuticos. Revista Ciências Farmacêuticas, v. 1, n. 1, 2003.
APS, L. R. de M. M. et al. Eventos adversos de vacinas e as consequências da não vacinação: uma análise crítica. Revista de Saúde Pública, v. 52, p. 40, 2018.
BRASIL. Ministério da Saúde. Vacinação. Disponível em: https://www.gov.br/saude/pt-br/vacinacao. 2020.Acesso em 16 nov. 2021.
BRASIL, Ministério da Saúde. Manual de vigilância epidemiológica de eventos adversos pós-vacinação. 4. ed, Brasília: Ministério da Saúde p.340, 2021.
BRITO, S. B. P. et al. Pandemia da Covid -19: o maior desafio do século XXI. Revista Visa em Debate, v. 8, n. 2, p. 54-63, 2020.
CASTRO, R. Vacinas contra a Covid-19: o fim da pandemia? Physis: Revista de Saúde Coletiva, v. 31, n. 1, e310100, p. 1-5, 2021
CDC. Center for Disease Control. Principles of vaccination. Atlanta, USA: Center for Disease Control and Prevention. 2016. Disponível em: https://www-cdc-gov.translate.goog/vaccines/pubs/pinkbook/prinvac.html?_x_tr_sl=en&_x_tr_tl=pt&_x_tr_hl=pt-BR&_x_tr_pto=nui,sc.Acesso em 15 de nov. 2021
CHAGAS, S, R. et al. Vacinas e suas reações adversas: revisão. Pubvet, v. 13, p. 153, 2019.
CONASEMS. Conselho Nacional de Secretários de Saúde. Vacinômetro. Disponível em https://conselho.saude.gov.br/vacinometro. 2022. Acesso em: 14 de out. 2022.
COUTO, M. T.; BARBIERI, C. L. A.; MATOS, C. C. de S. A. Considerações sobre o impacto da covid-19 na relação indivíduo-sociedade: da hesitação vacinal ao clamor por uma vacina. Revista Saúde e Sociedade, v. 30, n. 1, p. 1-11, 2021.
FIOCRUZ, Fundação Oswaldo Cruz. Vacinômetro: o que já sabemos sobre vacinas contra a Covid-19 no mundo. 2021ª. Disponível em: https://www.arca.fiocruz.br/bitstream/icict/46783/2/Vacin%c3%b4metro.pdf. Acesso em: 28 jun. 2021.
FIOCRUZ, Fundação Oswaldo Cruz. Nota Técnica Observatório Covid – 19: Vigilância Epidemiológica e Sanitária de Eventos Adversos pós-vacinação. p. 21. 2021b Disponível em: file:///C:/Users/anderson/Desktop/Farm%C3%A1cia/nota_tecnica_-_observatorio_covid-19_fiocruz_-_2021-02-19.pdf.Acesso em: 28 jun. 2021.
GREGÓRIO, D. L. Responsabilidade Civil em Decorrência dos Eventos Adversos Pós-Vacinação Contra a Covid-19 e os riscos do desenvolvimento. Universidade Federal de Uberlândia: Uberlândia. 2021. Disponível em: https://repositorio.ufu.br/handle/123456789/31934. Acesso em: 28 jun. 2021.
LIMA, E. J. da F.; ALMEIDA, A. M.; KFOURI, R. de Á. Vacinas para Covid -19-o estado da arte. Revista Brasileira de Saúde Materno Infantil, v. 21, p. 13-19, 2021.
OMS. Organização Mundial da Saúde. Efeitos colaterais das vacinas Covid -19. Disponível em: https://www.who.int/pt/news-room/feature-stories/detail/side-effects-of-covid-19-vaccines.Acesso em: 28 jun. 2021.
ORRICO, G. et al. Perfil vacinal de pacientes que evoluíram para óbito por covid 19 em um hospital de referência para Covid-19, Salvador-Bahia. The Brazilian Journal of Infectious Diseases, v. 26, p. 102552, 2022.
R CORE TEAM. R. A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. 2017. Disponível em: https://www.R-project.org/. Acesso em: 10 nov. 2021.
RODRIGUES, D.; DALRI, R. de C. M. B. Eventos adversos pós-vacinação contra influenza em idosos no Brasil. Revista de Salud Pública, v. 21, n. 1, p. 1-27, 2019.
SIEGEL, S. J. Estatística Não Paramétrica para as Ciências do Comportamento. Artmed Bookman. São Paulo, 2008.
SILVA, L. O. P. da; NOGUEIRA, J. M. da R. A corrida pela vacina em tempos de pandemia: a necessidade da imunização contra a Covid-19. Revista Brasileira de Análises Clínicas, v. 52, n. 2, p. 149-53, 2020.
SILVA, R. B. da et al. Eventos adversos pós-vacinação contra o SARS-CoV-2 (covid-19) no estado de Minas Gerais. Revista de Saúde Pública, v. 55, p. 66, 2021.
STÁVALE, M. C. de M.; LEAL, M. da L. F.; FREIRE, M. da S. A evolução regulatória e os desafios na perspectiva dos laboratórios públicos produtores de vacinas no Brasil. Cadernos de Saúde Pública, v. 36, p. e00202219, 2020.
TEIXEIRA, L. C. S. Comparação das vacinas coronavac e astrazeneca aprovadas para uso emergencial no Brasil. 2021.
VALDOLEIROS, S. R. et al. Protocolo de Prevenção e Tratamento de Infeções Associadas à Terapêutica Imunossupressora de Doenças Autoimunes. Acta Medica Portuguesa, v. 34, n. 6, 2021.
XAVIER, M. S. et al. Automedicação e o risco à saúde: uma revisão de literatura. Brazilian Journal of Health Review, v. 4, n. 1, p. 225-240, 2021.
XIMENES, R. A. de A. et al. Covid-19 no nordeste do Brasil: entre o lockdown e o relaxamento das medidas de distanciamento social. Ciência & Saúde Coletiva, v. 26, p. 1441-1456, 2021.
[1] Farmacêutica. Universidade Estadual da Paraíba Campus I. e-mail: adelia.rodrigues@aluno.uepb.edu.br.
[2] Discentes do Curso de Medicina. Centro Universitário Facisa. e-mail: yngrid.queiroz@maisunifacisa.com.br; mariaclaraqueiroz001@gmail.com
3 Discente do Curso de Farmácia Generalista. Universidade Estadual da Paraíba. Campus I. e-mail: caroline.pereira@aluno.uepb.edu.br
4 Maria do Socorro Ramos de Queiroz. Universidade Estadual da Paraíba. Campus I. Doutora em Biotecnologia em Saúde (RENORBIO/UFPB). e-mail: queirozsocorroramos@servidor.uepb.edu.br dor.com.br
