TWO-STAGE HEPATECTOMY WITH SEGMENTAL PORTAL VEIN LIGATION FOR THE TREATMENT OF BIPOLAR HEPATIC ADENOMAS: A CASE REPORT
REGISTRO DOI: 10.69849/revistaft/ch10202501180838
João Marcos da Costa Oliveira
Coautores:
Antônio Alves Junior
Yan Thieris Santos Mesquita
Renê Pereira da Costa
William José Ferreira Leismann
Emiliano Nahuel Fantini
Evilyn Rachel Teixeira Barreto dos Anjos Oliveira
Orientador: Luis Cesar Bredt
RESUMO:
O adenoma hepatocelular (AHC) é uma neoplasia benigna rara do fígado, com risco de hemorragia e transformação maligna, classificada em subtipos moleculares distintos. Em casos de lesões extensas ou risco elevado de complicações, como em pacientes com doenças de armazenamento de glicogênio (DAG), a ressecção cirúrgica é indicada, sendo frequentemente necessária a hepatectomia em dois tempos para garantir a função hepática residual adequada. O relato descreve uma paciente de 23 anos com esteatose hepática severa e AHCs bilobares, associada à suspeita de DAG tipo I, que foi submetida a hepatectomia em dois tempos. Durante o primeiro tempo, foi realizada ressecção do segmento 3 e ligadura do ramo portal do setor posterior direito, promovendo a hipertrofia de áreas livres de lesão, como os segmentos 5 e porção ventral de 8. Após seis semanas, a hipertrofia foi suficiente para completar a ressecção. A abordagem utilizou a ligadura da veia portal (LVP) em vez da embolização da veia portal (EVP), estratégia que se mostrou eficaz para induzir a regeneração do fígado residual. A histologia pós-operatória confirmou AHC do subtipo inflamatório, com características típicas de DAG. Este caso ilustra a importância da abordagem multidisciplinar no tratamento de AHCs, especialmente em pacientes com comorbidades hepáticas, como a esteatose e doenças genéticas associadas, e destaca a viabilidade da hepatectomia em dois tempos com LVP para garantir a segurança do paciente e a preservação de função hepática.
PALAVRAS CHAVE: Adenoma Hepatocelular (AHC); Hepatectomia em dois tempos; Doença de Armazenamento de Glicogênio (DAG)
INTRODUÇÃO:
O adenoma hepatocelular (AHC) é uma neoplasia benigna incomum do fígado, caracterizada por duas complicações principais: hemorragia e potencial transformação maligna.¹ O AHC foi classificado em pelo menos oito subtipos com base na patologia molecular, cada um exibindo características histopatológicas únicas, considerações clínicas e risco de transformação maligna.8
Em geral, 15% a 20% dos pacientes portadores de AHC são tratados cirurgicamente, e habitualmente recomenda-se a ressecção de lesões que excedam 5 cm de diâmetro, lesões em homens, progressão da lesão durante a vigilância, lesões do subtipo β-catenina (exon 3) – ativado, AHCs sonic hedgehog–ativados, e AHCs associados à doenças de armazenamento do glicogênio (DAG).2-4
Embora na maioria dos casos as ressecções anatômicas ou segmentares sejam realizadas, a hepatectomia em dois estágios pode ser considerada quando os adenomas são extensos e o volume do futuro remanescente hepático (FRH) é inicialmente inadequado.5,6 Tanto a embolização da veia portal (EVP) como a ligadura da veia porta (LVP) podem ser realizadas para induzir a hipertrofia do FRH nestes casos de ressecções em dois tempos, sendo então ocluído o ramo portal direito ±o ramo para o segmento (S) 4, ou mais raramente o ramo esquerdo é ocluído. Especificamente nos casos de hepatectomia em dois tempos, a LVP pode ser vantajosa em relação à EVP, pois pode ser realizada durante o primeiro tempo da ressecção.[7,8]
Neste presente relato descrevemos uma paciente com suspeita clínica de DAG tipo I, portadora de esteatose hepática severa e AHCs extensos e bilobares. O paciente foi tratado com hepatectomia em dois tempos, sendo a LVP restrita ao ramo setorial posterior direito, possibilitando com esta estratégia inédita a hipertrofia adicional (além de S1, S2 e S4) das partes livres de lesão de S5 e porção ventral de S8, fundamentais para se atingir um volume de FRH adequado neste cenário de fígado esteatótico.
RELATO DO CASO
Paciente do sexo feminino, 23 anos com história de dor periumbilical associada ao aumento do volume abdominal sem icterícia e sintomas colestáticos e sem história de etilismo ou abuso de substâncias. Fazia uso de anticoncepcional oral há um ano, suspenso após o diagnóstico das lesões hepáticas. Apresentava história familiar de hepatomegalia, esteatose hepática e adenomas hepáticos em dois irmãos e duas irmãs, filhos da mesma mãe e do mesmo pai, todos de baixa estatura, dislipidemia e outras alterações fenotípicas compatíveis com doença de armazenamento de glicogênio (DAG) tipo 1, sendo que já estavam em acompanhamento com geneticista para investigação de síndrome genética familiar.
Ao exame físico apresentava-se hipocorada, anictérica, baixa estatura (1,45 cm e IMC 22,4 kg/m²) e “fáscies de boneca”. O abdome era globoso com fígado palpável à dez centímetros do rebordo costal direito. Os exames laboratoriais demonstravam anemia microcítica com componente carencial misto e dislipidemia. As dosagens séricas de aspartato alaninotransferase (ALT) e aspartato aminotransferase (AST) era de 56 e 68 U/L, respectivamente, com níveis de bilirrubinas dentro da normalidade. As dosagens séricas dos marcadores tumorais alfafetoproteína, antígeno carcino-embrionário (CEA) e Ca19-9 eram 2,0, 2,4 e 13,8 ng/mL respectivamente, estando dentro da normalidade.
A tomografia computadorizada de abdômen com contraste trifásico demonstrou fígado de dimensões aumentadas, contornos rombos e heterogêneo, sugerindo esteatose hepática severa, medindo 24 cm no seu maior diâmetro longitudinal, com múltiplos nódulos hepáticos hipodensos e com realce arterial precoce, progressivo, com tendência à homogeinização, sendo que duas lesões confluentes se localizavam em S3 (medindo 7,0 x 5,9 x 7,6 cm e 5,8 x 5,6 x 4,4 cm), uma em S5/6 (medindo 4,1 x 6,4 x 6,0 cm), uma em S7 (medindo 5,4 x 4,8 x 4,5 cm), e uma na porção dorsal de S8 (2,2 x 1,8 cm). As imagens foram compatíveis com adenomas hepáticos (figuras 1 A e B).Foi realizado a reconstrução 3D das imagens.
Após discussão multidisciplinar foi optado por ressecção cirúrgica devido risco de sangramento e/ou malignização. Foi realizado a volumetria hepática e cálculo da razão do FRH / volume total do fígado (VTF) x 100, não atingindo o mínimo seguro de 40% (figuras 1 C e D).
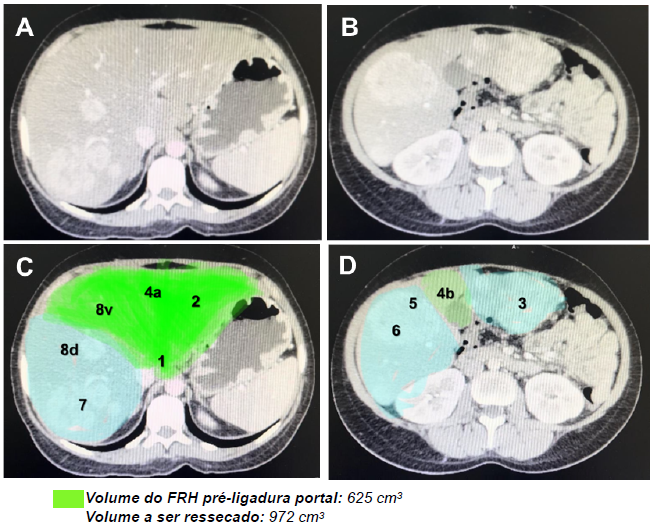

Figura 1. A e B. Tomografia axial computadorizada trifásica com diagnóstico dos adenomas; C e D. Volumetria hepática com detalhe dos segmentos hepáticos (FRH / VTF = 39,1%). FRH, futuro remanescente hepático; VTF, volume total do fígado.
Pela presença de doença extensa bilobar e com a volumetria hepática demonstrando FRH / VTF = 39,1%, foi então programado a realização do primeiro tempo com ressecção de S3 e ligadura do ramo portal do setor posterior direito, para hipertrofia de S1, S2, S4, e partes livres de lesão de S5 e porção ventral de S8 (figuras 2 A-D).

Figura 2. A. Reconstrução 3D demonstrando doença extensa bilobar; B. Detalhe intra-operatório da lesão em S3; C. Ilustração da ligadura portal do setor posterior direito; D. Ressecção de S3 e linha de isquemia após ligadura portal no primeiro tempo.
Paciente evoluiu sem intercorrências no período pós-operatório, recebendo alta hospitalar no sexto dia de internamento, com estabilidade clínica e laboratorial, retornando ao ambulatório no décimo quinto dia pósoperatório apenas com suplementação de ferro e vitamina B12.
Seis semanas após a data do primeiro tempo da hepatectomia foi realizado nova volumetria hepática com FRH ml / VTF ml = 54,6% (figura 3. A), sendo então programado a realização do segundo tempo da hepatectomia.. Oito semanas após o primeiro tempo a paciente foi submetida à setorectomia posterior direita com extensão para porção dorsal de S8 e porção lateral de S5 (figura 3. B).
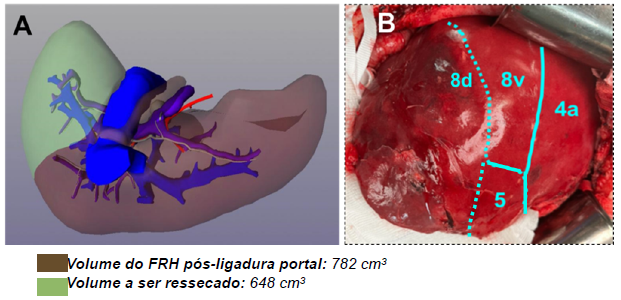
Figura 3. A. Reconstrução 3D após o primeiro tempo demonstrando a hipertrofia dos setores medial e anterior, e S2 (face diafragmática), (FRH / VTF = 54,6%); B. Detalhe intra-operatório da isquemia do setor posterior direito com hipertrofia dos setores medial e parte do anterior, e a linha de transecção hepática, incluindo a porção dorsal (d) de S8, porção lateral de S5, e todo setor posterior direito. FRH, futuro remanescente hepático; VTF, volume total do fígado.
O procedimento ocorreu sem intercorrências, e a paciente recebeu alta hospitalar no quinto dia pós-operatório. Os achados histológicos foram sugestivos de adenoma hepatocelular (múltiplos nódulos), sem atipias, padrão trabecular; infiltrado inflamatório misto, presença de esteatose macro e microgoticular acentuada e focos com degeneração, discreta colestase, discreto infiltrado inflamatório crônico periportal e áreas de expansão fibrosa portal, com margens de ressecção livres. O resultado do exame imunohistoquímico do espécime cirúrgico revelou adenoma hepático do tipo inflamatório com beta catenina 14 positivo apenas na membrana celular (WHO 2019) (figura 4).
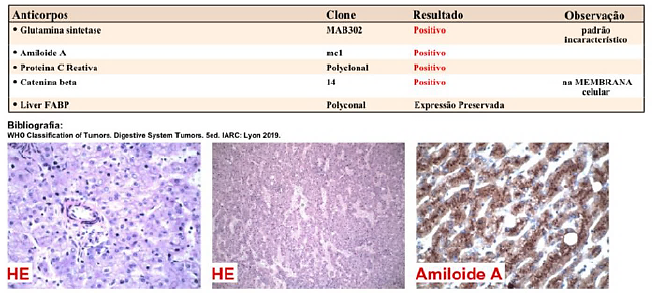
Figura 4. Perfil imunohistoquímico com: Glutamina Síntetase MAB302 positivo de padrão incaracterístico; Amiloide A mc1 positivo; Proteína C Reativa Polyclonal positivo; Catenina beta 14 positivo na membrana celular; Liver FABP Polyclonal expressão preservada.
DISCUSSÃO:
Estudos epidemiológicos realizados nos Estados Unidos e na Europa indicam que o AHC é mais comum em mulheres jovens e de meia-idade, com uma proporção de oito mulheres para cada homem afetado. Além da exposição ao estrogênio exógeno, outros fatores de risco incluem o uso de andrógenos, obesidade, doença hepática gordurosa, distúrbios vasculares hepáticos, e condições genéticas associadas ao desenvolvimento do AHC, que incluem DAG tipo I and III, diabetes juvenil tipo 3 (MODY3), e síndrome de McCune-Albriht .6, sendo DAG tipo 1 a suspeita clínica deste paciente relatado.²
O AHC subtipo inflamatório é encontrado em cerca de 40% a 50% dos casos e estão frequentemente associados à obesidade, estrogênio exógeno, síndrome metabólica e consumo de álcool, sendo também o subtipo mais frequente em pacientes portadores de DAG. Mutações genéticas relacionadas ao AHC inflamatório já são identificadas e incluem: gp130/IL6ST, FRK, STAT3, GNAS, e JAK1. A análise histopatológica do subtipo inflamatório revela infiltrado inflamatório, dilatação sinusoidal e vasos distróficos, com imunocoloração revelando a presença de proteína amilóide sérica e proteína C reativa. Assim como o AHC subtipo sonic hedgehog–ativado, essas lesões têm uma tendência maior de sangramento, apresentando sinusóides dilatados e artérias anormais, além de serem geralmente localizadas em áreas subcapsulares e com grande diâmetro.²
Embora a hepatectomia parcial em pacientes com DAG apresente maior morbidade em comparação à população geral, exatamente pela coexistência de dislipidemia, esteatose e outras comorbidades, a ressecção cirúrgica é a única medida eficaz para prevenir o desenvolvimento de carcinoma hepatocelular e sangramento,. 7 Na maioria dos casos a hepatectomia anatômica ou segmentar com margens deve ser realizada, devido ao potencial maligno destas lesões, contudo, uma hepatectomia em dois tempos pode ser indicada quando os adenomas são extensos e o FLR é inicialmente inadequado, sendo que o transplante hepático pode ser considerado de acordo com a severidade das lesões.
As ressecções hepáticas em dois tempos são descritas com maior ênfase em doentes com lesões malignas do fígado, principalmente metástases de tumores colorretais. Seguindo então as indicações desta abordagem, a estratégia neste paciente foi a realização da hepatectomia em dois tempos com a segunda operação potencialmente curativa e segura, com parênquima funcional suficiente para prevenir insuficiência hepática pós-operatória. 5-7, que na presença de hepatopatia crônica, como na esteatose, se recomenda a razão do FRH / VTF ≥ 40%.
A EVP, a deprivação venosa hepática (DVH), e a LVP associada ou não à partição do parênquima hepático [ALPPS (Associating Liver Partition and Portal vein Ligation for Staged hepatectomy)] são estratégias usadas para induzir a hipertrofia do FLR, e apesar de seus objetivos semelhantes, eles diferem em técnica, eficácia e impacto fisiológico.9-14 A EVP envolve a oclusão percutânea dos ramos das veias porta utilizando agentes embólicos, o que leva a um redirecionamento do fluxo sanguíneo para os segmentos hepáticos não embolizados, promovendo a hipertrofia. Essencialmente é ocluído o ramo portal direito ±ramo paraS4 para ressecções alargadas à direita, e mais raramente o ramo esquerdo é ocluído para ressecções à esquerda. Existem evidências que a EVP alcança uma oclusão mais eficaz e durável dos ramos portais, resultando em maior hipertrofia do FRH em comparação com à LVP, com uma menor permanência hospitalar pós-procedimento.[10] A DVH consiste na associação da EVP com embolização das veias hepáticas, promovendo um adicional de hipertrofia do FRH.11
A LVP, por outro lado, é um procedimento cirúrgico onde os ramos das veias porta são ligadas por laparotomia ou laparoscopia. A hipótese para a resposta regenerativa inferior em comparação à EVP seria a formação de colaterais entre o parênquima com ramos portais ocluídos e não ocluídas durante a LVP.[11-12] No entanto, a LVP é um método acessível e passível de ser realizada no primeiro tempo da hepatectomia em dois tempos, o que pode ser vantajoso em certos cenários clínicos.[14-16], e foi a estratégia adotada em nosso caso, já é descrita a fast-track two-stage hepatectomy, método que combina a EVP + primeiro tempo da hepatectomia simultaneamente em sala cirúrgica adaptada.17,18
Neste presente relato descrevemos uma paciente com suspeita clínica de DAG tipo I, portadora de esteatose hepática severa e AHCs extensos e bilobares. O paciente foi tratado com hepatectomia em dois tempos, sendo a LVP restrita ao ramo setorial posterior direito, possibilitando com esta estratégia inédita a hipertrofia adicional (além de S1, S2 e S4) das partes livres de lesão de S5 e porção ventral de S8, fundamentais para se atingir um volume de FRH adequado (>40%) neste cenário de fígado esteatótico.
O tratamento cirúrgico de adenomas hepáticos deve ser discutido em um ambiente multidisciplinar, considerando a saúde geral do paciente, a extensão do envolvimento hepático, potenciais riscos e benefícios do procedimento.
REFERÊNCIAS:
1 – SZOR, D. J.; URSOLINE, M.; HERMAN, P. Adenoma hepático. ABCD, Arquivos Brasileiros de Cirurgia Digestiva[Internet], v. 26, n. 3, p. 219–222, jul. 2013. Disponível em: https://doi.org/10.1590/S0102-67202013000300012. Acesso em: 15 jan.2025.
2 – WANG, X.; ZHANG, X. Hepatocellular adenoma: Where are we now? World Journal of Gastroenterology, v. 28, n. 14, p. 1384-1393, 14 abr. 2022. DOI: 10.3748/wjg.v28.i14.1384.
3 – AZIZ, H. et al. A Scoping Review of the Classification, Diagnosis, and Managemen of Hepatic Adenomas. Journal of Gastrointestinal Surgery, v. 26, n. 4, p. 965–978, abr.2022.
4 – AZIZ, H. et al. Hepatic adenoma: evolution of a more individualized treatment approach. Journal of Gastrointestinal Surgery, v. 28, n. 6, p. 975-982, jun. 2024.
5 – ADAM, R.; LAURENT, A.; AZOULAY, D.; CASTAING, D.; BISMUTH, H. Two-stage hepatectomy: A planned strategy to treat irresectable liver tumors. Annals of Surgery, v. 232, n. 6, p. 777-785, 2000.
6 – TOGO, S. et al. Two-stage hepatectomy for multiple bilobular liver metastases from colorectal cancer. Hepatogastroenterology, v. 52, n. 63, p. 913-919, mai.-jun. 2005.
7 – MYERS, L.; AHN, J. Focal Nodular Hyperplasia and Hepatic Adenoma: Evaluation and Management. Clinics in Liver Disease, v. 24, n. 3, p. 389–403, 2020. DOI: 10.1016/j.cld.2020.04.013.
8 – CAMPOS AMICO, E. et al. Should focal nodular hyperplasia still be operated upon?Analysis of a case series. Digestive Diseases, v. 37, p. 309-314, 2019.
9 – ISFORDINK, C. J. et al. Portal vein ligation versus embolization for induction of hypertrophy of the future liver remnant: uma revisão sistemática e meta-análise. Oncologia Cirúrgica, v. 26, n. 3, p. 257–267, 2017. DOI: 10.1016/j.suronc.2017.05.001.
10 – WILMS, C. et al. Comparative study of portal vein embolization versus portal vein ligation for induction of hypertrophy of the future liver remnant using a mini-pig model. Annals of Surgery, v. 247, n. 5, p. 825-834, 2008. DOI: 10.1097/SLA.0b013e31816a9d7c.
11 – GUIU, B. et al. Liver venous deprivation: a bright future for liver metastases—but what about hepatocellular carcinoma? Hepatobiliary Surgery and Nutrition, v. 10, n. 2, p. 270-272, abr. 2021. DOI: 10.21037/hbsn-21-7.
12- BROERING, D. C. et al. Portal vein embolization vs. portal vein ligation for induction of hypertrophy of the future liver remnant. Journal of Gastrointestinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract, v. 6, n. 6, p 905-913, nov.-dez. 2002. DOI: 10.1016/s1091-255x(02)00122-1.
13 – ISFORDINK, C. J. et al. Portal vein ligation versus portal vein embolization for induction of hypertrophy of the future liver remnant: a systematic review and meta-analysis. Surgical Oncology, v. 26, n. 3, p. 257–267, 2017. DOI: 10.1016/j.suronc.2017.05.001.
14 – RUIZ, Á. J. G. et al. Associating liver partition and portal vein ligation for staged hepatectomy tourniquet as a resource for hepatic transplant in patient with hepatic adenomatosis: a case report. Transplantation Proceedings, v. 52, n. 2, p. 594-595, 2020. DOI: 10.1016/j.transproceed.2019.11.036.
15 – HABERMAN, D. M. et al. Role of CT in two-stage liver surgery. Radiographics: A Review Publication of the Radiological Society of North America, Inc., v. 42, n. 1, p. 106–124, jan.-fev. 2022. DOI: 10.1148/rg.210067.
16 – ESHMUMINOV, D. et al. Outcomes of staged hepatectomies for liver metastases: A meta-analysis of associating liver partition with portal vein ligation and portal vein occlusion for two-stage hepatectomy. The British Journal of Surgery, v. 103, n. 13, p. 1768-1782, 2016. DOI: 10.1002/bjs.10290.
17 – SHINDOH, J. et al. Optimal future liver remnant in patients treated with extensive preoperative chemotherapy for colorectal liver metastases. Annals of Surgical Oncology, v. 20, n. 8, 2013. DOI: 10.1245/s10434-012-2864-7.
18 – KAWAGUCHI, Y. et al. Dealing with an insufficient future liver remnant: PVE an two-stage hepatectomy. Surgical Oncology, v. 119, n. 5, p. 594-603, abr. 2019. DOI: 10.1002/jso.25430.
