PHYSIOPATHOLOGY OF MICROVARICES: GENETIC ASPECTS
REGISTRO DOI: 10.69849/revistaft/th102411161150
Joelma Lino Lacerda da Silva[1]
Marcia Geronima da Silva[2]
Rafael Perseghini Del Sarto[3]
Resumo
Milhares de pessoas no mundo são afetadas pela presença de microvarizes, principalmente nos membros inferiores. Existem diferentes fatores associados à formação dessas microvarizes, e um desses fatores são os aspectos genéticos. Partindo do entendimento de que a hereditariedade e as predisposições genéticas são fatores associados ao surgimento dessa condição, o objetivo dessa pesquisa foi analisar as predisposições genéticas que contribuem para o desenvolvimento de microvarizes, com foco nas mutações e variantes genéticas relacionadas à disfunção venosa. Foi utilizada como metodologia a pesquisa bibliográfica, que possibilitou a coleta de dados em estudos semelhantes ao tema e já publicados. Logo, concluiu-se que alterações em genes levam à perda da elasticidade e da resistência venosa, tornando as veias mais propensas à formação de microvarizes. O fator hereditário se revela um marcador importante para avaliar o risco de desenvolvimento de microvarizes em indivíduos com histórico familiar de doenças venosas. Ainda, a identificação de mutações genéticas associadas à disfunção venosa proporciona uma compreensão mais ampla sobre o desenvolvimento de microvarizes e oferece bases para futuras estratégias de tratamento.
Palavras-chave: Microvarizes. Genética. Hereditariedade. Disfunção venosa.
1 INTRODUÇÃO
As microvarizes, caracterizadas por pequenas veias dilatadas próximas à superfície da pele, são uma condição comum que afeta pessoas em todo o mundo. Estima-se que cerca de 30% da população mundial, ou seja, aproximadamente 2,4 bilhões de pessoas, sofra dessa condição. Embora frequentemente consideradas uma questão estética, sua presença pode indicar disfunções subjacentes no sistema venoso, refletindo alterações mais profundas na estrutura e na função das veias (Rocha et al., 2020).
A prevalência mundial de microvarizes em membros inferiores (MMII) é de cerca de 73% na população feminina e cerca de 56% na população masculina. Já no Brasil, os dados indicam que a prevalência chega a um valor aproximado de 62,79% nas mulheres e a 37,9% nos homens (Lins et al., 2012). Rocha et al. (2020), ao analisarem a população brasileira na faixa etária entre 30 e 40 anos, identificam que cerca de 3% dos homens apresentam microvarizes, enquanto 20% das mulheres têm essa condição. Na população brasileira geral acima de 70 anos de idade, estima-se a presença das microvarizes em 70%.
É importante compreender que existem diferentes fatores associados à formação das microvarizes, como os fatores clínicos, etiológicos, anatômicos e fisiopatológicos. Ainda, essa condição pode ser influenciada por aspectos genéticos, hormonais e metabólicos. A idade, a obesidade ou presença de sobrepeso, a ocorrência de ortostatismo prolongado durante a atividade laboral, ou seja, ficar em pé por um período longo de tempo, podem levar ao aparecimento de varizes nos MMII (Lins et al., 2012).
Medeiros et al. (2014) realizaram um estudo com 50 indivíduos portadores de varizes e observaram que 46% destes tinham antecedentes familiares de varizes e úlceras venosas. As microvarizes que aparecem influenciadas pela tendência hereditária são as chamadas varizes primárias, enquanto as que aparecem em consequência de doenças adquiridas no decorrer da vida são as secundárias, cujo tratamento é mais complexo (Santos et al., 2020). Considerando a hereditariedade e as predisposições genéticas como fatores associados ao surgimento dessa condição, esta pesquisa tem como foco alcançar a resposta para a seguinte pergunta: Quais mutações genéticas e variantes hereditárias estão associadas à disfunção venosa que leva ao desenvolvimento de microvarizes?
Esse estudo é desenvolvido com o objetivo de analisar as predisposições genéticas que contribuem para o desenvolvimento de microvarizes, com foco nas mutações e variantes genéticas relacionadas à disfunção venosa. Para tal, busca-se identificar as mutações genéticas mais comuns associadas à disfunção venosa em pacientes com microvarizes; examinar as variantes genéticas hereditárias que aumentam a predisposição ao desenvolvimento de microvarizes; e investigar a relação entre a presença de mutações em genes responsáveis pela integridade da parede venosa e o surgimento de microvarizes.
Esta é uma pesquisa de importante relevância, pois o papel das predisposições genéticas e hereditárias na formação das microvarizes ainda é um estudo que carece de maior exploração. Logo, esse é um estudo que se justifica pela necessidade de aprofundar o conhecimento sobre os mecanismos genéticos que influenciam o surgimento das microvarizes. Espera-se, com esta pesquisa, disseminar informações relacionadas aos aspectos genéticos associados às microvarizes.
2 METODOLOGIA
Foi realizada uma pesquisa bibliográfica, por meio da qual puderam ser selecionados estudos que promoveram o embasamento deste texto. A pesquisa foi realizada a partir de 5 bases de dados, nas quais há uma ampla publicação de estudos da área da saúde, que são: Pubmed, Lilacs, Embase, Scielo e o Portal de periódicos da Capes. Dentro dessas bases de dados, a pesquisa foi feita tendo como ponto de partida o uso das seguintes palavras-chave: microvarizes, genética, hereditariedade e dilatação da veia. Em alguns casos, foi feita uma combinação de palavras-chave para a busca de estudos.
Para garantir a relevância e a qualidade dos estudos analisados, foram selecionados artigos que abordam especificamente a relação entre mutações genéticas, variantes hereditárias e disfunção venosa associada ao desenvolvimento de microvarizes. A triagem foi realizada com base nos títulos e resumos, priorizando estudos que apresentassem dados sobre a fisiopatologia genética das microvarizes, publicados em revistas científicas revisadas por pares. No total, 159 estudos foram localizados.
Para refinar a seleção dos estudos, foram aplicados critérios de inclusão que garantissem a relevância e atualidade das pesquisas analisadas. Foram considerados apenas artigos publicados a partir de 2010, nos idiomas português e inglês. Além disso, foram incluídos apenas estudos que abordassem especificamente casos de microvarizes, com ênfase nos aspectos genéticos relacionados à disfunção venosa. Esse processo de filtragem visou garantir que os artigos selecionados estivessem alinhados com o foco da pesquisa e trouxessem contribuições significativas ao tema. Alguns estudos traziam dados muito amplos ou com pouca semelhança ao presente tema, por isso foram excluídos. Ao final, 16 estudos foram selecionados para o embasamento da pesquisa.
3 RESULTADOS E DISCUSSÕES
3.1 Mutações genéticas associadas à disfunção venosa
Existem mutações genéticas que estão associadas à disfunção venosa, contribuindo para o desenvolvimento de microvarizes. Essas mutações afetam principalmente genes responsáveis pela manutenção da integridade estrutural da parede venosa, o equilíbrio da matriz extracelular e a função de componentes celulares que garantem a elasticidade e resistência dos vasos (Fukaya et al., 2018).
O gene COL1A1 (Colágeno tipo I alfa 1), por exemplo, codifica uma das principais proteínas estruturais presentes na matriz extracelular das veias. Mutações neste gene estão associadas à produção deficiente de colágeno tipo I, um componente essencial para a integridade estrutural das paredes venosas. A deficiência na formação dessa proteína pode resultar em fraqueza da parede venosa, tornando as veias mais propensas à dilatação, condição frequentemente associada ao desenvolvimento de microvarizes. A variante mais comum desse gene, segundo dados do National Center for Biotechnology Information (NCBI, 2024), é a mutação rs1800012, que afeta a síntese e organização das fibras colágenas (Duong et al., 2020). Há também o gene COL3A1 (Colágeno tipo III alfa 1), que desempenha um papel crucial na estrutura da matriz extracelular. Mutações neste gene, como a mutação rs1800255, podem levar à redução na produção de colágeno tipo III, que é importante para a elasticidade e flexibilidade dos vasos sanguíneos. Pacientes com mutações no COL3A1 têm maior predisposição a distúrbios de colágeno que afetam diretamente a capacidade das veias de suportar a pressão sanguínea, resultando em microvarizes (Kuivaniemi; Tromp, 2020; NCBI, 2024).
Ainda, um gene que está envolvido na regulação da remodelação da matriz extracelular, bem como na proliferação das células do músculo liso venoso, é o TGFBR2 (Receptor beta do fator de crescimento transformador). Existem mutações associadas a esse gene que podem levar à disfunção na sinalização do fator de crescimento transformador beta (TGF-β), como a mutação rs2228048, e isso resulta em alterações na regulação do colágeno e outras proteínas estruturais das veias. Essas alterações aumentam a fragilidade da parede venosa e, também, predispõem o surgimento de microvarizes (Peres et al., 2021; NCBI, 2024).
O gene FOXC2 (Forkhead box C2) está intimamente relacionado ao desenvolvimento do sistema linfático e à morfologia das veias. Mutações no FOXC2, como a mutação rs34221221 (polimorfismo), são associadas à disfunção no desenvolvimento venoso e linfático, levando a uma má regulação da pressão venosa e ao acúmulo de fluido, fatores que contribuem diretamente para o desenvolvimento de microvarizes (Tavian et al., 2020). A mutação rs34221221 causa uma substituição de uma citosina por uma timina na posição -512, isto é, a substituição de citosina por uma timina localizada a 512 pares de bases antes do início da tradução do gene FOXC2. Pacientes com essas mutações frequentemente exibem uma maior predisposição genética para doenças venosas crônicas (Ribeiro, 2016; NCBI, 2024).
Destaca-se, ainda, o gene MTHFR (Metileno tetrahidrofolato redutase), que codifica uma enzima crucial no metabolismo do ácido fólico e na metilação do DNA. Quando ocorrem mutações nesse gene, por exemplo a mutação rs1801133, há uma predisposição aumentada a problemas circulatórios, incluindo disfunção venosa. A deficiência de metilação pode interferir na reparação do endotélio venoso, resultando em uma fragilidade vascular que, da mesma forma que os genes anteriormente apontados, contribui para o surgimento de microvarizes (Shaker et al., 2016; NCBI, 2024). Cada gene apresentado, bem como suas principais mutações, efeitos e consequências clínicas, encontram-se expostos na tabela 1.
Tabela 1. Principais mutações relacionadas à disfunção venosa
Gene Principais mutações Função do gene Efeitos das mutações Consequências clínicas COL1A1 rs1800012 Codifica colágeno tipo I Redução na síntese de colágeno tipo I Fraqueza estrutural da parede venosa COL3A1 rs1800255 Codifica colágeno tipo III Diminuição na produção de colágeno tipo III Perda de elasticidade e resistência venosa TGFBR2 rs2228048 Regulação da remodelação da matriz extracelular Disfunção na sinalização TGF-β Fragilidade da parede venosa FOXC2 rs34221221 Desenvolvimento venoso e linfático Disfunção no desenvolvimento venoso e linfático Predisposição a varizes e edema linfático MTHFR rs1801133 Metabolismo do ácido fólico e metilação do DNA Deficiência de metilação e reparação endotelial Fragilidade vascular e predisposição a microvarizes
Fonte: Dados da pesquisa (2024).
As mutações nos genes COL1A1, COL3A1, TGFBR2, FOXC2 e MTHFR desempenham um papel crucial na disfunção venosa associada ao desenvolvimento de microvarizes. Essas mutações afetam diretamente a produção de colágeno, a regulação da matriz extracelular e a integridade estrutural das paredes venosas, resultando em maior fragilidade e suscetibilidade à dilatação venosa. O conhecimento dessas alterações genéticas permite uma compreensão mais aprofundada dos mecanismos fisiopatológicos subjacentes às microvarizes e pode auxiliar no desenvolvimento de abordagens terapêuticas mais direcionadas para pacientes com predisposição genética a essa condição (Fukaya et al., 2018).
3.2 Variantes genéticas hereditárias
Algumas variantes hereditárias aumentam significativamente a predisposição ao desenvolvimento de microvarizes e outras condições venosas. Essas variantes são frequentemente transmitidas de forma autossômica dominante, o que explica a prevalência de doenças venosas em certas famílias e grupos populacionais. As variantes genéticas hereditárias estão, em grande parte, associadas a genes que regulam a estrutura da matriz extracelular, a função do endotélio e o fluxo venoso adequado (Fukaya et al., 2018).
Ressalta-se que um dos genes mais associados à hereditariedade de doenças venosas é o FOXC2, pois mutações e variantes associadas a esse gene, como a rs34221221, são comumente associadas à disfunção venosa crônica, incluindo o desenvolvimento de microvarizes (Serra et al., 2012; NCBI, 2024). Segundo Tavianet al. (2020), os portadores dessa variante apresentam uma alteração no desenvolvimento das válvulas venosas, resultando em insuficiência venosa e acúmulo de pressão nas paredes dos vasos sanguíneos. Os autores observam que os grupos familiares com histórico de varizes severas apresentam uma alta prevalência de variantes no FOXC2, e isso confirma a forte associação hereditária.
Há, também, como apontam Amaro et al. (2017) e o portal NCBI (2024), o gene VEGF (Vascular Endothelial Growth Factor ou fator de crescimento endotelial vascular), que regula a angiogênese e a formação de novos vasos sanguíneos e tem como uma de suas variantes hereditárias a variante rs3025039. Essa variante tem sido associada a uma predisposição aumentada ao desenvolvimento de varizes e microvarizes. Quando analisado o gene VEGF, caso a função do gene seja comprometida devido a suas variantes hereditárias, observa-se um resultado de vascularização deficiente e problemas com o remodelamento venoso. Deve ser ressaltado que a presença da variante rs3025039 é mais comum em pacientes com histórico familiar de varizes, reforçando a natureza genética dessa condição.
Já o MTHFR apresenta, além das mutações que afetam diretamente a parede venosa, variantes genéticas hereditárias que aumentam a predisposição a microvarizes. A variante rs1801131, uma das mais estudadas no contexto de doenças venosas como já observado, afeta a circulação sanguínea e está ligada à predisposição genética em famílias com disfunção venosa hereditária. Estudos populacionais demonstram que essa variante é mais prevalente em indivíduos de ascendência europeia e pode ser transmitida de geração em geração com elevada frequência em grupos familiares (Shaker et al., 2016).
Enquanto isso, o gene COL5A1, responsável pela produção de colágeno tipo V, também está associado a uma maior prevalência de varizes e microvarizes em indivíduos com variantes hereditárias, e sua variante rs12722 afeta a síntese de colágeno tipo V, resultando em uma menor integridade das paredes venosas e predispondo os indivíduos ao enfraquecimento estrutural das veias (Calò et al., 2024; NCBI, 2024).
Certas populações possuem maior incidência de variantes hereditárias associadas a doenças venosas. As populações europeias e do Oriente Médio, por exemplo, apresentam alta prevalência de variantes no FOXC2 e MTHFR (Tavian et al., 2020). Além disso, em grupos familiares com histórico de doenças venosas crônicas, como em famílias de ascendência europeia, há uma maior incidência de variantes nos genes relacionados à matriz extracelular e remodelação vascular, sugerindo um forte componente hereditário. A transmissão autossômica dominante dessas variantes faz com que a predisposição ao desenvolvimento de microvarizes e varizes em geral seja significativamente elevada em certas famílias.
Tabela 2. Principais variantes genéticas hereditárias relacionadas ao desenvolvimento de microvarizes
Gene Principais variantes Função do gene Efeitos das variantes Prevalência em grupos populacionais FOXC2 rs34221221 Regulação do desenvolvimento venoso Disfunção no desenvolvimento de válvulas venosas Alta prevalência em famílias com histórico de varizes VEGF rs3025039 Angiogênese e formação de novos vasos Vascularização deficiente e remodelamento venoso prejudicado Populações com histórico familiar de varizes MTHFR rs1801131 Metabolismo do ácido fólico e circulação sanguínea Predisposição genética a disfunção venosa hereditária Mais comum em populações europeias COL5A1 rs12722 Produção de colágeno tipo V Redução da integridade das paredes venosas Altamente prevalente em famílias com doenças venosas crônicas
Fonte: Dados da pesquisa (2024).
De fato, as variantes genéticas hereditárias nos genes FOXC2, VEGF, MTHFR e COL5A1 desempenham um papel significativo no aumento da predisposição ao desenvolvimento de microvarizes. Essas variantes afetam diretamente a estrutura e a função das paredes venosas, resultando em fraqueza estrutural e insuficiência venosa. A alta prevalência dessas variantes em certos grupos familiares e populações reforça a hipótese de que a hereditariedade é um fator crucial no desenvolvimento de microvarizes, especialmente em pacientes com histórico familiar de doenças venosas crônicas (Tavian et al., 2020).
3.3 Relação entre mutações e integridade da parede venosa
A integridade estrutural da parede venosa é crucial para a manutenção de um fluxo sanguíneo adequado e para prevenir o desenvolvimento de disfunções venosas, como varizes e microvarizes. Mutações genéticas em genes que regulam a composição e a função do tecido venoso podem causar alterações estruturais significativas, resultando na perda de elasticidade e resistência da parede venosa. Essas mutações afetam componentes chave, como colágeno, elastina e a matriz extracelular, que desempenham papéis fundamentais na homeostase venosa (Fukaya et al., 2018).
O colágeno é uma das principais proteínas estruturais responsáveis pela integridade e resistência da parede venosa. As mutações nos genes que codificam diferentes tipos de colágeno, como COL1A1 e COL3A1, estão diretamente relacionadas à fragilidade e degradação da matriz extracelular. As mutações no gene COL1A1, que codifica o colágeno tipo I, afetam a rigidez e a resistência à tração das paredes venosas. A deficiência na síntese de colágeno tipo I leva à fragilidade das veias, predispondo os vasos à dilatação e formação de varizes. Estudos mostram que a mutação rs1800012 no COL1A1 está associada a uma menor integridade da parede venosa e aumento do risco de insuficiência venosa crônica, que inclui a formação de microvarizes (Duong et al., 2020; NCBI, 2024).
Já o colágeno tipo III, codificado pelo gene COL3A1, contribui para a elasticidade e flexibilidade das paredes vasculares. Mutações no COL3A1, como rs1800255, resultam em uma síntese defeituosa de colágeno tipo III, o que compromete a integridade venosa. Pacientes com essas mutações apresentam maior predisposição a rupturas capilares, enfraquecimento venoso e dilatação progressiva dos vasos, levando ao aparecimento de microvarizes (Kuivaniemi; Tromp, 2020).
Segundo Peres et al. (2021), o gene TGFBR2 é capaz de regular a remodelação da matriz extracelular e a integridade dos tecidos vasculares através da sinalização do TGF-β. Sendo assim, mutações como a variante rs4522809, interferem na regulação adequada da proliferação e diferenciação das células endoteliais e da musculatura lisa venosa, impactando diretamente o processo de remodelação dos vasos. Essas mutações reduzem a capacidade das paredes venosas de se adaptarem ao estresse mecânico, o que resulta na degeneração progressiva do tecido venoso e na formação de varizes).
Outro componente essencial da matriz extracelular e que proporciona elasticidade às veias, é a elastina, codificada pelo gene ELN. Mutações nesse gene, por exemplo a rs2071307, estão associadas a uma elasticidade reduzida da parede venosa, tornando os vasos mais suscetíveis à dilatação sob pressão constante do fluxo sanguíneo. É importante compreender que a redução na elasticidade devido a defeitos na elastina leva a uma capacidade limitada das veias de retornarem à sua forma original após serem esticadas, o que resulta na deformação permanente das paredes venosas, aumentando o risco de microvarizes e insuficiência venosa. Essa mutação é frequentemente identificada em famílias com alta prevalência de varizes (Lasio; Kozel, 2018; NCBI, 2024).
Há, ainda, um gene cuja mutação codifica uma enzima que degrada o colágeno e outros componentes da matriz extracelular, trata-se do gene MMP9 (Metaloproteinase de Matriz 9). Uma mutação comum desse gene é a variante rs3918242, que resulta em uma atividade aumentada da metaloproteinase, levando a uma degradação acelerada do colágeno nas paredes venosas. Como apontam Ghersel et al. (2019), essa degradação excessiva compromete a estabilidade estrutural da parede venosa e promove a dilatação dos vasos, contribuindo diretamente para a formação de varizes e microvarizes. Pacientes com mutações no MMP9 demonstram maior tendência ao enfraquecimento da parede venosa.
Cada uma dessas mutações influencia fatores como resistência à tração, elasticidade venosa, capacidade de remodelação e degradação da matriz extracelular, conforme exposto no gráfico que se segue.
Gráfico 1. Impacto das mutações genéticas na integridade da parede venosa
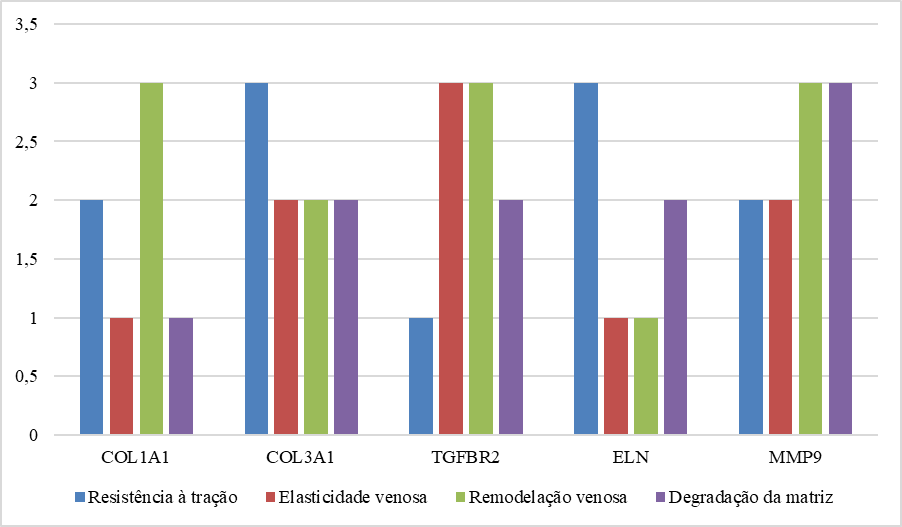
Fonte: Elaborado pelas autoras (2024), a partir de dados da pesquisa.
Dessa forma, as mutações genéticas nos genes apresentados comprometem a integridade estrutural da parede venosa, resultando em alterações significativas, como redução da elasticidade, resistência e capacidade de remodelação. Essas mutações, ao afetarem componentes essenciais da matriz extracelular e da parede venosa, tornam as veias mais vulneráveis à dilatação, contribuindo diretamente para o desenvolvimento de microvarizes e insuficiência venosa crônica (Fukaya et al., 2018).
3.4 Análise dos dados
De acordo com os dados obtidos, observa-se que a fisiopatologia das microvarizes envolve uma série de mutações genéticas que, ao interferirem na estrutura e função da parede venosa, promovem uma predisposição à disfunção venosa. Estudos como os de Fukaya et al. (2018) e Duong et al. (2020) destacam o papel das mutações nos genes COL1A1 e COL3A1 na integridade da matriz extracelular venosa. Essas mutações resultam em uma produção deficiente de colágeno tipos I e III, elementos essenciais para a resistência e elasticidade das veias. Especificamente, a mutação rs1800012 em COL1A1 e a rs1800255 em COL3A1 são apontadas por esses autores como promotoras de uma menor síntese e organização das fibras colágenas, o que compromete a sustentação das paredes venosas e torna os vasos mais suscetíveis ao desenvolvimento de microvarizes. Tavian et al. (2020) reforçam essa análise ao indicarem que tais mutações impactam a regulação da pressão e elasticidade vascular, o que é essencial para a manutenção da saúde venosa.
Complementando o papel do colágeno na integridade venosa, Peres et al. (2021) descrevem a importância do gene TGFBR2, envolvido na sinalização do fator de crescimento transformador beta (TGF-β), um modulador crucial da remodelação da matriz extracelular. As mutações no TGFBR2, como a rs2228048, podem levar a uma disfunção na sinalização de TGF-β, dificultando a regulação adequada da produção de colágeno e de outras proteínas estruturais. Isso converge com a proposta de Duong et al. (2020) sobre a interdependência entre os sistemas de produção de colágeno e outros fatores de remodelação. A literatura sugere uma sinergia entre os efeitos das mutações em TGFBR2 e nos genes de colágeno (COL1A1 e COL3A1), pois ambas as alterações contribuem para uma matriz extracelular mais frágil e para a vulnerabilidade das veias ao acúmulo de pressão e dilatação.
Outro gene que desempenha um papel significativo na integridade estrutural da parede venosa é o FOXC2, conforme discutido por Tavian et al. (2020) e Serra et al. (2012). Essas pesquisas indicam que a variante rs34221221 em FOXC2 pode estar ligada a uma disfunção no desenvolvimento de válvulas venosas e linfáticas, essencial para a regulação da pressão venosa. Amaro et al. (2017) e Serra et al. (2012) acrescentam que essa mutação, ao afetar a morfologia e função das veias, contribui diretamente para a ocorrência de microvarizes. Concordando com essas observações, Shaker et al. (2016) aponta o papel de variantes hereditárias no gene MTHFR, que, ao impactarem a metilação do DNA e o metabolismo do ácido fólico, aumentam a predisposição à disfunção venosa. Assim, a literatura converge no entendimento de que tanto FOXC2 quanto MTHFR estão associados a predisposições genéticas que aumentam a suscetibilidade de certos indivíduos ao desenvolvimento de microvarizes, particularmente aqueles com histórico familiar de insuficiência venosa crônica.
No que diz respeito à elasticidade das veias, Fukaya et al. (2018) ressaltam a importância do gene ELN, que codifica a elastina, uma proteína essencial para a flexibilidade venosa. A mutação rs2071307 no gene ELN resulta em uma menor elasticidade da parede venosa, aumentando a suscetibilidade à dilatação sob pressões constantes do fluxo sanguíneo. Lasio e Kozel (2018) corroboram esses dados, sugerindo que a elasticidade reduzida é um fator crítico na fisiopatologia das microvarizes, visto que a falta de resistência elástica nas paredes venosas predispõe os vasos ao desenvolvimento de dilatações venosas. Esse mecanismo é complementado pela ação das metaloproteinases, em especial a MMP9, que, segundo Ghersel et al. (2019), possui variantes como a rs3918242 associadas a uma atividade aumentada de degradação do colágeno. Essa degradação excessiva, promovida pela metaloproteinase MMP9, fragiliza ainda mais a estrutura venosa, tornando as veias propensas a disfunções como o surgimento de microvarizes.
Considerando a influência da angiogênese, Amaro et al. (2017) identificam o gene VEGF como um regulador fundamental da formação de novos vasos sanguíneos, sendo a variante rs3025039 associada à formação de microvarizes. Este aspecto da angiogênese revela uma via distinta para a predisposição à disfunção venosa, destacando que além das mutações que afetam a estrutura da matriz extracelular, alterações na formação de vasos também desempenham um papel importante. Dessa forma, VEGF e MMP9 contribuem para uma compreensão mais abrangente sobre os mecanismos de fragilidade estrutural e disfunção na microcirculação venosa, promovendo um ambiente favorável ao desenvolvimento de microvarizes.
De forma geral, os dados obtidos fornecem uma compreensão robusta das predisposições genéticas que influenciam o desenvolvimento de microvarizes. As mutações em genes como COL1A1, COL3A1, TGFBR2, FOXC2, MTHFR, e ELN estão todas associadas a mecanismos específicos de disfunção venosa, incluindo a produção inadequada de colágeno, alterações na sinalização do TGF-β, redução da elasticidade venosa e uma maior propensão à degradação da matriz extracelular. A literatura consultada, portanto, apoia a hipótese de que fatores hereditários são determinantes no desenvolvimento de microvarizes, oferecendo evidências que fortalecem a relevância dos genes envolvidos no metabolismo do colágeno e na regulação da pressão venosa.
Esses achados são relevantes, pois permitem a identificação de variantes genéticas que poderiam, futuramente, orientar estratégias de triagem e prevenção para indivíduos com alta predisposição genética a disfunções venosas. Além disso, a análise das interações entre genes estruturais e reguladores da matriz extracelular proporciona uma base para novas pesquisas que visem intervenções terapêuticas direcionadas, capazes de minimizar a progressão da insuficiência venosa crônica.
4 CONCLUSÃO/CONSIDERAÇÕES FINAIS
Por meio deste estudo, foi possível observar que fatores genéticos desempenham um papel significativo na predisposição e desenvolvimento das microvarizes. As mutações em genes estruturais e reguladores, que impactam diretamente a integridade e a funcionalidade da parede venosa, evidenciam a complexidade fisiopatológica subjacente a essas condições venosas. Foi possível identificar que alterações em genes, como os que codificam o colágeno e a elastina, bem como mutações que afetam a matriz extracelular, levam à perda da elasticidade e da resistência venosa, tornando as veias mais propensas à formação de microvarizes.
Ainda, a análise dos genes que regulam a remodelação da matriz extracelular e a proliferação das células musculares lisas das veias reforça a ideia de que a disfunção venosa envolve não apenas fatores estruturais, mas também reguladores. Esses processos afetam a capacidade das veias de se adaptarem às demandas fisiológicas do fluxo sanguíneo, contribuindo para a formação de microvarizes. A predisposição hereditária também foi evidenciada, pois algumas variantes genéticas analisadas são transmitidas de forma familiar, o que reforça a importância da hereditariedade na incidência de microvarizes.
Logo, pode-se concluir que o fator hereditário se revela um marcador importante para avaliar o risco de desenvolvimento de microvarizes em indivíduos com histórico familiar de doenças venosas, indicando uma possível via para práticas preventivas e intervenções mais direcionadas. A identificação de mutações genéticas associadas à disfunção venosa proporciona uma compreensão mais ampla dos mecanismos subjacentes ao desenvolvimento de microvarizes, além de oferecer bases para futuras estratégias de tratamento.
REFERÊNCIAS
AMARO, A.; GUERRA, A. B.; DEFINO, M. P.; VIEIRA, L. A.; PELUSO, C.; BIANCO, B.; et al. Variação do gene fator de crescimento endotelial vascular como preditor de risco para a degeneração discal. Einstein, v. 15, n. 4, p. 403-408, 2017. DOI: https://doi.org/10.1590/S1679-45082017AO4053.
CALÒ, Carla Maria; MASSIDDA, Myosotis; SORGE, Roberto; TILOCA, Alessandra; MONTELEONE, Giovanni. Gene COL5A1 e o risco de lesões do LCA no esporte de equipe: Um relatório preliminar. Rev Bras Ortop, v. 5, n. 4, p. 584-589, 2024. DOI: https://doi.org/10.1055/s-0043-1771531.
DUONG, J.; RIDEOUT, A.; MACKAY, S.; BEIS, J.; PARKASH, S.; SCHWARZE, U.; et al. A family with Classical Ehlers-Danlos Syndrome (cEDS), mild bone fragility and without vascular complications, caused by the p.Arg312Cys mutation in COL1A1. European Journal of Medical Genetics, v. 63, n. 2, fev. 2020. DOI: https://doi.org/10.1016/j.ejmg.2019.103730.
FUKAYA, E.; FLORES, A. M.; LINDHOLM, D.; GUSTAFSSON, S.; ZANETTI, D.; INGELSSON, E.; et al. Clinical and genetic determinants of varicose veins. Circulation, v. 138, n. 25, p. 2869-2880, dez. 2018. DOI: 10.1161/CIRCULATIONAHA.118.035584.
GHERSEL, F. R.; SOUTO, R. P.; GONZALES, E. W. P.; PAULO, D. S.; FERNANDES, C. E.; OLIVEIRA, E. Assessment of Metalloproteinase Matrix 9 (MMP9) Gene Polymorphisms Risk Factors for Pelvic Organ Prolapse in the Brazilian Population. Rev Bras Ginecol Obstet, v. 41, n. 3, p. 164-169, mar. 2019. DOI: https://doi.org/10.1055/s-0039-1681112.
KUIVANIEMI, Helena; TROMP, Gerard. Type III collagen (COL3A1): Gene and protein structure, tissue distribution, and associated diseases. Gene, v. 707, p. 151-171, 2020. DOI: 10.1016/j.gene.2019.05.003.
LASIO, Maria Laura Duque; KOZEL, Beth A. Elastin-driven genetic diseases. Matrix Biol., v. 72, p. 144-160, out. 2018. DOI: 10.1016/j.matbio.2018.02.021.
LINS, Esdras Marques; BARROS, José Wellington; APPOLÔNIO, Fernanda; LIMA, Eduardo Cavalcanti; BARBOSA JUNIOR, Marcos; ANACLETO, Eduardo. Perfil epidemiológico de pacientes submetidos a tratamento cirúrgico de varizes de membros inferiores. J Vasc Bras, v. 11, n. 4, p. 301-304, 2012. DOI: https://doi.org/10.1590/S1677-54492012000400008.
MEDEIROS, Ana Beatriz de Almeida; FRAZÃO, Cecília Maria Farias de Queiroz; TINÔCO, Jéssica Dantas de Sá; PAIVA, Maria das Graças Mariano Nunes de; LOPES, Marcos Venícios de Oliveira; LIRA, Ana Luisa Brandão de Carvalho. Úlcera venosa: fatores de risco e classificação dos resultados de enfermagem. Invest Educ Enferm, v. 32, n. 2, p. 252-259, 2014.
PERES, K. C.; TEODORO, L.; AMARAL, L. H. P.; TEIXEIRA, E. S.; BARRETO, I. S.; FREITAS, L. L. L. de; et al. Clinical utility of TGFB1 and its receptors (TGFBR1 and TGFBR2) in thyroid nodules: evaluation based on single nucleotide polymorphisms and mRNA analysis. Arch Endocrinol Metab., v. 65, n. 2, p. 172-184, mar./abr. 2021. DOI: https://doi.org/10.20945/2359-3997000000330.
RIBEIRO, Flávia de Figueiredo. Triagem de mutações no gene FOXC2 em uma família com a síndrome linfedema-distiquíase. Dissertação (Pós-Graduação em Genética). – 79 f. – Departamento de Biologia Geral, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte, 2016.
ROCHA, Fernanda Appolonio; LINS, Esdras Marques; ALMEIDA, Catarina Coelho de; DIAS JUNIOR, Ronaldo Campelo; SILVA, Pedro Alberto Livino da; GAMELEIRA, Claudia Almeida; et al. Quality of life assessment before and after surgery for lower limb varicose veins. J Vasc Bras, v. 19, p. 1-7, 2020. DOI: https://doi.org/10.1590/1677-5449.190108.
SANTOS, Thalita Grazielly; BERNARDES, Nicole Blanco; PÁDUA, Karina Maciel; SILVA, Alessandra Bonacini Cheraim. Tipos de escleroterapia em telangiectasias e microvarizes em membros inferiores. Id on Line Rev Mult Psic, v. 14, n. 51, p. 993-1007, 2020. DOI: 10.14295/idonline.v14i51.2651.
SHAKER, O. G.; ALNOURY, A. M.; HEGAZY, G. A.; HADDAD, H. E.; SAYED, S.; HAMDY, A. Polimorfismos dos genes metilenotetrahidrofolato redutase, fator de crescimento transformador β1 e linfotoxina- α e susceptibilidade à artrite reumatoide. Rev Bras Reumatol, v. n. 5, p. 414-420, 2016. DOI: https://doi.org/10.1016/j.rbre.2016.04.002.
SERRA, Raffaele; BUFFONE, Gianluca; FRANCISCIS, Andrea de; MASTRANGELO, Diego; MOLINARI, Vincenzo; MONTEMURRO, Rossella; et al. A genetic study of chronic venous insufficiency. Ann Vasc Surg, v. 26, n. 5, p. 636-642, 2012. DOI: 10.1016/j.avsg.2011.11.036.
TAVIAN, D.; MISSAGLIA, S.; MICHELINI, S.; MALTESE, P. E.; MANARA, E.; MORDENTE, A.; et al. FOXC2 Disease mutations identified in lymphedema distichiasis patients impair transcriptional activity and cell proliferation. Int J Mol Sci, v. 21, n. 14, jul. 2020. DOI: 10.3390/ijms21145112.
[1] Discente do Curso Superior de Biomedicina da Faculdade Uniprojeção. E-mail: joelmamylife@yahoo.com
[2] Discente do Curso Superior de Biomedicina da Faculdade Uniprojeção. E-mail: marciageronima@gmail.com
[3] Docente do Curso Superior de Biomedicina da Faculdade Uniprojeção. Doutor em Ciências Biológicas/Biologia Molecular e Bioquímica.
