RISK FACTORS FOR THE DEVELOPMENT OF CEREBRAL PALSY AND PRESENTATION OF MOTOR ASPECTS: AN INTEGRATIVE REVIEW
REGISTRO DOI: 10.5281/zenodo.8289355
Sara Caroline Fontoura Dall’Alba1
Renata dos Santos Bueno2
Laís Rodrigues Gerzson3
Carla Skilhan de Almeida4
Resumo: Contextualização: A paralisia cerebral (PC) é uma condição de saúde de caráter não progressivo que acomete o cérebro no início do seu desenvolvimento, comprometendo o desenvolvimento neuropsicomotor e as experiências individuais. Em países em desenvolvimento, sua prevalência é de 7/1000 nascidos vivos. Os fatores de risco para PC são aqueles que influenciam negativamente na saúde da mãe ou da criança, ocorrendo nas fases pré, peri e pós-natal. Objetivo: O objetivo desse estudo foi realizar uma revisão integrativa de estudos que possuem dados epidemiológicos sobre a PC e as características motoras apresentadas pelas crianças em diferentes regiões brasileiras. Metodologia: Foi realizada busca nas bases de dados MEDLINE (via PubMed), google escolar, publicado nos últimos seis anos, busca manual em revistas, anais de congressos e nas revisões sobre o tema e nas listas de referências de todos os artigos considerados relevantes, através dos descritores: “fatores de risco; epidemiologia e fase da lesão na paralisia cerebral”. A elegibilidade para seleção dos artigos foram publicações nos últimos seis anos, em português, com crianças brasileiras, caracterizando a epidemiologia da PC, fase da lesão encefálica, relação entre esses dados e topografia apresentada pelos indivíduos com PC, analisados através de formulário padronizado, analisando assim os participantes, intervenções e desfechos. Resultados: Nove estudos foram selecionados, sendo a maioria deles realizados na região Nordeste e Sudeste do BR. As causas perinatais foram predominantes, seguidas de pós e pré-natais. Na fase perinatal destacou-se a anóxia neonatal, hipóxia, prematuridade, complicações clínicas perinatais, doenças e infecções congênitas ou malformações, parto laborioso e falta de assistência no parto. Na fase pré-natal destacou-se a eclâmpsia, parto emergencial, infecção urinária. Como causas pós-natais predominaram convulsões, icterícia, cardiopatias, doenças ou traumas infantis, encefalopatia hipóxicoisquêmica após parada cardiorrespiratória (PCR). A idade de diagnóstico variou entre um mês de vida até cinco meses de idade. As características motoras predominantes foram a espasticidade bilateral e unilateral, com classificação da função motora grossa (GMFCS) IV e V., com topografia tetraplégica predominante seguida de hemiplegia e paraplegia. A idade materna foi entre 18 e 36 anos, a profissão materna predominante foi dona de casa, e escolaridade entre 9 e 12 anos de estudo. Todos os estudos evidenciaram até um salário mínimo como renda predominante, e recebimento de auxílio financeiro governamental. A idade gestacional variou entre pré-termo tardio e a termo, a principal via de parto foi vaginal, em ambiente hospitalar, sendo os bebês do sexo masculino, com peso ao nascer 2,500 g, de etnia parda ou preta. A maioria das crianças dos estudos foram internadas logo após o nascimento, apresentando como principais comorbidades associadas à PC a epilepsia, deficiência intelectual, sensorial e perceptual como a visão e audição, alterações comportamentais, alteração na linguagem com anormalidade na expressão verbal e na fala, disfagia, disfunções gástricas, micro ou hidrocefalia, alterações respiratórias ou cardíacas, desproporção craniofacial, alteração do tônus. Conclusões: As questões sociodemográficas e o acesso à saúde pelas famílias mais vulneráveis é uma questão relevante e que afeta as populações levando à PC.
Descritores: Paralisia cerebral, Lesões Encefálicas, Fisioterapia (Técnicas), Transtornos do desenvolvimento, tônus muscular.
Abstract: Background: Cerebral palsy (CP) is a non-progressive health condition that affects the brain at the beginning of its development, compromising neuropsychomotor development and individual experiences. In developing countries, its prevalence is 7/1000 live births. Risk factors for CP are those that negatively influence the health of the mother or child, occurring in the pre, peri and postnatal phases. Objective: The aim of this study was to carry out an integrative review of studies that have epidemiological data on CP and the motor characteristics presented by children in different Brazilian regions. Methodology: A search was carried out in MEDLINE databases (via PubMed), school google, published in the last six years, manual search in journals, conference proceedings and reviews on the subject and in the reference lists of all articles considered relevant, through the descriptors: “risk factors; epidemiology and stage of injury in cerebral palsy”. The eligibility for selection of articles were publications in the last six years, in Portuguese, with Brazilian children, characterizing the epidemiology of CP, stage of brain injury, relationship between these data and topography presented by individuals with CP, analyzed using a standardized form, analyzing thus the participants, interventions and outcomes. Results: Nine studies were selected, most of them carried out in the Northeast and Southeast regions of BR. Perinatal causes were predominant, followed by post and prenatal causes. In the perinatal phase, neonatal anoxia, hypoxia, prematurity, perinatal clinical complications, diseases and congenital infections or malformations, laborious delivery and lack of assistance during delivery stood out. In the prenatal phase, eclampsia, emergency delivery, and urinary infection were highlighted. As postnatal causes, seizures, jaundice, heart diseases, childhood illnesses or traumas, hypoxic-ischemic encephalopathy after cardiac arrest (CPA) predominated. The age at diagnosis ranged from one month old to five months old. The predominant motor characteristics were bilateral and unilateral spasticity, with gross motor function classification (GMFCS) IV and V., with predominant quadriplegic topography followed by hemiplegia and paraplegia. Maternal age was between 18 and 36 years, the predominant maternal profession was housewife, and schooling between 9 and 12 years of study. All studies showed up to a minimum wage as the predominant income, and receipt of government financial aid. Gestational age varied between late preterm and full-term, the main mode of delivery was vaginal, in a hospital environment, with male babies, with a birth weight of 2,500 g, of brown or black ethnicity. Most of the children in the studies were hospitalized soon after birth, presenting as main comorbidities associated with CP epilepsy, intellectual, sensory and perceptual impairment such as vision and hearing, behavioral alterations, alteration in language with abnormality in verbal expression and speech, dysphagia, gastric dysfunctions, micro or hydrocephalus, respiratory or cardiac alterations, craniofacial disproportion, tone alteration. Conclusions: Sociodemographic issues and access to health by the most vulnerable families is a relevant issue that affects populations leading to CP.
Keyword: Cerebral Palsy, Brain Injuries, Physical Therapy Modalities, Neurodevelopmental Disorders, Muscle Tonus.
Introdução
A paralisia cerebral (PC) é uma condição de saúde permanente, de caráter não progressivo que acomete o cérebro no início do seu desenvolvimento. Essa patologia é a maior causa de deficiências em crianças, afetando diretamente a postura e o movimento corporal, comprometendo o desenvolvimento neuropsicomotor e as experiências individuais. É diagnosticada através de sinais e sintomas que podem abranger síndromes variadas e complexas, com diferentes comorbidades clínicas e cinético-funcionais¹.
Com variações quanto à distribuição anatômica (unilateral, bilateral) topografia (diplégica espástica, hemiplégica espástica, quadriplégica espástica, discinética, atáxica e mista), à gravidade de acometimento motor (classificada quanto ao nível motor no Sistema de Classificação da Função Motora Grossa (GMFCS) I, II, III, IV e V) e sintomas clínicos associados².
A prevalência de PC em países desenvolvidos é de 2,1 casos para 1000 nascidos vivos, mantendo-se constante nos últimos anos3,4. Em países como em desenvolvimento, como o Brasil, o cenário da PC se modifica e pode-se chegar a uma prevalência de 7 a cada 1000 nascidos vivos. Tal dado ocorre principalmente pelo aumento dos fatores de risco que levam ao aumento dos casos de PC, onde destaca-se a desigualdade socioeconômica que leva à pobreza e ao baixo acesso à saúde materna 5.
São considerados fatores de risco para o desenvolvimento da PC aqueles que influenciam negativamente na saúde da mãe ou da criança, os quais ocorrem nas fases pré-natal, perinatal e pós-natal. Os principais fatores de risco para o desfecho de PC são a prematuridade abaixo de 28 semanas, o peso do nascimento abaixo de 1500g e o índice de Apgar menor que 7 no quinto minuto6.
Como principais fatores pré natais para a ocorrência de PC temos os fatores genéticos, infecções congênitas, malformações congênitas, agentes tóxicos, pobre nutrição materna e alterações vasculares; os fatores perinatais mais prevalentes são a hipóxia intrauterina e alterações metabólicas; e, por último, os fatores pós-natais que mais se apresentam são o afogamento, meningite, as síndromes convulsivas, sepse, anóxia, Traumatismo Crânio Encefálico (TCE), Acidente Vascular Cerebral (AVC), tumores, encefalopatias, e destaca-se a prematuridade7,8,9.
No Brasil, esses dados são encontrados e podem se modificar de acordo com as regiões, dada a dimensão continental brasileira, sendo assim, o objetivo desse estudo foi realizar uma revisão integrativa de estudos que possuem dados epidemiológicos sobre a PC e as características motoras apresentadas pelas crianças em diferentes regiões brasileiras.
Metodologia
Como estratégia, foi realizada busca nas bases de dados MEDLINE (via PubMed), google escolar, publicado nos últimos seis anos, além de busca manual em referências de estudos já publicados sobre o assunto, busca nas revisões sobre o tema e nas listas de referências de todos os artigos considerados relevantes, além de pesquisa manual em algumas revistas. A busca compreendeu os seguintes descritores “Fatores de risco paralisia cerebral”, “epidemiologia paralisia cerebral”, “fase da lesão paralisia cerebral”, e suas respectivas traduções para a língua inglesa, associando a seus termos sinônimos e uma lista de termos sensíveis para a busca.
Os trabalhos selecionados foram avaliados de acordo com os seguintes critérios:
Critérios de elegibilidade para seleção dos artigos: Foram considerados critérios de inclusão: artigos publicados nos últimos dez anos, em português, população da pesquisa sendo crianças com paralisia cerebral, realizado no Brasil (pois no Brasil, quando comparados à outros países, ainda necessita-se entender os fatores de risco que levam à PC), tema do artigo relacionado à epidemiologia da paralisia cerebral, fase da lesão encefálica, relação entre esses dados e a topografia apresentada pelos indivíduos com PC.
Critérios de exclusão: Foram excluídos artigos que não condizem com o tema do pesquisa, publicados há mais de seis anos, estudos de caso, que apresentavam adultos como população do artigo ou abordavam outras patologias neurológicas que não a paralisia cerebral.
Na seleção dos artigos, a busca de referências se limitou a artigos publicados desde 2017 até 2022, escritos em português, onde foram avaliados os títulos e resumos de todos os artigos identificados pela estratégia de busca, dos quais foram excluídos da pesquisa artigos que os resumos que não apresentassem informações suficientes sobre os critérios de inclusão e exclusão foram selecionados para avaliação do texto completo. Nessa segunda fase, foram avaliados os textos completos dos artigos e a seleção foi feita de acordo com os critérios de elegibilidade especificados anteriormente conforme os temas citados acima. A extração dos dados foi realizada utilizando um formulário padronizado criado pelas autoras, constando os dados citados no próximo ítem. Foram extraídas informações com relação às características metodológicas dos artigos, participantes, intervenções e desfechos.
Processo de extração dos dados e principais variáveis utilizadas
Os dados e as variáveis principais foram extraídos dos artigos selecionados por um autor do atual estudo. As seguintes informações foram coletadas separadamente de cada trabalho selecionado: (1) autor, país, ano, (2) tipo de estudo, (3) objetivos, (4) desenho da pesquisa (5) resultados, (6) fase da lesão e apresentação motora.
Resultados
A estratégia de busca selecionou 1560 artigos, dos quais 22 foram considerados relevantes e retomados para análise detalhada. Destes, nove pesquisas preencheram os critérios de elegibilidade e foram incluídos na revisão, totalizando nove participantes. A figura 1 mostra o fluxograma dos artigos incluídos e a Tabela 1 apresenta as principais características destes estudos.
Figura 1 – Fluxograma da busca de artigos nas bases de dados.
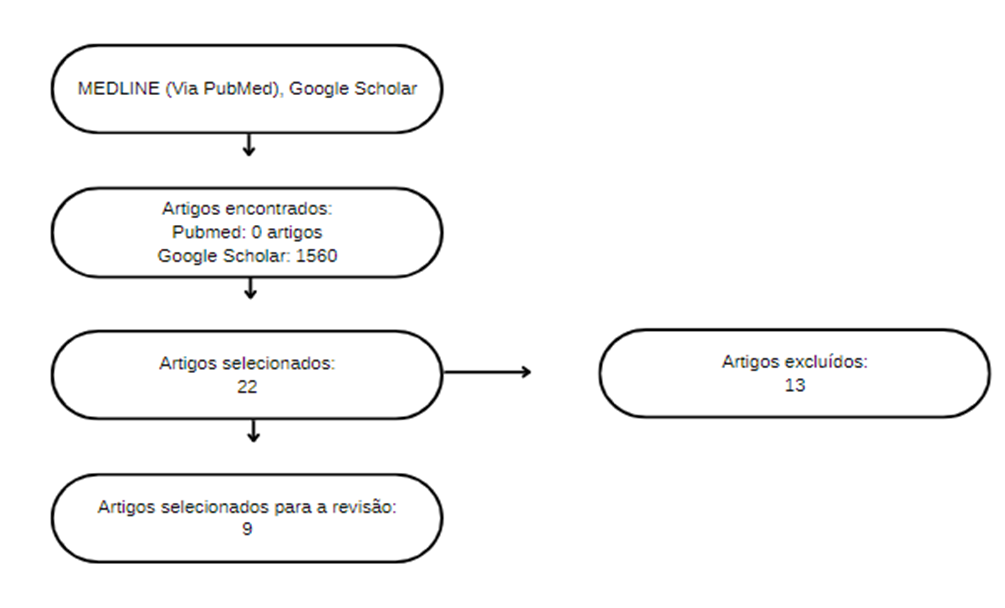
Tabela 1 – Descrição dos dados apresentados pelosartigos, autor, país, ano, tipo de pesquisa, objetivos, desenho do estudo, resultados, fase da lesão e apresentação motora
Autor/ Estado Tipo de estudo Objetivos Desenho do estudo Resultados Apresenta a relação da fase da lesão e da apresentação motora Cavalcante et. al.10/ BR. Descritivo, abordagem quantitativa Descrever o perfil de pais e crianças com paralisia cerebral assistidas em ambulatórios de Fortaleza, Ceará/BR Desenvolvido com 122 pais de crianças com PC, atendidas em duas instituições de saúde em nível ambulatorial e de reabilitação em Fortaleza – CE, de outubro de 2012 a janeiro de 2013. que receberam treinamento para participar do estudo. Utilizou-se dados de prontuários e um formulário desenvolvido pelos pesquisadores para obtenção de informações socioeconômicas, demográficas e clínicas, posteriormente analisadas em banco de dados. Identificou-se 88 (72,1%) das crianças com PC espástica, tendo como principal causa a anóxia neonatal 64 (52,5%), em que foram diagnosticadas com menos de um mês de vida 47(38,5%) e que além do aspecto motor, apresentam outros distúrbios, como problemas na fala 92 (75,4%). Sim, PC espástica com maior causa a anóxia neonatal. Peixoto, et. al.11 / SE Estudo epidemiológico do tipo transversal a partir de um inquérito de base populacional sobre a paralisia cerebral em crianças e adolescentes Descrever a prevalência de paralisia cerebral entre crianças e adolescentes, seus subtipos, as possíveis comorbidades e as características socioeconômicas das famílias na cidade de Aracaju (SE), Brasil. O estudo obteve informações sobre 240 crianças e adolescentes com paralisia cerebral a partir das respostas a um questionário feitas por seus responsáveis, entre junho de 2016 e dezembro de 2017 Foi encontrada a prevalência de período de 1,37 em cada mil, mas a taxa de prevalência total não foi um indicador homogêneo. A maioria dos participantes foi do sexo masculino (56,25%), de raça/cor declarada como parda ou preta (67,50%), a média de idade foi de 8,56 anos. O tipo de parto prevalente foi vaginal, em ambiente hospitalar, e peso ao nascer de 2,500 g, a maioria das crianças precisou de internação após nascimento. A paralisia cerebral de tipo espástica bilateral foi a mais frequente (45,42%) e a comorbidade referida na maioria dos casos foi a epilepsia (48,33%), as complicações clínicas no parto (27,92%) foram a maior causa de PC, e o momento da lesão mais referido foi o peri-natal (42,50%). A renda familiar mensal predominante correspondia a extrema pobreza. Sim, PC espástica bilateral e causa perinatal. Lima, et. al.12/ PA Descritiva, exploratória e transversal, com abordagem quantitativa. Caracterizar as crianças com Paralisia Cerebral que residem no Estado do Pará, segundo indicadores sociodemográficos e clínicos da criança. Participaram 132 familiares de crianças com Paralisia Cerebral (PC) das cidades-polo das mesorregiões do Estado do Pará, especificamente Belém, Castanhal, Marabá e Santarém, as quais eram usuárias de centros de atendimento especializado a pessoas com deficiência. Foram aplicados questionário sociodemográfica, GMFCS. A idade prevalente foi entre 05 a 08 anos, a maioria recebia auxílio financeiro governamental e tinham renda de até 1 salário mínimo. A maior parte da amostra residia na zona urbana, eram primogênitos, e tiveram como principais causas para a PC as perinatais e apresentaram GMFCS IV e V. A maioria dos indivíduos tinham outros problemas de saúde associados. Sim, fase perinatal e GMFCS IV e V. Felice, et. al.13/SP epidemiológico, descritivo, de levantamento retrospectivo. verificar os fato- res de risco para PC no período de 5 anos (2010- 2014) no município de Ribeirão Preto-SP, buscan- do identificar a proporção de crianças nascidas na rede pública do município e que foram identifica- das como apresentando risco de atraso de desen- volvimento e, dentre estas, as que foram diagnos- Medicina (Ribeirão Preto. Online) 2019;52(3):179-91 181 Estudo retrospectivo: fatores de risco na paralisia cerebral ticadas com paralisia cerebral, além de identificar os fatores de riscos mais prevalentes e associá-los ao diagnóstico de PC. Análise de 481 prontuários, dados sociodemográficos e referentes à saúde materna e do bebê. Maioria das crianças apresentou os fatores de risco a ocorrência pós-natal isolado e associado com Peso <2500g, IG <37, Apgar <5 no 1º minuto ou <7 no 5ª minuto. As intercorrências perinatais tiveram maior apresentação (41,88%), 52,82% tiveram intercorrências na gestação, foi verificada associação entre a saúde prévia da mãe e as intercorrências não havia informações sobre a saúde prévia da mãe em 76,92% dos prontuários. ___ Silva et, al.14/ CE Transversal, documental, observacional e com delineamento quantitativo Investigar o perfil do paciente com Paralisia Cerebral atendido no setor de pediatria Neuroinfantil de em uma clínica escola. Realizada em Dez/2018. Foram analisados 14 fichas/prontuários de avaliações. A IG média foi de 37,08 % semanas, a maioria tinha idade cronológica de 7 anos. As causas etiológicas para o desenvolvimento da PC foram a hipóxia cerebral (33,3%), prematuridade (22,2 %) e icterícia com (16,7%). 78,6% apresentaram PC do tipo espástica. Não relacionou, mas trouxe as causas e a apresentação motora. Santos, et. al.15/SP Quantitativa do tipo exploratória descritiva. Avaliar o perfil epidemiológico dos pacientes com PC atendidos na clínica de fisioterapia da Universidade São Judas Tadeu (CFUSJT). Foi realizado um estudo retrospectivo, através da coleta de dados de prontuários físicos dos pacientes com paralisia cerebral (PC) atendidos na clínica de fisioterapia da Universidade São Judas Tadeu (USJT) no período de 2010 a 2020.A amostra foi composta por 87 prontuários de pacientes com diagnóstico de paralisia cerebral de 0 a 18 anos de idade de ambos os gêneros. Posteriormente os prontuários foram avaliados minuciosamente, sendo tabulados e submetidos a análise estatística. Distribuição da apresentação motora: Tetraplégico espástico (37,93%), diplégico espástico (37,93%), hemiplégico espástico (9,20%) e paraplégico espástico (1,15%) e não informaram (13,79%). Foram identificadas intercorrências que podem ter desencadeado a PC nestes pacientes, sendo um destes fatores o acometimento a mãe no período gestacional, destacando-se eclâmpsia (27,04%), parto de emergência (10,82%), infecção urinária (8,12%) e parto demorado (5,12%). Outros acontecimentos importantes identificados foram as intercorrências com a criança, destacando-se convulsões e anóxia (17,04%), hipóxia (15,93%) e problemas cardíacos (14,80%). não relacionou, mas trouxe as causas e a apresentação motora. Vieira, Chagas16/ BA Estudo com uma série de relato de casos Avaliação do perfil funcional e sócio demográfico dos portadores de Paralisia Cerebral (PC) atendidos no Hospital Santo Antônio, CER IV, das Obras Sociais Irmã Dulce Utilizando-se uma amostra por conveniência de pacientes diagnosticados com PC atendidos no período de setembro de 2014 a Julho de 2015 no Centro Especializado em Reabilitação IV (CER IV) do Hospital Santo Antônio em Salvador Os dados, incluindo os sócio demográficos, foram coletados em prontuário dos pacientes, assim como, os dados clínicos de exame realizado por Neuropediatra Na população estudada, a predominou os fatores perinatais em 18/59 casos (30,5%), em 17/59 (28,8%) os fatores pós-natais e apenas 6/59 (10,2%) pré-natais. Em 18/59 (30,5%) dos casos, não foram encontrados estes registro em prontuário e/ou responsável pela criança não dispunham desta informação. Entre as causas perinatais, hipóxia/asfixia ocorreu em 17/18 (94,4%) dos portadores de PC e correspondeu a maior prevalência. Casos de Malformações foram detectados em 3/6 (50%) e Infecções congênitas em 2/6 (33,3%), correspondendo às causas pré-natais. Observou-se também, entre as causas pós-natais, elevado predomínio de encefalopatia 103 Revista Brasileira de Neurologia e Psiquiatria. 2017 Maio/Ago;21(2):100-108. http://www.revneuropsiq.com.br hipóxico-isquêmica após parada cardiorrespiratória (PCR) correspondente a 10/17 (58,8%) dos casos, seguida por meningoencefalite em 3/17 (17,6%). frequência de PC Espástica foi muito elevada. O estudo sócio demográfico dos pacientes demonstrou que em PC a variável gênero não se constitui em fator de risco. 3. O estudo aponta dependência funcional em cerca de 67,8% dos pacientes com paralisia cerebral. e hiperreflexia dos membros inferiores, correspondente a 26/59 (44%). ausência de marcha em 40/59 (67,8%); epilepsia em 36/59 (61%) Não relacionou, mas trouxe as causas e a apresentação motora. Herther et al. 17/RS Trata-se de um estudo retrospectivo Revisão de 131 prontuários, de pacientes do ambulatório de Reabilitação em 2019, coletando-se os dados de histórico gestacional das crianças e a avaliação atual da equipe multidisciplinar. Inclui-se todas as crianças e adolescentes até 18 anos de idade com diagnóstico de PC. Analisar a correlação entre a fase de lesão cerebral e o diagnóstico cinéticofuncional de crianças com PC 131 crianças participaram do estudo. Sobre a classificação dos fatores de risco: 56 crianças classificadas como pré-natal (42,7%), 57 classificadas como fase perinatal (43,5%, sendo mais de 60% destes em razão da prematuridade) e 18 na fase pós-natal (13,7%). Houve a associação significativa entre a fase da lesão e o diagnóstico motor (p=0,013). A fase pré-natal associou-se com a espasticidade bilateral (48,9%). A fase perinatal associou-se com a espasticidade unilateral (85,7%), mista (50%) e atáxica (53,8%). Com relação à fase pós-natal, a associação foi com sujeitos que possuem um diagnóstico de discinesia (60%). A hipotonia não se associou com nenhuma fase, mas ocorreu de forma equilibrada nas três fases. Sim, houve correlação entre a fase da lesão e o diagnóstico cinético funcional. Binha, et al.18 /SP Retrospectivo, através da coleta de dados dos prontuários eletrônicos de 743 pacientes atendidos em consultas iniciais em uma grande unidade de uma instituição de reabilitação de SP (BR). Caracterizar a população dos novos pacientes da clínica de PC da AACD (Ibirapuera- SP/SP), entre Janeiro-2012 e Dezembro-2014. Foram coletados e tabulados os dados de 614 prontuários de pacientes com dados de identificação, realização de terapias e demais dados sociodemográficos e clínicos, Foram coletados 291 pacientes, maioria do sexo masculino (52,6%). Idade: 29,5% menores de 2 anos, 34% de 2 a 4 anos, 15,5% de 4 a 6 anos, 16,3% de 6 a 12 anos. Outras deficiências: 5,7% visual, 3,9% cognitiva, 1,3% auditiva, 1,8% duas ou mais deficiências além da motora, 87,3% dos pacientes não apresentavam deficiências associadas. IG: 50,7% pré-termo, 45% nascidos a termo. Destes, 15% prematuros extremos, 15% prematuros graves, 11,4% prematuros moderados. 96,4% nasceram em Hospital. Tipo de parto: : 56,5% cesarianas, 37,5% parto normal Complicações no período gestacional/pré-natal ocorreram em 71,8%. Apresentação motora: 13,4% Hemiparéticos espásticos , 33,9% Diparéticos espásticos, 0,5% Triparéticos espásticos, 12,2% Tetraparéticos espásticos, 0,5% Monoparéticos espásticos, 5,9% Discinéticos/atáxicos, 5,7% PC mista, 1% hipotônicos. GMFCS 13,7% tipo 1, 9,8% tipo 2, 12,2% tipo 3, 9,4% tipo 4, 12,4% tipo 5 55,5% Quanto à renda, 36,6 não recebiam nenhum tipo de benefício-social, 36,6%.
Descrição dos resultados
Dos oito estudos selecionados para essa revisão, dois foram oriundos do Ceará, dois de São Paulo, um do Pará, um da Bahia e por último um do Rio Grande do Sul. Através do presente estudo, pode-se perceber que a maioria dos estudos foram realizados na região Nordeste e Sudeste do Brasil.
As causas perinatais foram predominantes, seguidas de pós-natais e pré-natais. As pesquisas selecionadas trouxeram como principais causas para o desenvolvimento da PC na fase pré-natal as complicações na gestação, como acometimento da mãe no período gestacional, destacando-se aqui a eclâmpsia, parto de emergência, infecção urinária. Na fase perinatal foram apontados a anóxia neonatal, hipóxia, prematuridade, complicações clínicas no parto, doenças congênitas ou malformações, infecções congênitas, parto demorado ou laborioso e, por fim, a falta de assistência no parto. Como causas pós-natais foram predominantes as convulsões, icterícia, problemas cardíacos, doenças ou traumas da infância e encefalopatia hipóxico-isquêmica após parada cardiorrespiratória (PCR).
Ainda, as causas perinatais foram mais fortemente relacionadas às intercorrências gestacionais, saúde prévia da mãe e intercorrências no parto. Uma das pesquisas trouxe a causa pós-natal associada ou não com baixo peso ao nascer, prematuridade, Apgar <5 no 1º minuto ou <7 no 5º minuto.
Quanto à apresentação motora, houve predominância da PC do tipo espástica bilateral e espástica unilateral, seguida de discinética, atáxica, hipotônica, mista. Os indivíduos avaliados nos estudos variaram quanto ao GMFCS e capacidade de marcha com ou sem auxílio. O nível de GMFCS em um dos estudos foi, na sua maioria, GMFCS IV e V seguido de I, II e III.
A topografia relatada na maioria dos estudos foi tetraplegia, hemiplegia, e diplegia/paraplegia. Os demais artigos trouxeram os dados motores e a fase da lesão de maneira descritiva, com maior prevalência da PC espástica uni e bilateral e ocorrência na fase perinatal.
A idade de diagnóstico das crianças foi estudada em duas pesquisas, e variaram de menos de um mês de vida até cinco meses de idade. A variação da idade materna foi entre 18 e 36 anos, com a maioria das mães sendo donas de casa, com escolaridade entre nove e 12 anos de estudo. Todos os estudos evidenciaram a baixa renda como fator prevalente (até um salário mínimo), com a maioria recebendo auxílio financeiro governamental.
A idade gestacional (IG) levantada nos estudos variou entre pré-termo tardio e a termo, a principal via de parto foi a vaginal, em ambiente hospitalar, com os bebês nascidos do sexo masculino, com peso ao nascer de 2,500 g e de etnia parda ou preta. A idade das crianças no momento da avaliação variou entre zero e oito anos de idade, onde a maioria das pesquisas demonstraram que a idade das avaliações ocorreu entre seis e oito anos.
A maioria das crianças das pesquisas foram internadas logo após o nascimento, apresentando como principais comorbidades associadas à PC a epilepsia, deficiência intelectual, sensorial e perceptual como a visão e audição, alterações comportamentais, alteração na linguagem com anormalidade na expressão verbal e na fala, disfagia, disfunções gástricas, micro ou hidrocefalia, alterações respiratórias ou cardíacas, desproporção craniofacial, alteração do tônus.
Discussão
Idade gestacional (IG)
A prematuridade tardia foi predominante nos estudos levantados, podendo esta ser uma importante causa para o desenvolvimento de PC. Estima-se que de 5 a 10% dos bebês nascidos prematuros irão desenvolver PC, e 25 a 50% apresentarão comprometimentos cognitivos e transtornos comportamentais19. Diversos estudos têm relacionado a IG prematura com o desenvolvimento da PC19, 20, 21, 22, 23, 24, sendo essa relação consequente das maiores taxas de leucomalácia periventricular, hemorragia intraventricular e displasia broncopulmonar, ou das lesões na substância branca e cinzenta que ocorrem após o parto prematuro25, 26.
Apesar dos avanços na área da medicina obstétrica, os partos prematuros ainda ocorrem em maior número em países em desenvolvimento, predispondo a criança a ter alterações do desenvolvimento neuropsicomotor e comorbidades associadas à essa condição de saúde28, 29, 30.
Um levantamento nacional de base hospitalar, realizado em 191 municípios, entrevistando 23.894 mulheres demonstrou que a taxa de prematuridade brasileira naquele estudo foi de 11,5%, quase duas vezes maior do que em países europeus, onde 74% desses prematuros foram considerados tardios (34 a 36 semanas gestacionais)30.
Em uma pesquisa que avaliou a incidência da PC na Espanha percebeu que as crianças prematuras foram mais propensas a apresentar paralisia cerebral bilateral, sendo a diplegia espástica o subtipo mais frequente e a tetraplegia associada com o menor peso e menor IG41. Outro estudo observou que 1% de todos os prematuros com peso de nascimento inferior a 2.500 g apresentaram HPI, mais uma vez ocorrendo com mais frequência em bebês com menor peso ao nascer e menor IG31.
Através da presente pesquisa, percebemos que o Brasil ainda possui uma frequência importante de partos prematuros que, quando combinados ou não com demais fatores de risco podem causar alterações no neurodesenvolvimento.
Idade e escolaridade materna, renda familiar e idade de diagnóstico de PC.
A idade materna entre 29 e 36 anos foi predominante, demonstrando corroborar com a literatura
A escolaridade materna foi entre nove e 12 anos de estudo. O nível de escolaridade materna pode potencializar ou inibir as aquisições motoras, a literatura demonstra que o nível escolar materno tem uma importante influência no neurodesenvolvimento de prematuros, sugerindo também que este seja o fator de maior impacto em relação aos demais fatores socioeconômicos2,32. Patra et al.33 realizaram avaliaram em Nova York (EUA) a relação entre os níveis de escolaridade materna e o desenvolvimento de crianças pré escolares prematuras, inferindo que quanto menor o nível de escolaridade, maior o comprometimento cognitivo, de linguagem e motor, das crianças avaliadas.
As famílias com menos anos de escolaridade podem realizar menos atividades de interação com as crianças, tanto por menor disponibilidade de tempo de qualidade para as brincadeiras, quanto de espaço físico residencial ou público que proporcione segurança para as famílias, além de menor acesso a conteúdo educacionais e de saúde preventivos. Sendo assim, percebe-se que o fator escolaridade materna influencia no desempenho motor, no desenvolvimento cognitivo e de linguagem e na socialização da criança.
A renda familiar apresentada em todos os artigos foi de até um salário mínimo, e apenas um artigo de até dois salários mínimos, caracterizando baixa renda.
A baixa renda média familiar é um importante fator de risco socioeconômico para o desenvolvimento infantil, aumentando o risco direta ou indiretamente para o desenvolvimento de PC. Uma pesquisa realizada com 100 mães de prematuros, ainda em fase de puerpério, evidenciou que os menores níveis de escolaridade e socioeconômicos estavam associados ao diagnóstico de PC34. Geralmente, a população com menor nível socioeconômico tem menos acesso a informações e conhecimento referentes às medidas de prevenção e promoção da saúde, o que as torna mais vulneráveis a doenças de um modo em geral.
Um estudo encontrou uma associação entre práticas menos efetivas de cuidado e a menor renda familiar de mães de crianças com PC. As participantes deste estudo recebiam o benefício social por meio do Benefício de Prestação Continuada (BPC), que se constitui de um benefício assistencial à pessoa com deficiência ou à Bolsa Família, configurando a baixa renda destas famílias35. Lima36 em sua pesquisa sinalizou que a vulnerabilidade social das famílias de pessoas com PC, tem sido associada a uma pior qualidade de vida e um maior risco ao desenvolvimento saudável tanto da mãe quanto da criança.
Tal situação também se reflete no diagnóstico tardio da PC em países em desenvolvimento, onde o diagnóstico precoce não é uma realidade recorrente. O acesso à saúde por parte das mães e das crianças é precário, apesar da existência de programas governamentais, o diagnóstico e acompanhamento da criança que apresenta atraso no desenvolvimento neuropsicomotor ainda é limitado, sendo que o encaminhamento para programas de follow-up não é a realidade na maioria destes países.
Isso pode ocorrer pois quando as famílias possuem um baixo poder aquisitivo sofrem restrições em diversas áreas sociais e culturais, acarretando em um comportamento predominantemente inativo das crianças, como menor locomoção por acesso limitado à dispositivos auxiliares de marcha ou cadeiras de rodas adequados, afetando ainda mais a população de crianças com PC GMFCS IV e V, principalmente no que se refere à mobilidade.
O restrito acesso à saúde associado à precário assistência no período gestacional, parto e período neonatal, demonstram recursos limitados para a população de baixa renda. Tais fatores expõem as desigualdades sociais que existem e são persistentes na sociedade brasileira, desfavorecendo aqueles que precisam de atenção, prevenção e cuidados para a sua saúde.
Internação após o nascimento e idade de diagnóstico
Todos os estudos demonstraram que as crianças foram internadas logo após o nascimento. Uma pesquisa realizada no Rio Grande do Sul (BR) recentemente evidenciou que prematuros extremos ficaram internados 75 dias, já os moderados ficaram 25 dias internados em média logo após o nascimento, tendo associação estatisticamente significante com o escore de desenvolvimento motor apresentado pelos bebês37.
A vulnerabilidade nos ambientes hospitalares neonatais bem como a exposição repentina da vida extra uterina podem contribuir para uma série de efeitos adversos ao desenvolvimento neuropsicomotor do neonato38.
A maturidade do Sistema Nervoso Central (SNC) dos bebês internados, somada à fragilidade dos sistemas de controle hormonal, neurogênico e dos diferentes órgãos do corpo do bebê pode levar à maior disposição às alterações nas condições de saúde do neonato durante a internação. Há ainda, no ambiente de internação hospitalar, a diminuição de estímulos, a restrição do contato com a mãe e o excesso de equipamentos para manter a vida do recém-nascido pré-termo ou de risco, restringindo os estímulos oferecidos ao neonato, consequentemente colaborando com o desenvolvimento de alguma disfunção38.
A idade de diagnóstico em dois estudos na presente pesquisa foi de um mês e cinco meses. Um estudo norte americano realizou um programa de conscientização sobre a PC em uma clínica de acompanhamento, onde a idade de diagnóstico chegou a ser realizada entre 13 a 18 meses de idade das crianças, aproximadamente39. No Brasil, ainda temos como realidade o diagnóstico tardio, o que limita o acesso à programas de intervenção precoce das crianças com PC. Tal fator não foi descrito em todas as pesquisas encontradas, o que limita a análise aprofundada dos dados.
Comorbidades associadas
A epilepsia foi a comorbidade mais evidenciada na presente pesquisa, seguida de deficiência intelectual, visual e auditiva.Uma revisão sobre a presença de epilepsia em crianças com PC apontou que a epilepsia aparece em 15-60% dos pacientes com PC, podendo se apresentar no período neonatal (19%) ou iniciar dentro de um ano de idade (47%). Dentro dessa pesquisa, a hemiplegia espástica teve predomínio dos casos, seguida da quadriplegia e diplegia40. Outra pesquisa traz dados parecidos, identificando que a epilepsia ocorre entre 25 a 45% dos pacientes com PC, tendo sua maior incidência em pacientes com quadriplegia espástica e hemiplegia adquirida, e menos comum em diplegia espástica e PC que é principalmente atetóide41.
Ainda, Cooper et al.42 descreveram a ocorrência de convulsão em 166 crianças com PC devido a lesão da substância branca, com as seguintes características: convulsão após um mês de idade (25%), West (2,4%), outras síndromes epilépticas (8,4%), convulsão febril (7,8%) e convulsões focais benignas (18%), sendo que todas as convulsões foram resolvidas em 80% dos casos.
Uma revisão sistemática apontou as principais comorbidades presentes na PC, indo ao encontro dos dados encontrados neste estudo. Os dados apontaram que a deficiência intelectual é mais predominante em crianças com quadriplegia espástica, que podem ser severamente afetadas. Essa alteração cognitiva impacta diretamente o desenvolvimento da linguagem, principalmente na PC hemiplégica41,43.
Já as alterações visuais são observadas em quase 30% das crianças com PC, sendo mais comum em crianças com PC que foram prematuras, podendo estar relacionada ao comprometimento cortical, ambliopia, erros de refração e defeitos de campo visual43.
As alterações gastrointestinais foram quase 90% das crianças com PC, que podem desenvolver constipação concomitante, refluxo gastroesofágico, vômitos, distúrbios de deglutição ou dor abdominal. As patologias respiratórias podem ocorrer em crianças com PC secundárias a aspiração recorrente, escoliose e alteração da coordenação muscular respiratória41,43.
Causas para o desenvolvimento de PC
Quanto às causas para o desenvolvimento de PC, houve maior ocorrência das perinatais, seguidas de pós-natais e pré-natais. As pesquisas selecionadas que trouxeram como principais causas para o desenvolvimento da PC a fase pré-natal, apontaram principalmente as complicações na gestação, o acometimento da mãe no período gestacional, destacando-se aqui a eclâmpsia, o parto de emergência e a infecção urinária como causas pré-natais. Uma revisão sistemática realizada em Zahedan, Irã, levantou evidências de que as infecções maternas durante a gravidez estão associadas com menor idade gestacional e baixo peso ao nascer, podendo estar associada a um risco aumentado de PC44.
Ainda, outra publicação identificou, entre outras causas, a hipertensão gestacional45 como fator de risco pré-natal para a PC. A hipertensão gestacional é apontada como umas das principais complicações não infecciosas que afetam a saúde materna e, consequentemente, a fetal. Os danos fetais demonstrados por essa metanálise consequentes da hipertensão gestacional são o baixo peso ao nascer, suprimento inadequado de oxigênio, risco de desenvolver doenças pulmonares, restrição de crescimento fetal intrauterino, parto prematuro, ruptura prematura de membranas e cesariana de emergência46. Apesar de ser prioridade na saúde do Brasil e de ter tido significativos resultados na diminuição da mortalidade materno-infantil, o acompanhamento da saúde da mulher precisa de estratégias assistenciais governamentais que atinjam as populações mais necessitadas, oportunizando melhorias nesses indicadores dos serviços de atenção à saúde47.
Já na fase perinatal, o presente estudo apontou como principais causas a anóxia neonatal, hipóxia, prematuridade, complicações clínicas no parto, doenças congênitas ou malformações, infecções congênitas, parto demorado ou laborioso e, por fim, a falta de assistência no parto. Essas causas perinatais foram mais relacionadas às intercorrências gestacionais, saúde prévia da mãe e intercorrências no parto.
Uma pesquisa realizada no Paquistão em 2022 evidenciou que a maioria das crianças com PC participantes da amostra tiveram como principal acometimento perinatal a asfixia ao nascer (42,7%)48, onde a maior parte das crianças nasceram em hospitais com idade gestacional a termo, mães primigestas com média de idade de 26 anos. Predominante no estudo, o baixo peso ao nascer foi significativamente associado ao risco de paralisia cerebral bem como a história de choro tardio, corroborando com os achados da presente pesquisa e com demais dados da literatura sobre a PC.
Em 2017, Frank et al.49 descreveram um estudo que percebeu a encefalopatia neonatal como fator perinatal mais presente para a PC, ocorrendo em 24% das crianças nascidas a termo (37-40 semanas) e 33,6% das nascidas a termo e pós termo (41-42 semanas).
A prematuridade já é uma causa bem documentada de PC. Uma revisão sistemática realizada em 2018 nos EUA mostrou uma prevalência de PC em crianças extremamente prematuras que variou de 16 a 21%50. A hemorragia intraventricular (IVH) é uma consequência da prematuridade que ocorre em 25 a 30% dos prematuros, e é um forte fator de risco para a hidrocefalia e PC. A IVH está associada a fatores intrauterinos que levam ao parto prematuro, podendo se destacar descolamento prematuro da placenta e inflamação51, 52, 53.
Como causas pós-natais foram predominantes as convulsões, icterícia, problemas cardíacos, doenças ou traumas da infância e encefalopatia hipóxico-isquêmica após parada cardiorrespiratória (PCR). Uma das pesquisas trouxe a causa pós natal associada ou não com baixo peso ao nascer, prematuridade, Apgar <5 no 1º minuto ou <7 no 5º minuto.
Achados na literatura demonstraram que as lesões pós-natais hipóxicos/isquêmicas, incluindo ressuscitação cardiopulmonar no nascimento, doença pulmonar crônica e sepse tiveram contribuição significativa para o desfecho de PC54. A sepse neonatal foi apontada na literatura, pois ocorre um aumento nas citocinas sistêmicas associadas com corioamnionite, que, quando somadas às alterações hemodinâmicas dos prematuros aumentam o risco de isquemia cerebral50,55.
Como uma causa pós-natal com alta incidência para a PC, encontramos também o AVC, que ocorre também na fase perinatal e é uma doença hipóxico isquêmica do recém-nascido. O AVC pode ocorrer ainda no útero a partir de 22 semanas (pré-natal) ou até um mês após o nascimento devido a hemorragia, isquemia ou fenômeno tromboembólico (peri e pós-natais) sendo esse um importante fator pós-natal, podendo ou não estar associado à convulsões23.
A hiperbilirrubinemia neonatal também é um fator pós-natal relevante para a PC. No estudo de Frank et al56, 10% da amostra de crianças com PC nascidas a termo (37-40 semanas) apresentaram hiperbilirrubinemia neonatal. A deposição de bilirrubina nas células do sistema nervoso imaturo é o principal processo fisiopatológico subjacente da encefalopatia induzida por bilirrubina, acarretando na PC.
Apresentação motora e topografia
A PC do tipo espástica bilateral e espástica unilateral foram predominantes nos achados da presente pesquisa, seguidas dos tipos discinética, atáxica, hipotônica e mista. Quanto ao GMFCS, na sua maioria, foram evidenciados na sua maioria os níveis IV e V seguido de I, II e III. A capacidade de marcha com ou sem auxílio variou nos estudos.
Os achados topográficos encontrados nas pesquisas, em ordem de predominância, foram a tetraplegia, hemiplegia e diplegia/paraplegia. A apresentação motora que mais ocorreu foi a PC espástica uni e bilateral, com maior incidência de ocorrência na fase perinatal.
Uma das investigações17 realizou a associação entre a fase da lesão e o diagnóstico motor, com resultados significativos. A fase pré-natal associou-se com a espasticidade bilateral (48,9%). A fase perinatal associou-se com a espasticidade unilateral (85,7%), mista (50%) e atáxica (53,8%). Com relação à fase pós-natal, a associação foi com sujeitos que possuem um diagnóstico de discinesia (60%). A hipotonia não se associou com nenhuma fase, mas ocorreu de forma equilibrada nas três fases. Esses dados são de extrema relevância e demonstram que pode haver associação entre o período de lesão no encéfalo imaturo e a topografia motora apresentada pelas crianças com PC.
Corroborando com os achados nesta pesquisa, Frank et al.49 também encontraram o fator perinatal com maior ocorrência em crianças com PC, onde 36,8% das crianças nascidas a termo (37 – 40 sem) desenvolveram tetraplegia espástica ou discinética, e o nível de GMFCS mais encontrado foi IV e V nas crianças de diferentes idades gestacionais.
Um estudo realizado no Paquistão foi ao encontro dos dados aqui apresentados, onde a asfixia perinatal foi a fase e a lesão mais encontradas, mas foi associada à tetraplegia espástica na maioria dos relatos encontrados (53,9%), seguida da diplegia espástica (18%)38. Ainda, no mesmo estudo, foram encontrados dados diferentes dos aqui apresentados, onde como alteração pós-natal foram encontradas as sequelas pós-meningíticas, associadas com a tetraplegia espástica na maioria pacientes, seguidas de acidente vascular cerebral isquêmico e sangramento intracraniano. Outro trabalho realizado na Índia revelou um padrão semelhante de fase da lesão e de apresentação motora57.
Ainda, o acidente vascular cerebral isquêmico (AVCi) na fase perinatal é uma das principais causas de PC, tendo como causa predominante a oclusão de uma artéria cerebral, mais frequentemente a artéria cerebral média (ACM), causando a encefalopatia hipóxico isquêmica. A oclusão proximal da ACM pode incluir as artérias lentículo-estriadas laterais, que suprem as principais estruturas dos gânglios da base, incluindo o putâmen e o caudado. Já as oclusões distais de ACM além das artérias lenticuloestriadas limitam os danos à substância branca regional e ao córtex. Mais raramente, as artérias lenticuloestriadas sozinhas podem ser lesadas isoladamente. Outro acometimento da ACM pode resultar no infarto venoso periventricular (IVP), oriundo de uma hemorragia da matriz germinal fetal que leva a um infarto venoso secundário antes de 32 semanas de gestação, danificando apenas a substância branca periventricular, poupando a substância cinzenta cortical e subcortical58. Essas lesões perinatais estão intimamente relacionadas à PC hemiparética espástica59-64. Garfinkle et al65. revisaram a gravidade da PC ocorrida após encefalopatia neonatal no Registro Canadense de Paralisia Cerebral, encontrando a fase perinatal com maior ocorrência para a PC, onde das 147 crianças nascidas a termo com PC, 41% tinham a suspeita de asfixia ao nascer, onde, assim como nessa pesquisa, o GMFCS V e a quadriplegia espástica foram mais encontrados.
Ainda, esse mesmo estudo apontou que a quantidade de lesões bilaterais profundas da substância cinzenta em pesquisas de ressonância magnética (MRI), foram maiores em crianças com suspeita de lesão na fase perinatal, sendo ela a asfixia no nascimento, ou com encefalopatia neonatal e PC do que naqueles sem suspeita de asfixia no parto. Essas crianças apresentaram maior incidência de tetraparesia e outras comorbidades, sendo os tipos de lesões mais graves. Já os dados sobre as lesões na substância branca e/ou lesões corticais de ressonância magnética não mostraram diferenças entre os grupos de lesão na fase peri ou pós-natal. A quadriplegia espástica tem limitações funcionais significativas, com outras comorbidades associadas (déficit cognitivo, epilepsia, deficiência visual59, 60, 66, 67, 68.
Outro artigo encontrou a diplegia espástica em 35% das crianças com PC, que, segundo esse estudo, é o tipo clínico mais comum da PC60,66, 67,69,70. A diplegia espástica é decorrente de dano à oligodendroglia imatura entre 20 e 34 semanas de gestação, causando alterações na via motora corticoespinal e na via tálamo-cortical 59,60,71. O achado neuropatológico mais comum observado na neuroimagem é a leucomalácia periventricular59,60,71. A maioria das crianças com diplegia espástica terá a função cognitiva normal e um bom prognóstico para marcha independente.
Por último, encontrou-se com menor predominância a PC dos tipos discinética, atáxica, hipotônica e mista. A PC extrapiramidal compreende 15% dos casos de PC60, 66, 69, 70, 71, onde a maioria dos casos é observada em crianças nascidas a termo, com forte associação com a encefalopatia hipóxico-isquêmica, kernicterus, distúrbio neurometabólico ou neurogenético59, 60, 71.
Essas crianças têm maior incidência de comorbidades associadas (déficit cognitivo, epilepsia, alterações comportamentais e do sono, déficit sensorial, visual ou auditivo59, 66, 67, 69, 71,72. Tais condições são decorrentes de lesões graves nos gânglios da base, com alterações no tônus axial e dos membros, movimentos voluntários e visão, desenvolvendo PC grave sem sentar independente.
Conclusão
Percebe-se, através da presente pesquisa, que os dados brasileiros estão próximos aos encontrados nos demais países em desenvolvimento, mas ainda distantes dos países desenvolvidos.
As questões sociodemográficas e o acesso à saúde pelas famílias mais vulneráveis são questões relevantes que afetam as populações em risco social, sendo essas as Pessoas com Deficiência (PCD).
As informações levantadas neste estudo podem contribuir para o monitoramento, comparação e entendimento da epidemiologia da PC no Brasil.
REFERÊNCIAS
- Rosenbaum P, Paneth N, Leviton A, et al. Um relatório: a definição e classificação da paralisia cerebral Abril de 2006. Dev Med Child Neurol Suppl. 2007; 109:8–14. [PubMed: 17370477].
- Pereira KRG, Valentini NC, Saccani R. Brazilian infant motor and cognitive development: Longitudinal influence of risk factors. Pediatr Int. 2016; 58(12):1297-1306.
- Odding E, Roebroeck ME, Stam HJ. The epidemiology of cerebral palsy: incidence, impairments and risk factors. Disabil Rehabil. 2006;28(4):183-91.
- Oskoui M, Coutinho F, Dykeman J, Jetté N, Pringstheim T. An update on the prevalence of cerebral palsy: a systematic review and meta-analysis. Dev Med Child Neurol. 2013;55(6):509-19.
- Relatório mundial sobre a deficiência / World Health Organization, The World Bank ; tradução Lexicus Serviços Lingüísticos. – São Paulo : SEDPcD. 334 p. 2012.
- Himmelmann K, Ahlin K, Jacobsson B, Cans C, Thorsen P. Risk factors for cerebral palsy in children born at term. Acta Obstet Gynecol Scand. 2011;90(10):1070-81.
- Fahey MC, MacLennan AH, Kretzschmar D, Gecz J, Kruer MC. The genetic basis of cerebral palsy. Dev Med Child Neurol. 2017;59(5):462-9.
- Robertson NJ, Faulkner S, Fleiss B, Bainbridge A, Andorka C, Price D, et al. Melatonin augments hypothermic neuroprotection in a perinatal asphyxia piglet model. Brain. 2013;136(Pt 1):90-105.
- Robertson NJ, Tan S, Groenendaal F, van Bel F, Juul SE, Bennet L, et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant? J Pediatr. 2012;160(4):544-52.e4.
- Cavalcante VMV, Martins MC, OriáII MOBI, Ximenes LB, FrotaV MA, Carvalho ZMF. Perfil epidemiológico das crianças com paralisia cerebral em atendimento ambulatorial. Rev enferm UERJ, Rio de Janeiro, 2017; 25:e8780. 10.12957/reuerj.2017.8780.
- Peixoto MVS, Duque AM, Carvalho S, Gonçalves TP, Novais APS, Nunes MAP. Características epidemiológicas da paralisia cerebral em crianças e adolescentes em uma capital do nordeste brasileiro. Fisioter Pesqui. 2020;27(4):405-412. DOI: 10.1590/1809-2950/20012527042020.
- Lima BDS, Silveira MS, Silva SSC. Características clínico-sociodemográficas de crianças com paralisia cerebral em cidades paraenses. Revista Psicologia e Saúde, v. 13, n. 4. 2021, p. 77-89. doi: http://dx.doi.org/10.20435/pssa. v13i4.1255.
- Felice TMN, Santos JLF, Pfeifer LI. Estudo retrospectivo de fatores de risco materno, pré e perinatal para paralisia cerebral na rede pública de saúde Medicina (Ribeirão Preto. Online) 2019;52(3):179-91. doi:10.11606 /issn.2176-7262.
- Silva AR, Tavares MRS, Filgueira VGB, Silva AR. Análise do perfil clínico de crianças com paralisia cerebral atendidas em uma clínica escola. Revista Científica multidisciplinar núcleo do conhecimento. Juazeiro do Norte (CE) BR. 2020.
- Santos NSC, Moreira LC, Almeida ML, Silva GG, Franciulli PM. Perfil epidemiológico dos pacientes com paralisia cerebral atendidos na clínica de fisioterapia da Universidade São Judas Tadeu. Rev. Bras. Ciênc. Biomed. v. 2, 1-7, 2021. doi: 10.46675/rbcbm.v1i3.41.
- Vieira JLR, Chagas JRLP. perfil funcional e sócio demográfico dos pacientes com paralisia cerebral em reabilitação num centro de referência em Salvador. Revista Brasileira de Neurologia e Psiquiatria. 2017 Maio/Ago;21(2):100-108.
- Herther DS, Gerzson LR, Almeida CS. Fase da lesão cerebral e o diagnóstico cinético-funcional de sujeitos com paralisia cerebral. Conscientia e Saúde 2019;18(3):352-365. doi: 10.5585/ConsSaude.v18n3 14176
- Binha AMP, Maciel SC, Bezerra CCA. Perfil epidemiológico dos pacientes com paralisia cerebral atendidos na AACD – São Paulo. Acta Fisiatr. 2018;25(1):1-6.
- Favrais, G., Tourneux, P., Lopes, E., Durrmeyer, X., Gascoin, G., Ramful, D., Zana-Taieb, E., & Baud, O. (2014). Impact of common treatments given in the perinatal period on the developing brain. Neonatology, 106(3), 163-172. doi: 10.1159 / 000363492.
- García P, San Feliciano L, Benito F, García R, Guzmán J, Salas S, et al. Evolución a los 2 años de edad corregida de una cohortede recién nacidos con peso inferior o igual a 1.500 g de los gru-pos pertenecientes a la red neonatal SEN1500. An Pediatr (Barc). 2013;79(5):279-87.
- Agut T, Póo P, Launes C, Auffant M, Iriondo M. Incidence of cerebral palsy in a cohort of preterm infants with a gestational age of less than 28 weeks. An Pediatr (Barc). 2015;82(1):49-50.
- Gozdas, E., Parikh, N. A., Merhar, S. L., Tkach, J. A., He, L., & Holland, S.K. (2018). Altered functional network connectivity in preterm infants: antecedents of cognitive and motor impairments? Brain Structure and Function, 223(8), 3665-3680. doi: 10.1007 / s00429-018-1707-0.
- Spittle, A. J., Morgan, C., Olsen, J. E., Novak, I., & Cheong, J. L. Y. (2018). Early diagnosis and treatment of cerebral palsy in children with a history of preterm birth. Clinics in Perinatalogy, 45(3), 409-420. doi: 10.1016 / j.clp.2018.05.011.
- Volpe, J. J. (2019). Dysmaturation of Premature Brain: Importance, Cellular Mechanisms, and Potential Interventions. Pediatric Neurology, 95, 42-66. Doi: 10.1016/j.pediatrneurol.2019.02.016.
- Sewell MD, Eastwood DM, Wimalasundera N. Managing common symptoms of cerebral palsy in children. BMJ. 2014;349:g5474.
- DOUGLAS-ESCOBAR, M.; WEISS, M. D. Hypoxic-Ischemic Encephalopathy: a review for the clinician. JAMA Pediatrics, v. 169, n. 4, p. 397, 1 abr. 2015.
- Almeida AC, Jesus ACP, Lima PFT, Araújo MFM, Araújo TM. Fatores de risco maternos para prematuridade em uma maternidade pública de Imperatriz- MA. Revista Gaúcha de Enfermagem. 2012; 33(2):86-94.
- Ferreira RC, Alves CRL, Guimarães MAP, Menezes KKP, Magalhães LC. Effects of early interventions focused on the family in the development of children born preterm and/or at social risk: a meta‐analysis. J Pediatr (Rio J). 2020; 96(1):20-38.
- Quinn J, Munoz FM, Gonik B, Frau L, Cutland C, Mallett-Moore T, Kissou A, Wittke F, Das M, Nunes T, Pye S, Watson W, Ramos AA, Cordero JF, Huang W, Kochhar S, Buttery J, The Brighton Collaboration Preterm Birth Working Group. Preterm birth: Case definition & guidelines for data collection, analysis,and presentation of immunisation safety data. Vaccine. 2016; 34(49):6047- 6056.
- Leal MD, Esteves-Pereira AP, Nakamura-Pereira M, Torres JA, Theme-Filha M, Domingues RM, et al. Prevalence and risk factors related to preterm birth in Brazil. Reprod Health. 2016;13(3):127.
- Bassan H, Feldman HA, Limperopoulos C, Benson CB, Ringer SA, Veracruz E, Soul JS, Volpe JJ, du Plessis AJ. Periventricular hemorrhagic infarction: risk factorsand neonatal outcome. Pediatr Neurol. 2006;35(2):85–92. doi: 10.1016/j.pediatrneurol.2006.03.005.
- Namazzi G, Hildenwall H, Mubiri P, Hanson C, Nalwadda C, Nampijja M, Kakooza-Mwesige A, Waiswa P, Tumwine J. Prevalence and associated factors of neurodevelopmental disability among infants in eastern Uganda: a population TRUBIAN et al. 588 R bras ci Saúde 25(3):579-588, 2021 based study. BMC pediatr (Online). 2019; 19(1):379-389.
- PATRA K, Greene MM, Patel AL, Meier P. Maternal Education Level Predicts Cognitive, Language, and Motor Outcome in Preterm Infants in the Second Year of Life. Am J Perinatol. 2016;33(8):738-44. doi: 10.1055/s-0036-1572532.
- Ferreira LM, Santos VB, Pessoa PB, Silva OS, Sousa SMB, Silva LM. Análise dos Fatores de Risco Para Desenvolvimento de Encefalopatia Crônica Não Progressiva. R bras ci Saúde. 2015;19(2):129-34.
- BRAUN SVM, Nascimento RG, Pires SMAM, Cunha KC, Silva SSC. Práticas de cuidado de mães de crianças com paralisia cerebral. Mudanças – Psicologia da Saúde, 29 (1) 1-8, Jan.-Jun., 2021.
- Lima, M. B. S. (2016). Estresse Parental de cuidadores de crianças com paralisia cerebral no Estado do Pará. Tese de Doutorado apresentada ao Programa de Pós-graduação em Teoria e Pesquisa do Comportamento, Núcleo de Teoria e Pesquisa do Comportamento, Universidade Federal do Pará.
- Salvagni K, Gerzson L, Almeida CS, Avaliação do desenvolvimento motor de recém-nascidos. Rev Ter Ocup Univ São Paulo. 2020 maio/ago.;30(2):77-85.
- Theis RCSR, Gerzson LR, de Almeida CS. A atuação do profissional fisioterapeuta em unidades de terapia intensiva neonatal . Cinergis, Santa Cruz do Sul, 17(2):pág, abr./jun. 2016.
- Byrne R, Noritz G, Maitre NL; NCH Early Developmental Group. Implementation of Early Diagnosis and Intervention Guidelines for Cerebral Palsy in a High-Risk Infant Follow-Up Clinic. Pediatr Neurol. 2017 Nov;76:66-71. doi: 10.1016/j.pediatrneurol.2017.08.002.
- Kun-Long H. Epilepsy Comorbidity in Children with Cerebral Palsy. Epilepsy J 4: 1000e117, 2018. doi:10.4172/2472-0895.1000e117.
- Gulati, S., Sondhi, V. Cerebral Palsy: An Overview. Indian J Pediatr 85, 1006–1016 (2018). https://doi.org/10.1007/s12098-017-2475-1.
- Cooper MS, Mackay MT, Fahey M, Reddihough D, Reid SM, Williams KA, Harvey S. Convulsões em Crianças com Paralisia Cerebral e Lesão da Substância Branca. Pediatria março de 2017; 139 (3): e20162975. 10.1542/peds.2016-2975.
- Novak I, Hines M, Goldsmith S, Barclay R. Clinical prognostic messages from a systematic review on cerebral palsy. Pediatrics. 2012;130:e1285–312.
- Ayubi E, Sarhadi S, Mansori K. Maternal Infection During Pregnancy and Risk of Cerebral Palsy in Children: A Systematic Review and Meta-analysis. J Child Neurol. 2021;36(5):385-402. doi: 10.1177/0883073820972507.
- Chen D, Huang M, Yin Y, Gui D, Gu Y, Zhuang T, Chen C, Huo K. Risk factors of cerebral palsy in children: a systematic review and meta-analysis. Transl Pediatr. 2022;11(4):556-564. doi: 10.21037/tp-22-78.
- Biscaia, S. K., & Vieira, F. D. S. F. (2022). Riscos diagnosticados durante o período gestacional: pré natal em uma cidade do interior do Paraná. Revista Universitas da Fanorpi, 4(8), 165-180.
- MINISTÉRIO DA SAÚDE, Manual de gestação de alto risco. Brasília, 2022. Disponível em: <https://portaldeboaspraticas.iff.fiocruz.br/atencao-mulher/manual-de-gestacao-de-alto-risco-ms-2022/>. Acesso em 08 de Janeiro de 2023.
- Khan SA, Talat S, Malik MI. Fatores de risco, tipos e achados de neuroimagem em crianças com paralisia cerebral. Pak J Med Sci. 2022;38(7):1738-1742. doi:10.12669/pjms.38.7.6175.
- Frank R, Garfinkle J, Oskoui M, Shevell MI. Clinical profile of children with cerebral palsy born term compared with late- and post-term: a retrospective cohort study. BJOG. 2017;124(11):1738-1745. doi: 10.1111/1471-0528.14240.
- Ream, M. A., & Lehwald, L. (2018). Neurologic Consequences of Preterm Birth. Current Neurology and Neuroscience Reports, 18(8). doi:10.1007/s11910-018-0862-2.
- Chevallier M, et al. Leading causes of preterm delivery as risk factors for intraventricular hemorrhage in very preterm infants: results of the EPIPAGE 2 cohort study. Am J Obstet Gynecol. 2017;216(5): 518.e1–518.e12. This large multicenter population-based study in France provided multiple important observations.
- Gamaleldin I, Harding D, Siassakos D, Draycott T, Odd D. Significant intraventricular hemorrhage is more likely in very preterm infants born by vaginal delivery: a multi-centre retrospective cohort study. J Matern Fetal Neonatal Med. 2017:1–6.
- Stangenes KM, Fevang SK, Grundt J, Donkor HM, Markestad T, Hysing M, et al. Children born extremely preterm had different sleeping habits at 11 years of age and more childhood sleep problems than term-born children. Acta Paediatr. 2017;106(12):1966–72.
- Wang LW, Lin YC, Wang ST, Yeh TF, Huang CC. Hypoxic/ischemic and infectious events have cumulative effects on the risk of cerebral palsy in very-low-birth-weight preterm infants. Neonatology. 2014;106(3):209-15. doi: 10.1159/000362782.
- Smith, D. D., Sagaram, D., Miller, R., & Gyamfi-Bannerman, C. (2018). Risk of cerebral palsy by gestational age among pregnancies at-risk for preterm birth. The Journal of Maternal-Fetal & Neonatal Medicine, 1–11. doi:10.1080/14767058.2018.1536745.
- Karimzadeh P, Fallahi M, Kazemian M, Taslimi Taleghani N, Nouripour S, Radfar M. Bilirubin Induced Encephalopathy. Iran J Child Neurol. 2020 Winter;14(1):7-19.
- Chauhan A, Singh M, Jaiswal N, Agarwal A, Sahu JK, Singh M. Prevalência de paralisia cerebral em crianças indianas: uma revisão sistemática e meta-análise. Indian J Pediatr. 2019; 86 (12):12–1124.
- Hassett J, Carlson H, Babwani A, Kirton A. Alterações bihemisféricas do desenvolvimento nos volumes dos gânglios da base após acidente vascular cerebral perinatal unilateral. Neuroimagem Clin. 2022;35:103143. doi:10.1016/j.nicl.2022.103143.
- Colver A, Fairhurst C, Pharoah PO. Paralisia cerebral. Lancet 2014;383:1240-9. doi:10.1016/S0140-6736(13)61835-8.
- Graham HK, Rosenbaum P, Paneth N, et al. Paralisia cerebral. Nat Rev Dis Primers 2016; 2 :15082. 10.1038/nrdp.2015.82.
- Himmelmann K. Crianças e jovens com paralisia cerebral complexa: cuidados e gestão. Editado por Laurie J. Glader, Richard D. Stevenson. Londres: Mac Keith Press, 2019, pp 384. ISBN: 978-1-909962-98-9. Acta Paediatr 2019.
- Liptak GS, Murphy NA, Conselho de Crianças com Deficiência. Fornecer um lar médico de cuidados primários para crianças e jovens com paralisia cerebral. Pediatria 2011; 128:e1321-9. doi: 10.1542/peds.2011-1468.
- Korzeniewski SJ, Slaughter J, Lenski M, et al. A complexa etiologia da paralisia cerebral. Nat Rev Neurol 2018; 14:528-43. 10.1038/s41582-018-0043-6.
- Oskoui M, Shevell MI, Swaiman KF. Paralisia cerebral. In: Swaiman KF, Ashwal S, Ferriero DM, et al. editores. Neurologia pediátrica: princípios e prática. 6ª ed. Filadélfia: Elsevier, 2017:e1660-72.
- Garfinkle J , Winetrmark P , Shevel MI , Oskoui M , Em nome do Registro Canadense de Paralisia Cerebral . Paralisia cerebral após encefalopatia neonatal: neonatos com suspeita de asfixia têm piores resultados? Dev Med Child Neurol2016 ; 58 : 189 – 94.
- Johnston MV. Paralisia cerebral. Em: Kliegman RM, St Geme III JW, Blum NJ, et al. editores. Nelson livro de pediatria. 21ª ed. Filadélfia: Elsevier, 2020:3168-72.
- Johnson TL, Chin EM, Hoon AH. Paralisia cerebral. In: Batshaw ML, Roizen NJ, Pellegrino L. editores. Crianças com deficiência. 8ª ed. Baltimore: Paul Brookes, 2019:423-56.
- Liptak GS, Murphy NA, Conselho de Crianças com Deficiência. Fornecer um lar médico de cuidados primários para crianças e jovens com paralisia cerebral. Pediatria 2011; 128 :e1321-9. 10.1542/peds.2011-1468.
- Centro Nacional de Defeitos Congênitos e Deficiências de Desenvolvimento, Centros de Controle e Prevenção de Doenças. Dados e estatísticas para paralisia cerebral. Disponível online: https://www.cdc.gov/ncbddd/cp/data.html.
- Michael-Asalu A, Taylor G, Campbell H, et al. Paralisia cerebral: diagnóstico, epidemiologia, genética e atualização clínica. Adv Pediatr 2019; 66 :189-208. 10.1016/j.yapd.2019.04.002.
- Korzeniewski SJ, Slaughter J, Lenski M, et al. A complexa etiologia da paralisia cerebral. Nat Rev Neurol 2018; 14 :528-43. 10.1038/s41582-018-0043-6. Himmelmann K. Crianças e jovens com paralisia cerebral complexa: cuidados e gestão. Editado por Laurie J. Glader, Richard D. Stevenson. Londres: Mac Keith Press, 2019, pp 384. ISBN: 978-1-909962-98-9. Acta Paediatr 2019.
¹Mestranda pelo Programa de Pós Graduação em Ciências do Desenvolvimento Humano – Universidade do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
ORCID: 0000-0002-4995-3086
2Mestranda pelo Programa de Pós Graduação em Ciências do Desenvolvimento Humano – Universidade do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
ORCID: 0000-0003-3184-5869
3Doutora pelo programa de Pós-Graduação em Saúde da Criança e do Adolescente da Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
ORCID: 0000-0002-0911-9820
4PhD Universidade de Barcelona (UB), docente da Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
ORCID: 0000-0003-1271-2876
