FARMANGUINHOS AND THE PUBLIC PRODUCTION OF TUBERCULOSIS DRUGS:
REGISTRO DOI:10.5281/zenodo.12637064
Silvia Pereira da Silva Santos1
Jorge Souza Mendonça2
Wanise Borges Gouvea Barroso3
Resumo
O Instituto de Tecnologia em Fármacos – Farmanguinhos é um dos mais importantes laboratórios públicos oficiais, e atende às diversas demandas do Ministério da Saúde. O Instituto consiste em uma unidade técnico-científica da Fundação Oswaldo Cruz – Fiocruz e produz medicamentos destinados ao tratamento de doenças negligenciadas, além de fornecer medicamentos de alto valor agregado provenientes de Parcerias para o Desenvolvimento Produtivo – PDP. O Instituto tem um papel fundamental na produção de medicamentos e em outras áreas cruciais para a saúde pública, tais como: pesquisa, educação, inovação, desenvolvimento tecnológico e assimilação de tecnologias avançadas, contribuindo com a promoção da saúde e o avanço científico no país. Dentre os produtos do portfólio de Farmanguinhos, destacam-se os medicamentos utilizados para o tratamento de doenças endêmicas, como malária e tuberculose (TB). O Brasil, por ser considerado um dos países com maior número de casos de tuberculose no mundo, desde 2003, passou a enfrentar a doença como prioridade na agenda política do Ministério da Saúde. Embora a TB seja uma doença com diagnóstico e tratamento realizados de forma universal e gratuita pelo Sistema Único de Saúde (SUS), somente no ano de 2021 foram notificados 68.271 novos casos no Brasil. Atualmente, o Brasil se encontra entre os países que registram a maior quantidade de casos da doença por ano, sendo importante o investimento de políticas de saúde que possibilitem a vigilância, o diagnóstico rápido e assertivo e o tratamento adequado através dos medicamentos disponibilizados pelo SUS. O objetivo deste artigo é apresentar a comparação entre os medicamentos registrados na Anvisa pelo Instituto e aqueles listados na RENAME, de modo a auxiliar na regulação de mercado, contribuindo para o desenvolvimento tecnológico e econômico, fortalecendo assim o Complexo Econômico e Industrial da Saúde (CEIS).
Palavras-chave: Farmanguinhos. Tuberculose. Produção pública. Medicamentos. SUS.
ABSTRACT
The Instituto de Tecnologia em Fármacos – Farmanguinhos is one of the most important official public laboratories, addressing various demands of the Ministry of Health. The Institute is a technical-scientific unit of the Fundação Oswaldo Cruz – Fiocruz, and it produces medications for the treatment of neglected diseases and provides high-value-added medications from Productive Development Partnerships – PDP. The Institute plays a fundamental role in the production of medications and other crucial areas for public health, such as research, education, innovation, technological development, and the assimilation of advanced technologies, contributing to the promotion of health and scientific advancement in the country. Among the products in Farmanguinhos’ portfolio, the medications used for the treatment of endemic diseases, such as malaria and tuberculosis (TB), stand out. Since 2003, Brazil, being considered one of the countries with the highest number of tuberculosis cases in the world, has prioritized the disease on the political agenda of the Ministry of Health. Although TB is a disease with diagnosis and treatment provided universally and free of charge by the Unified Health System (SUS), 68,271 new cases were reported in Brazil in 2021. Brazil is among the countries that record the highest number of TB cases per year, making it important to invest in health policies that enable surveillance, rapid and accurate diagnosis, and adequate treatment through medications provided by SUS. The objective of this article is to present a comparison between the medications registered with Anvisa by the Institute and those listed in RENAME, in order to assist in market regulation, contributing to technological and economic development, thus strengthening the Health Economic and Industrial Complex (CEIS).
Keywords: Farmanguinhos. Tuberculosis. Public production. Drug. SUS.
1 INTRODUÇÃO
O Instituto de Tecnologia em Fármacos (Farmanguinhos) desempenha um papel de extrema relevância no cenário de saúde pública no Brasil. Criado com a missão de desenvolver tecnologias de produção, adaptar tecnologias transferidas e elaborar produtos quimioterápicos e profiláticos para atender às necessidades dos programas de saúde e às exigências da Segurança Nacional, Farmanguinhos foi criado em 1976 como laboratório, sendo posteriormente, elevado à condição de Instituto (FIOCRUZ, 2021).
Farmanguinhos, considerado um dos mais importantes laboratórios públicos oficiais, opera de maneira abrangente, atendendo às diversas demandas do Ministério da Saúde (MS). Como uma unidade técnico-científica vinculada à Fundação Oswaldo Cruz (Fiocruz), o Instituto se destaca não apenas na produção de medicamentos destinados ao tratamento de doenças negligenciadas, mas também no fornecimento de medicamentos de alto valor agregado, provenientes de Parcerias para o Desenvolvimento Produtivo (BRASIL, 2023).
O conjunto dos Laboratórios Farmacêuticos Oficiais (LFO) é uma característica da indústria farmacêutica brasileira, que possui um parque público de laboratórios voltados para a produção de medicamentos a nível nacional. Essa produção contribui para minorar o problema de suprimento de determinados medicamentos e para reduzir os custos dos programas públicos de saúde, seja pela oferta de medicamentos a preços reduzidos, seja pelo efeito indutor e regulatório que exercem sobre os preços privados. (GADELHA, QUENTAL, FIALHO, 2003; OLIVEIRA et al., 2007).
Os LFO fazem parte do complexo industrial farmacêutico do Brasil, sendo parte integrante do SUS, constituindo recursos estratégicos para promoção do acesso da população a medicamentos de que ela necessita (GOMES, CHAVES, NINOMYA, 2008, DIAS SANTIAGO, 2015).
Os LFO são fundamentais para a estabilização dos preços de medicamentos no mercado nacional bem como para a produção de medicamentos para doenças negligenciadas, tendo em vista a falta de interesse dos laboratórios privados para estes fármacos. A produção desses medicamentos representa baixa lucratividade, justificando a falta de interesse por parte dos laboratórios privados (HASENCLEVER, 2003).
É importante ressaltar que além de seu papel fundamental na produção farmacêutica, Farmanguinhos desempenha um papel significativo em outras áreas cruciais a soluções multiformes para a saúde pública, como pesquisa, educação, inovação, desenvolvimento tecnológico e assimilação de tecnologias avançadas. Isso reflete um compromisso abrangente com a promoção da saúde nacional e o avanço científico no país (FIOCRUZ, 2024).
Entre os medicamentos registrados e fabricados por Farmanguinhos, tem-se aqueles utilizados para o tratamento de doenças endêmicas, como malária e tuberculose, além de medicamentos antirretrovirais que compõem o portfólio do Instituto. Além destes, tem-se no portfólio, medicamentos objetos das Parcerias para o Desenvolvimento Produtivo (PDP) e de Acordos de Cooperação Técnica (FIOCRUZ, 2024).
Um exemplo notável do impacto de Farmanguinhos pode ser evidenciado pelo seu desempenho em 2022, quando forneceu mais de 520 milhões de unidades farmacêuticas ao Sistema Único de Saúde (SUS). Adicionalmente, concluiu com sucesso a absorção tecnológica do medicamento tuberculostático 4 em 1 (Rifampicina 150 mg + Isoniazida 75 mg + Etambutol 275 mg + Pirazinamida 400 mg), resultado de uma parceria estratégica com a farmacêutica indiana Lupin. Esse marco é particularmente relevante, pois contribui significativamente para o tratamento eficaz da tuberculose no Brasil (BRASIL, 2023).
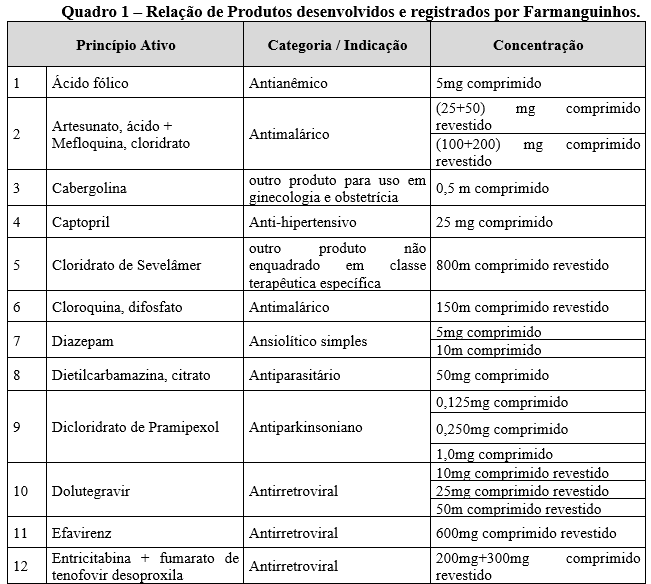
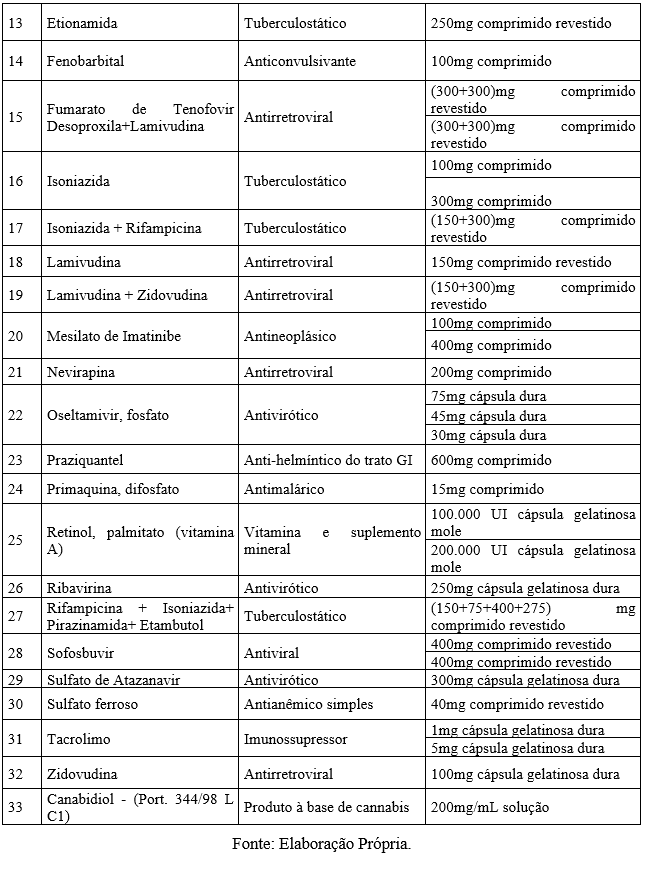
Para demonstrar de maneira concreta a capacidade e a competência tecnológica de Farmanguinhos no desenvolvimento, registro e produção de medicamentos em diversas classes terapêuticas, apresenta-se a seguir o Quadro 1 que lista os 33 medicamentos registrados na Agência Nacional de Vigilância Sanitária (Anvisa) por Farmanguinhos. Este Quadro 1 descreve detalhadamente o nome dos princípios ativos (Insumos Farmacêuticos Ativos (IFA), a categoria/indicação e a dosagem dos medicamentos registrados por Farmanguinhos.
2. TUBERCULOSE
A TB pode ser causada por qualquer uma das sete espécies que integram o complexo Mycobacterium tuberculosis (Mtb): M. tuberculosis, M. bovis, M. africanum, M. canetti, M. microti, M. pinnipedi e M. caprae, sendo a M. tuberculosis, conhecida também como bacilo de Koch (BK), a espécie mais importante (WHO, 2022).
A transmissão ocorre por via aérea de uma pessoa com TB pulmonar ou laríngea, que elimina bacilos no ambiente (caso fonte) a outra pessoa, por exalação de aerossóis oriundos da tosse, fala ou espirro (BRASIL, 2017).
A doença geralmente afeta os pulmões (TB pulmonar), podendo acometer outras partes do organismo (TB extrapulmonar). Com isso, estima-se que um quarto da população mundial é infectada com M. tuberculosis (WHO, 2022).
Dados do relatório global TB 2021 da OMS (WHO, 2022), apontam que a pandemia de COVID-19 reverteu anos de progresso global no combate à tuberculose, aumentando o número de mortes por TB, pela primeira vez, em mais de uma década. Registra-se que, em 2020, houve aumento do número de óbitos causados por TB, com redução de pessoas sendo diagnosticadas e tratadas ou recebendo tratamento preventivo de TB comparados aos dados de 2019, incluindo os gastos gerais com serviços essenciais de TB. A alocação de recursos em resposta ao COVID-19 teria limitado a disponibilidade de serviços essenciais ao combate à tuberculose (WHO, 2022)
Em 2014, durante a Assembleia Mundial de Saúde, na Organização Mundial da Saúde (OMS), foi aprovada a nova estratégia global para o enfrentamento da tuberculose, com a visão de um mundo livre da tuberculose até 2035. Em 2015, por sua vez, com a divulgação do End TB Strategy, a OMS incluiu dentre suas metas a redução de 95% da incidência de tuberculose no Planeta até 2030. Para alcançar a ousada meta, certo é que, além de depender do diagnóstico e tratamento precoce da doença ativa, visando interromper a cadeia de transmissão do Mycobacterium tuberculosis, é preciso priorizar também a prevenção (LÖNNROTH et al., 2010; WHO, 2022).
No Brasil, o Plano Nacional pelo Fim da Tuberculose como Problema de Saúde Pública, proposto pelo Ministério da Saúde, também tem entre suas prioridades o tratamento preventivo da tuberculose (WHO, 2022; BRASIL, 2017). O maior país latino-americano teve o papel de destaque global ao ser o principal proponente da estratégia de tratamento, sobretudo por conta de sua experiência com o complexo sistema de saúde (SUS) e com sua rede de pesquisas em Tuberculose (Rede-TB).
Mesmo com os avanços conquistados, torna-se imperioso, reforçar as políticas públicas de acesso da população aos medicamentos e realizar estudos que possibilitem acompanhar de forma prospectiva o desenvolvimento de novos medicamentos para o tratamento da tuberculose, os quais poderão contribuir para a redução das taxas de contaminação e o aumento da cura da doença, além de permitir a alocação estratégica de recursos de forma mais efetiva em produtos promissores.
3 TRATAMENTO MEDICAMENTOSO DA TUBERCULOSE NO BRASIL
O medicamento é a terapêutica mais utilizada no processo saúde-doença na medicina ocidental, sendo apontado como fator relevante para a saúde das pessoas e utilizado pela ciência para interromper ou modificar o curso natural das doenças, assim como preveni-las ou reduzir seus sintomas, reforçando a necessidade de seu acesso (ABAJO, 2001; OLIVEIRA et al, 2007; DIAS SANTIAGO, 2015).
Com o entendimento de que os medicamentos são bens de consumo, do ponto de vista econômico, eles possuem particularidades que os fazem específicos em relação a outros produtos industrializados. Como bens de saúde, constituem o recurso médico e terapêutico mais frequentemente utilizado, significando que deficiências na produção, circulação e consumo dessas mercadorias podem ter um impacto negativo na saúde de determinada população (TOBAR, 2008).
Por ser a tuberculose uma doença curável, após a realização do tratamento, mister é a necessidade de investimentos em formas de prevenção. O tratamento medicamentoso da tuberculose ocorre, geralmente, em um regime de 6 (seis) meses e, caso não haja aderência ao mesmo, a doença pode retornar, tornando a recuperação do paciente mais complicada (BRASIL, 2019). Os medicamentos empregados no tratamento da doença são denominados medicamentos antituberculose ou tuberculostáticos.
No Brasil, o fornecimento destes produtos é garantido pelo Programa Nacional de Controle da Tuberculose (PNCT) e, não estão disponíveis comercialmente (BRASIL, 2011). O Brasil foi o primeiro país do mundo a padronizar o esquema de 6 meses de tratamento medicamentoso na rede pública de saúde, com todas as drogas administradas via oral e distribuídas gratuitamente (RABAHI et al., 2017). Até hoje, esses medicamentos são amplamente distribuídos na rede pública de saúde e entregues ao paciente mediante a apresentação da ficha de notificação preenchida (BRASIL, 2019).
Desde 1979, o Ministério da Saúde padronizou os esquemas de tratamento da TB, sendo recomendada uma associação de fármacos para diminuir a probabilidade de seleção de bacilos resistentes (ARBEX et al., 2010; BRASIL, 2019).
Os fármacos empregados para o tratamento de TB são divididos em drogas de primeira linha e drogas de segunda linha, sendo ainda distribuídos em cinco grupos. Todas as classificações estão descritas na Tabela 1.
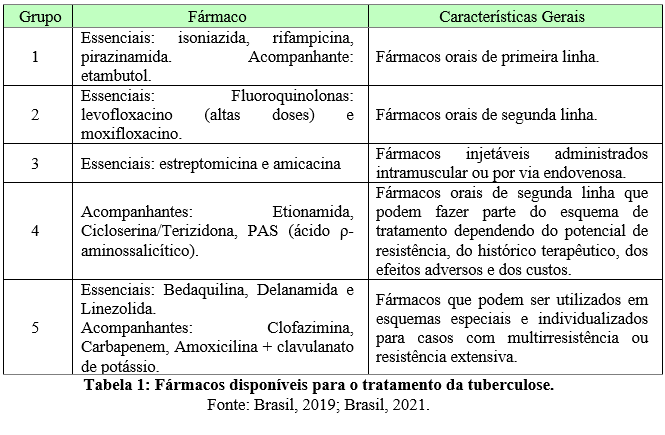
Como mencionado, os fármacos de primeira linha compõem o esquema básico de tratamento, enquanto os de segunda são reservados ao tratamento de tuberculose resistente ou em situações que impossibilitem o uso do esquema básico (BRASIL, 2019; BRASIL, 2011). Na representação gráfica da Figura 1, é possível identificar os medicamentos de primeira e segunda linha.
Figura 1 – Medicamentos de primeira e segunda linhas empregados no tratamento da tuberculose.
Fonte: Elaboração própria (2024).
O tempo de tratamento consiste em 6 meses, dividido em duas fases: fase intensiva ou fase 1 e fase de manutenção ou fase 2. A fase intensiva deve ser de pelo menos 2 meses, enquanto a fase de manutenção deve ser de, pelo menos, 4 meses. O tempo da fase intensiva depende do tipo da TB, doenças associadas e evolução do caso (BRASIL, 2011). O Ministério da Saúde oferece 14 medicamentos para tratamento de tuberculose (BRASIL, 2022) em suas diversas formas de concentração.
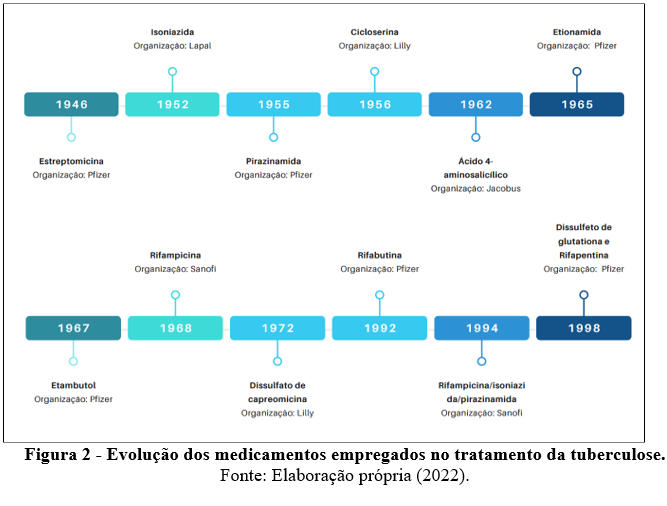
Mesmo sofrendo alterações ao longo dos anos, o tratamento medicamentoso convencional de tuberculose (TB) contempla fármacos utilizados há décadas. A Estreptomicina, o primeiro medicamento usado para o tratamento de TB, foi utilizado em 1946. Depois, outras drogas foram sendo identificados como a Isoniazida, em 1952, a Rifampicina, em 1965, o Etambutol, em 1960 e a Pirazinamida utilizada em 1970 (Nota Informativa 10, PMCT, 2022) (SÃO PAULO, 2022). Com exceção da Estreptomicina, todos ainda compõem o esquema de tratamento para tuberculose no Brasil nos dias de hoje.
Na Figura 2 é possível observar a evolução dos medicamentos empregados no tratamento da tuberculose ao longo dos anos.
O sucesso de um tratamento possui variáveis, dentre elas a completa adesão do paciente ao esquema medicamentoso. Por ser um tratamento longo, a adesão ao tratamento pode ser considerada uma das causas associadas à baixa efetividade. Rabahi e colaboradores (2017) mencionam que a falta de adesão pode ocorrer em três níveis: (i) abandono do tratamento, quando o paciente para de usar os medicamentos; (ii) uso incorreto, quando o paciente usa apenas alguns dos medicamentos ou mesmo quando faz uso irregular, e (iii) quando o paciente toma os medicamentos, mas não cumpre o cronograma diário de administração.
Nesse sentido, visando reduzir ou minimizar os fatores associados ao insucesso, é que, além de recomendações e cuidados sobre o tratamento da tuberculose, a OMS incluiu duas novas recomendações sobre a composição dos regimes terapêutico, trazendo, inclusive, a combinação de novos fármacos (bedaquilina, pretomanida e linezolida) (WHO, 2022).
Diante do contexto complexo e desafiador apresentado, fica evidente a urgente necessidade de investimentos estratégicos em novas ferramentas tecnológicas, sobretudo no desenvolvimento ou redesenvolvimento de fármacos, para enfrentar a tuberculose em escala global, garantindo que as gerações futuras não enfrentem as mesmas dificuldades que ainda persistem nos dias de hoje.
4 RENAME E OS MEDICAMENTOS INDICADOS AO TRATAMENTO DA TUBERCULOSE NO BRASIL
Considerando que a produção pública de medicamentos é direcionada através dos medicamentos que são incorporados ao SUS, é na RENAME que constam os medicamentos indicados ao tratamento da tuberculose e que são distribuídos pelo SUS, consequentemente, sendo passíveis de serem registrados e produzidos por laboratórios oficiais.
A Relação Nacional de Medicamentos – RENAME é o instrumento que cumpre o papel estratégico para as políticas de saúde, cumprindo as diretrizes da Organização Mundial da Saúde (OMS) que orientam os países a estabelecerem uma relação de medicamentos com objetivo de orientar e promover o acesso seguro e racional de tecnologias.
Em 1975, através da publicação da Portaria n.º 233 do Ministério da Previdência e Assistência Social, a lista foi oficializada como Relação Nacional de Medicamentos Essenciais (RENAME). Desde então, a RENAME tem sido publicada e aperfeiçoada como instrumento para garantia do acesso à assistência farmacêutica e para promoção do uso racional de medicamentos. Diversos atos normativos reafirmam a importância dessa estratégia no SUS (BRASIL, 2022).
Um dos maiores desafios para o SUS em manter a RENAME como instrumento promotor do uso racional e como uma lista orientadora do financiamento e acesso a medicamentos no âmbito da Assistência Farmacêutica é investir na sua atualização permanente devido à complexidade das necessidades de saúde da população, a velocidade da incorporação tecnológica e os diferentes modelos de organização e financiamento do sistema de saúde. (BRASIL, 2022)
5 METODOLOGIA
Este estudo consiste em um estudo exploratório para obtenção de dados para a análise de medicamentos empregados no tratamento da tuberculose produzidos por Farmanguinhos comparados aos medicamentos preconizados ao tratamento através da relação nacional de medicamentos (RENAME).
Desta forma, a metodologia a seguir monitora os medicamentos tuberculostáticos registrados na agência reguladora nacional (ANVISA), associando-os aos medicamentos incorporados ao SUS, que constam na RENAME 2022 para o tratamento da doença.
Os dados referentes à produção de Farmanguinhos foram obtidas através de publicação do próprio Instituto, em sítios eletrônicos oficiais, através do seu relatório anual de gestão (ano 2023). Os dados referentes à produção retroativa dos medicamentos do período de 2017 a 2023 foram solicitados ao Instituto que disponibilizou os dados para utilização e publicação.
As buscas nas bases de dados foram realizadas no período de setembro de 2021 a fevereiro de 2024 e considerou-se apenas as informações vigentes.
5.1 ANÁLISE DOS MEDICAMENTOS REGISTRADOS POR FARMANGUINHOS
Para identificação dos medicamentos registrados por Farmanguinhos, realizou-se a busca em duas etapas. A primeira etapa foi realizada a busca a partir do CNPJ da empresa através do link https://consultas.anvisa.gov.br/#/medicamentos/.
Coletou-se apenas os dados dos medicamentos com registros vigentes tendo como detentor de registro de medicamentos, a Fundação Oswaldo Cruz, com do CNPJ: 33.781.055/0001-35. Foram excluídos os medicamentos cancelados e/ou caducos, bem como as vacinas e os kits diagnósticos.
De forma a refinar a busca, para identificar-se os medicamentos tuberculostáticos realizou-se a seguinte busca;
• Acessou-se o link https://consultas.anvisa.gov.br/#/medicamentos/
• No campo Classe Terapêutica buscou-se por “tubercul”. Selecionou-se as marcações “outros medicamentos para o tratamento da tuberculose”, “tuberculostáticos” e “tuberculostáticos e hansenostáticos). Clicou-se em “consultar”. Foram excluídos os medicamentos cancelados e/ou caducos e vacinas.
Coletou-se apenas os dados dos medicamentos com registros vigentes tendo como detentor de registro de medicamentos, a Fundação Oswaldo Cruz, através do CNPJ: 33.781.055/0001-35. Os dados obtidos foram tratados em planilha Excel.
Figura 3: Consulta de medicamentos registrados na ANVISA.
Fonte: Extraído de https://consultas.anvisa.gov.br/#/medicamentos/, 2024.
5.2 ANÁLISE DOS MEDICAMENTOS TUBERCULOSTÁTICOS INCLUÍDOS NA RENAME 2022
Na seleção dos medicamentos tuberculostáticos da lista da RENAME, utilizou-se a última versão vigente da lista, ou seja, a do ano de 2022, disponível no sítio eletrônico do Ministério da Saúde/MS), a partir do endereço eletrônico: https://www.gov.br/saude/pt-br/composicao/sectics/daf/rename/20210367-rename-2022_final.pdf/view
Para o estudo, considerou-se os medicamentos citados nos 2 apêndices da RENAME, visando recuperar todos os medicamentos dessa classe terapêutica, classificando-os tanto pela ATC Vode (Anatomical Therapeutic Chemical code) quanto pelo componente de financiamento. Adicionalmente, efetuou-se a busca a partir do termo “tubercul”, onde também identificou-se os medicamentos tuberculostáticos contemplados na relação nacional.
5.3 DADOS DA PRODUÇÃO DE MEDICAMENTOS TUBERCULOSTÁTICOS PRODUZIDOS POR FARMANGUINHOS.
Foi utilizado o relatório anual de gestão 2023, disponibilizado através do sítio eletrônico do Instituto:
Foram coletados os dados e figuras referentes à produção dos medicamentos, disposto nas seções 2 e 6. Seção 2 – Destaques do ano – página 8 e Seção 6A – Macroprocesso de fornecimento de medicamento – página 20, 21 e 22.
Visando uma análise ampliada, entrou-se em contato com o Instituto através dos seus canais de comunicação e solicitou-se a disponibilização dos dados referente à produção dos medicamentos tuberculostáticos que compunham o portfólio no período de 2017 a 2023. Os dados foram disponibilizados em planilha Excel conforme Gráfico 3. Utilizou-se a planilha da forma que foi disponibilizada, sem inserções ou deleções.
6 RESULTADOS E DISCUSSÕES
6.1 MEDICAMENTOS INCORPORADOS NA RENAME PARA O TRATAMENTO DA TUBERCULOSE
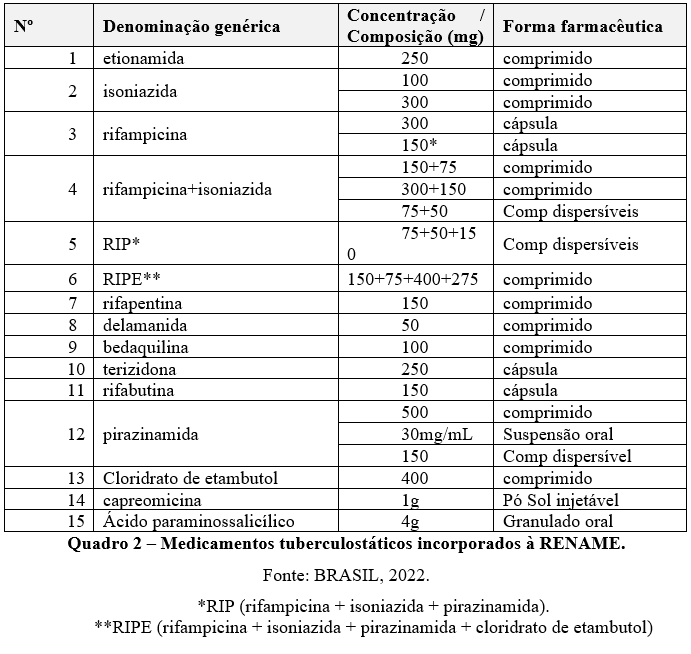
Analisando-se os medicamentos tuberculostáticos definidos pela RENAME 2022, verificou-se 15 medicamentos. Destes, 12 medicamentos referem-se a monoterapias e 3 referem-se a combinações em dose fixa. Todos eles são medicamentos que compõe o componente estratégico.
Os 15 medicamentos são divididos em 21 apresentações comerciais distinta e entende-se como apresentação comercial distinta, como o medicamento é registrado, diferindo da concentração ou forma farmacêutica.
Observou-se ainda que na RENAME constam medicamentos tanto de primeira linha quanto medicamentos de segunda linha e medicamentos tidos como acompanhantes que são empregados no tratamento de tuberculose resistente. Tal fato é um diferencial, considerando que a adesão ao tratamento é dificultada devido o tempo de tratamento (geralmente, 6 meses) fazendo com que muitos pacientes o abandonem, provocando resistência do agente causador da tuberculose.
Os medicamentos tuberculostáticos financiados pelo SUS que constam na RENAME 2022, são apresentados no Quadro 2.
6.2 MEDICAMENTOS QUE COMPÕE O PORTFÓLIO DE FARMANGUINHOS DESTINADOS AO TRATAMENTO DA TUBERCULOSE
Os 33 medicamentos registrados pelo Instituto (Tabela 2) são catalogados em 18 classes terapêuticas e mais de 60 apresentações comerciais disponíveis para fornecimento à população brasileira, as quais encontram-se representadas na tabela abaixo.
Os medicamentos classificados como antirretrovirais compõe 33% do portfólio de Farmanguinhos, representam a principal classe terapêutica e possui 8 medicamentos inseridos nessa classe, isso reafirma a posição de Farmanguinhos como maior produtor público de medicamentos antirretrovirais para o SUS e com maior número de PDP autorizadas pelo MS (OLIVEIRA, 2020; FERNANDES, 2020)
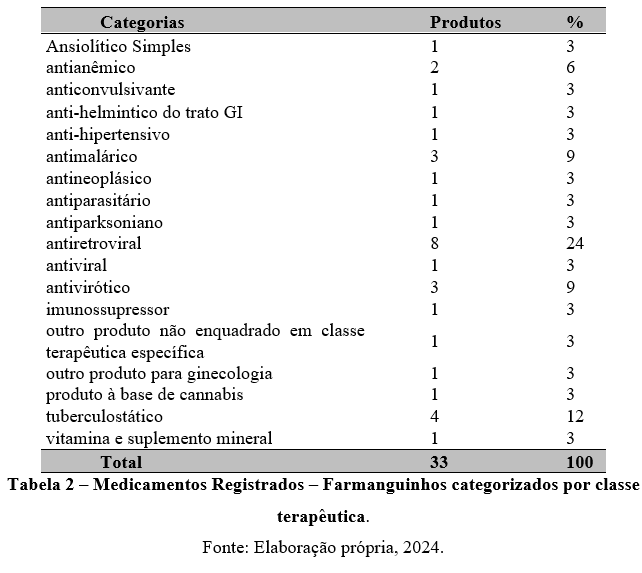
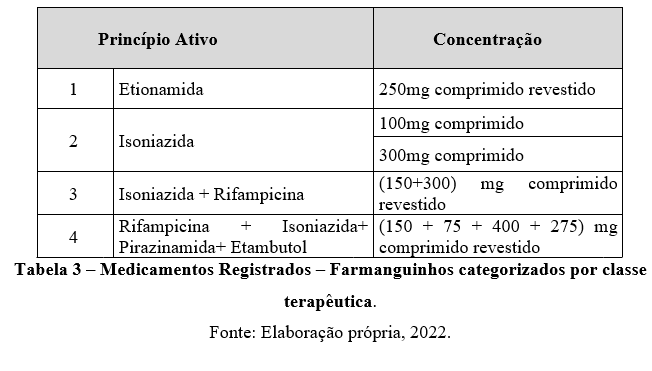
A segunda classe terapêutica com maior número de medicamentos registrados é a de tuberculostáticos, com um total de 4 medicamentos, sendo eles: etionamida, isoniazida, isonizaida+rifampicina, rifampicina+isoniazida+ pirazinamida+ etambutol.
No quadro abaixo, segue os medicamentos tuberculostáticos registrados que compõem o portfólio de Farmanguinhos, ou seja, são os medicamentos que podem ser produzidos para atendimento ao Programa de tuberculose junto ao Ministério da Saúde.
6.3 A EVOLUÇÃO DA PRODUÇÃO DE FARMANGUINHOS NOS ÚLTIMOS ANOS
De acordo com o Instituto, somente no ano de 2023, foram fornecidas aproximadamente 615 milhões de unidades farmacêuticas (UF) (595 milhões para o SUS e 20 milhões para instituições parceiras). Considerando-se que toda a produção de medicamentos de Farmanguinhos é destinada aos programas do Ministério da Saúde, é possível afirmar que o laboratório público apresenta aumento dos medicamentos produzidos nos últimos 7 anos, conforme o gráfico da Figura 3, que demonstra a quantidade em unidades farmacêuticas fornecidas por Farmanguinhos nos últimos anos.
Figura 3: Série histórica de fornecimento de medicamentos de Farmanguinhos em unidades farmacêuticas.
Fonte: Relatório Anual de Gestão, 2023.
Segundo o Instituto, a classe dos medicamentos tuberculostáticos corresponde a 67,76% dos medicamentos do componente estratégico, conforme mostra o gráfico da Figura 4 de distribuição percentual dos medicamentos fornecidos na categoria “Componente Estratégico” por classe terapêutica em 2023.
Figura 4: Distribuição percentual dos medicamentos fornecidos na categoria “Componente Estratégico” por classe terapêutica em 2023.
Fonte: Relatório Anual de Gestão – Farmanguinhos, 2023.
Os medicamentos do Componente Estratégico da Assistência Farmacêutica (CESAF) são aqueles medicamentos que possuem financiamento e aquisição centralizados pelo Ministério da Saúde, em uma logística própria de funcionamento (BRASIL, 2022).
O CESAF garante o acesso aos medicamentos e insumos para as seguintes doenças: tuberculose, hanseníase, toxoplasmose, filariose, tracoma, meningite, leishmaniose, doença de Chagas, cólera, esquistossomose, hepatite, dengue, micoses sistêmicas, lúpus, febre maculosa, brucelose, bem como outras doenças que atendam aos critérios do Componente. Também garante o fornecimento dos insumos e medicamentos destinados ao controle do tabagismo, à influenza, à prevenção ao vírus sincicial respiratório, à intoxicação por cianeto, à alimentação e nutrição, à hepatite, aos 35 hemocomponentes, a coagulopatias e hemoglobinopatias, às imunoglobulinas, à IST/aids, às vacinas e aos soros (BRASIL, 2022).
6.4 EVOLUÇÃO DA PRODUÇÃO DOS MEDICAMENTOS TUBERCULOSTÁTICOS
Considerando-se que a produção pública dos medicamentos se dá a partir dos medicamentos inscritos na RENAME, realizou-se uma análise dos medicamentos tuberculostáticos contidos na última versão vigente, de janeiro de 2022.
A partir da Figura 5 visualiza-se a série histórica de produção de medicamentos em unidades farmacêuticas para o ano de 2023.
Figura 5 – Série histórica de medicamentos produzidos por Farmanguinhos em 2023.
Fonte: Relatório Anual de Gestão – Farmanguinhos, 2023.
Os dados acima representam a quantidade total para todas as classes de medicamentos.
Para os medicamentos utilizados especificamente para o tratamento da tuberculose, no ano de 2023, foram produzidas 49.273.870 unidades farmacêuticas divididas entre os medicamentos: rifampicina 150mg + isoniazida 75mg + pirazinamida 400mg + etambutol 275mg; isoniazida 150mg + rifampicina 300mg; isoniazida 100mg e isoniazida 300mg.
Foram disponibilizados os números referentes à produção dos medicamentos tuberculostáticos de 2017 até 2023, onde é possível verificar um aumento significativo de crescimento de produção a cada ano dentro deste período, sendo o quantitativo produzido para os medicamentos desta classe em 2023, referente a 1300% do quantitativo do ano de 2017 (menor valor de produção de medicamentos tuberculostáticos dentro do período de 2017 a 2023).
Portanto, a Tabela 4 compreende a evolução dos medicamentos empregados no tratamento da tuberculose.
Figura 4 – Evolução dos medicamentos empregados no tratamento da tuberculose.
Fonte: Elaboração própria a partir dos dados de Farmanguinhos (2023).
7 CONCLUSÃO/CONSIDERAÇÕES FINAIS
Considerando-se que o Brasil tem um papel extremamente relevante, por ter sido o principal proponente de uma nova estratégia global de combate à doença, chamada de Estratégia Fim da Tuberculose (End TB Strategy), é imperioso que ocorram investimentos e ações nos diversos tratamentos para o cumprimento da agenda de erradicação da tuberculose.
Farmanguinhos atua como um importante produtor público de medicamentos junto ao Ministério da Saúde, obtendo destaque nos últimos anos a partir da implementação de ações que visam não só o atendimento à produção de medicamentos de alto custo mas também na produção dos medicamentos destinados ao tratamento das doenças negligenciadas, como a tuberculose (MENDONÇA, 2018).
É possível observar que, ao longo dos últimos 7 anos, ocorreu um aumento de produção dos medicamentos destinados ao tratamento da tuberculose que compõem o portfólio do Instituto. Destaca-se que as demandas atendidas pelo Instituto se originam do Ministério da Saúde. Logo, é mister investir em ferramentas de prospecção e monitoramento para o tratamento de doenças que possuem tratamento integral fornecido pelo SUS, dentre elas, HIV/AIDS e tuberculose.
Com os investimentos realizados pelo Instituto na nova área de tuberculostáticos, será possível a fabricação de maior quantidade de medicamentos da classe, possibilitando a ampliação do acesso e incorporação de novas tecnologias para o tratamento da tuberculose.
Isto posto, decorre de que a RENAME possui 15 medicamentos destinados ao tratamento da tuberculose e Farmanguinhos possui o registro de 4 destes medicamentos disponíveis (etionamida, isoniazida, isonizaida+rifampicina, rifampicina+isoniazida+ pirazinamida+ etambutol). Logo, apenas estes 4 medicamentos cujo Instituto possui o registro ativo, é que são candidatos para a produção pública e atendimento aos programas junto ao Ministério da Saúde.
Recomenda-se que o Instituto motive internamente uma avaliação de capacidade técnica produtiva para os outros 11 medicamentos, de forma a ampliar a quantidade de medicamentos tuberculostáticos dentro do seu portfólio e, consequentemente, a possibilidade de produção de novos medicamentos registrados para esta classe.
Considerando que as aquisições relativas ao tratamento e diagnóstico da tuberculose ocorre de maneira centralizada pelo Ministério da Saúde, recomenda-se, também, estudos complementares que relacionem a demanda adquirida pelo Ministério da Saúde para todos os medicamentos adquiridos para atendimento ao Programa para um melhor panorama do que está sendo adquirido pelo MS frente ao tratamento indicado pela RENAME.
Outro ponto de atenção que reforça a importância deste levantamento e monitoramento dos medicamentos indicados pela RENAME versus os detentores/fabricantes de registros dos medicamentos adquiridos pelo MS, é observar os medicamentos que possuem apenas uma empresa fabricante, pois considerando serem medicamentos ofertados pelo SUS, no caso de suspensão temporária de fabricação ou descontinuação do medicamento, pode haver desabastecimento, além de dificultar a regulação de preço destes, uma vez que não haveria competição de mercado por parte das empresas para o fornecimento destes medicamentos.
No caso da tuberculose, por ser considerada uma das doenças mais incapacitantes da atualidade, a prospecção de cenários futuros para a saúde pública brasileira deve integrar os esforços para consolidar e qualificar o Sistema Único de Saúde (SUS) e garantir melhores condições de vida e saúde para a população brasileira.
Os medicamentos produzidos até o momento, são medicamentos correspondentes à primeira linha, ou seja, medicamentos que contém fármacos descobertos há muitos anos, que embora ainda sejam devidamente aplicáveis ao tratamento da doença, é importante que haja investimento no desenvolvimento e pesquisas de novas classes, ou classes já existentes de segunda linha aplicáveis ao tratamento da tuberculose resistente. Observou-se que embora Farmanguinhos possua registros e produção de monoterapias também é possível observar o registro e produção de doses fixas combinadas.
Recomenda-se que sejam realizados estudos mais aprofundados que contemplem a comparação entre os medicamentos incorporados ao SUS utilizados no tratamento da doença associado aos detentores de registros nacionais. Por se tratar de uma doença negligenciada, é comum que as empresas privadas e big pharmas não tenham interesse na produção e desenvolvimento de fármacos dado o valor de investimento de pesquisas e aquisição de insumos farmacêuticos ativos relacionados a estes medicamentos, uma vez que são doenças associada a países em desenvolvimento e devido a falta de retorno financeiro.
Por outro lado, não é interessante que os LFO concorram entre si na produção pública dos mesmos medicamentos, considerando o papel estratégico deles como reguladores de mercado e consequentemente, sendo instrumentos junto ao complexo econômico e industrial da saúde (CEIS) para o desenvolvimento tecnológico e econômico.
Farmanguinhos, portanto, se destaca como uma instituição vital para o combate de doenças negligenciadas no Brasil, não apenas através da produção de medicamentos de alta qualidade, mas também por meio de suas contribuições significativas em pesquisa, desenvolvimento tecnológico e inovação.
REFERÊNCIAS
ABAJO, F. J. El medicamento como solución y como problema para lasalud pública. Una breve incursión a los objetivos de la farmacoepidimiología. Revista Española de Salud Pública. Volume 75, número 4, p. 281-283, 2001.
ARBEX, M. A; VARELLA M. C; SIQUEIRA H. R, MELLO, F. A. Antituberculosis drugs: drug interactions, adverse effects, and use in special situations. Part 1: first-line drugs. J Bras Pneumol. 2010; 36(5):626-40.
BRASIL. Ministério da Saúde. Fundação Oswaldo Cruz. Instituto de Tecnologia em Fármacos. Relatório anual de gestão: 2022. / Instituto de Tecnologia em Fármacos – Farmanguinhos. – Rio de Janeiro: Farmanguinhos, 2023. 62 p.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Brasil Livre da Tuberculose: Plano Nacional pelo Fim da Tuberculose como Problema de Saúde Pública. Brasília. 2017.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de Recomendações para o Controle da Tuberculose no Brasil. Brasília: Ministério da Saúde, 2019. 2ª edição. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/tuberculose/manual-de-recomendacoes-e-controle-da-tuberculose-no-brasil-2a-ed.pdf/view. Acesso em: 09 jul. 2022.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Tratamento diretamente observado (TDO) da tuberculose na atenção básica: protocolo de enfermagem. Brasília. 2011. 168 p. Brasil. Conselho Nacional de Secretários de Saúde. Assistência Farmacêutica no SUS. Brasília: CONASS, 2011. 186 p. (Coleção Para Entender a Gestão do SUS 2011, 66 7) (2011a).
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Brasil Livre da Tuberculose: Plano Nacional pelo Fim da Tuberculose como Problema de Saúde Pública. Brasília. 2017.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de Recomendações para o Controle da Tuberculose no Brasil. Brasília: Ministério da Saúde, 2019. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/manual_recomendacoes_controle_tubercu lose_brasil_2_ed.pdf. Acesso em: 09 Jul. 2022.
BRASIL. Ministério da Saúde. Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. Departamento de Assistência Farmacêutica e Insumos Estratégicos. Relação Nacional de Medicamentos Essenciais Rename 2022 [recurso eletrônico]. Brasília: Ministério da Saúde, 2022.
DIAS SANTIAGO, E. M. Produção Pública para os componentes da assistência farmacêutica – 2003 a 2013. Dissertação (Mestrado em Saúde Coletiva). Universidade de Brasília. 2015, 218 f.
FERNANDES, D. R. A. Fatores críticos de sucesso em Parceria para o Desenvolvimento Produtivo PDP Estudo de caso em um laboratório farmacêutico público (Farmanguinhos). [dissertação]. Rio de Janeiro: Escola Nacional de Saúde Pública Sergio Arouca, Fundação Oswaldo Cruz; 2019. Disponível em: https://www.arca.fiocruz.br/handle/ icict/34235. Acesso em: 10 nov. 2020.
FIOCRUZ. Fundação Oswaldo Cruz, Instituto de Tecnologia em Fármacos Farmanguinhos. História 1976 a 1989. Disponível em: https://www.far. fiocruz.br/instituto/historia/1976-a-1990/. Acesso em jan. 2021.
FIOCRUZ. Fundação Oswaldo Cruz – Instituto de Tecnologia em Fármacos – Relatório Anual de Gestão 2023 – Rio de Janeiro – Farmanguinhos, 2024.
GADELHA, C. A. G.; QUENTAL, C.; FIALHO, B. C. Saúde e inovação: uma abordagem sistêmica das indústrias da saúde. Cadernos de Saúde Pública, n.19, v.1, p. 47-59, 2003.
GOMES, C. A. P.; CHAVES, J. G.; NINOMYA, T. Os laboratórios farmacêuticos oficiais e a produção pública de medicamentos: avanços e desafios. In: BUSS, P. M. (Org.); CAVALHEIRO, J. R.; CASAS, C. P. R. Medicamentos no Brasil: inovações e acesso. Rio de Janeiro: Editora FIOCRUZ, 2008. p. 251-267.
HASENCLEVER, L, et al. O Programa Brasileiro de Combate à Aids e a Experiência Brasileira na Produção Local de Medicamentos Antiretrovirais. Rio de Janeiro: IE/UFRJ – ANRS, 2003. Mimeo.
LÖNNROTH, K.; et al. Tuberculosis control and elimination 2010-50: cure, care, and social development. The Lancet. Volume 375; Issue 9728, 1814-29. Mai 2010. DOI: 10.1016/S0140-6736(10)60483-7.
MENDONÇA, J. S. Importância de laboratórios oficiais para a sustentabilidade de políticas públicas e o desenvolvimento tecnológico no país. Rev. Facto Abifina. 2018; 12(57):28-31.
OLIVEIRA V. Farmanguinhos obtém registro de mais um antirretroviral. Rio de Janeiro: Fiocruz, Farmanguinhos. 2020. Disponível em: https://www.far.fiocruz.br/2020/10/farmanguinhos-obtem-registro-de-mais-um-antirretroviral/. Acesso em: 20 nov. 2020.
OLIVEIRA, E. A. Política de produção pública de medicamentos no Brasil: o caso do Laboratório Farmacêutico do Estado de Pernambuco (LAFEPE). 2007. Tese (Doutorado em Saúde Pública) – Escola Nacional de Saúde Pública Sérgio Arouca, Fundação Oswaldo Cruz, Rio de Janeiro, 2007, 168 p.
OLIVEIRA, M. A.; BERMUDEZ, J. A. Z.; OSÓRIO-DE-CASTRO, C. G. S. Assistência farmacêutica e acesso a medicamentos. Rio de Janeiro, Editora Fiocruz. 2007. 112p. Disponível em: http://www.scielo.br/pdf/csp/v24n6/28.pdf. Acesso em: 14 jul. 2022
RABAHI, M. F. et al. Tratamento da tuberculose. J Bras Pneumol. 2017;43(5):472-486. DOI: 10.1590/S1806-37562016000000388.
SÃO PAULO. Prefeitura do Município de São Paulo. Secretaria Municipal da Saúde. Coordenadoria de Vigilância em Saúde – COVISA. Divisão de Vigilância Epidemiológica. Tratamento e Acompanhamento para Tuberculose 2022. Nota Informativa 10 PMCT/2022.
TOBAR, F. Economía de los medicamentos genéricos en América Latina. Revista Panam Salud Publica, Buenos Aires, v. 23, n. 1, p. 59-67, 2008.
WHO. Global tuberculosis report 2022. Geneva: World Health Organization; 2022
1Doutoranda do Programa de Pós-Graduação Profissional em Gestão, Pesquisa e Desenvolvimento na Indústria Farmacêutica, do Instituto de Tecnologia em Fármacos da Fundação Oswaldo Cruz. e-mail: silvia.santos@fiocruz.br
2Diretor do Instituto de Tecnologia em Fármacos – Farmanguinhos/FIOCRUZ. Atual Presidente da Associação dos Laboratórios Farmacêuticos Oficiais Associados (ALFOB). Farmacêutico Industrial, Mestre em Química Orgânica pela UFRJ, MBA em Gestão Industrial – COPPE/UFRJ. e-mail: jorge.mendonca@fiocruz.br
3Docente do Programa de Pós-Graduação Profissional em Gestão, Pesquisa e Desenvolvimento na Indústria Farmacêutica, do Instituto de Tecnologia em Fármacos da Fundação Oswaldo Cruz. PhD do Instituto de Ciência e Tecnologia em Biomodelos. e-mail: wanise.barroso@fiocruz.br
