THE FACE OF THE IMMUNE RESPONSE IN THE COURSE OF INFLAMMATION
REGISTRO DOI: 10.5281/zenodo.10963335
Jozélio Pereira de Sousa1 Aline Soares de Santana Dutra² Nicole Stephanie Silva Santos³, Ingrid Carneiro Brandão4 Larissa Albuquerque Mendes5 Vitoria Isterfany Pimenta Silva6, Juliana Alves Rampazzo7 Rodrigo Aparecido dos Santos8 Júlia Alves Valois Galvão9 Cláudia Pacheco Prates10
RESUMO
Os estudos nos mostraram a relevância do tema, visto que distinguem o processo inflamatório do sistema imunológico. A análise mostrou que o processo inflamatório é fundamental para garantir uma resposta imune adquirida, pois eleva o fluxo da linfa e, de acordo com isso, o número de células presentes que transportam como antigas para os órgãos linfóides. Além disso, os linfócitos funcionam no organismo como uma importante estrutura de defesa, interagindo com um conjunto de células e moléculas específicas, liberando os agentes invasores e impedindo sua ação, protegendo assim a integridade e o equilíbrio do organismo e sistema imunológico frente ao processo inflamatório. Este estudo é uma revisão narrativa com o objetivo de discutir e descrever a resposta imune e sua relação com processos inflamatórios. Utilizou-se os bancos de dados como: SciElo (SciElo Library Online) e PubMed (US National Biblioteca de Medicina), oferecendo informações científicas importantes e sem restrições ao ano de publicação. A inflamação começa durante a microcirculação. É dentro dela que são encontrados os resíduos indesejados e os micronutrientes cruciais. O papel crucial da microcirculação na pressão arterial é desempenhado. É feito por vênulas pós-capilares, capilares e arteríolas. Compõe uma camada de células endoteliais protegidas pelo colágeno. De acordo com uma rede de células, os linfócitos desempenham um papel crucial na defesa do organismo.
Palavras-chave: Resposta imunológica. Inflamação. Imunologia.
ABSTRACT
The studies showed us the relevance of the subject, since they distinguish the inflammatory process from the immune system. The analysis showed that the inflammatory process is fundamental to guaranteeing an acquired immune response, as it increases the flow of lymph and, accordingly, the number of cells present that transport as old to the lymphoid organs. In addition, lymphocytes function in the body as an important defense structure, interacting with a set of specific cells and molecules, releasing invading agents and preventing their action, thus protecting the integrity and balance of the body and immune system in the face of the inflammatory process. This study is a narrative review with the aim of discussing and describing the immune response and its relationship with inflammatory processes. Databases such as SciElo (SciElo Library Online) and PubMed (US National Library of Medicine) were used, offering important scientific information and without restrictions on the year of publication. Inflammation begins during microcirculation. It is within the microcirculation that unwanted waste and crucial micronutrients are found. The microcirculation plays a crucial role in blood pressure. It is made up of post-capillary venules, capillaries and arterioles. It is made up of a layer of endothelial cells protected by collagen. According to a network of cells, lymphocytes play a crucial role in the body’s defense.
Keywords: Immune response. Inflammation. Immunology.
1 INTRODUÇÃO
A principal função do sistema imunológico é manter a homeostase do organismo humano e combater as agressões em geral, sendo constituída por uma rede intrincada de órgãos, células e moléculas. É composto por duas categorias de imunidade: inata e adaptativa. A moto primária é caracterizada por ser mais lenta e sem especificidade, enquanto uma adaptativa adquirida é mais lenta e cria uma memória para antígenos específicos (Cruvinel et al., 2010).
As células que recebem imunidade inata são compostas por dendríticas, neutrófilos, macrófagos e células Natural Killer. Elas possuem a função de fiscalizar, ou seja, ação de sentinelas para detectar microrganismos e células que apresentam algum dano nos tecidos. Assim, eles ativam funções para que a defesa comece seu papel contra os microrganismos, pois são capazes de estabelecer barreiras físicas para que assim não sejam infecções (Coelho- Castelo et al., 2009).
Suas funções são desempenhadas, entre outras, através da fagocitose, da liberação de mediadores inflamatórios e da ativação de proteínas do sistema implementado. Apenas estruturas moleculares de ocorrência distribuídas em diferentes grupos de microrganismos estimulam esses mecanismos. Os lipopolissacarídeos ácidos teicóicos são um exemplo disso, pois estes definem os padrões moleculares relacionados aos patógenos, que são conhecidos como PAMPS (Barros et al, 2012).
Principalmente, o funcionamento do sistema imunológico consiste em proteger as barreiras físicas e químicas epiteliais, como a pele e a cobertura dos tratos gastrointestinais e respiratórios, que atuam constantemente para bloquear a entrada microbiana (Cruvinel et al., 2010).
É comumente diferente da imunidade inata, que é definida pela exposição a agentes infecciosos, ou que aumenta sua magnitude para proteger o organismo contra um determinado microrganismo. Ela evolui ao se adaptar à infecção e se desenvolve com ela, dando origem ao nome (Jobim; & Jobim; 2008).
A habilidade da adaptativa é distinguir entre diferentes substâncias, conhecidas como especificidade, e responder de forma contínua a um determinado microrganismo, conhecido como memória (Machado et al., 2004).
2 OBJETIVO
A presente proposta se destaca por uma revisão narrativa que objetivou-se elucidar as hipóteses da literatura relacionadas ao paradigma da associação entre o processo inflamatório e a resposta imune. Esta característica é devido a inconsistências entre os estudos.
3 FUNDAMENTAÇÃO TEÓRICA
3.1 CONCEITO DE PADRÕES MOLECULARES ASSOCIADOS A PATÓGENOS (PAMPS) E RECEPTORES DE RECONHECIMENTO DE PADRÕES (PRR)
Receptores de Reconhecimento de Padrões (RRP) são receptores conhecidos como ácidos teicóicos, resíduos de manose e lipopolissacarídeos, que são frequentemente encontrados na superfície de microrganismos e que ativam a resposta imune inata pela interação com diferentes receptores, incluindo a família dos receptores Toll-like (TLR). Esta interação é semelhante à complementaridade entre um complementaridade entre um anticorpo e um antígeno ou entre um antígeno e um receptor de linfócitos T (TCR), mas neste caso não há diversidade nem adaptabilidade anticorpo a novas gerações de receptores ou reconhecimento de novos padrões moleculares que não são codificados em o código genético (Medzhitov et al., 2000).
Os TLRs são encontrados entre os diversos RRPs ativados em opsonização, ativação de complemento e fagocitose, especialmente em sua função central na ligação a patógenos e na iniciação de resposta inflamatória. Os receptores são encontrados principalmente em macrófagos, neutrófilos e células dendríticas (DCs). Até agora, foram encontrados 11 TLRs distintos; agora, alguns são encontrados na membrana celular, enquanto outros são encontrados no interior das células (Janeway et al., 2002). Foram encontrados 11 TLRs distintos; alguns são encontrados na membrana celular, enquanto outros são encontrados no interior das células. Os receptores para citocinas, interleucinas, complementos e imunoglobulinas (tipo FcγR) são outros receptores presentes em fagócitos que têm um papel significativo na resposta imune (Abbas et al., 2003).
O patógeno está ligado aos receptores de superfície do fagócito para iniciar a fagocitose, ou é internalizado em vesículas conhecidas como fagossomos no interior do fagócito. Mutações em genes componentes do sistema de oxidases encontrados na membrana do fagolisossomo provocam incapacidade de explosão respiratória e na proteção de espécies reativas de oxigênio (EROs). Uma importante imunodeficiência primária conhecida como doença granulomatosa crônica, é causada por uma grave deficiência na capacidade destrutiva dos fagócitos, que é determinada pela ausência de EROs (Heyworth et al., 2003).
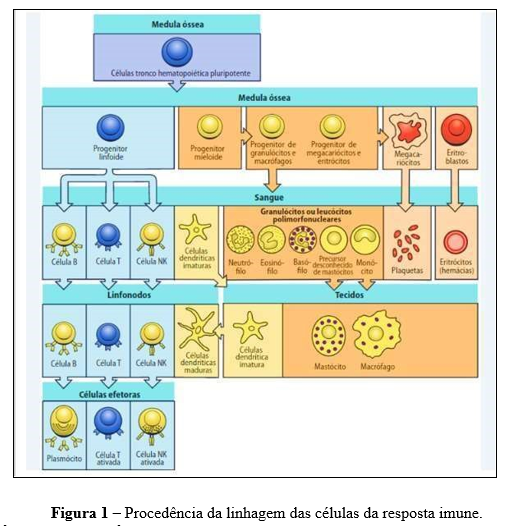
Em contraste com a resposta inata, a resposta imune adaptativa depende da ativação de células especializadas, leucócitos e das moléculas solúveis que são produzidas por essas células. A autolimitação, tolerância a componentes do próprio organismo, memória, especialização da resposta e especificidade e diversidade de reconhecimento são as características principais da resposta adquirida. Apresentando antígenos relacionados a moléculas do complexo de histocompatibilidade principal (MHC, major histocompatibility complex) para os linfócitos T (LT), as células apresentadas de antígenos (APCs) desempenham um papel fundamental em sua ativação, embora os linfócitos sejam os principais envolvidos na resposta imune adquirida (Delves et al., 2000). O sistema imunológico é composto por diversas células, como ilustrado na Figura 1.
3.2 CÉLULA DENDRÍTICAS
Apresentando-se como uma ponte entre a imunidade inata e a adaptativa, as células dendríticas, especializadas na captura e apresentação de antígenos para os linfócitos, são atraídas e ativadas por elementos da resposta inata e viabilizarem a sensibilização de LT da resposta imune adaptativa. Em tecidos periféricos como pele, intestino e fígado, onde reúnem antígenos e são ativados. Eles então migram para regiões linfonodos regionais onde processam e apresentam antígenos lipídicos ou proteicos aos linfócitos. As maduras são muito eficientes na apresentação, enquanto as DCs imaturas são altamente eficientes na captura de antígenos (Banchereau et al., 2000).
Durante a vida útil, as DCs imaturas migram da medula óssea pela corrente sanguínea, atingindo tecidos periféricos como a pele, onde se tornam células residentes (células de Langerhans). Uma coisa notável é que os DCs são as células que chegam às temperaturas mesmas de um local infeccioso, antes que os neutrófilos. Do antígeno, as DCs são ativadas e migram através dos vasos linfáticos para os órgãos linfóides secundários (Shortman et al., 2002).
A provenientes de células NK, NK/T e LT, de moléculas pró-inflamatórias como citocinas, prostaglandinas e interferons, e dos PAMPs, podem receber sinais de maturação. Durante longos períodos, as DCs retêm o antígeno nos órgãos linfoides, o que pode contribuir para a memória imunológica. Por meio de mutação de quimiocinas, essas células orquestram a migração de outros tipos de células imunes dentro dos linfonodos e regulam a diferenciação, a maturação e a função de LT de modo contato-dependente e por alternância de fatores solúveis. Portanto, essas células são fundamentais para o início e a progressão da resposta imunológica adquirida (Germain, 1994).
Desde um progenitor comum, há duas maneiras de diferenciar como DCs. As células de Langerhans, as DCs intersticiais encontradas em outros tecidos e as principais DCs na pele são geradas por meio da via mieloide. As DCs plasmocitoides (pDCs), que predominam no sangue periférico e secretam grandes quantidades de interferon tipo I (IFN-α/β) na vigilância de infecções virais, geram uma outra forma de diferenciação. RNA (TLRs 7 e 8) e DNA (TLR9).
Existem duas abordagens para diferenciar os DCs de um progenitor semelhante. As células de Langerhans, são encontradas na pele e as DCs intersticiais encontradas em outros tecidos e são geradas por meio da via mieloide. Outra modalidade de distinção produzida como DCs plasmocitoides (pDCs), que se encontram predominantemente no sangue periférico e secretam altos valores de interferon tipo I (IFN-α/β) no contexto de infecções virais. Enquanto os mDCs expressam principalmente receptores de superficiência para PAMPs, como peptidoglicanos (TLR2) e lipopolissacarídeos (TLR4), os pDCs possuem receptores citoplasmáticos que podem responder ao RNA (TLRs 7 e 8) e ao DNA (TLR9) (Shortman et al., 2002).
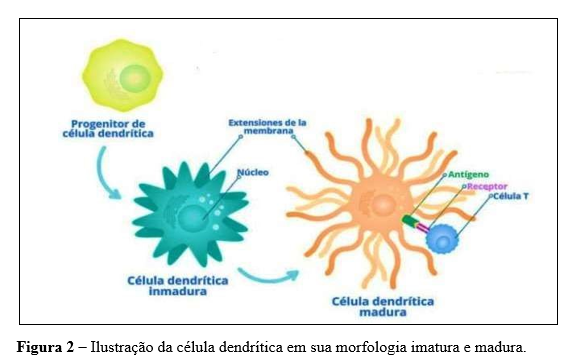
Para determinar a ativação e o tipo de imunidade mediada pelos LTs, é importante considerar os DCs. DCs imaturas são imunoestimuladoras, enquanto DCs maduras são tolerogênicas em geral. No entanto, em certas situações, os DCs maduros podem aumentar a quantidade de LTs reguladores. A combinação de sinais recebidos pelos DCs, como uma ativação de TLRs e citocinas presentes no meio, determina uma indução de tolerância ou resposta imune (Salusto et al., 1999).
3.3 NEUTRÓFILOS
Os leucócitos mais abrangentes no sangue periférico são os neutrófilos, que têm um papel significativo nas fases precoces das reações inflamatórias e sensíveis e agentes quimiotáxicos, tais como substâncias liberadas por mastócitos e basófilos. Elas estão entre as primeiras células a migrar dos vasos sanguíneos para os tecidos atraídas por quimiocinas, como a IL-8, e são ativadas por vários estimulantes, como produtos derivados de bactérias, proteínas relacionadas ao complemento (C5a), imunocomplexos (IC), quimiocinas e citocinas (Brinkmann et al., 2004).
A capacidade fagocitária dos neutrófilos é estimulada pela ligação de seus receptores às opsoninas, IgG Fc, C3b e TLRs dos neutrófilos é estimulada por seus receptores que se ligam às opsoninas, IgG Fc, C3b e TLRs. Três classes de coletores são liberadas no meio extracelular por meio de granulação dessas células:
- Grânulos primários ou azurófilos, que incluem medidores cruciais como proteína de aumento da permeabilidade bacteriana, defensinas, elastase neutrofílica e catepsina G.
- Grânulos secundários, principalmente lactoferrina, que se refletem em componentes secretados especificamente por neutrófilos.
- 3. Terciários, as quais as proteínas principais são as gelatinases e as catepsinas.

Os neutrófilos podem ser responsáveis pelas “armadilhas extracelulares neutrofílicas” (NETs, inglês para neutrophilic extracelular traps), que consistem em componentes nucleares e substâncias das substâncias extracelulares, especificamente em fatores de virulência e destruição de bactérias extracelulares. As redes são abundantes em sítios tóxicos, onde exercem uma atividade direta em relação aos microrganismos, além de fundir uma barreira física que impedirá sua propagação (Cerwenka et al., 2001).
Os neutrófilos são retirados da circulação e dos tecidos inflamados por apoptose em condições normais. As dificuldades no apoptose dessas células estão relacionadas a uma enorme variedade de auto anticorpos, já que os restos apoptóticos circulantes contêm materiais nucleares e podem contribuir para diversas condições autoimunes, especialmente ao LES (Brinkmann et al., 2004).
3.4 MACRÓFAGOS
O macrófago e as células dendríticas são origem dos monócitos, que estão entre 3% e 8% dos leucócitos circulantes no tecido conjuntivo ou parênquima de órgãos. Os macrófagos, em contraste com os neutrófilos, podem se manter no tecido por meses a anos, funcionando como verdadeiras sentinelas. Além do seu papel na imunidade insuficiente, eles processam e apresentam antígenos através de moléculas do MHC, estimulando assim a resposta mediada pela LT. Macrófagos e monócitos são fagócitos eficientes que engolfam patógenos e detritos celulares permanecem no tecido por meses ou até anos, atuando como verdadeiros órgãos sentinela (Abbas et al., 2003).
Em caso de inflamação, os macrófagos atuam como APCs, potencializando a ativação de LT e LB por meio da expressão de moléculas coestimuladoras e liberando citocinas pró- inflamatórias como IL-1, IL-6, IL-12, TNF -α e quimicinas. Em outras palavras, o óxido nítrico (NO) é o principal representante dos intermediários reativos do nitrogênio, além de ânion superóxido, radical hidroxila e peróxido de hidrogênio (H2O2). Em macrófagos de proteção, o NO é produzido pela sintetase do óxido nítrico induzível, iNOS, mas é causado pela ativação de TLRs em resposta a PAMPs, principalmente na presença de INF-γ (Mosser et al., 2008).
3.5 CÉLULAS NATURAL KILLER
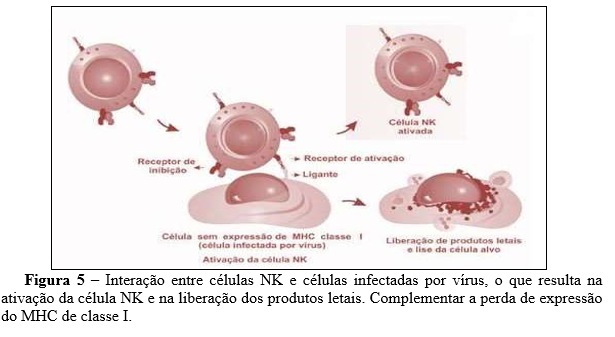
As células Natural Killer (NK) têm origem na medula óssea, a partir de um progenitor comum aos LTs, constituindo de 5% a 20% das células mononucleares do sangue. São uma importante linha de defesa inespecífica, reconhecendo e lisando células infectadas por vírus, bactérias e protozoários, bem como células tumorais. Ademais, recrutam neutrófilos e macrófagos, ativam DCs e linfócitos T e B. A expansão e a ativação das NKs são estimuladas pela IL-15, produzida por macrófagos, e pela IL-12, indutor potente da produção de IFN-γ e ação citolítica. Uma vez ativadas, as NKs lisam células infectadas e tumorais e secretam citocinas pro-inflamatórias (IL-1, IL-2 e principalmente IFN-γ) (Cerwenka et al., 2001).
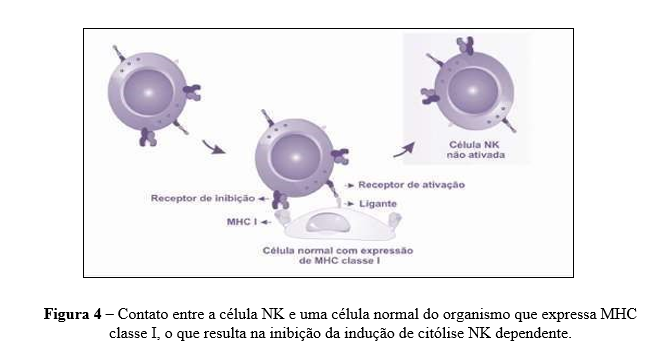
A citotoxicidade em NK ocorre através de enzimas produtoras de perforina e granzimas, levando à morte celular por apoptose. As células NK possuem receptores para ativação e inibição, e o equilíbrio entre eles determina sua atividade. Em humanos, existem 14 receptores KIR, oito inibidores e seis agonistas. Células infectadas e células tumorais são vulneráveis à ação do NK15. A capacidade tumoricida das NK é aumentada por citocinas como interferons e interleucinas (Yokoyama et al., 2004).
3.6 MASTÓCITOS
Mastócitos são células normalmente não encontradas na circulação, sendo derivadas de progenitores hematopoiéticos CD34+ na medula óssea. Os progenitores da medula óssea se diferenciam in situ de acordo com as características particulares do microambiente e migram para os tecidos periféricos como células imaturas. Ações de contato com o meio ambiente são frequentes para os mastócitos maduros, que se distribuem estrategicamente junto aos vasos sanguíneos, nervos e sob o epitélio da pele e mucosas. Eles desempenham um papel primordial nas reações inflamatórias agudas (Metcalfe, 2008).
Os mastócitosexibem receptores exibem alta afinidade (FcεRI) na superfície que estão ligados a moléculas de IgE. Esses receptores são ativados quando as IgEs e reconhecem antígenos multivalentes. Independentemente da ligação de IgE, os estímulos como produtos de ativação do complemento, substâncias básicas, alguns venenos de animais, certos neuropeptídios e diferentes agentes físicos como trauma mecânico, calor e frio, podem ativar mastócitos. 2, 4 e 6 e outros receptores específicos, como o CD48, que resultam na liberação de mediadores (Abbas et al., 2003).
As reações alérgicas, onde os mastócitos e seu equivalente circulante, o basófilo, em contato com o alérgeno, desencadeiam a reação de hipersensibilidade do tipo I através da ativação de FcεRI, são o exemplo clássico de seu envolvimento em processos inflamatórios. Degranulação e liberação de mediadores pré-formados ocorrem após o estímulo, seguida da liberação de mediadores neoformados. Aminas vasoativas, proteases, heparina, IL-4, TNF-α e GM-CSF (Granulocyte-Macrophage Colony-Stimulating Factor) estão entre os mediadores pré-formados. Os mediadores formados após ativação incluem uma variedade de citocinas e o fator ativador de plaquetas (PAF), que provêm do ácido araquidônico (Metcalfe, 2008).
O deslocamento desses mediadores resulta na migração de células inflamatórias, como neutrófilos e macrófagos, na ação da permeabilidade vascular, na secreção de muco, na aumentação da motilidade gastrintestinal e na broncoconstrição, os sinais e sintomas das alergia e anafilaxia (Abbas et al., 2003).
3.7 BASÓFILOS
Formam menos de 1% dos leucócitos do sangue periférico, sendo granulócitos derivados de progenitores na medula óssea onde amadurecem. Apesar de não se encontrar normalmente nos tecidos, eles podem ser encontrados junto com eosinófilos para sítios inflamatórios. As glândulas encontradas nos basófilos apresentam mediadores que se assemelham aos dos mastócitos. Além disso, os basófilos expressam FcεRI, ligam IgE e são ativados por complexos IgE-antígeno, o que pode contribuir para reações de hipersensibilidade imediata (Calixto et al., 2004).
3.8 EOSINÓFILOS
Os granulócitos eosinófilos são células importantes no combate às infecções; sua ação antiparasitária (helmintos) é um dos mecanismos de defesa mais poderosos e eficazes do organismo. Ademais desempenham um papel importante nas reações alérgicas e asma também. A medula óssea é o ambiente em que os eosinófilos se desenvolvem, produzindo e armazenando muitas seleções proteolíticas secundárias antes de sair da medula. Depois de amadurecer, eles circulam pequenas quantidades pela corrente sanguínea e podem ser detectados em maior número nas regiões mucosas, como o trato gastrointestinal, infecções e geniturinário (Abbas et al., 2003).
Os eosinófilos são utilizados para combater parasitárias e alérgicas, combatendo infecções por citotoxicidade em células dependentes de anticorpos, com o receptor FcεRI. Eles induzem reforço em reforços revestidos com anticorpos IgE (IgA), componentes eosinofílicos, com potencial citotóxico e tecidual (Sayed et al., 2008).
Tanto a neurotoxina e a catiônicaproteína proteína eosinofílicasão ribonucleases com propriedades antivirais são ribonucleases com propriedades antivirais. A principal proteína básica é tóxica para os parasitas, causa a degranulação de mastócitos e basófilos e estimula a síntese de fatores de remodelação pelas células epiteliais. A proteína catiônica eosinofílica causa rupturas na membrana da célula-alvo, possibilitando a entrada de outras moléculas citotóxicas além de impedir a estimulação de LT, restringindo a produção de anticorpos por LB, provocando a degranulação de mastócitos e estimulando a estimulação de glicosaminoglicanos por fibroblastos. O estresse oxidativo nas células-alvo é promovido pela peroxidasse eosinofílica, que forma EROs e NO. Apoptose e necrose provocam morte celular (Hogan et al., 2008).
O processo inflamatório é contribuído por outros mecanismos efetores, tais como a produção de uma variedade de citocinas, como IL-1, IL-2, IL-4, IL-5, IL-6, IL-8, IL-13 e TNF-α, e liberação de mediadores lipídicos pró-inflamatórios, como os leucotrienos (LTC4, LTD4, LTE4) e as prostaglandinas (PGE2). Enzimas como elastase e fatores de crescimento como TGF-β, PDGF, VEGF e fator de crescimento de vasos endoteliais contribuíram para a remodelação tecidual (Sayed et al., 2008).
3.9 SISTEMA COMPLEMENTO
Uma família de mais de 20 glicoproteínas plasmáticas, sintetizadas principalmente no fígado, mas também por macrófagos e fibroblastos, constitui o Sistema Complemento (SC). A atividade proteolítica é adquirida por cada componente ativado no SC, ou que ativa os elementos seguintes na cascata. Durante uma etapa, são fabricados vários mediadores que modificam a permeabilidade vascular e apoiam o progresso da resposta inflamatória. Por último, forma-se o complexo de ataque à membrana (MAC), que facilita a lise osmótica da célula-alvo e auxilia na remoção do agente infeccioso (Abbas, 2003).
Há três formas de ativar o SC: clássica, alternativa e via das lectinas ligadoras de manose (MBL) A ativação dessas vias auxilia na integração dos mecanismos responsáveis pela imunidade inata e adaptativa (conforme a Figura 6). Durante a resposta imune inata, os patógenos se deparam com substâncias solúveis da resposta imune inata, como as proteínas do SC, proteína C reativa e outras. Na imunidade adaptativa, o SC é ativado pela ligação de anticorpos preformados com o patógeno ou antígeno (imunocomplexo) (Barrington et al., 2001).
A utilização de lectinas é iniciada quando a MBL, que está ligada às serinaproteases MASP1 e MASP2, identifica a presença de lectinas na superfície. A ativação dessas proteases resulta na quebra dos componentes C2 e C4 do SC, resultando em fragmentos menores (C2b e C4a) e maiores (C2a e C4b) O complexo C4bC2a é a C3 convertase da via clássica, que transforma C3 em C3a solúvel e C3b, que, por sua vez, liga C4bC2a na superfície do micro- organismo. O processo de conversão C4bC2aC3b, conhecido como C5, é iniciado por meio da conexão do componente C5, culminando na formação do MAC. A via tradicional é semelhante à via das lectinas e se inicia com a conexão do componente C1q a duas moléculas de IgG ou uma de IgM, que se combinam com o antígeno-alvo (imunocomplexos) A conexão em questão aciona as proteases R (C1r) e S (C1s), que apertam os componentes C2 e C4, dando continuidade à via descrita anteriormente. A via clássica está ligada à resposta imune específica do humor, pois depende da produção prévia de anticorpos específicos aderidos à superfície dos patógenos (Fujiwara et al., 2005).

Figura 6 – As três vias do Sistema Complemento
A via alternativa começa com a quebra espontânea do componente C3 nos fragmentos C3a e C3b (conforme a Figura 6) A clivagem mostra uma ligação tioéster no fragmento C3b, que permite a sua ligação covalente à superfície dos micro-organismos invasores. Caso o componente C3b não exista, a ligação tioéster é prontamente hidrolisada e o fragmento é inativo. A remoção de C3b possibilita a conexão com o Fator B, que é então clivado nos fragmentos Ba e Bb pelo Fator D. O complexo C3bBb (convertido pela via alternativa) é acionado por C3b e permanece em contato com a superfície. A properdina é a responsável por estabilizar esse complexo, aumentando a quebra de C3. C3bBb é um aminoácido capaz de clicar C5 na última etapa da via alternativa (Barrington et al., 2001).
As duas vias das lectinas, a clássica e a alternativa, apresentam a presença de C5 convertase, que promove a clivagem do componente C5 e resulta nos fragmentos C5a e C5b. A ligação do C5b à superfície do patógeno leva à formação do complexo de ataque à membrana pela ligação sucessiva dos componentes C6 e C7 na bicamada lipídica da membrana celular. O complexo C5b,6,7 permite a ligação do componente C8 e, por fim, a polimerização do C9 atravessa a bicamada lipídica e promove lise osmótica do agente infeccioso (Fujiwara et al., 2005).
Os fragmentos menores liberados durante a ativação da cascata têm impactos biológicos relevantes. C2a e C4a estão ligados a alterações na permeabilidade vascular, Bb está relacionado à ativação dos macrófagos, C3a, C4a e C5a induzem a ativação de mastócitos e neutrófilos, enquanto C5a estimula a motilidade e a adesão dos neutrófilos ao foco inflamatório. Os fragmentos C3b e C4b funcionam como opsoninas, aumentando o processo de fagocitose pela interação com o receptor de complemento CR1, presente na superfície dos fagócitos. A interação CR1-C3b também contribui para a depuração dos imunocomplexos, que são transportados pelas hemácias e removidos por fagócitos no fígado e no baço (Hogan et al., 2008).
As proteínas acopladas à membrana celular e solúveis circulantes apoiam a regulação da ativação do SC. É um mecanismo específico que garante que a ativação do SC em níveis baixos não comprometa as células do próprio organismo e evita que ocorra a deposição dos complexos gerados sobre as células autônomas nos momentos de ativação intensa (Abbas, 2003).
3.10 COMPLEXO DE HISTOCOMPATIBILIDADE PRINCIPAL
O complexo de histocompatibilidade principal humano, conhecido como MHC, é composto por um conjunto de genes altamente polimórficos, conhecidos como complexo HLA (human leukocyte antigen), que engloba mais de 120 genes funcionais, dos quais cerca de 20% estão ligados à imunidade. A conexão entre as enfermidades autoimunes e os genes do MHC evidencia a relevância desses elementos na orientação da resposta imune (Germain, 1994).
Devido à sua função na apresentação de antígenos, o MHC estabelece uma conexão entre a resposta inata e a resposta adaptativa. No ser humano, esses genes estão localizados no cromossomo 6 e são classificados em classes I, II e III. Apenas os genes das classes I e II estão envolvidos na produção de antígenos proteicos para LT. As moléculas de classe I estão na superfície de todas as células nucleadas, enquanto as de classe II são mais comuns nas APCs (macrófagos, DCs e LB) Todas as moléculas de MHC que estão presentes na superfície de uma célula possuem um peptídeo. Apesar de possuírem características estruturais distintas, elas são descritas como heterotrímeros, nos quais duas cadeias são da molécula de MHC e a terceira é o peptídeo presente nos LT (Figura 7) (Klein et al., 2000).

Figura 7 – Cadeias peptídicas das moléculas de MHC de classe I e classe II.
Na região HLA de classe I, existem cerca de 20 genes. Três deles, HLA-A, B e C, são considerados clássicos (Figura 8). Os genes que codificam as moléculas fundamentais do MHC apresentam uma grande variedade de polimorfismo. As moléculas de classe I são compostas por uma cadeia α, codificada pelos genes HLA-A, B ou C, e uma cadeia β2- microglobulina, a qual é invariável. Uma vez que esses genes têm codominância, cada pessoa pode ter de três a seis tipos diferentes de moléculas de HLA de classe I nas células, codificadas pelos alelos maternos e paternos dos genes HLA-A, B e C. As moléculas de classe I apresentam, para os LTs CD8, peptídeos endógenos, ou seja, peptídeos que são derivados de proteínas autólogas no citoplasma (Kunkel et al., 2002).

As moléculas HLA de classe II são compostas por duas cadeias, α e β, ambas codificadas por genes polimórficos presentes nas regiões do complexo MHC de classe II (Figura 9). Os gens das famílias HLA-DR, DP e DQ codificam as cadeias α e β das moléculas de classe II. Em geral, uma cadeia α de um tipo específico, como o DR, é associada à cadeia β do mesmo tipo. No entanto, é possível haver pareamento heterôntico, o que pode resultar em uma variedade de moléculas de classe II na superfície. A primeira letra indica a classe (D); a segunda, a família (M, O, P, Q e R); e a terceira, a cadeia A (α) ou B (β) (Klein et al., 2000).
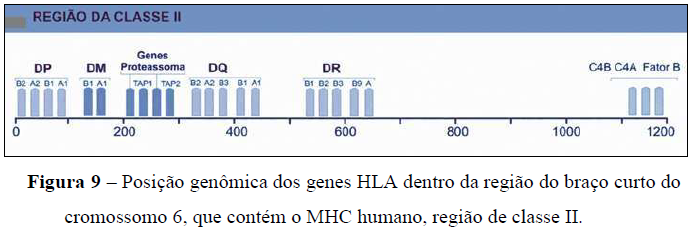
Os genes de cada uma dessas famílias são diferenciados por números. A nomenclatura completa de uma variante alélica é dada por um asterisco. O alelo 0101 do gene 1 é o alelo 0101 que codifica a cadeia β da molécula de classe II da família DR (conforme a Figura 10). As moléculas de HLA de classe II contêm peptídeos exógenos, ou seja, decorrentes da proteólise de proteínas não autólogas em fagolisossomos (Kunkel et al., 2002).

3.11 IMUNIDADE INATA NO CONTEXTO DA RESPOSTA INFLAMATÓRIA
A primeira reação do organismo a um dano tecidual é a resposta inflamatória, um processo biológico complexo que envolve elementos vasculares, celulares e uma variedade de substâncias solúveis. Além disso, os sinais clínicos característicos incluem rubor, calor, edema, dor e prejuízo funcional (Abbas et al., 2003).
No decurso da inflamação, diversos mecanismos bioquímicos, como a cascata do SC e a coagulação, são acionados, o que auxilia no início, progresso e solução do problema. Além disso, substâncias solúveis de longa-vida são liberadas, exercem sua função e são degradadas. Em geral, o êxito na remoção do estímulo desencadeador leva ao fim da resposta aguda e ao reparo tecidual completo (Banchereau et al., 2000).
As células que habitam o tecido começam uma fase vascular que inicia uma resposta inflamatória aguda logo após o dano. Menos uma parte dos capilares que compõem a rede tecidual está perdida em condições normais. Após uma resposta, então, há um aumento da permeabilidade capilar e da vasodilatação local, mediado por aminas vasoativas liberadas por mastócitos e monócitos, serotonina e histamina. Inicialmente, formam o transudado a partir da leitura de pequenas moléculas e elétrons no pulmão; posteriormente, também formam moléculas maiores como albumina e fibrinogênio, que formam o exsudato circular junto ao endotélio, pela saída de proteínas para o espaço extravascular (Fujiwara et al., 2005).
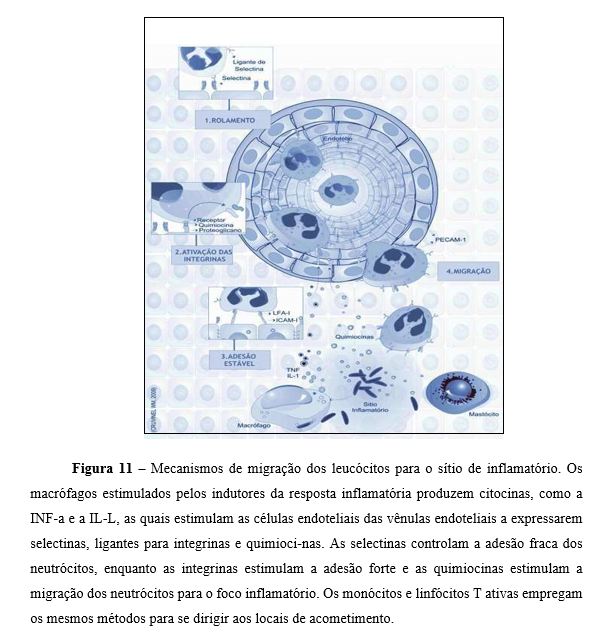
A migração de células circulantes para os tecidos, chamada diapedese, é direcionada pela presença de um grande número de substâncias quimiotáticas no sítio inflamatório. As células buscam fagocitar o patógeno, o que leva à repaginação da lesão (Figura11). Na inflamação aguda, predominam os elementos da resposta imune inata e as células principais envolvidas são os neutrófilos e macrófagos. Na inflamação crônica, geralmente causada pelo estímulo nóxico, o processo inflamatório se mantém e sofre alterações qualitativas, caracterizadas por mudanças progressivas nos elementos celulares e solúveis que infiltram o tecido. A permanência do agente lesivo leva à atracação do procedimento, em que ocorre simultaneamente a destruição e a repasto do tecido (Abbas et al., 2003).
3.12 MIGRAÇÃO DOS LEUCÓCITOS: MOLÉCULAS DE ADESÃO
As células circulam no centro do vaso sanguíneo, onde a resistência é menor e a velocidade do fluxo é maior. Quando há vasodilatação, a velocidade do fluxo sanguíneo diminui e as células circulantes colidem mais vezes com as células endoteliais ativadas, que expressam moléculas de superfície capazes de se ligar aos leucócitos. As células que estão ativadas exibem altos níveis de selectinas da família das selectinas, incluindo a molécula de adesão intercelular (ICAM-1) e a molécula de adesão da célula vascular (VCAM-1). A ativação endotelial é determinada por produtos de micro-organismos, citocinas (IL-1, TNF-α), elementos ativos do SC, fatores de coagulação, histamina e leucotrieno B4 (Abbas et al., 2003).
As glicoproteínas conhecidas como L-selectina, E- e P-selectina em endotélio e plaquetas P-selectina medeiam adesão de baixa umidade entre leucócitos e endotélio, em geral. As moléculas glicosiladas encontram – se na superfície de outras células. É possível atrair os leucócitos para a periferia e promover contato com o endotélio apesar da baixa camada (Cartier et al., 2005).
Por exemplo, sua interação inicial com o endotélio ativado é mediada pela interação entre as selectinas P e no endotélio para que a mucina apresente sua superfície. Os neutrófilos se encontram na parede dos vasos impulsionados pelo fluxo sanguíneo por meio dessas ligações de dissociação rápida, ficando assim expostos a fatores quimiotáticos. Fragmentos de fibrina, colágeno, fatores solúveis plaquetários, mediadores de mastócitos, C5a, C3a e C4a, resíduos do metabolismo bacteriano como peptídeos n-formilados e as quimiocinas secretadas por diferentes tipos de celulares estão enumerados entre os fatores quimiotáticos (Carlos et al., 1994).
As quimiocinas causam alterações em outro conjunto de adesinas na superfície dos leucócitos, as integrinas, o que leva ao reconhecimento de maior avidez aos ligantes expressos no endotélio, imobilizando os neutrófilos e promovendo sua aderência à parede do vaso. A migração das células aderidas para o tecido adjacente é guiada pelo crescente número de produtos quimiotáticos, facilitado pela interação das integrinas com os componentes da matriz extracelular, como a fibrina e a fibronectina. O extravasamento e a migração leucocitária dependem de quimiocinas, como IL-8 e MCP-1, que são produzidas nos locais de infecção e se ligam aos proteoglicanos na matriz extracelular e em moléculas semelhantes na superfície das células endoteliais. A IL-8, liberada por macrófagos ativos, atrai neutrófilos, que são estimulados a penetrar no tecido inflamado. Enquanto isso, a MCP-1 atrai monócitos, células T, células NK e células dendríticas mais tarde (Abbas et al., 2003).
Na Figura 11, estão representadas algumas moléculas de adesão e seus respectivos ligantes. A velocidade de produção das moléculas de adesão é variável de minutos a horas. Algumas, como a selectina P, estão na membrana de vesículas secretórias intracitoplasmáticas (corpos de Weibel-Palade) que, logo, se fundem à membrana plasmática quando a célula é estimulada. Outras substâncias, como a selectina E, a ICAM-1 e a VCAM-1, demandam uma longa jornada de síntese (Carlos et al., 1994).
3.13 QUIMIOCINAS
As quimiocinas são uma grande família de citocinas com similaridade estrutural, responsáveis pela movimentação dos leucócitos, incluindo sua movimentação para áreas de inflamação do tecido que se origina do sangue. São polímeros de tamanhos variados, variando de 8 a 12kDa, que possuem pontes dissulfeto internas. Aproximadamente 50 quimiocinas diferentes já foram identificadas, sendo classificadas em famílias pelo número e localização dos resíduos de cisteína N-terminais. As duas principais famílias são as das quimiocinas CC, nas quais os resíduos de cisteína estão próximos, e a família CXC, como a IL-8, em que esses resíduos são separados por um aminoácido (Kunkel et al., 2002).
Quimiocinas causadas, também conhecidas como inflamatórias, são fabricadas por diversas células em resposta a estímulos inflamatórios, através de que elas atraem leucócitos em locais de inflamação (Cyster et al., 1999).
4 METODOLOGIA
Este estudo é uma revisão narrativa que tem como objetivo discutir e descrever a resposta imune e sua conexão com processos inflamatórios. Usou-se o banco de dados: SciElo (Scientific Eletronic Library Online) e PubMed (US National Library of Medicine), com dados científicos, sem limitação idioma e sem limitação de ano de publicação.
As palavras chaves utilizadas foram empregues para abordar a temática de imunologia e inflamação, com um esquema prospectivo de “resposta imunológica”, “inflamação” e “imunologia”. A fim de aprimorar as buscas nas bases de dados, revisamos todas as citações dos artigos selecionados e dos artigos em revisão. Com o intuito de obter informações sem esgotar as fontes de dados, foi realizada a coleta de estudos originais e não originais, resultando em uma publicação ampla, apropriada para descrever e discutir o progresso do processo inflamatório sob a perspectiva imunológica.
4.1 CRITÉRIOS DE INLUSÃO E EXCLUSÃO
Foram considerados os seguintes critérios para inclusão: estudo publicado em periódicos e revistas; estudos prospectivos que avaliavam a imunologia como uma resposta independente à ocorrência de processos inflamatórios e sem limitação do ano de publicação, levando em conta a sua importância.
Foram selecionados 30 artigos dentre os 100 disponíveis no banco de dados da SciElo, sendo que 15 foram excluídos e 15 foram adicionados. Foram selecionados 50 dos 100 artigos do PubMed, sendo que 12 foram excluídos e 38 foram adicionados. Foram excluídos, editoriais, comentários, cartas aos editores, resumos, estudos qualitativos, estudos que relataram apenas uma análise transversal, ensaios, estudos que descreveram método de pesquisa ou validação de instrumento e estudos de acompanhamento que não tiveram um grupo de comparação (não exposto à inflamação) ou imunologia tratado como desfecho (variável dependente).
4.2 ARTIGOS SELECIONADOS
O autor principal selecionou os estudos de maneira independente, em três etapas: 1 é uma análise dos títulos dos artigos, 2 é a leitura dos resumos e 3 é a leitura dos textos completos. Havendo divergências em qualquer estágio, um segundo autor seria questionado de forma vulgar, e a decisão final seria tomada por maioria ou consentimento.
5 RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
Os estudos examinaram o papel que a imunologia desempenhou durante a invasão de microrganismos. A primeira coisa que queremos destacar são as células de defesa do corpo, também conhecidas como leucócitos, eles são divididos em: linfócitos, basófilos, neutrófilos, eosinófilos e monócitos.
A divisão primária é realizada pelos linfócitos que habitam o sangue. É possível diferenciar entre tamanhos maiores e menores a partir do ponto de vista microscópico. A maioria dos indivíduos ricos são considerados assassinos naturais. É possível referir-se às linhas T ou B como linhas T (Nikolich et al., 2004). Uma porção da imunidade celular mediada é composta de células Natural Killer. Em tumores e infecções virais, têm como função destruir células hospedeiras e proteger os hospedeiros possíveis. O funcionamento dos linfócitos T é promover a imunidade celular, obrigando de forma eficaz qualquer matéria que não seja identificada ou infectada. A linhagem T compreende CD8+, T8 e agentes citotóxicos, que matam as células infectadas induzindo a morte celular programada por meio de apoptose. A morte é realizada por intermediários que ativam outros tipos de células para agirem de determinada maneira; estes incluem linfócitos CD4+, células T4 e células auxiliares (Raz & Mahabaleshwar, 2009). A função primária dos linfócitos B é a imunidade humoral através da produção de imunoglobulinas, também conhecidas como anticorpos, que funcionam contra substâncias estranhas. É importante ressaltar que os linfócitos B, quando ativados, se transformam em plasmócitos, que podem produzir anticorpos em uma escala ampliada através da vesícula de Golgi.
Os basófilos realizaram a segunda divisão celular devido ao seu tamanho; os pesquisadores observam que eles têm um formato de “S” irregular, a segunda, a heparina, tem a função de inibir ou impedir a formação de trombos e coágulos na corrente sanguínea. Segundo Calixto et al. (2004), basófilos envelhecem respectivamente em respostas alérgicas e na prevenção de coágulos no sangue. A função da segunda, a heparina, é prevenir ou inibir a formação de trombos e coágulos na corrente sanguínea. Segundo Calixto et al. (2004), os basófilos avançaram em relação à prevenção de coágulos no sangue e respostas em alérgicas.
A terceira divisão é realizada pelos neutrófilos, que, assim como os macrófagos, se ligam às células endoteliais e circulam até atingirem o local sinalizado, que é afetado por alguma infecção. O papel dos neutrófilos é crucial para indivíduos que sofrem de danos genéticos ou que possuem uma quantidade reduzida de glóbulos brancos, pois é especialmente importante nesses casos para que o acometido por algum processo inflamatório consiga se recuperar (Farhat et al, 2000).
Os leucócitos eosinófilos, que possuem coletores dentro do seu citoplasma, são os responsáveis pela divisão de quarta. É extremamente relevante na questão de proteção do organismo contra infecções parasitárias. Pesquisas indicam que os eosinófilos apresentam menor eficiência que os neutrófilos no processo de eliminação de bactérias intracelulares (Kipriyanov & Le Gall, 2004). As reações de hipersensibilidade, como a histamina, leucotrienos, lisofosfolipídios e tempo de essencialidade na proteção do organismo contra infecções parasitárias. Estudos indicam que a eficácia dos eosinófilos na remoção de bactérias intracelulares é inferior à dos (Kipriyanov & Le Gall, 2004). Por outro lado, resultam em reações de hipersensibilidade modulares, como histamina, leucotrienos, lipofosfolipídios e heparina. Além disso, por mecanismos ainda desconhecidos, o processo de eosinofilia pode causar lesões teciduais (Lindsley et al., 2020).
As células brancas conhecidas como granulócitos, como eosinófilos, são responsáveis pela quinta divisão. Além de eliminar partículas estranhas e destruir células tumorais, eles são importantes na proteção do organismo contra bactérias ou vírus. Os monócitos migraram do sangue para os tecidos quando há uma indicação de algo estranho ocorrendo. Desde então, são conhecidos como macrófagos, com o objetivo principal de proteger os tecidos do organismo (Barshack et al., 2003).
Pordeus et al. (2003) enfatiza os tipos de imunidades em tempo de ação necessária para combater o agente invasor. A primeira ativação, inata, é a imunidade inata, mediada por neutrófilos e macrófagos, em torno de 12 horas. A segunda imunidade ativada, adaptativa, se desenvolve em 7 dias após a entrada do microrganismo, na função de linfócitos e anticorpos, melhorando a defesa contra invasores, por isso fica mais focado e atua através das células de memória (Curtis et al, 2003).
O organismo além dessas imunidades supracitadas, apresenta também desenvolvimento de imunidade passiva. A doença começa quando um indivíduo recebe células de outro indivíduo resistente à infecção, exemplo disso é o recém-nascido, que ainda não possui o sistema imunológico totalmente desenvolvido e recebe imunidade da placenta e do leite materno (Matsumoto et al., 2000).
As análises focaram principalmente na resposta inflamatória. É ela que limpa os resíduos indesejáveis e nutre os tecidos dos micronutrientes essenciais. O papel valioso da microcirculação na pressão sanguínea é evidente. Ela consiste em capilares, vênulas pós- capilares e arteríolas. Com uma camada de células endoteliais revestidas por colágeno, eles são compostos. Uma inflamação aguda é estimulada quando ocorre, sendo fornecida por um aumento expressivo de leucócitos, proteínas plasmáticas e fluidos provenientes do sangue. Citocinas, como mastócitos, macrófagos e células endoteliais, são responsáveis por todas essas alterações (Kazatchkine & Kaveri 2001) que circulavam anteriormente na corrente sanguínea viajam até o local da lesão para matar o agente invasor e iniciar o processo de cicatrização do tecido lesado. Além disso, a resposta inflamatória tem uma cronificação quando o organismo tarda para eliminar o agente invasor (Shoenfeld et al., 2002).
A inflamação está ligada ao sistema nervoso central, com terminações de sensibilização da pele passando para o cérebro através de desfibrilações de nervos não mióides. Caligiuri, et al (2003) defende que a medida que as lesões se aproximam da região bifurcada, o sinal pode se mover, causando secreção de neuropeptídios e vasodilatação.
A dificuldade de encontrar estudos que objetivamente foram aprofundados na relação sólida entre a imunidade e os mecanismos estimulatórios e inibidores da inflamação foram expostos durante a seleção de artigos para realizar esta revisão. No entanto, os procedimentos de sequência se enfrentam quando há uma inflamação.
6 CONSIDERAÇÕES FINAIS
Os estudos analisados nos permitiram deduzir a relevância do tema, pois estima a esplendor entre o processo inflamatório e o sistema imunológico. A análise mostrou que o processo inflamatório é crucial para garantir uma resposta imune adquirida, pois aumenta o fluxo da linfa e, de acordo com isso, o número de células apresentadas que transportam antigas para os órgãos linfóides. Além disso, os linfócitos agem no organismo como uma importante estrutura de defesa, interagindo em um complexo de células e moléculas específicas, liberando os agentes invasores e impedindo sua ação, preservando a integridade e o equilíbrio do mesmo. Para que tenhamos um estudo mais aprofundado na temática, é necessário aprofundar mais nossos estudos futuros na relação de transmissão de sinais do local da entrega até o sistema nervoso central.
REFERÊNCIAS
Abbas AK, Lichtman AH: Cellular and Molecular Immunology. 6th ed. Saunders 2003. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu Y et al Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18:767-811.
Barshack,I., et al (2003). Relation of preexisting anti-beta 2 GPI antibodies to infarct size in a rat model. Cardiovasc Pathol; 12(4): 195-201
Barrington R, Zhang M, Fischer M, Carroll MC. The role of complement in inflammation and adaptive immunity. Immunol Rev 2001; 180:5-15.
Barros, M. P., et al (2012). Mecanismos específicos de patogenicidade de protozoários intracelulares: Tripanosoma cruzi, Leishmania spp., Toxoplasma gondii e Plasmodium spp. Revista Liberato, Novo Hamburgo, 3(20), p. 01-19
Brinkmann V, Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS et al Neutrophil extracellular traps kill bacteria. Science 2004; 303:1477-8.
Caligiuri,G., et al (2003). Autoreactive antibody repertoire is perturbed in atherosclerotic patients. Lab Invest;83(7):939-47
Calixto JB, Medeiros R, Fernandes ES, Ferreira J, Cabrini DA, Campos MM. Kinin B1 receptors: key G-protein-coupled receptors and their role in inflammatory and painful processes. Br J Pharmacol 2004; 143:803-18.
Carlos TM, Harlan JM. Leukocyte-endothelial adhesion molecules. Blood 1994; 84:2068- 210.
Cartier L, Hartley O, Dubois-Dauphin M, Krause KH. Chemokine receptors in the central nervous system: role in brain inflammation and neurodegenerative diseases. Brain Res Brain Res Rev 2005; 48:16-42.
Coelho-Castelo, A. A. M.,et al (2009). Resposta imune a doenças infecciosas. Revista Medicina de Ribeirão Preto. Ribeirão Preto, 42(2), p. 42-127.
Cerwenka A, Lanier LL. Natural killer cells, viruses and cancer. Nat Rev Immunol 2001; 1:41-9.
Cruvinel, W. M.,et al (2010). Sistema Imunitário–Parte I Fundamentos da imunidade inata com ênfase nos mecanismos moleculares e celulares da resposta inflamatória. Revista Brasileira de Reumatologia, São Paulo, v. 50(4), p. 61 –434.
Curtis M. A. (2003). Summary: microbiological perspective. Mol Immunol; 40(7): 477-9.
Cyster JG. Chemokines and cell migration in secondary lymphoid organs. Science 1999; 286: 2098-102.
Delves PJ, Roitt D. The Immune System – First of two parts. N Engl J Med 2000; 343:37-50.
Farhat, C. K.,et al (2000). Bases imunológicas e Imunizações: fundamentos e prática. (4ª. ed.): Atheneu, p. 19-36
Fujiwara N, Kobayashi K. Macrophages in inflammation. Curr Drug Targets Inflamm Al- lergy 2005; 4:281-8.
Germain RN. MHC-dependent antigen processing and peptide presentation: providing ligands for T lymphocyte activation. Cell 1994; 76:287-99.
Heyworth PG, Cross AR, Curnutte JT. Chronic granulomatous disease. Curr Opin Immunol 2003; 15:578-84.
Hogan SP, Rosenberg HF, Moqbel R, Phipps S, Foster PS, Lacy P et al Eosinophils: biological properties and role in health and disease. Clin Exp Allergy 2008; 38:709-50.
Janeway CA, Medzhitov R. Innate immunity recognition. Annu Rev Immunol 2002; 20:197- 216.
Jobim, M.,& Jobim, L. F. J. (2008). Células natural killer e vigilância imunológica. Jornal de Pediatria, Rio deJaneiro, 84(4) (suplemento), p. S58.
Kazatchkine M. D.,& Kaveri S. V (2001). Immunomodulation of autoimmune and inflammatory diseases with intravenous immune globulin. N Engl J Med;345: 747-55.
Kipriyanov S. M.,& Le Gall F (2004). Generation and production of engineered antibodies.Mol Biotechnol;26(1):39-60
Klein J, Sato A. The HLA System. First of two parts. N Engl J Med 2000; 343:702-9.
Kunkel EJ, Butcher EC. Chemokines and the tissue-specific migration of lymphocytes. Immunity 2002; 16:1-4.
Lindsley A. W., et al (2020). Eosinophil responses during COVID-19 infections and coronavirus vaccination. J Allergy Clin Immunol 146(1):1–7.
Machado, P. R. L.,et al (2004). Mecanismo de resposta immune às infecções. Anais Brasileiros de Dermatologia, Rio de Janeiro79(6), p. 647-662.
Matsumoto,Y., et al (2000).Successful TCR-based immunotherapy for autoimmune myocarditis with DNA vaccines after rapid identification of pathogenic TCR. J Immunol; 164(4): 2248-54
Medzhitov R, Janeway C Jr. Innate immunity. N Engl J Med, 2000; 343:338-44
Metcalfe DD. Mast cells and mastocytosis. Blood 2008; 112: 946-56.
Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol 2008; 8:958-69.
Nikolich, J., etal (2004). The many important facets of T-cell repertoire diversity. Nature Reviews Immunology, 4: 123-132.
Pordeus,V., et al (2003). Multiparametric Analysis of Reactivity Profiles of serum IgG of Patients with Myocarditis and Dilated Cardiomyopathy. In: Brazilian Congress on Heart Failure. São Paulo: Brazilian Society of Cardiology.
Raz,E.,& Mahabaleshwar,H.(2009). Chemokine signaling in embryonic cell migration: a fisheye view. Development.136(8):1223-9. Review.
Sallusto F, Lanzavecchia A. Mobilizing dendritic cells for tolerance, priming, and chronic inflammation. J Exp Med 1999; 189:611-4.
Sayed BA, Christy A, Quirion MR, Brown MA. The Master Switch: the role of mast cells in autoimmunity and tolerance. Annu Rev Immunol 2008; 26:705-39.
Shoenfeld, Y., et al (2002). Efficacy of IVIG affinity-purified anti-double-stranded DNA anti- idiotypic antibodies in the treatment of an experimental murine model of systemic lupus erythematosus. Int Immunol; 14(11): 1303-11.
Yokoyama WM, Kim S, French AR. The Dynamic life of natural killer cells. Annu Rev Immunol 2004; 22:405-29.
¹Biomédico. Especialista em Patologia Clínica. Mestrando em Biotecnologia – Centro Universitário – UNINTA. Orcid: https://orcid.org/0009-0001-5597-2398. Email: jozeliobiomedico@gmail.com
²Bióloga – UFRPE. Orcid: https://orcid.org/0009-0007-4996-7000. Email: alinesantanabiologa@gmail.com
³Graduanda em Enfermagem – Universidade Tiradentes – UNIT. Email: nicolester123@gmail.com
4Cirurgiã-dentista – Centro Universitário – UNINTA. Orcid: https://orcid.org/0009-0000-5020-3445. Email: ingridbrandao812@gmail.com
5Biomédica– Mestranda em Biotecnologia – Centro Universitário – UNINTA. Email: bmd.larissaalbuquerque@gmail.com Orcid: https://0000-0002-0517-6465.
6Graduanda em Odontologia – Centro Universitário – UNINTA. Orcid: https://orcid.org/0009-0009-8112-1835 Email: vitoriaisterfany@gmail.com
7Graduada em Enfermagem – PUC Minas. Orcid: https://orcid.org/0009-0006-3941-9687. Email:Email: julianarampazzo28@gmail.com
8Graduando em Medicina – Universidade Nove de Julho – São Bernardo do Campo. Orcid:https://orcid.org/0009-0003-6190-8928. Email: rodriggosantos@gmail.com
9Graduanda em Medicina – Universidade Tiradentes – UNINT . Orcid: https://orcid.org/0009-0001-0461-6764. Email: julia.valois@souunit.com.br
10Meste em Ensino de Biologia – Universidade Federal de Santa Catarina (UFSC). Orcid: https://orcid.org/0000-0001-7313-5414. Email: claupprates@gmail.com
