REGISTRO DOI: 10.69849/revistaft/th102411251432
Cavalcante, Paula Andréa Malveiraa1
Jacobucci, Ricardo Luis Ramascoa1
Prumes, Cristiane Pasquaa1
Resumo: A prática regular de exercícios traz benefícios à saúde geral e pode reduzir o risco de Doença de Alzheimer (DA). Contudo, seu impacto na progressão da doença em pacientes já diagnosticados é incerto. Analisamos 16 estudos da base de dados PubMed sobre o potencial do exercício físico em melhorar funções cognitivas e físicas em pacientes com DA. Dos 11 estudos que avaliaram a função cognitiva, 45,45% relataram melhorias significativas, enquanto os demais não tiveram ganhos relevantes. Em relação às funções físicas, 88,89% dos 9 estudos indicaram melhorias notáveis, com apenas 11,11% sem benefícios significativos. Concluímos que o exercício físico tem impacto positivo na função física de pacientes com DA, mas os benefícios cognitivos parecem ser mais limitados. Abstract: Regular exercise brings overall health benefits and may reduce the risk of Alzheimer’s Disease (AD). However, its impact on the disease progression in diagnosed patients is uncertain. We analyzed 16 studies from the PubMed database on the potential of physical exercise in improving cognitive and physical functions in AD patients. Out of the 11 studies that assessed cognitive function, 45.45% reported significant improvements, while the rest did not show relevant gains. Regarding physical functions, 88.89% of the 9 studies indicated notable improvements, with only 11.11% showing no significant benefits. We concluded that physical exercise has a positive impact on the physical function of AD patients, but the cognitive benefits seem to be more limited. Palavras-chave/ Keywords: Alzheimer; exercício físico, função cognitiva, função física, Alzheimer’s, physical exercise, cognitive function, physical function
1. Introdução
Embora existam evidências que indiquem os benefícios da prática regular de exercícios físicos para a saúde geral e a possível redução do risco de desenvolver a Doença de Alzheimer (DA) ou retardar o seu aparecimento1-4, seu impacto na progressão da DA em pacientes já diagnosticados ainda é incerto.
A DA é uma doença neurodegenerativa crônica que afeta progressivamente as funções cognitivas, comprometendo a memória, a linguagem, o raciocínio e a capacidade de realizar atividades diárias5. Com o envelhecimento global da população, a DA tem se tornado um desafio para a saúde pública e um foco prioritário de pesquisa científica.6,7
Apesar de a cura para a DA ainda não existir, atualmente há várias abordagens terapêuticas sendo investigadas com o objetivo de retardar a progressão da doença e melhorar a qualidade de vida dos pacientes. Dentre essas abordagens, o exercício físico tem despertado um interesse crescente, devido aos potenciais benefícios que podem proporcionar para a função cognitiva e física dos indivíduos afetados pela doença.7,8
As evidências atuais sugerem que a implementação de uma rotina de exercícios pode ser uma estratégia promissora para mitigar os sintomas e aprimorar a qualidade de vida dos indivíduos com DA.9 No entanto, a literatura ainda não chegou a uma conclusão definitiva em relação aos efeitos dos exercícios nas funções cognitivas e físicas dos pacientes com DA. É igualmente relevante ressaltar que não existe um método único capaz de garantir a prevenção completa ou o tratamento eficaz dessa condição.
Nesta revisão sistemática, nosso objetivo foi avaliar a literatura científica existente e investigar se o exercício físico promove melhorias nas funções cognitivas e físicas de pacientes diagnosticados com DA. Para alcançar esse objetivo, realizamos uma análise de estudos que abordaram exercícios aeróbicos, resistidos e combinados, buscando entender seus efeitos específicos nas diversas dimensões das funções cognitivas e físicas em pacientes com DA. Com base nas informações obtidas, pretendemos fornecer uma síntese abrangente dos resultados e contribuir para a compreensão dos potenciais benefícios do exercício físico como uma intervenção terapêutica complementar para pacientes com DA.
2. Metodologia
A metodologia adotada para esta revisão seguiu as bases de dados científicas da PubMed, em 01/08/2022, utilizando combinações de palavras-chave relacionadas ao exercício físico e à DA. Essa metodologia também foi empregada em um artigo publicado por Cavalcante PAM em 2017.10
Para realizar a busca, foram selecionados ensaios clínicos randomizados no período de 2017 a 2022. A pesquisa envolveu 6 palavras-chave: “Alzheimer”, “aerobic exercise”, “strength exercise”, “physical activity”, “resistance exercise”, “exercise”.
Para combinar as palavras-chave, foram criados 5 grupos para conectar os termos relacionados ao exercício (“aerobic exercise”, “strength exercise”, “physical activity”, “resistance exercise”, “exercise”) ao termo associado à DA (“Alzheimer”).
Os grupos foram formados a partir da combinação de duas palavras-chave individuais, utilizando o operador booleano “AND”. Os grupos foram organizados da seguinte maneira:
Grupo 1 – Alzheimer AND aerobic exercise
Grupo 2 – Alzheimer AND strength exercise
Grupo 3 – Alzheimer AND physical activity
Grupo 4 – Alzheimer AND exercise
Grupo 5 – Alzheimer AND resistance exercise
Além disso, incluímos artigos que abordaram no mesmo estudo tanto a DA quanto outras demências. Também foram considerados estudos que investigaram a prática de exercícios combinados, envolvendo tanto exercícios aeróbios quanto exercícios resistidos realizados na mesma sessão.
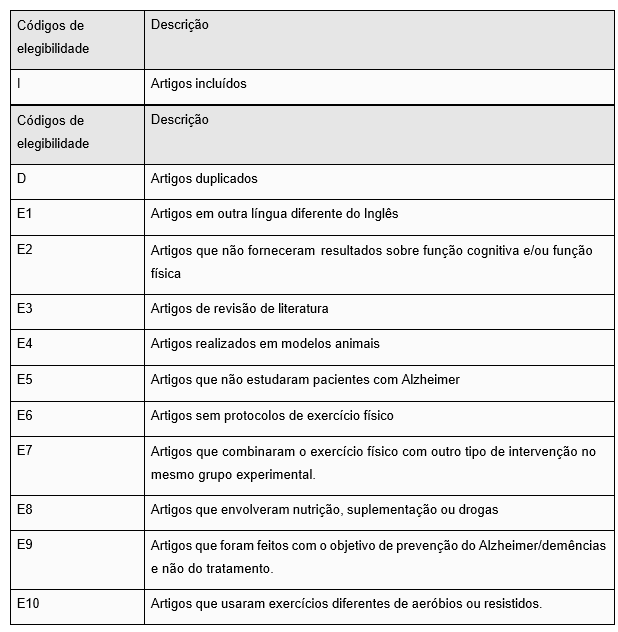
Os critérios de exclusão dos artigos nesta revisão, conforme descritos na Tabela 1, foram categorizados da seguinte forma: artigos em outra língua diferente do Inglês; artigos que não forneceram resultados sobre função cognitiva e/ou função física; artigos de revisão de literatura; artigos realizados em modelos animais; artigos que não estudaram pacientes com Alzheimer; artigos sem protocolos de exercício; artigos que combinaram o exercício físico com outro tipo de intervenção no mesmo grupo experimental; artigos que envolveram nutrição, suplementação ou drogas; artigos que foram feitos com o objetivo de prevenção do Alzheimer/demências e não do tratamento; artigos que usaram exercícios diferentes de aeróbios ou resistidos.
Para isso, foram desenvolvidos códigos que associaram os critérios de elegibilidade a todos os itens encontrados durante a pesquisa.
Tabela 1: Códigos de elegibilidade
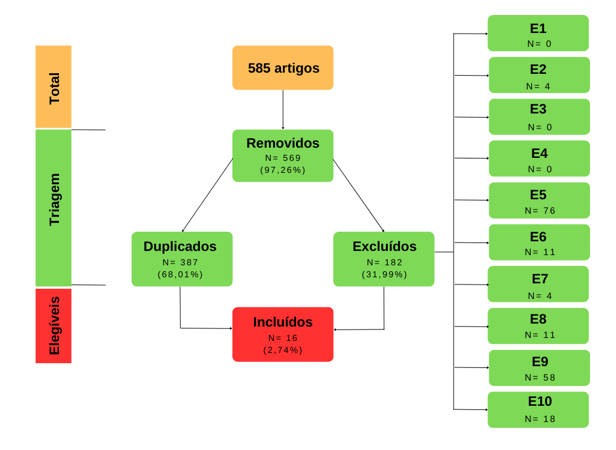
Em 01/08/2022, foram identificados 585 artigos no banco de dados do PubMed. A distribuição dos artigos na pesquisa pode ser observada na Tabela 2. O fluxograma do processo de seleção dos artigos e a sua associação com o tema da pesquisa é apresentado na Figura 1. Além disso, detalhamos cuidadosamente o número total de artigos encontrados e a distribuição dos artigos excluídos.
Tabela 2: Distribuição do número de artigos por grupos estudados
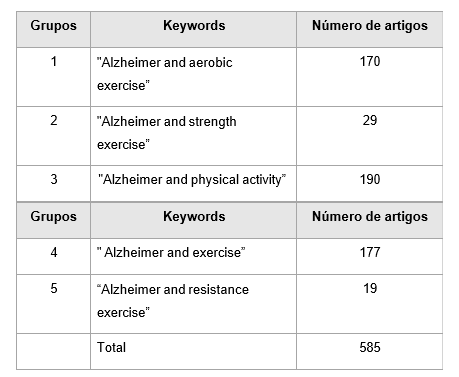
Figura 1: Fluxograma da pesquisa bibliográfica
4. Resultados
Após realizar a triagem conforme demonstrado na Figura 1, identificamos 16 artigos que preencheram os requisitos de elegibilidade para esta revisão. Todos foram baseados em amostras humanas. Os artigos selecionados foram classificados de acordo com o tipo de exercício abordado, sendo eles aeróbio, resistido ou combinado, conforme apresentado nas Tabelas 3 a 9.
Por meio desses artigos elegíveis, tivemos a oportunidade de analisar de forma mais detalhada os impactos do exercício físico nas capacidades físicas e cognitivas. Com o objetivo de categorizar os artigos que apresentaram melhora na função cognitiva e/ou física, adotamos a designação “S”. Por outro lado, aos estudos que não observaram melhora em uma dessas funções, foi atribuída a letra “N”. Para os artigos incluídos nesta revisão, mas que não investigaram especificamente uma dessas duas funções (cognitiva ou física), utilizamos o código “0”.
Durante nossa pesquisa, identificamos 3 artigos que constataram melhorias na função cognitiva por meio de exercícios aeróbicos.11-13 Por outro lado, encontramos 3 artigos que não encontraram melhorias significativas na função cognitiva com o exercício aeróbico14-16, conforme destacado nas Tabelas 3 e 4.
Quanto aos exercícios combinados, encontramos 3 artigos17-19 que não demonstraram melhora nas funções cognitivas, enquanto 2 artigos20,21 observaram melhora (Tabelas 5 e 6). Nenhum dos artigos incluídos nesta revisão estudou especificamente os efeitos dos exercícios resistidos na função cognitiva, como mostrado nas Tabelas 7 e 8.
Com relação às funções físicas, em nosso estudo encontramos 3 artigos que demonstraram melhora na função física por meio de exercícios aeróbicos.11,22,23 Não foram encontrados artigos em nosso estudo que indicassem que o exercício aeróbico não resultou em melhorias significativas na função física, conforme apresentado nas Tabelas 3 e 4.
Quanto aos exercícios resistidos, encontramos um estudo24 que evidenciou melhora na função física (Tabelas 7 e 8).
Nos exercícios combinados, ou seja, aqueles que envolveram exercícios aeróbicos e resistidos na mesma sessão, identificamos 4 estudos17,19,25,26 que concluíram que houve melhora na função física. Por outro lado, um artigo18 não observou melhora significativa na função física (Tabelas 5 e 6).
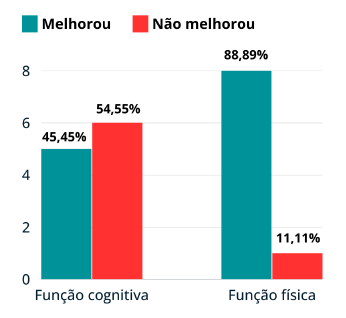
Na Tabela 9 e na Figura 2, apresentamos a quantidade de estudos que comprovaram melhorias na função física e cognitiva por meio da prática de exercícios aeróbicos, resistidos ou combinados. Dos 11 artigos que investigaram a função cognitiva, verificamos que 45,45% deles evidenciaram melhorias nesse aspecto, enquanto nos outros 54,55% não foram observados ganhos significativos. Em relação às funções físicas, dos 9 artigos que abordaram essa temática, 88,89% dos estudos indicaram uma melhora notável, enquanto em 11,11% não foram observados benefícios significativos (Figura 2).
Esses dados resumem as descobertas relacionadas à função cognitiva e física nos estudos revisados. As informações fornecidas na Tabela 9 e na Figura 2 oferecem uma visão geral do panorama das evidências encontradas, destacando a proporção de estudos que demonstraram melhorias nessas áreas específicas.
Tabela 3: Exercícios aeróbios:
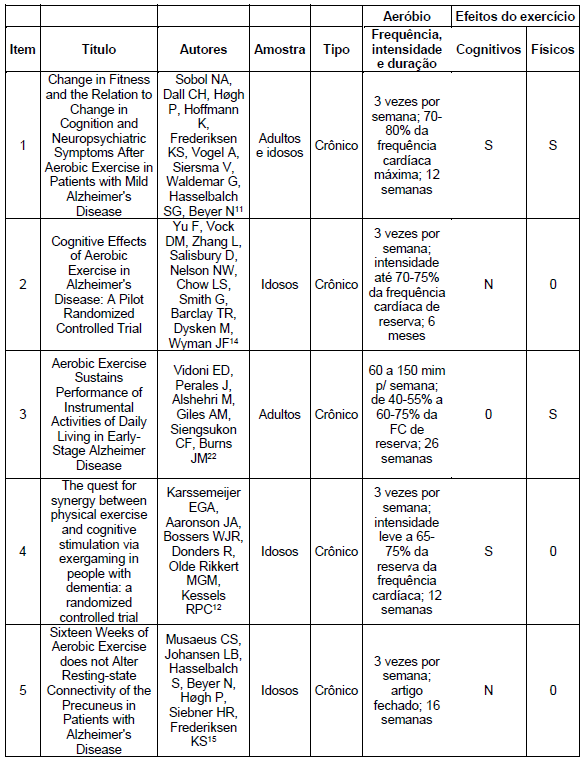
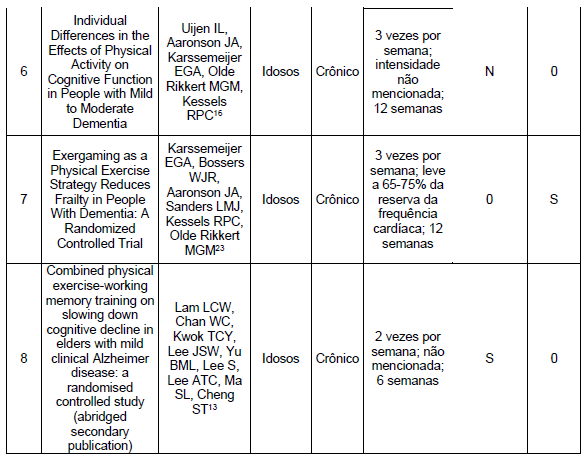
Tabela 4: Resultados quantitativos das funções física e cognitiva nos exercícios aeróbios
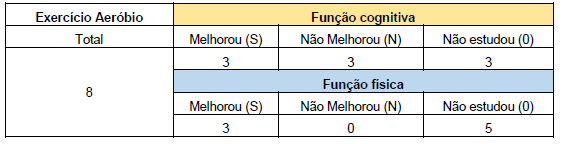
Tabela 5: Exercícios combinados

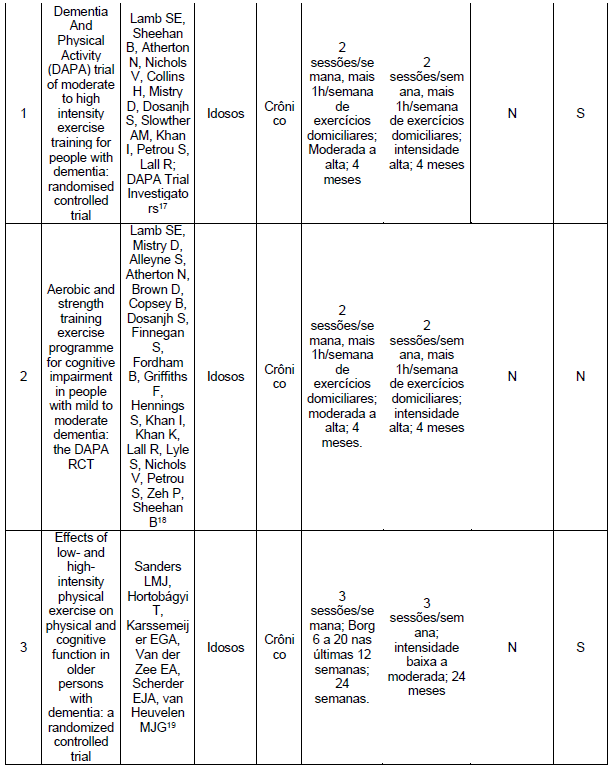
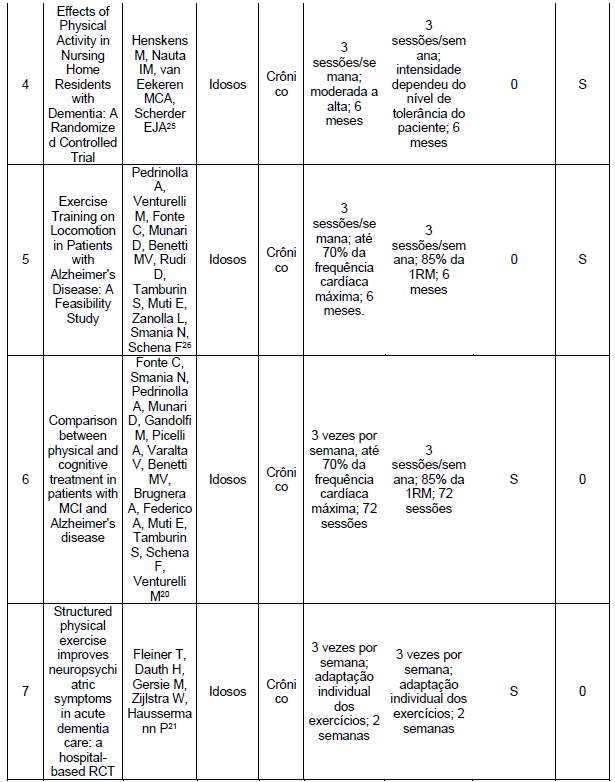
Tabela 6: Resultados quantitativos das funções física e cognitiva nos exercícios combinados

Tabela 7: Exercícios resistidos:
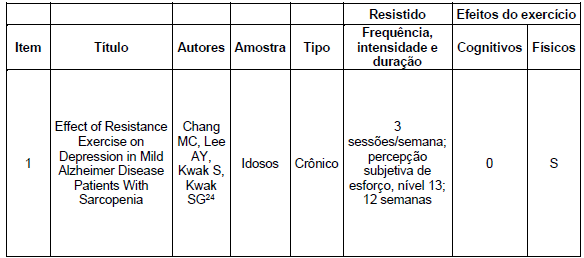
Tabela 8: Resultados quantitativos das funções física e cognitiva nos exercícios resistidos

Tabela 9: Resultados quantitativos das funções física e cognitiva nas 3 modalidades de exercício
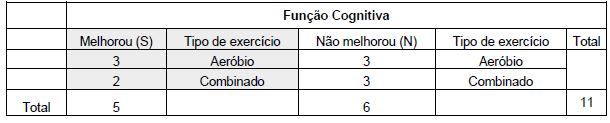
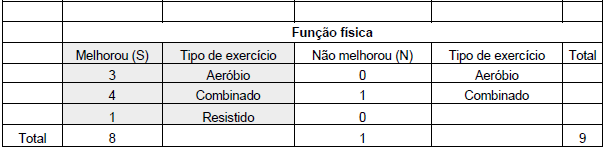
Figura 2: Resultados das funções física e cognitiva nas 3 modalidades de exercício
4. Discussão
Esta revisão ofereceu duas importantes contribuições para o campo de estudo sobre o exercício físico em pacientes com DA. A primeira contribuição é a evidência clara da melhora na função física. Os resultados mostraram consistentemente que o exercício físico proporciona benefícios significativos para a função física em pacientes com DA. Essas descobertas reforçam a importância do exercício como uma intervenção terapêutica não farmacológica para melhorar a capacidade física e a qualidade de vida desses indivíduos.
A segunda contribuição é a identificação das limitações na melhora da função cognitiva. Embora o exercício tenha demonstrado um impacto positivo na função física, os ganhos na função cognitiva foram mais limitados em pacientes com DA.
4.1 Efeitos do exercício físico nas funções cognitivas
A DA é caracterizada pela gradual perda das funções cognitivas. As funções cognitivas desempenham um papel fundamental na compreensão dos comportamentos, desde os mais simples até as situações mais complexas, envolvendo atividades cerebrais elaboradas. Entre as principais funções cognitivas estão percepção, atenção, memória, linguagem, raciocínio, inteligência e funções executivas.27
Em relação à intervenção por meio de exercícios físicos aeróbios em pacientes com demência, o estudo de Uijen et al. (2020)16 constatou que apenas uma pequena parcela desses indivíduos apresentou melhorias significativas e consistentes na cognição global ou em qualquer um dos domínios cognitivos. Além disso, observou-se que a redução na memória episódica foi menos acentuada em pessoas com demência que não seja Alzheimer após a intervenção.
Um estudo conduzido por Musaeus et al. (2022)15 investigou o efeito de 16 semanas de exercício aeróbio na conectividade funcional do córtex cingulado posterior e do precuneus adjacente em pacientes com DA. No entanto, os resultados não mostraram modificações na conectividade funcional dessas regiões. Estudos sugerem que o córtex cingulado posterior desempenha um papel cognitivo importante e que anormalidades nessa região estão claramente relacionadas à DA.28
O estudo de Yu et al. (2021)14 revelou que uma intervenção de exercícios aeróbios por seis meses, três vezes por semana, reduziu o declínio da cognição global em idosos com DA. No entanto, não foram encontrados efeitos cognitivos superiores ao grupo controle de alongamento.
Sobol et al. (2018)11 sugeriram que as mudanças na aptidão aeróbica resultantes do treinamento aeróbico podem estar relacionadas a alterações na cognição e nos sintomas neuropsiquiátricos. No entanto, é importante considerar a diferença interindividual, pois nem todos os indivíduos responderão da mesma forma ao mesmo tratamento, no mesmo grau e no mesmo período de tempo, nem terão os mesmos perfis de efeitos colaterais29.
Os resultados do estudo de Yu (2021)29, realizado em pacientes com DA, demonstraram que as respostas em termos de aptidão aeróbica e cognição ao exercício aeróbico podem variar entre os participantes. Essa descoberta sugere, entre outras coisas, que mesmo indivíduos com baixa sensibilidade a intervenções de exercício aeróbico ainda podem obter benefícios cognitivos com o exercício, indicando que o exercício aeróbico pode proporcionar benefícios cognitivos independentemente das alterações na aptidão aeróbica.
Em relação ao estudo de Karssemeijer et al. (2019)12, dois grupos experimentais foram formados. Um deles recebeu treinamento aeróbio em bicicleta, enquanto o outro participou de um treinamento combinando cognitivo-aeróbico em bicicleta. O resultado mostrou melhorias na velocidade psicomotora em ambos os grupos experimentais, em comparação com um grupo controle ativo. No entanto, não foram encontrados efeitos diretos sobre a função executiva, memória episódica e memória de trabalho.
No estudo de Lam et al. (2022)13, um programa de treinamento aeróbico de seis semanas resultou em melhorias significativas no teste de fluência verbal e na capacidade de memorização atrasada. No entanto, os benefícios alcançados foram de curta duração e se dissiparam rapidamente após a interrupção da intervenção.
Fleiner et al. (2017)21 constataram que um programa de exercícios combinados com duração de duas semanas promoveu uma redução significativa nos sinais e sintomas neuropsiquiátricos em pacientes com demência moderada. Outros estudos17-19, não encontraram efeitos significativos do programa combinado de exercícios na função cognitiva em pacientes com demência.
O estudo conduzido por Fonte (2019)20 comparou os efeitos do treinamento cognitivo com o treinamento físico em relação à DA. Ambos os grupos conseguiram preservar o estado cognitivo ao longo dos seis meses de tratamento, porém, observou-se uma queda acentuada no desempenho cognitivo três meses após o término do treinamento.
Os nossos resultados sugerem que o impacto do exercício físico nas funções cognitivas é mais variável e não tão consistentemente positivo quanto nas funções físicas (Figura 2).
4.2 Efeitos do exercício físico nas funções físicas
As funções físicas são de extrema importância para o pleno funcionamento do corpo humano e estão diretamente ligadas à nossa capacidade de realizar uma ampla variedade de atividades. Elas englobam um conjunto de habilidades e capacidades relacionadas ao movimento e ao desempenho físico, tais como mobilidade, força, resistência, flexibilidade, equilíbrio, entre outras.30
A função física tem sido reconhecida como um indicador crucial da saúde de um indivíduo. Limitações nas funções físicas estão associadas a resultados adversos para a saúde, tais como aumento do risco de incapacidade, mortalidade, hospitalização e baixa qualidade de vida.30,31
Os estudos incluídos nessa revisão investigaram os efeitos do exercício físico nas funções físicas de pacientes com DA. Os resultados indicaram benefícios significativos proporcionados pelo exercício físico nessa população.11,17,19,22-26
Em relação aos exercícios aeróbicos, os estudos incluídos nesta revisão11,22,23 relataram benefícios na função física de pacientes com DA. Entre os resultados encontrados, destaca- se a melhoria do VO2pico11, a independência nas atividades instrumentais da vida diária22 e a redução do nível de fragilidade.23
No que diz respeito aos exercícios combinados, os estudos demonstraram melhorias no condicionamento físico17, na velocidade da marcha19, na resistência física25 e no custo energético da marcha.26 No entanto, o estudo de Lamb (2018)18 concluiu que um programa de exercícios combinados não produziu nenhum benefício clinicamente significativo na função física ou na qualidade de vida em pessoas com DA ou na sobrecarga do cuidador. Quanto aos exercícios resistidos, o estudo de Chang (2020)24 evidenciou melhorias na força muscular isométrica em pacientes com DA.
Esses achados sugerem que o exercício físico desempenha um papel importante na preservação das funções físicas em pacientes com DA. Recomenda-se que os pacientes com DA participem de programas de exercícios supervisionados e adaptados às suas necessidades individuais, visando melhorar a função física, a independência e a qualidade de vida. No entanto, é importante ressaltar que a prescrição e supervisão de exercícios devem ser realizadas por profissionais de saúde especializados, levando em consideração as limitações e condições específicas de cada paciente.
4.3 Mecanismos ligados à fisiopatologia da DA
Além do principal fator de risco genético, a presença do alelo ε4 da apolipoproteína E (APOE), outros fatores de risco devem ser considerados na doença de Alzheimer, tais como baixa escolaridade, hipertensão, obesidade, perda auditiva, depressão, diabetes, sedentarismo, tabagismo e isolamento social.8,32
Ainda que a presença do alelo ε4 da APOE seja um fator de risco significativo para o desenvolvimento da doença, é importante ressaltar que nem todas as pessoas que possuem esse alelo desenvolverão a doença de Alzheimer, assim como nem todas as pessoas sem o alelo ε4 estarão livres do risco.33
Estudos mostraram34,35 que a desregulação epigenética, incluindo modificações de histonas, metilação do DNA, remodelamento da cromatina e RNAs não codificantes esteja subjacente ao declínio funcional relacionado ao envelhecimento, é em si um fator de risco para várias doenças esporádicas, como a DA. López-Otín (2013) e colegas36, exploraram as diferentes características biológicas associadas ao envelhecimento e forneceram evidências substanciais de que a desregulação epigenética desempenha um papel crucial no processo de envelhecimento e na predisposição a doenças crônicas, incluindo o câncer e a DA.
Os avanços na medicina molecular têm revelado a via do β amiloide (Aβ) como um componente central na fisiopatologia da DA. No entanto, os mecanismos moleculares específicos dessa via e a dinâmica espaço-temporal que levam à falência sináptica, neuro degeneração e início clínico ainda estão sendo extensivamente investigados.37
A inflamação tem sido identificada como um importante contribuinte para a patologia da DA.38. Contudo, permanece incerto se a inflamação é a causa ou o resultado do acúmulo patológico de placas Aβ. Em outras palavras, não está claro se as placas Aβ desencadeiam a inflamação ou se a neuroinflamação aumenta o acúmulo de Aβ.39
É fundamental ressaltar que uma compreensão detalhada desses mecanismos é essencial para o desenvolvimento de estratégias terapêuticas eficazes contra a DA. Nesse sentido, estudos como o trabalho de Selkoe (2016)40 têm contribuído significativamente para elucidar os intrincados processos envolvidos na formação e acumulação de Aβ no cérebro, fornecendo uma base sólida para o entendimento da progressão da doença e a identificação de possíveis alvos terapêuticos. No entanto, ainda há muito a ser descoberto e compreendido sobre essa via complexa e o seu papel na DA, destacando a necessidade contínua de pesquisas em andamento para desvendar completamente os mecanismos subjacentes a essa doença devastadora.
Além disso, é importante enfatizar que os níveis da proteína tau aumentam na DA, confirmado por análises patológicas, e são reconhecidos como um biomarcador de neuro degeneração nos estudos contemporâneos sobre demência da DA.41 Embora seja possível que as placas de β-amiloide e os depósitos de tau neurofibrilar não sejam diretamente causais na patogênese da DA, são esses depósitos proteicos anormais que caracterizam a DA como uma doença neurodegenerativa única em relação a outras condições que também podem levar à demência.42 No entanto, a complexidade intrínseca dessa doença requer investigações contínuas para obter uma compreensão mais aprofundada e, assim, desenvolver intervenções terapêuticas eficazes. É necessário explorar os mecanismos subjacentes aos depósitos de β- amiloide e tau, bem como a interação entre eles, a fim de identificar alvos terapêuticos potenciais.
As pesquisas atuais estão focadas em investigar não apenas a formação desses depósitos, mas também os eventos moleculares e celulares que desencadeiam a disfunção sináptica e a neuro degeneração associadas à DA. Compreender esses processos complexos é crucial para o desenvolvimento de estratégias terapêuticas direcionadas, que possam atrasar, prevenir ou até mesmo reverter os efeitos debilitantes da doença. A abordagem multidisciplinar, envolvendo neurociência, biologia molecular, genética e outros campos relacionados, é fundamental para avançar no conhecimento da DA e proporcionar melhores perspectivas para diagnóstico, tratamento e cuidados dos pacientes afetados por essa condição.
4.4 Mecanismos subjacentes aos efeitos do exercício físico
Existem fatores de risco evitáveis relacionados ao estilo de vida que estão associados ao aumento do risco de demência e DA, tais como o sedentarismo e a falta de atividade física.43,44
Um crescente conjunto de evidências aponta fortemente que o exercício físico pode desempenhar um papel na redução do comprometimento cognitivo e no risco de desenvolver doença de Alzheimer, atuando por meio de diversos mecanismos.45 No entanto, é importante ressaltar que essas descobertas não são consistentes em todos os estudos, e muitas pesquisas não conseguiram comprovar essa associação.46
Nesse contexto, o uso de exercícios físicos como uma abordagem terapêutica complementar ao tratamento médico convencional para DA e outras demências é uma perspectiva atrativa,47mas os efeitos bioquímicos subjacentes a essa relação ainda são amplamente desconhecidos.48,49
Evidências indicam que a atividade física pode atenuar o comprometimento cognitivo por meio de mecanismos independentes do beta-amiloide (Aβ), como a redução da ativação da microglia e o aumento das células positivas para o fator neurotrófico derivado do cérebro (BDNF)46. Nesse sentido, a prática regular de exercícios estimula a produção de substâncias neuro protetoras e anti-inflamatórias, como o BDNF.50-52
Além disso, o exercício pode melhorar a circulação sanguínea cerebral e reduzir o risco de doenças cardiovasculares e inflamatórias, que são fatores que contribuem para a deterioração cognitiva. Ele também promove a neuroplasticidade, ou seja, a capacidade do cérebro de se adaptar e mudar ao longo da vida.7
No entanto, a maneira mais eficaz de proteger o cérebro e reduzir o risco de DA provavelmente é a prevenção em estágios pré-clínicos. Parece que a atividade física, especialmente o exercício aeróbico, é um desses fatores preventivos.46
Recentemente, houve um aumento do interesse na irisina, uma miocina induzida pelo exercício. Contudo, os estudos sobre esse tema ainda estão em estágios iniciais, e há questões em aberto que necessitam de mais investigação para compreender completamente o seu papel e os benefícios potenciais no tratamento e prevenção da DA.51,53
5. Conclusão
Até o momento, este estudo se destaca por sua contribuição pioneira ao abordar a proporção de estudos que investigaram os efeitos dos exercícios na melhoria das funções cognitiva e física em pacientes diagnosticados com DA. Assim, essa pesquisa traz uma importante contribuição para a compreensão dos potenciais benefícios dos exercícios aeróbicos, resistidos e combinados nessa população.
Nossa principal descoberta é a evidência de que o exercício proporciona melhorias significativas na função física, enquanto os ganhos na função cognitiva são mais limitados em pacientes com DA, sugerindo a necessidade de outras abordagens terapêuticas para tratar especificamente os déficits cognitivos associados à doença.
Em termos de implicações clínicas e recomendações para a prática clínica, esta revisão destaca a importância de integrar o exercício físico como parte do tratamento e manejo de pacientes com DA. Os profissionais de saúde devem encorajar e prescrever programas de exercícios personalizados, levando em conta a capacidade e as necessidades individuais dos pacientes. Embora o exercício possa não ter um impacto significativo na função cognitiva, é crucial reconhecer seus benefícios para a função física, que podem melhorar a independência e a qualidade de vida dos pacientes com DA.
É importante considerar as limitações e particularidades de cada estudo, como diferenças nos protocolos de exercícios, amostras de pacientes e medidas de avaliação. Portanto, são necessárias mais pesquisas futuras para uma compreensão mais aprofundada dos efeitos do exercício físico na função cognitiva, explorando diferentes abordagens e examinando fatores que possam influenciar os resultados. Além disso, é necessário explorar estratégias complementares que visem aprimorar a função cognitiva em pacientes com DA, seja por meio de abordagens multidisciplinares, combinação de intervenções ou desenvolvimento de protocolos de exercícios mais específicos.
Essas conclusões reforçam a importância de uma abordagem abrangente e individualizada no tratamento da DA, incorporando o exercício físico como parte integrante de um plano terapêutico multifacetado.
6. Referências bibliográficas:
Larson EB, Wang L, Bowen JD, McCormick WC, Teri L, Crane P et al. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older. Ann Intern Med. 2006; 144(2):73-81.
Lautenschlager NT, Cox KL, Flicker L, Foster JK, van Bockxmeer FM, Jianguo X et al. Effect of physical activity on cognitive function in older adults at risk for Alzheimer disease: a randomized trial. JAMA. 2008; 300(9):1027-37.
Buchman AS, Boyle PA, Yu L, Xá RC, Wilson RS, Bennett DA. Total daily physical activity and the risk of AD and cognitive decline in older adults. Neurology. 2012; 78(17):1323-9.
Meng Q, Lin M-S, Tzeng I-S. Relationship Between Exercise and Alzheimer’s Disease: A Narrative Literature Review. Front Neurosci. 2020; 26;14:131.
Rao VR, Subramaniam KG, Gregory J, Bredesen AL, Coward C, Okada S et al. Rationale for a Multi-Factorial Approach for the Reversal of Cognitive Decline in Alzheimer’s Disease and MCI: A Review. Int J Mol Sci. 2023; 24(2): 1659.
Alzheimer’s Association. Alzheimer’s disease facts and figures. Alzheimer’s Dement. 2021;17(3):327-406.
Chen C e Nakagawa S. Physical activity for cognitive health promotion: An overview of the underlying neurobiological mechanisms. Ageing Res Ver. 2023; Volume 86, 101868.
Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D et al. Dementia prevention, intervention, and care. Lancet. 2017; 390(10113):2673-2734
Daskalopoulou C, Stubbs B, Kralj C, Koukounari A, Prince M, Prina AM. Physical activity and healthy ageing: A systematic review and meta-analysis of longitudinal cohort studies. Ageing Res Ver.2017; 38:6-17.
Cavalcante PAM, Gregnani MF, Henrique JS, Ornellas FH e Araújo RC. Aerobic but not Resistance Exercise Can Induce Inflammatory Pathways via Toll-Like 2 and 4: a Systematic Review. Sports Medicine. 2017; Open volume 3, Article number: 42.
Sobol NA, Dall CH, Høgh P, Hoffmann K, Frederiksen KS, Vogel A et al. Change in Fitness and the Relation to Change in Cognition and Neuropsychiatric Symptoms After Aerobic Exercise in Patients with Mild Alzheimer’s Disease. J Alzheimers Dis. 2018;65(1):137-145.
Karssemeijer EGA, Aaronson JA, Bossers WJR, Donders R, Olde Rikkert MGM, Kessels RPC. The quest for synergy between physical exercise and cognitive stimulation via exergaming in people with dementia: a randomized controlled trial. Alzheimers Res Ther. 2019 Jan 5;11(1):3.
Lam LCW, Chan WC, Kwok TCY, Lee JSW, Yu BML, Lee S et al. Combined physical exercise-working memory training on slowing down cognitive decline in elders with mild clinical Alzheimer disease: a randomised controlled study (abridged secondary publication). Hong Kong Med J. 2022;28 Suppl 3(3):28-30.
Yu F, Vock DM, Zhang L, Salisbury D, Nelson NW, Chow LS. Cognitive Effects of Aerobic Exercise in Alzheimer’s Disease: A Pilot Randomized Controlled Trial. J Alzheimers Dis. 2021;80(1):233-244.
Musaeus CS, Johansen LB, Hasselbalch S, Beyer N, Høgh P, Siebner HR et al. Sixteen Weeks of Aerobic Exercise does not Alter Resting-state Connectivity of the Precuneus in Patients with Alzheimer’s Disease. Curr Alzheimer Res. 2022;19(2):171-177.
Uijen IL, Aaronson JA, Karssemeijer EGA, Olde Rikkert MGM, Kessels RPC. Individual Differences in the Effects of Physical Activity on Cognitive Function in People with Mild to Moderate Dementia. J Alzheimers Dis. 2020;74(2):435-439.
Lamb SE, Sheehan B, Atherton N, Nichols V, Collins H, Mistry D et al. Dementia And Physical Activity (DAPA) trial of moderate to high intensity exercise training for people with dementia: randomised controlled trial. BMJ. 2018; 361: k1675.
Lamb SE, Mistry D, Alleyne S, Atherton N, Brown D, Copsey B et al. Aerobic and strength training exercise programme for cognitive impairment in people with mild to moderate dementia: the DAPA RCT. Health Technol Assess. 2018 May;22(28):1-202.
Sanders LMJ, Hortobágyi T, Karssemeijer EGA, Van der Zee EA, Scherder EJA, van Heuvelen MJG. Effects of low- and high-intensity physical exercise on physical and cognitive function in older persons with dementia: a randomized controlled trial. Alzheimers Res Ther. 2020 19;12(1):28.
Fonte C, Smania N, Pedrinolla A, Munari D, Gandolfi M, Picelli A et al. Comparison between physical and cognitive treatment in patients with MCI and Alzheimer’s disease. Aging (Albany NY). 2019 May 24;11(10):3138-3155.
Fleiner T, Dauth H, Gersie M, Zijlstra W, Haussermann P. Structured physical exercise improves neuropsychiatric symptoms in acute dementia care: a hospital-based RCT. Alzheimers Res Ther. 2017;9(1):68.
Vidoni ED, Perales J, Alshehri M, Giles AM, Siengsukon CF, Burns JM. Aerobic Exercise Sustains Performance of Instrumental Activities of Daily Living in Early-Stage Alzheimer Disease. J Geriatr Phys Ther. 2019 Jul/Sep;42(3):E129-E134.
Karssemeijer EGA, Bossers WJR, Aaronson JA, Sanders LMJ, Kessels RPC, Olde Rikkert MGM. Exergaming as a Physical Exercise Strategy Reduces Frailty in People
With Dementia: A Randomized Controlled Trial. J Am Med Dir Assoc. 2019 Dec;20(12):1502-1508.e1.
Chang MC, Lee AY, Kwak S, Kwak SG. Effect of Resistance Exercise on Depression in Mild Alzheimer Disease Patients With Sarcopenia. Am J Geriatr Psychiatry. 2020 May;28(5):587-589.
Henskens M, Nauta IM, van Eekeren MCA, Scherder EJA. Effects of Physical Activity in Nursing Home Residents with Dementia: A Randomized Controlled Trial. Dement Geriatr Cogn Disord. 2018;46(1-2):60-80
Pedrinolla A, Venturelli M, Fonte C, Munari D, Benetti MV, Rudi D et al. Exercise Training on Locomotion in Patients with Alzheimer’s Disease: A Feasibility Study. J Alzheimers Dis. 2018;61(4):1599-1609.
Lezak, M. D., Howieson, D. B., Bigler, E. D., & Tranel, D. Neuropsychological assessment (5th ed.). Oxford University Press; 2012
Leech R, Sharp DJ. The role of the posterior cingulate cortex in cognition and disease. Brain : a journal of neurology. 2014 Jan 2014;137
Yu F, Salisbury D, Mathiason MA. Inter-individual differences in the responses to aerobic exercise in Alzheimer’s disease: Findings from the FIT-AD trial. J Sport Health Sci. 2021 Jan;10(1):65-72.
Hillsdon M, Foster C. What are the health benefits of muscle and bone strengthening and balance activities across life stages and specific health outcomes? J Frailty Sarcopenia Falls. 2018 Jun 1;3(2):66-73.
Bhasin S, Jasuja R, Tu P, Storer TW, Guo W. Novel strategies for improving physical function. Horm Res Paediatr. 2011;76 Suppl 1(Suppl 1):17-23.
ADI. World Alzheimer Report 2014: Dementia and Risk Reduction – An analysis of protective and modifiable factors. Alzheimer’s Disease International. Disponível em: https://www.alz.co.uk/research/world-report-2014
Tang MX, Stern Y, Marder K, Bell K, Gurland B, Lantigua R, et al. The APOE-epsilon4 allele and the risk of Alzheimer disease among African Americans, whites, and Hispanics. JAMA. 1998;279(10):751-755.
Hampel H, Lista S, Neri C, Vergallo A. Time for the systems-level integration of aging: Resilience enhancing strategies to prevent Alzheimer’s disease. Prog Neurobiol. 2019; 181:101662.
Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer’s disease related cognitive functioning. Aging. 2015; 7:1198–211.
López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The Hallmarks of Aging. Cell. 2013; 153(6): 1194–217.
Hampel H, Hardy J, Kaj Blennow K, Chen C, Perry G, Kim SH. The Amyloid-β Pathway in Alzheimer’s Disease. Mol Psychiatry. 2021; 26(10): 5481–5503.
Ransohoff RM. How neuroinflammation contributes to neurodegeneration. Science. 2016; 353(6301):777-83.
Bagyinszky E, Giau VV, Shim K, Suk K, An SSA, Kim S. Role of inflammatory molecules in the Alzheimer’s disease progression and diagnosis. Journal of the Neurological Sciences. 2017;376:242-254.
Selkoe DJ & Hardy J. The amyloid hypothesis of Alzheimer’s disease at 25 years. EMBO Mol Med. 2016 Jun 1; 8(6):595-608.
Abed SS, Hamdan FB, Hussein MM, Al-Mayah QS. Plasma tau and neurofilament light chain as biomarkers of Alzheimer’s disease and their relation to cognitive functions. J Med Life. 2023 Feb; 16(2): 284–289.
Jack Jr CR, Bennett DA, Blennow K, Carrillo MC, Dunn B, Haeberlein SB, et al. NIA- AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018 Apr; 14(4):535-562.
Sink KM, Espeland MA, Castro CM, Church T, Cohen R, Dodson JA, et al. Effect of a 24-month physical activity intervention vs health education on cognitive outcomes in sedentary older adults: The life randomized trial. JAMA. 2015; 314:781–90.
Prakash RS, Voss MW, Erickson KI, Kramer AF. Physical activity and cognitive vitality. Annu Rev Psychol. 2015; 66:769–97.
Ahlskog JE, Geda YE, Graff-Radford NR, Petersen RC. Physical exercise as a preventive or disease-modifying treatment of dementia and brain aging. Mayo Clin Proc. 2011; 86:876–84.
Ebrahimi K, Majdi A, Baghaiee B, Hosseini SH, Sadigh-Eteghad S. Physical activity and beta-amyloid pathology in Alzheimer’s disease: A sound mind in a sound body. EXCLI J. 2017; 16: 959–972.
Groot, C., Hooghiemstra, A.M., Raijmakers, P.G.H.M., van Berckel, B.N.M., Scheltens, P.,Scherder, E.J.A., et al. The effect of physical activity on cognitive function inpatients with dementia: a meta-analysis of randomized control trials. 2016; Ageing Res.Rev. 25, 13–23.
Jensen CS, Hasselbalch SG, Waldemar G, Simonsen AH. Biochemical Markers of Physical Exercise on Mild Cognitive Impairment and Dementia: Systematic Review and Perspectives. Front Neurol. 2015; 6:187
Jensen CS, Bahl JM, Østergaard LB, Høgh P, Wermuth L, Heslegrave A, et al. Exercise as a potential modulator of inflammation in patients with Alzheimer’s disease measured in cerebrospinal fluid and plasma. Exp Gerontol. 2019;121:91-98.
Erickson KI, Voss MW, Prakash RS, Basak C, Szabo A, Chaddock L, et al. Exercise training increases size of hippocampus and improves memory. Proc Natl Acad Sci U S
A. 2011; 15;108(7):3017-22.
Lourenço MV, Frozza RL, de Freitas GB, Zhang H, Kincheski GC, Ribeiro FC, et al. Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory defects in Alzheimer’s models. Nature Medicine. 2019; 25, pages165–175.
Wrann CD. FNDC5/irisin – their role in the nervous system and as a mediator for beneficial effects of exercise on the brain. Brain Plast. 2015; 1(1):55-61.
González RD, Martínez AH, Valenzuela PL, Morales JS, Soriano-Maldonado A. Effects of physical exercise on plasma brain-derived neurotrophic factor in neurodegenerative disorders: A systematic review and meta-analysis of randomized controlled trials. Neurosci Biobehav Rev. 2021; 128:394-405.
1: Centro Universitário das Faculdades Metropolitanas Unidas FMU Departamento da Fisioterapia, São Paulo, Brasil
