REGISTRO DOI: 10.5281/zenodo.12575403
Wolne Luiz Amado Centenaro
Abstract
Background: Staphylococcus aureus são micro-organismos pertencentes a flora da cavidade nasal e podem habitar a cavidade oral. Apresentam risco de vida quando em infecções invasivas. Cepas resistentes (MRSA) podem trazer riscos em ambientes hospitalares, comunitários e ambulatoriais. O objetivo deste estudo foi avaliar a possibilidade de colonização no exercício da odontologia assim como ocorre em ambientes hospitalares por Staphylococcus aureus e sua forma resistente.Methods: O crescimento bacteriano de Staphylococcus aureus obtidos a partir de swab nasal, salivar e de superfícies foi obtido através da semeadura em sal manitol e teste de gram. com identificação visual da formação de colônias. A resistência a meticilina foi realizada previamente por método de identificação por Cromo Agar e a partir deste os identificados como resistentes foram submetidos ao Teste de Suscetibilidade Antimicrobiana (TSA) com discos de cefoxetina e oxacilina observando-se os halos de inibição de crescimento em meio Agar Mueller-Hinton. As amostras comprovadas como resistentes foram submetidas à Eletroforese em Gel de Campo Pulsado (PFGE) para identificação da similaridade genética e à Polymerase Chain Reaction (PCR) para identificação dos genes de mecA para resistência a meticilina e lukS-lukF que codifica a toxina Panton-Valentine Leukocidin (PVL).Results: 156 pessoas da área de saúde (UTI Hospitalar, acadêmicos e profissionais de odontologia) submetidas a coleta nasal e salivar além de 40 superfícies foram amostradas. No total 93 amostras positivas para Staphylococcus aureus, 50 MRSA em meio cromogênico, 09 MRSA confirmados por TSA provenientes de coletas nasais e 52 amostras positivas para Staphylococcus aureus, 32 MRSA em meio cromogênico, 06 MRSA confirmados por TSA provenientes de amostras da saliva. Além de 05 amostras positivas para Staphylococous aureus, 03 MRSA em meio cromogênico e 01 MRSA confirmado por TSA provenientes das superfícies. 04 amostras apresentaram similaridade genética, 11 identificações do Gene mecA e 04 do Gene PVL.Conclusions: Mesmo não determinando o risco absoluto da ocorrência de uma possível contaminação cruzada por MRSA e Staphylococcus aureus em procedimentos odontológicos, o mesmo sugere uma associação de prevalência em ambientes odontológicos tanto quanto em ambientes hospitalares.
Keywords: Dentistry, colonization MRSA, colonization Staphylococcus aureus.
1. INTRODUÇÃO
O controle de infecção em estabelecimentos de saúde é hoje uma temática que envolve uma abordagem multidisciplinar (SHABANA, et al 2016). Neste momento do século XXI as profissões relacionadas à saúde, especialmente às que executam procedimentos de cuidados intensivos e invasivos como a medicina e a odontologia, em que pese os avanços científicos e tecnológicos que as caracterizam, ambiguamente enfrentam a questão da colonização, transmissão e infecção de patógenos, causadores de doenças infectocontagiosas com retrocessos importantes e perigosos em termos de saúde pública (ALVAREZ et al 2010; CONCEIÇÃO et al, 2016). Entre estes, as modificações genéticas sofridas por micro-organismos, tais como a resistência bacteriana à medicamentos antimicrobianos (KLEVENS et al. 2007, PRAY (2008).
Staphylococcus aureus sensíveis à Meticilina (MSSA) e suas formas resistentes a antimicrobianos, Staphylococcus aureus resistentes a meticilina (MRSA) estão entre os micro-organismos que podem causar doenças potencialmente graves ou infectarem sítios cirúrgicos, além de serem patógenos importantes tanto na medicina quanto na odontologia, devido à abundância de sítios de colonização especialmente próximos à cavidade oral e em tratamentos de pacientes com imunidade alterada e/ou procedimentos invasivos. É também, uma das principais causas de infecções de feridas e tem o potencial invasivo para induzir osteomielites, endocardites e bacteremias, levando à infecções secundárias em qualquer um dos principais sistemas de órgãos. ROBERTS ET AL., 2011, ROBERTSON & SMITH, 2009, KOLEND 2010, RIORDAN 2004).
Infecções estafilocócicas ocorrem mais frequentemente quando barreiras como a pele ou mucosas são rompidas, após a inserção de um corpo estranho, como por exemplos em implantes ósseos e em hospedeiros com sistemas imunológicos comprometidos (SANTOS, et al., (2007). Como consequência da prevalência de cepas resistentes aos antibióticos e o recente surgimento de isolados clínicos resistentes à vancomicina, o controle da colonização por MSSA e MRSA tornou-se cada vez mais problemático (MICET, 2007; CDC, 2007). Estes desempenham um papel importante em infecções nosocomiais e tem sido reconhecidos como uma importante causa de infecções adquiridas na comunidade. Infecções por Staphylococcus aureus nesta última, muitas vezes ocorrem em indivíduos saudáveis que não apresentam fatores de risco esperados para as mesmas, como por exemplo, hospitalização e/ou cirurgias recentes ou o uso de drogas injetáveis. Postula-se que as cepas que causam infecções adquiridas na comunidade têm um elevado potencial de virulência, motivadas pela sua capacidade de causar doença em hospedeiros imunocompetentes. (SANTOS, et al., 2007 CAMPOCCIA 2013).
O propósito de investigar a colonização destes patógenos em profissionais atuantes em UTI(s) hospitalares que servem como ambiente de comparação, bem como os que atuam em ambientes ambulatoriais, tais como a odontologia (cirurgiões-dentistas e auxiliares em saúde bucal, além de acadêmicos de cursos de odontologia e superfícies que compõe seus ambientes de trabalho), tem como objetivo identificar a possibilidade de uma possível colonização cruzada por Staphylococcus aureus bem como por cepas resistentes deste micro-organismo em ambientes odontológicos, da mesma forma como ocorre em ambientes hospitalares. Além disso, é possível quantificar fenotipicamente e genotipicamente, dentro deste universo profissional, estabelecendo-se parâmetros da situação nestes espaços de atendimento, bem como sugerir protocolos de rotinas de trabalho, investigação e descolonização de profissionais, mesmo considerando que esta colonização possa ser transitória, que visem o efetivo controle de infecção em estabelecimentos de saúde.
O objetivo deste estudo foi detectar a presença, destes patógenos na odontologia, e por conseguinte, a colonização por Staphylococcus aureus e Staphylococcus aureus resistentes a meticilina em ambientes odontológicos, podendo esta ser tão prevalente quanto ambientes hospitalares.
2. MATERIAIS E MÉTODOS
2.1 Considerações éticas
Os participantes do estudo foram convidados e para os mesmos foi detalhado o Termo de Consentimento Livre e Esclarecido, obtendo-se assim a voluntariedade na participação do estudo. As assinaturas ocorreram no momento da coleta das amostras e após o Projeto de Pesquisa ter sido aprovado pelo Comitê de Ética da Universidade do Extremo Sul de Santa Catarina – Brasil, conforme parecer consubstanciado número 931.316, em 09 de Dezembro de 2014.
2.2 Caracterização da população:
Foram coletadas amostras nasais (nasofaringe) e salivares (cavidade oral, região sublingual, superfície da língua e mucosa da bochecha). Para efeitos comparativos o grupo comparação utilizado foi o de funcionários de uma UTI Hospitalar Geral Adulta. Foram coletadas amostras em superfícies de ambientes odontológicos referentes a duas universidades. Além disso mais amostras foram obtidas de acadêmicos cursando os dois últimos anos de cursos de odontologia em universidades distintas; cirurgiões-dentistas com dois ou mais anos de atuação efetiva em consultórios odontológicos e suas respectivas auxiliares em saúde bucal. Complementando; superfícies odontológicas, referentes às clínicas das duas universidades utilizadas, em regiões territoriais distintas no Sul do Brasil, também forneceram amostras ao estudo.
2.3 Obtenção das Amostras
As amostras da nasofaringe e da saliva bem como das superfícies, foram coletadas com um swab (ESWAB™ COPAN MRSA) que, segundo o fabricante, é um sistema multiuso de coleta e transporte de micro-organismos. Este tipo de swab caracteriza-se por manter a viabilidade das bactérias anaeróbias e aeróbicas por até 48 horas à temperatura ambiente e em geladeira. O mesmo contémuma extremidade flocada de Nylon® e fica imerso em uma solução contendo 1 ml de líquido modificado de Amies,(Copan Italy), considerado ideal para a coleta deste tipo de micro-organismo. (VANDENDRIESSCHE et al 2014, SILBERT et al 2014, MUKOVNIKOVA 2014). Além disso foram escolhidos cinco equipamentos odontológicos, aleatoriamente, em ambas as clínicas odontológicas dos cursos de odontologia que haviam sido usados durante um turno de atendimento na disciplina de Clínica Integrada, e em cada um destes equipamentos, quatro superfícies serviram de local para a coleta das amostras. Em todos os equipamentos as superfícies foram as mesmas (alça do refletor, descanso do braço do paciente na cadeira odontológica, porta toalhas descartáveis e cuspideira). Ainda em associação às superfícies as mesmas não foram submetidas a nenhum tipo de desinfecção após o atendimento, sendo as coletas efetuadas nos locais determinados na forma como os acadêmicos haviam deixado, após a dispensa do paciente. Nenhuma recomendação adicional ou treinamento prévio foi realizado com os voluntários do estudo em associação as normas de controle de infecção em serviços de saúde, bem como ao uso de EPI(s) durante os turnos em que realizaram os atendimentos. O propósito de incluir neste estudo, em profissionais e ambientes odontológicos, também profissionais atuantes em UTI(s) hospitalares, que neste serviu como grupo controle, é o de estabelecer um parâmetro de comparação, entre o primeiro grupo e o grupo UTI, cujos relatos da literatura reportam com sendo um dos grupos de profissionais que estão, no exercício de sua atividade, mais sujeitos a colonização por micro-organismos patogênicos. O mesmo pode apresentar índices de colonização por Staphylococcus aureus variáveis de 1,6 a 39% (CHUN et.al 20153; GARCÍA et al 20124; GEOFREY et.al 20125). Neste modelo, para efeitos comparativos, o grupo comparação utilizado tende a apresentar uma tendência maior à estas colonizações pesquisadas, em associação aos profissionais relacionados à odontologia, considerando-se que os mesmos são mais vulneráveis à colonização por Staphylococus aureus e suas formas resistentes, baseado em relatos de estudos que determinaram uma porcentagem maior de colonização para este tipo de profissional (CAVALCANTE et al, 2000).
Em relação aos profissionais/acadêmicos e superfícies de ambientes odontológicos, cujo ambiente de trabalho é ambulatorial, a importância de realizar um estudo neste grupo reside no fato de que nos últimos anos houve uma evolução e um aumento muito grande nesta profissão, quando evidenciamos, procedimentos cirúrgicos, especialmente ligados à reposição estética e funcional do sistema estomatognático, através de implantes, enxertos ósseos/sinusais e cirurgias de prognatismo entre outros procedimentos realizados de forma ambulatorial, ou seja, fora do ambiente hospitalar. Além disso, foi possível quantificar por amostragem, dentro deste universo, o número de profissionais em todos os grupos, colonizados por Staphylococcus aureus e MRSA, buscando identificar suas características, fenotípicas e genotípicas.
2.4.Caracterização das amostras
2.4.1 Identificação de Staphylococcus aureus
A identificação de Staphylococcus aureus foi obtida através da coleta e cultura com swab nasal/oral e em superfícies odontológicas, sendo identificados através de métodos microbiológicos padrões, recomendados pela Sociedade Americana de Microbiologia (ISENBERG HD 2004).
2.4.2 Identificação de MRSA
2.4.2.1 Testes de Sensibilidade
2.4.2.1.1 Meio Cromogênico
O inóculo obtido, quando da identificação de Staphylococcus aureus, foi repicado, através de alças bacteriológicas estéreis, em capela de fluxo laminar, para o meio seletivo CHROMAGAR MRSA PL 0297” em placas de 90 x15 mm contendo uma divisão (CHROMagar; Paris, France). O mesmo possui os seguintes componentes: peptona e extrato de levedura 40,0g, sais 25,0g, mistura cromogênica 2,6g, ágar 15,0g, suplemento: SU625 1mL. Com as seguintes características físicas e químicas: gel de viscosidade firme; cor: amarelado; pH: 6,9 ± 0,2 à 25°C. O Controle de qualidade foi efetuado através de cepas controle com os seguintes resultados: Escherichia coli – ATCC 25922 inibição total, Staphylococcus aureus – ATCC 25923 inibição total Staphylococcus aureus – ATCC 43300 crescimento bom de colônias com tons de cor rosa tendendo para coloração malva (OHKUSHI et al 2013, MERLINO et al 2000, PAO et al 2012, CERLANA et al 2004, GAILLOT et al, RAHMAN et al, GOODWIN et al 2009, PHILIPPE et al 2014).
As placas com CHROMAGAR MRSA PL 0297 foram também incubadas a temperatura média de 36 °C durante um período máximo de 48 horas e após, realizada a leitura das mesmas conforme as especificações acima descritas, ou seja, as que apresentaram colônias de coloração rosa para malva foram classificadas como MRSA.
2.4.2.1.2 Teste de Sensibilidade aos antimicrobianos
A etapa posterior (dentre os que foram classificados como MRSA no meio cromogênico), foi a confirmação da resistência, detectada através do Teste de Sensibilidade aos Antimicrobianos (TSA), para os fármacos Cefoxetina e Oxacilina. Em conformidade com as diretrizes do Manual Clinical and Laboratory Standards Institute – CLSI (1988), a resistência mediada por mecA à oxacilina pode ser detectada através da utilização de discos de Cefoxetina ou de oxacilina. Em cada uma das placas foram adicionados os dois discos (Cefoxetina e Oxacilina), e a cepa foi considerada resistente quando não houve inibição de crescimento para qualquer um dos antibióticos ou para ambos. A transferência das colônias do meio cromogênico para Agar Mueller Hinton 2% NaCl (NewProv, Curitiba, Paraná, Brasil), se deu, através de uma agulha estéril, onde foram retiradas parte das colônias de MRSA do Cromo Agar e inseridas em solução salina estéril para formar o inóculo bacteriano que posteriormente foi semeado nas placas de Agar Mueller Hinton, com auxílio de um swab. A seguir, deixou-se a placa semeada, secar por 5 minutos à temperatura ambiente, para que o inóculo fosse completamente absorvido pelo ágar. Foram aplicados os discos de Cefoxetina (30 µg) e Oxacilina (1 µg), sendo em seguida, incubadas por 24 horas na mesma temperatura que as demais. Utilizou-se para a determinação da resistência os diâmetros dos halos de inibição: Oxacilina menor ou igual a 13 mm e para a Cefoxetina menor ou igual à 22 mm.
As amostras obtidas, consideradas como MRSA pelo TSA e somente às que foram consideradas como resistentes a este, foram congeladas a uma temperatura de -85 °C em caldo triptona de soja (TSB), (JAMES 1993, LONDONO et al 2006, MONCAYO et al 2015, RADDI et al 2009, MIMICA et al 2012, MÉNDEZ et al 2013, CAVASSIN et al 2015). Os micro-organismos foram preparados para o congelamento por inoculação em placas de agar-sangue e incubação até a fase estacionária de crescimento (18–24 horas). As colônias puras desenvolvidas na superfície do ágar foram recolhidas com alça esterilizada e transferidas diretamente para um criotubo contendo caldo triptona de soja (TSB) e 10% de glicerol, emulsionadas até uma suspensão final densa (REIMER, 2003).
2.4.2.1.3 Detecção do Gene mecA
Após a confirmação da resistência aos fármacos, através do TSA, as amostras foram submetidas à ensaios de PCR para detecção do gene mecA baseado em ensaio descrito por Kondo et al. (2007).
2.4.2.1.4 Detecção do Gene lukS-lukF
A detecção do gene lukS-lukF, responsável pela codificação da Leucocidina de Panton-Valentine (PVL) foi realizada de acordo com protocolo descrito por Ribeiro (2005).
2.4.2.1.5 Eletroforese de Campo Pulsado (Pulsed-Field Gel Electrophoresis – PFGE)
A similaridade genética dos isolados resistentes foi avaliada por Eletroforese de campo Pulsado (PFGE), utilizando protocolo adaptado de Pinto 2013 e com condições de corrida descritos por McDougal et al., (2003).
2.5 ORGANIZAÇÃO E ANÁLISE DE DADOS
Os dados coletados foram protocolados com codificação previamente definida e inseridos em bancos de dados em Excel e exportados para o pacote estatístico SPSS (Statistical Package for Social Sciences), versão 18.0 e analisados por meio de estatística descritiva (frequências relativas e absolutas) e inferencial (teste qui-quadrado) utilizando os valores de p<0,05 como nível de significância sendo considerados estatisticamente significativos. A prevalência foi calculado com intervalo de confiança de 95% para posteriormente serem descritos e apresentados em tabelas. As associações genéticas dos isolados foram analisados pelo coeficiente de Disse, com média aritmética (UPGMA) usando o software Gel Compar II de acordo com instruções do fabricante (Applied Maths, Inc, Austin, TX). Cepas que foram maior ou igual à 80% na escala de semelhança, foram classificados como cepas que apresentam similaridade genética.
3. RESULTADOS
3.1. População
A tabela 1, apresenta o número de participantes em números absolutos, bem como a porcentagem do total de voluntários do estudo, distribuídos por grupos. Como complemento ao estudo, foram incluídas na amostra as 40 superfícies já descritas nas universidades I e II 20 e 20 respectivamente, (10,2% em cada uma delas). Totalizando 196 amostras (100%) amostras.
Tabela 1 – Número de participantes por grupos
Func. UTI Acad. Univ. I Acad. Univ. II C. Dentistas ASB Total N 36 47 23 31 17 156 % 18,2 23,7 11,6 15,7 8,6 59,6 %
3.2.Identificação das colonizações e associação entre colonização nasal e salivar
3.2.1 Identificação Staphylococcus aureus entre grupos /associação entre colonização nasal e salivar
A tabela 2, evidencia os resultados da colonização por Staphylococcus aureus, nos diversos grupos. Além disso os dados referentes as superfícies amostradas nas universidades pesquisadas nos indicam que na universidade I 04 dentre 20 apresentaram colonização por Staphylococcus aureus e apenas 01 dentre 20 na universidade I.
3.2.2. Resistência Cromo Agar e associação entre colonização nasal /salivar
Da mesma forma na tabela 2 estão expressos os dados referentes aos grupos colonizados por MRSA, detectados através do método cromogênico. Além disso os dados referentes às superfícies amostradas na universidade I nos dão conta que entre as 04 superfícies colonizados por Staphylococcus aureus em 02 foram detectadas colonização por MRSA (5%), enquanto que para a Universidade II, 01 superfície que havia sido colonizada por Staphylococcus aureus apresentou também resistência, ou seja identificada com colonização por MRSA (100%).
3.2.3 Resistência TSA e associação entre colonização nasal/ salivar
Os testes de sensibilidade aos antimicrobianos Oxacilina e Cefoxetina foram efetuados em todos os grupos que apresentaram resistência ao meio cromogênico, são também apresentados na tabela 2. A finalidade destes testes foi obter a confirmação desta resistência. Em cada uma das placas foram adicionados os dois discos (Cefoxetina e oxacilina), e a cepa foi considerada resistente quando não houve inibição de crescimento para qualquer um dos antibióticos ou para ambos. Além disso os dados referentes as superfícies amostradas nas universidades pesquisadas nos indicam que na universidade I a confirmação de MRSA através do TSA não ocorreu em nenhuma das superfícies anteriormente detectadas pelo meio cromogênico, já na universidade II a única superfície detectada pelo meio cromogênico como colonizada por MRSA foi confirmada através do TSA como possuindo colonização por este micro-organismo resistente (MRSA). Tabela 2
Tabela 2 – Identificação Staphylococcus aureus – Resistência: Cromo Agar/TSA
Grupos S.aureus MRSA Cromo Agar MRSA TSA Acadêmicos (Univ. I) n/total Swab Nasal (+) for S.aureus 30/47 S.aureus Nasal (+) for MRSA 20/29 MRSA Nasal (+) for Cef. e ou Oxa. 6/20 % 61,70 68,96 30,00 n/total Swab Salivar (+) for S.aureus 12/47 S.aureus Salivar (+) for MRSA 9/13 MRSA Nasal (+) for Cef. e ou Oxa 2/10 % 27,65 76,92 20,00 p <0,005 <0,005 0,15 Acadêmicos (Univ. II) n/total Swab Nasal (+) for S.aureus 13/23 S.aureus Nasal (+) for MRSA 13/13 MRSA Nasal (+) for Cef. e ou Oxa 0/13 % 56,52 100,00 0,00 n/total Swab Salivar (+) for S.aureus 12/23 S.aureus Salivar (+) for MRSA 10/11 MRSA Nasal (+) for Cef. e ou Oxa 0/9 % 47,82 81,81 0,00 p 0,84 0,53 Não Resistentes C.Dentistas n/total Swab Nasal (+) for S.aureus 11/31 S.aureus Nasal (+) for MRSA 7/11 MRSA Nasal (+) for Cef. e ou Oxa 2/7 % 35,48 63,63 28,57 n/total Swab Salivar (+) for S.aureus 14/31 S.aureus Salivar (+) for MRSA 5/14 MRSA Nasal (+) for Cef. e ou Oxa 1/5 % 45,16 35,71 20,00 p 0,54 0,56 0,56 Auxiliares em Saúde Bucal n/total Swab Nasal (+) for S.aureus 11/18 S.aureus Nasal (+) for MRSA 6/11 MRSA Nasal (+) for Cef. e ou Oxa 1/6 % 61,11 54,54 16,66 n/total Swab Salivar (+) for S.aureus 7/18 S.aureus Salivar (+) for MRSA 3/7 MRSA Nasal (+) for Cef. e ou Oxa 1/3 % 38,88 42,85 33,33 p 0,34 0,31 1,00 Funcionários UTI n/total Swab Nasal (+) for S.aureus 14/36 S.aureus Nasal (+) for MRSA 11/14 MRSA Nasal (+) for Cef. e ou Oxa 7/11 % 38,88 78,57 63,63 n/total Swab Salivar (+) for S.aureus 7/36 S.aureus Salivar (+) for MRSA 5/8 MRSA Nasal (+) for Cef. e ou Oxa 2/5 % 22,22 62,50 40,00 p 0,12 0,13 0,96
3.3 Associações entre os grupos colonizados
3.3.1 Colonização nasal e salivar entre os grupos colonizados por Staphylococcus aureus
Em relação a colonização nasal por Staphylococcus aureus, quando associamos a Universidade I com a Universidade II, UTI, e CD a frequência maior de colonização na Universidade I foi estatisticamente significativa. O mesmo não ocorre quando associamos a frequência de colonização por Staphylococcus aureus entre os demais grupos entre si (Tabela 3). Na mesma tabela, cuja amostras foram obtidas de colonização salivar não existe diferença estatisticamente significativa quando associamos os grupos entre si, ou seja, as frequências de colonização observadas não mostram diferenças significativas entre os grupos.
3.3.2 Resistência Cromo Agar nasal/salivar (MRSA)
A tabela 3 evidencia ainda que quando associamos os grupos cuja resistência foi detectada por meio cromogênico, através da colonização nasal, na universidade I obtivemos uma frequência maior de acadêmicos colonizados quando associados ao grupo cirurgiões-dentistas e esta frequência maior colonização é significativa estatisticamente. Porem em relação ao grupo comparação e aos demais grupos entre si, a associação entre as frequências de colonização são semelhantes, não ocorrendo resultados significativos estatisticamente
Nesta mesma tabela em que a frequência de resistência (obtida através do meio Cromo Agar) dentre as amostras e que são provenientes da saliva, não existe diferença estatisticamente significativa quando associamos os grupos entre si.
3.3.3. Resistência TSA nasal/salivar (MRSA).
Destacamos que neste estudo, como dito anteriormente, somente foram submetidos aos Testes de Sensibilidade aos antimicrobianos Cefoxetina e Oxacilina as amostras, que apresentaram resistência comprovada através do meio cromogênico tanto de procedência nasal como salivar. Destacamos nesta análise que a frequência de colonizações por MRSA no grupo auxiliares em saúde bucal é maior que a frequência de colonização por MRSA no grupo comparação sendo esta frequência maior estatisticamente significativa. Como não houve resistência entre os acadêmicos da universidade II não foi possível, estabelecer uma associação estatisticamente significativa com os demais grupos e com os acadêmicos da universidade (Tabela 3).
Tabela 3. Associação de colonizações entre grupos
Colonização Staphylococcus aureus nasal Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 30 14 14 14 14 11 11 11 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 13 11 30 13 11 11 30 14 p <0,005 0,54 <0,005 0,84 0,54 1,00 <0,005 0,68 Colonização Staphylococcus aureus salivar Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 12 7 7 7 7 14 14 14 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 12 7 7 7 7 14 14 14 p 1,00 0,12 0,25 0,25 1,00 1,27 0,69 1,00 MRSA em Meio Cromo Agar colonização nasal Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 20 11 11 11 11 7 7 7 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 13 7 20 13 6 6 20 13 p 0,22 0,34 0,10 0,82 0,22 0,78 <0,005 0,46 MRSA em Meio Cromo Agar colonização salivar Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 9 5 5 5 5 5 5 5 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 10 5 9 10 3 3 9 10 p 0,81 1,00 0,28 0,05 0,48 0,48 0,28 0,05 TSA para comprovação de Resistentes Cromo Agar colonização nasal Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 6 7 7 7 7 2 2 2 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 0 2 6 0 1 1 6 0 p – 0,09 0,78 – <0,005 0,56 0,15 – TSA para comprovação de Resistentes Cromo Agar colonização salivar Grupos Univ. I UTI UTI UTI UTI CD CD CD Colonizados 2 2 2 2 2 1 1 1 Grupos Univ.II CD Univ. I Univ.II ASB ASB Univ. I Univ.II Colonizados 0 1 2 0 1 1 2 0 p – 0,56 1,00 – 0,56 1,00 0,56 –
3.4 Identificação dos genes mecA e responsável pela codificação da PVL
Após a realização do PCR para a comprovação da frequência de ocorrência dos genes responsáveis pela resistência dos micro-organismos detectados, foi possível identificar o Gene mecA em dez das amostras existentes e em quatro amostras os genes lukS-lukF, responsáveis pela codificação da Leucocidina de Panton-Valentine (PVL). o que caracteriza estas amostras como CA-MRSA (Sthaphylococcus aureus resistentes a Meticilina provenientes da comunidade). Entre as amostras isoladas que apresentaram o gene mecA, que caracteriza a resistência das mesmas à meticilina e demais antimicrobianos sensíveis a produção de betalactamases, destacamos que quatro voluntários do estudo pertencem a mesma universidade (Universidade II); as outras amostras restantes ficaram assim divididas: cinco pertencentes ao grupo comparação e uma refere-se à um Cirurgião-dentista. Todas as amostras positivas para o gene mecA foram coletadas de superfícies nasais. Todas as amostrasque apresentaram os genes lukS-lukF, foram coletadas da superfície nasal e somente em quatro apresentaram o Gene mecA através do PCR. Dentre estas, duas pertencentes ao grupo de cirurgiões-dentistas; uma pertencente a universidade I a outra pertencente ao grupo comparação (funcionários da UTI. Em relação a realização do PCR para a obtenção dos genes gene mecA lukS-lukF, responsáveis pela codificação da Leucocidina de Panton-Valentine (PVL), o que caracteriza estas amostras como CA-MRSA. Entre as amostras isoladas que apresentaram o gene mecA, que caracteriza a resistência das mesmas à meticilina, destacamos que 04 voluntários do estudo pertencem a universidade II; as outras amostras restantes ficaram assim divididas: 05 pertencentes ao grupo comparação e uma refere-se à um cirurgião-dentista. Todas as amostras positivas para o gene mecA foram coletadas de superfícies nasais. Todas as amostrasque apresentaram os genes lukS-lukF, foram coletadas da superfície nasal e somente em 04 apresentaram o ambos os genes mecA e lukS-lukF através do PCR. Dentre estas, 02 pertencentes ao grupo de cirurgiões-dentistas; uma pertencente a universidade I a outra pertencente ao grupo comparação (funcionários da UTI). (Tabela 9).
Tabela 4 –Identificação Genes mecA e PVL e Similaridade Genética
PCR – Identificação Genes mecA e PVL PFGE Amostras mecA PVL % S. Genética 005NA* + – <80% 007NA* – – <80% 009NA* + – <80% 024NA* – + <80% 024SA* + – <80% 025NA* + – <80% 027NA* + – >80% 103N 102NU** – – <80% 103NU** + – >80% 027N 112NU** – – <80% 115NU** + – >80% 116N 116NU** + – >80% 115N 119SU** – – <80% 126NU** + – <80% 129NU** + + <80% 302NU** – + <80% 302SU*** – – <80% 304NU*** + – <80% 314NU*** – + A= Acadêmicos Universidade I * UTI ** C.Dentista*** N= nasal S= Salivar
3.5. SIMILARIDADE GENÉTICA
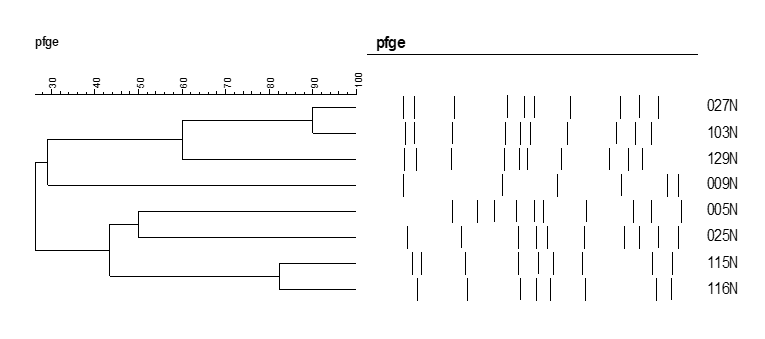
O dendograma representado abaixo (figura 1), indica que 04 amostras apresentam similaridade genética entre si.
Figura 1 – Dendograma – similaridade genética entre as amostras analisadas.
4 DISCUSSÃO
Todas as estatísticas descritivas levaram em consideração o percentual de voluntários colonizados, através da relação estabelecida entre número de colonizados sobre o número total de amostrados. Quando evidenciamos a colonização salivar por Staphylococcus aureus nos grupos estudados, todos relacionados à odontologia apresentaram um percentual maior de colonização do que o grupo UTI que está ligado a ambiente hospitalar. Em relação à colonização nasal por Staphylococcus aureus, obtivemos dados estatisticamente significativos da associação entre a Universidade I e Universidade II, UTI, e CD. A frequência maior de colonização ocorreu na Universidade I. O mesmo não ocorre quando associamos a frequência de colonização por Staphylococcus aureus entre os demais grupos entre si, e em relação à colonização salivar. (Tabela 3). Quando verificamos a frequência do número de colonizados por Staphylococcus aureus sobre o total de amostrados por este micro-organismo, entre os grupos estudados, detectamos que a frequência da associação da colonização nasal e salivar foi maior e estatisticamente significativa entre os acadêmicos da Universidade I, para as demais categorias a associação das frequências de colonização nasal e salivar foram semelhantes (Tabela 2).
Cooper et al., 2003, relatam que este micro-organismo coloniza normalmente as narinas ou pele de cerca de 30% da população. Este valor aumenta para 50% quando se trata de profissionais de saúde ou pessoas internadas. Os dados obtidos neste estudo nos levam a presumir que em procedimentos odontológicos a exposição de profissionais e pacientes apresentam possibilidades de colonização até então não comparadas a grupos de atuação hospitalar, quando nos referíamos a este tipo de patógeno. A razão para este incremento deve-se a introdução de novos equipamentos nos últimos anos na odontologia. Estes contribuíram significativamente para que os consultórios e ambientes clínicos fossem impregnados por aerossóis biológicos (Cotone et al 1991). Os mesmos apresentam-se sob a forma de partículas com propriedades físicas típicas como energia cinética e baixo peso molecular que podem atingir locais distantes às unidades individuais de atendimento ao paciente (KEDJARUNE E LEGGAT, 2001). Crawford et al. 1983 relatam que o Staphylococcus aureus pode permanecer no ambiente clínico e em superfícies por até cinco dias.
Em relação à colonização por MRSA, os dados referentes ao percentual de voluntários colonizados, quando o meio utilizado para testar esta resistência foi um meio cromogênico, a colonização salivar nas Universidades I e II são percentualmente maiores que nos demais grupos. Quando associamos, entre os grupos estudados, a frequência de colonização nasal e salivar, a mesma foi maior e estatisticamente significativa entre os acadêmicos da Universidade I, para as demais categorias foram semelhantes, repetindo-se o que ocorreu em relação à colonização por Staphylococcus aureus não resistentes (Tabela 3). Quando associamos a frequência de colonização nasal por MRSA entre os grupos, esta é maior e estatisticamente significativa entre os grupos universidade I em relação ao grupo c.dentistas. Em colonização salivar os grupos não apresentaram diferenças (Tabela 2).
Conforme foi mencionado anteriormente somente foram submetidos ao TSA os voluntários do estudo que apresentaram-se como MRSA detectados através do meio cromogênico. A tabela 03 nos mostra que o grupo utilizado como grupo comparação (UTI) em relação à colonização nasal foi o grupo que apresentou colonizações por Staphylococcus aureus resistentes (MRSA) em maior porcentagem, dados estes que se apresentam com as mesmas características para a resistência detectada em amostras provenientes da saliva. Destaca-se ainda que a universidade II não apresentou colonização por MRSA tanto em amostras provenientes da saliva, como da cavidade nasal. Destacamos que o grupo comparação apresentou uma frequência maior e estatisticamente significativa de colonização por MRSA em relação ao grupo auxiliares em saúde bucal, quando as amostras são oriundas da colonização nasal. O mesmo não ocorre quando comparamos a frequência da colonização por MRSA entre os demais grupos entre si, exceto para a Universidade II que não apresentou colonização por MRSA. Para as amostras coletadas na saliva não houve diferenças estatisticamente significativa entre os grupos amostrados, exceto para a Universidade II que não apresentou colonização por MRSA. Quando verificamos a frequência do número de colonizados sobre o total de amostrados por MRSA, entre os grupos estudados detectamos que frequência de colonização nasal e salivar foi semelhantes para todos os grupos pesquisados (Tabela 2). Desta forma evidencia-se que a colonização por MRSA em ambiente odontológico é semelhante ao ambiente hospitalar
Destacamos, neste estudo, dados relevantes no que diz respeito às colonizações por MRSA entre as universidades. Na universidade II, apenas uma superfície apresentou colonização por MRSA proveniente de uma amostra localizada no braço da cadeira do operador e dados estatisticamente significativos, demonstram que nenhum dos acadêmicos amostrados apresentou colonização por MRSA comprovado pelo TSA. Estudos adicionais devem ser realizados para verificar se estes dados comparativos de colonização por MRSA entre as duas universidades está relacionado aos padrões de biossegurança adotadas nas mesmas, uma vez que diferem basicamente no critério paramentação e ambas seguem as normas da Agência Nacional de Vigilância Sanitária, (ANVISA, 2006). Todos os acadêmicos da universidade II previamente ao atendimento clínico trocam a roupa utilizada para chegar até o local do mesmo, acrescido da condição de que a paramentação correspondente necessariamente deva ser esterilizada e toda esta paramentação é novamente trocada em local apropriado após o atendimento o mesmo não ocorre na universidade I, exceto em procedimentos cirúrgicos.
Os dados obtidos neste estudo, referente a colonização por Staphylococcus aureus e MRSA sugerem que estudos específicos devam ser realizados, em relação a segurança dos Epi(s) referente a filtragem dos mesmos, especialmente os de proteção oral e nasal. Em sua grande maioria, a classe odontológica no Brasil utiliza as denominadas máscaras cirúrgicas triplas como Epi para a proteção nasal e oral. O fator proteção facial através de máscaras e respiradores é importante, porem parece não ser suficiente nas rotinas e protocolos de biossegurança em consultórios e clinicas pertencentes à academia. Corroborando com esta ideia Chen et al., (1992), relata que embora a máscara cirúrgica possa ser suficiente para eliminar as bactérias exaladas pelos profissionais de saúde, eles podem não ser suficientes para eliminar os aerossóis de tamanho submicrométricos contendo agentes patogênicos a que estes profissionais de saúde são potencialmente expostos. Em uma revisão sistemática com metanálise, Smith et al., 2016 concluíram que embora respiradores N95 (no Brasil PFF2) aparentemente apresentam uma vantagem de proteção sobre máscaras cirúrgicas, o estudo mostrou que os dados são insuficientes para determinar definitivamente se máscaras N95 (PFF2) são superiores às máscaras cirúrgicas para proteger os trabalhadores da saúde contra infecções respiratórias agudas transmissíveis em ambientes clínicos. Os dados mostrados por estes autores perpassam a ideia de que procedimentos de controle de infecções em estabelecimentos de saúde devem seguir protocolos rigorosos, especialmente no que tange a prevenção da colonização cruzada por via aérea, em especial a odontologia.
Em relação às características genotípicas do estudo a realização do PFGE determinou que a similaridade genética das amostras de MRSA ocorreu em 04 do total amostrado, sendo todas procedentes de colonização nasal, pertencentes à mesma região geográfica e correspondem a 03 acadêmicos de odontologia da universidade I e a 01 funcionário do grupo comparação (Figura 1) a resistência das mesmas foi comprovada através do PCR em que todas apresentaram positividade para a Gene mecA. Ainda através do PCR das 19 amostras 11 apresentaram-se positivas em relação à presença do Gene mecA e 04 apresentaram a presença dos genes lukS-lukF que determina a existência da toxina PVL, caracterizando estas últimas como sendo CA-MRSA, porém de regiões geográficas distintas.
Conclusão:
Este foi um estudo transversal que nos leva a concluir que, mesmo não determinando o risco absoluto da ocorrência de uma possível contaminação cruzada por MRSA e Staphylococcus aureus em procedimentos odontológicos, o mesmo sugere uma associação de prevalência em ambientes odontológicos tanto quanto em ambientes hospitalares. Estudos futuros são necessários para que se possa estabelecer uma associação direta entre as infecções pós-operatórias em procedimentos invasivos e não invasivos realizados na prática odontológica.
REFERÊNCIAS
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Serviços Odontológicos: Prevenção e Controle de Riscos / Ministério da Saúde, Agência Nacional de Vigilância Sanitária. – Brasília: Ministério da Saúde, 2006.
CAVALCANTE. N.J.F et al. Unidade de terapia intensiva.In: FERNANDES, A. T. et al. Infecções hospitalares e suas interfaces na área de saúde. São Paulo: Atheneu, 2000.p:749-769.
CAMPOCCIA Davide , Montanaro Lucio, Arciol Carla Renata A review of the clinical implications of anti-infective biomaterials and infection-resistant surfaces Biomaterials, Volume 34, Issue 33, November 2013, Pages 8018–8029.
CARRICAJO Anne, Axel Treny, Nathalie Fonsale, Michele Bes, Marie Elisabeth Reverdy, Yves Gille,2 Gerald Aubert, Anne Marie Freydiere, Performance of the Chromogenic Medium CHROMagar Staph Aureus and the Staphychrom Coagulase Test in the Detection and Identification of STAPHYLOCOCCUS AUREUS in Clinical Specimens, Journal Of Clinical Microbiology, July 2001, p. 2581–2583
CAVASSIN Emerson Danguy , Luiz Francisco Poli de Figueiredo , José Pinhata Otoch , Marcelo Martins Seckler, Roberto Angelo de Oliveira , Fabiane Fantinelli Franco, Valeria Spolon Marangoni, Valtencir Zucolotto , Anna Sara Shafferman Levin,Silvia Figueiredo Costa, Comparison of methods to detect the in vitro activity of silver nanoparticles (AgNP) against multidrug resistant bacteria. J Nanobiotechnol (2015) 13:64
CENTERS FOR DISEASE CONTROL AND PREVENTION Infection Prevention Checklist for Dental Settings Basic Expectations for Safe Care, Summary of Infection Prevention Practices in Dental Settings http://www.cdc.gov/oralhealth/ Consultado em 11/04/2016.
CERLANA P., A. Corso, P. Gagetti, M. Rodriguez, S. Corbella, M. Iglesias, M. Galas Evaluation of the new chromogenic media “CHROMagar™ Staph aureus” for presumptive identification of S.aureus. XVII Latino-American Congress & X Argentina Congress of Microbiology 18-21 October 2004. San Martin General Cultural Center. Buenos Aires. Argentina.
CHAPMAN, G.H. (1945) The significance of sodium chloride in studies of staphylococci. J Bacteriol 50, 201–203.
CHEN, Chih-Chieh, Willeke Klaus. Aerosol penetration through surgical masks. American Journal of Infection Control. Volume 20, Issue 4, August 1992, Pages 177-184
CHUN, Hee‐Kyung; Kim, Kyung‐Mi; Park, Ho‐Ran. Effects of hand hygiene education and individual feedback on hand hygiene behaviour, MRSA acquisition rate and MRSA colonization pressure among intensive care unit nurse. International Journal of Nursing Practice, 2015, Vol.21 (6), pp.709-715
CLINICAL AND LABORATORY STANDARDS INSTITUTE (CLSI). Performance standards for antimicrobial susceptibility testing, 17th informational supplement. Wayne: CLSI; 2007 (M100-S17). Janeiro de 2003.
CONCEIÇÃO T, Coelho C, de Lencastre H, Aires-de-Sousa M. 2016. High prevalence of biocide resistance determinants in Staphylococcus aureusisolates from three African countries. Antimicrob Agents Chemother 60:678– 681. doi:10.1128/AAC.02140-15.
COTONE J; Terezhalmy GT; Molinari JA. Practical Infection Control in Dentistry; 1991, Pennsyvania. Lea & Febiger. 1: 285
COOPER, BS; Stone, SP; Kibbler, CC; Cookson, BD; Roberts, JA; Medley, GF;
Duckworth, GJ; Lai, R; Ebrahim, S (2003) Sistematic review of isolation policies in the
hospital management of the methicillin-resistant STAPHYLOCOCCUS AUREUS : a review of the literature with epidemiological and economic modelling. Health Technol Assess. 7
(39): 1-194.
CRAWFORD, J.J. Sterilization, disinfection, and asepsis in dentistry. In: S.S. Block (Ed.) Disinfection, sterilization and preservation. Ed 3. Lea & Febiger, Philadelphia; 1983:505–523.
DAVIS, J.A., Farrah, S.R. and Wilkie, A.C. (2006), Selective growth of STAPHYLOCOCCUS AUREUS from flushed dairy manure wastewater using acriflavine-supplemented mannitol salt agar. Letters in Applied Microbiology, 42: 606–611. doi:10.1111/j.1472-765X.2006.01915.
ERDOĞAN Haluk, Nasal and Pharyngeal Carriage of STAPHYLOCOCCUS AUREUS among Hotel Staff and Risk Assessment, Klimik Journal 1301-143X, 2011 vol:24, pg:90 -93.
GAILLOT OLIVIER MURIEL WETSCH, NICOLAS FORTINEAU, AND PATRICK BERCHE, Evaluation of CHROMagar Staph. aureus, a New Chromogenic Medium, for Isolation and Presumptive Identification of STAPHYLOCOCCUS AUREUS from Human Clinical Specimens. JOURNAL OF CLINICAL MICROBIOLOGY, Apr. 2000, p. 1587–159.
GARCÍA-Lozano, Tomás; Egido, Adoración; Contel, Elena; Picón, María Isabel; Martínez, María Ángeles; Aznar, Eduardo ¿Es necesario conocer qué trabajadores son portadores de SARM en contacto con enfermos oncológicos? Is it necessary to know which workers are carriers of MRSA in contact with cancer patients? Revista española de quimioterapia: publicación oficial de la Sociedad Española de Quimioterapia, December 2012, Vol.25(4), pp.252-5
GEOFREY Alfred, Ahmed Abade, Said Aboud, Methicillin-resistant STAPHYLOCOCCUS AUREUS (MRSA)colonization among Intensive Care Unit (ICU) patients and health care workers at Muhimbili national hospital. The Pan African medical journal, 2015, Vol.21, pp.211
GOODWIN K.D., M. Pobuda, Performance of CHROMagar™ Staph aureus and CHROMagar™ MRSA for detection of STAPHYLOCOCCUS AUREUS in seawater and beach sand – Comparison of culture, agglutination, and molecular analyses, Water Research, Volume 43, Issue 19, November 2009, Pages 4802-4811.
GUIMARÃES Junior. Biossegurança e Controle de Infecção cruzada em consultórios odontológicos. São Pualo. ED; Santos, 2001.
HORIBA N, Yoshida T, Suzuki K, Maekawa Y, Ito M, Matsumoto T, Isolation of methicillin-resistant Staphylococciin the dental operatory. J Endo 1995; 21:21-5.
ISENBERG HD. Clinical microbiology procedures handbook. 20 Ed 2004. Washington: ASM Press
YOKO Kondo,Teruyo Ito,Xiao Xue Ma,Shinya Watanabe,Barry N. Kreiswirth,Jerome Etienne, Keiichi Hiramatsu. Combination of Multiplex PCRs for Staphylococcal Cassette Chromosome mec Type Assignment: Rapid Identification System formec, ccr, and Major Differences in Junkyard Regions. Antimicrobial Agents and Chemotherapy, Jan. 2007, p. 264–274 Vol. 51, no1.
JAMES H. Jorgensen, Selection Criteria for an Antimicrobial Susceptibility Testing System, Journal of Clinical Microbiology, Nov. 1993, p. 2841-2844
KEDJARUNE B, Leggat A Bacterial aerosols in the dental clinic: a revive. International Dental Journal Volume 51, Issue 1, pages 39–44, February 2001.
Kolend L Charles Inc. THE CHANGING PATTERN OF INFECTIONS WITH MRSA AND OTHER ORGANISMS AFTER MAJOR RECONSTRUCTIVE SURGERY OF THE MAXILLOFACIAL REGION In: Methicillin-Resistant Staphylococcus Aureus… ISBN: 978-1-60741-398-1 Editor:. i © 2010 Nova Science Publishers, Livro
KURITA H, Kurashina K, Honda T. Nosocomial transmission of methicillin-resistant STAPHYLOCOCCUS AUREUS via the surfaces of the dental operatory. Br Dent J 2006; 201:297-300.
LONDONO, Juan F; Ortiz, Gloria M, Gaviria Ángela María. Prevalence of personnel of the intensive of Medellín 2004, Infectio 0123-9392, Juan 2006 vol:10 iss:3 pg:160 -166
MCDOUGAL Linda K., Christine D. Steward, George E. Killgore, Jasmine M. Chaitram, Sigrid K. McAllister, and Fred C. Tenover Pulsed-Field Gel Electrophoresis Typing of Oxacillin-Resistant Staphylococcus aureus Isolates from the United States: Establishing a National Database. JOURNAL OF CLINICAL MICROBIOLOGY, Nov. 2003, p. 5113–5120 Vol. 41, no. 11.
MÉNDEZ Iván Alberto; Holguín Riaño, Diego Fabián; Pachón Barinas, Diana Patricia; Africano, Francisco Javier; Gómez – González, Iván Mauricio; Rojas, Nydia Alexandra, Prevalence and antimicrobial susceptibility of STAPHYLOCOCCUS AUREUS methicilin resistant isolated from medical students Revista CES Medicina, 2013, Vol.27(1), pp.21-30
MERLINO J, Leroi M, Bradbury R, Veal D, Harbour C. New chromogenic identification and detection of STAPHYLOCOCCUS AUREUS and methicillin-resistant S. aureus. J Clin Microbiol. 2000;38: 2378–80
MICET, S. T. Alternatives to vancomycin for the treatment of methicillin-resistant Staphyloccus aureus infections. Clinical Infectious Diseases 45, S184–S190 (2007)
MIMICA, Marcelo J.; Carvalho, Rozane L.; Mimica, Marcelo J.; Berezin, Eitan N.; Damaceno, Neiva; Caiaffa-Filho, Hélio H. Comparison of five methods for oxacillin susceptibility testing of STAPHYLOCOCCUS AUREUS isolates from cystic fibrosis patients, Revista do Instituto de Medicina Tropical de São Paulo, 2012 vol:54 iss:6 pg:305 -306
MONCAYO-Ortiz, José-Ignacio; Corredor-Arias, Luisa-Fernanda; Luligo-Espinal, Jenna-Samara; Álvarez-Aldana, Adalucy; Santacruz-Ibarra, Jorge-Javier Correlation between detection of superantigens and oxacillin resistance of STAPHYLOCOCCUS AUREUS in hospital isolates, Infectio Volume 19, Issue 3, July–Setembro 2015, Pages 109–114
MUKOVNIKOVA Marina, Erlangen Yusuf,Veerle Cossey, Annette Schuermans, Veroniek Saegeman; A Evaluation of a Chromogenic Biplate Medium ( ChromID MRSA/ChromID S. aureus) for the Simultaneous Detection of Methicillin-Resistant and Methicillin-Susceptible STAPHYLOCOCCUS AUREUS in Preoperative Screening Samples from the Anterior Nares. Journal of Clinical Microbiology p. 678–680 February 2014 Volume 52 Number 2;
OHKUSHI Daisuke, Yuki Uehara,Akira Iwamoto, Shigeki Misawa, Shigemi Kondo, Kenichiro Shimizu, Satoshi Hori, Keiichi Hiramatsu; An effective active surveillance method for controlling nosocomial MRSA transmission in a Japanese hospital. J Infect Chemother (2013) 19:871–875.
PAO-Kuei Hsiao , Wan-Ting Chen , Kai-Chih Chang , Yu-Ju Ke , Chung-Long Kuo, Chun-Chieh Tseng; Performance of CHROMagar Staph aureus and CHROMagar MRSA for Detection of Airborne Methicillin Resistant and Methicillin-Sensitive STAPHYLOCOCCUS AUREUS , Aerosol Science and Technology, 46:297–308, 2012
PHILIPPE R. S. Lagace-Wiens,Michelle J. Alfa,Kanchana Manickam,Godfrey K. M. Harding, Reductions in Workload and Reporting Time by Use of Methicillin-Resistant STAPHYLOCOCCUS AUREUS Screening with MRSA Select Medium Compared to Mannitol-Salt Medium Supplemented with Oxacillin. Journal Of Clinical Microbiology, Apr. 2008, p. 1174–1177
PRAY, L. (2008) Antibiotic resistance, mutation rates and MRSA. Nature Education 1(1):30
RADDI M. S. G.; V. C. Colli; A. C. Pizzolitto Determinação da resistência de STAPHYLOCOCCUS AUREUS : um desafio? Revista de Ciências Farmacêuticas Básica e Aplicada [1808-4532] yr:2009 vol:30 iss:1 pg:115 -118
RAHMAN Abd El, Abeer Afaf El Sayed, Afaf Mahmood. Evaluation of CHROMagar and Pastorex Test in Identification of STAPHYLOCOCCUS AUREUS . Egypt J. Med. Lab. Sci. September 2009; 18(2):53-60
RIBEIRO Apoena, Cıcero Dias, Maria Cıcera, Silva Carvalho, Laura Berquo´, Fabienne Antunes Ferreira, Raquel Neves Soares Santos, Bernadete Teixeira Ferreira-Carvalho, Agnes Marie Figueiredo. First Report of Infection with Community-Acquired Methicillin-Resistant STAPHYLOCOCCUS AUREUS in South America. Journal of Clinical Microbiology, Apr. 2005, p. 1985–1988. Vol. 43, No. 4
RIORDAN Katherine O’, Jean C. Lee, STAPHYLOCOCCUS AUREUS Capsular Polysaccharides, Clinical Microbiology Reviews, Jan. 2004, p. 218–234 Vol. 17, No. 1
ROBERTS Marilyn C, Olusegun O. Soge, Kiet A. Ly, Peter Milgrom, Methicillin-resistant STAPHYLOCOCCUS AUREUS from dental school clinic surfaces and students. American Journal of Infection Control, October 2011.
ROBERTSON D, A. J. Smith. The microbiology of the acute dental abscess, Journal of Medical Microbiology (2009), 58, 155–162
SANTOS, (2007).2 André Luis dos et al. Staphylococcus aureus: visitando uma cepa de importância hospitalar. J. Bras. Patol. Med. Lab. [online]. 2007, vol.43, n.6, pp.413-423. ISSN 1676-2444. http://dx.doi.org/10.1590/S1676-2444200700060000
RAMON Shabana, Deborough Macbetha, Nicole Vause, Geoff Simon – Documentation, composition and organisation of infection control programs and plans in Australian healthcare systems: A pilot study – Infection, Disease & Health. 2016
SILBERT Suzane, Carly Kubasek, Dominic U, Raymond Widen; A Comparison of the ESwab with Traditional Swabs for the Detection of MRSA Using Two 2 Different Walk-Away Commercial Real Time PCR Methods; American Society for Microbiology J. Clin. Microbiol.2014,
U.S. Centers for Disease Control (CDC). MRSA: Methicillin-resistant Staphylococcus aureus in health care settings. (2007)
VANDENDRIESSCHE Stien Wannes Vanderhaeghen, Jesper Larsen, Ricardo de Mendonc¸ Marie Hallin Patrick Butaye, , Katleen Hermans, Freddy Haesebrouck and Olivier Denis; High genetic diversity of methicillin-susceptible STAPHYLOCOCCUS AUREUS (STAPHYLOCOCCUS AUREUS ) from humans and animals on livestock farms and presence of SCCmec remnant DNA in STAPHYLOCOCCUS AUREUS CC398; J Antimicrob Chemother 2014; 69: 355 –362
WARNKE Philipp, Hagen Frickmann, Peter Ottl, Andreas Podbielski1 Nasal Screening for MRSA: Different Swabs – Different Results. PLOS ONE | www.plosone.org 1 October 2014, Volume 9, Issue 10 e 11.
ZHANG Kunyan, Jo-Ann McClure, Sameer Elsayed, Thomas Louie,
John M. Conly, Novel Multiplex PCR Assay for Characterization and Concomitant Subtyping of Staphylococcal Cassette Chromosome mec Types I to V in Methicillin-Resistant STAPHYLOCOCCUS AUREUS . Journal Of Clinical Microbiology, Oct. 2005, p. 5026–5033 Vol. 43, no. 10
X2 = Somatório [(o – e)2/e] ou Somatório d2 / e
o = frequência observada
e= frequência obtida
d = Intervalo entre a frequência observada e a frequência esperada
Avaliar a associação existente entre variáveis qualitativas.
Verificar se a frequência com que um determinado acontecimento observado em uma amostra se desvia significativamente ou não da frequência com que ele é esperado.
Comparar a distribuição de diversos acontecimentos em diferentes amostras, a fim de avaliar se as proporções observadas destes eventos mostram ou não diferenças significativas ou se as amostras diferem significativamente quanto às proporções desses acontecimentos
Ho – Não existe associação entre os grupos (quando o valor esperado para aquela classe é próximo do valor encontrado). Rejeita a hipótese e ela e nula.
H1 – Existe associação entre os grupos pesquisados. Quando o valor apurado de uma classe é diferente do valor esperado (não são muito próximos), neste caso a hipótese não é rejeitada
