REGISTRO DOI: 10.5281/zenodo.7453441
Francisnara de Paula Rezende Coltro1
Micaele Aparecida de Lima2
José Pedro Thompson Júnior3
Resumo
Palavras-chave: Sulfeto de hidrogênio. Tratamento de efluentes. Métodos de remoção. Oxidação eletroquímica. Reagente Fenton. Reatores microaerados.
Abstract
Key words: Hydrogen sulfide. Wastewater treatment. Removal methods. Electrochemical oxidation. Fenton reagent. Microaerated reactors.
Introdução
O desenvolvimento tecnológico e industrial trouxe grandes melhorias para a humanidade, porém tais benefícios tem um custo, resultando em impactos industriais das mais diversas formas. O descarte de efluentes contendo sulfeto de hidrogênio tem sido responsável pela contaminação e desbalanceamento do ciclo do enxofre no meio ambiente. Sendo assim, a remoção deste componente dos efluentes industriais tem se tornado cada vez mais indispensável.
O presente artigo tem o intuito de realizar um comparativo entre metodologias de remoção do H2S presente em efluentes. Existem diversos estudos em andamento que apresentam possíveis atuações para a remoção do H2S, dentre eles podemos citar: remoção de sulfeto de hidrogênio através de oxidação eletroquímica, recuperação de enxofre elementar através de reatores microaerados, o tratamento com método de coagulação e floculação, remoção através do processo de oxidação química com peróxido de hidrogênio (H2O2), remoção de sulfetos através do processo de oxidação química com Reagente Fenton e o tratamento de efluentes através do processo separação por precipitação em tanques. Serão apresentados três métodos distintos e seus resultados serão analisados e comparados visando buscar qual é a metodologia de maior eficiência.
Referencial Teórico
O Sulfeto de hidrogênio (H2S)
O sulfeto de hidrogênio trata-se de um gás tóxico e incolor e é facilmente reconhecido pelo seu odor semelhante a ovos podres. Em condições normais de temperatura e pressão tem forma gasosa. Pequenas quantidades de H2S presentes em um hidrocarboneto resultam em grandes quantidades de gás na fase vapor. Segundo Souza (2012) em investigações de campo foi estabelecido que cada ppm (mg/Kg) de H2S no líquido pode gerar de 20 a 400 ppm (V/V) na fase vapor.
Tabela 1 – Propriedades do sulfeto de hidrogênio
Propriedade Resultado Aparência Gás incolor Número CAS 7783-06-4 Fórmula molecular H2S Peso molecular 34,08 Ponto de ebulição -79,59°F (-60,33°C) Peso específico 0,916 a -60°C Pressão de vapor 20,0 a 25,5°C Ponto de fusão -121,9°F (-85,49°C) Solubilidade em água 1 g em 242 ml a 20°C Limites de explosividade 4,3 a 45% pH de solução aquosa saturada 4,5 pKa a 25°C 6,97 – 12,90
O sulfeto de hidrogênio pode ser encontrado na natureza através de campos de petróleo e gás natural, águas subterrâneas, zonas pantanosas, jazidas de sal, carvão ou em minérios sulfetados. Se tratando dos segmentos industriais eles podem ocorrer através de processos de remoção química, lavagem de gases ácidos, de sistemas de tratamento de efluentes, de fermentações ou de decapagens ácidas.
É comumente encontrado em produtos derivados de petróleo, sendo assim está presente em todas as correntes de processo da refinaria. Souza (2012) explica que em gases e hidrocarbonetos destilados ele é normalmente removido por processos de destilação e stripping (técnica baseada no borbulhamento de gás) ou por métodos de adoçamento tais como a lavagem cáustica. Já em soluções aquosas o pH interfere diretamente na quantidade de H2S que é liberado, em pH básico a maior parte do H2S estará sob a forma de íons sulfeto ou hidrossulfeto. A forma estável do H2S é determinada pelo pH do meio, para um pH menor que 7, e fração total de sulfetos igual a 1 íon g/l, a forma predominante é o H2S, para um pH acima de 7 há uma predominância dos íons HS– e para valores altos de pH a forma estável é o S2-. Neutralizantes à base de aminas tem alta eficácia com o H2S, porém só são efetivos em baixas temperaturas, não tendo estabilidade quando aquecidos e bases fortes como o hidróxido de sódio são eficientes como sequestrantes de H2S.
Método de oxidação eletroquímica
Este estudo apresentado por Mattiusi, Kaminari e Ponte (2011) faz uso da oxidação eletroquímica para remoção de H2S de efluentes. Os autores ressaltam que a maior vantagem desta técnica se dá ao fato de que o seu principal reagente, o elétron, é um reagente limpo. A reação eletroquímica é um processo químico heterogêneo (com interface sólido/solução) que consiste na transferência de cargas para ou de um eletrodo metálico ou semicondutor. A purificação eletroquímica do sulfeto de hidrogênio proporciona a conversão eletroquímica em um ambiente aquoso, contanto que os potenciais padrões das reações correspondentes estejam dentro de uma faixa de estabilidade correspondente aos eletrólitos aquosos. Segundo os autores, o produto resultante das oxidações de sulfeto de hidrogênio é na sua maioria o enxofre elementar.
Os estudos de oxidação eletroquímica são desenvolvidos em células eletroquímicas com volumes de solução pequenos (em torno de 100 ml), quando tais estudos são aplicados em reatores estes volumes não ultrapassam os 3 litros. Por esse motivo Zaman e Chakma (1995) defendem o aumento de escala e uma investigação dos efeitos das condições hidrodinâmicas nas taxas de transporte para maiores informações de projeto.
O sulfeto de hidrogênio, parcialmente solúvel em água, tem a capacidade de se dissociar e formar espécies químicas HS– (sulfeto ácido ou íon bissulfeto) e S2- (sulfeto), sendo o HS– a espécie corrosiva. As reações (1) e (2) representam a dissociação do sulfeto de hidrogênio com suas respectivas constantes de dissociação (Mahan, 1997 e Zhang et al., 2008):

A dissociação também está diretamente relacionada à temperatura e pH. Com base nisso os autores afirmaram que o pH menor que 7 resulta em S-2 e maior que 7 em HS–. Os autores também apresentam as reações de oxidação dos íons bissulfeto (HS–) e seus respectivos potenciais (Ateya e Al-Kharafi, 2002; Szpyrkowicz, 2005):
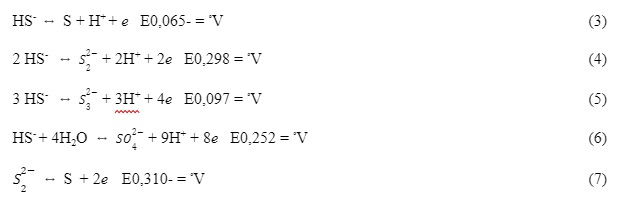
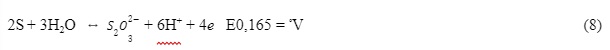
Para o processo de oxidação eletroquímica Mattiusi et al. utilizou uma solução sintética de sulfeto de hidrogênio dissolvido, sendo este composto de uma solução preparada a partir de sulfeto de sódio nonaidratado (Na2S·9H2O) e água destilada desoxigenada por injeção de nitrogênio (N2) durante 30 minutos. Como eletrólito suporte da solução, conforme Brett (1996), foi utilizado NaCl a 0,1 mol·L-1, temperatura de 25ºC. A justificativa para utilizar essa metodologia em laboratório deve-se à segurança operacional, evitando a utilização do H2S gasoso, devido à sua alta toxicidade. Esta solução foi transferida para a célula eletroquímica através da diferença de pressão positiva de N2.
Para as medidas voltamétricas utilizou-se a voltametria, trata-se de uma técnica eletroquímica que registra as informações, qualitativas e quantitativas, de corrente em função do potencial de uma dada espécie química. As curvas denominadas voltamogramas são obtidas durante a eletrólise da espécie em uma célula eletroquímica composta de 3 eletrodos. O potencial é aplicado variando uma velocidade em função do tempo, ou seja, em forma de varredura (BRETT, 1996; MATTIUSI, 2012).
Mattiusi et al. utilizou-se três concentrações de soluções 30 mg·L-1, 300 mg·L-1 e 3000 mg·L-1 e três velocidades de varredura: 1 mV·s-1, 5 mV·s-1 e 10 mV·s-1 e, para cada velocidade, três rotações distintas do eletrodo de trabalho: sem rotação, 50 rpm e 100 rpm. A varredura anódica foi realizada, entre os potenciais -0,5 V (vs. ECS) e 1,0 V (vs. ECS), por meio do galvanostato potenciostato Gamry (ZRA Reference 600) acoplado à um computador para registro dos voltamogramas pelo software Gamry Instrument Manager.
Como aparato experimental utilizaram-se os seguintes itens: Célula convencional eletroquímica de 100 mL com 3 orifícios: para o eletrodo disco rotatório (eletrodo de trabalho) (onde ocorrem as reações de oxidação), para o eletrodo calomelano saturado (ECS) (eletrodo de referência) (para medidas relativas de potencial) e para o eletrodo de platina (contra-eletrodo); Eletrodo de trabalho disco rotatório de carbono vítreo reticulado de área superficial de 0,126 cm²; Eletrodo de referência tipo calomelano (ECS) (Hg/Hg2Cl2), KCl saturado, potencial de +0,241 V em relação ao eletrodo padrão de hidrogênio e eletrodo auxiliar de platina em espiral.
Oxidação de compostos de enxofre por meio de reagente Fenton
Evandro Silva Santos (2021) apresenta em seu trabalho a remoção do sulfeto de hidrogênio através da utilização do reagente Fenton. Com este reagente muitas moléculas de caráter orgânico podem ser oxidadas facilmente sem recorrer a altas pressões e temperaturas elevadas ou ainda equipamentos complexos. A combinação entre ferro II e peróxido de hidrogênio são eficientes processos para oxidação de compostos orgânicos (BRITO, 2012). Santos (2021) explica que este processo consiste na geração de radical hidroxila a partir de uma mistura de peróxido de hidrogênio e sais ferrosos. As limitações de pH e a formação de precipitados coloidais de hidróxido férrico representam as maiores dificuldades de aplicação do método. Brito (2012) comenta que Haber e Weiss em 1898, propuseram o desenvolvimento de radicais hidroxil, entretanto, o verdadeiro mecanismo somente foi desvendado na década de 40 por Merz e Waters que propuseram a decomposição do H2O2 catalisada por Fe3+. Esta reação descrita na Equação (9) é favorecida cineticamente, tendo uma constante cinética k= 76 L.mol‐1s‐1 a 30 ºC e pH igual a 3,0. O mecanismo de geração catalítica de radicais hidroxil, provado e aceito desde 1971, é descrito pelas equações abaixo (ROCHA, et. al., 2018).
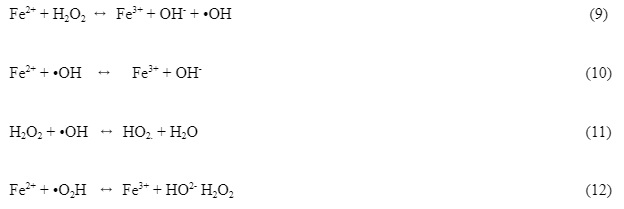

De acordo com Tambosi (2005), os fatores relevantes a serem observados no sistema Fenton são os seguintes:
– Concentração de peróxido de hidrogênio: Esta representa o papel crucial na eficiência total do processo de degradação. Geralmente tem sido observado que a eficiência de degradação aumenta com um aumento na dosagem de peróxido de hidrogênio. Entretanto, o peróxido de hidrogênio, se presente em grandes quantidades, atua como um sequestrador de radicais hidroxil, e, portanto, não é recomendado que se use peróxido de hidrogênio em excesso.
– Concentração inicial de poluente, normalmente efluentes com baixas cargas de poluentes são mais facilmente degradados (KWON et al., 1999).
– Temperatura de operação, condições ambientes podem ser usadas com boa eficiência no processo. Em geral a eficiência de degradação não é afetada, mesmo quando a temperatura aumenta de 10 para 40o C (LIN e LO, 1997).
– Coagulação química, a coagulação química é um passo recomendado após a oxidação Fenton para manter a concentração de ferro solúvel dentro dos limites permitidos (LIN e LO, 1997).
A realização da metodologia foi dividida em três etapas: na primeira os autores realizaram testes preliminares visando a caracterização do efluente neutralizado a ser trabalhado, tal procedimento teve o intuito de verificar qual a composição das amostras e a identificação de possíveis interferentes, os testes realizados foram de DBO, DQO, fenóis, sólidos sedimentáveis, sólidos suspensos totais, sulfeto, coliformes termotolerantes, fósforo total, mercúrio, nitrogênio total, óleos e graxas minerais, pH e cloretos. Também na etapa 1 foram realizadas simulações das concentrações de peróxido (H2O2) em 50 e 500 mg/L e do íon ferroso (Fe2+) em 10 e 50 mg/L, já as variações de pH ficaram em neutro (aproximadamente pH 6,8) e ácido (aproximadamente pH 4,0). Todas as simulações foram realizadas em triplicata. Segue abaixo a tabela de planejamento das simulações:
Tabela 3 – Planejamento das simulações
Não houve adição de reagentes de preservação nos efluentes, os testes foram feitos em temperatura ambiente. Os ajustes de pH foram realizados com uma solução de HCl 2M e as concentrações de Fe2+ e H2O2 foram adicionadas sob constante agitação, mantendo a reação de 22 horas, após este período foram coletadas as alíquotas para a realização dos testes.
A etapa 2 consistiu num planejamento fatorial de experimentos 2k. Silva (2021) explica que houve variável de resposta a redução da concentração de sulfetos, considerando a relação com os fatores de concentração de Peróxido de hidrogênio, íons ferrosos e tempo de reação. O autor também explicou que nesta etapa, as concentrações de peróxido (H2O2) em 50 e 500 mg/L e as do íon ferroso (Fe+2) foram definidas em 10 e 50 mg/L, as variações de pH em neutro (aproximadamente pH 6,8) e ácido (aproximadamente pH 4,0). Essas proporções e quantidades foram estabelecidas com base em testes preliminares e nas informações obtidas na literatura consultada (TAMBOSI, 2005; ARAÚJO et.al., 2009; ERTUGAY e ACAR, 2017; ALVES 2006).
Tabela 4 – Matriz de planejamento fatorial
A etapa 3 buscou adequar as concentrações dos reagentes de acordo com os dados obtidos nas etapas anteriores, visando evitar possíveis desperdícios e verificar condições em que a relação de redução seja benéfica. Foi planejado o experimento da etapa 3, definindo as concentrações de peróxido de hidrogênio, íon ferroso e pH, para um tempo de reação de 24 horas.
Tabela 5 – Matriz de planejamento fatorial 2k – Etapa 3
Recuperação de enxofre elementar em reatores microaerados
A recuperação de enxofre elementar em reatores microaerados é o método apresentado por Priscila Rosseto Camiloti (2002) em sua dissertação. Com o intuito oxidar o sulfeto a enxofre elementar a autora utilizou reatores com aeração por difusão do oxigênio em duas condições: gás sob pressão (Reator de Membrana Submersa) e pressão atmosférica (Reator de Membrana Externa).
Camiloti (2002) cita que os processos microaeróbios são uma alternativa que representam menor consumo energético dentro do sistema, ao passo que, com o uso de membranas poliméricas permeáveis, a microaeração pode ser obtida somente pela troca atmosférica e o consumo energético pode ser ainda menor. A autora ressalta que a produção de enxofre elementar através da oxidação do sulfeto é uma alternativa lucrativa, afinal o produto gerado pode ser recuperado por processos físico-químicos de separação, sendo este de alto valor agregado.
A dissertação foi dividida em duas etapas, sendo que na primeira focou nos estudos hidrodinâmicos e na estimativa de parâmetros de transferência de massa, já na segunda etapa foi realizado o estudo da oxidação do sulfeto a enxofre elementar.
A autora explicou que foram realizadas duas configurações de reatores, a primeira foi a de membrana submersa (RMS) com troca realizada no interior da membrana para o meio líquido, a segunda foi a de membrana externa (RME) aonde a troca ocorreu no sentido contrário, do exterior da membrana (sob pressão atmosférica) para o líquido no seu interior. Camiloti (2002), cita que
Os reatores foram operados em batelada com regime de mistura completa. A agitação foi realizada por meio de barra magnética e controlada por meio de um agitador magnético (Fisatom modelo 752A). O modelo permite agitação de 120 a 1500 rpm, desta forma os reatores foram operados com agitação de aproximadamente 900 rpm para RME e d aproximadamente 700 rpm para RMS. A membrana de silicone (Perfimed®), utilizada nas configurações, tinha diâmetro de 8×12,8 mm, espessura de 2,4 mm e um comprimento total de 0,2 m.
Tabela 6 – Dimensões dos reatores microaeróbios
O reator de membrana submersa (RMS) foi configurado de forma que a membrana permeável a oxigênio (tubo cilíndrico de silicone) estivesse imersa no meio líquido, com ar sintético pressurizado para que ocorresse a difusão molecular para o meio líquido, conforme figura abaixo:
Camiloti (2002) explica que o reator de membrana submersa teve como principal variável a pressão do ar no interior da membrana (bar), como fato de transferência de oxigênio do meio gasoso para o meio liquido. Houve uma variação da pressão no interior da membrana para que houvesse também uma variação no fluxo de transferência de massa na fase gasosa. As faixas de pressão de trabalho foram de 1,25 a 1,5; 1,5 a 1,75 e 1,75 a 2,0 bar.
Na configuração do reator de membrana externa (RME), a membrana externa ao reservatório e suas paredes tiveram contato com o ar atmosférico. Camiloti (2002) detalhou que o meio, contido em um reservatório, era bombeado para o interior da membrana e a troca gasosa era realizada por permeação do ar sob pressão atmosférica, conforme apresentado na figura abaixo:
A principal variável operacional do RME foi a velocidade do líuido no interior da membrana [m/s], calculada como vazão de líquido dividida pela área seccional da membrana, conforme equação (15):
(15)
Segundo a autora, a área da membrana foi mantida e o sistema era manipulado através da vazão da bomba de recirculação alterando, assim, a relação. O objetivo da variação de escoamento de líquido foi o de variar o fluxo de transferência de massa na fase líquida, influenciando na transferência do oxigênio no filme líquido.
A solução de sulfeto utilizada no método foi sintética, sua preparação foi com sulfeto de sódio nonahidratado (Na2S.9H2O) com concentração de 50 mg.L-1. A solução foi mantida em um fluxo de N2 por 15 minutos e então adicionou-se os reagentes para o tamponamento do meio para o pH específico, conforme tabela abaixo:
Tabela 6 – Dimensões dos reatores microaeróbios
O passo seguinte consistiu na adição do meio nutricional para crescimento de Thiobacillus sp. Descrito por Kuenen & Robertson (2006), este meio também tinha caráter tamponante.
Tabela 7 – Composição do meio de enriquecimento do inóculo
Tabela 8 – Composição da solução de micronutrientes
A autora explica que o inóculo foi previamente enriquecido e adicionado ao meio com proporção de 10% em volume. Também cita outro trabalho de Pantoja Filho (2008) onde o mesmo procedeu com o enriquecimento de forma semelhante e obteve eficiências superiores a 99,3% de remoção do sulfeto de hidrogênio.
Para o monitoramento do oxigênio dissolvido foi utilizada a sonde de medidor por luminescência Hach modelo LDO HQ10. O potencial redox e o pH foram monitorados por potenciometria. O sulfato foi analisado pelo cromatógrafo de íons (Dionex 5000) com detector de condutividade e coluna IonPac® AS11HC operando a uma temperatura de 30ﹾC. Como fase móvel foi utilizada a solução de carbonato de cálcio (4,5 mM) e bicarbonato de cálcio (0,8 mM) com fluxo de 1,0 mL.min-1.
Análises de enxofre de elementar foram realizadas pelo método colorimétrico com extração em acetona descrito por Barlett & Skoog (1954). Camiloti (2002) explica que com a adição de uma solução de cianeto que, em presença de enxofre e eacetona, reage rapidamente formando tiocianato, que por sua vez, na presença de solução de cloreto férrico, apresenta um produto de coloração vermelho-alaranjada. A metodologia foi utilizada de forma qualitativa, sondo os resultados de enxofre elementar obtidos pelo método não participaram de cálculos de rendimento.
As rotas de oxidação foram estudadas em diferentes valores de pH (8,0; 9,0 e 10,0) e também com variáveis operacionais de velocidade e pressão. Abaixo são apresentadas as tabelas de planejamento fatorial para cada reator.
Tabela 9 – Planejamento fatorial para reator de membrana submersa
Tabela 10 – Planejamento fatorial para reator de membrana externa
Metodologia
O principal objetivo deste artigo foi realizar um comparativo entre métodos de remoção de sulfetos de efluentes industriais. Para realizar tal comparativo, buscou-se informação de trabalhos que tratassem do tema proposto, porém com formas distintas de obtenção. Além da necessidade de tratar do tema remoção de sulfetos de efluentes industrias era necessário que houvessem pontos em comum para que de fato fosse possível realizar um comparativo, para suprir tal necessidade, colocou-se como critério trabalhos que utilizassem soluções sintéticas de sulfeto sódio nona hidratado (Na2S.9H2O). Com base nisso foram selecionados os seguintes trabalhos e métodos:
– Aplicação da oxidação eletroquímica de sulfeto para tratamento de efluentes industriais. Autores: Eveline Martins Mattiusi, Nice Mika Sakamoto Kaminari, Maria José Jerônimo de Sanatana Ponte e Haroldo de Araújo Ponte. Universidade Federal do Paraná, Laboratório de Tecnologia Ambiental (LTA). Curitiba, 2011.
– Oxidação de compostos de enxofre em efluentes industriais por meio do reagente Fenton. Autor: Evandro Silva dos Santos. Universidade La Salle. Canoas, 2021.
– Recuperação de enxofre elementar em reatores microaerados. Autora: Priscila Rosseto Camiloti. Universidade de São Paulo. São Carlos, 2012.
Após a seleção, estudamos os trabalhos e buscamos conhecer melhor o funcionamento de cada método e então realizamos uma tabela comparativa com os prós e contras de cada método e os resultados obtidos em cada experimento. Tais dados serão discutidos de forma ampla na seção de resultados e discussões.
Resultados e discussões
Com o intuito de visualizar de forma mais prática os pros e contras de cada método, fizemos uso de uma tabela comparativa entre os métodos, a tabela é apresentada abaixo.
Tabela 11 – Tabela comparativa vantagens e desvantagens de cada método
Comparativo de vantagens e desvantagens Métodos Oxidação eletroquímica Oxidação por meio de reagente Fenton Recuperação de enxofre elementar em reatores microaerados Fator comum Solução sintética de sulfeto de hidrogênio dissolvido, preparado a partir de sulfeto de sódio nona hidratado (Na2S·9H2O) Solução sintética de sulfeto de hidrogênio dissolvido, preparado a partir de sulfeto de sódio nona hidratado (Na2S·9H2O) Como acontece A oxidorredução ocorre em meio aquoso e há transferência de elétrons: o sulfeto de hidrogênio se dissocia formando o enxofre elementar (e o íon bissulfeto). Tal fato está diretamente ligado ao pH menor que 7 resulta em S-2 e maior que 7 em HS–. O peróxido de hidrogênio oxida íons sulfeto produzindo enxofre elementar ou íos sulfato (dependendo das condições da reação). Adiciona-se íos FE2+ de modo a aumentar a velocidade da reação (reação de Fenton) A oxidação de sulfeto a enxofre elementar pode ocorrer por via biológica ou química. Na biológica utiliza-se microoganismos capazes de oxidar o sulfeto sob concentrações limitadas de oxigênio. Na química acontece de forma espontânea se houver presença de oxigênio. Vantagens Baixo custo de implantação; Ocupa pouco espaço; Seletividade; Compatibilidade ambiental (elétron, pode não gerar lodo) facilidade de automação; Versatilidade, estabilidade eficácia (remoção de cor, odor, turbidez, metais, microrganismos, rapidez). Baixo custo; Produtos da reação não danificam o meio ambiente; Fácil aquisição dos reagentes; Alto Potencial de oxidação; Aplicável a uma ampla variedade de compostos orgânicos. Depois de oxidado o enxofre elementar pode ser removido por sedimentação; Economia de energia utilizada no processo de aeração; Bom para remover orgânicos de baixa massa molar; Pouca manutenção. Desvantagens Alto custo de operação; Deve-se ter domínio sobre o processo se o efluente conter alto teor de cloro. Ineficiente em ambiente alcalino; Ajuste do pH entre 3-5; Liberação de calor (reação exotérmica); Possibilidade de explosão; Contaminantes orgânicos absorvidos requerem alta concentração dos reagentes. Pequena área disponível para tratamento; Alto custo de implantação; Longos tempos de retenção do efluente; Se a taxa de oxigenação variar por algum motivo, o sulfeto será convertido a sulfato, gerando o conceito de ciclo fútil.
A seguir são apresentados os resultados obtidos em cada um dos métodos estudados:
Método de oxidação eletroquímica
Uma reação eletroquímica ocorre em três etapas básicas. A etapa correspondente ao transporte de massa da espécie reagente que se aproxima da superfície do eletrodo. A etapa que ocorre a transferência de carga para superfície do eletrodo ocasionando a oxidação da espécie reagente. E a etapa onde a espécie reagida sofre dessorção e é transportada de volta ao seio da solução. (BARD e FAULKNER, 2001; SCOTT, 1995).
É demonstrado na figura 4 a relação das porções de curva de polarização às etapas determinantes da taxa. Conforme Mattiusi et al. Explica, pode-se observar que em baixas correntes aplicadas as reações são governadas por transferência de carga (TC), ou seja, toda carga fornecida ao sistema reage imediatamente com os íons presentes na solução, assimpode-se dizer que o controle do processo ocorre por ativação (zona 1) (PLETCHER e WALSH, 1990; COEURET, 1992). A porção horizontal refere-se à corrente limite (iL) (ou corrente de pico), onde a reação ocorre sob controle de transporte de massa (TM), e independe do potencial (zona 3). Logo, diz-se que o controle do processo ocorre por transporte de matéria (SCOTT, 1995). A zona 2 representada na Fig. 2 corresponde ao controle misto, o qual ocorrem de forma simultâneas ambos os fenômenos anteriores (COEURET, 1992).
Os autores explicaram que em todas as soluções de HS– analisadas foi possível observar o aumento da corrente de pico com o aumento da velocidade de varredura, sendo que os valores de potencial de pico (Ep) ficaram próximos a 0,3 (V vs. ECS). Tal comportamento acontece pois o aumento da concentração de HS– na solução indica controle do sistema de transporte de massa.
Segundo Ateya e Al-Kharafi (2002), após oxidação anódica o íon bissulfeto pode resultar em enxofre elementar (S0), polissulfetos, oxiânions de enxofre sulfato e tiossulfato. O trabalho revelou que é possível oxidar eletroquimicamente íons sulfeto em soluções aquosas com o auxílio do eletrodo de carbono vítreo reticulado. O potencial no qual ocorrem as reações de interesse fica próximo a 0,3V, sugerindo a presença das mesmas reações para todos os casos analisados. Também foi demonstrado que o enxofre elementar não passiva a superfície do eletrodo, podendo este ser removido do efluente.
O estudo não apresentou análises de superfície e de concentração, como microscopia eletrônica de varredura e cromatografia iônica, tais análises deveriam ser realizadas no eletrodo de trabalho para quantificar os compostos presentes após os testes. Os autores justificaram tal ausência de dados com o fato de que se tratava de um trabalho para verificar qual a melhor configuração do aparato de oxidação eletroquímica.
Oxidação de compostos de enxofre por meio de reagente Fenton
Foi possível verificar que a adição do reagente de Fenton ao efluente durante processo de tratamento, que oxidam ou precipitam os sulfetos em geral, ou ionizam o H2S(aq) (HS-, S2-) impedindo a sua liberação para a fase gasosa, como H2S (g), desta forma diminuindo significativamente a geração de gases mal odorosos. A principal vantagem da utilização do peróxido de hidrogênio é que, além de oxidar os sulfetos, ele se decompõe em H2O e O2.
Considerando os dados da etapa 3 a proposta apresenta-se adequada visto que foram observadas reduções das concentrações de sulfetos na amostra estudada, com otimização em relação ao uso de reagentes químicos e da identificação da melhor faixa de pH de trabalho, com resultado de até 45% de redução do teor de sulfetos.
Os dados obtidos da etapa 1, apresentaram resultados de diminuição dos teores de sulfetos que indicaram a potencialidade do projeto e de que os objetivos específicos da proposta inicial poderiam ser alcançados, se mantido o aprimoramento do experimento nas etapas 2 e 3.
Na etapa 1, foram utilizadas concentrações mais elevadas de reagentes com o propósito de identificar a viabilidade da oxidação de compostos de sulfetos, nesta a maior redução identificada foi de 76%. Desta forma foi possível atender ao primeiro objetivo específico onde iniciou-se um planejamento de experimentos variando as concentrações de peróxido de hidrogênio, íon ferroso, pH e tempo de reação no processo Fenton, para identificar a potencialidade do projeto.
Confirmada a hipótese inicial, foi realizado o planejamento de experimentos da etapa 2 e nesta foi possível verificar que a maior redução da carga de sulfetos foi nas amostras 2, 7, 9, ambas com redução de 78% da concentração de sulfetos, sendo que a menor relação [9]:[1], entre os reagentes foi das amostras 2 e 9, convém considerar as questões de volumes e efeitos colaterais a partir das altas concentrações dos regentes utilizados é importante nesta avaliação do experimento, conforme apresentado na tabela 10 e já comentado anteriormente através das referências consultadas na construção deste projeto.
Com base nestes resultados e validados através da análise estatística dos resultados pela análise de regressão múltipla com um R² de 0,993, com base nos resultados obtidos considera-se que o segundo objetivo específico foi atendido, pois possível identificar os parâmetros significativos no processo Fenton para a remoção de sulfetos, sendo neste caso a concentração de H2O2, a concentração do íon ferroso, o pH e o tempo de reação.
Fundamentado nas informações obtidas nas etapas anteriores e orientado pelos objetivos propostos foi realizada a etapa 3, onde o melhor resultado individual identificado são as amostras 5, 6 e 7, com resultados de redução de 41 a 45% dos valores iniciais de sulfetos. Estes suportados e validados através da análise estatística dos resultados pela análise de regressão múltipla com um R² de 0,971, permite afirmar que atendeu-se o terceiro objetivo específico proposto de avaliar as condições mais adequadas de operação do processo visando aplicação 50 em escala industrial, pois foi possível identificar que com uma utilização significativamente menor de reagentes, na relação aproximada de [9:1] de H2O2 :Fe2+ realizada, foi possível obter resultados expressivos no percentual de redução dos teores de sulfetos na amostra testada. A etapa 3, mesmo com as reduções de reagentes citadas obteve um rendimento de 69% se comparada a etapa 1 e de 73% se comparada com a etapa 2. O pH permanece como um fator de extrema importância no meio reacional, mantendo-se a condição ideal na faixa de 3,5 a 4,5 conforme já citado no decorrer deste trabalho.
Importante destacar que as conclusões aqui apresentadas fazem referência amostra em teste e a matriz estudada. Os resultados obtidos nos permitem entender que é viável a aplicação do reagente Fenton no tratamento dos efluentes para redução dos compostos de enxofre e consequente eliminação do odor gerado, mas é importante uso dos conhecimentos aqui apresentados a fim de caracterizar adequadamente as relações entre as variáveis relevantes desenvolvidas neste projeto e cabe destacar ainda que essas não são absolutas e também não são inalteráveis. É importante conhecer as variações que podem ocorrer em cada efluente a ser tratado, tal como se usa hoje o tratamento por polímeros, a fim de adequar continuamente as relações entre as principais variáveis de redução dos compostos oxidativos como forma de obter a melhor resolução o melhor tratamento do efluente desejado.
A continuidade dos estudos na adequação das concentrações dos reagentes utilizados frente uma condição adequada de redução de compostos alvos deve ser permanente elemento de pesquisa, pois através deste projeto foi possível identificar condições satisfatórias com níveis reduzidos de reagentes, além de que, como o oxidante não é seletivo para a reação com os sulfetos dissolvidos, em geral, a aplicação do H2O2 controlado pode aumentar a eficiência, sendo relevante que futuros projetos devem considerar é o tempo de reação dos experimentos, pois há possibilidade de consideração da relevância deste como uma variável tão importante quanto a concentração dos reagentes propriamente ditos.
Outra variável importante a ser estudada em projetos baseados nesse estudo, é a possibilidade de toxicidade decorrente do uso do peróxido de hidrogênio ou mesmo do íon ferroso, os quais em altas concentrações podem permanecer com residual ativo significativo, impactando nas condições de sobrevivência de organismos vivos no meio ou do efluente após o tratamento realizado.
Recuperação de enxofre elementar em reatores microaerados
1, 2Aluno do Curso de Engenharia Química, Universidade São Francisco; Campus Campinas.
3Professor Orientador, Curso de Engenharia Química, Universidade São Francisco; Campus Campinas.
