Feline sporotrichosis – case report
REGISTRO DOI: 10.69849/revistaft/th10249041511
Williane Caroline da Rocha Cruz1
Erika Souza Vieira2*
Emerson Israel Mendes3
Antônio Matos Fraga Júnior4
Anne Caroline Leite Andrade Santos de Oliveira5
Caio Guilherme Menezes Barreto6
Edney Leite de Mendonça7
Higor Matheus Dantas Costa8
Jessica Torres Matos9
Resumo: A esporotricose felina é uma doença causada pelo fungo Sporothrix spp., caracterizado como saprófito e aeróbio. É uma doença que possui distribuição mundial, sendo mais prevalente em regiões de clima tropical, subtropical e temperado, sendo rara na Europa, porém frequente nas Américas, África, Japão e Austrália. O gato doméstico, principalmente o macho, não castrado em idade reprodutiva e com livre acesso à rua, tem papel epidemiológico importante na esporotricose, a transmissão acontece por intermédio da arranhadura e/ou mordedura, a sintomatologias mais frequentes cursam com lesões cutâneas fixas, linfocutânea, cutânea disseminada, extra cutânea e sistêmica, assim se assemelhando a outras doenças, dessa forma se faz necessário fazer o diagnóstico precoce para iniciar o tratamento logo no início. O presente artigo, tem como objetivo relatar um caso de esporotricose felina, de um felino macho, castrado, sem histórico clínico, por ser um animal de resgate atendido em uma clínica veterinária em Aracaju, Sergipe, avaliando seu histórico clínico até o desfecho do diagnóstico e tratamento medicamentoso. O tutor relatou que o paciente apresentava uma lesão cutânea em região caudal próxima ao ânus, com sensibilidade e rubor. Inicialmente o animal foi submetido a tratamento do ferimento, sem melhoras clínicas foram realizados cultura microbiana, antibiograma e uma citologia da lesão imprinting e através da biopsia foi confirmada a esporotricose. O protocolo terapêutico desse animal foi extenso pois houve mudanças de medicamentos até o diagnóstico conclusivo, optando-se por uso de itraconazol (podendo ser usado de forma isolada ou em associação a outros fármacos) e a lesão apresentou completa cicatrização.
Palavras-chave: Esporotricose, Itraconazol, Sporothrix spp., Zoonose
Abstract: Feline sporotrichosis is a disease caused by the fungus Sporothrix spp., characterized as saprophytic and aerobic. It is a disease that has a worldwide distribution, being more prevalent in regions with tropical, subtropical and temperate climates, being rare in Europe, but frequent in the Americas, Africa, Japan and Australia. Domestic cats, especially males, not neutered in reproductive age and with free access to the street, play an important epidemiological role in sporotrichosis. Transmission occurs through scratches and/or bites. The most frequent symptoms are fixed cutaneous, lymphocutaneous, disseminated cutaneous, extracutaneous and systemic lesions, thus resembling other diseases. Therefore, it is necessary to make an early diagnosis to start treatment early. This article aims to report a case of feline sporotrichosis in a neutered male feline with no clinical history, as he was a rescue animal treated at a veterinary clinic in Aracaju, Sergipe, evaluating his clinical history until the outcome of the diagnosis and drug treatment. The owner reported that the patient had a skin lesion in the caudal region near the anus, with sensitivity and redness. Initially, the animal underwent treatment of the wound, but without clinical improvement, microbial culture, antibiogram and a cytology of the imprinting lesion were performed and through biopsy, sporotrichosis was confirmed. The therapeutic protocol for this animal was extensive because there were changes in medications until the conclusive diagnosis, opting for the use of itraconazole (which can be used alone or in combination with other drugs) and the lesion presented complete healing.
Keywords: Sporotrichosis, Litraconazole, Sporothrix spp., Zoonosis
Introdução
A esporotricose é causada pelo fungo Sporothrix spp., caracterizado como saprófito e aeróbio, o gênero Sporothrix pertence à família Ophiostomataceae, ordem Ophiostomatales, subclasse Euascomycetes e divisão Ascomycota (Oliveira et al., 2011).
A transmissão pode ocorrer também por meio da via respiratória (Schubach et al., 2012; Santos et al., 2018). Os felinos podem se tornar portadores assintomáticos através do hábito de encobrir seus dejetos com terra e ao afiar suas unhas em troncos de árvores, com isso o microrganismo é transferido da natureza para a região ungueal dos animais (Souza et al., 2009).
As formas clínicas mais frequentes são lesões cutâneas múltiplas e nas mucosas conjuntival, nasal, bucal ou genital (Schubach et al., 2012). As partes mais acometidas do corpo são a cabeça, principalmente nariz e orelhas, região cefálica, cauda e membros posteriores (Larsson, 2011; Schubach et al., 2012; Bazzi et al., 2016).
O diagnóstico presuntivo da esporotricose pode ser obtido por anamnese, epidemiologia, manifestações clínicas e exames complementares. Para o diagnóstico definitivo, é necessária a cultura micológica de exsudatos, tecidos ou aspirados de lesões e isolamento do agente (Jericó et al., 2015).
A terapia adequada para o tratamento da esporotricose vai depender do tipo e extensão da lesão, estado imunológico do hospedeiro e o tipo de agente etiológico envolvido (Rodrigues et al., 2020).
O presente artigo, tem como objetivo relatar um caso de esporotricose felina, atendido em consultório veterinário na clínica veterinária Pet&Zoo, em Aracaju, Sergipe, avaliando seu histórico clínico até o desfecho do diagnóstico e tratamento medicamentoso.
Relato de caso
Foi atendido na clínica veterinária Pet&Zoo, em Aracaju, Sergipe, no dia 20 de julho de 2022 um felino castrado, pelo curto brasileiro (PCB), com 1 ano e 2 meses de idade, pesando 4kg, sem histórico detalhado por ser um animal de resgate, a responsável relatou que o animal apresentava uma lesão cutânea em região caudal próxima ao ânus, com sensibilidade e rubor, como pode ser observada na Figura 1.
Figura 1: Lesão em região caudal no dia 20/07/2022.
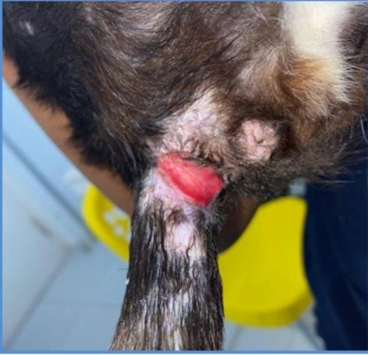
Fonte: Imagens cedidas pela Dra Maysa Medeiros, 2022.
A princípio, conduziu-se à anamnese do paciente e, procedeu-se ao exame clínico geral e específico do animal. Foi realizada a avaliação dos parâmetros fisiológicos, como a frequência cardíaca (FC) a qual pode ser determinada usando um estetoscópio e os resultados expressos em batimentos por minuto (bpm); a frequência respiratória (FR) pode ser estimada observando-se os movimentos torácicos do paciente ao longo de um minuto (mpm). A temperatura retal (TR) pode ser medida inserindo-se um termômetro clínico digital na ampola retal do paciente e mantendo-o em contato com a mucosa retal por um minuto e o resultado expresso em graus Celsius (ºC).
A temperatura retal (TR) foi de 39.8ºC, a frequência cardíaca (FC) de 150 batimentos por minutos (bpm) e a frequência respiratória (FR) foi de 24 movimentos por minutos (mpm), o tempo de preenchimento capilar foi maior que 2 segundos, sem alteração de linfonodos, escore de condição corporal (ECC) abaixo do ideal e o animal apresentava-se 10% desidratado. Os parâmetros fisiológicos de frequência cardíaca e respiratória se mostraram normais dentro do valor de referência para a espécie, com exceção apenas da TR e o TPC.
Após a anamnese, foi solicitada a realização do hemograma e, para isso, foram coletados 3mL de sangue por meio da punção da veia cefálica e imediatamente colocado em tubo de tampa roxa contendo ácido etilenodiamino tetra-acético (EDTA), sendo encaminhado para o laboratório interno da Pet&Zoo.
Na série vermelha foi avaliada contagem global de hemácias, hemoglobina, o hematócrito, volume globular (VG), concentração de hemoglobina globular média (CHGM), plaquetas, entre outros. Na série branca foram avaliados os leucócitos e suas características morfológicas: agranulócitos (monócitos e linfócitos) e granulócitos (neutrófilos, eosinófilos e basófilos), foi realizada ainda a pesquisa de hemoparasitas na amostra e teste de imunoensaio rápido para detecção de FIV/FELV (vírus da imunodeficiência felina e vírus da leucemia felina respectivamente).
O exame mostrou algumas alterações hematológicas, pois o leucograma indicou leucocitose com neutrofilia relativa e absoluta e linfopenia relativa, sendo negativo na pesquisa de hemoparasitas e não reagente para FIV/FELV.
O protocolo inicialmente instituído para esse paciente foi a realização de tricotomia e limpeza do local da lesão com cloreto de sódio 0,9% e clorexidina, seguida pela aplicação da pomada Ganadol®.
Os medicamentos administrados foram dipirona injetável 50% por via subcutânea (SC) para a hipertermia, meloxicam 0,2% por via subcutânea (SC) como anti-inflamatório e como antibiótico de primeira escolha foi a amoxicilina tri-hidratada por via oral (VO), além de realizar a correção da desidratação com fluidoterapia subcutânea.
Foi solicitado um novo hemograma no dia 26/08/22 para acompanhamento dos níveis hematológicos do animal, com destaque para o leucograma, onde permaneceu a leucocitose, neutrofilia relativa e absoluta, linfopenia 42 relativa e a presença de eosinopenia relativa.
No dia 31/08/22, esse exame foi repetido e persistia a leucocitose e a neutrofilia relativa e absoluta. Após 30 (trinta) dias de utilização do cloreto de sódio 0,9%, da clorexidina e da pomada Ganadol®, e não apresentando resultados satisfatórios, a equipe médica resolveu trocar o tratamento tópico e começou a tratar a lesão com curativo fechado e, para uso tópico o animal passou a utilizar a pomada homeopática CMR®, cuja composição consiste em: Bellis perennis, Calendula officinallis e Myristica sebifera. Entretanto, o animal não foi responsivo ao uso dessa pomada, e, por isso, houve novamente substituição da pomada, elegendo-se Alantol® (óxido de zinco). O paciente persistiu sem evolução clínica e então optou-se pelo uso do Furanil® (diglucanato de clorexidina), e, posteriormente Rifocina® spray (rifamicina SV sódica), e como uma última tentativa uma vez que o tratamento tópico não estava surtindo efeito de maneira isolada optou-se por associar o antifúngico itraconazol 100mg, a cada 24 horas (SID), via oral (VO) que foi utilizado por 40 dias.
Conforme o animal não estava apresentando melhora clínica apesar da troca constante do tratamento tópico, uso do itraconazol e da amoxicilina, de modo que no dia 04/11/22 realizou-se uma cultura microbiana e um antibiograma, onde na amostra coletada com um auxílio de um swab, constatouse após o cultivo, crescimento, isolamento a identificação do agente bacteriano de morfologia bastonete Gram negativo classificado como Proteus mirabillis. No antibiograma, o animal era intermediário para: amoxicilina + ácido clavulânico, ampicilina + sulbactram e amicacina, enquanto que o mesmo era sensível apenas a doxiciclina, levofloxacina e norfloxacina, e resistente a ampicilina, ceftriaxona, cefalexina, cefalotina, cefotaxima, ceftazidima, ofloxacina e gentamicina.
Em seguida, foi feita uma citologia da lesão imprinting que foi sugestiva para um processo inflamatório com presença de neutrófilos, porém sem a conclusão de que se tratava de uma infecção fúngica uma vez que não houve visualização do agente etiológico, após o resultado do antibiograma.
No dia 09/11/22 houve a escolha de um novo antibiótico ao qual o animal era sensível, doxiciclina, cujo nome comercial é a Vibramicina® na apresentação de 100 mg, sendo prescrito ¼ do comprimido, SID, VO, por 7 dias; enquanto que para uso tópico passou a ser utilizada a pomada oftálmica Regencell® (cloranfenicol, acetato de retinol, aminoácidos e metionina) e o curativo era realizado a cada 12 horas (BID) até completa cicatrização, e passou a ser tratada como ferida aberta, sendo possível observar a evolução da lesão a esse tratamento conforme é apresentado naFigura 2.
Figura 2: Lesão em região caudal (A: dia 17/12/2022 e B: dia 24/12/2022).
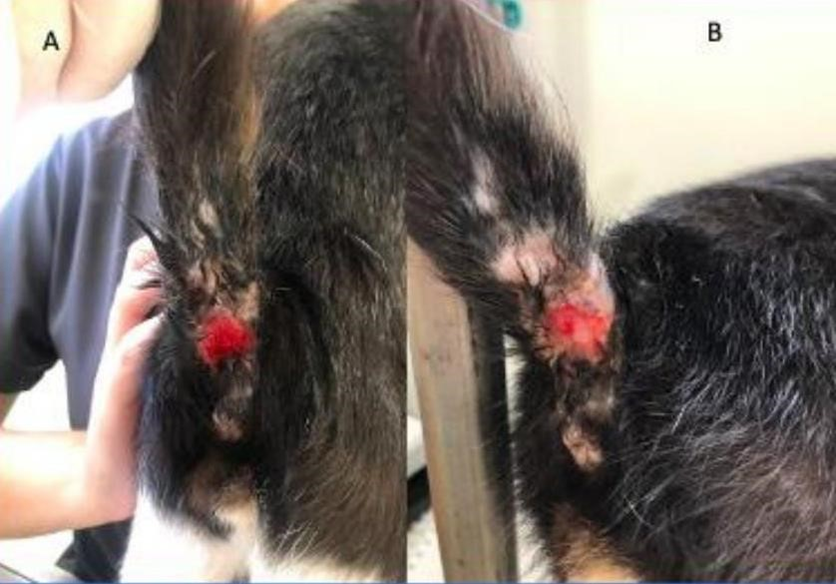
Fonte: Imagens cedidas pela Dra Maysa Medeiros, 2022.
Depois de inúmeras tentativas no protocolo terapêutico sem resposta após 6 meses do início do tratamento, onde o animal sempre apresentava recidivas, a equipe decidiu solicitar uma biópsia do ferimento na região da base da cauda para avaliação histopatológica no dia 03/01/23, e obteve como resultado macroscópico de fragmentos medindo 1,2 x 0,5 x 0,2 cm e 0,9 x 0,2 x 0,2 cm, irregulares, pardacentos, discretamente ulcerados e firme-elásticos. Na microscopia, os cortes histológicos foram corados pela hematoxilina-eosina (HE), onde foi possível fechar o diagnóstico para uma dermatite crônica piogranulomatosa sugestiva de infecção fúngica (esporotricose). O tratamento consistiu em fazer a higienização do local com clorexidina e cloreto de sódio 0,9%, associado ao itraconazol 100 mg, 1 comprimido a cada 24 horas durante 40 dias, podendo-se analisar a evolução da lesão a esse tratamento através da Figura 3.
Figura 3: Lesão em região caudal (A: dia 19/01/2023, B: dia 24/01/2023 e C: dia 28/01/2023).
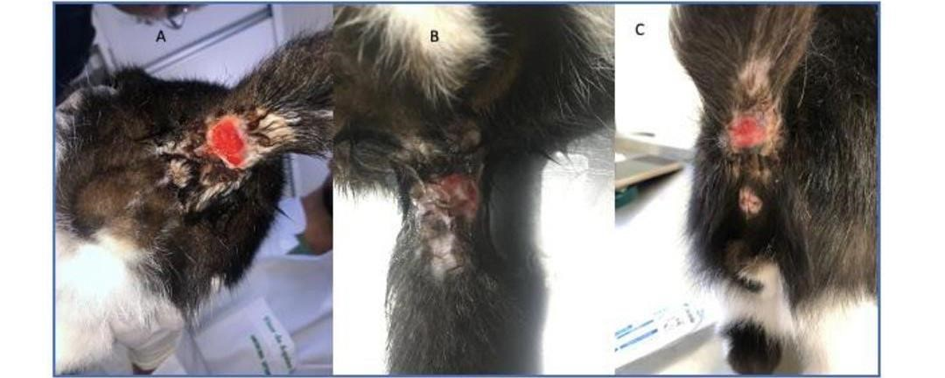
Fonte: Imagens cedidas pela Dra Maysa Medeiros, 2023.
Ademais, como o tratamento para essa lesão da base da cauda foi prolongado se faz necessário o acompanhamento através do hemograma, perfil renal e hepático para observar se houve influência significativa que alterasse o parâmetro fisiológico dos sistemas, seguindo essa linha de raciocínio no dia 14/01/23 foi solicitado novamente o hemograma que não apresentou nenhuma alteração, assim como na função hepática não houve alteração em alanina aminotransferase (ALT), fosfatase alcalina (FA); enquanto que em transaminase glutâmico oxalacética (AST) e a gama glutamil transferase (GGT) houve um aumento, bilirrubina total e frações sem alteração em seus níveis.
Em relação a função renal, os níveis de uréia e fósforo apresentaram-se elevados, enquanto os valores para creatinina, cálcio e ácido úrico estavam de acordo com os parâmetros esperados.
O animal foi submetido a uma consulta dermatológica no dia 21/02/23, pois o tratamento anterior instituído estava se mostrando ineficiente, com presença de recidivas, então após a confirmação da esporotricose através da biópsia, a veterinária achou necessário alterar alguns pontos do tratamento anterior.
Para o novo tratamento foi prescrito para o animal Predsim® 5mg/kg, antiinflamatório esteroidal (AIES), cujo princípio ativo é a prednisolona, na dose de 2 mL a cada 12 horas, ou seja, duas vezes ao dia (BID) durante 5 dias, para o desmame foi utilizada a mesma dose só que a cada 24 horas (SID), uma vez ao dia, por 5 dias, e 1mL (SID) por 10 dias.
Para a higienização do local foram eleitos clorexidina, cloreto de sódio 0,9% e Vetaglós® (gentamicina + sulfanilamida + sulfadiazina + ureia + palmitato de vitamina A) a cada 12 horas durante 30 dias. Como antibiótico de escolha foi selecionado o Cefa SID® 110mg (cefadroxila) a cada 24 horas (SID) durante 20 dias, associado a itraconazol 100 mg, 1 comprimido a cada 24 horas durante 40 dias e REFOS derme® (extrato de Euglena gracilis) suplemento alimentar 1 comprimido a cada 24 horas durante 30 dias.
No dia 28/02/23 após o início do tratamento pela dermatologista foi solicitado novamente uma citologia por imprinting onde havia a presença de infiltrado inflamatório neutrofílico infeccioso.
O paciente apresentou melhora clínica após a instituição do novo tratamento, conforme pode ser observado na Figura 4.
Figura 4: Lesão em região caudal – A: antes do tratamento indicado pela dermatologista no dia 21/02/23; após o início do tratamento indicado pela dermatologista: B: em 08/03/23; C: em 15/03/23; D: em 31/03/23; E: em 04/04/23; F: em 12/04/23; G: em 25/04/23; H: em 03/05/23; I: em 09/05/23
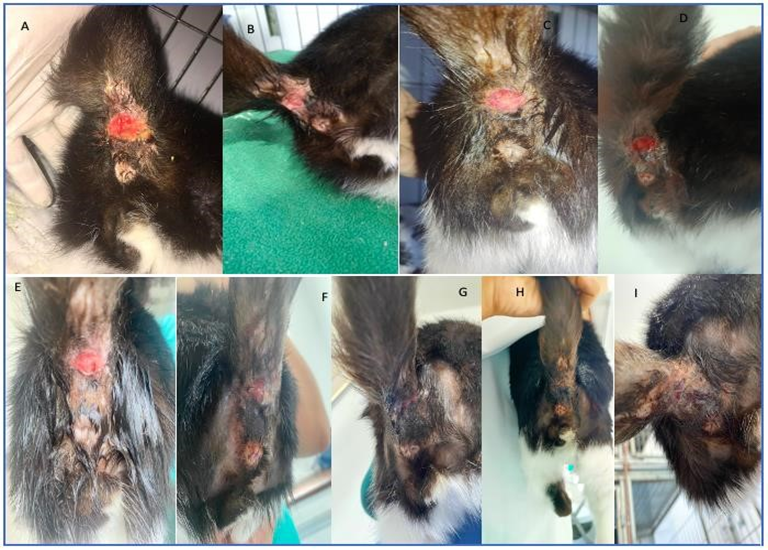
Fonte: Imagens cedidas pela Drª Maysa Medeiros, 2023
Após a instituição do tratamento foi possível observar a completa cicatrização da região como pode-se observar na Figura 5.
Figura 5: Lesão em região caudal completamente cicatrizada 01/06/2023.
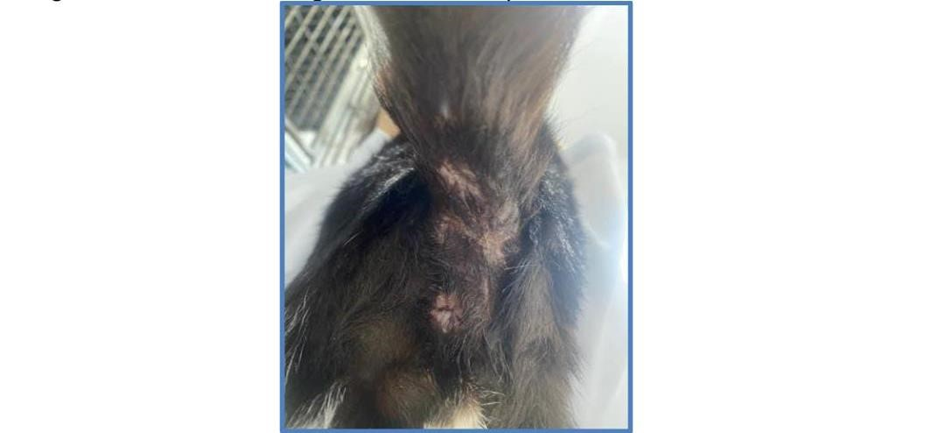
Fonte: Arquivo pessoal, 2024
Resultados e discussões
No exame físico foi possível analisar que o animal tinha tempo de preenchimento capilar maior que dois segundos, mucosas hipocoradas, temperatura retal elevada, enquanto os linfonodos não apresentaram alterações, frequência cardíaca e respiratória normais para a espécie, entretanto, o escore corporal estava abaixo do ideal.
De acordo com o que foi defendido por Feitosa (2020), a perfusão é uma função vital do sistema circulatório, responsável por fornecer nutrientes e oxigênio para os tecidos, avaliação clínica indireta da perfusão sanguínea pode ser realizada através da observação da coloração das mucosas e do tempo de preenchimento capilar, em um animal saudável as mucosas devem apresentar coloração róseo-clara e o tempo de preenchimento capilar deve ser de aproximadamente 2 segundos.
A frequência cardíaca em cães poderá apresentar valores entre 60 e 180 bpm (de acordo com raça, idade, conformação física e estado geral do paciente) e em felinos entre 140 e 240 bpm, a frequência respiratória (FR) normal em cães e gatos é de 20 a 30 movimentos por minuto (mpm), a temperatura retal normal em cães e felinos fica em média entre 37,5 ºC a 39,2 ºC. O escore de condição corporal (ECC) é uma ferramenta amplamente utilizada para avaliar a saúde física de cães, baseando-se na observação visual e na palpação do animal, através do uso de escalas numéricas padronizadas. Essa avaliação tem como objetivo avaliar a quantidade de gordura corporal e a condição geral do animal, (Laflamme, 1997).
Tendo em vista os exames hematológicos, houve uma variação dos valores alguns inferiores aos considerados dentre as normalidades de referências das espécies, enquanto outros estão dentro da faixa de limite, também não foram encontradas nas amostras a presença de hemoparasitas. Na esporotricose as alterações hematológicas são inespecíficas, normalmente as alterações podem acontecer devido a um processo patológico concomitante, em um estudo realizado por (Madrid et al., 2010) as principais alterações observadas foram leucocitose por neutrofilia que ocorre devido ao processo infeccioso e inflamatório exsudativo, anemia e trombocitopenia.
As alterações no hemograma e leucograma são semelhantes às observadas em várias doenças infecciosas, que frequentemente provocam uma resposta inflamatória da medula óssea, refletida por um aumento de leucócitos, podendo estar associado ou não a um quadro anêmico (Schubach et al., 2004).
A citologia por imprinting é empregada no diagnóstico de esporotricose, entretanto a sensibilidade dessa técnica é menor (52%) quando comparada a cultura micológica que é o padrão-ouro para o diagnóstico, podendo alguns fatores interferirem no resultado fidedigno da citologia, tais como: material em excesso (espesso), escasso ou ainda pobremente corado ou até mesmo a baixa carga fúngica. Ainda não há avaliações de sua sensibilidade em biópsias de gatos, podendo haver interferências como a ausência de fungos na amostra pode ser justificada pela biópsia em estágios iniciais da infecção ou a variação individual e da intensidade da resposta imune (Pereira et al., 2011; Miranda et al., 2013).
É comum observar o envolvimento sistêmico em gatos com achados histopatológicos que indicam a presença de infiltrado inflamatório de células mononucleares e estruturas fúngicas moderadas a leves em tecidos como pulmões, fígado, baço, olhos, adrenais e linfonodos (Schubach et al., 2012).
O protocolo terapêutico foi um pouco extenso para esse animal, por isso a importância de se fazer uma monitoração através de exames hematológicos e bioquímicos, assim em 14/01/23 fez um check-up do paciente, onde foi possível observar alterações em algumas enzimas hepáticas e renais.
De acordo com Thrall e colaboradores (2015), a enzima GGT pode apresentar elevação em casos de lesão hepática aguda e está presente nos mais diversos tecidos do corpo, incluindo o pâncreas, rins e glândula mamária de certos animais, como cadelas, ovelhas e vacas. Entretanto, as enzimas encontradas no plasma sanguíneo têm predominantemente origem hepática e são mais concentradas nos túbulos biliares.
Assim como a creatinina, a uréia é amplamente utilizada como biomarcador renal na prática clínica e, no entanto, só é capaz de avaliar as lesões renais em estágios tardios (Nascimento et al., 2017). Esse marcador não é específico e pode sofrer variações em seus valores em decorrência de fatores extra renais (Dalton, 2011), podendo aumentar em casos de desidratação, onde ocorre maior reabsorção da ureia, e em animais com hemorragia gastrointestinal, onde a fração proteica da hemácia é convertida em amônia pelas bactérias locais, sendo reabsorvida pelo fígado e transformada em ureia.
O fósforo é um composto que é absorvido pelo trato digestivo e principalmente excretado pelos rins. A presença de hiperfosfatemia é frequentemente observada em casos de Insuficiência Renal Crônica (IRC).
Em estágios iniciais dessa condição, os níveis séricos de fosfato são geralmente normais, medicações (aminoglicosídeos, antiinflamatórios não esteróides, agentes antineoplásicos) ou intoxicações podem causar lesão renal aguda (LRA), a recuperação renal incompleta após a LRA pode levar a doença renal crônica (DRC), ou seja, a hiperfosfatemia é conhecida por estar associada à progressão da DRC (Reynolds e Lefebvre, 2013).
No relato de caso apresentado, o tratamento convencional utilizando o fármaco de primeira escolha, itraconazol, apresentou aplicabilidade principalmente após a confirmação do agente etiológico através da biópsia, o que foi fundamental para a evolução clínica do paciente.
Houve um bem estar do paciente, observado após a consulta dermatológica e instituição do tratamento adequado para a esporotricose.
Tendo em vista os pontos abordados, torna-se evidente, portanto, que a utilização do protocolo terapêutico convencional através do uso do antifúngico de eleição, associado a antibióticos, imunomodulação atuando na barreira cutânea e o anti-inflamatório esteroidal, foi capaz de proporcionar ao animal uma melhor qualidade de vida, além de ser economicamente acessível e de fácil aplicação.
Conclusão
Tendo em consideração os pontos abordados, torna-se evidente que a utilização de antifúngicos como fármacos de primeira escolha no tratamento da esporotricose os resultados obtidos é bastante satisfatório, na qual foi possível observar a recuperação tecidual, ao fazer a associação de antifúngicos, antiinflamatórios esteroidais, imunomodulador cutâneo e antibióticos; uma vez que esse tratamento é aplicável e de baixo custo, porém necessita de comprometimento por parte do responsável pelo animal, tendo em vista que o tratamento leva um tempo para visualizar os resultados e evolução da lesão no animal.
O tratamento com itraconazol quando feito de maneira correta é bastante eficaz, porém é um tratamento prolongado e que exige a persistência do tutor, sendo capaz de proporcionar uma melhor qualidade de vida para o animal.
Referências Bibliográficas
1. Artigos de revista
Bazzi, T., Melo, S. M. P. D., Fighera, R. A., & Kommers, G. D. (2016). Características clínicoepidemiológicas, histomorfológicas e histoquímicas da esporotricose felina. Pesquisa Veterinária Brasileira, 36, 303-311.
Dalton, R. N. (2011).Creatinina sérica e taxa de filtração glomerular: percepção e realidade. Jornal Brasileiro de Patologia e Medicina Laboratorial, 47(1), 8–11.
Laflamme, D. (1997) Development and validation of a body condition score system for dogs. Canine Practice, v.22, p.10-15.
Larsson, C. E. (2011). Esporotricose. Brazilian Journal of Veterinary Research and Animal Science, 48(3), 250-259.
Madrid, I.M., Mattei, A., Martins, A., Nobre, M., Meireles, M. (2010)Feline sporotrichosis in the southern region of rio grande do sul, Brazil: clinical, zoonotic and therapeutic aspects. Zoonoses Public Health. 57(2):151-4.
Miranda L.H.M., Conceição-Silva F., Quintella L.P., Kuraiem B.P., Pereira S.A., Schubach T.M.P. (2013). Feline sporotrichosis: histopathological profile of cutaneous lesions and their correlation with clinical presentation. Microbiol. Infect. Dis. 36, 425-432.
Nascimento, M. R., Lima, C. S., Barros, J. C., Padovan, M., Cintra, C. A., Ayer, I. M., Borges, L. P. B., Pereira, A. G., & Crivellenti, L. Z. (2017). Conceitos e aplicabilidade dos principais biomarcadores na nefrologia veterinária – revisão de literatura. Investigação, 16(8), 37–43.
Oliveira MM, Almeida-Paes R, Muniz MM, Gutierrez-Galhardo MC, ZancopeOliveira RM. (2011) Phenotypic and molecular identification of Sporothrix isolates from an epidemic area of sporotrichosis in Brazil. Mycopathologia. 172(4):257-67.
Pereira, S.A., Menezes, R.C., Gremião, I. D. F., Silva, J.N., Honse C. de O., Figueiredo, F.B., Silva, D.T., Kitada, A. A. B., Reis, E. G., Schubach, T. M. P. (2011) Sensitivity of cytopathological examination in the diagnosis of feline sporotrichosis. J Feline Med Surg. apr;13(4):220-3.
Reynolds, A. S.; Lefebvre, H P. (2013) DRC felina: Fisiopatologia e fatores de risco – o que sabemos?. Revista de medicina e cirurgia felina, v. 15 p. 3-14.
Rodrigues, A. M. et al. (2020). The threat of emerging and re-emerging pathogenic Sporothrix species. Mycopathologia, v. 185, n. 5, p. 813-842. Disponível em:<https://www.arca.fiocruz.br/handle/icict/44478> . Acesso em: 14 abr. 2023.
Schubach TM, Schubach A, Okamoto T, Barros MB, Figueiredo FB, Cuzzi T, et al. (2004) Evaluation of an epidemic of sporotrichosis in cats: 347 cases (1998-2001). Journal of the American Veterinary Medical Association. 224(10):1623-9.
Santos, A. F. et. al. (2018). Guia prático para enfrentamento da esporotricose felina em Minas Gerais. Revista V&Z Em Minas, Ano XXXVIII, Número 137, Abr/Mai/Jun.
Souza, N. T., Nascimento, A. C. B. M., Souza, J. O. T., Santos, F. C. G. C. A., & Castro, R. B. (2009). Esporotricose canina: relato de caso. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 61, 572-576.
2. Livros
Feitosa, F.L.F. (2020). Semiologia veterinária: a arte do diagnóstico. 4 ed. Rio de Janeiro: Roca, p.12084.
Jericó, M. M., Andrade N., João Pedro de; Kogika, M. M. (2015) Tratado de medicina interna de cães e gatos. Rio de Janeiro.
Schubach, T.M.P., Menezes, R.C., Wanke, B. (2012) Sporotrichosis. In: Greene CE, editor. Infectious Diseases of the Dog and Cat. 4 ed. Philadelphia: Saunders Elsevier; p. 645-650.
Thrall, M. A.; Baker, D. C.; Campbell, T. W. et al. (2014). Hematologia e bioquímica clínica veterinária. 2 ed., São Paulo: Roca Ltda, p.1-1590.
1 Médica Veterinária da Soul Pet & Vet, Aracaju-SE. Brasil, rochawilliane@gmail.com
2 Docente Curso de Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE. Brasil, erika.souza@piodecimo.edu.br 3 Médico Veterinário Docente Curso de Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE. Brasil, emerson@piodecimo.edu.br
3 Médico Veterinário Docente Curso de Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE. Brasil, antonio.matos@piodecimo.edu.br
4 Médica Veterinária da Animal PatLab, Aracaju – SE, Brasil, carolineandradefreitas@gmail.com
5 Graduando Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE, Brasil, caio_guilherme25@live.com
6 Graduando Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE, Brasil, 201920033@estudenapiodecimo.com.br
7 Graduando Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE, Brasil, 201920426@estudenapiodecimo.com.br
8 Graduando Medicina Veterinária da Faculdade Pio Décimo, Aracaju-SE, Brasil, 201920462@estudenapiodecimo.com.br
*Autor para correspondência: E-mail: erika.souza@piodecimo.edu.br
