REGISTRO DOI: 10.5281/zenodo.11080932
Denny Fabricio Magalhães Veloso
Denise Sena Veloso
André Felipe Zuccolo Barragat de Andrade
RESUMO
A resposta das glândulas adrenais frente ao hipoandrogenismo ainda requer maiores estudos. O objetivo desse trabalho foi estudar alterações morfológicos da glândula adrenal em animais com hipogonadismo secundário a orquiepididimectomia total bilateral. Foram utilizados vinte ratos machos da linhagem Wistar, acompanhados diariamente que foram aleatoriamente distribuídos, de acordo com o procedimento operatório realizado, com dez animais em cada grupo: Grupo 1: controle, submetidos a operação simulada sem castração. Grupo 2: submetidos a orquiepididimectomia total bilateral. Os animais foram acompanhados durante oito meses após as operações. Então, foram anestesiados, pesados e depois mortos para medir os níveis séricos de testosterona livre e avaliar as morfologias microscópicas das glândulas adrenais. No Grupo 2 houve menor ganho ponderal e os níveis séricos de testosterona foram menores. A castração cirúrgica não modificou a espessura do córtex das glândulas adrenais entre os grupos. O teste de Pearson entre as variáveis estudadas detectou uma única correlação entre os níveis séricos de testosterona e a espessura cortical das glândulas adrenais, no Grupo 2 (p = 0,0073, IC – 0,9464 a – 0,3043). A análise de regressão linear identificou linha de tendência desta correlação com função inversamente proporcional entre os níveis séricos de testosterona e a espessura cortical das glândulas adrenais. As glândulas adrenais de ratos reagem com aumento da sua espessura cortical após a castração cirúrgica de maneira inversamente proporcional aos níveis séricos de testosterona.
Palavras chaves: Orquiectomia, espessura da adrenal, hipoandrogenismo
INTRODUÇÃO
A esteroidogênese se inicia na puberdade e é controlada por hormônios produzidos no hipotálamo e glândula hipófise. As células de Leydig, localizadas no interstício peritubular dos testículos, secretam mais de 95% da testosterona circulante no organismo sendo grande responsável pela formação e manutenção dos caracteres sexuais secundários. O restante deste hormônio é produzido pelas zonas fasciculada e reticulada das glândulas supra-renais.103(Smith 2002)
A castração cirúrgica é um dos tratamentos de escolha em homens com câncer de próstata avançado para os quais a subsequente redução dos níveis séricos de testosterona reduz a progressão da neoplasia. A resposta das glândulas adrenais frente ao hipoandrogenismo ainda requer maiores estudos. O objetivo desse trabalho foi estudar alterações morfológicos da glândula adrenal em animais com hipogonadismo secundário a orquiepididimectomia total bilateral.
MÉTODO
Este trabalho foi realizado de acordo com as recomendações das Normas Internacionais de Proteção aos Animais e aprovado pelo Comitê de Ética em Experimentação Animal (CETEA).91 (Rollin)
Foram utilizados vinte ratos (Rattus norvegicus albinus) machos da linhagem Wistar, com idade de três meses. Os animais foram alocados em gaiolas apropriadas com até quatro ratos por gaiola e mantidos em condições de temperatura e ambiente com luminosidade natural, obedecendo ao ciclo circadiano murino, com 12 horas de luz e 12 horas de escuridão.88 (Rocha) Eles foram acompanhados diariamente e receberam água e ração à vontade e foram aleatoriamente distribuídos, de acordo com o procedimento operatório realizado, com dez animais em cada grupo:
Grupo 1: controle, submetidos a operação simulada sem castração.
Grupo 2: submetidos a orquiepididimectomia total bilateral.
Todos os ratos foram anestesiados com associação de cloridrato de quetamina (Ketalar®, Pfizer, São Paulo), na dose de 50 mg/kg de peso corporal, e cloridrato de xilazina (Rompum®, Bayer, São Paulo), na dose de 5 mg/kg de peso corporal, por via intramuscular na região glútea direita. Durante todo o período de anestesia, foram observadas as frequências cardíaca e respiratória, além da movimentação voluntária dos ratos, com vista a detectar o nível da anestesia e possíveis complicações anestésicas.
As operações foram realizadas por incisão mediana anterior escrotal, abertura da túnica vaginal e exteriorização dos testículos. Em seguida, o procedimento dependeu do grupo ao qual o animal pertenceria. No Grupo 1, a pele do escroto era suturada com fio de categute cromado 3-0 (Catgut chromic Polysuture®). No Grupo 2, os funículos espermáticos foram ligados com fio de seda 3-0 (Ethicon – Johnson & Johnson) e seccionados. Os testículos e os epidídimos foram removidos e o escroto foi suturado com fio de categute cromado 3-0 (Catgut chromic Polysuture®).
Morfologia da glândula adrenal
Os animais foram acompanhados durante oito meses após as operações. Então, foram anestesiados, pesados e depois mortos para medir os níveis séricos de testosterona livre e avaliar as morfologias microscópicas das glândulas adrenais.
Para a avaliação ponderal dos animais, foi utilizada uma balança eletrônica de precisão (Marte®, modelo AS500), cuja carga máxima era de 500 g e sensibilidade de 0,01 g.
No período da manhã, realizou-se laparotomia mediana, por planos e foram colhidos 5 ml de sangue da veia cava caudal para dosar os níveis de testosterona. Em seguida, as glândulas adrenais foram retiradas com muito cuidado para evitar traumatizá-las. Os animais foram mortos com aprofundamento da anestesia.
A testosterona livre foi processada por ensaio competitivo pela técnica de imunofluorescência, com anticorpos policlonais de coelhos. Esse hormônio, atuando como antígeno, reage de forma competitiva com antígenos semelhantes dos kits reagentes marcados com substância fluorescente. Houve, portanto, uma competição entre esse antígeno pela ligação com os anticorpos policlonais de coelhos, da classe IgG, difusos na fase sólida. Essa ligação foi diretamente proporcional à concentração inicial de cada antígeno. Na etapa seguinte, o excesso de sobrenadante foi removido, permanecendo apenas os anticorpos ligados à fase sólida. Posteriormente, um segundo anticorpo de coelho da classe IgG, contra o anticorpo da fase sólida, foi acrescentado à reação e, ao ligar-se, liberou o antígeno marcado. No processo final, mediu-se a fluorescência desses antígenos residuais marcados e liberados. A intensidade de fluorescência obtida foi inversamente proporcional à concentração dos hormônios em análise.
As glândulas retiradas foram cuidadosamente manipuladas e fixadas em solução de formaldeído a 4%. Numa segunda etapa, elas foram desidratadas com imersão em soluções de etanol em água (concentração crescente de 70% até 100%) seguida por banho em xilol. Depois, foram incluídas em blocos de parafina histológica (Histose®), previamente derretida em uma estufa à temperatura aproximada de 60ºC. O tecido incluído nesses blocos foi seccionado longitudinalmente ao longo do seu maior eixo, em cortes com 4 µm de espessura, utilizando micrótomo rotativo (LEICA®, modelo RM2125, Germany). Os cortes foram fixados sobre lâminas de vidro e corados com hematoxilina e eosina (HE), para avaliar as características gerais da glândula e estabelecer o limite entre as camadas cortical e medular. A espessura da camada cortical foi medida com o auxílio de uma lente com régua de 1 centímetro graduada em décimos de milímetros, acoplada na ocular esquerda de microscópio óptico (Nikon®) sob aumento de 40 vezes (Figura 1).
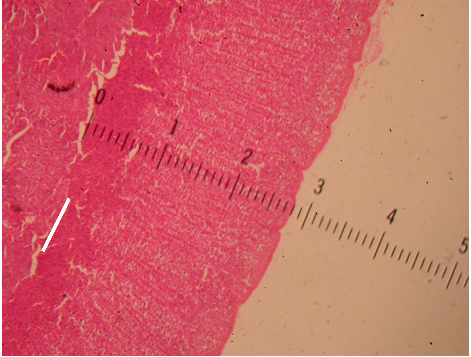
Figura 1 – Medida da espessura cortical da glândula adrenal, com régua graduada em milímetros.
– A linha branca delimita a transição entre a medula e o córtex.
– (Rato 3 do Grupo-controle, HE, 40X)
Sob visão a olho nu, a régua mede 10 mm. Ao ser acoplada sob a ocular, a imagem obtida da própria régua sofre um aumento de 10 vezes e passa a medir 100 mm transformando sua graduação de décimo de milímetros para milímetros. O tecido, por sua vez, está sob aumento de 40 vezes (10 X da ocular e 4 X da objetiva). Desse modo, a medida em milímetros encontrada sob microscopia deve ser dividida por 40 para se obter a medida real em milímetros. Por exemplo, uma medida de 28 mm ao microscópio corresponde a 0,70 mm. Esse aumento permite distinção satisfatória entre as camadas medular e cortical da glândula, bem como magnificação adequada da régua.
As adrenais foram codificadas e a análise microscópica foi realizada por examinador que não possuía informações sobre o grupo a que pertencia aquela glândula. Durante a microscopia, a adrenal foi dividida em quatro quadrantes e em cada um deles foi considerada a maior medida da camada cortical. Essas quatro medidas de cada glândula foram registradas e posteriormente agrupadas às medidas da adrenal contralateral para a análise estatística.
Estatística
As medidas coletadas foram submetidas ao teste Kolmogorov-Smirnov (KS), para determinar a distribuição gaussiana dos dados, e ao teste de Bartlett para encontrar as variâncias. Em seguida, foi realizada análise de variância (ANOVA). Nos resultados em que a diferença foi significativa, utilizou-se o pós-teste de comparação múltipla de Tukey, para definir quais grupos foram diferentes. Por último, foi aplicado o teste de correlação de Pearson entre as variáveis de testosterona e de espessura adrenal, seguido por teste de regressão linear na presença de correlação entre as variáveis. O nível de significância correspondeu a p < 0,05.
RESULTADOS
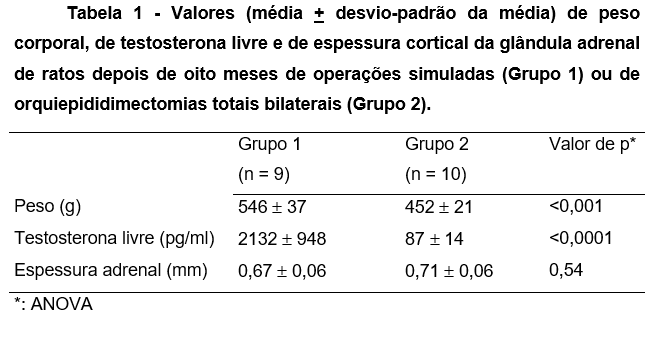
Um animal do Grupo 1 foi excluído da análise devido a falha no processamento da amostra sanguínea para dosagem da testosterona. No Grupo 2 houve menor ganho ponderal e os níveis séricos de testosterona foram menores. A castração cirúrgica não modificou a espessura do córtex das glândulas adrenais entre os grupos (Tabela 1).
O teste de Pearson entre as variáveis estudadas detectou uma única correlação entre os níveis séricos de testosterona e a espessura cortical das glândulas adrenais, no Grupo 2 (p = 0,0073, IC – 0,9464 a – 0,3043). A análise de regressão linear identificou linha de tendência desta correlação com função inversamente proporcional entre os níveis séricos de testosterona e a espessura cortical das glândulas adrenais (Figura 2).

Figura 2 – Curva de regressão linear obtida entre as variáveis testosterona livre (pg/ml) e espessura cortical das glândulas adrenais (mm) oito meses após a castração cirúrgica de ratos (p=0,0073).
DISCUSSÃO
Aproximadamente 98% da testosterona circulante está ligada a proteínas plasmáticas, quase 40% está ligada à SHBG (sex hormone binding globulin) e cerca de 60% está ligada a albumina, para tornar-se disponível quando necessária. A atividade biológica é realizada por 2% de testosterona livre, o que justificou sua aferição isoladamente. Nos testículos, a enzima 5-alfa redutase metaboliza a testosterona em diidrotestosterona, que é o andrógeno de maior atividade nos tecidos.15 (Basaria 2001)
Neste trabalho, os animais castrados ganharam menos peso que os do controle. As alterações de peso não são reflexo da deficiência de testosterona isoladamente, e deve estar ligado a outras desordens endócrinas e metabólicas decorrentes do hipogonadismo. Os resultados de Vanderschueren et al, com a castração em ratos, não indicaram alterações no peso corpóreo.114 (Vanderschueren 2000) Em humanos, Snyder et al também não encontraram alterações do peso de homens com deficiência androgênica do envelhecimento masculino submetidos a reposição hormonal.105 (Anyder 1999) Por outro lado, Smith et al verificaram aumento do peso corporal em pacientes com câncer de próstata e que foram castrados.103 (Smith 2002) Alterações nestes tecidos-alvo da testosterona ainda são conhecidos parcialmente, com achados divergentes na literatura.
O eixo hipotálamo-hipófise-adrenal está bem documentado na literatura quanto à regulação de hormônios tireoidianos. Por outro lado, em relação ao equilíbrio de hormônios sexuais, ainda são necessários estudos para indicar como a glândula adrenal reage frente ao hipogonadismo. A literatura indica alterações na morfologia da glândula adrenal com redução da testosterona livre e neste trabalho verificou-se que a glândula assume papel compensatório endócrino após orquiectomia, proporcional aos menores níveis séricos de testosterona livre.74 (Parker 1997) Embora não tenham realizado associações dos níveis séricos de testosterona com a espessura adrenal, os autores Cherry et al, em animais com hipogonadismo, e Parker et al, em indivíduos falecidos por trauma com hipogonadismo, também detectaram redução proporcional da zona reticular em relação às demais zonas corticais.23 (Cherry 2002), 74 (Parker 1997)
As indicações de orquiectomia são bem estabelecidas na literatura, entretanto é preciso reconhecer suas repercussões e complicações no organismo. Embora a resposta oncológica à castração não seja uniforme nos pacientes, a castração é um dos pilares no tratamento do adenocarcinoma prostático metastático.(Mohler) Nesse sentido, cabe ressaltar que a glândula adrenal responde ao hipogonadismo com hipertrofia cortical. Este conceito pode ser ainda mais relevante nos casos de pacientes em que há progressão oncológica mesmo após a orquiectomia bilateral.
CONCLUSÃO
As glândulas adrenais de ratos reagem com aumento da sua espessura cortical após a castração cirúrgica de maneira inversamente proporcional aos níveis séricos de testosterona.
REFERÊNCIAS
- Basaria S, Dobs AS. Hypogonadism and androgen replacement in elderly men. Am J Med 2001; 110: 563-72.
- Cherry BA, Cadigan B, Mansourian N, Nelson C, Bradley EL. Adrenal gland differences associated with puberty and reproductive inhibition in Peromyscus maniculatus. Gen Comp Endocrinol 2002; 104–13.
- Parker CR Jr, Mixon RL, Brissie RM, Grizzle WE. Aging alters zonation in the adrenal cortex of men. J Clin Endocrinol Metab 1997; 82: 3898-901.
- Rocha DC, Debeljuk L, Franca LR. Exposure to constant light during testis development increases daily sperm production in adult Wistar rats. Tissue Cell 1999; 31: 372-9.
- Rollin BE. The regulation of animal research and the emergence of animal ethics. Theor Med Bioeth 2006; 27: 285-304.
- Smith MR, Finkelstein JS, McGovern FJ, Zietman AL, Fallon MA, Schoenfeld DA, Kantoff PW. Change in body composition during androgen deprivation therapy for prostate cancer. J Clin Endocrinol Metab 2002, 87: 599-603.
- Snyder PJ, Peachey H, Hannoush P, Berlim JA, Loh L, Lenlow DA, Holmes JH, Dlewatti A, Santana J, Rosen CJ, Strom BL. Effect of testosterone treatment on body composition and muscle strength in men over 65 years of age. J Clin Endocrinol Metab 1999; 84: 2647-53.
- Vanderschueren D, Vandenput L, Boonen S, van Herck E, Swinnen JV, Bouillon R. An aged rat model of partial androgen deficiency. Endocrinology 2000; 141: 1642-7.
- Mohler JL. Concept and viability of androgen annihilation for advanced prostate cancer. Cancer 2014; 120 (17): 2628-2637.
