REGISTRO DOI: 10.5281/zenodo.8033789
Lívia Gonçalves de Oliveira1, Bianca Sampaio Tavares2, Eduarda Dias Bandeira de Melo3, Juliana Gil Dantas Marques da Rocha4, Giovana Leite Cavalcanti Olímpio5, Antônio Kayky Farias Leitão6, Ana Helena da Rocha7, Ana Clara Vieira de Souza8, Bruna Michelly de Barros Canuto Pinheiro9, Bruno Sousa de Freitas10, Camilla Fernandes Camana11, Cintia Mendes de Sousa Costa12, Cleane Nathália Maciel Xavier de Aguiar13, Fernanda Menezes Schneider14, Lidiane Ladeia Malheiros Souto15, Isabelly Maria Vasconcelos Lins16, Orientador: Marcos Brunno Aguiar Monteiro17
RESUMO
A investigação teve por base análise de artigos do Pubmed e Google Acadêmico. Alguns estudos expressaram que, além das características genéticas herdadas do pai e da mãe definirem as características fenotípicas do feto, fatores externos e hábitos de vida que acometem a mãe durante a gestação também podem provocar alterações na metilação do código genético e gerar consequências ao feto. A partir da investigação realizada, depreendeu-se que o estresse atua como modificador epigenético, bem como alterações epigenéticas durante o neurodesenvolvimento estão relacionadas à sensibilidade ao estresse. Estudos ainda apontam mudança na fisiologia endócrina do feto e associações entre o estresse materno, ansiedade ou depressão durante a gravidez e um consequente aumento do risco de a prole desenvolver depressão, ansiedade, déficits de atenção e comprometimento do desenvolvimento cognitivo. Ademais, hábitos paternos, como a ingestão de álcool, podem afetar o fenótipo da descendência através de mecanismos epigenéticos no esperma. Tal fato expressa que não só a utilização de álcool pela mãe durante a gravidez pode desencadear consequências para o feto. Este conhecimento poderá contribuir em nível aplicado para um melhor entendimento das alterações do eixo psico cognitivo do feto, seu desenvolvimento neurológico e físico causado por fatores como ansiedade, depressão, além da ingestão de álcool durante a gestação, os quais representam formas diversas de estresse.
Palavras-Chave: Epigenética; Estresse; Desenvolvimento Pessoal, crise alcóolica fetal; Consequências para o feto.
INTRODUÇÃO
A epigenética é definida como modificações do genoma que são herdadas pelas próximas gerações, mas que não alteram a sequência do DNA. Hoje os cientistas sabem que variações não-genéticas (ou epigenéticas) adquiridas durante a vida de um organismo podem frequentemente serem passadas aos seus descendentes (Fantappie, 2013). Atualmente, é largamente aceito que a epigenética pode ser modificada por exposições ambientais, particularmente durante o desenvolvimento, quando o epigenoma sofre profundas mudanças. (O’Keeffe, (2014). O estudo nas inúmeras bases de dados visa apontar que o estresse materno, através de mudanças epigenéticas, podem ocasionar consequências diversas a curto e longo prazo na saúde do feto. A partir da investigação realizada, depreendeu-se que o estresse atua como modificador epigenético, bem como alterações epigenéticas durante o neurodesenvolvimento estão relacionadas à sensibilidade ao estresse. Este conhecimento poderá contribuir em nível aplicado para um melhor entendimento das alterações do eixo psico cognitivo do feto, seu desenvolvimento neurológico e físico. O objetivo deste estudo foi apresentar e discutir achados da literatura referentes às consequências para o feto exposto durante a gestação ao estresse materno propriamente dito ou a hábitos que desencadearam este, a exemplo da ingesta de bebidas alcoólicas. Buscou-se explicar tais consequências através da perspectiva epigenética.
METODOLOGIA
Esse trabalho foi elaborado a partir de uma revisão sistemática nas bases de dados Medline/PubMed, artigos e materiais de pesquisa e dissertação encontrados no Google Acadêmico. Foram selecionados artigos publicados nos últimos 5 anos. Quanto ao idioma foram selecionados aqueles escritos em inglês e português. As palavras-chave usadas foram “epigenetic” (epigenética), “stress” (estresse); “gestation” (gestação), “consequences for the fetus” (consequências para o feto).
Foram usados como critérios de inclusão os artigos originais indexados no período entre primeiro de janeiro de 2013 e 31 de dezembro de 2017, com delineamento experimental ou observacionais (estudos de caso-controle, estudos de coorte e estudos antes e depois),realizados em humanos e também animais observando as consequências da exposição ao estresse durante a gestação, bem como ingesta de álcool, sendo esse considerado um tipo de estresse tanto físico, psicológico como celular; e antidepressivos. Foi usado, ainda, como critério de exclusão artigos de revisão literária.
Sobre a escolha dos artigos, antes de utilizar os critérios de inclusão e exclusão foram selecionados 5165 artigos no total, sendo 4650 do PubMED e 500 do google acadêmico. Após fazer uso dos critérios, reduziu-se para 11 no PubMED e 20 no google acadêmico. Destes, 20 foram lidos e analisados na íntegra e 6 foram selecionados, todos eles realizavam pesquisas do tipo coorte. Durante a leitura desses artigos, surgiu a necessidade de realizar uma nova revisão nas listas de referências desses artigos e mais 13 foram selecionados. O fluxograma abaixo explica todo esse processo.
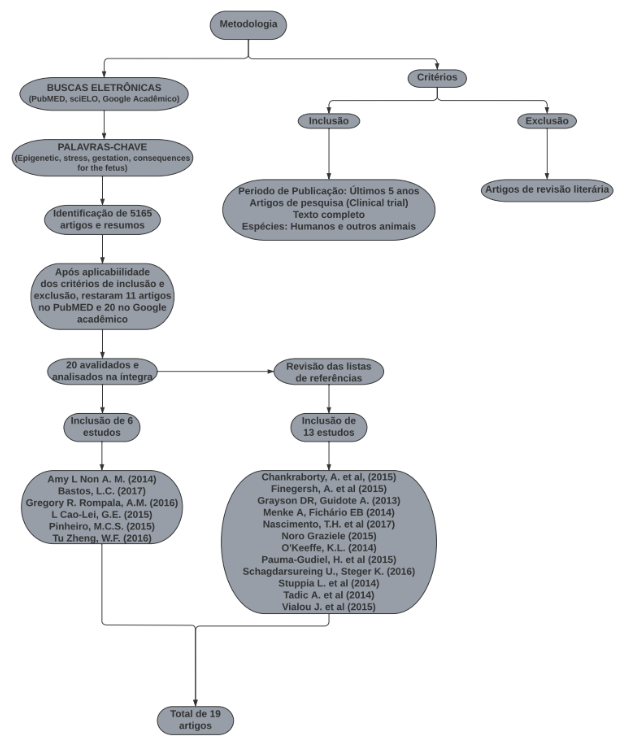
RESULTADOS E DISCUSSÃO
A exposição fetal aos sinais maternos de estresse exerce uma influência significativa sobre a trajetória do desenvolvimento fetal (Bastos L.C ,2017 apud Sandman et al, 2014). Tal fato demonstra que não somente as características do código genético (herdado do pai e da mãe através da fecundação dos gametas) definem as características fenotípicas do feto, mas também fatores externos que acometem a mãe durante a gestação, bem como aqueles que acometem o indivíduo ao longo de sua vida. Nesta revisão, pode-se observar como o estresse atua na modificação epigenética do feto enquanto em desenvolvimento.
As investigações epigenéticas estão no centro das pesquisas de estresse e, através de mecanismos epigenéticos, as influências ambientais podem aumentar ou diminuir a atividade dos genes sem alterar a sequência do DNA. Entre os processos epigenéticos mais importantes estão a metilação de segmentos de DNA e a modificação de histonas, que são as moléculas transportadoras do DNA. (Noro Grazielle.2015)
O marcador epigenético melhor estudado em mamíferos é a metilação das citosinas do ácido desoxirribonucleico (DNA) (Bastos.L.C, 2017 apud Bird, 2002). Modificações epigenéticas, em particular na metilação do DNA, e subsequente efeito nos genes alvo, alterando a expressão, são potenciais mecanismos ligados ao ambiente pré-natal adverso e um comportamento resultante (Bastos.L.C,2017 apud Bale et al,2009). Após a fertilização, ocorre a desmetilação de cerca de 80% do genoma (Bastos.L.C,2017 apud Goldberg et al., 2007), o epigenético e, consequentemente, o fenotípico, é induzido de novo em cada geração através de interações como o fenótipo materno e o ambiente durante a gravidez). Padrões epigenéticos somáticos precisam ser “reprogramados” em células germinativas e em embriões, e mecanismos epigenéticos são um meio pelo qual o ambiente pode influenciar ou “programar” a expressão gênica durante a gravidez (Bastos.L.C,2017 apud Burdge et al,2011).
A metilação do DNA é a adição covalente de um grupo metil (CH3) na posição 5 de uma citosina, quando esta procede uma guanina (G), formando um sítio CpG (citosina-fosfato-guanina). Há cerca de 28 milhões de sítios CpG no genoma humano. A região promotora de aproximadamente 60% dos genes humanos possui trechos com alto conteúdo CpG, denominados “ilhas CPG” (Bastos.L.C,2017 apud Ching et al., 2005); (Bastos.L.C,2017 apud Illingwonth and Bird, 2009). Dependendo da região cromossômica, tipo de célula, estágio de desenvolvimento e alelos de origem, um sítio CpG pode ser metilado, não metilado ou hemimetilado. A metilação do DNA seria como um “interruptor” que liga ou desliga o funcionamento de genes relevantes em resposta a alterações do ambiente interno e/ou externo, um mecanismo crucial para o desenvolvimento, diferenciação e homeostase do organismo (Noro Grazielle, 2015).
O padrão de metilação do DNA é altamente dinâmico em neurônios durante o desenvolvimento fetal e na idade adulta. Evidências mostram que alterações epigenéticas durante o neurodesenvolvimento estão relacionados à sensibilidade ao estresse (Bastos.L.C,2017 apud Feder et al., 2009); (Bastos.L.C,2017 apud Meaney and Szyf, 2005) e desempenham um papel crítico no condicionamento da memória e do medo (Bastos.L.C,2017). Diferentes estudos propõem que mecanismos epigenéticos, principalmente de metilação do DNA, fazem a mediação entre exposição a fatores de risco ambientais e desfechos psiquiátricos ao longo da vida (Bastos.L.C,2017 apud Steegers-Theunissen et al., 2009); (Bastos.L.C,2017 apud Zeisel, 2008). Isso implica em consequências permanentes para o feto, desde a infância até a vida adulta, gerada por alterações epigenéticas, oriundas da metilação do DNA.
Estudos também apontam uma mudança na fisiologia endócrina do feto, gerada graças à exposição materna ao estresse. Como mencionado anteriormente, a exposição ao estresse durante a vida intrauterina pode influenciar a fisiologia e comportamento do indivíduo devido à alta vulnerabilidade aos insultos. As evidências epidemiológicas mostraram que a exposição a fatores ambientais durante a vida fetal tem impacto no eixo hipotálamo-hipófise-adrenocortical (HPA) (Weinstock,2015) e na capacidade de resposta do sistema imunológico ao estresse, aumentando o risco de desenvolver doenças crônicas (Bastos.L.C,2017). Em vários estudos, a epigenética está associada a diferentes fatores ambientais, tais como: abuso de drogas/álcool (Chakraborty.A et al., 2015), contaminação tóxica, depressão materna, ansiedade e estresse emocional (Palma-Gudiel et al., 2015).
O epigenoma é particularmente vulnerável a estressores ambientais nos estágios iniciais da gravidez, quando as células embrionárias estão se dividindo rapidamente e as marcas epigenéticas estão sendo apagadas e redefinidas. Durante a gestação, a exposição à depressão ou ansiedade materna pode levar ao aumento da secreção de hormônios do estresse, como o cortisol ou a serotonina, tanto na mãe quanto no feto. Esses hormônios podem levar à alteração dos padrões de metilação do DNA em genes fetais envolvidos na função do eixo hipotálamo-hipofisário ou outros sistemas de resposta ao estresse. Em última análise, essas alterações de metilação do DNA podem alterar os padrões de expressão gênica que predispõem os filhos de mães aflitas a desenvolver distúrbios afetivos na vida adulta (Amy L NON A.M, 2014).
Outro estudo realizado na Alemanha por Sonja Entringer, Claudia Buss e Christine Heim citado por Yu Zheng, W. F. (2016), tendo como título “Experiências iniciais de estresse e volatilidade da doença” aponta evidências crescentes de que o estresse da mãe durante a gravidez pode ter uma influência sobre a saúde reprodutiva da prole. Estudos em animais mostraram uma relação causal entre o estresse materno durante a gravidez e alterações neuroendócrinas, imunológicas e comportamentais na prole (Menke A, Binder EB,2014). Estudos em humanos descobriram associações entre o estresse materno, ansiedade ou depressão durante a gravidez e aumento do risco de prole para depressão, ansiedade e déficits de atenção e comprometimento do desenvolvimento cognitivo (Yu Zheng, W. F. (2016) apud Krishnan V and Nestler EJ,2008). Há uma correlação significativa entre estresse pré-natal e mudanças negativas em todas as áreas examinadas. Adultos e jovens cujas mães foram expostas durante a gravidez a um forte stress psicológico mostram maior resistência à insulina e superiores níveis de gordura corporal, desregulação do eixo HPA (Hipotálamo-Pituitária-Adrenal), alterações na função imune e prejuízo em um teste de memória de trabalho após administração de cortisol (Yu Zheng, W. F, 2016). Tais consequências geram prejuízos por toda a vida do feto exposto a fatores estressantes, que vão desde problemas endócrinos e neuroendócrinos até retardo do desenvolvimento cognitivo, psicomotor e neural.
O estresse mental da mãe leva à liberação de cortisol em sua corrente sanguínea. A placenta é em grande parte uma barreira ao cortisol materno. Tal barreira é proporcionada por uma enzima na placenta, 11β-hidroxiesteróide desidrogenase (11β-HSD), que inativa o cortisol. Estima-se que apenas cerca de 10-20% do cortisol materno atinja a circulação fetal. Além disso, a atividade da enzima aumenta com o estresse agudo, por isso, quanto mais estressada é a mãe, melhor funciona a barreira (Karpova NN, (2014). No entanto, no estresse materno crônico, a atividade da enzima parece estar diminuída (Martinowich K, et al(2007), prejudicando a função protetora da placenta. Tanto o cortisol materno quanto o fetal pode estimular a liberação de CRH (Hormônio Liberador de Corticotrofina) na placenta, que entra nas circulações sanguíneas materno e fetal e estimula o HNA (eixo hipotálamo neuro adrenal), (Tadić A, et al, 2013). Ao contrário do hipotálamo, a secreção de CRH placentária não é inibida pelo cortisol, mas ativada, resultando em um mecanismo de alimentação entre o sistema materno, fetal e placentário, com respeito à liberação do hormônio do estresse. O cérebro fetal e muitos outros sistemas fisiológicos do feto dependem do cortisol materno para amadurecer e se desenvolver adequadamente (Yu Zheng, W. F. (2016) apud Shang H, et al, 2008), no entanto, níveis excessivamente elevados de cortisol pode ser destrutivo e ter consequências negativas a longo prazo, podendo, assim, explicar o aumento da reatividade estresse e vulnerabilidade a distúrbios mentais e físicos mais tarde da vida (Grayson DR, et al (2013); (Vialou J, et al, 2015). Por exemplo, em meninas pré-púberes cujas mães tinham níveis elevados de cortisol durante a gravidez, volumes maiores da amígdala e um aumento na prevalência de problemas afetivos foram observados (Yu Zheng, W. F, 2016).
A pesquisa realizada por Yu Zheng, W. F. (2016) mostra a relação endócrina e as consequências do aumento do nível das catecolaminas, no caso, o cortisol, que é intimamente ligado ao fator de estresse e possui sérias consequências no ciclo circadiano, pois é inversamente proporcional à liberação da melatonina e atua no feto, deixando-o vulnerável a distúrbios mentais e físicos. Tudo está relacionado à desregulação do eixo hipotálamo-hipofisário, o grande mestre do organismo humano, responsável pela regulação e funcionamento deste.
A exposição a antidepressivos durante a gravidez também tem sido associada a resultados desfavoráveis, incluindo baixo peso ao nascer, menores escores de Apgar, ou até mesmo sintomas de abstinência de antidepressivos após o nascimento (Amy L NON A.M, 2014).
Em geral, deve-se notar sobre os resultados listados que a predisposição genética para a depressão, ansiedade e aumento da sensibilidade ao estresse desempenha um papel na transmissão da experiência do estresse da mãe para a criança, uma vez que estes podem ser uma herança da mãe para a prole. Neste contexto, fatores genéticos também são discutidos como importantes moderadores que podem afetar as interações gene-gene materno-fetal e gene-ambiente em múltiplos níveis. Além disso, os achados estão aumentando de forma que mudanças epigenéticas devido a experiências iniciais de estresse também são moderadas pela disposição genética (Yu Zheng, W. F, 2016).
O estresse materno pré-natal (PNMS) pode afetar uma variedade de resultados na prole durante toda a infância e persistir na idade adulta, como demonstrado em estudos em humanos e em animais. Como agente da programação fetal, acredita-se amplamente que a PNMS afete o feto por meio de hormônios do estresse materno que, em níveis elevados, são conhecidos por atravessar rapidamente a placenta e assim impactar o feto em desenvolvimento. Isso pode afetar diretamente a fisiologia fetal no útero, ou indiretamente, e se manifestar ao longo da vida (L Cao-Lei et al, 2015). Em suma, o estresse causa a liberação de cortisol, mas a placenta é uma barreira ao cortisol materno. Entretanto, níveis muito elevados de cortisol podem atravessar a placenta e, consequentemente, afetar o desenvolvimento do feto.
De acordo com a pesquisa realizada por L Cao-Lei et al, 2015 o estresse é um fator que gera diversas consequências no feto, não somente na fase gestacional como durante sua infância e, até mesmo, toda a vida jovem e adulta, apontando a metilação como sendo um processo epigenético fundamental para a manifestação futura das consequências citadas na prole.
Além do estresse, a ingestão corriqueira de álcool durante a gestação pode acarretar problemas no feto, como a síndrome fetal do álcool. Desta maneira, tem-se mais uma vez o estresse, tanto físico e psicológico, quanto o celular, gerado pela ingestão de álcool, relacionado a consequências para o feto (Pinheiro, M.C.S, 2015).
A síndrome alcoólica fetal (SAF) é um tipo de anomalia causada nos fetos após o consumo de álcool pela mãe durante o período pré-natal. Ela é caracterizada por uma tríade sintomática que inclui dimorfismos faciais, prejuízo no desenvolvimento pré e pós-natal e anormalidades no sistema nervoso central (Pinheiro, M. D. (2015) apud LAMÔNICA et al., 2010). A amplitude da síndrome varia de acordo com vários fatores, entre eles: a quantidade e a frequência de álcool ingerido pela gestante, período da gestação exposto ao álcool, idade materna, juntamente com fatores genéticos, nutricionais e físicos, além do histórico de uso de outras drogas por parte da mãe (Pinheiro, M.C.S, (2015) apud GARCIA et al., 2007).
Os resultados desta revisão revelam que os problemas de saúde mental são proeminentes nas populações de indivíduos expostos ao álcool durante a gestação e ocorrem ao longo da vida, começando na infância precoce e persistindo na vida adulta.
No levantamento de estudos de modelo animal e humano para os efeitos da exposição ao álcool, na pré concepção, na geração subsequente, realizada por Vassoler e equipe em 2013 e citada por Pinheiro, M.C.S, (2015) identificou-se:
- Diminuição da fecundidade/fertilidade
- Ansiedade/depressão como fenótipos
- Distúrbios do desenvolvimento
- Alteração no nível de atividade basal e impedimentos na aprendizagem/memória/atenção em pesquisas de ambas perspectivas.
Relatou-se em muitos casos transtornos do espectro alcoólico fetal, podendo ter ligação com a herança genética, sustentando a ideia de que as possíveis alterações devido ao uso de álcool durante o período gestacional não se restringem a esse período e nem à fêmea genitora, mas também nos casos em que há consumo de álcool pelo macho (Pinheiro, M.C.S (2015) apud VASSOLER et al., 2013).
Outro autor que pesquisou essa possibilidade foi o Haycock, ele escreveu uma revisão indicando que muitos dos efeitos do álcool durante o desenvolvimento dos seres vivos, incluindo os efeitos do álcool antes da concepção e os efeitos sobre os gametas masculinos, são consistentes com o efeito epigenético. Assim como a capacidade de interferência do álcool em uma série de processos químicos, que são criticamente envolvidos na epigenética (GregoryR.Rompala, A. m. (2016) apud HAYCOCK, 2009).
Dada a crença de longa data de que os pais apenas contribuem com informações genômicas através da linha germinativa, a saúde preconceituosa do pai tem sido historicamente vista como inconsequente para o desenvolvimento da prole. No entanto, uma onda recente de pesquisas pré-clínicas desencadeou um crescente interesse em como vários fatores paternos, como estresse, dieta e álcool antes da concepção também podem afetar o fenótipo da descendência, presumivelmente através de mecanismos epigenéticos no esperma (Stuppia et al., 2015); (Schagdarsurengin e Steger, 2016). Machos expostos intermitentemente ao vapor de etanol durante 5 semanas produzem descendentes masculinos com menor consumo de etanol, maior sensibilidade ao etanol e responsividade ao estresse atenuado (GregoryR.Rompala, A. m, 2016).
Tal fato expressa que não só a ingestão de álcool pela mãe, durante a gravidez, mas também o hábito paterno dessa prática pode desencadear consequências para o feto.
Embora o DNA do esperma esteja densamente empacotado no núcleo, os espermatozoides não são apenas portadores passivos de material genético, mas também apresentam um mecanismo epigenético complexo. Como a maioria das histonas em espermatozoides é trocada por protaminas durante a espermatogênese, e o DNA do espermatozoide perde a maior parte de sua metilação na fertilização, identificar mecanismos baseados em espermatozoides da herança epigenética tem sido um desafio (GregoryR.Rompala, A. m. 2016).
Numerosos estudos descobriram que pequenos RNAs não-codificantes de espermatozoides são sensíveis a vários fatores ambientais paternos, incluindo estresse, dieta e exercício (GregoryR.Rompala, A. m, 2016).
A hipótese levantada por Gregory R.Rompala, Anais Mounier, […], e Greg E.Homanics ao transcorrer sobre tal tema foi que o etanol provoca reprogramação epigenética de pequenos RNAs não codificantes de espermatozoides. Dessa maneira percebe-se que essa forma de estresse não só físico, mas celular, causada pela ingestão de álcool pelo pai e possui consequências nas características fenotípicas e epigenéticas do feto.
Os resultados da pesquisa realizada por Gregory R.Rompala, Anais Mounier,[…], e Greg E.Homanics, encontrados através do uso e manipulação de camundongos como grupo de testes, adicionam etanol crônico à crescente lista de exposições paternais, que podem afetar a pequena abundância de RNA não codificante e as modificações de nucleotídeos nos espermatozoides. Como os pequenos RNAs não codificantes nos espermatozoides mostraram induzir causalmente fenótipos hereditários na prole, pesquisas adicionais são necessárias para entender os efeitos potenciais dos pequenos RNAs não-codificantes de espermatozoides responsivos ao etanol na saúde e desenvolvimento da prole.
Apesar de muitas pesquisas analisarem os impactos da ingestão de álcool durante a gestação, a partir de relatos, ou seja, não totalmente conclusivos, os estudos analisados afirmam que o consumo de álcool durante a gravidez pode afetar negativamente o quociente de inteligência, a saúde mental, a memória e o desempenho verbal ou visual do recém-nascido (Yu Zheng, W. F. (2016) apud POLANSKA et al., 2015).
Ao adotarem o critério de comportamento afetivo em roedores expostos ao álcool durante a gestação, Marquadt et al. identificaram que em 77,2% das pesquisas analisadas (obras de 1983 a 2015) apresentaram relação entre o álcool e os comportamentos observados pelos pesquisadores (MARQUADT et al., 2016).
Os animais utilizados nos experimentos analisados por Burger et al. apresentaram uma mudança na migração neuronal, que afeta particularmente o sistema dopaminérgico. Os efeitos clínicos mostram mudanças de atenção e capacidade de resposta, tanto em pequenos mamíferos quanto em macacos (BURGER et al., 2011).
Ainda de acordo com o levantamento realizado por esses autores, uma lista de comportamentos psicopatológicos foi identificada em indivíduos expostos ao álcool durante a gestação, como: sintomas de depressão em crianças com idade a partir de quatro anos, ansiedade, irritabilidade, tendências suicidas, dificuldade no aprendizado, dentre outros.
Dessa forma, pode-se constatar que as exposições a alguns fatores ambientais durante a gestação, como a permanência de hábitos de ingestão alcoólica, assim como o estresse, alteram desde o eixo psico cognitivo do feto até seu desenvolvimento neurológico e físico. Sendo assim, o conceito de epigenética mostra que características apresentadas por um organismo não são estáveis ao longo de sua vida, pois envolvem mudanças na metilação de DNA do organismo, causada por diversos fatores ambientais.
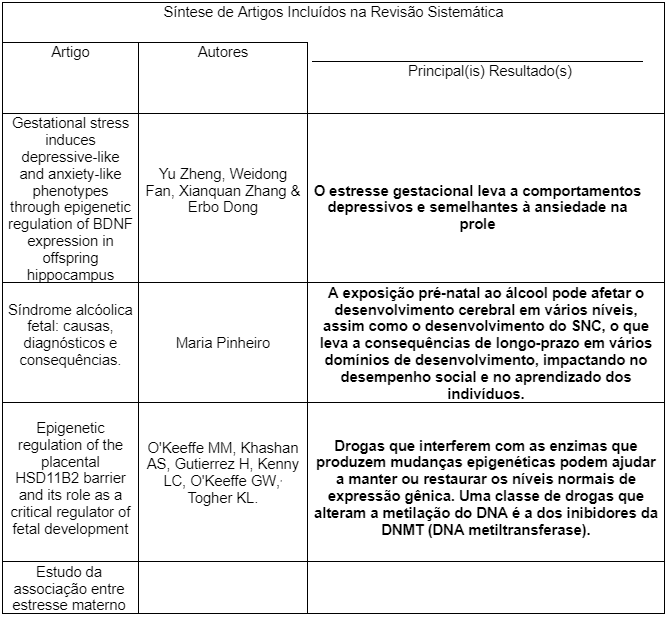
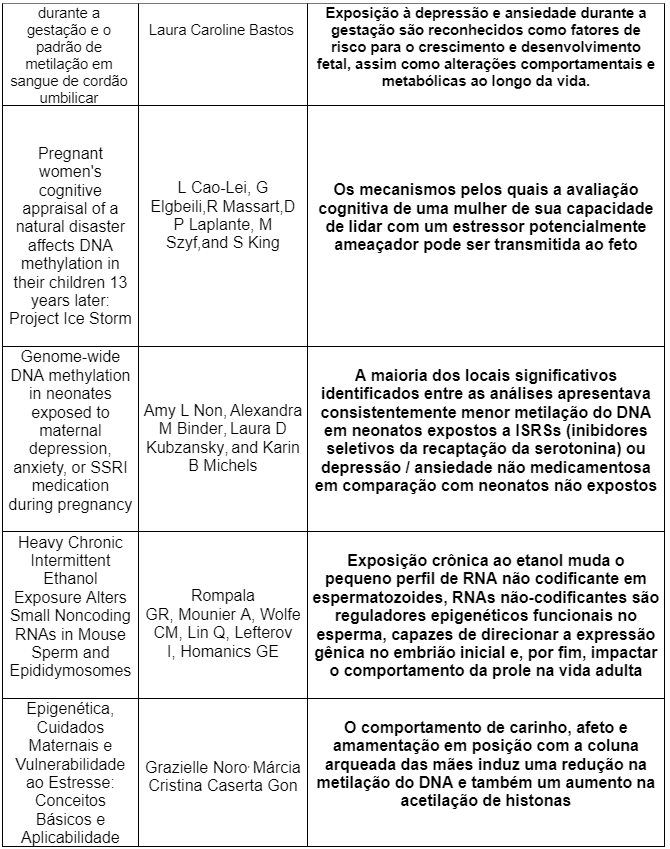
Através da análise da tabela de resultados pode-se observar as consequências da exposição do feto ao estresse durante a gestação, bem como a ingestão de álcool paterna e materna, sendo essa considerada uma forma de estresse não só psicológica, mas física e celular, e a uso de antidepressivos. Foi realizada uma comparação entre as pesquisas realizadas nos artigos. Todas essas pesquisas eram do tipo corte.
CONCLUSÃO
Neste artigo, abordou-se a relação da epigenética e do estresse materno durante a gravidez e suas consequências para o feto trazendo, ademais, hábitos como a ingestão de bebidas alcoólicas e antidepressivos, que podem ocasionar alterações epigenéticas e até mesmo endócrinas e fisiológicas no feto.
Após a revisão de literatura, foram identificados diversos comportamentos psicopatológicos em indivíduos que durante a gestação foram submetidos a estresse, seja ele físico, psicológico ou celular, a exemplo do consumo de álcool. Além disso, hábitos paternos, como a ingestão de álcool, podem afetar o fenótipo da descendência através de mecanismos epigenéticos no esperma. Tal fato expressa que não só a utilização de álcool pela mãe durante a gravidez pode desencadear consequências para o feto. As diferenciadas formas de exposição ao estresse ocasionam consequências diversas, sendo elas preocupantes, como depressão em crianças, irritabilidade, ansiedade, tendências suicidas, dificuldade no aprendizado, ou seja, alterações no eixo psico cognitivo do feto. As implicações epigenéticas materno-fetal fazem parte de uma área pouco pesquisada e relativamente desconhecida, demonstrando a necessidade de estudos mais aprofundados, que podem apontar diversos outros malefícios e/ou possibilidades intervencionistas às problemáticas geradas.
REFERÊNCIAS
Amy L Non, A. M. (2014). Genome-wide DNA methylation in neonates exposed to maternal depression, anxiety, or SSRI medication during pregnancy. epigenetic.
Bastos, l. c. (2017). Estudo da Associação entre Estresse Materno Durante a Gestação e o Padrão de Metilação em Sangue de Cordão Umbilical.
Chakraborty, A., Anstice N.S. Jacobs, R.J., et al. (2015) ‘prenatal exposure to recreational drugs affects global motion perception in preschool children’, Epigenetics 10:508-15.
Finegersh A., Rompala GR, Martin DI, Homanics GE (2015b). Beber além da vida: novos e emergentes insights sobre a exposição paterna ao álcool nas gerações subsequentes. Álcool 49, 461-470. 10.1016 / j.alcohol.2015.02.008 [ Artigo livre de PMC ] [ PubMed ]
Gregory R.Rompala, A. m. (18 de fevereiro de 2016). Heavy chronic intermittent ethanol exposure alters small noncoding RNAs in mouse sperm and Epididymosomes. frontirs in genetics.
Grayson DR, Guidotti A., A dinâmica da metilação do DNA na esquizofrenia e distúrbios psiquiátricos relacionados. Neuropsicofarmacologia 2013; 38 : 138-66; PMID: 22948975; http://dx.doi.org/10.1038/npp.2012.125 [ artigo livre de PMC ][ PubMed ]
L Cao-Lei, G. E. (2015). Pregnant women’s cognitive appraisal of a natural disaster affects DNAmethylation in their children 13 years later: project ice storm. translation psychiatry.
Menke A, fichário EB. Alterações epigenéticas na depressão e tratamento antidepressivo. Diálogos Clin Neurosci. 2014; 3 : 395-404 [ artigo livre de PMC ][ PubMed ]
Nascimento, T. H., Carla Vaneska Fernandes Leal, P. C., & Almeide, M. m. (2017). síndrome alcóolica fetal, uma revisão sistemática. journal of medicine and health promotion, pp. 819-826.
Noro Grazielle. Epigenética, cuidados maternais e vulnerabilidade ao estresse: conceitos básicos e aplicabilidade. Scielo, Psicol. Reflex. Crit. vol.28 no.4
Porto Alegre. Oct/dec.2015
O’Keeffe, K. L. (2014). Epigenetic regulation of the placental HSD11B2 barrier and its role as a critical regulator of fetal development. epigenetics.
Pauma-Gudiel, H., córdova-Palomera, A., Eixarch, E., Deuschle, M. and Fañanás, L. (2015) ‘Maternal psychosocial stress during pregnancy alters the epigenetic signature of the glucocorticoid receptor gene promoter in their offspring: A meta-analysis’, Epigenetics, pp. 893-902.
Pinheiro, M.C.S (2015). Síndrome alcoólica fetal: causas, diagnósticos e consequências.
Schagdarsurengin U., Steger K. (2016). Epigenética na reprodução masculina: efeito da dieta paterna na qualidade do esperma e na saúde da prole. Nat. Rev. Urol. 13, 584-595. 10.1038 / nrurol.2016.157 [ PubMed ]
Stuppia L., Franzago M., Ballerini P., Gatta V., Antonucci I. (2015). Epigenética e reprodução masculina: as consequências do estilo de vida paterno na fertilidade, no desenvolvimento do embrião e na saúde da criança. Clin. Epigenetics 7, 120. 10.1186 / s13148-015-0155-4 [ artigo livre de PMC ] [ PubMed ]
Tadić A, Müller-Engling L, Schlicht KF, Kotsiari A, N Dreimüller, Kleimann A, Bleich S, Lieb K, Frieling H. Metilação do promotor do fator neurotrófico brainderived exon IV e resposta antidepressiva na depressão maior. Mol Psiquiatria 2014; 19 : 281-3; PMID: 23670489; http://dx.doi.org/10.1038/mp.2013.58 [ PubMed ]
Vialou J, Feng J., Robison AJ, Nestler EJ. Mecanismos epigenéticos de depressão e ação antidepressiva. Annu Rev Pharmacol Toxicol. 2013; 53 : 59-87; PMID: 23020296; http://dx.doi.org/10.1523/jneurosci.1164-15.2015 [ artigo livre de PMC ] [ PubMed ]
Yu Zheng, W. F. (2016). Gestational stress induces depressive like and anxiety-like phenotypes through epignetic regulation of BDNF expressionn in offspring hipocampus. epigenetic.
1Graduanda em Medicina pelo CESMAC – Centro de Estudos Superiores de Maceió
2Médica
3Graduanda em Medicina pela FPS
4Graduanda em Medicina pela UNIFIP
5Graduanda em Medina pela UNIFIP
6Graduando em Medicina pela INTA- UNINTA
7Graduanda em Medicina pela UNIT/AFYA
8Graduanda em Medicina pela UNIT/AFYA
9Graduanda em Medicina pelo CESMAC
10Graduando em Medicina pelo ITPAC Porto
11Graduanda em Medicina pelo ITPAC Porto
12Graduanda em Medicina pelo ITPAC Porto
13Graduanda em Medicina pela UNIT/AFYA
14Graduanda em Medicina pela UNIT/AFYA
15Graduanda em Medicina pela UNIT/AFYA
16Graduanda em Medicina pela UNIT/ AFYA
17Médico formado pela FCM PB, Pediatra
