SIERRAS CAN ISOLATE ASSEMBLAGES OF ZYGOPTERA?
REGISTRO DOI: 10.5281/zenodo.10973943
Handerson Batista Castro,
Orientador: Paulo Cesar Venere
RESUMO
Odonata são invertebrados cuja distribuição está intimamente relacionada com as características ambientais locais. São popularmente conhecidas por libélulas, sendo um grupo bastante antigo, cuja distribuição inclui habitats de montanhas alpinas, pântanos, áreas úmidas tropicais e cachoeiras. Por essas características, se constitui em um grupo interessante para estudos que buscam interpretar os fatores associados à distribuição pelos diferentes microhabitats neotropicais. Nesse contexto as serras surgem como elementos da paisagem que têm a capacidade de direcionar o fluxo de riachos e consequentemente moldar a distribuição dos organismos aquáticos. Para organismos dependentes do ambiente aquático como são os Odonata, as serras podem representar uma barreira a sua dispersão. Diante disso, o objetivo deste trabalho foi investigar a influencia da Serra Azul (MT) sobre a composição de Zygoptera, insetos típicos de mata de galeria e de baixa capacidade de dispersão, comparando amostras de sítios localizados ao norte e ao sul das partes mais elevadas da serra. Foram amostrados 11 córregos que drenam a face norte e nove na face sul do da Serra Azul. Coletou-se zigópteros na fase adulta com rede entomológica, em transectos de 100 m, ao longo das margens dos córregos, entre 10:00 e 14:00 horas, nos meses de agosto e setembro de 2013, com os exemplares sendo armazenados em álcool absoluto P.A. Foram coletados 598 espécimes, pertencentes a 12 gêneros e 26 espécies. Dessas, 10 espécies ocorreram apenas na face norte e nove na face sul. Foi encontrada diferença na composição das assembleias entre face norte e sul do Parque Estadual da Serra Azul (ANOSIM: R= 0,254, p < 0,001). Os resultados obtidos permitem concluir que a Serra Azul atua como um elemento isolador que cria condições favoráveis para o estabelecimento de assembleias distintas de Zygoptera entre as duas vertentes estudadas.
Palavras chave: isolamento, composição de espécies, distância, dispersão.
ABSTRACT
Odonata are invertebrates whose distribution is closely related to local environmental characteristics. Dragonflies are popularly known as being a very ancient group, whose distribution includes habitats of alpine mountains , swamps , waterfalls and tropical wetlands . For these characteristics, constitutes an interesting model for studies that seek to interpret the associated distribution in the different microhabitats neotropical factors. In this context the mountains appear as landscape elements that have the ability to direct the flow of streams and consequently shape the distribution of aquatic organisms. For organisms dependent on the aquatic environment as are the Odonata, the mountains can be a barrier to their dispersal. Therefore, the aim of this study was to investigate the influence of the Serra Azul ( MT ) on the composition of Zygoptera , typical gallery forest insects and low dispersal ability , comparing samples from sites located north and south of the highest parts saw . Eleven streams that drain the north face nine on the south face of the Sierra Azul were sampled. Was collected zigópteros adults with entomological net in transects 100 m , along the banks of streams, between 10:00 and 14:00 in the months of August and September 2013, with copies being stored in alcohol absolute PA. 598 specimens belonging to 12 genera and 26 species were collected . Of these , 10 species occurred only in the north -nine face the south face . Difference was found in the composition of the meetings between north and south side of the Sierra Azul State Park (ANOSIM : R = 0.254 , p < 0.001) . The results indicate that the Sierra Azul acts as an insulator element that creates favorable conditions for the establishment of separate assemblies Zygoptera between the two aspects studied .
keywords: isolation, species composition, distance, dispersion.
INTRODUÇÃO
Os insetos da ordem Odonata são representados na região Neotropical por duas subordens, Anisoptera e Zygoptera com cerca de 1.640 espécies descritas (Kalkman et al., 2007). Os Anisoptera, em sua maioria, são insetos maiores e passam grande parte do tempo voando e, por isso, são classificados como voadores endotérmicos, já que dependem pouco da exposição direta ao sol, uma vez que conseguem produzir calor endógeno (May, 1976). Por sua vez os Zygoptera são, em geral, menores e são conhecidos como pousadores e territorialistas. Além disso, necessitam de incidência da luz do sol para iniciar suas atividades. Por isso, são também classificados como conformadores termais ou heliotérmicos. Geralmente apresentam tamanhos corporais pequenos, ficam mais restritos às matas de galeria, em locais bem sombreados, já aqueles heliotérmicos, de tamanho corporal médio, são encontrados pousados onde possam obter irradiação solar (May, 1976).
Os zygópteros possuem corpo delgado, coloração vistosa, e a maioria das espécies desse grupo pousam com asas fechadas e paralelas ao corpo (Gibbons, Reed, & Chew, 2002); apresentam fase larval aquática e fase adulta terrestre.
Os machos são territorialistas e frequentemente entram em disputa por manchas de sol e/ou bons poleiros (Switzer, 1997). Por outro lado, as fêmeas passam grande parte do tempo alimentando-se na mata, tendendo, por esse comportamento, a se dispersarem mais que os machos (Conrad et al., 2002). Suas fases larvais podem chegar a dois anos e, justamente pelo fato de permanecerem tanto tempo nessa fase de seu ciclo de vida, e também pelo fato de muitos deles serem sensíveis às oscilações na qualidade da água, são bons indicadores biológicos (Bonada, Prat, Resh, & Statzner, 2006; Corbet, 1980; Wallace & Webster, 1996).
Apesar da territorialidade, a alta capacidade reprodutiva e densidade de algumas espécies, aliada a natureza agressiva de disputa podem estimular a dispersão, pois, indivíduos derrotados tendem a migrar até um ponto em que encontrem os recursos que procuram (Corbet, 1980).
Nesse contexto, as serras são importantes elementos da paisagem que podem, em associação com os demais elementos da paisagem tais como matrizes de uso com agropecuária e grandes rios, moldar a dispersão das comunidades, uma vez que direcionam os riachos de nascentes próximas em direções opostas, e suas partes mais altas podem exercer um papel de barreira para estas espécies que buscam por novos recursos (Novelo-Gutiérrez & Gómez-Anaya, 2008). Além disso, são importantes formadores de microbacias, geradores de gradientes de solo e vegetação, influenciando tanto a fauna terrestre quanto a aquática (Ward, Tockner, Arscott, e Claret, 2002).
Em situações em que não existam barreiras para a dispersão, a tendência é que as espécies ampliem sua distribuição espacial e se instalem em ambientes que ofereçam os recursos mínimos necessários para sua sobrevivência (Hayes & Sewlal, 2004). Por outro lado, quando barreiras geográficas, como serras e cadeias de montanhas estão presentes no espaço, gradientes de altitude e precipitação podem moldar a composição de espécies (Gómez-Anaya et. al., 2011). Em casos extremos de restrição ao movimento natural das populações, ou seja, quando as populações não conseguem transpor barreiras físicas, o isolamento gerado pode dar origem a um processo de vicariância (Kodandaramaiah, 2010), mas quando o fluxo existe, a qualidade do nicho e a competição determinam o sucesso reprodutivo, a abundância e as assembleias locais (Samways, 1989).
A hipótese de isolamento de assembleias de Zygoptera foi analisada em platôs suíços. Os pesquisadores encontraram diferenças genéticas significativas entre assembleias de córregos à sudeste e nordeste desses platôs (Van-Strien, Keller, & Holderegger, 2012). De modo similar, Thompson & Watts ( 2006), também demonstraram que o cume das serras pode representar um fator limitante ao fluxo gênico. Em um estudo realizado na Serra do Coalcomán – México, Gomez-Anaya et al. (2011) verificaram que diferentes graus de declividade entre uma face e outra da serra podem influenciar na riqueza de espécies, pois, a face da serra que estiver mais próximo do litoral sofre efeito de fenômenos de sotavento e barlavento, podendo apresentar maiores precipitações do que aqueles mais distantes.
Assim, o objetivo do presente trabalho foi comparar a composição de espécies de Zygoptera entre córregos que nascem na face sul e norte da Serra Azul. Nossa hipótese é que os córregos da face norte apresentam uma composição de espécies distinta daquela da face sul, baseado na premissa de que a Serra é um elemento da paisagem que molda a distribuição, influenciando na dispersão e isolando as assembleias de Zygoptera, que habitam as faces norte e sul da serra Azul.
MATERIAL E MÉTODOS
Área de Estudo
Para a realização do presente trabalho foram amostrados 20 sítios de coleta, todos em nascentes do Parque Estadual da Serra Azul (PESA), no município de Barra do Garças, Mato Grosso, Brasil (Tabela 1, Figura 2). Desse total, 11 sítios estão localizados em córregos que drenam na face norte e nove na face sul da Serra.
A feição geomorfológica mais conspícua da Serra Azul é aquela do Planalto dos Guimarães que se constitui em um conjunto de relevos de aspectos tabulares, com altitudes médias entre 600 a 700 metros, refletindo sua estrutura horizontal e/ou sub-horizontal (dos grupos geológicos Ivaí e Paraná), tendo, localmente, cobertura detrítico-laterítica do Terciário- Quaternário (FEMA, 2000).
Os pontos de coleta nos córregos estão, em sua maioria, inseridos em áreas de menor altitude, 350-450 metros, em relação ao pico das formas tabulares. O principal critério adotado para escolha dos pontos foi o de coletar em todas as nascentes (ou bastante próximo delas) que se localizam a norte e sul do espinhaço (pontos mais altos da serra).
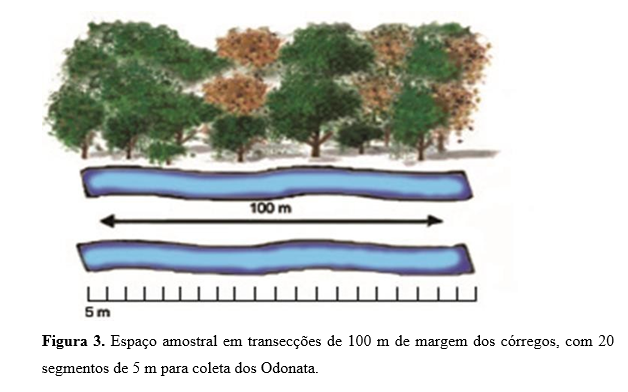
O clima em Barra de Garças é do tipo Aw, na classificação de Köppen-Geiger (Peel et. al., 2007). Durante o estudo, registramos uma temperatura mínima de 29,1°C e máxima de 35,1°C. Quanto à temperatura da água, a mínima foi de 22,6°C e a máxima de 28,1°C. A média de altitude dos pontos da face norte é de 397 metros e da face sul, 434 metros. As medidas de temperatura do ar, da água e as coordenadas geográficas foram tomadas sempre antes do inicio das coletas. Os adultos de Zygoptera (Odonata) foram coletados com uma rede entomológica (40 cm de diâmetro, 65 cm de profundidade e cabo de alumínio com 75 cm de comprimento), em transectos de 100 m dos córregos, baseados na metodologia de varredura em áreas fixas (Figura 3) (Juen & De Marco, 2011). As amostragens foram realizadas em 20 locais, em dias ensolarados, entre 10:00 e 14:00 horas, nos meses de seca, agosto e setembro de 2013. Todas as coletas foram feitas dentro dessa faixa de horário, para permitir que a maioria dos grupos de Odonata estivesse ativa no momento da coleta (May, 1976, 1991).
Tabela 1. Localização geográfica dos sítios de coleta, com posicionamento dos córregos em relação ao platô da Serra Azul e valores do Índice de Integridade de Hábitat [IIH] dos locais, PESA, Barra do Garças, Mato Grosso, Brasil, 2014.


Os exemplares foram armazenados em álcool absoluto P.A. A identificação das espécies foi realizada com base nos livros de Lencioni (2005, 2006) e Garrison, Ellenrieder, & Louton, (2010) e comparação com material da coleção de referência do Laboratório de Entomologia da UNEMAT – Nova Xavantina e confirmada por especialista. O material testemunho encontra-se depositado na coleção Zoobotânica “James Alexandre Ratter”, da Universidade do Estado de Mato Grosso.
ÍNDICE DE INTEGRIDADE AMBIENTAL
As análises da integridade são alternativas de baixo custo para avaliação do estado de conservação dos locais de coleta que, nesse trabalho, foram obtidas com o Índice de Integridade de Hábitat (Nessimian et al., 2008), um protocolo com 12 questões que avaliam, através de observações diretas, os graus de conservação dos córregos .
Cada item do protocolo é composto de quatro a seis alternativas ordenadas em relação aos aspectos percebidos de integridade do hábitat. Para que cada pergunta (Pi) tivesse peso igual na análise, já que o número de alternativas variava entre quatro e seis, os valores observados (ao) foram padronizados dividindo-se o valor atribuído pelo número máximo de alternativas possíveis para a pergunta (am– equação 1). O índice final é a somatória dos Pi em razão do número de questões (n – equação 2). Essas transformações produzem um índice que varia de 0 a 1 e que é diretamente relacionado às condições de integridade do hábitat, com locais mais íntegros próximos de um (Batista, 2006).
Fórmula para cálculo do IIH:

ANÁLISES ESTATÍSTICAS
Para testar a diferença dos grupos norte e sul, foi realizada uma análise de similaridade com 999 permutações (ANOSIM; McCune & Grace, 2002). A ANOSIM é um tipo particular de análise multivariada para comparação de médias, mas que não requer que os dados tenham distribuição normal e homogeneidade de variância, e testa grupos definidos numa matriz. A estatística do teste R varia de -1 a 1, quanto mais positivo for o valor, maior a diferença entre os grupos.
Para visualizar as relações de agrupamento dos córregos fez-se uso da Análise de Coordenadas Principais (PCoA) com medidas de distância de Bray-Curtis. Esta é uma métrica utilizada para ordenar dados de abundância das espécies, desenvolvido no software PC Ord for Windows v. 5.15 (McCune & Mefford, 2006).
Para controlar o efeito do espaço e ambiente, foram feitos dois Testes de Mantel, um para avaliar se existe efeito do espaço sobre o IIH e outro para avaliar se a distância geográfica afeta a composição dos córregos. Esta análise se deu confrontando a matriz com valores de IIH versus matriz de distância física (coordenadas geográficas, utilizando a distância euclidiana como métrica de dissimilaridade), e a matriz de composição de espécies versus matriz de distância física (utilizando Bray-Curtis como métrica), buscando avaliar se a proximidade e integridade de hábitat dos córregos afetam a composição de espécies de Zygoptera. Esta análise foi realizada no programa R, com o pacote Vegan (R Development Core Team, 2009).
O Teste de Mantel consiste em comparar duas matrizes derivadas das matrizes de dados multidimensionais e independentes (Legendre & Legendre, 1998). A estatística de Mantel varia de -1 a +1 (Quinn & Keough, 2002). A hipótese nula do Mantel é que não há relação linear entre as variáveis a serem testadas. Para testar essa hipótese, é aplicada a randomização de Monte Carlo para produzir uma distribuição nula no teste: a matriz independente é mantida enquanto que a matriz dependente possui suas linhas e colunas correspondentes randomizadas (Smouse, Long & Sokal, 1986) e, através do coeficiente de correlação de Pearson, é verificada a relação entre os elementos correspondentes. A probabilidade da hipótese nula é estimada contando o número de randomização no qual o resultado é menor ou igual ao resultado obtido na matriz original e então dividido pelo número de randomização (Quinn & Keough, 2002).
RESULTADOS
Foram coletados 462 espécimes, pertencentes a 12 gêneros e 26 espécies (Tabela 2). Dessas, 10 espécies ocorreram exclusivamente na face norte e nove na face sul da Serra, correspondendo a 73% do número de espécies com ocorrência restrita; as mais abundantes foram encontradas em ambos as faces (Figura 4). Analisando-se a distribuição por gêneros os taxa Argia smithiana, Argia sp.1, Argia sp.3 e Hetaerina sp.1 ocorreram somente na face sul, enquanto Argia sp 5, Argia sp. 6, Argia sp. 7 e Hetaerina curvicauda ocorreram apenas no norte e Hetaerina rosea ocorreu em ambos as faces.
Entre as mais abundantes, Argia tinctipennis e Argia reclusa (∑ 40%), ocorreram em 95% dos sítios amostrados e tem distribuição divergente nas abundâncias. Assim, Argia tinctipennis predomina ao sul (n=100) e teve menor abundância no norte (n=37), o contrário aconteceu com Argia reclusa (n =35 e n=85, respectivamente) (Figura 4).

Figura 4. Diagrama de Venn mostrando os conjuntos de espécies e morfoespécies registradas nos sítios de coleta da face norte e sul do PESA, Barra do Garças, Mato Grosso, Brasil.

Entre os dois testes de mantel realizados, o primeiro não foi significativo, mostrando que a distância não causa efeito sobre o IIH (R= 0,13, p= 0,054), e o segundo mostrou que a distância afeta a composição de espécies (R= 0,27, p= 0,001). A análise de coordenadas principais (PCoA) mostrou diferenças significativas na composição de espécies (Figura 5), com a separação parcial entre córregos da face norte e sul da Serra (ANOSIM: R= 0,254, p<0,001).

Figura 5. Ordenação das assembleias de Zygoptera (Odonata) da face sul e norte da Serra Azul, PESA, Barra do Garças, Mato Grosso, Brasil, 2013.
DISCUSSÃO
A hipótese de que os córregos que nascem na face norte da Serra Azul apresentariam uma composição de espécies diferente da dos córregos da face sul, baseados na premissa de que a Serra interfere na dispersão de Zygoptera, foi corroborada. Os resultados sugerem que as serras, como elementos de paisagem, afetam as assembleias.
Embora não seja possível explicar ao certo os fatores que possibilitam que algumas espécies de Zygoptera ocorram em ambos as faces da serra, é mister valorizar o resultado de que aproximadamente 75% das espécies ocorrem apenas em uma ou outra face da serra e que este resultado serve de alerta para o planejamento de gestão deste grupo.
Sabe-se que o isolamento, seja ele gerado por barreiras naturais ou de origem antrópica, aumentam as chances de perda de variabilidade genética e, consequentemente, a chance de extinção (Watts et al., 2007; Watts, Saccheri, Kemp, & Thompson, 2006), mas, por outro lado, podem contribuir para o surgimento de novos arranjos específicos (Mayr, 1942).
Os Zygoptera são aplicados em defender territórios nas matas de galeria, apresentam baixa habilidade de dispersão e, portanto, pouca capacidade de transpor barreiras (Juen e De Marco 2011). Naturalmente a dispersão varia com o comportamento de cada espécie, de modo que alguns grupos tendem a se distribuir em um raio menor, enquanto outros naturalmente migram mais (Ronquist, 1997). Fato que poderia explicar a relação significativa entre a distância entre os sítios amostrais e a similaridade de fauna.
Entende-se, portanto, que a queda da similaridade biológica é correlacionada com duas características do ambiente: distância e natureza do modelo espacial. O modelo espacial inclui tamanho de habitat e isolamento, que afeta com menor intensidade espécies com alta vagilidade (Nekola et al. 1999).
Ademais, os Zygoptera possuem fase adulta alada (Corbet, 1980) e podem mesmo que em amplitude restrita, se dispersarem. Entretanto, outros organismos que migram apenas dentro do ambiente aquático, como peixes e crustáceos (Begossi, 1998), podem estar compondo assembleias ainda mais dissimilares entre a face sul e norte da Serra Azul.
Os inventários da biodiversidade aquática devem atentar para uma amostragem que vislumbre os elementos da paisagem (serras) e a conformação das microbacias. Os dados aqui apresentados representam uma importante informação para a ecologia da conservação de Zygoptera, já que, entender como as espécies se distribuem oferece suporte para planejar estratégias regionais de manejo, visando futuras ações de conservação (Death & Collier, 2009; Death & Zimmermann, 2005; Hawking, 2003).
Entretanto, o fato de algumas espécies ocorrerem em ambos as faces, levanta novas perguntas, como por exemplo: é possível que as populações de Zygoptera existentes de uma face e outra da serra tenham sua ocorrência mais primitiva do que a própria formação das serras? Trabalhos futuros que avaliem geneticamente o parentesco de populações da face norte e sul poderão esclarecer esta questão.
CONCLUSÕES
Baseado em nossos resultados a Serra Azul representa um elemento da paisagem que está isolando as assembléias de Zygoptera que habitam a face norte daquelas que habitam a face sul.
A composição de espécies da face norte é diferente da face sul, mas, considerando que as espécies Argia tinctipennis, Argia reclusa e Hetaerina rosea apresentaram ampla distribuição em toda a serra, sugere-se que o isolamento é parcial e exerce influência apenas sobre algumas espécies.
É premissa básica em planos de manejo e conservação, estimar a conectividade entre manchas florestadas. Entretanto, os resultados deste trabalho mostram que a estimativa deve ir além, prevendo a conservação das bordas das serras e corredores naturais que permitam então a livre migração das espécies.
REFERÊNCIAS BIBLIOGRÁFICAS
Batista, J. D. (2006). Distribuição longitudinal de adultos de Odonata em riachos no Cerrado:uma hipótese ecofisiológica. Universidade Federal de Viçosa.
Batista, J. D. (2010). Sazonalidade, Impacto Ambiental e o Padrão de diversidade Beta de Odonata em Riachos Tropicais no Brasil Central. Universidade Federal de Viçosa.
Begossi, A. (1998). Property rights for fisheries at different scales: applications for conservation in Brazil. Fisheries Research, 34, 269–278. doi:10.1016/S0165- 7836(97)00085-4
Bonada, N., Prat, N., Resh, V. H., & Statzner, B. (2006). Developments in aquatic insect biomonitoring: a comparative analysis of recent approaches. Annual review of entomology, 51, 495–523. doi:10.1146/annurev.ento.51.110104.151124
Conrad, K. F., Willson, K. H., Whitfield, K., Harvey, I. F., Thomas, C. J., & Sherratt, T. N. (2002). Characteristics of dispersing Ischnura elegans and Coenagrion puella ( Odonata ): age , sex , size , morph and ectoparasitism. Ecography, 25, 439–445.
Corbet, P. S. (1980). Biology of Odonata. A. Rev. Ent., 25, 189–227. doi:10.1146/annurev.en.25.010180.001201
Death, R. G., & Zimmermann, E. M. (2005). Interaction between disturbance and primary productivity in determining stream invertebrate diversity. Oikos, 2, 392–402.
FEMA. (2000). Diagnóstico Ambiental – Parque Estadual da Serra Azul. Fundação Nacional do Meio Ambiente – Mato Grosso, 174.
Garrison R.W, von Ellenrieder N, L. J. A. (2010). Damselfly genera of the New World: an illustrated and annotated key to the Zygoptera (p. 490). Baltimore: The Johns Hopkins University Press.
Gibbons, L. K., Reed, J. M., & Chew, F. S. (2002). Habitat requirements and local persistence of three damselfly species ( Odonata : Coenagrionidae ). Journal of Insect Conservation, 6, 47–55.
Gómez-Anaya, J. A., Novelo-Gutiérrez, R., & Campbell, W. B. (2011). Diversity and distribution of Odonata ( Insecta ) larvae along an altitudinal gradient in Coalcomán mountains, Michoacán, Mexico, 59, 1559–1577.
Hawking, J. H., & New, T. R. (2003). Interpreting dragonfly diversity to aid in conservation assessment : lessons from the Odonata assemblage at Middle Creek , north-eastern Victoria. Journal of Insect Conservation, 6, 171–178.
Hayes, F. E., & Sewlal, J.-A. N. (2004). The Amazon River as a dispersal barrier to passerine birds: effects of river width, habitat and taxonomy. Journal of Biogeography, 31, 1809–1818. doi:10.1111/j.1365-2699.2004.01139.x
Juen, L., & De Marco, P. (2011). Odonate biodiversity in terra-firme forest streamlets in Central Amazonia: on the relative effects of neutral and niche drivers at small geographical extents. Insect Conservation and Diversity, 4, 265–274. doi:10.1111/j.1752-4598.2010.00130.x
Kalkman, V. J., Clausnitzer, V., Dijkstra, K.-D. B., Orr, A. G., Paulson, D. R., & Tol, J. (2007). Global diversity of dragonflies (Odonata) in freshwater. Hydrobiologia, 595, 351–363. doi:10.1007/s10750-007-9029-x
Legendre, P., & Legendre, L. (1998). Numerical ecology. Amsterdam: Elsevier.
Lencioni, F. A. A. (2005). Damselflies of Brazil—An illustrated identification guide – 1 – Non-Coenagrionidae families. (p. 316). São Paulo: All Print Editora.
Lencioni, F. A. A. (2006). Damselflies of Brazil, an illustrated indentification guide II: Coenagrionidae families. (p. 419). São Paulo: All Print Editora.
May, M. L. (1976). Energy metabolism of dragonflies (Odonata: Anisoptera) at rest and during endothermic warm-up. Journal of Experimental Biology, 83, 79–94.
Mayr, E. (1942). Systematics and the origin of species from the viewpoint of a zoologist (p. 334). New York: Columbia Univ. Press.
McCune, B., & J.B. Grace. (2002). Analysis of Ecological Communities. Gleneden Beach: MjM Software Design.
McCune, B., & Mefford, M. J. (2006). PC-ORD. Multivariate Analysis of Ecological Data. Version 5.15 Gleneden Beach, OR:MjM Software.
Nekola, J. C., White, P. S., Carolina, N., & Hill, C. (1999). The distance decay of similarity in biogeography and ecology. Journal of Biogeography, 26, 867– 878.
Nessimian, J. L., Venticinque, E. M., Zuanon, J., Marco, P., Gordo, M., Fidelis, L., Batista, J. D., et al. (2008). Land use, habitat integrity, and aquatic insect assemblages in Central Amazonian streams. Hydrobiologia, 614, 117–131. doi:10.1007/s10750-008-9441-x
Novelo-Gutiérrez, R., & Gómez-Anaya, J. A. (2008). A comparative study of Odonata (Insecta) assemblages along an altitudinal gradient in the sierra de Coalcomán Mountains, Michoacán, Mexico. Biodiversity and Conservation, 18, 679–698. doi:10.1007/s10531-008-9533-y
Quinn, P. & Keough, M. J. (2002). Experimental Design and Data Analysis for Biologists. Cambridge, UK: Cambridge University Press.
Ronquist, F. (1997). Dispersal-Vicariance Analysis: A New Approach to the Quantification of Historical Biogeography. Systematic Biology, 46, 195–203. doi:10.2307/2413643
Samways, M. J. (1989). Insect conservation and the disturbance landscape. Agriculture, Ecosystems & Environment, 27(1-4), 183–194. doi:10.1016/0167- 8809(89)90084-4
Smouse, P. E., Long, J. C., & Sokal, R. R. (1986). Multiple regression and correlation extensions of the Mantel test of matrix correspondence. Systematic Zoology, 35, 627–632.
Statzner, R. B., & Higler, B. (1986). Stream hydraulics as a major determinant of benthic invertebrate zonation patterns. Freshwater Biology, 16, 127–139.
Switzer, P. V. (1997). Factors affecting site fidelity in a territorial animal , Perithemis tenera. Anim. Behav., 53, 865–877.
Thompson, D. J., & Watts, P. C. (2006). The structure of the Coenagrion mercuriale populations in the New Forest , southern England. International Symposium of Odonatology, 1, 239–258.
Van-Strien, M. J., Keller, D., & Holderegger, R. (2012). A new analytical approach to landscape genetic modelling: least-cost transect analysis and linear mixed models. Molecular ecology, 21, 4010–23. doi:10.1111/j.1365- 294X.2012.05687.x
Wallace, J. B., & Webster, J. R. (1996). The role of macroinvertebrates in stream ecosystem function. Annual review of entomology, 41, 115–39. doi:10.1146/annurev.en.41.010196.000555
Ward, J. V., Tockner, K., Arscott, D. B., & Claret, C. (2002). Riverine landscape diversity. Freshwater Biology, 47, 517–539.
