T MICROBIOTA-GUT-BRAIN AXIS AND AUTISM SPECTRUM DISORDER: A SYSTEMATIC REVIEW
REGISTRO DOI: 10.69849/revistaft/ar10202505302237
Beatriz Gonçalves Guimarães¹; Rikelmy Santos Sales²; Benedito dos Santos Alves¹; Nathanael Nascimento dos Santos¹; José Wheslley Rodrigues de Lucena¹; Ivã Sales Magalhães¹; Douglas Soares de Oliveira¹; Vinicius Santos das Chagas¹; Francisco Elezier Xavier Magalhães³; Valécia Natália Carvalho da Silva⁴.
Resumo
O Transtorno do Espectro Autista (TEA) é uma condição complexa do neurodesenvolvimento caracterizada por déficits na comunicação social e comportamentos repetitivos. Estudos recentes sugerem que a microbiota intestinal pode exercer um papel crucial na fisiopatologia do TEA por meio do eixo microbiota-intestino-cérebro. Este estudo realizou uma revisão sistemática da literatura com o objetivo de investigar como alterações na microbiota intestinal influenciam os sintomas comportamentais, cognitivos e gastrointestinais em indivíduos com TEA. Foram selecionados 13 estudos observacionais publicados entre 2015 e 2025, utilizando as bases PubMed, Scielo, Lilacs e ScienceDirect. A maioria dos estudos demonstrou alterações na composição da microbiota de crianças com TEA, com redução da diversidade microbiana e aumento de microrganismos potencialmente patogênicos, como Clostridium, Klebsiella e Proteus. Também foram observadas reduções em bactérias produtoras de butirato, um ácido graxo de cadeia curta com efeitos anti-inflamatórios e neuroprotetores. Os achados apontam para uma relação entre disbiose intestinal e alterações no metabolismo de neurotransmissores, como GABA e glutamato, além de associação com sintomas comportamentais e distúrbios gastrointestinais. A influência de fatores maternos, dieta e localização geográfica sobre o microbioma também foi destacada. Apesar das divergências metodológicas entre os estudos, os resultados reforçam o papel do desequilíbrio microbiano na modulação neurocomportamental do TEA. A modulação da microbiota intestinal, por meio de intervenções como probióticos e dietas específicas, surge como uma abordagem terapêutica promissora, embora mais pesquisas padronizadas e longitudinais sejam necessárias para comprovar sua eficácia.
Palavras-chave: Transtorno do Espectro Autista. Transtornos do Neurodesenvolvimento. Microbiota Intestinal.
1 INTRODUÇÃO
O Transtorno do Espectro do Autismo (TEA) é uma condição do neurodesenvolvimento caracterizada por prejuízos na comunicação social e pela presença de comportamentos repetitivos e restritivos. Essas manifestações variam significativamente entre os indivíduos, podendo ocorrer em diferentes graus de intensidade, desde formas leves até quadros mais severos (Mikhail, 2024). A prevalência global do TEA é estimada entre 0,6% e 1% da população mundial (Salari et al., 2022). No Brasil, dados do Sistema de Informações Ambulatoriais (SIA), divulgados pelo Ministério da Saúde (2022), indicam que, em 2021, foram realizados aproximadamente 9,6 milhões de atendimentos relacionados ao autismo, sendo cerca de 4,1 milhões voltados a crianças de até 9 anos de idade.
A prevalência do Transtorno do Espectro Autista tem apresentado um aumento progressivo nas últimas décadas, o que pode ser parcialmente atribuído ao aprimoramento da conscientização entre profissionais da saúde e da educação, bem como às revisões e ampliações dos critérios diagnósticos estabelecidos, entretanto, as etiologias do TEA ainda não estão completamente elucidadas, sendo amplamente aceito que sua origem decorre de uma complexa interação entre fatores genéticos predisponentes e influências ambientais (Ye et al., 2021).
Nos últimos anos, um número crescente de evidências tem apontado que a microbiota intestinal exerce influência significativa sobre o desenvolvimento e funcionamento do cérebro, por meio do eixo microbiota-intestino-cérebro. Esse eixo representa uma via de comunicação bidirecional entre o sistema nervoso central e o trato gastrointestinal, mediada por sinais neurais, imunológicos, endócrinos e metabólicos. A microbiota intestinal, nesse contexto, desempenha um papel central, modulando processos neurológicos por meio da produção de metabólitos, como os ácidos graxos de cadeia curta (SCFAs), que influenciam a secreção de neurotransmissores, como o ácido gama-aminobutírico (GABA) e a regulação de respostas inflamatórias, afetando assim a homeostase cerebral e comportamental (He et al., 2024).
A disbiose, ou desequilíbrio na microbiota intestinal, tem sido associada a vários problemas de saúde, incluindo distúrbios metabólicos, transtornos mentais e doenças neurodegenerativas, como Alzheimer e Parkinson (Zhang et al., 2024; Zhuang et al., 2024). Além disso, a microbiota intestinal contribui para a integridade das barreiras intestinais e hematoencefálicas, destacando seu papel na manutenção da homeostase e potencialmente oferecendo alvos terapêuticos para distúrbios gastrointestinais e neurológicos (Diviccaro et al., 2024)
No contexto do TEA, a relação entre disbiose intestinal e manifestações clínicas tem sido cada vez mais explorada. Alterações na composição da microbiota intestinal têm sido correlacionadas com sintomas comportamentais e cognitivos característicos do transtorno, possivelmente por influenciarem a inflamação sistêmica e a permeabilidade intestinal, exacerbando manifestações sensoriais e neuropsiquiátricas (Moreno; Ashwood, 2024). A seletividade alimentar, comumente observada em indivíduos com TEA, também representa um fator agravante, uma vez que dietas restritas comprometem a diversidade microbiana, favorecendo o desequilíbrio intestinal (López et al., 2021).
Este trabalho tem como objetivo investigar a conexão entre o eixo microbiota-intestinocérebro e o Transtorno do Espectro Autista (TEA), buscando entender como as alterações na microbiota intestinal podem influenciar os sintomas comportamentais, cognitivos e gastrointestinais associados a essa condição. A importância da pesquisa está fundamentada na crescente evidência científica de que a microbiota exerce um papel fundamental na interação entre o intestino e o sistema nervoso central, afetando diretamente os processos neuroinflamatórios e a saúde mental. A relevância deste estudo reside em sua contribuição para o avanço de estratégias terapêuticas inovadoras voltadas à modulação da microbiota intestinal, fundamentadas em evidências científicas.
2 METODOLOGIA
O presente estudo trata-se de uma revisão sistemática da literatura que objetiva selecionar, avaliar e sintetizar as evidências relevantes disponíveis na literatura sobre o eixo microbiota-intestino-cérebro e o TEA publicados nos últimos 10 anos, utilizando as seguintes bases de dados: PubMed, Science Direct, Scielo e Lilacs via BVS.
O protocolo para esta revisão sistemática foi registrado no International Prospective Register of Systematic Reviews (PROSPERO), número de registro CRD420251044467.
Para desenvolver a revisão procedeu-se com as seguintes etapas: 1) elaboração da pergunta de pesquisa; 2) elaboração da estratégia de busca; 3) definição dos critérios de inclusão e exclusão; 4) seleção dos artigos e 5) extração dos dados.
2.1 Elaboração da pergunta de pesquisa e da estratégia de busca
Foi utilizado a estratégia PICOS (P – population; I – intervention; C – comparison; O – outcomes; S – study), apresentada no Quadro 1, para elaborar a questão de pesquisa. Ademais, foi utilizado os Descritores em Ciências da Saúde (DeCS) juntamente com os operadores booleanos AND e OR para o desenvolvimento da string de busca.
Quadro 1. Estratégia PICOS
| Componente | Definição | Descritores |
| P: população de interesse | Indivíduos com Transtorno do Espectro Autista (TEA) | “Autistic Disorder”, “Autism Spectrum Disorder”, “Neurodevelopmental Disorders” |
| I: intervenção | Presença e composição da microbiota intestinal, incluindo disbiose (desequilíbrio) | “Intestinal Microbiota”, “Gut Microbiota”, “Gastrointestinal Microbiome” |
| C: comparação | Indivíduos com TEA com microbiota equilibrada ou ausência de disbiose intestinal (se aplicável) | – |
| O: resultado/ desfecho | Sintomas clínicos do TEA, incluindo comportamentos e manifestações relacionadas ao transtorno | “Symptoms” [MeSH], “Behavior” [MeSH], “Clinical Manifestations” |
| S: tipo de estudo | Estudos observacionais | – |
A vista disso, a pergunta da pesquisa delimitada foi: “Como a interação da microbiota e o desequilíbrio intestinal influenciam nos sintomas clínicos do Transtorno do Espectro Autista (TEA)?”. Por fim, a string definida foi: “(“Autistic Disorder” OR “Autism Spectrum Disorder” OR “Neurodevelopmental Disorders”) AND (“Intestinal Microbiota” OR “Gut Microbiota” OR “Gut Microbiome”) AND (“Symptoms” OR “Behavior” OR “Clinical Manifestations”)”.
2.2 Critérios de inclusão e exclusão
A partir da definição da problemática, foram delimitados critérios de inclusão e de exclusão. Assim, optou-se por incluir artigos primários observacionais transversais e estudos de caso-controle; com acesso livre ao texto completo; independentemente do idioma; publicados entre 2015 e 2025; com o objetivo de analisar tanto publicações mais recentes quanto estudos anteriores, ampliando a compreensão da relação entre os construtos.
Como critérios de exclusão, artigos que não respondem à pergunta norteadora, que não tratem de microbiota e/ou disbiose no transtorno do espectro do autismo, teses, artigos teóricos, artigos de revisão, artigos duplicados, meta análise, editoriais, comentários sobre artigos, livros e capítulos de livro; que não continham a temática em seu título e resumo.
2.3 Seleção dos artigos
Foi utilizado o software StArt (State of the Art through Systematic Review, versão 2.3.4.2) com a finalidade de exclusão dos artigos duplicados de forma automatizada. Logo após, foi realizada a análise dos títulos, em seguida a leitura dos resumos para identificar quais estudos seriam avaliados por completo, de forma independente (cegamento) por dois avaliadores, em caso de discordâncias um terceiro avaliador se fez necessário para consenso final. Os dados necessários finais foram extraídos por meio de um instrumento com os dados de identificação (autores e ano), população e associação entre microbiota intestinal e TEA.
2.4 Avaliação da qualidade metodológica
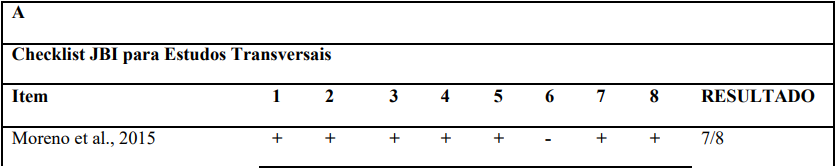
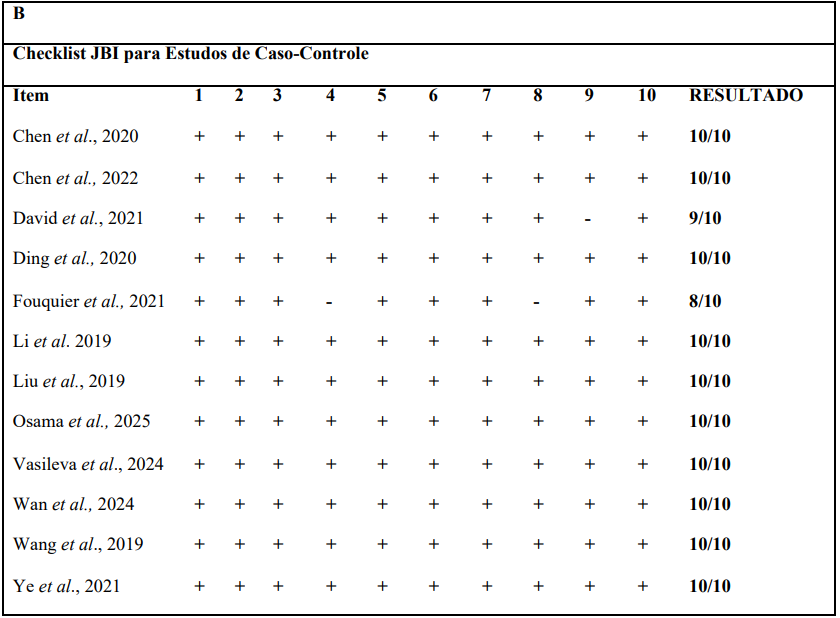
A qualidade metodológica dos estudos foi avaliada utilizando as ferramentas da Joanna Briggs Institute (JBI). Para estudos transversais foi utilizado a JBI Critical Appraisal Checklist for Case Control Studies e para estudos do tipo caso-controle foi utilizado a JBI Critical Appraisal Checklist for Analytical Cross Sectional Studies. As duas ferramentas são semelhantes em estrutura, com perguntas tipo “sim”, “não”, “não aplicável”, “não claro”. No entanto, a ferramenta para estudos transversais apresenta um total de 8 domínios enquanto a ferramenta para estudos do tipo caso-controle apresenta 10 domínios (Barker et al., 2023)
2.5 Extração de dados
Os dados extraídos foram recolhidos, combinados e resumidos para tirar conclusões lógicas dos resultados dos estudos individuais. A síntese considerou a força da evidência e se o efeito observado é consistente entre os estudos, bem como explicações para a possíveis inconsistências. Após reunir, avaliar a qualidade e extrair os dados, as conclusões foram realizadas por meio de uma abordagem narrativa.
2.6 Análise dos resultados
Após a leitura completa, os dados dos estudos incluídos nesta RS foram analisados e apresentados de forma descritiva em um quadro contendo a identificação do estudo (autores e ano), população, objetivos, metodologia e desfecho principal.
3 RESULTADOS
3.1 Seleção dos estudos
Ao todo foram encontrados 418 artigos nas bases de dados usadas (Lilacs 4; PubMed 15; Scielo 1; ScienceDirect 398). Desses, 4 artigos foram excluídos por serem duplicados e 350 foram excluídos pela leitura do título e resumo, resultando em 64 artigos para leitura do texto completo. Em seguida, 4 estudos foram excluídos por impossibilidade de acesso ao texto completo, 15 artigos por abordarem metodologias com murinos, 16 por serem ensaios clínicos e 16 por fugirem da temática. Ao fim, 13 estudos foram selecionados para avaliação da qualidade metodológica, resultando em 13 estudos selecionados para extração de dados (Figura 1).
Figura 1. Fluxograma de seleção de estudos de acordo com as recomendações PRISMA.
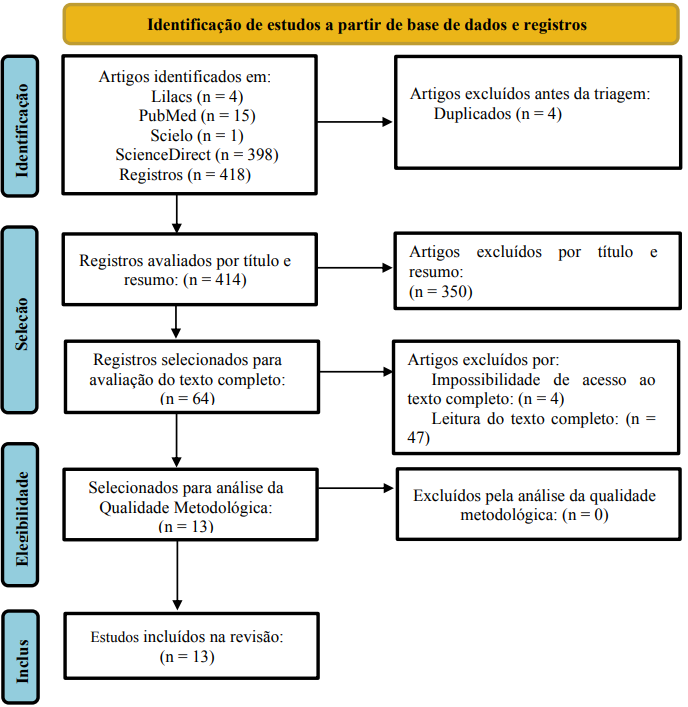
3.2 Qualidade metodológica
Após a avaliação por título e resumo e as exclusões, 13 artigos foram selecionados para a análise metodológica por meio da JBI para estudos transversais (Seção A da figura 2) e da JBI para estudos caso-controle (Seção B da figura 2). Por fim, todos os 13 estudos obtiveram um bom resultado na avaliação. Logo, foram incluídos para extração de dados.
Figura 2. Qualidade metodológica (JBI para estudos transversais e caso-controle).
3.3 Características dos estudos
Dentre os estudos selecionados, 12 eram estudos de caso-controle e apenas um estudo transversal. Visto isso, um estudo foi publicado em 2015, três estudos em 2019, dois estudos em 2020, três estudos em 2021, um estudo em 2022, dois estudos em 2024 e apenas um estudo foi publicado em 2025. Além disso, 12 estudos foram publicados na língua inglesa e apenas um em espanhol. A amostra total continha ao todo 1342 crianças, sendo 817 crianças com TEA (60,9%) e 525 crianças com DT (39,1%). Ademais, dois estudos selecionaram mães de crianças com TEA e mães de crianças com DT para avaliação.
Por fim, mais informações foram alocadas no Quadro 2, contemplando dados referentes à população investigada, aos delineamentos metodológicos empregados e aos principais achados relacionados à microbiota intestinal em indivíduos com Transtorno do Espectro Autista. Essa sistematização permite visualizar de forma integrada os padrões recorrentes e a diversidade de abordagens utilizadas nas pesquisas analisadas.
Quadro 2. Características dos estudos incluídos.
| Autores e ano | População | Objetivos | Metodologia | Resultados |
| Chen et al. (2022) | 82 crianças com TEA e 31 NT | Correlacionar microbiota com sintomas emocionais, comportamentais e GI | Estudo caso-controle. Sequenciamento 16S e escalas clínicas | Alterações microbianas ligadas a sintomas comportamentais; não aos GI |
| Chen et al., 2020 | 76 pares de crianças com TEA e suas mães, juntamente com 47 pares NT e suas mães. | Investigar se bactérias intestinais compartilhadas entre mães e filhos estão associadas ao nível de desenvolvimento e aos déficits sociais em crianças TEA | Estudo caso-controle. Foram coletadas amostras fecais para análise do microbioma intestinal por sequenciamento de DNA. As crianças com TEA também foram avaliadas quanto ao desenvolvimento cognitivo e social usando escalas padronizadas. A análise estatística buscou identificar correlações entre os perfis microbianos compartilhados e os níveis de desenvolvimento e déficits sociais observados nas crianças. | Crianças com TEA e suas mães apresentaram perfis distintos de microbiota intestinal em comparação com o controle. Certos tipos de bactérias intestinais compartilhadas entre mães e filhos com TEA estavam associadas a menores níveis de desenvolvimento e maiores déficits sociais nas crianças. Observou-se que essas assinaturas microbianas poderiam estar envolvidas na modulação do comportamento e no desenvolvimento neurológico. |
| David et al., 2021 | 60 crianças com TEA e 57 NT | Determinar a microbiota intestinal específica que se associa a traços comportamentais em crianças com TEA | Estudo caso-controle. Foram coletadas amostras de fezes dos participantes, juntamente com questionários detalhados sobre dieta, estilo de vida e hábitos gastrointestinais. As amostras foram processadas seguindo o protocolo do American Gut Project. | Crianças com TEA apresentaram maior abundância de certas bactérias e alterações em funções metabólicas microbianas. Também relataram mais sintomas gastrointestinais. Esses achados sugerem que o microbioma pode estar envolvido na fisiopatologia do autismo. |
| Ding et al. (2020) | 77 crianças com TEA e 50 NT | Microbiota e associação com gravidade do TEA | Estudo caso-controle. Sequenciamento 16S e random forest | Maior diversidade em TEA; biomarcadores microbianos associados à gravidade |
| Fouquier et al. (2021) | 49 crianças com TEA e 54 NT | Associar microbioma a TEA e sintomas GI; avaliar mudanças longitudinais | Estudo caso-controle. Sequenciamento com 16S | Composição influenciada por local e sintomas GI; variações associadas a mudanças comportamentais |
| Li. et al. 2019 | 59 pares de mães e filhos de crianças com TEA e 30 pares de mães e filhos NT | Investigar a relação entre os perfis da microbiota intestinal de crianças com TEA e suas mães, bem como identificar possíveis biomarcadores bacterianos que possam auxiliar na avaliação precoce do risco de TEA | Estudo caso-controle. Amostras fecais foram coletadas de todas as mães e crianças para análise da microbiota intestinal. O sequenciamento do gene 16S rRNA foi realizado para identificar e comparar os perfis bacterianos. Análises estatísticas avaliaram as diferenças microbianas entre os grupos e a correlação entre mães e filhos, com o objetivo de identificar potenciais biomarcadores associados ao TEA. | Vários biomarcadores bacterianos exclusivos, como Alcaligenaceae e Acinetobacter, foram identificados. Mães de crianças com TEA tinham mais Proteobacteria, Alphaproteobacteria, Moraxellaceae e Acinetobacter do que mães de crianças NT. Houve uma clara correlação entre os perfis do microbioma intestinal de crianças e de suas mães; no entanto, crianças com TEA ainda apresentavam biomarcadores bacterianos únicos, como Alcaligenaceae, Enterobacteriaceae e Clostridium |
| LIU et al., 2019 | 30 crianças com TEA e 20 NT | Investigar a relação entre microbiota intestinal, ácidos graxos de cadeia curta (SCFAs) e sintomas gastrointestinais em crianças com TEA e NT | Estudo caso-controle. Análise do microbioma intestinal e dos níveis de SCFAs nas fezes por métodos de sequenciamento genético e cromatografia. | Crianças autistas apresentaram menor diversidade microbiana, redução nos níveis de butirato e ácido acético, e aumento do ácido valérico. A constipação foi mais prevalente no grupo TEA. |
| Moreno et al., (2015) | 39 crianças com TEA | Avaliar a microbiota intestinal aeróbica (AMGI) e classificá-la como benéfica, transitória e enteropatogênica em crianças com TEA | Estudo transversal. Foram utilizados meios de cultura seletivos e diferenciais para isolar bactérias enteropatogênicas, benéficas e transitórias, além de meios específicos para recuperação de leveduras e fungos filamentosos. A quantificação foi realizada por UFC/g de fezes, e a identificação dos microrganismos ocorreu por testes bioquímicos, filamentação sérica, métodos automatizados e aglutinação | A análise revelou presença predominante de E. coli como flora benéfica em 87,2% das crianças, enquanto E. faecalis apresentou redução ou ausência em 30,8% dos casos. O crescimento de K. pneumoniae, P. mirabilis e S. marcescens variou significativamente entre os diferentes graus de disbiose (p = 0,030). Dois casos de Campylobacter coli foram identificados como agentes enteropatogênicos. As manifestações gastrointestinais mais frequentes incluíram constipação (38,7%), dor abdominal (25,8%) e diarreia (16,1%) |
| Osama et al. (2025) | 30 crianças com TEA e 30 NT | Multi-ômica: microbiota, metaproteômica e metabolismo | Estudo caso-controle. Integração multiômica com 16S e análise protéica | Menor diversidade microbiana; padrões metabólicos e proteínas alteradas |
| Vasileva et al. (2024) | 92 crianças com TEA, 42 irmãos NT e outras 40 crianças NT para controle | Associação entre eventos maternos adversos e microbiota | Estudo caso-controle. Análise com metagenômica | MIA associada ao diagnóstico de TEA; sem alterações significativas na microbiota |
| Wan et al. (2024) | 60 crianças com TEA e 64 NT | Analisar viroma e interações vírus-bactéria | Estudo caso-controle. Metagenômica com análises de rede e mediação | Menor riqueza viral, redes alteradas e menor capacidade funcional fágica |
| Wang et al., (2019) | 92 crianças com TEA e 42 NT | Investigar as diferenças na composição da microbiota intestinal e nos perfis metabólicos fecais entre crianças com TEA e crianças NT. | Estudo caso-controle. Amostras fecais de crianças com TEA e desenvolvimento típico foram submetidas ao sequenciamento metagenômico do tipo shotgun e à análise metabolômica baseada em cromatografia líquida acoplada à espectrometria de massas (LC-MS) | Houve alterações significativas nos perfis metabólicos intestinais de crianças com TEA, associadas a modificações na composição da microbiota. Observou-se maior abundância de Eggerthella lenta e Clostridium botulinum, além de redução de Bacteroides vulgatus, correlacionando-se com distúrbios no metabolismo de compostos aromáticos, glutamato e ácidos biliares. |
| Ye et al. (2021) | 71 meninos com TEA e 18 NT | Avaliar composição da microbiota e identificar biomarcadores diagnósticos | Estudo caso-controle. Análise 16S e metagenômica | Diferenças marcantes entre grupos; AUC do modelo preditivo: 0,947 |
4 DISCUSSÃO
Nos últimos anos, o crescente interesse pelo eixo microbiota-intestino-cérebro tem revelado novas perspectivas sobre os mecanismos envolvidos no desenvolvimento e na manifestação de transtornos neuropsiquiátricos, como o Transtorno do Espectro Autista (TEA). Este eixo representa uma via bidirecional de comunicação entre o sistema nervoso central, o sistema imunológico, o trato gastrointestinal e a microbiota intestinal, sendo modulada por sinais neurais, hormonais, metabólicos e imunológicos. Evidências acumuladas indicam que alterações na composição e função da microbiota intestinal, conhecidas como disbiose, podem impactar diretamente processos neurodesenvolvimentais e comportamentais, por meio da produção de metabólitos bioativos, da modulação da barreira hematoencefálica e da ativação de respostas inflamatórias (Lewandowska-Pietruszka, Figlerowicz and Mazur-Melewska, 2023).
Os achados de David et al. (2021) reforçam a hipótese de que a microbiota intestinal desempenha um papel relevante na fisiopatologia do Transtorno do Espectro Autista (TEA), independentemente de fatores ambientais compartilhados. Ao comparar crianças com TEA a seus irmãos neurotípicos, ambos convivendo no mesmo ambiente, observou-se um perfil microbiano intestinal significativamente distinto entre os grupos, com a identificação de 21 variantes de sequência de amplicon (ASVs) diferencialmente abundantes. No grupo TEA, destacaram-se bactérias das famílias Ruminococcaceae e Bacteroidaceae, enquanto nos controles houve predomínio de Lachnospiraceae, a qual se destaca por sua capacidade de produzir butirato, um ácido graxo de cadeia curta com efeitos neuroprotetores. A análise funcional preditiva revelou que os microrganismos predominantes nas crianças com TEA apresentam maior potencial genético para a síntese de butirato por meio da via metabólica do 4-aminobutirato (GABA), o que pode afetar diretamente a disponibilidade de neurotransmissores como glutamato e GABA, ambos associados às alterações neuroquímicas características do autismo.
Diferenças entre o microbioma intestinal de crianças com TEA e neurotípicos também foram relatadas no estudo de Wang e colaboradores (2019), ao comparar um total de 92 crianças com TEA e 42 crianças com desenvolvimento típico quanto à constituição de seu microbioma intestinal. Os dados do estudo revelaram que crianças com TEA apresentam quantidades menores de espécies bacterianas em comparação com crianças com desenvolvimento típico. O grupo de crianças com TEA apresentou níveis elevados de Clostridium, Eggerthella e Klebsiella, ao passo que apresentavam baixos níveis de Bacteroides vulgatus, Betaproteobacteria, Campylobacter jejuni, Coraliomargarita akajimensis, Proteus mirabilis e Spirochaeta thermophila. Ademais, as alterações na composição do microbioma intestinal foram relacionadas a alterações no metabolismo do glutamato, devido a diminuição de ácido 2-ceto-glutarâmico, o ácido l -aspártico e o ácido fumárico em pacientes autistas. Desse modo, alterações na composição dos metabólitos intestinais em crianças com TEA, se relacionam a mudanças na composição da microbiota intestinal.
Os resultados obtidos por Li et al., (2019) demonstram alterações significativas na composição da microbiota intestinal de crianças com TEA, quando comparadas a controles neurotípicos. Observou-se maior riqueza bacteriana e aumento na abundância de gêneros potencialmente patogênicos, como Acinetobacter, Alcaligenaceae, Enterobacteriaceae e Clostridium, além da redução de Prevotella melanogenica. As mães dessas crianças também apresentaram perfis microbianos distintos, com elevação de Proteobacteria, Alphaproteobacteria e Moraxellaceae, sugerindo que a microbiota materna pode influenciar o risco de desenvolvimento do TEA. Apesar da correlação entre os perfis microbianos de mães e filhos com TEA, as crianças exibiram biomarcadores exclusivos, indicando a presença de fatores adicionais modulando a colonização intestinal. Complementarmente, estudos como o de Chen et al., (2020) evidenciaram a redução de famílias como Lachnospiraceae e Ruminococcaceae, além do gênero Bifidobacterium, microrganismos associados à produção de metabólitos neuroativos, como butirato, acetato e GABA. A diminuição desses compostos pode comprometer a integridade da barreira hematoencefálica e a neurotransmissão, reforçando a hipótese de que a disbiose intestinal desempenha papel relevante na fisiopatogênese do TEA.
Por outro lado, estudos reforçam a hipótese de que crianças com Transtorno do Espectro Autista (TEA) apresentam disbiose intestinal em distintos graus, evidenciada pela predominância de microrganismos aeróbios potencialmente patobiontes, como Klebsiella pneumoniae, Proteus mirabilis e Serratia marcescens. Proteus mirabilis e Serratia marcescens. Segundo Moreno et al. (2015), a presença aumentada desses microrganismos, integrantes da microbiota transitória, pode indicar um desequilíbrio ecológico associado a disfunções funcionais e imunológicas da mucosa intestinal. Embora não tenha sido observada uma correlação estatisticamente significativa entre os graus de disbiose e as manifestações gastrointestinais ou comportamentais, a frequência e a variedade dos sintomas relatados neste grupo se alinham a achados prévios descritos na literatura.
Os achados relatados por Ye et al., (2021), David et al., (2021), Liu et al., (2019) e Ding et al., (2020) corroboram entre si de forma consistente com as evidências que apontam a disbiose intestinal como um componente central na fisiopatologia do TEA, sobretudo pela influência sobre o eixo intestino-cérebro e a modulação de metabólitos neuroativos. Assim como observado nestes estudos, houve alterações na abundância de filos bacterianos, com destaque para o aumento de Firmicutes e a redução de Bacteroidetes, implicando em uma menor razão Bacteroidetes/Firmicutes — padrão frequentemente associado à inflamação sistêmica. Além disso, a redução de gêneros produtores de butirato, como Faecalibacterium, e a presença aumentada de Lachnoclostridium e Collinsella — microrganismos com impacto negativo no metabolismo lipídico e na função de barreira intestinal — corroboram a hipótese de que o desequilíbrio microbiano pode afetar a produção de SCFAs de forma qualitativa e quantitativa. Embora o papel do butirato ainda apresenta controvérsias quanto à sua concentração em indivíduos com TEA, há consenso sobre sua relevância na integridade da barreira intestinal e modulação imunoneuroendócrina. Assim, os dados de ambos os estudos fortalecem a proposta de que intervenções capazes de restaurar o equilíbrio da microbiota intestinal e modular a produção de SCFAs, especialmente o butirato, podem representar estratégias terapêuticas promissoras no contexto do TEA.
Por outro lado, Vasileva et al., (2024) identificaram que, embora a ativação imune materna (AIM) tenha se associado ao aumento do risco de transtorno do espectro autista (TEA), não foram encontradas evidências robustas de que AIM ou estresse materno (SM) impactem diretamente a composição do microbioma intestinal da prole a longo prazo. Esses resultados contrastam com estudos experimentais em modelos animais, onde alterações microbianas foram frequentemente relatadas, destacando a limitada reprodutibilidade e a complexidade de transpor dados pré-clínicos para contextos humanos. A ausência de associação entre AIM/SM e o microbioma infantil pode refletir tanto a baixa sensibilidade das medidas retrospectivas utilizadas quanto o predomínio de fatores ambientais pós-natais, como dieta, idade e estilo de vida, na modulação do ecossistema intestinal. Adicionalmente, a inconsistência entre os táxons relatados em diferentes estudos reforça a necessidade de abordagens longitudinais e prospectivas que considerem a trajetória do microbioma desde o período gestacional até a infância, bem como a interação dinâmica entre fatores maternos, ambientais e microbianos na etiologia do TEA.
Chen e colaboradores (2022), também relataram diferenças significativas em microbiotas específicas do microbioma intestinal entre pacientes com TEA e indivíduos neurotípicos. De acordo com os dados do estudo, ambos os grupos apresentaram número semelhante de espécies diferentes, entretanto o grupo TEA apresentou espécies mais complexas, representado pelo aumento de um dos parâmetros na análise de diversidade. Nesse estudo, o grupo TEA apresentou aumentos significativos na abundância relativa de Fusobacteria, Fusobacteriaceae, Fusobacterium e Prevotellaceae. A maioria dos participantes da pesquisa apresentaram pontuações mais altas em relação aos sintomas gastrointestinais, entretanto, não foram encontradas associações entre esses sintomas, a microbiota e o TEA. Ademais, os autores sugerem que a composição microbiana possa estar ligada aos sintomas autistas e a problemas emocionais/comportamentais, haja vista que pacientes com TEA apresentaram maiores funções microbianas associadas ao metabolismo de aminoácidos, lipídios, produção de energia e processos digestivos, que podem se relacionar com a ocorrência de comportamentos correlacionados ao TEA.
Apesar de as bactérias intestinais serem os microrganismos mais populares na avaliação de sua associação com o transtorno do espectro autista, o intestino humano também pode ser colonizado por uma diversidade de vírus, em especial, por bacteriófagos. Nesse sentido, Wan e colaboradores (2024), investigaram a composição viral intestinal e a interação entre as bactérias e vírus em crianças com autismo. Como descrito pelos autores, as crianças com TEA apresentaram o viroma de DNA intestinal divergente em composição e diversidade em comparação às crianças neurotípicas, de modo que pacientes com TEA apresentaram uma menor riqueza de diversidade e maior heterogeneidade do que as crianças com desenvolvimento típico. Nesse estudo, crianças com TEA apresentaram maior abundância de fagos intestinais de Clostridium, Bacillus e Enterobacteria. Os resultados sugerem que mudanças na abundância destes fagos podem se relacionar à disbiose no sistema ecológico viral intestinal. Ademais, os autores descreveram que o efeito dos bacteriófagos na modulação de processos de codificação da biossíntese de metabólitos neuroativos foi prejudicado no TEA, ocasionando o comprometimento dos processos fisiológicos mediados por esses microrganismos e, possivelmente, influenciando na patogênese do TEA.
Osama et al., (2025), relatou que pacientes com TEA apresentaram diversidade microbiana significativamente menor em comparação com pacientes de desenvolvimento típico. Os pacientes com TEA apresentaram maiores níveis de Tyzzerella, Sarcina, Anaerostipes, Romboutsia, Blautia, Fusicatenibacter, Intestinibacter e Bifidobacterium, em oposição à redução de Mitsuokella, Butyrivibrio, Fusobacterium, Paraclostridium, Catenibacterium, Solobacterium e Granulicatella. Nesse estudo, os autores identificaram o aumento da produção de proteínas derivadas de Bifidobacterium, as quais apresentaram-se elevadas em pacientes autistas e podem estar relacionadas à hiperatividade associada ao TEA. Adicionalmente, também foram detectadas correlações entre metabólitos intestinais em desequilíbrio em pacientes com TEA e a presença de gêneros específicos, incluindo Blautia, Romboutsia e Anaerostipes. Ademais, a redução dos microrganismos associados à produção de ácidos graxos de cadeia curta (AGCC), incluindo Mitsuokella, Butyrivibrio e Fusobacterium, também foi relatada, podendo estar relacionada ao desequilíbrio na função e no comportamento cerebral, afetando o comportamento de pacientes com TEA. Por fim, destaca-se que alguns neurotransmissores, como glutamato e 3,4-di-hidroxifenilacetato, foram identificados exclusivamente em indivíduos com TEA, o que pode sugerir seu envolvimento na fisiopatologia do TEA.
Segundo os dados obtidos por Fouquier e colaboradores (2021), evidencia-se que fatores geográficos, especialmente o local de recrutamento dos participantes, exercem uma influência mais significativa sobre a composição do microbioma intestinal do que o próprio diagnóstico de Transtorno do Espectro Autista (TEA). A comparação entre as coortes do Arizona (AZ) e Colorado (CO) revelou disparidades significativas na diversidade e abundância de táxons bacterianos, como Prevotella e Coprococcus, sugerindo que fatores regionais — possivelmente relacionados à dieta, estilo de vida e clima — modulam profundamente o perfil microbiano intestinal. Essa heterogeneidade dificulta a generalização dos resultados entre diferentes populações e ressalta a necessidade de estudos multicêntricos padronizados. Além disso, a análise longitudinal demonstrou que alterações no microbioma estão associadas à gravidade de sintomas comportamentais específicos do TEA, como letargia/retraimento social e fala inadequada, independentemente de distúrbios gastrointestinais concomitantes ou mudanças dietéticas. Esses achados reforçam a hipótese de que o microbioma intestinal pode desempenhar um papel modulador na expressão fenotípica do TEA, especialmente em relação aos comportamentos centrais do transtorno.
5 CONSIDERAÇÕES FINAIS
Em resumo, com base nos estudos analisados, é possível concluir que a disbiose intestinal desempenha um papel relevante na fisiopatologia do Transtorno do Espectro Autista (TEA), influenciando não apenas aspectos gastrointestinais, mas também neurocomportamentais, por meio da modulação do eixo intestino-cérebro e da produção de metabólitos neuroativos, como os ácidos graxos de cadeia curta (AGCC). A diversidade microbiana reduzida, o aumento de microrganismos potencialmente patogênicos e a diminuição de bactérias produtoras de butirato aparecem como padrões recorrentes entre indivíduos com TEA.
Ainda que existem divergências metodológicas e resultados variáveis quanto à composição do microbioma entre diferentes estudos frequentemente atribuídos a fatores como dieta, localização geográfica e características individuais, mas a um consenso sobre a importância do equilíbrio microbiano para a saúde intestinal e neurológica. Dessa forma, intervenções terapêuticas voltadas à modulação da microbiota intestinal, seja por meio de probióticos, prebióticos, dieta ou transplante de microbiota fecal, configuram-se como estratégias potenciais na abordagem integrativa do TEA, embora mais estudos longitudinais, padronizados e multicêntricos sejam necessários para validar sua eficácia e segurança.
REFERÊNCIAS
BARKER, T. H. et al. Revising the JBI quantitative critical appraisal tools to improve their applicability: an overview of methods and the development process. JBI evidence synthesis, v. 21, n. 3, p. 478–493, 2023.
CHEN, Y. C. et al. Altered gut microbiota correlates with behavioral problems but not gastrointestinal symptoms in individuals with autism. Brain, Behavior, and Immunity, v. 106, p. 161–178, 1 nov. 2022.
CHEN, Y. et al. Gut Bacteria Shared by Children and Their Mothers Associate with Developmental Level and Social Deficits in Autism Spectrum Disorder. mSphere, v. 5, n. 6, p. e01044-20, 23 dez. 2020.
DAVID, M. M. et al. Children with Autism and Their Typically Developing Siblings Differ in Amplicon Sequence Variants and Predicted Functions of Stool-Associated Microbes. mSystems, v. 6, n. 2, p. e00193-20, 27 abr. 2021.
DING, X. et al. Gut microbiota changes in patients with autism spectrum disorders. Journal of Psychiatric Research, v. 129, p. 149–159, 1 out. 2020.
DIVICCARO, S. et al. The gut‐microbiota‐brain axis: Focus on gut steroids. Journal of neuroendocrinology, 2024.
FOUQUIER, J. et al. The Gut Microbiome in Autism: Study-Site Effects and Longitudinal Analysis of Behavior Change. mSystems, v. 6, n. 2, p. e00848-20, 27 abr. 2021.
HE, Y. et al. Microbiota–gut–brain axis in health and neurological disease: Interactions between gut microbiota and the nervous system. Journal of cellular and molecular medicine, v. 28, n. 18, 2024.
LEWANDOWSKA -PIETRUSZKA, Z.; FIGLEROWICZ, M.; MAZUR-MELEWSKA, K. Microbiota in Autism Spectrum Disorder: A Systematic Review. International Journal of Molecular Sciences, v. 24, n. 23, p. 16660, 1 dez. 2023.
LI, N. et al. Correlation of Gut Microbiome Between ASD Children and Mothers and Potential Biomarkers for Risk Assessment. Genomics, Proteomics & Bioinformatics, v. 17, n. 1, p. 26, 1 fev. 2019.
LIU, S. et al. Altered gut microbiota and short chain fatty acids in Chinese children with autism spectrum disorder. Scientific Reports, v. 9, n. 1, 1 dez. 2019.
LÓPEZ, M. et al. Implicación de la disbiosis intestinal en la etiopatogenia y el tratamiento del trastorno del espectro autista: una revisión bibliográfica. Revista de neurologia, v. 73, n. 08, p. 282, 2021.
MIKHAIL, M. Autism spectrum disorder (an update). Biomedical journal of scientific & technical research, v. 56, n. 4, 2024.
MORENO, R. J.; ASHWOOD, P. An update on microbial interventions in autism spectrum disorder with gastrointestinal symptoms. International journal of molecular sciences, v. 25, n. 23, 2024.
MORENO, X. et al. Microbiota gastrointestinal aeróbica en niños con trastorno del espectro autista. Estudio preliminar. Gen, v. 69, n. 2, p. 36–44, 2015.
OSAMA, A. et al. Integrative multi-omics analysis of autism spectrum disorder reveals unique microbial macromolecules interactions. Journal of Advanced Research, 25 jan. 2025.
SALARI, N. et al. The global prevalence of autism spectrum disorder: a comprehensive systematic review and meta-analysis. Italian journal of pediatrics, v. 48, n. 1, 2022.
VASILEVA, S. et al. Absence of association between maternal adverse events and long-term gut microbiome outcomes in the Australian autism biobank. Brain, Behavior, & Immunity – Health, v. 39, p. 100814, 1 ago. 2024.
WAN, Y. et al. Alterations in fecal virome and bacteriome virome interplay in children with autism spectrum disorder. Cell Reports Medicine, v. 5, n. 2, p. 101409, 20 fev. 2024.
WANG, M. et al. Alterations in Gut Glutamate Metabolism Associated with Changes in Gut Microbiota Composition in Children with Autism Spectrum Disorder. mSystems, v. 4, n. 1, p. e00321-18, 26 fev. 2019.
YE, F. et al. Comparison of gut microbiota in autism spectrum disorders and neurotypical boys in China: A case-control study. Synthetic and systems biotechnology, v. 6, n. 2, p. 120–126, 2021.
ZHANG, Y. et al. Gut microbiota in health and disease: advances and future prospects. MedComm, v. 5, n. 12, 2024.
ZHUANG, M.; ZHANG, X.; CAI, J. Microbiota–gut–brain axis: interplay between microbiota, barrier function and lymphatic system. Gut microbes, v. 16, n. 1, 2024.
¹Discente do Curso Superior de Biomedicina da Universidade Federal do Delta do Parnaíba. E-mail: beatrizguimaria28@gmail.com;
²Discente do Curso de Pós-Graduação em Ciências Biomédicas da Universidade Federal do Delta do Parnaíba;
³Docente do Curso Superior de Fisioterapia da Universidade Federal do Delta do Parnaíba;
⁴Docente do Curso Superior de Biomedicina da Universidade Federal do Delta do Parnaíba. Doutora em Biotecnologia – RENORBIO (PPGBiotec/UFDPar). E-mail: valeciacs@gmail.com.
