REGISTRO DOI: 10.5281/zenodo.8383991
Silvia Mara Haluch1
Flavia Caroline Haluch2
RESUMO: O ozônio (O3) é um gás com característica altamente oxidante, com o poder de clivar ligações duplas e triplas entre carbonos e agir nas células desestruturando paredes e membranas de diversos microrganismos. O sucesso do ozônio no tratamento de efluentes industriais e sanitários, consiste no fato de fragmentar as ligações covalentes das substâncias químicas orgânicas, eliminar compostos voláteis, dissociar compostos de alto peso molecular e aumentar a oxigenação e consequentemente menores impactos aos organismos aquáticos e ao Ecossistema. Sabe-se que no Brasil, os estudos voltados para testes com ozônio em estações de tratamentos de efluentes ainda são escassos e ocorrem poucas iniciativas para testes voltados ao tema, mesmo sendo altamente difundido e utilizado em outros países. Para tanto, esse trabalho visa ampliar o conhecimento e apresentar a versatilidade do ozônio para o tratamento de efluentes em uma estação projetada e um projeto-piloto laboratorial para testes em efluentes sanitários e industriais, respectivamente. Os parâmetros testes foram baseados na NBR ISO 30.500:2021 e os resultados com ozônio se mostraram altamente satisfatórios pelo uso de 1 a 5 horas de contato. A Estação ELISA apresentou eficiência de remoção, em 2 horas de 93,3% de DQO, 96,9% de sólidos, 88% de nitrogênio total, 97,7% de fósforo e eliminação das bactérias do grupo coliformes e parasitas intestinais. Para a estação piloto laboratorial em 5 horas de contato, trazem 95% de eficiência de remoção de DQO, 81,3% para sólidos, 80,3% para nitrogênio total, 86,2 % para fósforo e eliminação das bactérias do grupo coliformes e parasitas intestinais. Dessa forma, é possível otimizar estações de tratamentos industriais e domésticos e ampliar o uso de ozônio no país, atendendo as novas tendências biológicas e atuar nos princípios de sustentabilidade, proteção ambiental e sistema de gestão com foco em melhoria contínua.
Palavras Chave: microbiologia, parasitas, DQO, ETE, ELISA.
ABSTRAT: Ozone (03) is a gas with a highly oxidizing characteristic, with the power to cleave double and triple bonds between carbons and act on cells by disrupting walls and membranes of various microorganisms. The success of ozone in the treatment of industrial and sanitary effluents consists in the fact of fragmenting the covalent bonds of organic chemicals, eliminating volatile compounds, dissociating compounds of high molecular weight and increasing oxygenation and consequently lower impacts to aquatic organisms and the ecosystem. It is known that in Brazil, studies focused on ozone testing in effluent treatment plants are still scarce and there are few initiatives for tests focused on the subject, even though it is highly widespread and used in other countries. Therefore, this work aims to expand the knowledge and present the versatility of ozone for the treatment of effluents in a designed station and a laboratory pilot project for tests on sanitary and industrial effluents, respectively. The test parameters were based on NBR ISO 30.500:2021 and the results with ozone were highly satisfactory by the use of 1 to 5 hours of contact. The ELISA Station showed removal efficiency in 2 hours of 93.3% COD, 96.9% solids, 88% total nitrogen, 97.7% phosphorus and elimination of bacteria of the coliform group and intestinal parasites. For the laboratory pilot station in 5 hours of contact, they bring 95% efficiency of COD removal, 81.3% for solids, 80.3% for total nitrogen, 86.2% for phosphorus and elimination of bacteria of the coliform group and intestinal parasites. In this way, it is possible to optimize industrial and domestic treatment plants and expand the use of ozone in the country, meeting the principles of sustainability, environmental protection and management system with a focus on continuous improvement.
Keywords: microbiology, parasites, COD, ETE, ELISA.
INTRODUÇÃO
O Ozônio (03) é uma substância química derivada do alótropo do Oxigênio (O2) quando há presença de radiação ultravioleta oriunda do sol ou quando ocorre descargas elétricas. Em altas concentrações o ozônio é um gás levemente azulado com ponto de fusão de -192° C e ponto de ebulição de -112° C (Sapers et al., 1998; Oller et al., 2011). No estado líquido assume carácter explosivo e em grau puro, possui odor pungente e característico que o garantiu o nome grego “cheirar” (Kurmiawan et al., 2006; Hassemer et al., 2002). O ozônio é um gás com característica altamente oxidante (Langlais et al., 1991; Perchonok et al., 2005), tendo um poder de clivar ligações covalentes entre carbonos o que o torna um dos processos de oxidação e desinfecção mais eficientes em relação a agentes como cloro, quartenários de amônio e outros (Reynolds et al., 1989; Perchonok et al., 2005; Luis et al., 2013; Anzoli et al, 2018; Duarte et al., 2022).
O sucesso do ozônio no tratamento de efluentes industriais consiste no fato de fragmentar as ligações duplas e triplas entre carbonos e alterar ou desestruturar paredes membranosas de diversos microrganismos (Perchonok et al., 2005; Oller et al., 2011; Languais et al., 1991; Kurniawan et al., 2006; Hassemer et al.,2002; Amorin et al., 2009; Billota et al., 2011). O ozônio é altamente utilizado como processo de tratamento de água potável (Bocci, 2005; Luis et al., 2013; Lima et al., 2021; Duarte et al., 2022).
A obtenção do gás, para uso industrial, está baseada em processo elétrico com geradores, eletrodos e com a utilização do ar atmosférico, que possui em média de 21 a 22 % de oxigênio. O uso da radiação ultravioleta é o mesmo processo de sintetização da natureza. A obtenção de gás, em tanques de tratamento, é conquistado pelo fato do ozônio ser moderadamente solúvel em água. Porém, boa parte desse gás é perdido para atmosfera e outra parcela reage com as moléculas dissolvidas (Anzoli et al., 2018; Sapers et al., 1998). Em contato com a água, o processo inicia com a formação de íons hidroxila OH, formando consequentemente, os radicais hidroperoxil e superóxido, que participam de diversas reações em cadeia, culminando na degradação e oxidação da matéria orgânica e outros compostos indesejáveis (Ukuku et al., 2012). Além do poder oxidante da hidroxila, o próprio ozônio dissolvido, reage com os hidrocarbonetos alifáticos, hidrocarbonetos aromáticos, fenóis, aldeídos, cetonas, ácidos orgânicos, álcoois, polissacarídeos, ésteres de ácidos graxos, gorduras insaturadas e saturadas, além de reagir com íons metálicos, processo nomeado como POA – Processos oxidativos avançados (Duarte et al., 2022; Reynolds et al., 1989).
Inúmeros trabalhos já relatam da remoção de íons metálicos, compostos orgânicos e aromáticos em águas industriais, naturais e despejos domésticos. O processo de oxidação química visa à remoção de elétrons de uma substância aumentado seu estado oxidativo (Lima et al., 2021; Luis et al., 2013).Quando se trata de ozônio a reação é termodinamicamente espontânea, porém cineticamente lenta, portanto, requer tempo de permanência estendidas para alcançar o fim pretendido. Quanto maior a capacidade do gerador mais eficiência no poder oxidativo (Amorin et al., 2009; Hassemer et al.,2002; Oller et al., 2011).
O tropismo por compostos orgânicos também atribui sua toxicidade para a saúde humana. Em meio alcalino a sua ação se intensifica podendo atuar além da oxidação de compostos, como meio de arraste conhecido por striping, movendo elementos para a atmosfera gasosa e eliminando portanto, compostos voláteis (Duarte et al., 2022; Oliveira et al., 2018; Lima et al., 2021).
Os primeiros usos de ozônio foram para eliminar fungos, bactérias, vírus e agente de branqueamento em indústrias têxteis (Ukuku et al., 2012). Na primeira guerra mundial um hospital Inglês iniciou o uso do ozônio para curar feridas e assim surgiu a ozonioterapia, que é a técnica farmacológica e clínica para tratamentos alternativos medicinais (Bocci, 2005; Reynolds et al., 1989). Os primeiros relatos trazem a eficácia de feridas e infecções cutâneas por até 15 minutos. Atualmente existem milhares de publicações de diversas formas de aplicações e estratégias de tratamento em áreas de difíceis cicatrizações ou infecções crônicas de patógenos diversos, aos quais incluem desde aplicação direta, água ozonizada e óleos. Quase por totalidade, os dados dos estudos trazem beneficios em feridas diabéticas, poder antifúngico em micoses, poder cicatrizante e antimicrobiano e poucos casos de efeitos colaterais maléficos (Amorin et al., 2009; Billota et al., 2011; Anzoli et al., 2018).
Na indústria alimentícia o ozônio é utilizado não somente como desinfetante mais como agente conservador de alimentos devido à sua ação e baixo teor residual. Em 2020, período pandêmico causado pelo SARS-CoV-2, houve a necessidade e alternativas de desinfecções rápidas de ambientes e o ozônio foi impulsionado em diversas áreas de procedimentos no ramo da saúde (Duarte et al., 2022). Dessa forma, diversas empresas e cientistas atuaram no desenvolvimento de processos de pulverização, equipamentos, câmaras e outros, a fim da garantir a qualidade de desinfecção e compreender o mecanismo de ação do ozônio perante microrganismos de interesse clínico.
Desde 1991, foram observadas e publicadas a ação do ozônio em células, sendo seu principal mecanismo, a penetração das moléculas ativas do ozônio e a desorganização da membrana plasmática, causando exposição e transbordamento do material intracelular, conforme observado na figura 01 (Langlais et al., 1991; Sapers et al., 1998).
Figura 01: 1. Célula bacteriana em perfeito estado; 2. Ozônio entrando em contato com a parede celular; 3. Ozônio reagindo e criando uma fenda na célula; 4. Estrutura celular danificada; 5.Começo da desintegração; 6 Célula bacteriana destruída.

No ramo de tratamento de efluentes, que visa tornar um líquido contendo substâncias tóxicas ou elementos que possam causar efeitos deletérios ao ecossistema em água tratada, isenta de componentes que geram impacto ambiental, várias técnicas são usadas para garantir um descarte adequado e até mesmo, buscar reúso desse bem tão escasso. As estações de tratamento de efluentes – ETES, visam constantemente melhoria contínua, e para tanto, inserem diversos processos, aos quais são de operação físico- químico e biológicos, em prol do melhor cenário, a fim de atender padrões legislativos cada vez mais apertados. Estudos visando à eficácia em ETES são largamente publicados constantemente, desde inovações de agentes coaguladores, polímeros, materiais adsorventes para filtração, separadores, decantadores, flotadores, reatores, centrífugas, prensas e muitos outros, com novas tecnologias e altas performances (Haluch et al., 20233).
Mesmo com tamanha versatilidade ainda são escassos o uso em larga escala de ozônio no Brasil. Segundo a Abiclor Associação Brasileira da Indústria de cloro álcalis e derivados, devido ao marco legal do Saneamento, Lei 14.026 (2020) a produção de cloro se intensificou e atinge o patamar dos produtos mais fabricados no Brasil. Em comparação, segundo dados da Associação Brasileira de ozônio Abraozônio, mais de 80% dos países usam ozônio no tratamento de água, porém, por causa do extenso uso no Brasil, o cloro está em primeiro lugar e ozônio em segundo na escala global.
Visando essa nova demanda mundial a Organização Mundial de Padronização – ISO, publicou recentemente uma normativa que instrui e padroniza sobre requisitos gerais e desempenho de sistemas de saneamento. A análise de desempenho é medido de acordo com as especificações sendo dividida em Classe 1: tratamento não biológico (ex: fotoquímico, ozonólise e outros); Classe 2: tratamento biológico e Classe 3: junção de técnicas físicas, químicas e biológicas. Essa padronização traz um viés parasitológico e microbiológico muito importante após o período pandêmico, visando pesquisa de patógenos de interesse clínico e atendendo uma lacuna em relação as legislações ambientais (NBR 30.500, 2021).
A nova visão patológica introduz parâmetros microbiológicos e parasitológicos em normativas, que até o momento, eram desconsideradas nas legislações nacionais e internacionais (Haluch et al., 2023).
Portanto, esse trabalho tem o objetivo de avaliar a eficiência do ozônio em tratamentos de efluentes domésticos e industriais, segundo os parâmetros indicados pela NBR ISO 30.500 e fornecer uma base científica para melhorias em estações de tratamentos.
Parâmetros físicos e químicos
Os parâmetros físicos e químicos para monitoramento da eficiência de um processo de tratamento e controle de qualidade, visam ensaios que tragam respostas analíticas em prol da garantia de tratabilidade de uma ETE. As técnicas são universalmente padronizadas, normalizadas e publicadas. Os métodos físicos e químicos requerem resultados diretos ou indiretos de um mensurando, envolvendo mecanismos de radiação, adsorção, emissão, derivação, reação convencional entre reagentes e diversos outros princípios coligativos. (APHA, 2023).
Esses ensaios são de extrema relevância tanto na determinação da eficiência de um processo como parâmetros regulatórios de órgãos ambientais. As principais técnicas utilizados para tal fim, são a espectrofotometria, gravimetria, titulometria, cromatografia, volumetria, eletrometria e outras descritas e publicadas por agências de proteção ambiental. (US EPA, SW-846).
Parâmetros biológicos
A OMS Organização Mundial da Saúde em 2017, publicou a lista de parâmetros microbiológicos de prioridade máxima, baseado na mortalidade e perfil de resistência aos tratamentos medicamentosos atuais. Os gêneros que ganham destaque estão a família Enterobacteriaceae, gram negativas, representada por KPcKlebsiellla pneumoniae, Escherichia coli, Serratia ssp, Proteus spp, Enterobacter spp, Morganela spp, Providencia spp, gamaproteopacterias, e os gêneros Acinetobacter e Pseudomonas, todas essas, fazem parte do grupo das Proteobactérias (Haluch et al., 2023©).
Além da microbiologia, parâmetros parasitológicos ganham força no contexto internacional devido ao avanço da epidemiologia. Algumas diretrizes ambientais no tocante aos lodos e resíduos sólidos destinados para fins de agricultura, devem ser analisados os ovos viáveis de helmintos, contagem de coliformes termotolerantes e Salmonela spp antes da sua disposição no solo (Brasil, 2006).
As legislações nacionais e internacionais se baseiam principalmente no indicador fecal Escherichia coli e a contagem de coliformes totais e termotolerantes para classificar águas superficiais e subterrâneas (Brasil, 2005; Brasil, 2008). Esses parâmetros contemplam as Enterobactérias, sendo excelentes indicadores de contaminação ambiental. Entretanto, em controles de estações de tratamento de efluentes, tanto sanitários como industriais, sequer citam ou possuem alguma referência legislada no seguimento de parâmetros biológicos (Brasil, 2011, Haluch et al., 2023a).
MATERIAIS E MÉTODOS
ESTAÇÃO CASO
Foram avaliadas dois cenários sendo uma ETE compacta comercial para tratamento sanitário e um piloto laboratorial para estudo de tratamento de efluente industrial. A estação compacta é da empresa ELISA – Efluentes limpos Soluções Ltda (figura 02), foi utilizada para testes com efluentes domésticos. Essa estação é projetada em reservatórios de aço inox ou polipropileno, e o tamanho varia conforme a capacidade, sendo para o estudo, 10 m3/h, com tensão de 220V trifásico. Projetada para alta robustez obtendo a eficiência em altas e baixas umidades relativas do ar atmosférico e temperatura ambiente, possui a eficiência em média medida pelo fabricante de 80% para efluentes com cargas de 2.500 mg/L O2 de DQO com o tempo de permanência de 2 horas acopladas com filtros de areia e/ou carvão ativado.
A estação piloto em laboratório, para testes em efluentes industriais, foi projetada para 5 mg/h de ozônio em cuba de vidro de 2 litros.
Figura 02. Estação estudo da marca ELISA.

Os testes serão realizados segundo padrões da NBR ISO 30.500 (2021), sendo testes diários por 4 semanas, com amostragem em dois turnos contemplados das 8 até as 18 horas, perfazendo um total de 40 amostras para os ensaios biológicos e físico- químicos.
PARÂMETROS FÍSICOS E QUÍMICOS
Os ensaios foram realizados de acordo com os métodos padronizados pelo Standard Methods (APHA, 2023). O ensaio de DQO – Demanda química de oxigênio foi realizado pela técnica de refluxo fechado e pela digestão em termobloco na temperatura de 148° C por 2 horas. Após o tempo de resfriamento foi medido em equipamento fotométrico PF12 Plus – Macherey-Nagel (MN). O ensaio de NT- nitrogênio total foi realizado pelos reagentes da Nanocolor baseado no Standard Methods. O ensaio de PT – fósforo foi realizado pelo reagente Visocolor Eco – MN. Todas as leituras fotométricas foram realizadas no equipamento fotométrico PF12 Plus.
O ensaio de SST- sólidos suspensos totais foi realizado pela técnica de gravimetria, pela filtração em membrana de microfiltro fibra de vidro GF-3 da MN e pela secagem em estufa com temperatura de 103 a 1050 C em 1 hora. O resfriamento foi realizado em dessecador até pesagem constante em balança de alta precisão analítica Bioprecisa.
A medição de pH foi realizada pelo equipamento AKSO AK88 com compensação automática de temperatura.
Além dos testes indicados pela NBR 30.500, foram realizados em três efluentes industriais de fontes geradores diferentes, sendo o teste A – efluente de empresa de impressão e gráfica, teste B efluente de tintas e vernizes e teste C efluente de indústria papeleira, durante o período de 1, 3 e 5 horas de ação do ozônio, respectivamente, e depois encaminhados para pesquisa de compostos voláteis e a realização de teste com corante verde sintético, vendido comercialmente para tecidos, de forma a verificar sua capacidade de branqueamento pelo simples contato por 30 minutos e leitura de turbidez no PF12 plus, que possui turbidímetro acoplado.
A análise de voláteis seguiu a técnica de Cromatografia gasosa (CG) pelo uso de detector FID (flame ionization detector), coluna DB624 e DB5, gás de arraste nitrogênio e hidrogênio com ar sintético para manter a chama. A técnica analítica foi por Headspace (EPA 3890).
Todos os ensaios foram realizados com rígido controle de qualidade, pelo uso de padrões da Absolute Standards, acreditado ISO 17034 e 17025 e equipamentos calibrados na Rede Brasileira de calibração – RBC.
PARÂMETROS BIOLÓGICOS
Ensaio de coliformes totais e termotolerantes
Todos os procedimentos microbiológicos foram realizados de acordo com os protocolos em biossegurança e pelas boas práticas laboratoriais – BPL. A cepa controle utilizada para os testes foram a E. coli ATCC 25922 Newprov® e Salmonela typhimurium ATCC 13311 Newprov®. As amostras foram inoculadas em meio asséptico em até 8 horas após coleta, com os procedimentos normalizados pelo Standard Methods para pesquisa de quantificação de Enterobactérias (APHA, 2023). Foram incubadas em atmosfera com presença de oxigênio, com temperatura de 35 ±0,5 ° C pela técnica de tubos múltiplos, de forma presuntiva e pela técnica confirmativa em ágar MacConkey e Eosina Azul de metileno EMB. Após 48 horas de incubação em estufa bacteriológica, foram realizadas as contagens de células. Após a quantificação, as colônias foram isoladas e identificadas através de provas bioquímicas, kit NewprovR e pelo método 9225 C – Standard Methods (APHA, 2023). A identificação conta com padrão de crescimento, coloração, mecanismo bioquímico da bactéria, coloração de Gram (Madigan, 2016; Tortora, 2017, APHA, 2023; Haluch et al.^, 2023).
Ensaio parasitológico
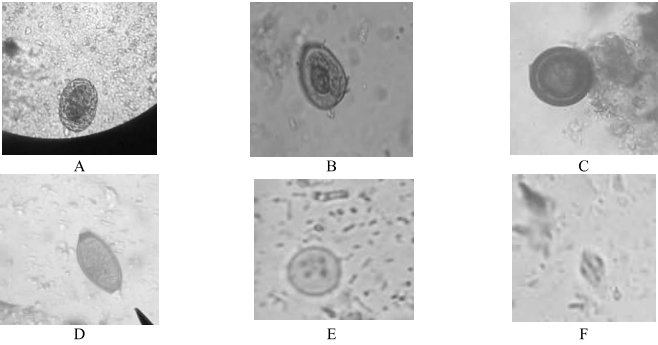
O ensaio foi realizado pela técnica clássica de sedimentação espontânea para avaliação de ovos, larvas e cistos com a solução de acetato de zinco 33% e lugol. As avaliações foram realizadas no microscópio Digilab em objetiva de 40, 100 e 400x em busca dos parasitas Ascaris sp, Enterobius vermiculares, Taenia sp, Trichuris trichiura, Entamoeba histolytica e Giardia lamblia, conforme figura 03.
Figura 03: A: Ascaris sp, B: Enterobius vermiculares, C: Taenia sp, D: Trichuris trichiura, E: Entamoeba histolytica e F: Giardia lamblia; 400x
RESULTADOS E DISCUSSÃO
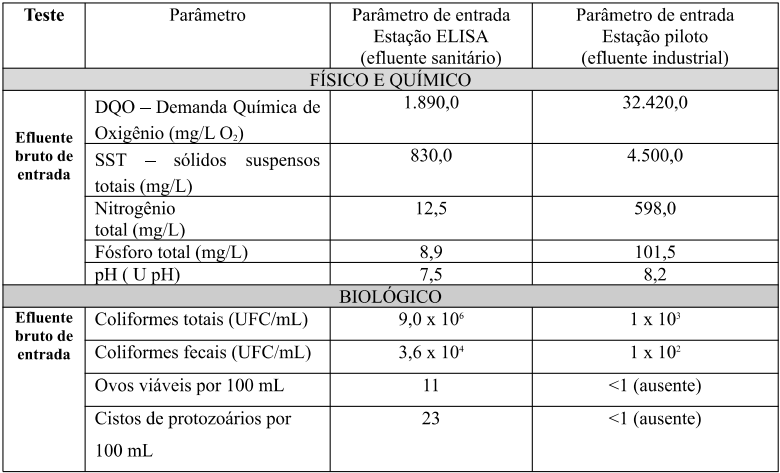
Para a verificação da eficiência das unidades testes, foi necessário caracterizar o efluente bruto a ser tratado e os resultados estão descritos na tabela 01 a seguir.
Tabela 01: Resultados do efluente bruto sanitário e industrial
A média dos resultados dos testes do efluente tratado (após ozônio), estão descritos na tabela 02 a seguir:
Tabela 02: Resultados do efluente tratado com ozônio
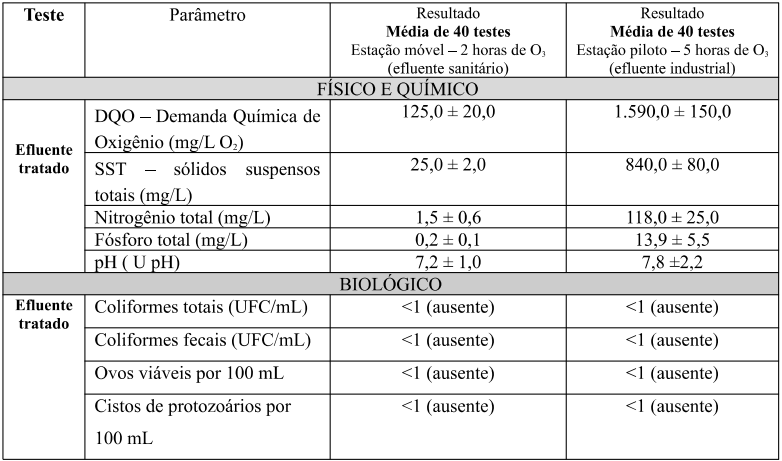
Pelos resultados obtidos podemos observar que a Estação ELISA, em 2 horas de contato com ozônio, apresentou eficiência de remoção de 93,3% de DQO, 96,9% de sólidos, 88% de nitrogênio total, 97,7% de fósforo e eliminação das bactérias do grupo coliformes e parasitas intestinais. Alguns autores, trazem nas literaturas, remoções de até 99% para vários parâmetros físico e químicos e diversos autores trazem dados da capacidade de esterilização e descontaminação total causado pelo efeito do ozônio (Duarte et al., 2022; Oliveira et al., 2018; Lima et al., 2021).
Para a estação piloto laboratorial, em 5 horas de contato com ozônio, apresentou os resultados de 95% de eficiência de remoção de DQO, 81,3% para sólidos, 80,3% para nitrogênio total, 86,2 % para fósforo e eliminação das bactérias do grupo coliformes e parasitas intestinais.
Em relação aos parâmetros biológicos, tabela 02, ocorreu eliminação total de parasitas fecais e bactérias do grupo coliformes em ambos os cenários, o que colabora com a indicação de diversos autores, de que o ozônio, é o melhor agente de descontaminação e esterilização em relação a todas as técnicas envolvidas para tal finalidade (Perchonok et al., 2005; Oller et al., 2011; Languais et al., 1991; Amorin et al., 2009; Billota et al., 2011; Eltech, 1998). O ozônio também aumenta os valores de oxigênio dissolvido no efluente e consequentemente, reduz seu efeito tóxico para os organismos aquáticos (Kurniawan et al., 2006; Hassemer et al.,2002).
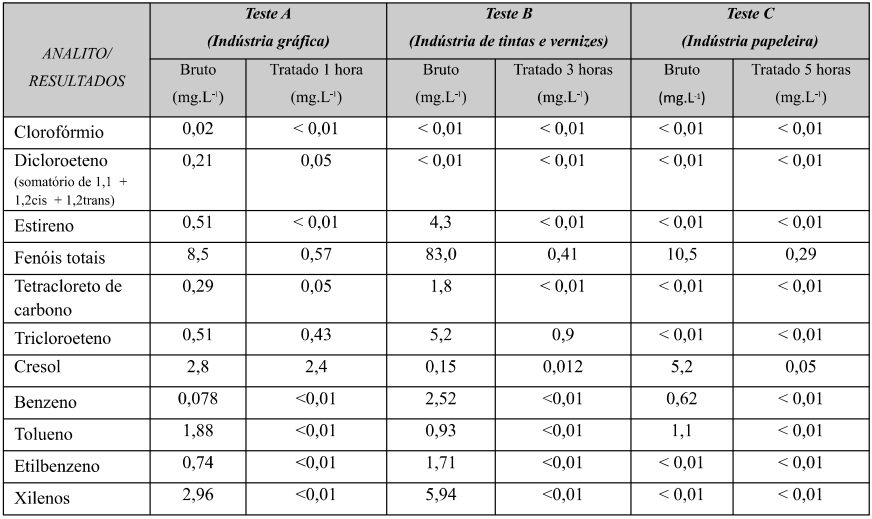
Além desses parâmetros indicados pela ISO 30.500, foram realizados corrida cromatográfica para substâncias voláteis em efluentes industriais, a fim de observar a remoção de hidrocarbonetos alifáticos e aromáticos durante o período de 1, 3 e 5 horas de ação do ozônio, na tabela 03.
Tabela 03: Resultados de compostos voláteis para efluente industrial tratado com ozônio.
De forma a facilitar a visualização do perfil de tratabilidade os cromatogramas da corrida cromatográfica estão apresentados na figura 04.
Figura 04: Cromatogramas dos testes realizados para pesquisa de voláteis

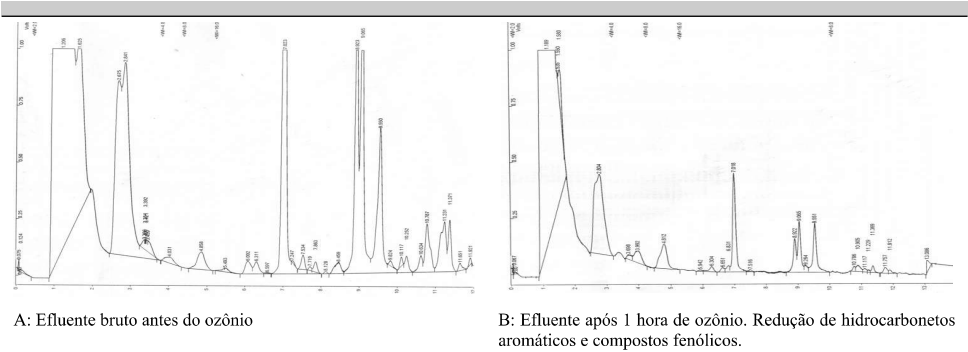
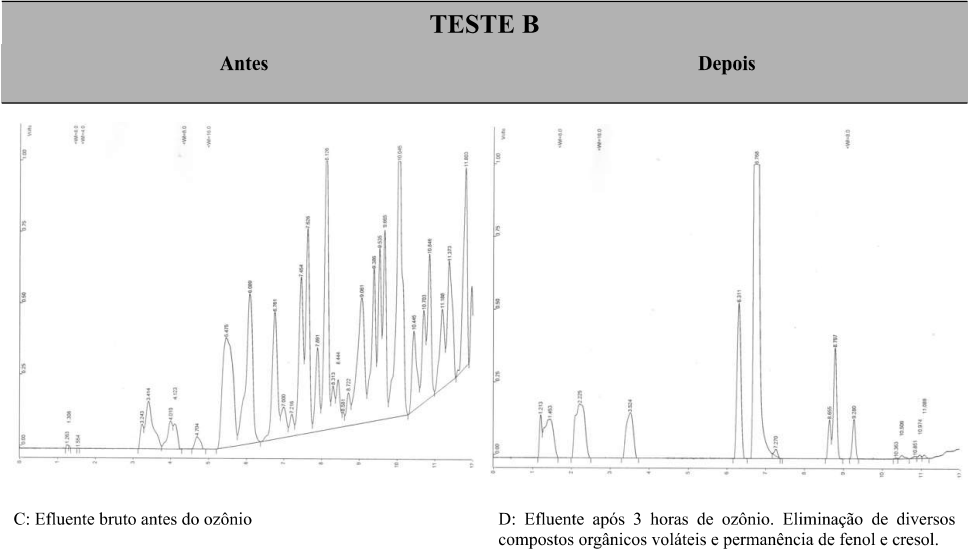
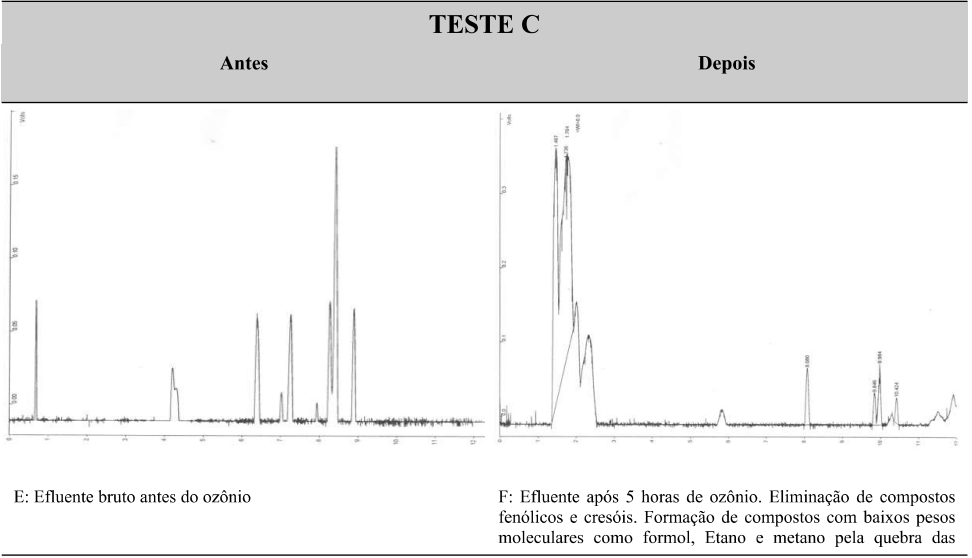
Fonte: Autores.
Com base na tabela 03 e na figura 04, o Teste A, com apenas 1 hora de contato com ozônio, apresentou redução de compostos voláteis e e eliminação completa dos hidrocarbonetos aromáticos, representados pelos BTEX – Benzeno, tolueno, etilbenzeno e xilenos. O teste B com 3 horas de contato apresenta expressiva eliminação de compostos voláteis, porém com remanescente de fenol e cresol. O teste C com 5 horas de contato, apresenta uma eliminação quase completa de compostos de alto peso molecular e cadeia aromática, com formação de compostos de baixo peso molecular de cadeia alifática, ou seja, redução de compostos tóxicos para compostos menos tóxicos. Pelos resultados obtidos podemos observar que ao final de 5 horas restou apenas o fenol e cresol como remanescente. É notável o poder de eliminação de compostos voláteis pelos dados obtidos.
A Resolução CONAMA 430 (Brasil, 2011) traz os valores máximos permitidos para descarte de efluentes no corpo hídrico ou infiltração no solo, sendo 1,2 mg.L1 para benzeno e tolueno, 1,0 mg.L1 para clorofórmio, tetracloreto de carbono, tricloroeteno e dicloroeteno, 0,07 mg.L1 para estireno, 0,84 mg.L1 para etilbenzeno, 0,5 mg.L1 para fenol e 1,6 mg.L1 para xilenos. Nos cenários apresentados, após 3 e 5 horas de contato, mesmo com altos índices de compostos orgânicos voláteis no efluente bruto, os resultados finais atendem a legislação ambiental e mostram a capacidade do ozônio.
Amorin et al.(2009); Hassemer et al. (2002); Oller et al. (2011) citam em seus estudos o poder de degração de compostos orgânicos saturados e insaturados. Os íons hidroxila e os radicais superóxido oxidam e degradam a matéria orgânica e o a parcela ionizada do ozônio quebram as ligações duplas e triplas de diversos componentes aromáticos (Duarte et al., 2022; Ukuku et al., 2012; Reynolds et al., 1989). Perchonok et al. (2005); Oller et al. (2011); Languais et al. (1991) citam o poder de oxidações de compostos não metálicos e metálicos. Matéria orgânica, metais e nutrientes podem ser reduzidos ou até eliminados via decomposição com ozônio ou arrastados por striping (Kurniawan et al.; 2006).
O fornecedor da estação ELISA, descreve em seu manual, que a alta carga de ozônio sob o efluente por um tempo de permanência estimada de 1 hora ou mais, de acordo com a característica do efluente, atua nas cadeias químicas, desestruturando e quebrando ligações saturadas e insaturadas, removendo corantes tóxicos, hidrocarbonetos aromáticos e oxidando metais na forma de óxidos. Auxiliando no processo físico-químico, o ozônio reduz carga de metais pela formação dos óxidos metálicos que decantam no fundo do reator, e ocorre também, a redução de surfactantes pela quebra da cadeia carbônica ativa, remoção de compostos tóxicos poli aromáticos como benzo(a)pireno, naftaleno e outros, além de desorganizar compostos ativos e eliminar monoaromáticos, como benzeno, tolueno e xilenos.
De acordo com a ISO 30.500 (tabela 04) e diante dos resultados analíticos durante algumas semanas, a estação pode ser classificada como A ou B, de acordo com o desempenho. A Categoria A pode ser destinada inclusive para áreas de proteção ambiental e a Categoria B para diversos usos, com restrição em áreas de proteção permanente ou de acordo com a licença de operação do empreendimento.
Tabela 04: Valores orientadores internacional para desempenho de estações sanitárias não descartadas em rede coletora pública.
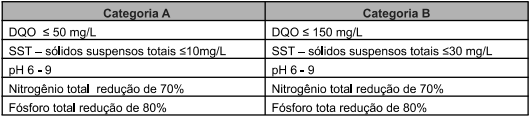
Dessa forma podemos caracterizar a estação para efluente sanitário da marca ELISA, baseado nos resultados da tabela 02, como categoria B.
Por fim, para demonstrar o poder de clivar corantes em geral, o teste por 30 minutos com 5 mg/h em 1 litro de água e corante, mostrou que após 15 minutos praticamente toda coloração dissociou e no final do tempo programado (Figura 05), em leituras de turbidez apresentou leitura < 1 UT (Unidades de Turbidez) que é o limite de quantificação do método, ou seja, o ozônio eliminou todo corante, o que colabora com Ukuku et al., (2012) que já citou o ozônio como melhor agente de branqueamento em indústrias têxteis.
Figura 05: Teste de remoção de cuba: água contendo corante sintético verde. Segunda cuba: água tratada com ozônio e eliminação completa do corante verde.

Estações de tratamento necessitam contínuo aperfeiçoamento, focados nos princípios de minimização de impactos ambientais e focados nos indicadores de desenvolvimento sustentável. O uso de ozônio se mostrou uma ferramenta de grande desempenho para estações de tratamento tanto sanitário como industrial, além de apresentar alta eficácia de remoção de patógenos de interesse clínico.
CONCLUSÕES
Por todo exposto, o ozônio é um excelente agente de descontaminação de bactérias do grupo Gamaproteobacterias, representada pelos coliformes totais e fecais, além de eliminar ao mesmo tempo, os demais parasitas intestinais representados pelos helmintos e protozoários.
Os testes realizados segundo a NBR ISO 30.500:2021 na estação de tratamento da ELISA, classifica a mesma como categoria B, sendo um excelente recurso quando se trata em linhas domésticas. Para efluentes industriais o ozônio apresentou excelentes reduções e em 5 horas, praticamente eliminou diversos compostos voláteis aromáticos e não aromáticos.
O estudo colabora com melhorias em estações de tratamentos industriais e domésticos, trazendo principalmente a versatilidade do ozônio, não apenas em tratamento medicinal e alimentício, mas também como um agente ideal em ETES de cunho geral, visando marcos futuros no tocante de microrganismos de interesse clínico e principalmente, visando à proteção da saúde e responsabilidade social.
AGRADECIMENTOS
Agradecemos a Empresa ELISA Efluentes limpos por dispor a realização dos testes e a publicação dos mesmos. Agrademos a empresa Goldlab Ciência e Tecnologia pela realização dos ensaios e testes necessários para este trabalho.
REFERÊNCIAS
APHA, AWWA, WEF in: L.S. Clesceri, A. E.; Greenberg, A. D. Eaton (Eds.), Standard Methods for the Examination of Water and Wastewater, 23th ed., American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC, USA, 2023.
Amorin, C. C.; Leao, M.; Moreira, R. F. P. M. Comparação entre diferentes Processos Oxidativos Avançados para degradação de corante azo. Revista de Eng. Sanitária e Ambiental, Rio de Janeiro, v. 14, n. 4, p. 543-550, out-dez. 2009.
Anzolin, A.P; Bertol,C.D. Ozone therapy as an integrating therapeutic in osteoartrosis treatment: a systematic review. REVIEW ARTICLE. BrJP. 2018.
Billota, P.; Daniel, L. A. Inativação de indicadores microbiológicos com ozônio no tratamento de esgoto sanitário visando o reuso de água. Revista AIDIS de Ingeniería y Ciencias Ambientales: investigación, desarrollo y práctica. v. 4, n. 2, p. 48-56, 2011.
Bocci, V. Ozone: a new medical drug. 1a ed., Berlin: Springer, 2005.
Brasil. Resolução CONAMA no 357. Conselho Nacional do Meio Ambiente. Brasília, 17 de março de 2005.
Brasil. Resolução CONAMA no 396. Conselho Nacional do Meio Ambiente. Brasília, 03 de agosto de 2008.
Brasil. Resolução CONAMA no 430. Conselho Nacional do Meio Ambiente. Brasília, 16 de maio de 2011.
Brasil. RESOLUÇÃO No 375 DE 29 DE AGOSTO DE 2006 Define critérios e procedimentos, para o uso agrícola de lodos de esgoto gerados em estações de tratamento de esgoto sanitário e seus produtos derivados, e dá outras providências. 2006.
Duarte, A.; Thomas, N.; Arul, J. Hydrogen Peroxide Can Enhance the Synthesis of Bioactive Compounds in Harvested Broccoli Florets. Frontiers in Sustainable Food Systems. 2022
Eltech Ozone Pvt. Ltd. Effects of Ozone on Bacteria, Ozone Generation System in Mumbai, India. 1998.
EPA. U.S. Environmental Protection Agency. METHOD 3890 – HEADSPACE. December. 1987. 1987.
Flávia Caroline Halucha, Gleyciane Martins Rodrigues, Helen Bury, Silvia Mara Haluch e Sandro José Froehner. (2023). CONTROLES E INDICADORES DE DESEMPENHO DE UMA ESTAÇÃO DE TRATAMENTOS DE EFLUENTES INDUSTRIAIS – ESTUDO DE CASO. Revistaft, 27(123), 48. https://doi.org/10.5281/zenodo.8076148 Haluch et al. B
Haluch et al. Investigação da presença de enterobactérias resistentes à antibióticos comerciais em matrizes de aterro hospitalar com vistas em novos parâmetros regulatórios. Revista FT. Ed 122. DOI: 10.5281/zenodo.7991957. 2023. Haluch et al. C
Hassemer, M. E. N.; Sens, M. L. Tratamento do efluente de uma indústria têxtil: processo físico- químico com ozônio e coagulação/floculação. Revista Engenharia Sanitária e Ambiental. v. 7, n.1, p. 30-36, 2002.
Kurniawan, T. A.; LO, W.; Chan, G. Y. S. Radicals-catalyzed oxidation reactions for degradation of recalcitrant compounds from landfill leachate. Chemical Engineering Journal, v. 125, p. 35-57, 2006.
Langlais, B.; Reckhow, D. A.; Brink, D.R.; Lewis Publisher. 121 South Main Street, Chelsea, MI 48118. Ozone in Water Treatment: Application and Engineering. Journal of Environmental Quality. 1991.
LEI No 14.026 DE 15 DE JULHO DE 2020. Brasil Marco legal do saneamento básico. Presidência da República. Secretaria-Geral. Subchefia para Assuntos Jurídicos. 2020.
Lima, M.JA.; Felix, E.P; APLICAÇÕES E IMPLICAÇÕES DO OZÔNIO NA INDÚSTRIA, AMBIENTE E SAÚDE. Revisão • Quim. Nova 44 (09) • 2021 • https://doi.org/10.21577/0100- 4042.20170759
Luis, J.D.; ABRAHAM, C.M.; CEPERO, S.M. Efeito modulador da terapia com ozônio sobre a atividade do sistema imunológico. Rev Cubana Hematol Inmunol Hemoter, 2013.
Madigan, M. T., Martinko, J. M., Bender, K. S., Buckley, D. H., STAHL, David A. Microbiologia de Brock, 14th Edition. ArtMed, 2016.(ISBN 9788582712986); 2016
NBR ISO 30500:2021. ABNT. Sistemas de saneamento não ligados à rede de esgoto Unidades de tratamento integradas pré-fabricadas Requisitos gerais de segurança e desempenho para projeto e ensaio. 2021.
Oliveira, L.S.; Eça, K.S.; Aquino, A.C.; Vasconcelos, L.B.. Hydrogen Peroxide (H2O2) for Postharvest Fruit and Vegetable Disinfection. In book: Postharvest Disinfection of Fruits and Vegetables, pp. 91. 2018.
OMS. OMS pública lista inédita de bactérias resistentes a antibióticos. Direitos humanos, 2017. Disponível em: <https://nacoesunidas.org/oms-publica-lista-inedita-de-bacterias-resistentes- a- antibioticos/amp/
Oller, I; Malato, O, S.; Sanchez Perez, J. A. Combination of Advanced Oxidation Processes and Biological Treatments for Wastewater Decontamination: a review. Science of the Total Environment, v. 409, p. 4141-4166, 2011.
Perchonok, M. H.; French, S. J. Hydrogen Peroxide Treatment of Vegetable Crops. V 114. Journal of aerospace, pp. 362. 2005.
Reynolds, G.; Graham, N.; Perry, R.; Rice, R.G., Aqueous Ozonation of Pesticides: AReview Ozone: Science & Engineering, vol 11, p. 339:382, 1989
Sapers, G., Simmons, G. Hydrogen peroxide disinfection of minimally processed fruits and vegetables. Food Technology. v. 52. n. 2. p. 48. 1998.
Silvia Mara Haluch, & Flávia Caroline Haluch. (2023). DIAGNÓSTICO DE PASSIVOS AMBIENTAIS EM ATERROS HOSPITALARES. Revistaft, 30. https://doi.org/10.5281/zenodo.8116930 Haluch et al. A 27(124),
Tortora, Gerard J., Funke, B. R., CASE, C.L. Microbiologia, 12th Edition. ArtMed, 2017.
Ukuku, D.O.; Bari, L.; Kawamoto, S. Hydrogen Peroxide. In book: Decontamination of Fresh and Minimally Processed Produce. pp.197. 2012.
Vijayakumar, C.E. Minimum bacteriostatic and bactericidal concentrations of household sanitizers for Escherichia coli strains in tryptic soy broth. Food Microbiology. Volume 19, Issue 4, Elsevier, Pages 383. 2002.
World Health Organization. Health aspects of air pollution with particulate matter, ozone and nitrogen dioxide, disponível em: http://www.euro.who.int/document/e79097.pdf. acesso 2023
Mestre em Ciências, Biomédica, Química e Biotecnologista. Pesquisadora e Consultora da Goldlab Ciência e Tecnologia Ltda1
Estudante de Biomedicina da UPP – Universidade Pequeno Príncipe. Microbiologista, Toxicologista e Gerente da Goldlab Ciência e Tecnologia Ltda2
