REGISTRO DOI:10.69849/revistaft/th10247311322
Matheus Alves de Souza
Fernando Simões Gielfi
Jaqueline Fátima Rodrigues
Felipe Cruvinel Resende
Resumo –. O presente trabalho objetivou avaliar a eficiência de dois isolados do vírus SfMNPV (variante Agbitech e Pamplona) em diferentes concentrações, no controle da lagarta do cartucho, Spodoptera frugiperda. O ensaio foi realizado no Laboratório de Entomologia Agrícola da Universidade Federal de Jataí (UFJ) em Goiás. Foram preparadas soluções do Virus da Poliedrose Nuclear Múltipla de Spodoptera frugiperda (SfMNPV)provenientes da Universidade de Pamplona (BST) da Espanha e da empresa Agbitech (Cartugen) com os seguintes tratamentos, vírus isolado (BST-Sf), vírus formulado (BST-F), vírus formulado SoluBio (BST-F SoluBio), vírus isolado Cartugen (BV-Solo) e vírus formulado Cartugen (Cartugen). Para cada tratamento foram preparadas três soluções virais com as concentrações 105, 106 e 107 de corpos de oclusão mL-1, que foram adicionadas a dieta artificial e fornecidas as larvas. As avaliações de morte das larvas foram feitas 24, 48, 72, 96, 120, 144 e 168h após o início da alimentação (AIA). O tratamento utilizando-se o isolado Agbitech (BV-Solo) apresentou 22% de mortalidade de larvas na concentração de 107 de corpos de oclusão mL-1 de SfMNPV. Os tratamentos BST-Sf e BST-F SoluBio, na concentração de 107 de corpos de oclusão mL-1, foram os únicos que demonstraram eficiência maior que 80% no controle da S. frugiperda.
Termos para indexação: controle biológico, entomopatógenos, milho
INTRODUÇÃO
A lagarta do cartucho (Spodoptera frugiperda) é considerada uma praga chave na cultura do milho, não somente pelos danos causados, mas especialmente ao seu difícil controle. O controle dessas larvas no milho é comumente feito com inseticidas organossintéticos que podem impactar o agroecossistema (SANTOS et al., 2007). Devido a esses efeitos negativos, meios alternativos como o controle biológico são procurados.
O Brasil é uma referência mundial na utilização de microbiológicos para o controle de insetos-praga. Desde o ano 2000, estão registrados 552 produtos de baixo impacto, de acordo com o Ministério da Agricultura Pecuária e Abastecimento (MAPA, 2022). Os produtos considerados de baixo impacto possuem ingredientes ativos biológicos, microbiológicos, semioquímios, bioquímicos, extratos vegetais e reguladores de crescimento.
Um dos microbiológicos altamente utilizados no campo é o vírus da Poliedrose Nuclear (VPN ou NPV) com destaque para Baculovirus spodoptera utilizado para o manejo de Spodoptera frugiperda (SfMNPV). Nas décadas passadas, muitos isolados de SfMNPV foram encontrados em lagartas de S. frugiperda em condições de campo na América com alguns resultando em produtos comerciais (Lezama-Gutiérrez et al., 2001). O Baculovirus spodoptera mostrou-se promissor no controle pragas agrícolas devido à sua eficiência e seletividade a inimigos naturais e insetos polinizadores (BARRETO et al., 2005).
No Brasil, o Baculovirus spodptera foi identificado por Valicente (1989) e possui alta capacidade de multiplicação no interior do inseto, atuando no seu intestino, sendo considerado específico para a lagarta do cartucho. Além do Baculovirus, existem outros gêneros de vírus que atacam a S. frugiperda, sendo eles os Ascovirus, Densovirus e Rhabdovirus (HUSSAIN et al., 2020).
Esse vírus atua no mesêntero dos insetos, havendo a necessidade que ele seja ingerido e, em meio alcalino, ele torna-se letal para os insetos. Nestas condições, os corpos de oclusão virais são dissolvidos, liberando os virions (nucleocapsídeo+envelope) e, quando esse vírus, atinge a hemolinfa e o sistema traqueal do inseto, ele se espalha e provoca infecções causando a ruptura na membrana das células. Nesse processo, os insetos perdem a capacidade de se alimentar e movimentar-se e com descoloração do corpo. Além disso, a multiplicação e propagação desses vírus são muito eficientes e rápidos por natureza, o que potencializa o controle microbiológico natural de larvas no campo (ANDRADE et al., 2004).
Desse modo, tem sido bem-sucedido o uso de agentes entomopatogênicos como o vírus da poliedrose nuclear, promovendo mortalidade superior a 80% (VALICENTE & TUELHER., 2009). Segundo os mesmos autores, outra vantagem do uso desse entomopatógeno, é o método de aplicação, no qual se utiliza o maquinário disponível na propriedade, seja pulverizador costal para pequenos produtores, ou autopropelidos para grandes produtores.
No entanto, um dos desafios técnicos é a baixa eficiência de Baculovírus no controle de pragas-chave quando comparado aos inseticidas químicos. Além do mais, o principal desafio social na utilização de Baculovírus no controle biológico é a falta de interesse dos agricultores em usar vírus para controlar insetos-praga em condições de campo. Dessa forma, a disposição ou adoção varia entre regiões geográficas e entre os grupos sócio-econômico desses agricultores (VALICENTE., 2019).
O objetivo desse trabalho foi avaliar a eficiência de dois isolados do vírus SfMNPV (variante Agbitech e Pamplona) em diferentes concentrações, no controle da lagarta do cartucho, S. frugiperda, em condições de laboratório.
MATERIAL E MÉTODOS
O trabalho foi conduzido no Laboratório de Entomologia da Universidade Federal de Jataí (UFJ) em Goiás. Os ovos de Spodoptera frugiperda. foram obtidos no Laboratório de Criação de Insetos da empresa Agbitech, localizada no município de Goiânia/GO. Esses ovos foram acondicionados em copos plásticos contendo dieta artificial. As larvas eclodidas foram mantidas nesses recipientes em BOD (26oC) até que atingissem o segundo ou terceiro ínstar.
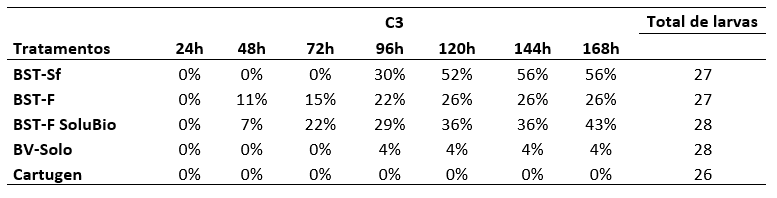
Foram preparadas soluções do vírus SfMNPV provenientes da Universidade de Pamplona da Espanha (BST) e da empresa Agbitech (Cartugen) com concentrações de 107 (C1), 106 (C2) e 105 (C3) corpos de oclusão mL-1. Essas soluções consistiram de vírus isolado (BST-Sf), vírus formulado (BST-F), vírus formulado SoluBio (BST-F SoluBio), vírus isolado Cartugen (BV-Solo) e vírus formulado Cartugen (Cartugen).
Fragmentos de dieta artificial foram embebidas nas diferentes concentrações dos isolados de SfMNPV, com exceção do tratamento Testemunha e em seguida acondicionadas em placas de plástico transparente (blisters) com 28 alvéolos. Conseguinte, foi colocada uma larva por alvéolo e em seguida os blisters foram fechados com papel cartão adesivo.
Após as larvas terem ingerido toda a dieta contaminada, foram adicionados outro fragmento de dieta para as larvas completarem seu ciclo.
As avaliações da eficiência dos isolados SfMNPV nas diferentes concentrações foram realizadas após 24, 48, 72, 96, 120, 144 e 168 horas após o início da alimentação (AIA) das larvas. Avaliou-se o número de larvas mortas e em seguida calculou-se a porcentagem de mortalidade, o que possibilitou a determinação da eficiência de controle de S. frugiperda.
RESULTADOS E DISCUSSÃO
No período das avaliações verificou-se fuga de larvas dos alvéolos, principalmente no tratamento que houve maior mortalidade das larvas (BST-Sf) na maior concentração de corpos de oclusão mL-1 (C3), fato explicado por Gasque et al. (2019) que, segundo eles, alguns Baculovírus induzem alterações no comportamento de larvas, que incluem hiperatividade e o comportamento de subir ao topo da planta ou árvore antes da liquefação.
De acordo com os resultados apresentados na Figura 1, verifica-se que não houve mortalidade de larvas de terceiro ínstar na menor concentração dos tratamentos 24h AIA, uma vez que a necessidade da interação inseto/patógeno a fim que ocorra o processo de infecção (BARRETO et al., 2005). Sucessivamente, na avaliação realizada 48h AIA, verificou-se mortalidade de 3 e 2 larvas nos tratamentos BST-F e BST-F SoluBio respectivamente, o que representa uma mortalidade de 11 e 7%. Como não houve mortalidade no tratamento Testemunha, os dados foram omitidos.
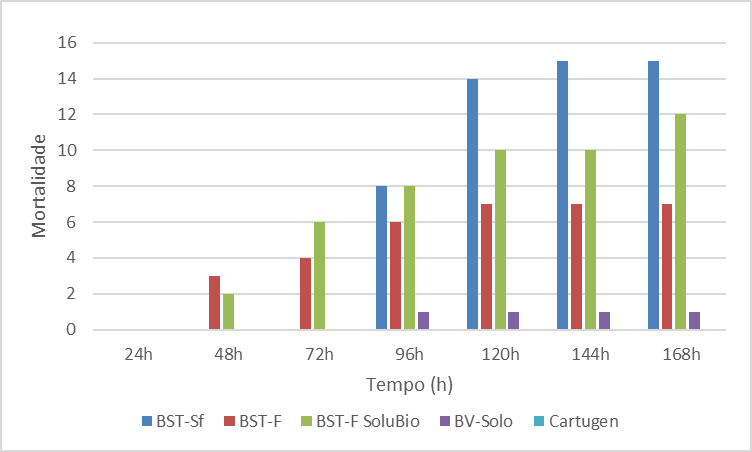
Figura 1. Mortalidade de Spodoptera frugiperda após início da alimentação na concentração 105 corpos de oclusão mL-1.
Na avalição após 72h, como na anterior, apenas nos tratamentos BST-F e BST-F SoluBio verificou-se mortalidade totalizando 4 e 6 larvas respectivamente, correspondendo a 15 e 21%. Já na terceira avalição realizada 96h AIA observou-se mortalidade em todos os tratamentos, com exceção dos tratamentos Cartugen e Testemunha. Conquanto, os tratamentos BST-Sf e BST-F SoluBio apresentaram mortalidade acumulada idênticas, totalizando 8 larvas mortas, de um total de 27 e 28 larvas respectivamente, correspondendo a uma mortalidade de 30 e 28%. No tratamento BST-F a mortalidade acumulada foi de 6 larvas, representado 22% de mortalidade e no BV-Solo, verificou-se a mortalidade de apenas uma larva.
Nas avaliações seguintes (120, 144 e 168h), o tratamento BST-Sf atingiu uma mortalidade acumulada de 55%. Apesar do crescimento da mortalidade, esse valor é inferior a uma mortalidade de 80% necessário em um produto comercial para o controle de insetos.
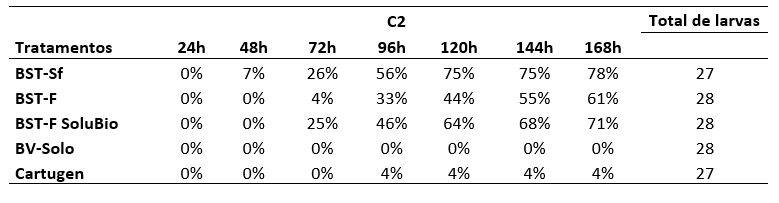
Na concentração de 106 corpos de oclusão mL-1 (Figura 2), observa-se o mesmo padrão de mortalidade observado na concentração 105 corpos de oclusão mL-1 na avaliação realizada 24h AIA, não sendo verificada mortalidade. Na avaliação realizada 48h AIA, apenas no tratamento BST-Sf verificou-se a morte de 2 larvas, representando 7% de mortalidade. No entanto, na avaliação realizada 72h AIA observou-se nos tratamentos BST-Sf e BST-F SoluBio a mesma mortalidade acumulada de 7 larvas, de um total de 27 e 28 larvas respectivamente, totalizando 26 e 25% de mortalidade.
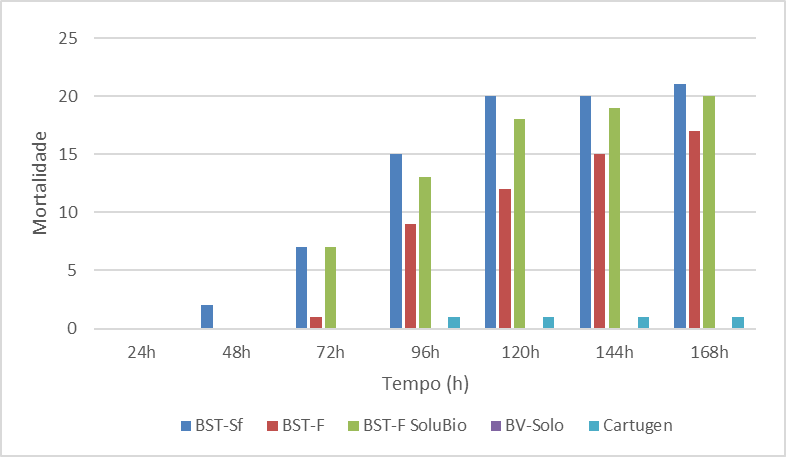
Figura 2. Mortalidade de Spodoptera frugiperda após início da alimentação na concentração 106 corpos de oclusão mL-1.
Nessa mesma avaliação, foi observada a primeira larva morta no tratamento BST-F. Depois, na avaliação realizada às 96h AIA, observou-se o aumento da mortalidade acumulada nos tratamentos BST-Sf, BST-F, BST-F SoluBio e Cartugen, sendo 15, 9, 13 e uma larva morta, respectivamente, representado 56, 33, 46 e 4%.
Nas avaliações posteriores (120, 144 e 168h) todos os tratamentos apresentaram aumento na mortalidade, exceto os tratamentos BV-Solo e Cartugen. No tratamento BV-Solo não ocorreu mortalidade e já o para o Cartugen houve a morte de apenas uma larva. Os tratamentos BST-F e BST-F SoluBio registraram um total de 17 e 21 larvas mortas, respectivamente, de um total de 28 larvas cada, o que representa 61 e 71%. O tratamento BST-Sf foi o que apresentou maior porcentagem de larvas mortas, sendo 78%, de um total de 27 larvas, esse foi o tratamento que chega mais perto da mortalidade mínima exigida de 80% para que um produto dessa categoria seja registrado. Agudelo et al. (1983) verificaram que larvas da lagarta do cartucho foram infectadas por uma variante de SfNPV e que a concentração de 6 x 106 pol mL-1 causou 100% de mortalidade em larvas de 7 e 10 dias de idade,com CL50 (concentração letal) de 4,7 e 7,3 dias, para cada grupo, respectivamente.
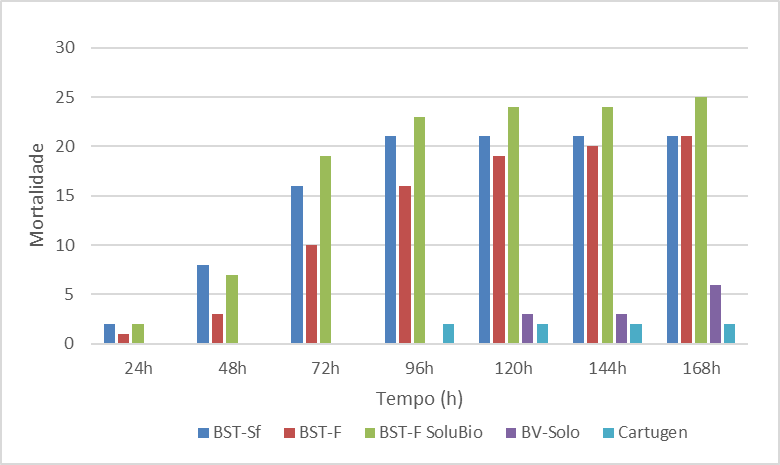
Figura 3. Mortalidade de Spodoptera frugiperda após início da alimentação na concentração 107 corpos de oclusão mL-1.
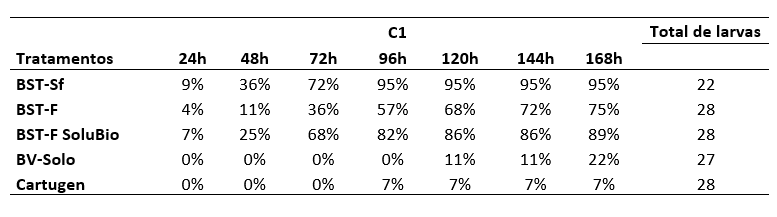
Em relação a mortalidade na maior concentração (107 corpos de oclusão mL-1) (Figura 3), observou-se mortalidade nas primeiras 24h AIA das larvas. Os tratamentos BST-Sf, BST-F e BST-F SoluBio apresentaram 2, uma e 2 larvas mortas respectivamente, de um total de 22, 28 e 28 larvas iniciais, o que representa respectivamente, 9, 4 e 7%.
Nas avaliações realizadas às 48 e 72h AIA, os mesmos tratamentos (BST-Sf, BST-F e BST-F SoluBio) mostraram aumento na mortalidade das larvas, sendo que na avaliação às 72h encontrou-se mortalidade acumulada de 16, 10 e 19 larvas, o que representa 72, 36 e 68% de mortes comparadas com o total inicial.
Após 96h do início da alimentação foi observada mortalidade de 2 larvas no tratamento Cartugen, de um total de 28 larvas, o que representa 7%. Nas avaliações seguintes não foi observado aumento na mortalidade nesse tratamento. Já no tratamento BST-Sf todas as larvas morreram, sendo 21 mortas pelo vírus e outra morta por causa não determinada, totalizando 95% de mortalidade pelo vírus. No tratamento BST-F SoluBio, foi observada uma mortalidade acumulada de 23 larvas, representando 82%, ultrapassando a porcentagem mínima de 80% para o registro de um produto antes do término das avaliações.
Na avaliação às 120h AIA encontrou-se as primeiras larvas mortas no tratamento BV-Solo, num um total de 3 larvas mortas, o que não se alterou na avaliação realizada nas 144h após o início da alimentação.
Na última avaliação, 168h AIA, foi observada mortalidade total de 21, 21, 25, 6 e 2 larvas nos tratamentos BST-Sf, BST-F, BST-F SoluBio, BV-Solo e Cartugen, de um total inicial de 22, 28, 28, 27 e 28 larvas respectivamente, representando uma mortalidade total de 95, 75, 89, 22 e 7% de mortalidade. Assim, apenas os tratamentos BST-Sf e BST-F SoluBio registraram mortalidade acima do mínimo exigido para a o registro do produto para controle de S. frugiperda. Behle & Popham (2012) avaliaram a eficiência dos isolados Sf3 e 3AP2 de SfMNPV e observaram que larvas inoculadas com 2,5×107 e 5×108 de corpos de oclusão mL-1 tiveram 98% e 100% de mortalidade, respectivamente, para ambos os vírus.
No tratamento em que houve maior mortalidade (BST-Sf) verificou-se uma maior fuga das larvas, onde do total de 28, no fim das avaliações restaram apenas 22 larvas. Segundo Gasque et al. (2019), alguns Baculovírus induzem alterações no comportamento de larvas, que incluem hiperatividade e o comportamento de subir ao topo da planta ou árvore antes da liquefação, o que explica o fato de que nesse tratamento tenha ocorrido maior fuga de larvas.
Outro aspecto que pôde ser observado nos tratamentos com maior concentração, foi a mortalidade mais rápida das larvas, que é um fator importante levando em consideração que matando as larvas mais rapidamente, diminui-se os potenciais danos causados na cultura (BEHLE & POPHAM., 2012).
Conforme observado por Barreto et al. (2005), as maiores porcentagens de mortalidade foram registradas nos tratamentos com maior concentração de corpos de oclusão mL-1.
CONCLUSÕES
1. Os tratamentos BST-Sf e BST-F SoluBio registraram mortalidade acima do mínimo exigido para a o registro do produto para controle de S. frugiperda.
2. O melhor resultado no controle de S. frugiperda foi obtido na concentração de 107 corpos de oclusão mL-1.
REFERÊNCIAS
Agudelo, F.; Romano, M.; Wassink, H.; Cuello de Ucategui, H. Una poliedrosis de Spodoptera frugiperda en Venezuela. Turrialba v.33, p.219-222, 1983.
ANDRADE, F. G.; NEGREIRO, M. C. C.; FALLEIROS, A. M. F. Aspectos dos mecanismos de defesa da lagarta da soja Anticarsia gemmatalis (Hübner, 1818) relacionados ao controle biológico por Baculovirus anticarsia (agmnpv). Arquivos do Instituto Biológico, v. 71, n. 3, p. 391-398, 2004.
BARRETO, M. R.; GUIMARÃES, C. T.; TEIXEIRA, F. F.; PAIVA, E.; VALICENTE, F. H. Efeitos de isolados do Baculovirus spodoptera em lagartas de Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae) e sua caracterização por meio de RAPD. Neotropical Entomology, v. 34, n. 1, p. 67-75, 2005.
Behle, R.W.; POPHAM, H.J.R. Laboratory and field evaluations of the efficacy of a fast-killing baculovirus isolate from Spodoptera frugiperda. Journal of Invertebrate Pathology, v.109, p.194-200, 2012.
Gasque, S.N.; van Oers, M.M.; Ros, V.I. Where the baculoviruses lead, the caterpillars follow: Baculovirus-induced alterations in caterpillar behaviour. Current Opinion Insect Science, v.33, p.30–36, 2019.
HUSSAIN, A.G.; WENNMANN, J.T.; GOERGEN, G.; BRYON, A.; ROS, V.I.D. Viruses of the Fall Armyworm Spodoptera frugiperda: a review with prospects for biological control. Viruses 2021, v 13, 2020. Disponível em: https://doi.org/10.3390/ v13112220. Acesso em: 22 nov. 2022.
Lezama-Gutiérrez, R.; Hamm, J.J.; Molina-Ochoa, J.; López-Edwards, M.; Pescador-Rubio, A.; González-Ramirez, M.; Styer, E.L. Occurrence of entomopathogens of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the Mexican states of Michoacán, Colima, Jalisco and Tamaulipas. Florida Entomologist, v 84, p.23-30, 2001.
Ministério da Agricultura, Pecuária e Abastecimento. MAPA registra 46 defensivos agrícolas, incluindo sete produtos biológicos. [S. l.], p. 1-2, 1 jul. 2022. Disponível em: https://www.gov.br/agricultura/pt-br/assuntos/noticias-2022/mapa-registra-46-defensivos-agricolas-incluindo-sete-produtos-biologicos. Acesso em: 25 ago. 2022.
SANTOS, V. M. R.; DONNICI, C. L.; COSTA, J. B. N.; CAIXEIRO, J. M. R. Compostos organofosforados pentavalentes: histórico, métodos sintéticos de preparação e aplicações como inseticidas e agentes antitumorais. Química Nova. v. 30, n. 1, p. 159-170, 2007.
Valicente, F.H. Levantamento dos inimigos naturais de Spodoptera frugiperda (J. E. Smith) (Lepidoptera: Noctuidae) em diferentes regiões do estado de Minas Gerais. Anais da Sociedade Entomológica do Brasil, v. 18, n.1, p. 119-127, 1989.
Valicente, F.H. Entomopathogenic Viruses. In: Natural Enemies of Insect Pests in Neotropical Agroecosystems; Springer International Publishing: Berlin/ Heidelberg, Germany, 2019; pp. 137–150.
VALICENTE, F.H.; TUELHER, E.S. Controle da lagarta do cartucho, Spodoptera frugiperda, com o Baculovirus spodoptera. 2009. 14.p Circular Técnica, 114 (Embrapa/CNPMS).
Anexo I. Porcentagem de mortalidade de larvas de Spodoptera frugiperda em função do tempo (h) após o início da alimentação na concentração de 107 corpos de oclusão mL-1.
Anexo II. Porcentagem de mortalidade de larvas de Spodoptera frugiperda em função do tempo (h) após o início da alimentação na concentração de 106 corpos de oclusão mL-1.
Anexo III. Porcentagem de mortalidade de larvas de Spodoptera frugiperda em função do tempo (h) após o início da alimentação na concentração de 105 corpos de oclusão mL-1.