REGISTRO DOI: 10.69849/revistaft/dt10202505221516
Rodrigo Rodrigues Pache
Samuel Borges Bezerra
Niedja Santana Sampaio
RESUMO
A obesidade infantil é uma doença crônica que teve um crescimento significativo nos últimos anos, associado com a mudança de modo de vida do ser humano, tornando-se uma condição prevalente em todo o mundo. Traz consigo diversos prejuízos para a criança, aumentando o risco do desenvolvimento de diversas comorbidades.
O tratamento da obesidade infantil se baseia em uma abordagem em 4 estágios, na falha de um prossegue-se ao próximo. Inicialmente é tentado medidas dietoterápicas isoladamente, no último estágio associa-se também medicações e/ou cirurgias.
Nesse contexto, a liraglutida surgiu como uma alternativa para o tratamento da obesidade infantil. Alguns ensaios clínicos randomizados foram produzidos sobre esse tema e a partir deles e de outros estudos produzimos essa revisão integrativa, sendo incluídos pacientes pediátricos (5 a 18 anos) com diagnóstico de obesidade e que usaram liraglutida como tratamento experimental. Sendo os desfechos primários o IMC e o peso corporal, e os desfechos secundários a hipoglicemia e os efeitos adversos.
Os resultados encontrados apontaram para uma perda de peso corporal estatisticamente significativa do grupo liraglutida em relação ao grupo placebo (MD = -2,58 [-4,98, -0,18], p = 0,04), além de uma redução significativa do IMC do grupo liraglutida em relação ao placebo (MD = -1,38 kg [-2,61, -0,15], p = 0,03). Ademais, não foram encontradas diferenças significativas tanto para o desfecho hipoglicemia quanto para o desfecho dos efeitos adversos.
Palavras chave: Liraglutida, Obesidade, Crianças, Segurança, Hipoglicemia, IMC, peso corporal.
ABSTRACT
Childhood obesity is a chronic disease that has seen significant growth in recent years, associated with changes in human lifestyles, becoming a prevalent condition worldwide. It brings with it several harms to the child, increasing the risk of developing several comorbidities.
The treatment of childhood obesity is based on a 4-stage approach; if one fails, the next stage is moved on to. Initially, dietary therapy measures are attempted in isolation; in the last stage, medications and/or surgeries are also associated.
In this context, liraglutide has emerged as an alternative for the treatment of childhood obesity. Some randomized clinical trials have been produced on this topic, and based on these and other studies, we produced this integrative review, including pediatric patients (5 to 18 years old) diagnosed with obesity who used liraglutide as an experimental treatment. The primary outcomes were BMI and body weight, and the secondary outcomes were hypoglycemia and adverse effects.
The results showed a statistically significant weight loss in the liraglutide group compared to the placebo group (MD = -2.58 [-4.98, -0.18], p = 0.04), in addition to a significant reduction in BMI in the liraglutide group compared to the placebo group (MD = -1.38 kg [-2.61, -0.15], p = 0.03). Furthermore, no significant differences were found for either the hypoglycemia outcome or the adverse effects outcome.
Keywords: Liraglutide, Obesity, Children, Safety, Hypoglycemia, BMI, Body Weight.
INTRODUÇÃO
A obesidade é uma doença crônica complexa, caracterizada por depósitos excessivos de gordura que podem prejudicar a saúde. A obesidade pode levar ao aumento do risco de diabetes tipo 2 e doenças cardíacas, além de afetar a saúde óssea e a reprodução, além de aumentar o risco de certos tipos de câncer. A obesidade influencia a qualidade de vida, como o sono e a movimentação. (OMS, 2025).
A prevalência de obesidade infantil aumentou significativamente nos últimos anos, afetando mais de 100 milhões de crianças em todo o mundo (GBD 2015). A prevalência da obesidade em crianças brasileiras passou de 6,5% na década de 1990 para 12% na década de 2010, sendo mais prevalente no sexo masculino, e nas Regiões Sul e Sudeste do Brasil (FERREIRA, 2021).
Diante desse cenário, a liraglutida surge como alternativa. A Food and Drug Administration (FDA) dos Estados Unidos e a Agência Europeia de Medicamentos (EMA) aprovaram o uso de liraglutida em 2020 e 2021, respectivamente, para tratar obesidade crônica em adolescentes de 12 a 18 anos (NICOLUCCI, 2022). A liraglutida, como análogo do peptídeo-1 semelhante ao glucagon é administrada por via subcutânea, com o objetivo de reduzir a secreção de glucagon, retardar o esvaziamento gástrico e resultar na redução de peso devido a redução da ingestão alimentar (CAN, 2014; MCLEAN, 2021). Assim, a liraglutida surge como uma alternativa para o tratamento da obesidade.
Nessa revisão integrativa objetivamos investigar a eficácia da liraglutida em comparação ao placebo no tratamento da obesidade em pacientes de 5 a 18 anos de idade. Avaliando também a segurança e a tolerabilidade nessa população.
METODOLOGIA
Critérios de elegibilidade
Para a análise estatística, os estudos incluídos atenderam aos seguintes critérios: (1) Estudos clínicos randomizados (ECRs); (2) Pacientes pediátricos (5 a 18 anos) com diagnóstico de obesidade; (3) Liraglutida como tratamento experimental; (4) Grupo placebo como tratamento padrão.
Foram excluídos, das análises estatísticas, estudos de revisões sistemáticas, metanálises, análises post-hoc, literatura cinzenta, editoriais, relatos de caso e quaisquer outros que não se enquadrem nos critérios de inclusão. Contudo, na produção do texto (exceto para a análise estatística) foram incluídos outros estudos, como metanálise e revisões sistemáticas.
Busca bibliográfica e estratégia de busca
Foi realizada uma busca na base de dados do PubMed no dia 02/05/2025. utilizando os Descritores em Ciência da Saúde (DeCS) em inglês “liraglutide”, “children” e “obesity” associadas ao operador booleano “AND”. Dois pesquisadores independentes (SB e RP) avaliaram os resultados.
Triagem e extração de dados
Duplicatas foram detectadas e removidas utilizando o software Rayyan (OUZZANI, 2016) e, após a remoção, dois autores independentes (SB e RP) analisaram os títulos e resumos utilizando a mesma plataforma. Posteriormente, houve uma revisão dos textos completos restantes para tomada de decisão final dos estudos elegíveis. Qualquer discordância foi resolvida por meio de discussão entre os autores.
Os seguintes dados foram extraídos, por dois autores (SB e RP), com base em critérios de busca predefinidos: 1 – características basais da população dos estudos incluídos; 2 – tamanho da amostra de cada estudo; 3 – desfechos primários (alteração de de IMC e peso corporal) e secundários de interesse (hipoglicemia e efeitos adversos).
Análise estatística
Todas as análises estatísticas foram feitas utilizando o software ReviewManager 5.4 (REVMAN, 2020). Foi utilizado a diferença de média (MD) com intervalo de confiança de 95% como estimativa do efeito para os desfechos contínuos (LAKENS, 2013). Para avaliar desfechos dicotômicos, o Risco Relativo (RR) foi aplicado para mensurar o efeito com seu IC de 95% juntamente com o método estatístico Mantel-Haenszel. Recorreu-se ao modelo de efeitos aleatórios para todos os desfechos, pois em contraste com o modelo de efeitos fixos, ele considera que os estudos incluídos representam uma amostra aleatória da população. Além disso, proporciona um erro padrão mais alto na estimativa combinada e adiciona certo peso aos estudos menores em comparação com os maiores.
RESULTADOS
Resultados da pesquisa bibliográfica
No total, 134 estudos foram obtidos pela pesquisa. Esses registros passaram pela triagem de título e resumo e, por fim, restaram 8 estudos para análise de texto completo. Após a revisão dos textos completos, 7 ECRs foram incluídos. A seguir, o diagrama de fluxo prisma para busca detalhada da literatura de estudos incluídos e excluídos em cada estágio na Figura 1.
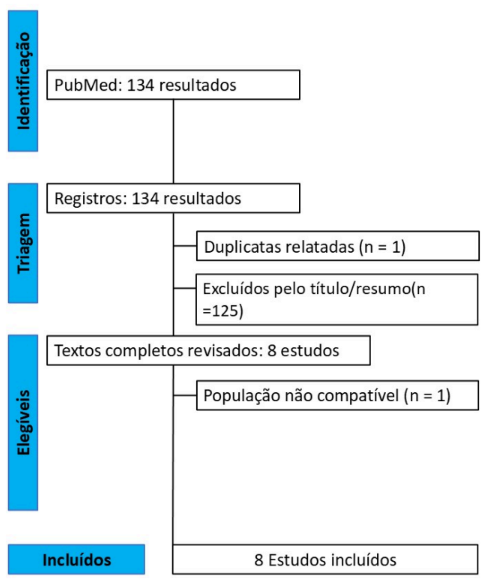
Características dos estudos individuais
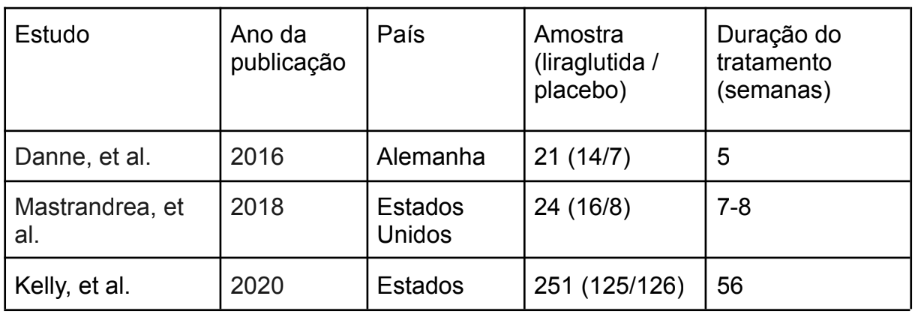
Nessa análise, foram incluídos 7 ECRs, totalizando 575 pacientes. Tais estudos foram conduzidos nos EUA, Alemanha e China. A duração do tratamento durou entre 5 semanas (KLEIN, 2014) até 56 semanas (CLÁUDIA, 2024). Essas informações estão detalhadas na Tabela 1.
Resultados primários
Alteração do IMC
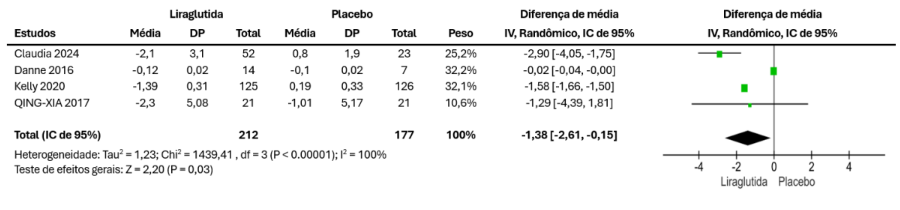
Dados foram sintetizados de 4 estudos, com 212 participantes no grupo liraglutida e 177 no grupo placebo. Os resultados combinados mostraram redução significativa do IMC no grupo liraglutida (MD = -1,38 kg [-2,61, -0,15], p = 0,03), assim demonstrada na Figura 2.
Figura 2 – Resultados combinados para alteração no IMC.
Alteração no peso corporal
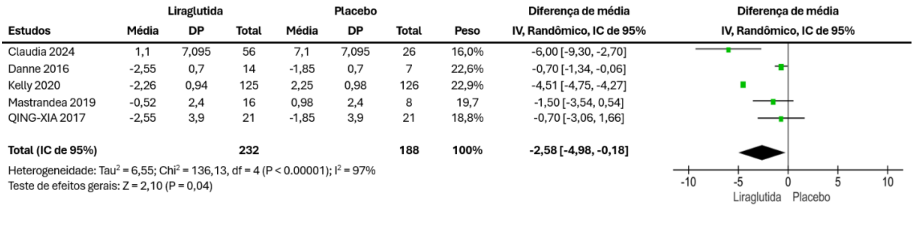
Os dados do peso corporal foram provenientes de 5 estudos, com 232 pacientes no grupo liraglutida e 188 no grupo placebo. As estimativas combinadas mostram diminuição significativa nos pacientes que utilizaram liraglutida (MD = -2,58 [-4,98, -0,18], p = 0,04), presente na Figura 3.
Figura 3 – Resultados combinados para alteração no peso corporal.
Resultados secundários
Hipoglicemia
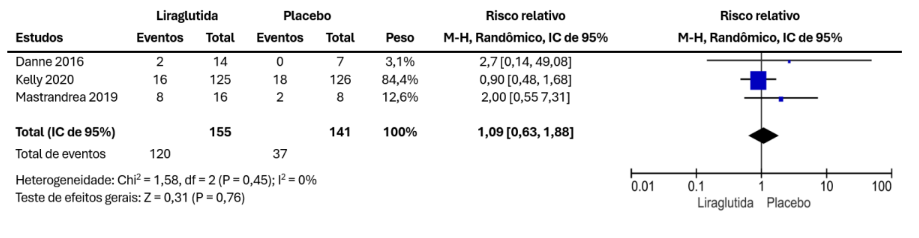
Para avaliação da hipoglicemia, há dados provenientes de 3 artigos, sendo 120 pacientes no grupo liraglutida e 141 no grupo placebo. Não houve diferença significativa entre os grupos (MD = 1,09 [0,63, 1,88], p = 0,76), como visto na Figura 4.
Figura 4 – Resultados combinados para hipoglicemia
Efeitos adversos
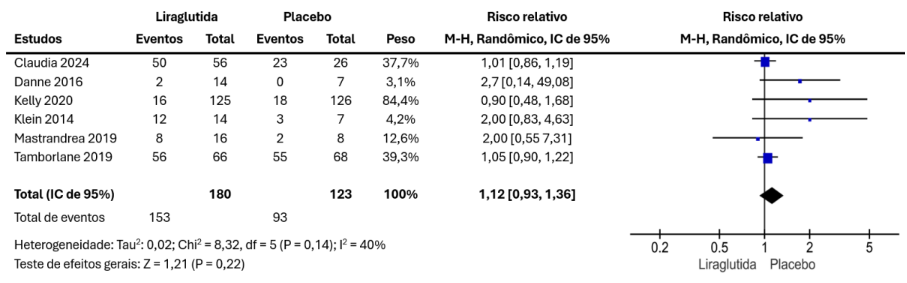
Em relação aos efeitos adversos, um total de 6 estudos contribuíram para o resultado global, sendo 153 no grupo liraglutida e 123 no grupo placebo. Não houve diferença significativa entre o grupo liraglutida e placebo (1,12 [0,93, 1,36], p = 0,22), conforme Figura 5.
Figura 5 – Resultados combinados para efeitos adversos.
DISCUSSÃO
O surgimento, nas últimas décadas, de um estilo de vida sedentário associado à industrialização da alimentação formou um dos alicerces do incremento dos casos de obesidade infantil. A prevalência saltou de 6,5% na década de 1990 para 12% na década de 2010, praticamente dobrando em um período de 20 anos. Em relação ao sexo, essa condição é mais prevalente em meninos (13%) em comparação às meninas (10%). Além disso, as diferenças regionais são significativas, com taxas de 6,4% na região nordeste e taxas de 10,6% na região sudeste. (FERREIRA, 2021).
A obesidade infantil pode ser primária ou secundária a alguma desordem. Dentre elas, destacam-se as desordens endocrinológicas como a síndrome de cushing, a hiperinsulinemia e o hipotireodismo, desordens do sistema nervoso central como os tumores hipotalâmicos, e desordens genéticas como a síndrome de Prader-Willi. (DUNN, W; 2006)
Já a obesidade primária é consequência da interação entre um conjunto complexo de fatores que estão relacionados ao meio ambiente, à genética e a efeitos ecológicos como a família, a comunidade e a escola. (DUNN, W; 2006)
Diversos hormônios foram elencados como participantes no desenvolvimento da obesidade, como a leptina que atua regulando o apetite e o peso. Ela afeta os circuitos centrais no hipotálamo, suprimindo, assim, a ingestão de alimentos e estimulando o gasto energético. Outros hormônios relatados incluem: Adiponectina; visfatina; resistina; apelina e interleucina 6. Dentro dos fatores genéticos foram identificadas polimorfismos e/ou mutações afetando tanto hormônios quanto seus receptores, bem como muitas outras moléculas. (DUNN, W; 2006)
Já os fatores ambientais são em sua grande maioria um reflexo do atual modo de vida urbanizado, muitos deles integram a estratégia de intervenção do tratamento da obesidade infantil. Dentre eles temos: aumento do sedentarismo; falta de atividades físicas; dieta rica em alimentos ultraprocessados; solidão e isolamento social; urbanização; problemas psicossociais e problemas familiares. (DUNN, W; 2006)
O diagnóstico da obesidade infantil é feito a partir da anamnese e do exame físico do paciente, para isso é necessário investigar os seguintes elementos: História da obesidade; antecedentes pessoais; antecedentes familiares; uso de drogas, álcool e tabaco; antecedentes alimentares; hábitos alimentares; comportamento e estilo de vida; e revisão de sistemas. No exame físico geral, devem ser realizadas as medidas antropométricas para definir o estado nutricional do paciente, além dos exames físicos de cada sistema, de modo a identificar sinais e sintomas que possam indicar comorbidades que estão causando ou que são complicações da obesidade. (SBP, 2019)
A avaliação do estado nutricional os pacientes de 5 aos 19 anos incompletos é realizado plotando-se o IMC do paciente no gráfico de peso por idade, se o percentil for maior que 97% e menor ou igual à 99,9% ou maior que o Z score +2 e menor ou igual ao Z score +3 o estado nutricional é categorizado como obesidade. Caso seja maior que o percentil 99,9 ou maior que o Z score +3 é categorizado com obesidade grave. (SBP, 2019)
Exames complementares devem ser utilizados como ferramenta para a investigação de patologias frequentemente associadas com a obesidade infantil, incluindo: Diabetes (glicemia de jejum; teste oral de tolerância à glicose; e glicemia ao acaso); dislipidemia (perfil lipídico); e doença gordurosa não alcóolica do fígado (alanina aminotransferase). (SBP, 2019)
Com o diagnóstico estabelecido, deve-se então traçar o plano de tratamento. Para isso, o comitê de especialistas sobre prevenção, avaliação e tratamento do sobrepeso e obesidade em crianças e adolescentes defende uma abordagem focada em estágios. Inicialmente no estágio 1 tenta-se mudanças da dieta e realização de atividade física. Se não houver melhora do IMC nos primeiros 3 a 6 meses deve-se prosseguir ao estágio 2, nele mantém-se a abordagem inicial, mas existindo uma maior estruturação da alimentação com atenção a densidade energética dos alimentos, além do acompanhamento com nutricionista. De acordo com a resposta ao tratamento, discute-se seguir ao estágio 3, nele existe uma abordagem próxima com uma equipe multidisciplinar, implementando-se atividade físicas estruturadas. Crianças com resposta inadequada ao estágio 3 e presença de riscos aumentados devem ser consideradas para o estágio 4, aqui além das medidas já realizadas no estágio 3 a criança deve ser abordada em um centro de referência no tratamento da obesidade infantil. Nesse estágio podem entrar como complemento a abordagem medicamentosa e/ou cirúrgica. (KUMAR, S; 2017)
No Brasil não existem fármacos antiobesidade aprovados para uso pediátrico, mas podem ser utilizados de maneira limitada em crianças que apresentem obesidade grave associada com comorbidades como depressão, compulsão alimentar, e outros transtornos neuropsiquiátricos.2 Dentre os medicamentos mais utilizados no contexto da obesidade infantil estão os seguintes:
1. Orlistate: É aprovado pelo Food and Drug Administration (FDA) para o tratamento a longo prazo de pacientes com idade maior ou igual à 12 anos. Ele atua inibindo a lipase pancreática e gástrica e diminuindo a absorção de lipídios. Tem seu uso limitado pela quantidade de efeitos colaterais como fezes oleosas, dor abdominal, urgência e incontinência fecal, flatulência e deficiência de vitaminas lipossolúveis. Com perda relatada em relação ao placebo de 2,61 kg após um ano de tratamento. (SINGHAL, Vibha; 2021)
2. Fentermina: É aprovada nos Estados Unidos para uso em pacientes com idade maior que 16 anos por um curto período de até 12 semanas. Ela reduz a recaptação de norepinefrina, estimulando assim os neurônios pró-opiomelanocortina no hipotálamo e também afeta a recaptação de serotonina e dopamina, que no córtex pré-frontal melhora o controle inibitório do apetite. Os efeitos colaterais mais comuns são irritabilidade, insônia, alteração de humor, boca seca, tontura, tremor, dor de cabeça, elevação da frequência cardíaca e da pressão arterial e efeitos colaterais gastrointestinais. (SINGHAL, Vibha; 2021)
3. Análogos do peptídeo semelhante ao glucagon 1 (Exenatida/Dulaglutida/Liraglutida/Semaglutida): são incretinas que aumentam a secreção de insulina e a saciedade ao retardar o esvaziamento gástrico, bem como pelo efeito no núcleo arqueado do hipotálamo, sistema límbico/de recompensa na amígdala e no córtex. Os efeitos adversos são principalmente gastrointestinais – náuseas, vômitos e diarreia. (SINGHAL, Vibha; 2021)
Essa revisão integrativa buscou compilar estudos clínicos randomizados para avaliar a eficácia e segurança da liraglutida em relação ao placebo no tratamento da obesidade infantil, para isso, foram considerado os desfechos primários IMC e peso corporal, e desfechos secundários hipoglicemia e efeitos colaterais gerais.
Em relação ao peso corporal as estimativas combinadas mostram diminuição significativa nos pacientes que utilizaram liraglutida (MD = -2,58 [-4,98, -0,18], p = 0,04). De três revisões sistemáticas e metanálises encontradas na literatura, duas apresentaram redução do peso corporal estatisticamente significativa no grupo liraglutida em relação ao grupo placebo (GOU, 2023; AFRIDI, 2025), enquanto uma das revisões não ocorreu a redução significativa (CORNEJO-ESTRADA, 2023).
Já referente ao IMC, também ocorreu redução significativa do IMC no grupo liraglutida (MD = -1,38 kg [-2,61, -0,15], p = 0,03). Em concordância com duas revisões sistemáticas e metanálises (GOU, 2023; AFRIDI, 2025) concluíram que a liraglutida leva à redução estatisticamente significativa do peso corporal em relação ao placebo. Ao passo que a terceira (CORNEJO-ESTRADA, 2023) não encontrou diferença significativa entre os dois grupos.
Nos resultados secundários da hipoglicemia não houve diferença significativa entre os grupos (MD = 1,09 [0,63, 1,88], p = 0,76). Apenas uma das revisões sistemáticas e metanálises trabalhou o desfecho hipoglicemia, nela também não foi encontrada diferença significativa entre os grupos (CORNEJO-ESTRADA, 2023).
Se tratando dos efeitos adversos não houve diferença significativa entre o grupo liraglutida e placebo (1,12 [0,93, 1,36], p = 0,22). Novamente apenas duas (CORNEJO-ESTRADA, 2023; AFRIDI, 2025) das revisões e metanálises encontradas considerou esse desfecho, mas que também não encontrou diferença estatisticamente significativa entre os grupos.
CONCLUSÃO
Essa revisão evidenciou que a liraglutida diminuiu significativamente o IMC e o peso corporal da população infantil e adolescente sem aumentar os episódios de hipoglicemia e efeitos adversos. Entretanto, para que tais resultados possam ser generalizados, são necessários mais ECRs de alta qualidade sobre o tema. Além disso, é importante o acompanhamento profissional para o tratamento da obesidade por meio dessa modalidade terapêutica, com o objetivo de minimizar os efeitos adversos e acentuar os benefícios que o tratamento oferece.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Colaboradores da Obesidade do GBD 2015. Afshin A., Forouzanfar MH, Reitsma MB, Sur P., Estep K., Lee A., Marczak L., Mokdad AH, Moradi-Lakeh M., et al. Efeitos do sobrepeso e da obesidade na saúde em 195 países ao longo de 25 anos. N. Engl. J. Med. 2017;377:13–27. doi: 10.1056/NEJMoa1614362.
2. Ferreira, A. M., et al. Prevalence of childhood obesity in Brazil: systematic review and meta-analysis, Jornal de Pediatria, v. 97, ed. 5, 2021, p. 490-499,
3. DUNN, W. The impact of sensory processing abilities on the daily lives of young children and their families: A conceptual model. Physiotherapy Theory and Practice, v. 22, n. 1, p. 3–9, 2006. Disponível em: https://www.sciencedirect.com/science/article/pii/S0957583905001764.
4. SOCIEDADE BRASILEIRA DE PEDIATRIA. Manual de orientação: obesidade na infância e adolescência. 3. ed. Rio de Janeiro: SBP, 2019. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/Manual_de_Obesidade_-_3a_Ed_web _compressed.pdf.
5. Nicolucci A, Maffeis C (2022) The adolescent with obesity: what perspectives for treatment? Ital J Pediatr 48:9
6. Van Can J, Sloth B, Jensen CB, Flint A, Blaak EE, Saris WH (2014) Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond) 38:784–793
7. McLean BA, Wong CK, Campbell JE, Hodson DJ, Trapp S, Drucker DJ (2021) Revisiting the complexity of GLP-1 action from sites of synthesis to receptor activation. Endocr Rev 42:101–132
8. LAKENS, D. Calculating and reporting effect sizes to facilitate cumulative science: a practical primer for t-tests and ANOVAs. Frontiers in psychology, v. 4, n. 863, nov. 2013.
9. OUZZANI, M. et al. Rayyan—a web and mobile app for systematic reviews. Systematic reviews, v. 5, n. 210, p. 1-10, 2016
10. THE COCHRANE COLLABORATION. Review Manager (RevMan). Versão 5.4. 2020. The Cochrane Collaboration, 2020. Disponível em: revman.cochrane.org. Acesso em 25 abr. 2025
11. CLAUDIA, K. F., et al. Liraglutide for Children 6 to <12 Years of Age with Obesity — A Randomized Trial. The New England Journal of Medicine, n. 392, p. 555, setembro de 2024.
12. Gou, H., Zhai, Y. & Guo, J. Eficácia e segurança da liraglutida para controle de peso em crianças e adolescentes: uma revisão sistemática e meta-análise de ensaios clínicos randomizados. Eur J Pediatr 182 , 5095–5108 (2023).
13. Cornejo-Estrada, Alejandra et al. “Efficacy of Liraglutide in Obesity in Children and Adolescents: Systematic Review and Meta-Analysis of Randomized Controlled Trials.” Children (Basel, Switzerland) vol. 10,2 208. 25 Jan. 2023, doi:10.3390/children10020208
14. AFRIDI, A., et al. Efficacy and safety of liraglutide in pediatric Obesity:A systematic review and meta-analysis of randomized controlled trials. Obesity Medicine, v. 55, maio de 2025.
15. Zhou QX, Wang ZY, Zhao HF, Wang S (2017) The effects of GLP-1 analogues on pre-diabetes of the children. Exp Ther Med 13:1426–1430
16. Mastrandrea LD, Witten L, Carlsson Petri KC, Hale PM, Hedman HK, Riesenberg RA (2019) Liraglutide effects in a paediatric (7–11 y) population with obesity: a randomized, double-blind, placebo-controlled, short-term trial to assess safety, tolerability, pharmacokinetics, and pharmacodynamics. Pediatr Obes 14:e12495
17. Danne T, Biester T, Kapitzke K, Jacobsen SH, Jacobsen LV, Petri KCC, Hale PM, Kordonouri O (2017) Liraglutide in an adolescent population with obesity: a randomized, double-blind, placebo-controlled 5-week trial to assess safety, tolerability, and pharmacokinetics of liraglutide in adolescents aged 12–17 years. J Pediatr 181:146-153.e143
18. Tamborlane WV, Barrientos-Pérez M, Fainberg U, Frimer-Larsen H, Hafez M, Hale PM, Jalaludin MY, Kovarenko M, Libman I, Lynch JL, Rao P, Shehadeh N, Turan S, Weghuber D, Barrett T (2019) Liraglutide in children and adolescents with type 2 diabetes. N Engl J Med 381:637–646
19. Klein DJ, Battelino T, Chatterjee DJ, Jacobsen LV, Hale PM, Arslanian S, De Schepper J, Barrett T, Bone M, Randel T, Blumer J, Christensen M, Ferry R, Hazan L, Klein DJ, Lopez X, Neufeld N, Toltzis P, Tsalikian E, Wadwa RP, Wintergerst K (2014) Liraglutide’s safety, tolerability, pharmacokinetics, and pharmacodynamics in pediatric type 2 diabetes: a randomized, double-blind, placebo-controlled trial. Diabetes Technol Ther 16:679–687
20. Kelly AS, Auerbach P, Barrientos-Perez M, Gies I, Hale PM, Marcus C, Mastrandrea LD, Prabhu N, Arslanian S (2020) A randomized, controlled trial of liraglutide for adolescents with obesity. N Engl J Med 382:2117–2128
21. SINGHAL, Vibha; CHOVEL SELLA, Aluma; MALHOTRA, Sonali. Pharmacotherapy in pediatric obesity: current evidence and landscape. Current Opinion in Endocrinology, Diabetes and Obesity, v. 28, n. 1, p. 55–63, fev. 2021. Disponível em: https://journals.lww.com/co-endocrinology/fulltext/2021/02000/pharmacotherapy_in_p ediatric_obesity__current.10.aspx. Acesso em: 18 maio 2025.
22. DUNN, W. The impact of sensory processing abilities on the daily lives of young children and their families: A conceptual model. Physiotherapy Theory and Practice, v. 22, n. 1, p. 3–9, 2006. Disponível em: https://www.sciencedirect.com/science/article/pii/S0957583905001764. Acesso em: 18 maio 2025.
23. KUMAR, S.; KELLY, A. S. Review of childhood obesity: from epidemiology, etiology, and comorbidities to clinical assessment and treatment. Mayo Clinic Proceedings, v. 92, n. 2, p. 251–265, fev. 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28065514/. Acesso em: 18 maio 2025.
Instituição: Universidade Federal do Tocantins.
