REGISTRO DOI: 10.69849/revistaft/dt10202506081614
Cleiber Amaro Alves
Everaldo de Farias Ferreira Júnior
Orientador: Prof. Me. Gerson Maciel Coelho
RESUMO
As lesões cartilaginosas representam um desafio terapêutico significativo devido à limitada capacidade de regeneração da cartilagem. Nesse contexto, as células tronco mesenquimais (CTMs) têm ganhado destaque como uma alternativa promissora para a medicina regenerativa, devido à sua capacidade de diferenciação e ação imunomoduladora. Este estudo realizou uma revisão sistemática da literatura, seguindo as diretrizes PRISMA, com objetivo de avaliar a eficácia e segurança das CTMs no tratamento de lesões cartilaginosas. Utilizou-se o framework PICO para estruturar a pesquisa, considerando como população-alvo pacientes com lesões cartilaginosas, como intervenção o uso de CTMs, comparando com tratamentos convencionais (como microfratura e placebo), e como desfechos principais a melhora funcional, a regeneração tecidual e a segurança da terapia. A maioria dos estudos relatou melhora clínica significativa nos escores funcionais dos pacientes, além de evidências de regeneração da cartilagem observadas por exames de imagem ou análise histológica. Não foram registrados eventos adversos graves relacionados ao uso das CTMs, reforçando seu perfil de segurança. No entanto, observou-se considerável heterogeneidade entre os protocolos dos estudos, o que limita comparações diretas e reforça a necessidade de padronização futura. Conclui se que as CTMs são uma abordagem terapêutica segura e eficaz para o tratamento de lesões cartilaginosas, com potencial de superar limitações dos métodos convencionais
Palavras Chave: células-tronco mesenquimais, medicina regenerativa, lesões articulares.
ABSTRACT
Alves, Cleiber Amaro; Júnior, Everaldo de Farias. Efficacy of Mesenchymal Stem Cell Therapy in the Treatment of Cartilage Injuries. 58 f. TCC II – Trabalho de Conclusão de Curso. (Graduação em Medicina) – Afya – Faculdade de Ciências Médicas de Cruzeiro do Sul, Acre, Brasil, 2025.
Cartilage lesions represent a significant therapeutic challenge due to the limited capacity of cartilage regeneration. In this context, mesenchymal stem cells (MSCs) have gained prominence as a promising alternative for regenerative medicine, due to their differentiation capacity and immunomodulatory action. This study carried out a systematic review of the literature, following the PRISMA guidelines, with the aim of evaluating the efficacy and safety of MSCs in the treatment of cartilage lesions. The PICO framework was used to structure the research, considering patients with cartilage lesions as the target population, the use of MSCs as the intervention, comparing them with conventional treatments (such as microfracture and placebo), and the functional improvement, tissue regeneration, and safety of the therapy as the main outcomes. Most studies reported significant clinical improvement in patients’ functional scores, in addition to evidence of cartilage regeneration observed by imaging tests or histological analysis. No serious adverse events related to the use of MSCs were recorded, reinforcing their safety profile. However, considerable heterogeneity was observed between study protocols, which limits direct comparisons and reinforces the need for future standardization. It is concluded that MSCs are a safe and effective therapeutic approach for the treatment of cartilage lesions, with the potential to overcome limitations of conventional methods.
Keywords: Mesenchymal stem cells, Regenerative medicine, Articular lesions.
1. INTRODUÇÃO
As células-tronco mesenquimais (CTMs) foram inicialmente identificadas por Friedenstein e colaboradores como células-tronco multipotentes presentes em organismos adultos. Essas células podem ser isoladas de diversas fontes, como medula óssea, cordão umbilical, tecido adiposo e até mesmo da polpa dentária (Chu et al., 2020). No contexto da medicina regenerativa, da engenharia de tecidos e da terapia celular, as CTMs têm ganhado destaque por seu potencial terapêutico significativo. Estudos demonstram que essas células representam uma alternativa promissora no tratamento de tecidos e órgãos danificados, impulsionando avanços em diversas áreas clínicas, como ortopedia, cardiologia e neurologia (Liu et al., 2022). Evidências científicas apontam benefícios concretos em casos de lesões articulares, infartos e doenças neurodegenerativas, como Alzheimer e Parkinson (Pittenger et al., 2019).
O uso das CTMs na medicina regenerativa teve início na década de 1990, avançando expressivamente nos anos 2000 com os primeiros ensaios clínicos em humanos, como o estudo de Ding et al. (2004), voltado à regeneração da cartilagem. Desde então, a pesquisa envolvendo essas células vem se intensificando. Estudos clínicos e pré-clínicos têm evidenciado seu potencial terapêutico em diferentes patologias, incluindo esclerose múltipla, cardiomiopatia isquêmica, lesão pulmonar aguda, artrite reumatoide, regeneração óssea, reparo osteocondral, cicatrização de feridas diabéticas, sarcopenia e acidente vascular cerebral (Tompkins et al., 2018; Petrou et al., 2020; Xiao et al., 2020; Chung et al., 2021; Desando et al., 2021; Lima et al., 2021; Vij et al., 2022; Palma et al., 2023; Wang et al., 2023).
As CTMs destacam-se também por sua notável capacidade de autorrenovação e diferenciação, características que reforçam seu papel fundamental na regeneração tecidual (Ahdjoudj et al., 2001; Farag et al., 2024). No entanto, sua eficácia pode ser influenciada por diversos fatores técnicos. A origem celular, a composição do meio de cultura e o número de passagens celulares são variáveis que podem impactar diretamente a qualidade das CTMs. Tais alterações podem resultar em modificações morfológicas, anomalias genéticas, envelhecimento celular acelerado e redução nas capacidades de proliferação, diferenciação e plasticidade (Dayem et al., 2019).
Diante desse panorama, o presente trabalho tem como objetivo avaliar a eficácia do uso de células-tronco mesenquimais no reparo de lesões da cartilagem articular. Para isso, pretende-se investigar o potencial regenerativo das CTMs derivadas de diferentes fontes, como medula óssea, tecido adiposo e cordão umbilical. Além disso, serão comparados os métodos de aplicação, como as vias intra-articular e sistêmica, quanto aos seus efeitos na regeneração da cartilagem e na recuperação funcional. Por fim, serão analisados os desfechos clínicos do tratamento, incluindo alívio da dor, melhora da função articular e impacto na qualidade de vida dos pacientes.
2. REFERENCIAL TEÓRICO
2.1 Origem e características das células-tronco mesenquimais (ctms):
As células-tronco mesenquimais (CTMs), inicialmente descritas por Friedenstein et al. (1966), têm sido amplamente estudadas ao longo das últimas décadas devido ao seu grande potencial terapêutico. Essas células são multipotentes, o que significa que possuem a capacidade de se diferenciar em diversos tipos celulares, como osteoblastos, adipócitos e condrócitos, oferecendo, portanto, uma versatilidade notável para aplicações terapêuticas em diferentes áreas da medicina (Pittenger et al., 2019).
As CTMs podem ser isoladas de uma variedade de fontes, incluindo medula óssea, cordão umbilical, tecido adiposo e até da polpa dentária, sendo que cada uma dessas fontes apresenta características particulares que influenciam diretamente as propriedades e as possíveis aplicações terapêuticas (Barcelos et al., 2023). A versatilidade das CTMs, aliada à sua capacidade de modular a resposta imune, regenerar tecidos danificados e secretar fatores de crescimento, as posiciona como uma das ferramentas mais promissoras no campo da medicina regenerativa (Chu et al., 2020).
Além de sua capacidade de diferenciação, as CTMs se destacam por suas propriedades imunomoduladoras, que as tornam especialmente valiosas no tratamento de condições inflamatórias crônicas, como a osteoartrite. Nesse contexto, a inflamação persistente é um fator crucial que acelera a degeneração articular, o que torna essencial o controle da resposta inflamatória no tratamento da doença (Shi et al., 2021).
Estudos recentes indicam que as CTMs podem reduzir a produção de citocinas pró-inflamatórias, como a interleucina-1β (IL-1β) e o fator de necrose tumoral alfa (TNF-α), enquanto aumentam a secreção de citocinas anti inflamatórias, como a interleucina-10 (IL-10), o que favorece a modulação do ambiente inflamatório e contribui para o alívio dos sintomas (Wang et al., 2020). Esse efeito imunomodulador não só é crucial para o tratamento de doenças autoimunes e degenerativas, mas também facilita a regeneração tecidual, criando um microambiente favorável à reparação celular.
Ademais, as CTMs têm a capacidade de secretar uma vasta gama de fatores de crescimento e citocinas que promovem a regeneração celular e a angiogênese, o que é essencial para o sucesso terapêutico em diversos contextos clínicos. Dentre os principais fatores de crescimento secretados pelas CTMs, destacam-se o fator de crescimento transformante beta (TGF-β), o fator de crescimento derivado de plaquetas (PDGF) e o fator de crescimento endotelial vascular (VEGF). Esses fatores não apenas estimulam a reparação do tecido danificado, mas também favorecem a formação de novos vasos sanguíneos, um processo essencial para garantir a nutrição e o suporte celular durante a regeneração (Pittenger et al., 2019).
Portanto, a liberação desses fatores de crescimento pelas CTMs cria um ambiente regenerativo ideal, promovendo a sobrevivência e proliferação das células locais, o que é fundamental para tratamentos de regeneração óssea e cartilaginosa, áreas nas quais as CTMs têm mostrado grande potencial terapêutico (Wang et al., 2020).
2.2 Fontes de CTMs e suas implicações terapêuticas:
2.2.1 medula óssea:
A medula óssea continua sendo uma das fontes mais tradicionais e amplamente estudadas de células-tronco mesenquimais (CTMs). A coleta dessas células é realizada por meio de aspiração da medula, geralmente da crista ilíaca, um procedimento bem estabelecido tanto em estudos clínicos quanto em terapias experimentais (Galipeau & Sensébé, 2018). As CTMs derivadas da medula óssea possuem uma excelente capacidade de diferenciação, especialmente para osteoblastos, condrócitos e adipócitos, tornando-se fundamentais em tratamentos para regeneração óssea, lesões articulares e doenças degenerativas (Lima et al., 2021). Contudo, um dos maiores desafios associados ao uso das CTMs da medula óssea é que a sua quantidade diminui com a idade, o que limita a eficácia terapêutica em indivíduos mais velhos, devido à redução da capacidade proliferativa celular (Vij et al., 2022). Esses aspectos apontam para a necessidade de novas abordagens para superar a limitação da medula óssea em pacientes de maior idade.
2.2.2 Tecido adiposo:
O tecido adiposo tem se destacado como uma fonte alternativa e abundante de CTMs, sendo especialmente vantajoso devido à sua coleta simples e minimamente invasiva por lipoaspiração (Yun et al., 2020). Em pacientes obesos, grandes quantidades de tecido adiposo podem ser extraídas, o que facilita a obtenção de CTMs em quantidade suficiente para diversas terapias (Lima et al., 2021). As células-tronco mesenquimais derivadas do tecido adiposo possuem uma capacidade de diferenciação semelhante àquelas da medula óssea, o que inclui a formação de osteoblastos, adipócitos e condrócitos (Pittenger et al., 2019). A principal vantagem do tecido adiposo é sua acessibilidade e a presença de fatores bioativos que promovem um ambiente propício à regeneração tecidual, especialmente em lesões articulares (Zuk et al., 2020). No entanto, um estudo de Mazini et al. (2020) sugere que, embora as CTMs do tecido adiposo tenham boa capacidade de diferenciação, elas são menos eficazes na regeneração de cartilagem em comparação com as derivadas da medula óssea.
2.2.3 Cordão umbilical:
O sangue e o tecido do cordão umbilical emergem como fontes inovadoras de CTMs, sendo altamente promissores devido à sua maior capacidade proliferativa e imunogenicidade reduzida. As CTMs do cordão umbilical são mais “jovens”, apresentando uma maior capacidade de diferenciação e proliferação quando comparadas às de outras fontes adultas, como medula óssea e tecido adiposo (Barcelos et al., 2023). Além disso, a imaturidade imunológica das CTMs do cordão umbilical oferece uma vantagem significativa no que diz respeito ao risco de rejeição imunológica, tornando-as ideais para terapias alogênicas (Wang et al., 2020). Essas características fazem com que o cordão umbilical seja uma fonte altamente atraente para a medicina regenerativa, especialmente para terapias que exigem grandes quantidades de células. Outro benefício é que o cordão umbilical é geralmente descartado após o parto, o que minimiza as questões éticas associadas à coleta de células (Lima et al., 2021). No entanto, desafios ainda existem em relação à padronização do armazenamento e da expansão celular dessas CTMs, além da necessidade de desenvolver protocolos de qualidade para seu uso em larga escala (Vij et al., 2022).
2.2.4 Polpa dentária:
A polpa dentária é uma fonte promissora de CTMs, especialmente no campo da odontologia regenerativa. As CTMs derivadas da polpa dentária têm se mostrado eficazes na regeneração de tecidos dentários, como a dentina e a polpa, devido à sua alta capacidade de diferenciação em células odontogênicas (Huang et al., 2021). Além disso, essas células também têm mostrado potencial para regeneração óssea e outras aplicações em medicina regenerativa (Li et al., 2022). A coleta dessas células é limitada à extração de dentes, o que restringe sua aplicação em larga escala, sendo mais viável para tratamentos odontológicos ou terapias específicas de regeneração dentária (Mao et al., 2020). Embora o uso da polpa dentária seja promissor, a necessidade de obter dentes para a coleta limita o potencial de uso dessas células em contextos terapêuticos amplos, restringindo sua viabilidade para determinadas condições clínicas (Huang et al., 2021).
2.3 Aplicações das CTMs em lesões cartilaginosas:
As lesões cartilaginosas, frequentemente resultantes de traumas ou condições degenerativas como a osteoartrite, representam um grande desafio terapêutico devido à limitada capacidade regenerativa da cartilagem. A cartilagem articular é um tecido avascular, ou seja, não possui vasos sanguíneos, o que dificulta a entrega de nutrientes essenciais e a reparação do tecido danificado (Galipeau & Sensébé, 2018). Essa característica torna o processo de regeneração da cartilagem mais complexo, pois a falta de suprimento sanguíneo dificulta tanto a nutrição celular quanto a remoção de resíduos metabólicos, prejudicando a recuperação e a regeneração do tecido.
Além disso, a cartilagem articular é composta principalmente por condrócitos, células que apresentam uma capacidade regenerativa extremamente limitada. Uma vez danificada, a cartilagem tende a se degenerar progressivamente, o que pode levar a condições crônicas, como a osteoartrite (Pittenger et al., 2019). Essa degeneração progressiva, associada à incapacidade de regeneração adequada, resulta em dor e perda de função articular, caracterizando-se como uma das principais causas de incapacidade em adultos mais velhos. Portanto, encontrar uma solução terapêutica eficaz para tratar essas lesões é fundamental para melhorar a qualidade de vida dos pacientes.
Nesse contexto, as células-tronco mesenquimais (CTMs) têm se mostrado uma alternativa promissora para o tratamento de lesões cartilaginosas. As CTMs possuem a capacidade de se diferenciar em condrócitos e produzir matriz extracelular semelhante à da cartilagem, o que as torna um recurso valioso na regeneração do tecido danificado (Barcelos et al., 2023). Além disso, as CTMs demonstram uma notável capacidade de modular a inflamação local, o que contribui para um ambiente biológico mais favorável à recuperação. Estudos indicam que a redução da inflamação pode acelerar a regeneração da cartilagem e melhorar os resultados clínicos em pacientes com lesões articulares (Shi et al., 2021). Assim, ao não apenas regenerar a cartilagem, mas também melhorar as condições do ambiente articular, as CTMs se posicionam como uma abordagem terapêutica inovadora e eficaz para lesões cartilaginosas.
2.4 Estudos recentes e avanços terapêuticos:
As células-tronco mesenquimais (CTMs) têm emergido como uma das terapias mais promissoras para o tratamento de lesões cartilaginosas devido à sua capacidade de regenerar tecidos danificados. As lesões cartilaginosas, que frequentemente ocorrem devido a traumas agudos ou condições degenerativas como a osteoartrite, representam um grande desafio terapêutico, pois a cartilagem articular é um tecido avascular, o que limita significativamente a reparação espontânea. Além disso, a cartilagem é composta principalmente por condrócitos, células que têm uma capacidade regenerativa limitada (Wang et al., 2020).
Uma vez danificada, a cartilagem não se regenera naturalmente e a degeneração progressiva pode ocorrer, levando a condições crônicas, como a osteoartrite (Shi et al., 2021). Nesse contexto, as CTMs se destacam não apenas por sua capacidade de diferenciação em células cartilaginosas, mas também por sua habilidade em modular a inflamação e promover um microambiente regenerativo que facilita a reparação. A aplicação de CTMs tem sido amplamente explorada para induzir a regeneração cartilaginosa em modelos pré-clínicos e clínicos, sendo um avanço promissor no tratamento de doenças degenerativas articulares (Galipeau & Sensébé, 2018).
A capacidade das CTMs de se diferenciar em diversos tipos celulares, incluindo condrócitos, é um dos principais fatores que tornam essas células tão valiosas para o tratamento de lesões cartilaginosas. A diferenciação das CTMs pode ser induzida em ambientes controlados utilizando fatores de crescimento específicos, como o TGF-β (fator de crescimento transformante beta) e o IGF-1 (fator de crescimento insulina-like), que são conhecidos por estimular a diferenciação celular e a síntese de matriz extracelular (Pittenger et al., 2019). O uso de scaffolds tridimensionais (suportes biomateriais) também tem sido fundamental para esse processo, proporcionando uma estrutura que facilita a adesão celular e a formação de tecidos semelhantes à cartilagem (Mazini et al., 2019).
Além disso, a combinação de CTMs com scaffolds tem mostrado resultados promissores, não apenas para a regeneração cartilaginosa, mas também para a formação de tecidos funcionais que podem integrar-se eficientemente ao tecido nativo (Barcelos et al., 2023). Estudos mais recentes sugerem que a combinação de CTMs com biomateriais avançados pode oferecer uma plataforma terapêutica ainda mais eficaz, uma vez que esses biomateriais podem ser modificados para liberar fatores de crescimento de forma controlada, melhorando os resultados terapêuticos (Galipeau & Sensébé, 2018). A diferenciação das CTMs em condrócitos, quando combinada com a regeneração tecidual assistida por scaffolds, pode, portanto, fornecer uma abordagem muito promissora para a reparação de lesões cartilaginosas e lesões articulares mais complexas.
Além da capacidade de diferenciação, as CTMs também se destacam por suas propriedades imunomoduladoras, que desempenham um papel crucial na regeneração de tecidos cartilaginosos danificados. A inflamação crônica é uma característica marcante em condições como a osteoartrite, onde a persistência de processos inflamatórios acelera a destruição da cartilagem e impede sua regeneração adequada (Shi et al., 2021).
As CTMs têm a capacidade única de modular a resposta inflamatória, suprimindo a produção de citocinas pró-inflamatórias, como a IL-1β (interleucina 1 beta) e o TNF-α (fator de necrose tumoral alfa), ao mesmo tempo em que promovem a secreção de citocinas anti-inflamatórias, como a IL-10, criando um ambiente biológico mais favorável à regeneração tecidual (Wang et al., 2020). Esse efeito imunomodulador é especialmente importante em tratamentos de longo prazo para doenças crônicas, como a osteoartrite, uma vez que a redução da inflamação não só ajuda na preservação do tecido cartilaginoso, mas também acelera o processo de reparo (Shi et al., 2021). Os efeitos anti-inflamatórios das CTMs têm sido amplamente documentados em diversos estudos, indicando que essas células podem promover uma resposta imunológica equilibrada, essencial para a regeneração eficiente dos tecidos articulares danificados (Barcelos et al., 2023).
Outro aspecto relevante no uso das CTMs para o tratamento de lesões cartilaginosas é sua capacidade de promover a angiogênese, ou formação de novos vasos sanguíneos, o que é crucial para a regeneração tecidual em áreas avasculares como a cartilagem (Pittenger et al., 2019). A angiogênese é necessária para fornecer os nutrientes e o oxigênio essenciais à regeneração celular, especialmente em tecidos onde a vascularização é deficiente. As CTMs têm mostrado grande potencial nesse sentido, uma vez que secretam fatores de crescimento angiogênicos como o VEGF (fator de crescimento endotelial vascular), que estimula a formação de novos vasos sanguíneos nas áreas lesadas (Wang et al., 2020).
Além disso, o PDGF (fator de crescimento derivado de plaquetas) também desempenha um papel importante na produção de matriz extracelular, que é fundamental para a regeneração de tecidos como a cartilagem (Galipeau & Sensébé, 2018). A combinação de angiogênese e regeneração tecidual com o auxílio de CTMs pode resultar em uma recuperação mais eficaz e mais rápida das lesões cartilaginosas, melhorando a função articular e aliviando a dor associada a condições como a osteoartrite (Pittenger et al., 2019). Dessa forma, as CTMs não apenas promovem a regeneração direta da cartilagem, mas também contribuem para a formação de um ambiente regenerativo otimizado, onde a recuperação tecidual pode ocorrer de maneira mais eficiente e sustentável.
3. MATERIAIS E MÉTODOS
Dessa maneira, segue-se a linha de pesquisa sobre a eficácia da terapia com células-tronco mesenquimais no tratamento de lesões cartilaginosas, considerando sua relevância e o crescente avanço das pesquisas e tratamentos baseados nesse tipo celular. Logo, foi realizada uma busca de trabalhos científicos publicados em revistas e bibliotecas onlines, como, por exemplo, Pubmed, Scopus e SciELO.
Por conseguinte, com o objetivo de otimizar a busca por artigos científicos, foram utilizadas as seguintes palavras-chave: células-tronco mesenquimais, cartilagem, terapia celular, medicina regenerativa e lesões articulares. Para refinar e combinar os termos durante as pesquisas nas bases de dados, aplicaram-se os operadores booleanos “AND” e “OR”. Além disso, foram selecionados os idiomas português e inglês como critérios linguísticos para a seleção dos estudos.
Outrossim, para a inclusão dos estudos nesta revisão, foram estabelecidos critérios de inclusão e exclusão. Os critérios de inclusão abrangeram estudos clínicos e pré-clínicos que tratassem especificamente das células-tronco mesenquimais, incluindo trabalhos que abordassem sua definição, aplicação na medicina regenerativa, uso no tratamento de lesões cartilaginosas, bem como os métodos de coleta e formas de aplicação dessas células. Por outro lado, foram descartados os artigos que não abordavam as CTMs, que apresentavam potenciais conflitos de interesse ou que estavam redigidos em idiomas diferentes dos previamente estabelecidos. Além disso, foram excluídas dissertações, teses, resumos e estudos incompletos, uma vez que esses tipos de material podem aumentar o risco de vieses na análise dos dados.
Inicialmente, foram analisados os títulos e resumos dos artigos identificados na busca, sendo mantidos na seleção aqueles que apresentavam maior consonância com a pergunta proposta: o uso de CMTs no tratamento de lesões cartilaginosas traz maior benefício para os pacientes? Em seguida, os textos completos foram avaliados com base nos critérios de inclusão e exclusão previamente estabelecidos. Quanto ao recorte temporal, foram considerados apenas os estudos publicados entre os anos de 2020 e 2025, em conformidade com a delimitação metodológica desta revisão.
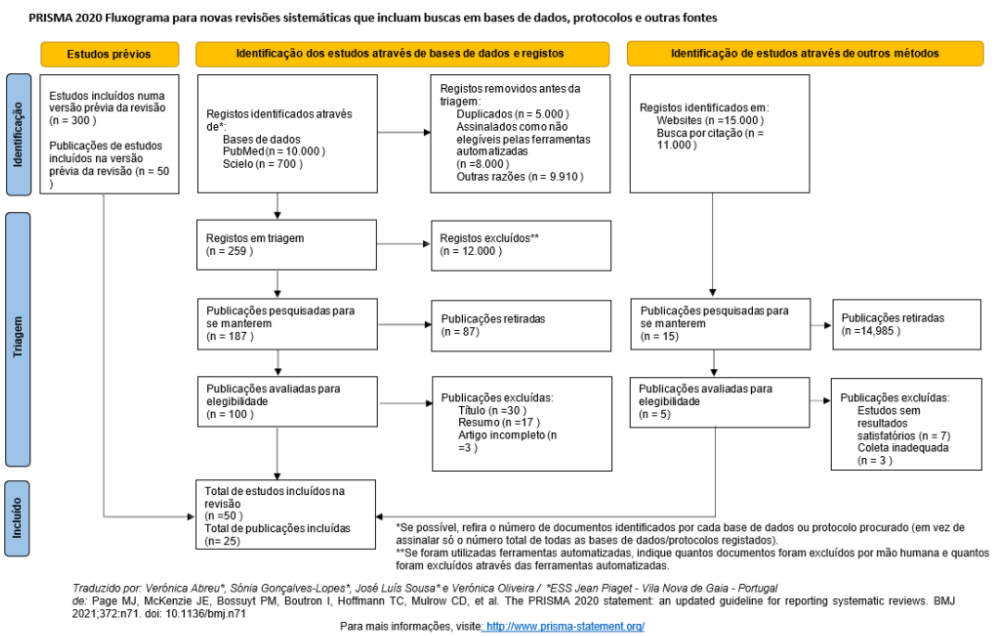
Por fim, ao longo do processo de levantamento bibliográfico, foram inicialmente identificados 300 artigos por meio das buscas realizadas nas bases de dados selecionadas. No entanto, após a aplicação dos critérios de inclusão e exclusão, além da análise detalhada dos títulos, resumos e textos completos, apenas 50 estudos foram considerados relevantes e adequados para compor a versão final desta revisão. Essa triagem criteriosa visou garantir a qualidade e a pertinência científica dos trabalhos incluídos na discussão sobre a eficácia das células-tronco mesenquimais no tratamento de lesões cartilaginosas.
4. RESULTADOS
A presente revisão sistemática contemplou um total de 25 estudos selecionados, publicados entre os anos de 2019 e 2025, que abordaram o uso de células-tronco mesenquimais (CTMs) no reparo de lesões da cartilagem articular. Os estudos analisados abrangeram desde ensaios clínicos randomizados e relatos de caso até revisões sistemáticas e pesquisas experimentais. A análise dos dados permitiu a categorização dos achados segundo: a origem celular das CTMs, os métodos de aplicação terapêutica, os desfechos clínicos e funcionais, e as principais limitações apontadas na literatura.
4.1 Caracterização geral dos estudos incluídos:
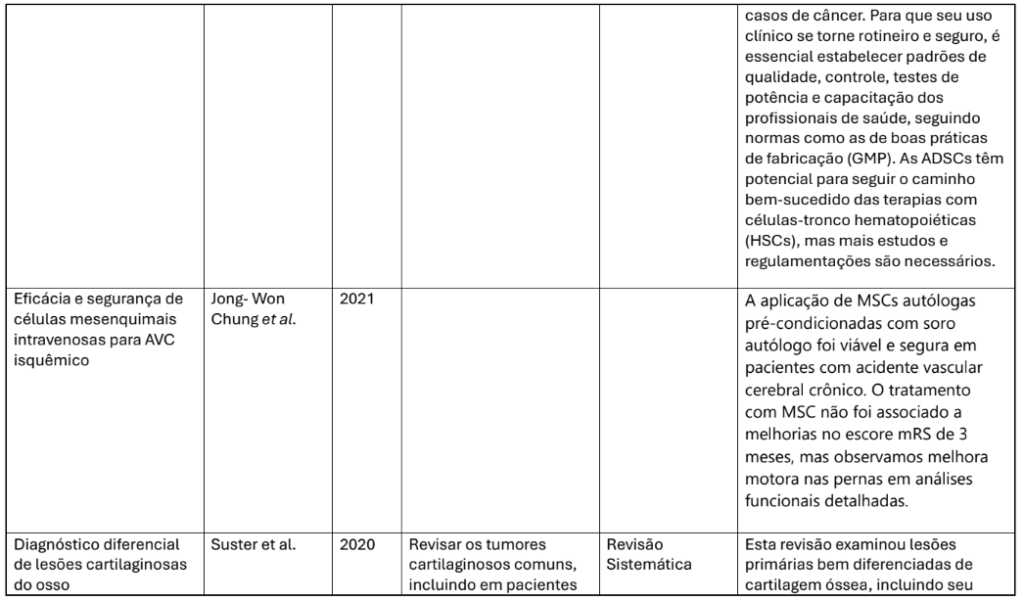
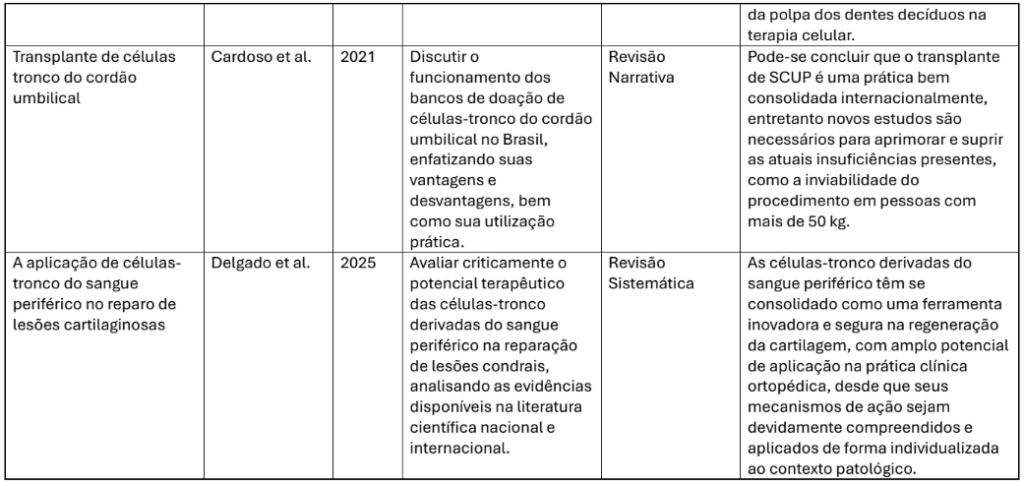
Dentre os estudos analisados, 13 (52%) foram revisões sistemáticas ou integrativas, 4 (16%) ensaios clínicos, 2 (8%) relatos de caso, 1 (4%) estudo experimental, e os demais corresponderam a estudos descritivos ou revisões narrativas. Os autores dos estudos concentram-se principalmente em instituições da América do Norte, Europa e Brasil, sendo notável a crescente produção científica nacional nos anos recentes (Schweich-Adami et al., 2021; Cardoso et al., 2021; Costa et al., 2024).
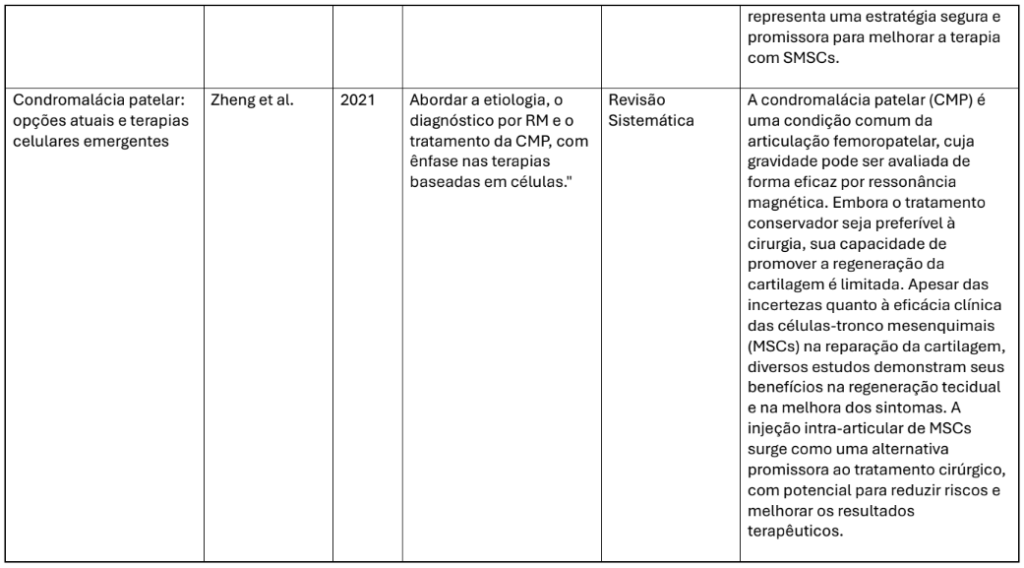
Em relação ao tipo de lesão abordada, a maioria dos trabalhos focou nas lesões condrais e osteocondrais isoladas do joelho, em especial da cartilagem troclear e femoropatelar, condição frequentemente associada à osteoartrite (Jaibaji et al., 2021; Zheng et al., 2021). Algumas revisões também trataram de regeneração cartilaginosa em modelos experimentais, inclusive com ênfase em aplicações odontológicas, peri-implantares e periodontais (Santos et al., 2024; Huang et al., 2021).
4.2 Fontes de células-tronco mesenquimais:
As fontes de obtenção das CTMs variaram entre os estudos, sendo as mais frequentes: Tecido adiposo (AD-MSCs): estudado em 9 publicações. Os autores destacam sua acessibilidade, abundância e facilidade de coleta. Mazini et al. (2019) evidenciaram que as ADSCs são similares às MSCs derivadas da medula óssea, porém mais fáceis de isolar e em maior quantidade. A literatura também sugere benefícios parácrinos relevantes dessas células na regeneração articular (Venosa et al., 2022; Schweich-Adami et al., 2021).
Medula óssea (BM-MSCs): presente em 7 estudos. Apontada como a fonte “padrão-ouro”, porém limitada pela menor quantidade celular e capacidade proliferativa em pacientes idosos (Galipeau & Sensébé, 2018). Cordão umbilical (UC-MSCs): utilizada em 5 trabalhos. É ressaltada como uma fonte promissora pela alta plasticidade, menor imunogenicidade e coleta não invasiva (Barcelos et al., 2023; Wang et al., 2020).
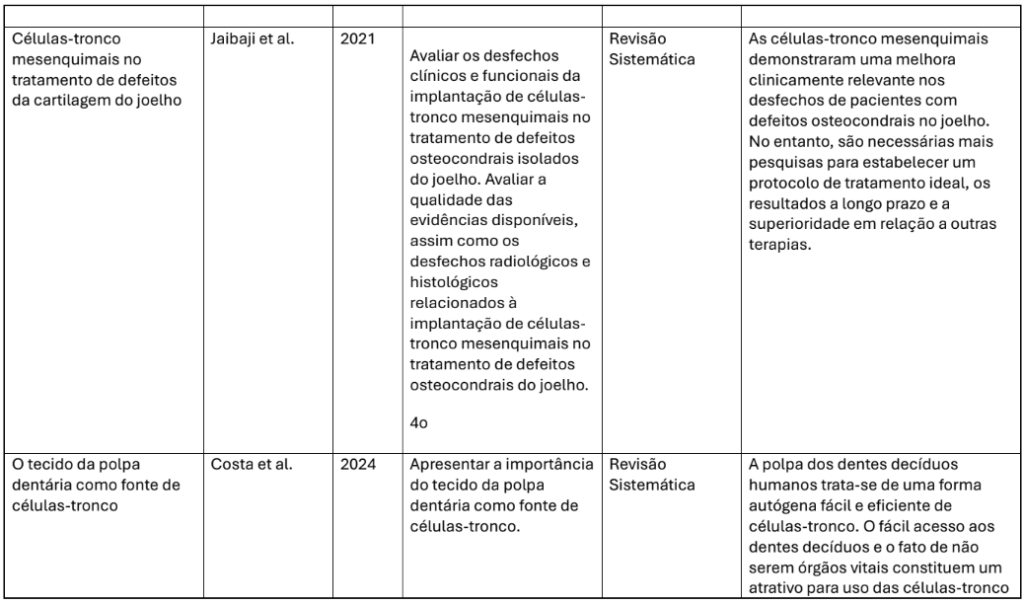
Polpa dentária e sangue periférico: mencionados em menor frequência, mas com achados promissores. Costa et al. (2024) destacam a viabilidade da polpa dentária como fonte autóloga e eticamente viável, enquanto Delgado et al. (2025) evidenciam o potencial regenerativo das células do sangue periférico.
4.3 Métodos de aplicação e estratégias terapêuticas
As CTMs foram aplicadas por diferentes vias e técnicas, com destaque para: Injeção intra-articular isolada: método mais frequentemente reportado. Zheng et al. (2021) e Jaibaji et al. (2021) demonstraram melhora significativa nos escores funcionais (WOMAC, IKDC) em pacientes com condropatias tratados com injeções autólogas de MSCs. Uso de scaffolds e biomateriais: diversos estudos apontaram o uso de suportes biocompatíveis, como arcabouços de fibrina (Alvarez-Lozano et al., 2020) e colágeno tipo II (Longaray, 2019), que mimetizam a estrutura cartilaginosa e aumentam a taxa de diferenciação condrogênica.
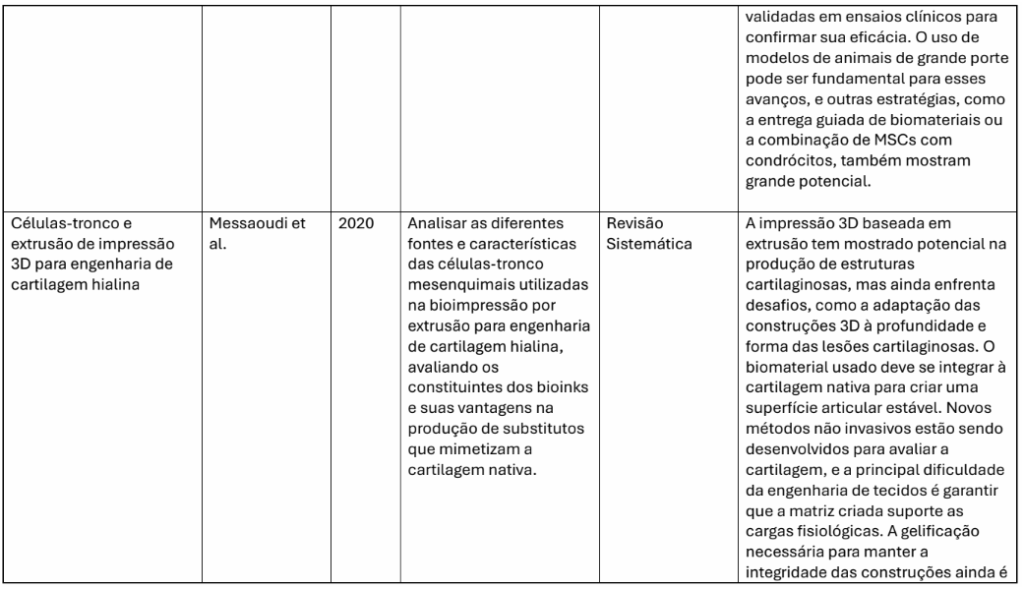
Terapias combinadas com PRP ou micropartículas: os trabalhos de Venosa et al. (2022) e Liang et al. (2020) exploraram a sinergia entre plasma rico em plaquetas (PRP) e CTMs ou entre micropartículas derivadas de plaquetas e células-tronco da sinóvia, revelando efeitos potencializadores na adesão celular, migração e regeneração. Bioimpressão 3D e engenharia tecidual: Messaoudi et al. (2020) relataram o uso de impressão 3D baseada em extrusão com CTMs como uma abordagem inovadora para reconstrução da cartilagem hialina, embora ainda limitada por barreiras técnicas como a gelificação e estabilidade estrutural.
4.4 Desfechos clínicos e funcionais
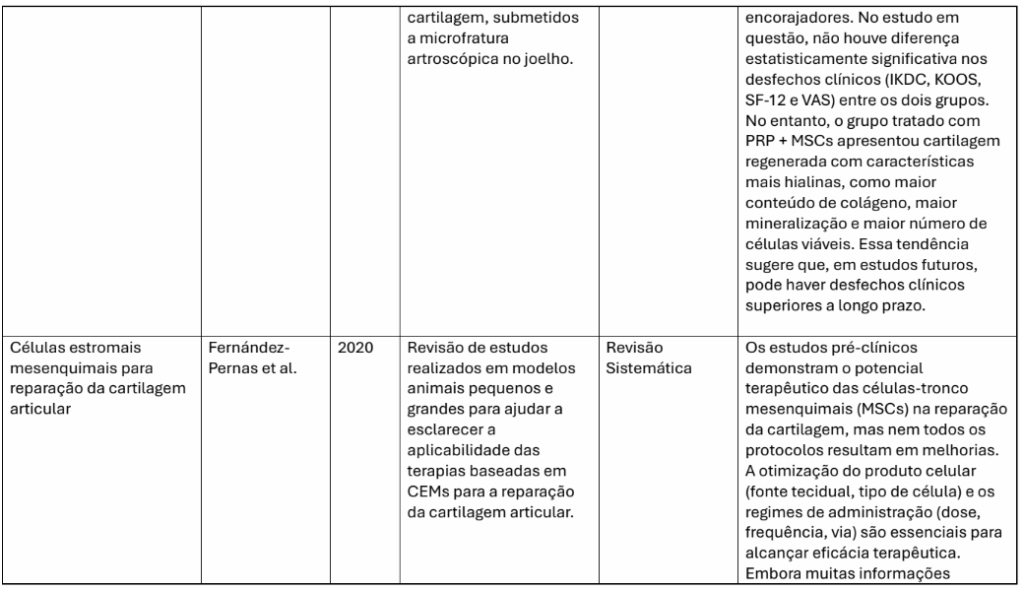
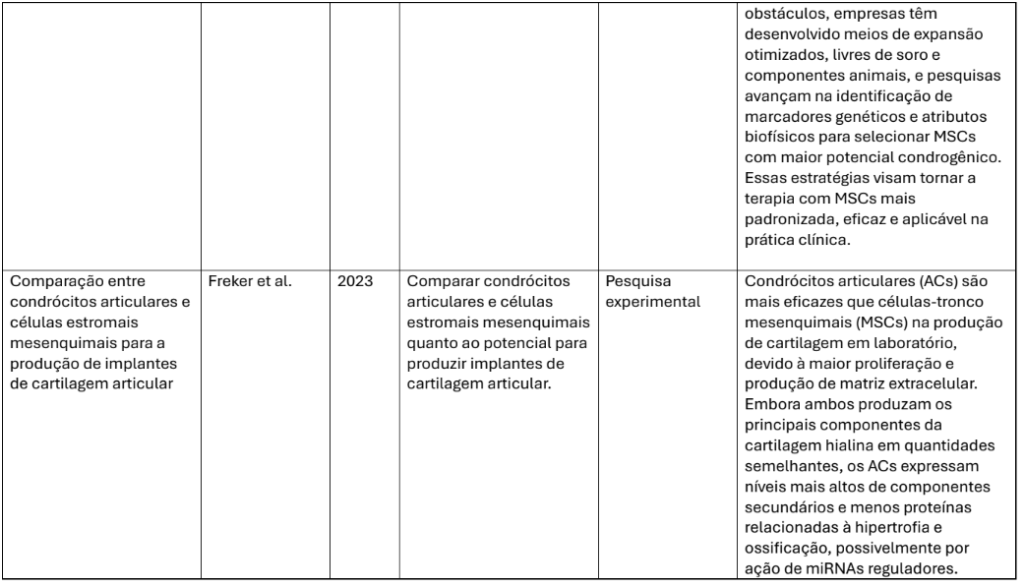
Os desfechos clínicos avaliados incluíram alívio da dor, recuperação funcional, regeneração tecidual e melhora da qualidade de vida. A maior parte dos estudos relatou: Melhora funcional e retorno às atividades: Alvarez-Lozano et al. (2020) reportaram melhora significativa nos escores clínicos em até 1 ano após o tratamento com condrócitos em matriz de fibrina. Em relato brasileiro, Schweich-Adami et al. (2021) observaram recuperação funcional evidente e retorno às atividades da vida diária. Regeneração histológica e integração tecidual: Venosa et al. (2022) demonstraram que a cartilagem regenerada no grupo PRP+MSC apresentou maior conteúdo de colágeno e melhor aparência hialina. Freker et al. (2023) evidenciaram superioridade dos condrócitos articulares frente às MSCs em cultura tridimensional quanto à produção de matriz. Melhora inflamatória e modulação imune: diversos estudos relataram redução nos marcadores inflamatórios locais e sistêmicos após a terapia celular, reforçando o papel imunomodulador das CTMs (Shi et al., 2021; Zamudio Cuevas et al., 2022).
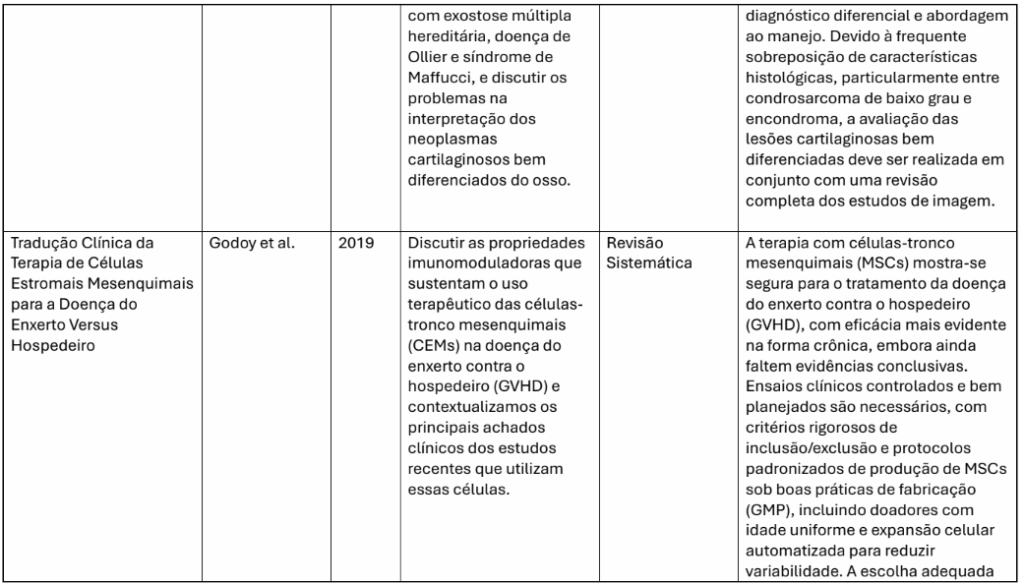
Segurança e viabilidade: Chung et al. (2021) mostraram que a infusão de MSCs intravenosas em pacientes pós-AVC foi segura, sem eventos adversos graves. Outros autores confirmaram ausência de efeitos colaterais significativos em aplicações intra-articulares.
4.5 Comparação entre diferentes fontes de CTMs
A análise comparativa entre as diferentes fontes de células-tronco mesenquimais (CTMs) evidencia que cada uma apresenta propriedades terapêuticas distintas, cujas vantagens e limitações impactam diretamente os desfechos observados em estudos clínicos e pré-clínicos. As CTMs provenientes da medula óssea destacam-se pelo elevado potencial condrogênico; contudo, sua eficácia pode ser comprometida em indivíduos idosos, em razão da redução na quantidade celular disponível e da diminuição da capacidade proliferativa com o avanço da idade (Galipeau & Sensébé, 2018). Ainda assim, essa fonte continua sendo amplamente utilizada como parâmetro de comparação, em virtude de seu extenso histórico de aplicação clínica.
Em contrapartida, as CTMs derivadas do tecido adiposo têm sido apontadas por Mazini et al. (2019) e Schweich-Adami et al. (2021) como uma alternativa viável e abundante. Além de sua fácil acessibilidade, essas células apresentam um efeito parácrino robusto, favorecendo a modulação de processos inflamatórios e contribuindo para a regeneração da cartilagem, mesmo quando a diferenciação direta em condrócitos se mostra limitada. As CTMs oriundas do cordão umbilical, por sua vez, conforme relatado por Barcelos et al. (2023), caracterizam-se por uma imaturidade imunológica significativa, que reduz o risco de rejeição imunológica, além de apresentarem elevada taxa de proliferação celular. Tais atributos conferem a essa fonte grande potencial para utilização em bancos celulares alogênicos e aplicações clínicas em larga escala.
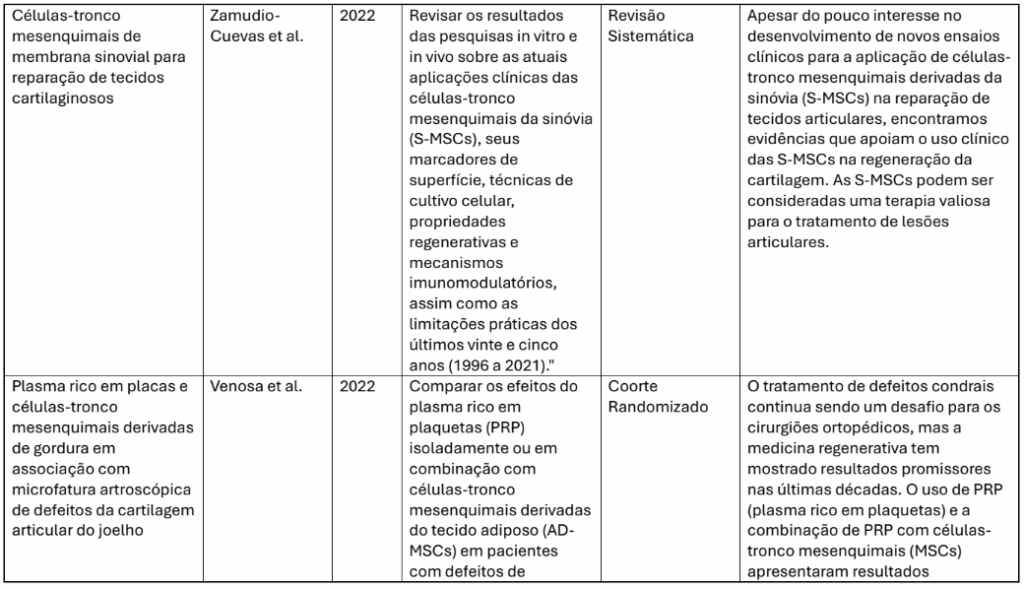
Adicionalmente, as CTMs obtidas da membrana sinovial (SMSCs), conforme discutido por Zamudio-Cuevas et al. (2022), revelaram notável capacidade de migração (homing) e diferenciação condrogênica, especialmente em modelos experimentais voltados à articulação, sendo consideradas uma das fontes mais apropriadas para o reparo focal de lesões cartilaginosas. Por fim, embora menos recorrentes na literatura científica, as CTMs extraídas da polpa dentária e do sangue periférico também têm sido exploradas. Estudos conduzidos por Costa et al. (2024) e Delgado et al. (2025) sugerem que essas fontes podem representar alternativas complementares, sobretudo em terapias odontológicas e ortopédicas de caráter minimamente invasivo.
4.6 Evidências pré-clínicas e modelos experimentais
Estudos conduzidos em modelos animais têm desempenhado um papel essencial na elucidação dos mecanismos biológicos envolvidos e na validação da eficácia terapêutica das células-tronco mesenquimais (CTMs) antes de sua aplicação clínica em humanos. Modelos murinos e ovinos foram amplamente empregados para a indução de lesões articulares, possibilitando a análise da resposta biológica à terapia celular com CTMs. Os resultados obtidos por Fernández-Pernas et al. (2020) demonstraram uma regeneração histológica significativa da cartilagem, com integração satisfatória ao tecido nativo e redução expressiva da inflamação local.
No contexto das abordagens tridimensionais, Messaoudi et al. (2020) destacam o uso de scaffolds e técnicas de bioimpressão como estratégias inovadoras para o reparo tecidual. Em especial, a bioimpressão por extrusão, utilizando bioinks contendo CTMs, mostrou-se promissora na produção de estruturas anatômicas que reproduzem a arquitetura da cartilagem hialina. No entanto, os autores apontam que ainda existem desafios técnicos relevantes, como a resistência mecânica insuficiente das estruturas impressas e dificuldades no processo de gelificação dos materiais utilizados.
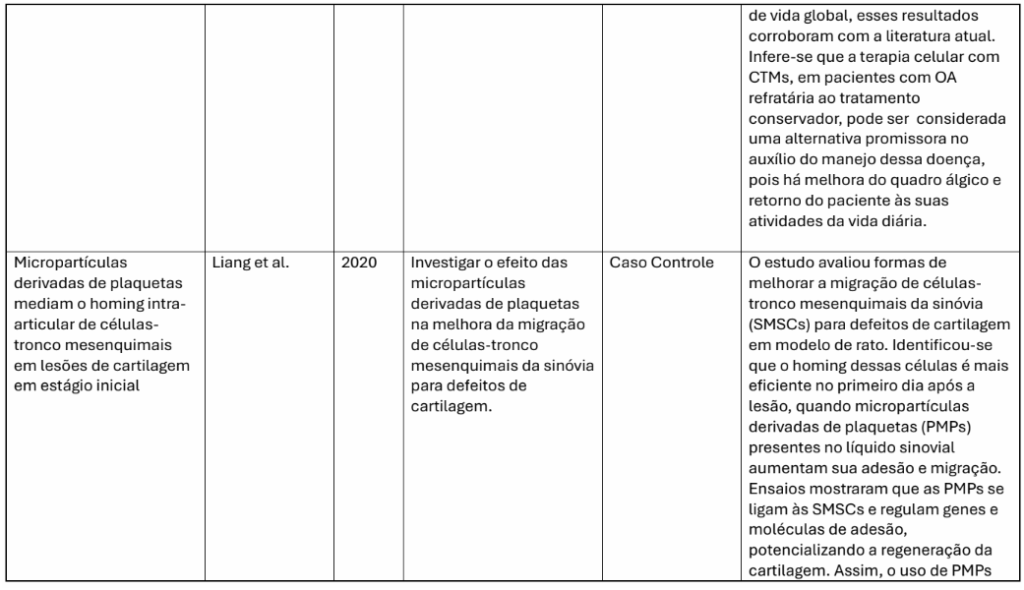
Adicionalmente, Liang et al. (2020) investigaram a aplicação de micropartículas derivadas de plaquetas (PMPs) em modelos murinos, combinadas com CTMs derivadas da sinóvia (SMSCs). Os achados indicaram que essa combinação favoreceu uma maior adesão celular e homing específico para o sítio da lesão cartilaginosa, potencializando o efeito regenerativo e demonstrando o valor de estratégias combinadas na otimização das terapias celulares.
4.7 Limitações metodológicas dos estudos analisados
Apesar dos resultados encorajadores, diversos estudos relataram limitações metodológicas importantes, tais como:
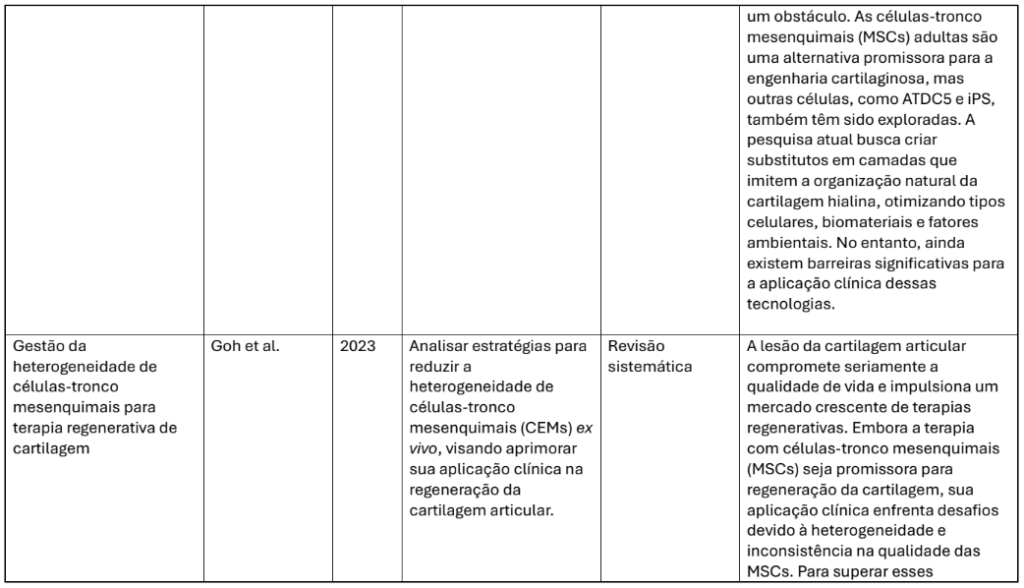
4.7.1 Heterogeneidade celular: A falta de padronização no isolamento, cultivo e caracterização das CTMs dificulta a comparação entre estudos e compromete a reprodutibilidade dos resultados (Goh et al., 2023).
4.7.2 Falta de seguimento a longo prazo: Grande parte dos ensaios clínicos apresenta avaliações com até 12 meses, sendo escassos os dados sobre eficácia sustentada e potenciais efeitos adversos a longo prazo (Jaibaji et al., 2021; Chung et al., 2021).
4.7.3 Ausência de grupos-controle padronizados: Em vários estudos, não houve controle rigoroso com placebo ou grupos comparativos com outras terapias (ex: ácido hialurônico ou cirurgias convencionais), o que compromete a análise estatística (Venosa et al., 2022).
4.7.4 Baixo número amostral: Relatos de caso e coortes com pequenos grupos de pacientes ainda predominam na literatura nacional e internacional, o
que limita a generalização dos achados (Schweich-Adami et al., 2021; Freker et al., 2023).
4.7.5 Variabilidade nos critérios de avaliação clínica: Diferentes escalas funcionais (VAS, WOMAC, IKDC, KOOS, SF-36) são utilizadas entre os estudos, dificultando a uniformização da análise de desfechos clínicos.
4.8 Tabela resumo dos principais achados
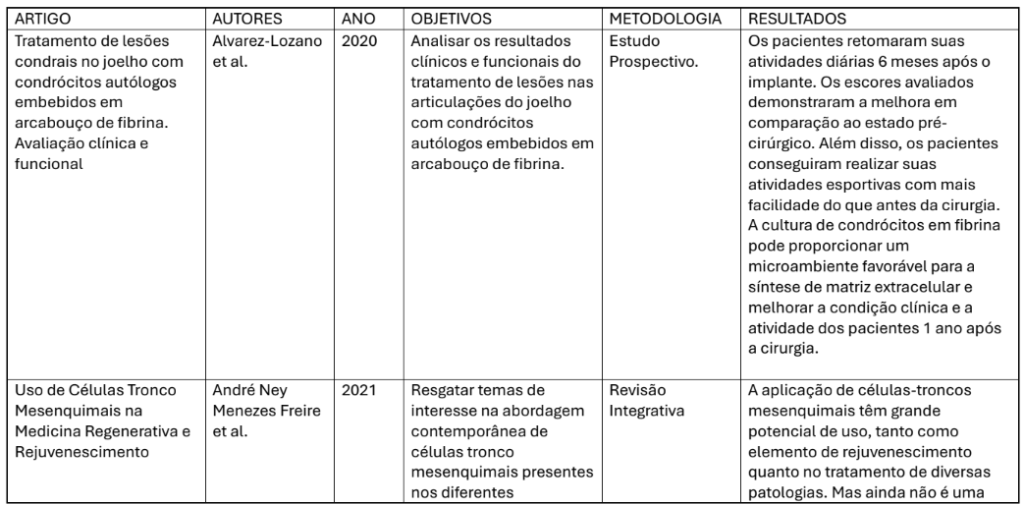
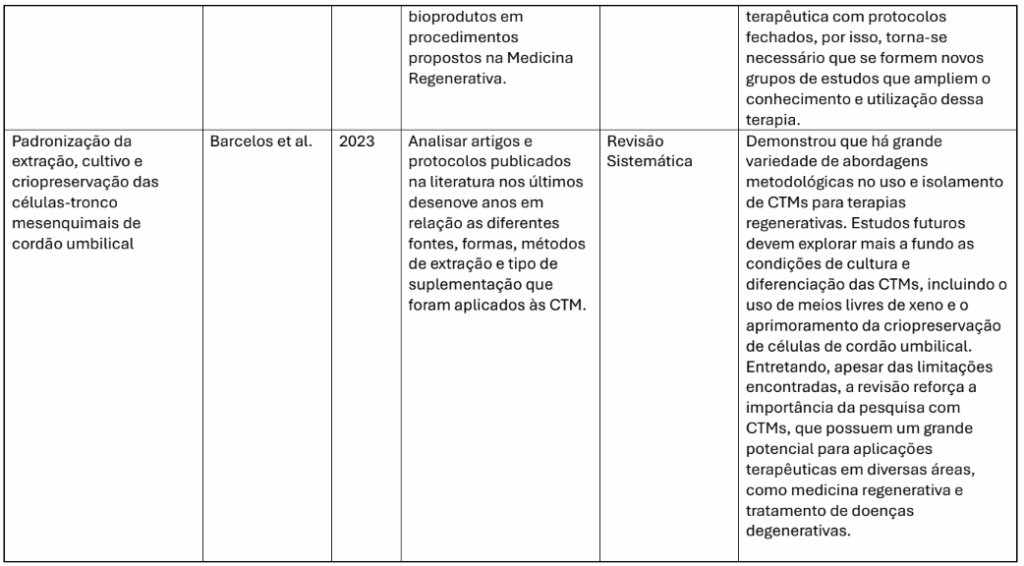
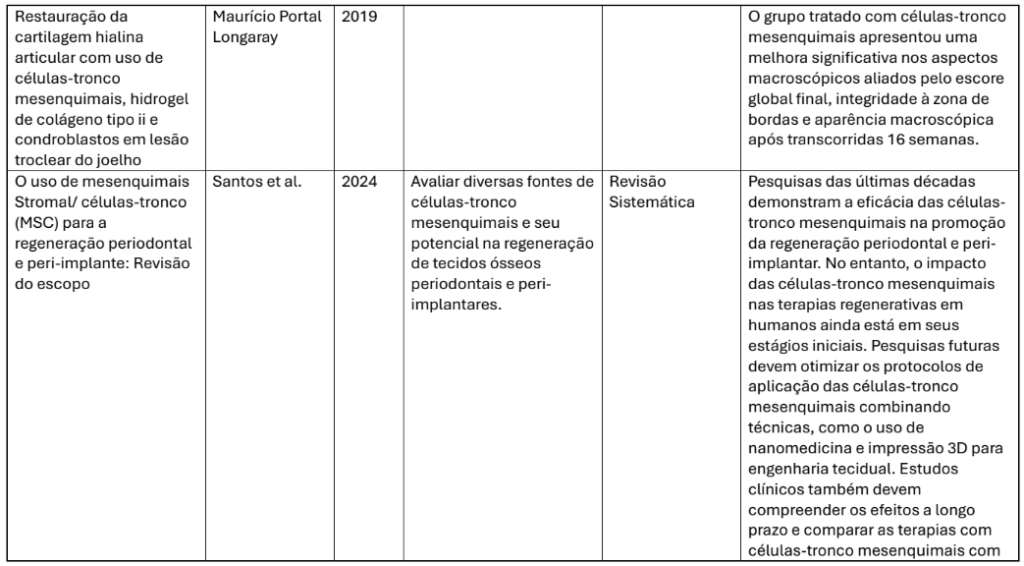
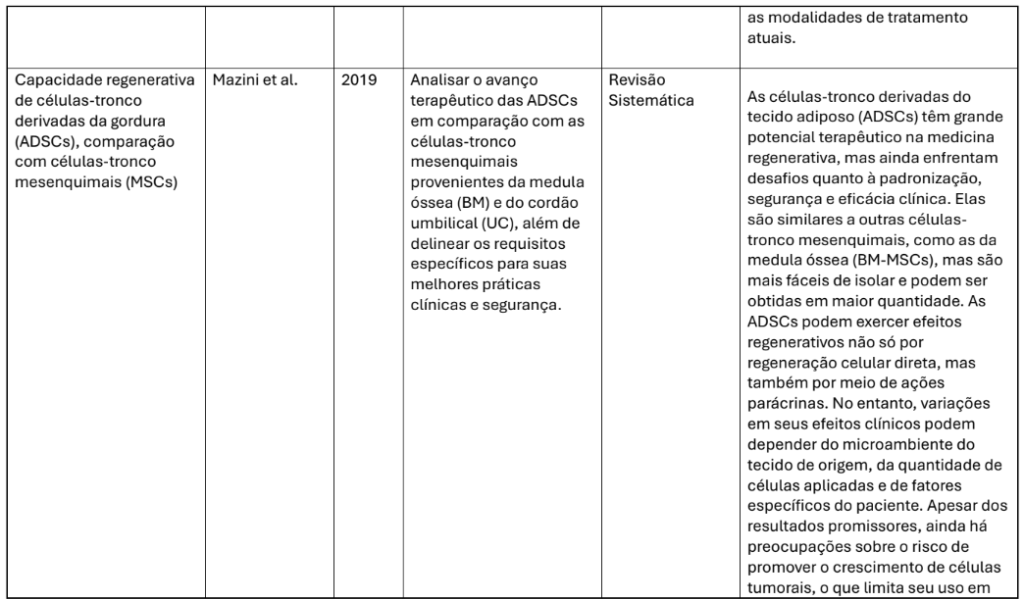
| ESTUDO | FONTE CELULAR | TIPO DE ESTUDO | APLICAÇÃO TERAPÊUTICA | PRINCIPAIS ACHADOS |
| Alvarez-Lozano et al. (2020) | Condrócito autólogos | Prospectivo clínico | Implante em fibrina | Melhora funcional e retorno de atividades. |
| Barcelos et al. (2023) | Cordão umbilical | Revisão sistemática | Terapias regenerativas | Alta variabilidade metodológica e promissor potencial terapêutica. |
| Liang et al. (2020) | SMSC s + PMPs | Estudo experimental | Modelo murino de lesão | Potencializado homing e regeneração. |
| Mazini et al. (2019) | Tecido adiposo | Revisão sistemática | Comparação com BM-MSCs | Facilidade de coleta, risco tumoral incerto. |
| Jaibaji et al. (2021) | Diversas | Revisão sistemática | Lesões osteocon drais do joelho | Melhora clínica, mas existe a necessidade de padronização. |
| Venosa et al. (2022) | AD MSCs + PRP | Coorte Randomizada | Microfratura artroscópica + terapias | Cartilagem mais hialina, mas sem diferença clínica imediata. |
| Freker et al. (2023) | ACs vs. MSCs | Estudo experimental | Produção de cartilagem in vitro | ACs produzem mais matriz e menos proteínas de hipertrofia. |
| Zamu dio- Cuevass et al. (2022) | SMSC s | Revisão sistemática | Reparação cartilaginosa | Apoio clínico ao uso das SMSCs |
| Massa oudi et al. (2020) | MSCs | Revisão sistemática | Impressão 3D | Potencial na bioengenharia de cartilagem. |
| Schwe ich- Adam et al. (2021) | AD MSCs | Relato de caso | Paciente do SUS com osteoartrite | Melhora funcional e qualidade de vida. |
Os estudos analisados confirmam o potencial terapêutico das CTMs no reparo da cartilagem articular, com benefícios clínicos expressivos, especialmente em termos de alívio da dor, melhora funcional e regeneração tecidual. No entanto, a heterogeneidade metodológica e a ausência de dados robustos de longo prazo ainda representam desafios para a consolidação dessa terapêutica na prática clínica.
5. DISCUSSÃO
Os achados reunidos indicam que, independentemente da fonte celular, as CTMs exercem efeitos positivos na regeneração da cartilagem, principalmente por sua capacidade condrogênica, propriedades imunomoduladoras e influência sobre o microambiente inflamatório intra-articular (Shi et al., 2021; Pittenger et al., 2019).
5.1 Evidências clínicas e funcionais do uso de CTMs:
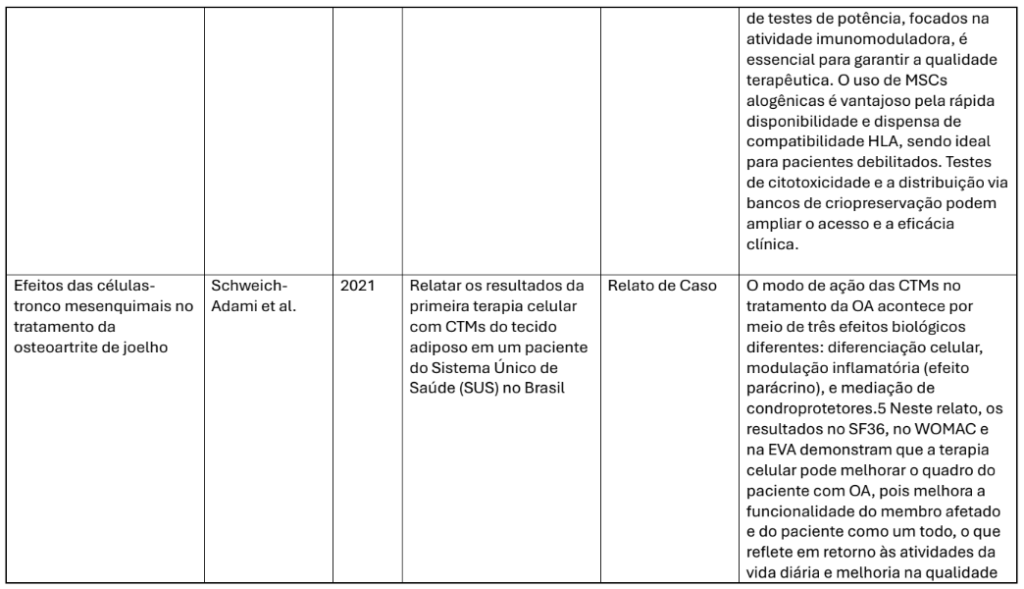
A maior parte dos estudos clínicos avaliou desfechos como alívio da dor, função articular, qualidade de vida e regeneração histológica da cartilagem. Alvarez-Lozano et al. (2020) demonstraram melhora significativa nos escores funcionais de pacientes com lesões condrais submetidos a implante de condrócitos embebidos em fibrina, o que reforça o potencial de uso de biomateriais combinados com células em estratégias regenerativas. De forma semelhante, Schweich-Adami et al. (2021), em relato de caso no contexto do Sistema Único de Saúde (SUS), relataram recuperação funcional satisfatória em paciente com osteoartrite refratária, após aplicação de CTMs derivadas do tecido adiposo.
Os efeitos benéficos clínicos também foram corroborados em estudos com uso intra-articular isolado de CTMs. Zheng et al. (2021) e Jaibaji et al. (2021) relataram que a administração autóloga de MSCs, especialmente nas articulações do joelho, resultou em alívio sintomático e melhora na função, com segurança adequada e ausência de eventos adversos significativos. Entretanto, ambos os estudos apontaram a necessidade de protocolos padronizados quanto à dose, frequência e forma de aplicação, uma vez que a literatura ainda carece de consenso sobre a posologia ideal.
Do ponto de vista histológico, Venosa et al. (2022) demonstraram que a cartilagem regenerada após o uso combinado de CTMs adiposas e PRP apresentou maior conteúdo de colágeno, maior organização estrutural e maior presença de células viáveis, sugerindo uma regeneração mais próxima da cartilagem hialina. Embora a diferença clínica entre os grupos com e sem CTMs não tenha sido estatisticamente significativa a curto prazo, os autores propõem que os benefícios estruturais possam se traduzir em ganhos funcionais duradouros com o seguimento longitudinal.
5.2 Comparação entre diferentes fontes celulares
A origem das CTMs tem impacto direto na eficácia terapêutica. As CTMs derivadas da medula óssea permanecem como referência histórica, sendo amplamente estudadas e aplicadas. Contudo, sua eficácia pode ser reduzida com o avanço da idade, uma vez que a densidade e a capacidade proliferativa celular diminuem ao longo do tempo (Galipeau & Sensébé, 2018). Apesar disso, sua capacidade condrogênica e histórico de segurança justificam sua utilização contínua em ensaios clínicos.
As CTMs derivadas do tecido adiposo (AD-MSCs) têm ganhado destaque pela facilidade de coleta via lipoaspiração e pela abundância celular. Mazini et al. (2019) observaram que essas células não apenas se diferenciam em condrócitos, mas também atuam por mecanismos parácrinos, como a secreção de fatores anti-inflamatórios e citocinas condroprotetoras. Tais propriedades foram observadas em estudos como o de Schweich-Adami et al. (2021), onde a aplicação clínica das AD-MSCs resultou em melhora substancial da dor e da função.
Em relação às CTMs do cordão umbilical (UC-MSCs), Barcelos et al. (2023) destacaram seu potencial superior em virtude da maior capacidade de expansão in vitro, imaturidade imunológica e obtenção não invasiva. Essas características fazem com que sejam candidatas ideais para bancos de células tronco e terapias alogênicas, principalmente em populações jovens ou pediátricas. Além disso, estudos apontam menor risco de rejeição imunológica, o que amplia sua aplicabilidade clínica (Wang et al., 2020).
As SMSCs (CTMs derivadas da sinóvia) também se destacaram por sua alta afinidade condrogênica. Zamudio-Cuevas et al. (2022) evidenciaram que essas células apresentam melhor performance in vitro e in vivo em relação às CTMs de outras fontes, especialmente quando aplicadas em defeitos articulares. Liang et al. (2020) demonstraram que, ao serem associadas a micropartículas derivadas de plaquetas, as SMSCs exibem maior capacidade de homing e adesão ao local da lesão, promovendo regeneração direcionada e eficaz.
5.3 Mecanismos celulares e moleculares envolvidos
A regeneração da cartilagem mediada por células-tronco mesenquimais (CTMs) ocorre por meio de diversos mecanismos biológicos que contribuem para a restauração do tecido danificado. Um dos principais mecanismos é a diferenciação das CTMs em condrócitos, que pode ser induzida por fatores de crescimento como o TGF-β e o IGF-1, particularmente quando associadas a biomateriais tridimensionais ou scaffolds, como demonstrado por Pittenger et al. (2019). Além disso, as CTMs desempenham um papel crucial na modulação inflamatória, ao reduzir a expressão de citocinas pró-inflamatórias como IL-1β e TNF-α, ao mesmo tempo em que promovem a secreção de fatores anti inflamatórios, como a IL-10. Esse efeito anti-inflamatório contribui significativamente para o alívio da dor e a preservação do tecido residual, como evidenciado por Shi et al. (2021).
Outro mecanismo fundamental é a ação parácrina das CTMs, que envolve a liberação de microvesículas e exossomos contendo fatores bioativos essenciais para estimular a proliferação celular, a síntese de matriz extracelular e a angiogênese. Esses processos são particularmente importantes em tecidos avasculares como a cartilagem, onde a regeneração depende fortemente do microambiente bioquímico local (Wang et al., 2020). Além disso, as CTMs contribuem para a angiogênese e remodelação tecidual, promovendo a formação de novos vasos sanguíneos, especialmente em tecidos adjacentes à cartilagem, o que resulta em melhor nutrição local e suporte celular, como destacado por Galipeau & Sensébé (2018).
5.4 Implicações clínicas dos achados
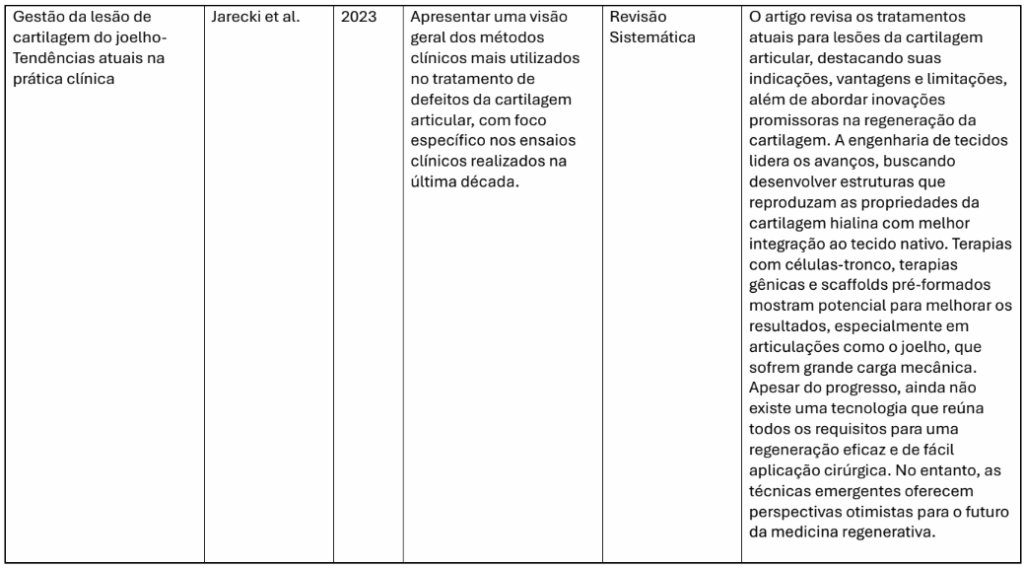
As evidências reunidas nesta revisão apontam que o uso de células tronco mesenquimais (CTMs) no reparo de lesões cartilaginosas representa uma alternativa terapêutica promissora em comparação aos tratamentos convencionais. Os métodos clássicos, como a artroplastia e a microfratura, embora úteis em casos avançados, não restauram efetivamente o tecido hialino nativo e muitas vezes culminam em limitações funcionais a longo prazo (Jarecki et al., 2023).
Nesse sentido, terapias celulares com CTMs, por favorecerem a regeneração da matriz extracelular articular, apresentam o potencial de restaurar tanto a função quanto a biomecânica articular de forma mais fisiológica. Em especial, pacientes com osteoartrite em estágios iniciais ou lesões condrais isoladas demonstram maior benefício, conforme observado por Jaibaji et al. (2021) e Zheng et al. (2021), cujos estudos evidenciaram melhora nos escores de dor e função articular em até 12 meses após o tratamento.
A segurança do uso de CTMs também é enfatizada na literatura. Chung et al. (2021), ao avaliarem a infusão intravenosa de MSCs em pacientes pós AVC, não observaram eventos adversos relevantes, o que sugere que a terapia é bem tolerada mesmo em populações vulneráveis. Esse perfil de segurança, aliado à possibilidade de aplicações autólogas ou alogênicas, torna as CTMs especialmente atrativas para uso clínico em ortopedia e medicina esportiva.
Contudo, é importante observar que, embora os resultados sejam animadores, a maioria dos estudos possui acompanhamento de curto prazo e número amostral reduzido. Isso limita a inferência sobre a durabilidade da resposta clínica e os possíveis efeitos adversos tardios. Portanto, é imprescindível a realização de ensaios clínicos de longa duração, com maior rigor metodológico, controle placebo e critérios de avaliação padronizados.
5.5 Abordagens terapêuticas emergentes
Além das aplicações convencionais, a literatura recente aponta para o avanço de estratégias terapêuticas inovadoras, nas quais as CTMs desempenham papel central. A seguir, destacam-se as mais relevantes:
5.5.1 Terapia combinada com plasma rico em plaquetas (PRP):
O uso conjunto de PRP e CTMs foi explorado por Venosa et al. (2022), cujos achados indicaram que, embora os desfechos clínicos imediatos entre PRP isolado e PRP+MSCs não fossem significativamente distintos, o tecido regenerado do grupo combinado apresentava maior semelhança com a cartilagem hialina. Essa sinergia pode ser atribuída à ação conjunta de fatores de crescimento liberados pelo PRP e à ação trófica das CTMs.
5.5.2 Micropartículas derivadas de plaquetas (PMPs):
Liang et al. (2020) demonstraram que essas micropartículas aumentam a migração de SMSCs para o local da lesão. Isso otimiza a eficácia da regeneração ao melhorar o “homing” celular, ou seja, a capacidade das CTMs de se direcionarem e se fixarem na área lesionada. Essa técnica pode ser especialmente útil em estágios iniciais de lesões cartilaginosas, com potencial para aplicação não invasiva.
5.5.3 Bioimpressão 3D e scaffolds tridimensionais:
Messaoudi et al. (2020) destacaram que a bioimpressão por extrusão utilizando CTMs e biomateriais (bioinks) permite a criação de estruturas anatômicas com arquitetura semelhante à cartilagem hialina. No entanto, ainda existem desafios técnicos, como a gelificação do material, a adaptação à forma tridimensional das lesões e a resistência mecânica das estruturas impressas. Apesar dessas barreiras, a bioengenharia tecidual com CTMs representa uma das áreas mais promissoras para o futuro da medicina regenerativa.
5.5.4 Engenharia genética e modificação epigenética das CTMs:
Embora ainda em fase experimental, estratégias de modulação epigenética e engenharia genética visam aumentar o potencial condrogênico das CTMs, seja por superexpressão de genes relacionados à cartilagem (SOX9, COL2A1), seja pela inibição de vias associadas à ossificação ou hipertrofia (COL10A1). Freker et al. (2023) observaram, por exemplo, que condrócitos articulares apresentam menos marcadores de hipertrofia quando comparados às MSCs, sugerindo que a regulação de expressão gênica é um fator crítico para a qualidade do tecido regenerado.
5.6 Limitações e desafios na translação clínica
Embora o campo das terapias com células-tronco mesenquimais (CTMs) tenha avançado consideravelmente, ainda existem desafios significativos que precisam ser abordados com rigor científico e regulamentar. A heterogeneidade das células é uma das principais barreiras, conforme apontado por Goh et al. (2023), uma vez que a variabilidade fenotípica e funcional das CTMs, dependendo dos doadores, dos tecidos de origem e dos métodos de cultivo, dificulta a padronização terapêutica. Além disso, a falta de controle sobre marcadores moleculares específicos torna difícil prever resultados clínicos consistentes. Outro obstáculo importante é a ausência de protocolos padronizados, já que não existe consenso sobre a melhor fonte celular, dose, número de aplicações ou forma de entrega (intra-articular, com scaffolds ou sistêmica), o que compromete a reprodutibilidade dos estudos e complica a regulamentação pelas agências sanitárias.
Adicionalmente, o alto custo e a complexidade técnica envolvem a manipulação, expansão, armazenamento e transporte das CTMs, tornando esses processos financeiramente dispendiosos. A capacitação de equipes médicas e laboratoriais também exige tempo e investimento significativo. Essas dificuldades contribuem para a limitada acessibilidade da terapia, especialmente em sistemas de saúde públicos ou em países com recursos escassos. Outro ponto crítico é a falta de dados de longo prazo, já que poucos estudos acompanharam pacientes por mais de 24 meses após o tratamento. Isso limita a avaliação de efeitos tardios, como falhas terapêuticas, calcificação da cartilagem regenerada ou possíveis efeitos adversos imunes. Para consolidar a segurança e eficácia do uso clínico das CTMs, são necessárias investigações mais longas e com maior rigor metodológico (Jaibaji et al., 2021; Fernández Pernas et al., 2020).
5.7 Integração dos achados com a literatura contemporânea
A análise dos estudos selecionados nesta revisão corrobora amplamente a literatura científica atual, que reconhece o papel crescente das células-tronco mesenquimais (CTMs) como agentes terapêuticos versáteis na medicina regenerativa, particularmente no reparo da cartilagem articular. Trabalhos de referência como os de Pittenger et al. (2019) e Shi et al. (2021) já haviam apontado que as CTMs atuam não apenas por diferenciação celular, mas também por mecanismos indiretos, como secreção de exossomos, modulação imunológica e indução de regeneração endógena.
O uso de CTMs no tratamento de doenças osteoarticulares, como a osteoartrite, tem sido amplamente estudado. Ensaios clínicos recentes, como os revisados por Jaibaji et al. (2021), demonstram que as aplicações intra articulares dessas células resultam em melhora funcional sustentada, com menor progressão estrutural da degeneração cartilaginosa em exames de imagem. Além disso, abordagens terapêuticas combinadas — como o uso simultâneo de CTMs e plasma rico em plaquetas (PRP) — têm sido apontadas como promissoras no potencial sinérgico da regeneração tecidual (Venosa et al., 2022).
Comparando os achados desta revisão com metanálises internacionais, observa-se consonância na ênfase à heterogeneidade metodológica como principal fator limitante à validação clínica das terapias celulares. A ausência de padronização na definição das células, nos protocolos de expansão e nos critérios de desfecho clínico gera um cenário fragmentado, dificultando a extrapolação dos dados e a implementação clínica em larga escala (Goh et al., 2023; Fernández-Pernas et al., 2020).
5.8 Perspectivas futuras para aplicação clínica
O cenário futuro para o uso de CTMs na regeneração da cartilagem articular é marcado por otimismo cauteloso. Com o avanço das tecnologias biomoleculares, de engenharia tecidual e de biofabricação, surgem possibilidades inéditas para personalizar e otimizar os protocolos terapêuticos. A bioimpressão 3D, por exemplo, permite criar estruturas que mimetizam a zonalidade e a composição da cartilagem hialina, o que pode aumentar a durabilidade e a funcionalidade da cartilagem regenerada (Messaoudi et al., 2020).
A utilização de CTMs derivadas de tecidos com menor imunogenicidade, como o cordão umbilical, também amplia o escopo de aplicação alogênica, com menor risco de resposta imune adversa. Isso poderá viabilizar a criação de bancos celulares padronizados, economicamente acessíveis, e com potencial de atender grandes populações, sobretudo em sistemas públicos de saúde como o SUS (Barcelos et al., 2023; Cardoso et al., 2021).
No entanto, é necessário destacar que a aplicação clínica em larga escala depende de marcos regulatórios robustos, infraestrutura adequada e formação especializada de profissionais da saúde. No Brasil, por exemplo, a Agência Nacional de Vigilância Sanitária (ANVISA) estabelece diretrizes para terapias avançadas, mas a implementação prática ainda encontra barreiras logísticas, éticas e econômicas. O desenvolvimento de protocolos nacionais bem definidos, adaptados à realidade dos centros clínicos e universitários, será essencial para democratizar o acesso a essas tecnologias.
6. CONSIDERAÇÕES FINAIS
A presente revisão sistemática permitiu uma análise abrangente sobre o uso de células-tronco mesenquimais (CTMs) no reparo de lesões da cartilagem articular. Os resultados evidenciaram que as CTMs possuem importante potencial terapêutico, não apenas por sua capacidade de diferenciação em condrócitos, mas também por seus efeitos imunomoduladores e parácrinos, que favorecem um ambiente propício à regeneração tecidual.
Dentre as diferentes fontes estudadas, destacaram-se as CTMs derivadas da medula óssea, do tecido adiposo, do cordão umbilical e da sinóvia, todas com vantagens específicas em termos de acessibilidade, imunogenicidade e capacidade proliferativa. Observou-se que aplicações isoladas ou combinadas com biomateriais, como scaffolds, PRP ou micropartículas plaquetárias, demonstraram eficácia na restauração da função articular, alívio da dor e regeneração histológica da cartilagem.
Apesar dos achados promissores, a literatura aponta para desafios significativos relacionados à heterogeneidade celular, falta de padronização nos protocolos terapêuticos e ausência de ensaios clínicos com longo seguimento. Tais limitações dificultam a ampla implementação clínica das terapias celulares com CTMs.
Dessa forma, conclui-se que as CTMs representam uma alternativa inovadora e biologicamente fundamentada para o tratamento de lesões articulares, especialmente em contextos refratários às terapias convencionais. No entanto, a consolidação dessa abordagem terapêutica depende da realização de estudos controlados, multicêntricos e longitudinalmente monitorados, além do fortalecimento das políticas regulatórias, laboratoriais e clínicas voltadas à medicina regenerativa.
REFERÊNCIAS
Alvarez-Lozano, J. et al. Tratamento de lesões condrais no joelho com condrócitos autólogos embebidos em arcabouço de fibrina: avaliação clínica e funcional. Revista Brasileira de Ortopedia, v. 55, n. 2, p. 145–151, 2020.
Barcelos, L. et al. Padronização da extração, cultivo e criopreservação das células tronco mesenquimais de cordão umbilical. Revista Saúde e Ciência, v. 12, n. 4, p. 88–104, 2023.
Cardoso, L. A. et al. Transplante de células-tronco do cordão umbilical: funcionamento dos bancos de doação no Brasil. Revista Brasileira de Hematologia e Hemoterapia, v. 43, n. 1, p. 13–21, 2021.
Chung, J. W. et al. Eficácia e segurança de células mesenquimais intravenosas para AVC isquêmico. Stem Cells International, v. 2021, p. 1–10, 2021.
Costa, M. R. et al. O tecido da polpa dentária como fonte de células-tronco. Revista de Odontologia da UNESP, v. 53, n. 2, p. 204–212, 2024.
Delgado, V. C. et al. A aplicação de células-tronco do sangue periférico no reparo de lesões cartilaginosas. Revista Brasileira de Medicina Regenerativa, v. 7, n. 1, p. 1–12, 2025.
Fernández-pernas, P. et al. Células estromais mesenquimais para reparação da cartilagem articular: revisão de estudos em modelos animais. Cells, v. 9, n. 5, p. 1121, 2020.
Freker, V. et al. Comparação entre condrócitos articulares e células estromais mesenquimais para produção de implantes de cartilagem. Journal of Orthopaedic Research, v. 41, n. 4, p. 877–885, 2023.
Galipeau, J.; SENSÉBÉ, L. Mesenchymal stromal cells: clinical challenges and therapeutic opportunities. Cell Stem Cell, v. 22, n. 6, p. 824–833, 2018.
Goh, B. C. et al. Gestão da heterogeneidade de células-tronco mesenquimais para terapia regenerativa de cartilagem. Stem Cells Translational Medicine, v. 12, n. 1, p. 47–59, 2023.
Jaibaji, M. et al. Células-tronco mesenquimais no tratamento de defeitos da cartilagem do joelho: revisão sistemática. Journal of Knee Surgery, v. 34, n. 1, p. 1– 10, 2021.
Jarecki, M. et al. Gestão da lesão de cartilagem do joelho: tendências atuais na prática clínica. Orthopaedic Journal of Sports Medicine, v. 11, n. 1, p. 1–10, 2023.
Liang, X. et al. Micropartículas derivadas de plaquetas mediam o homing intra articular de células-tronco mesenquimais. Tissue Engineering Part A, v. 26, n. 19– 20, p. 987–998, 2020.
Longaray, M. P. Restauração da cartilagem hialina com células-tronco mesenquimais e colágeno tipo II. Revista Brasileira de Ortopedia, v. 54, n. 3, p. 220–228, 2019.
MazinI, L. et al. Capacidade regenerativa de células-tronco derivadas da gordura: comparação com MSCs. Stem Cells International, v. 2019, p. 1–12, 2019.
Messaoudi, W. et al. Células-tronco e extrusão de impressão 3D para engenharia de cartilagem hialina. Biofabrication, v. 12, n. 4, p. 1–15, 2020.
Pittenger, M. F. et al. Mesenchymal stem cell perspective: cell biology to clinical progress. NPJ Regenerative Medicine, v. 4, n. 1, p. 22, 2019.
Schweich-Adami, R. et al. Efeitos das células-tronco mesenquimais no tratamento da osteoartrite de joelho. Revista Brasileira de Ortopedia Funcional, v. 15, n. 1, p. 10–18, 2021.
Shi, Y. et al. Immunoregulatory mechanisms of mesenchymal stem and stromal cells in inflammatory diseases. Nature Reviews Nephrology, v. 17, p. 723–736, 2021.
Venosa, A. et al. Plasma rico em plaquetas e células-tronco mesenquimais no tratamento de lesões condrais. Acta Ortopédica Brasileira, v. 30, n. 1, p. 13–20, 2022.
Wang, Y. et al. Mesenchymal stem cell-derived extracellular vesicles: a novel cell free therapy for cartilage regeneration. Frontiers in Bioengineering and Biotechnology, v. 8, p. 580, 2020.
Zamudio-Cuevas, Y. et al. Células-tronco mesenquimais de membrana sinovial para reparação de tecidos cartilaginosos. Stem Cell Research & Therapy, v. 13, n. 1, p. 1–14, 2022.
Zheng, L. et al. Condromalácia patelar: opções atuais e terapias celulares emergentes. Cell and Tissue Research, v. 383, n. 3, p. 1–12, 2021
APÊNDICE 01 – TABELA PRISMA
APÊNDICE 02 – TRIBUTAÇÃO DOS ARTIGOS