EFFECT OF CLONAZEPAM AND MELATONIN ON THE MEMORY OF WISTAR RATS SUBJECTED TO SLEEP DEPRIVATION
REGISTRO DOI: 10.5281/zenodo.10708191
Amanda Fuchshuber Miola1; Andressa Aparecida da Silva2; Andressa Mott3; Bruna Pereira Bitencourt da Silva4; Joaquim Carlos Saldeira Junior5; Mykael Chrystian Dreveck6; Erica Cristina Bueno do Prado Guirro7
Resumo
O fármaco clonazepam é empregado no tratamento de insônia e a melatonina é o hormônio que está relacionado ao ciclo circadiano de sono/vigília. Esse estudo avaliou o efeito do clonazepam e melatonina em relação à memória de curto e longo prazo de ratos Wistar submetidos à 24 horas de privação de sono. 96 animais formaram 12 grupos experimentais para essa avaliação. Os animais receberam a medicação conforme o seu grupo e 24 horas após avaliou-se a memória com o teste de reconhecimento de objeto, sendo que animais sem déficit de memória permanecem mais tempo com um objeto novo (ON) do que com um objeto familiar (OF). Utilizou-se ANOVA de duas vias (tratamento e privação de sono) com medidas repetidas (objeto novo e familiar) e após o teste post hoc (Newman-Keuls). Os grupos de melatonina tiveram menos tempo com OC e mais com ON, independente da privação ou não de sono, ou seja, ela não prejudicou a memória dos animais, ao contrário do observado com o grupo que recebeu clonazepam.
Palavras-chave: Benzodiazepínico. Cognição. Hormônio. Insônia.
ABSTRACT
Clonazepam is used to treat insomnia and melatonin is the hormone related to the circadian sleep/wake cycle. This study evaluated the effect of clonazepam and melatonin in relation to the short and long-term memory of Wistar rats subjected to 24 hours of sleep deprivation. 96 animals formed 12 experimental groups for this evaluation. The animals received the medication according to their group and 24 hours after evaluating their memory with the object recognition test, with animals without a deficit spending more time with a new object (ON) than with a familiar object (DE). Two-way ANOVA (treatment and sleep deprivation) with repeated measures (new and familiar object) and post hoc test (Newman-Keuls) were used. The melatonin groups had less time with OC and more with ON, regardless of sleep deprivation or not, that is, it did not harm the animals’ memory, unlike the presentation with the group that received clonazepam.
Keywords: Benzodiazepine. Cognition. Hormone. Insomnia.
Introdução
O sono é uma propriedade fisiológica necessária para a manutenção da homeostase do organismo. A modificação do estado de consciência promovida pelo sono colabora para o funcionamento de atividades endócrinas, controle térmico, aprendizado, consolidação da memória, renovação de componentes celulares, conservação e restauração de energia, regulação hormonal, metabolismo dos carboidratos e aumento de marcadores inflamatórios (RIBEIRO et al., 2014; WIENER, 2016). Nesse contexto, perturbações do sono podem gerar consequências graves, comprometendo a qualidade de vida, o funcionamento físico, ocupacional, cognitivo e social do indivíduo (BILLIARD; BENTLEY, 2004; JANSEN et al., 2007).
O sono possui dois estágios: o sono de movimentos oculares não rápidos (NREM) e o de movimentos oculares rápidos (REM). O primeiro é composto por três etapas (N1, N2, N3) que se comportam em grau crescente de profundidade e é caracterizado pela redução gradativa da atividade cerebral, pelo relaxamento muscular com manutenção do tônus, além da diminuição dos movimentos corporais e das ondas eletroencefalográficas regulares (FERNANDES, 2006). Já o estágio REM é caracterizado por movimentos oculares rápidos, hipotonia ou atonia muscular, conservação da respiração, dessincronização nas ondas eletroencefalográficas e supressão da atividade na eletromiografia (DA SILVA, 1996). Nesse sentido, o ciclo sono-vigília geralmente ocorre na seguinte sequência: vigília, N1, N2, N3 e REM (NEVES et al., 2013). As informações aprendidas requerem um período de sono adequado para serem retidas e é, possivelmente, durante o estágio de sono REM que são fixadas a longo ou a curto prazo. Dessa forma a privação ou o sono de má qualidade podem comprometer o processo de memorização e o raciocínio lógico (IDZIKOWSKI, 1984).
O estado de despertar é gerado através de uma interação dinâmica entre neurotransmissores como noradrenalina, serotonina, acetilcolina, dopamina e orexina e a promoção do sono está relacionada ao ácido gama-aminobutírico (GABA), glicina, melatonina e adenosina. O desequilíbrio entre essas substâncias relaciona-se com a neurobiologia da insônia (GULYANI et al.,2012). A insônia é o transtorno do sono mais frequente na população e caracteriza-se como uma condição debilitante que consiste na dificuldade de iniciar ou manter o sono, apesar da existência de oportunidades adequadas para dormir (MARUICHI et al., 2011).
Dentre as classes farmacológicas mais utilizadas para o tratamento da insônia destacam-se os benzodiazepínicos, que alteram a arquitetura do sono e facilitam o início e a manutenção do sono (POYARES et al., 2004; WICKBOLDT et al., 2012). Essa classe é utilizada pois reduz a atividade e excitação do sistema nervoso central, produzindo um estado de sonolência (BALDWIN et al., 2013).
Os benzodiazepínicos atuam como moduladores alostéricos positivos do GABA, que é o principal neurotransmissor inibitório do sistema nervoso central, sendo encontrado em altas concentrações no córtex e no sistema límbico. Por ser de natureza inibitória, ele reduz a excitabilidade dos neurônios. (HAEFELY et al., 1993). O GABA possui três receptores denominados de A, B e C. Os benzodiazepínicos atuam no receptor GABAA, produzindo uma modificação estrutural, sendo modulador alostérico positivo, facilitando a abertura dos canais para cloreto, aumentando o influxo celular deste íon gerando hiperpolarização celular e com isso ocorre a inibição sináptica (ZORUMSKI; ISENBERG, 1991).
Porém essa classe possui efeitos colaterais importantes como desenvolvimento de tolerância e possível insônia rebote após a interrupção da medicação. Além disso, provoca sedação residual e sedação diurna, aumenta o risco de quedas e de confusão, exacerba possíveis dificuldades respiratórias subjacentes e gera problemas de memória de curto prazo (SCHUMANN et al., 2020). Há também uma possível relação entre o uso prolongado de benzodiazepínicos e o agravamento do declínio cognitivo juntamente com os processos de envelhecimento normal, levando ao aumento dos quadros de demência. (LAGNAOUI et al., 2002; WU et al., 2009; GAGE et al., 2012; GALLACHER et al., 2012). O clonazepam foi o segundo benzodiazepínico de alta potência descoberto. Esse fármaco se comporta como um agonista do receptor GABAA de forma altamente potente e de longa ação (GRIFFIN et al., 2013).
A melatonina (N‐acetil‐5‐metoxitriptamina) é o principal hormônio produzido pela glândula pineal que atua no ciclo circadiano de sono‐vigília nos mamíferos (GRINGRAS et al., 2017). Quando empregada de forma terapêutica para tratar distúrbios do sono em adultos e crianças é considerada um medicamento relativamente não tóxico pois não produz efeitos colaterais significativos (SEABRA et al., 2000; GITTO et al., 2004; HUSSAIN et al., 2011). Ela atua via receptores de membrana MT1 e MT2 acoplados à proteína G (DUBOCOVICH, 1995; REPPERT et al., 1994), receptores nucleares da família do ácido retinóico (WIESENBERG et al., 1995), apresenta efeitos diretos em proteínas intracelulares como calmodulina ou tubulina (CARDINALI; FREIRE, 1975; BENÍTEZ-KING, 2006). Há relatos de administração da dose de 5mg/kg de melatonina para distúrbios do sono (DAHLITZ et al., 1991; MALHOTRA et al., 2004).
As funções da melatonina são divididas em cronobióticas e não-cronobióticas. Os efeitos cronobióticos englobam a regulação das funções fisiológicas e neuroendócrinas, como a sincronização dos ritmos reprodutivos sazonais (TAMARKIN et al., 1976), a regulação dos ciclos circadianos (ALONSO-VALE et al., 2008), do ciclo sono/vigília (LYSENG-WILLIAMSON, 2012), da temperatura (AOKI et al., 2008), do ritmo diário dos hormônios (IKEGAMI et al., 2019) e citocinas (CECON; MARKUS, 2011). Os efeitos não-cronobióticos possuem propriedades antioxidantes e de remoção de radicais livres, demonstrando função protetora em várias doenças relacionadas ao estresse oxidativo, como a doença de Alzheimer (SRINIVASAN et al., 2005) e a doença de Parkinson (MILLER et al., 1996). Além disso, os efeitos nãocronobióticos estão relacionados à resposta de defesa imunológica (CECON; MARKUS, 2011), a efeitos anti-inflamatórios (GENOVESE et al., 2005), antidepressivos (ERGÜN et al., 2006), anticonvulsivantes (YAHYAVI-FIROUZ-ABADI et al., 2006) e analgésicos (MANTOVANI et al., 2006).
Existem quase 30 formas de realizar a privação de sono em roedores já descritas (Revel et al., 2009). Para inibição do sono REM um dos métodos mais utilizados é o modelo de Plataformas Múltiplas Modificado, adaptado do modelo de plataforma (VAN HULZEN; COENEM; 1981). Nesse modelo utilizam-se múltiplas plataformas em um tanque preenchido com água para promover privação de sono em vários animais de uma única vez, pois assim os ratos estão livres para se movimentar no tanque de uma plataforma para outra e para interagir com os demais animais, o que reduz o estresse decorrente da imobilidade e do estresse social (SUCHECKI et al., 1998; MACHADO et al., 2004). A plataforma permite que o animal se acomode e obtenha sono NREM, porém ao se iniciar a fase REM ocorre perda de tônus muscular e como consequência a perda do equilíbrio postural, dessa forma o animal encosta na água, o que o faz despertar (MALLICK et al., 2011)
A privação do sono por uma noite pode prejudicar o desempenho em muitas tarefas cognitivas (DURMER; DINGES 2005; KILLGORE 2010). Em ratos, os protocolos de privação do sono podem variar de 24 até 96 horas (JEDDI et al., 2016; ALMEIDA, 2018). Estudos utilizando o protocolo de 24 horas demonstram que esse período de privação de sono já causa alterações e prejuízos, podendo ser utilizado como modelo experimental (ZHAO et al., 2018; PORCHERET et al., 2019).
A memória pode ser classificada segundo o tempo com que são adquiridas ou com relação ao seu conteúdo. Conforme o tempo em que são armazenadas, as memórias podem ser classificadas em memória a curto prazo ou a longo prazo. A memória de curto prazo está relacionada ao armazenamento temporário de informações, ou seja, durante um curto período. A memória de longo prazo diz respeito ao armazenamento de informações por um período maior (CECHELLA et al., 2014). Com relação ao conteúdo, a memória pode ser dividida em declarativa ou não declarativa. A memória declarativa diz respeito ao armazenamento de conhecimentos que podem ser intencionalmente recordados e a memória não declarativa está relacionada as atividades motoras e perceptivas (DE FARIA et al., 2020).
A memória de reconhecimento é a capacidade de julgar um item recentemente encontrado como familiar. A capacidade da memória de reconhecimento foi particularmente bem documentada em camundongos, ratos e macacos, bem como em humanos (MANNS et al., 2003). Ela pode ser testada em roedores usando tarefas de reconhecimento de objetos que são baseadas na tendência espontânea que os roedores apresentam de explorar objetos novos quando os animais se lembram dos objetos aos quais eles foram previamente expostos (VEDOVELLI, 2011).
Dessa forma, o objetivo deste estudo é avaliar o efeito do clonazepam e da melatonina sobre a memória de curto e de longo prazo de ratos Wistar submetidos à 24 horas de privação de sono.
DESENVOLVIMENTO
O experimento ocorreu no Biotério Experimental de Roedores da Universidade Federal do Paraná, Setor Palotina, onde ficaram alojados 96 ratos da espécie Rattus norvegicus albinus, variedade Wistar, com 45 dias de idade, sendo 48 fêmeas e 48 machos. Os animais permaneceram em ambiente controlado, com manejo adequado à espécie, acesso livre a alimento e água, com iluminação controlada, sendo a fase claro-escuro respeitada. Este estudo foi aprovado pela Comissão de Ética para Uso de Animais da Universidade Federal do Paraná setor Palotina sob protocolo número 07/2020.
Para a privação do sono foi utilizado método de plataformas múltiplas modificado, com caixas organizadoras de plástico transparente (68 x 45 x 47 cm) com cilindros de concreto de oito centímetros de altura e de diâmetro, em número correspondente ao número de ratos mais 50%, totalizando seis plataformas, a fim de se reduzir o estresse por restrição de movimentos. Manteve-se o grupo de animais provenientes do alojamento, reduzindo também o estresse adicional social. Os animais passaram pelo protocolo da privação de sono três vezes, em dias alternados e depois foi realizado o teste de reconhecimento de objeto com cada animal individualmente para avaliação da memória. Para isso, nos dias D1, D3 e D5 de experimento os animais dos grupos a serem privados de sono foram submetidos ao modelo de plataformas múltiplas modificadas.
A caixa organizadora foi preenchida com água até um cm abaixo do topo das plataformas. As tampas das caixas eram dotadas de diversas perfurações para permitir a troca de ar. Os animais permaneceram durante 24 horas, iniciando às oito horas da manhã. Após isso, os animais foram medicados seguindo o grupo experimental e retornaram à caixa de alojamento. Os animais passaram pela privação de sono três vezes, recebendo três doses de medicação, em dias alternados. Os animais que não passaram pela privação de sono também foram medicados no mesmo horário para evitar erros nas comparações, sendo realizado sempre às oito horas da manhã.
Para avaliação da memória de curto prazo, os animais foram distribuídos nos seguintes grupos experimentais:
- G1: 0,2mL água potável (veículo), sem privação de sono (controle);
- G2: 0,2mL água potável (veículo), com privação de sono;
- G3: 5mg/Kg melatonina, sem privação de sono (controle);
- G4: 5mg/Kg melatonina, com privação de sono;
- G5: 1mg/Kg clonazepam, sem privação de sono (controle); G6: 1mg/Kg clonazepam, com privação de sono.
O teste de reconhecimento de objeto foi utilizado para avaliação da memória dos animais, realizado após 24 horas da última privação de sono, no qual, cada animal era colocado individualmente em uma arena de 75x75x75 cm sobre uma placa de vidro, com contenção ao redor. Os animais eram colocados sempre no mesmo lugar dentro da arena, no canto oposto aos objetos. Esse teste compreende três sessões: habituação, aquisição e retenção (GOMES, 2015). Entre os animais era realizada a limpeza do local com álcool 70° INPM.
Na sessão de habituação, cada animal permaneceu na arena por 15 minutos para que o animal se familiarizasse com o ambiente da arena, onde não haviam objetos e o animal poderia fazer livre exploração do local. As sessões de habituação eram desenvolvidas sempre da mesma forma, tanto no experimento da memória curta, quanto da memória longa.
A sessão de aquisição foi realizada 24 horas após a sessão de habituação e tinha duração de dez minutos. Nessa sessão os animais foram individualmente colocados na arena na qual haviam dois objetos idênticos. Os objetos utilizados foram duas garrafas de vidro transparente contendo líquido preto de 30 centímetros de altura. Esses objetos foram denominados de objetos familiares. Os objetos em questão possuíam peso suficiente para não serem arrastados pelos animais. As sessões de aquisição eram desenvolvidas sempre da mesma forma, tanto no experimento da memória curta, quanto da memória longa.
A sessão de retenção teve duração de cinco minutos e foi realizada uma hora após a sessão de aquisição no teste de memória curta (FIGURA 1). Nessa sessão, um dos objetos familiares foi substituído por um objeto novo, que se tratava de uma lata metálica, cilíndrica e amarela de 15cm de altura, preenchida com areia. Os objetos eram diferentes entre si na cor, textura, formato e tamanho. Nessa sessão foi observado o tempo que o animal permaneceu explorando cada um dos objetos, sendo esperado que os animais que retiveram memória passam a explorar mais o objeto novo do que o previamente conhecido. O tempo em segundos foi mensurado por um observador às cegas do tratamento.
Figura 1 – Linha do tempo demonstrando os dias que os animais passaram pela privação de sono, os dias do tratamento e as sessões do experimento para avaliação da memória de curto prazo.
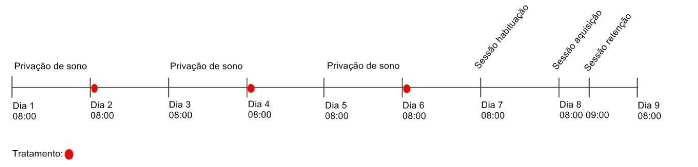
Fonte: Do autor.
A partir do tempo em segundos da exploração desses animais foi realizado o índice de reconhecimento (também chamado de índice de discriminação), que consiste em subtrair o tempo que o animal explorou o objeto novo (TON) e o tempo que o animal explorou o objeto familiar (TOF) dividido pela soma desses dois valores, na seguinte fórmula: (TON-TOF) / (TON+TOF) (GOMES, 2015). A exploração de objetos é definida quando o animal está próximo ao objeto, cheirando, tocando ou observando o mesmo.
Para avaliação da memória de longo prazo, os animais foram distribuídos nos seguintes grupos experimentais:
- G7: 0,2mL água potável (veículo), sem privação de sono (controle);
- G8: 0,2mL água potável (veículo), com privação de sono;
- G9: 5mg/Kg melatonina, sem privação de sono (controle);
- G10: 5mg/Kg melatonina, com privação de sono;
- G11: 1mg/Kg clonazepam, sem privação de sono (controle); G12: 1mg/Kg clonazepam, com privação de sono.
Após 24 horas da última privação de sono, os animais passaram pela sessão de habituação, com duração de 15 minutos. E após 24 horas, foi realizado a sessão de aquisição, com duração de 10 minutos.
- sessão de retenção teve duração de 5 minutos e ocorreu 24 horas após a sessão de aquisição no teste de memória longa (FIGURA 2). Esta sessão visou verificar o quanto o animal reteve de memória e para isso um dos objetos familiares foi substituído por um objeto novo. Os objetos eram os mesmos do experimento da memória de curto prazo, bem como a fórmula do índice de reconhecimento.
Figura 2 – Linha do tempo demonstrando os dias que os animais passaram pela privação de sono, os dias do tratamento e as sessões do experimento para avaliação da memória de longo prazo.
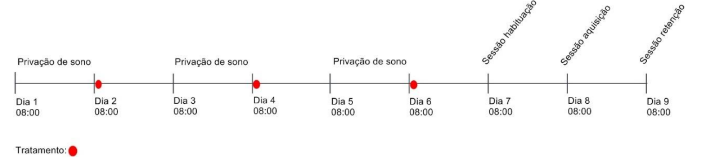
Fonte: Do autor.
Para a realização da estatística dos dados foi utilizado o método de ANOVA de duas vias (tratamento e privação de sono) com medidas repetidas (objeto novo e familiar) para a média dos valores dos tempos em segundos e a ANOVA de duas vias para o índice de reconhecimento. Após isso, houve interação entre todos os dados, então foi realizado teste Newman-Keuls como post hoc.
Com relação aos resultados obtidos, nos grupos que passaram pelo teste de reconhecimento de objetos de memória de curto prazo, o índice de discriminação teve interação, ou seja, houve diferença estatística entre os tratamentos e a privação de sono na ANOVA fatorial (F2, 42 = 8.6115, p = 0.00073). Os animais que não realizaram a etapa de privação de sono (controle) e foram medicados com a melatonina obtiveram o maior índice de discriminação. Já o grupo que foi medicado com o clonazepam e que passou pela privação obteve o menor índice em comparação com os outros grupos, sendo (FIGURA 3). Os animais que não passaram pelo protocolo de privação de sono obtiveram maior índice de discriminação, calculado a partir do tempo de exploração em cada objeto no teste de reconhecimento de objeto (F 1,42 = 15.320 e p = 0.00033) (FIGURA 4).
Figura 3 – Na memória de curto prazo, o índice de discriminação dos animais privados e não privados de sono (controle) que receberam melatonina (5mg/kg), clonazepam (1mg/kg) e veículo (0,2ml de água) e passaram pelo teste de reconhecimento de objetos. Barras verticais denotam intervalos de confiança de 0,95. Sendo F2,42 = 8.612 e p<0,05.
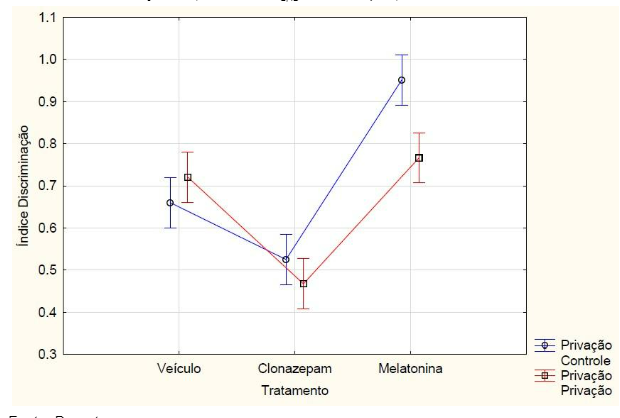
Fonte: Do autor.
Figura 4 – Na memória de curto prazo, o índice de discriminação calculado a partir do tempo de exploração no teste de reconhecimento de objeto dos animais que passaram ou não (controle) pelo protocolo de privação de sono. Barras verticais denotam intervalos de confiança de 0,95. Sendo F 1,42 = 15.320 e p<0,05.
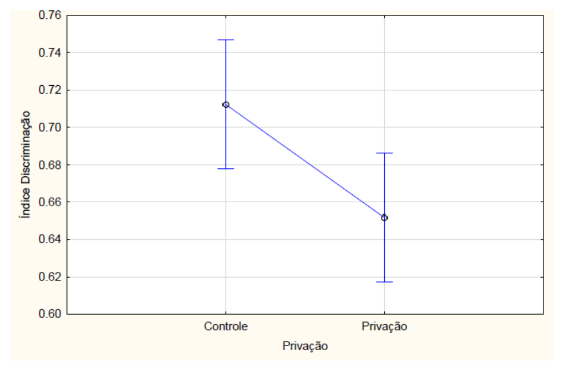
Fonte: Do autor.
Ainda na memória de curta duração, a ANOVA fatorial detectou interação entre os tempos de exploração dos objetos, os tratamentos e a privação de sono (F2, 42 = 5.3684, p= 0.00839) (FIGURA 5). No teste post-hoc de Newman-Keuls, o grupo de animais que não sofreu a privação do sono e recebeu a melatonina explorou mais o objeto novo e passou menor tempo explorando o objeto já conhecido. Já os animais que receberam o clonazepam foi inverso, passando mais tempo explorando o objeto familiar e menor tempo no objeto novo (p<0,05). O grupo de animais que recebeu a melatonina obteve o maior índice de discriminação e o grupo de animais que recebeu o clonazepam obteve o menor índice de discriminação. Demonstrando que os animais que receberam a melatonina se lembraram do objeto já conhecido e o grupo que recebeu o tratamento de clonazepam e não passou pela restrição de sono não teve diferença entre os objetos e, portanto, não se lembraram do objeto familiar.
Figura 5 – Na memória de curto prazo, a mensuração do tempo em segundos de exploração, tanto do objeto novo quanto do familiar, dos animais que passaram pela privação de sono ou não (controle) e receberam a medicação conforme o grupo experimental de melatonina a (5 mg/kg), clonazepam (1mg/kg) e veículo (0,2 mL de água). Barras verticais denotam intervalos de confiança de 0,95. Sendo F2, 42 = 5.3684, p<0,05.
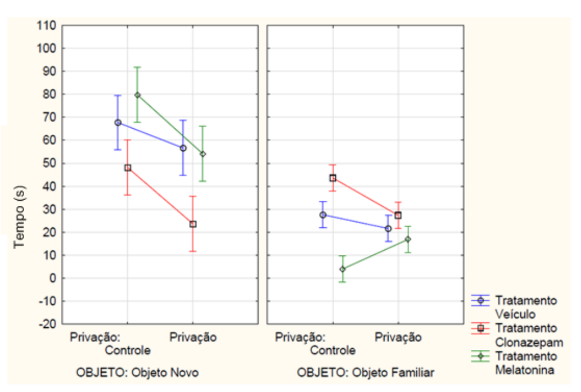
Fonte: Do autor.
A melatonina é um hormônio natural produzido principalmente pela glândula pineal, sendo o principal regulador do ciclo circadiano e participa da consolidação da memória. Além disso, a melatonina pode interagir com a proteína calmodulina, (LEÓN et al., 2006) que tem importante ação em funções neurais, incluindo a cognição (BENITO; BARCO, 2010; ORTEGA-MARTÍNEZ, 2015) indicando que a melatonina pode afetar positivamente as funções cognitivas (IWASHITA et al., 2021).
A melatonina também tem ação na modulação dos níveis de moléculas de adesão celular neural, na região do hipocampo dos animais. Essas moléculas estão envolvidas no circuito neural e participam do processamento cognitivo, significando que a melatonina modula a plasticidade neuronal e está relacionada nos processos de memória e aprendizagem (BAYDAS et al., 2008). O sono de qualidade é necessário para que haja desenvolvimento de algumas funções, inclusive cognitivas. (SANTORO; PINATO, 2014)
Na análise comparativa dos fármacos, notou-se que o grupo que recebeu a melatonina foi o que mais dedicou tempo à exploração do objeto novo. Além disso, demonstrou menor interesse pelo objeto já conhecido. Em contrapartida, os animais submetidos ao clonazepam exibiram o menor tempo de exploração no objeto novo e uma prolongada investigação do objeto familiar. Esses resultados indicam que a melatonina exerceu um efeito menos prejudicial à memória em comparação ao clonazepam, este último evidenciando comprometimento na retenção de informações. No tratamento com a melatonina, os animais que não foram submetidos à privação de sono exploraram mais o objeto novo em relação aos animais submetidos, demonstrando que o descanso adequado auxilia na retenção de novas informações.
Os animais que receberam o clonazepam dedicaram um tempo semelhante em relação à exploração de ambos os objetos, independente da privação de sono (p>0,05), sugerindo uma possível falta de recordação em relação à familiaridade de um dos objetos. O uso de benzodiazepínicos não compromete a memória de informações adquiridas antes da administração do fármaco, conhecida como memória retrógrada. No entanto, a aquisição de novas informações após a utilização do fármaco, denominada memória anterógrada, é prejudicada por essa classe farmacológica (IZQUIERDO; MEDINA, 1997; GRAEFF; GUIMARÃES, 1999; LADER, 2011).
Nos animais que passaram pelo teste de memória de longa duração, com relação ao índice de reconhecimento, a ANOVA fatorial detectou uma interação entre tratamento e privação de sono (F2, 42 = 5.6046, p = 0.00696) (FIGURA 6). O teste posthoc de Newman-Keuls indicou (p<0,05) que o grupo dos animais que receberam melatonina e não passaram pela privação de sono obteve maior índice de discriminação em relação ao grupo que recebeu clonazepam e não passou pela privação de sono e em relação ao grupo que recebeu melatonina e passou pela privação de sono. Os animais que receberam clonazepam e não passaram pela privação de sono tiveram menor índice de discriminação em comparação com os outros grupos sem restrição de sono e em relação ao grupo clonazepam com privação de sono. Apesar de não haver diferença estatística, os animais privados do sono tiveram o índice de exploração menor em relação aos animais que não foram privados de sono (F1, 42 = 0.46355, p = 0.49970) (FIGURA 7). O grupo de animais que recebeu clonazepam obteve estatisticamente índice menor de exploração em relação aos outros grupos.
Figura 6 – Na memória de longo prazo, o índice de discriminação dos animais privados e não privados de sono (controle) que receberam melatonina (5mg/kg), clonazepam (1mg/kg) e veículo (0,2mL de água) e passaram pelo teste de reconhecimento de objetos. Barras verticais denotam intervalos de confiança de 0,95. Sendo F2, 42 = 5.6046 e p<0,05.
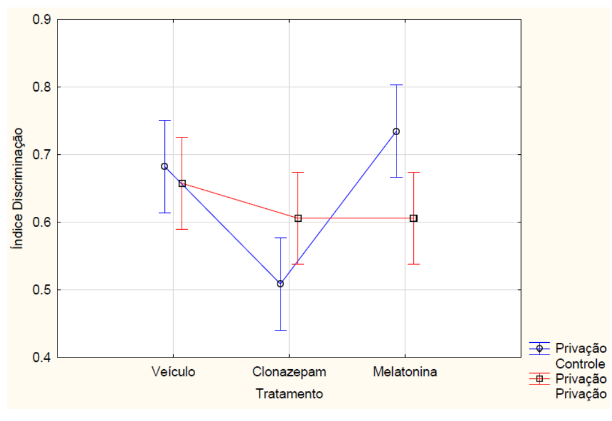
Fonte: Do autor.
Figura 7 – Na memória de longo prazo, o índice de discriminação calculado a partir do tempo de exploração no teste de reconhecimento de objeto dos animais que passaram ou não (controle) pelo protocolo de privação de sono. Barras verticais denotam intervalos de confiança de 0,95. Sendo F1, 42 = 0.46355, p = 0.49970.
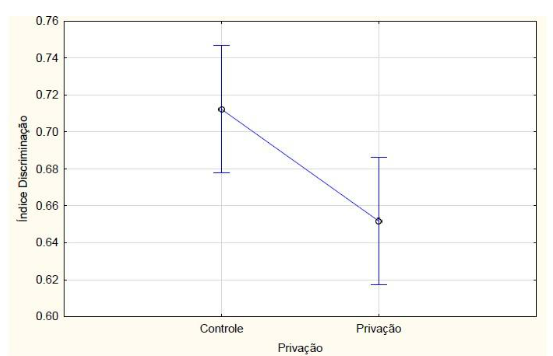
Fonte: Do autor.
Ainda sobre a memória de longo prazo, com relação à média dos tempos de exploração em segundos a ANOVA fatorial detectou uma interação objeto, tratamento e privação de sono (F2, 42 = 4.1487, p= 0.02269) (FIGURA 8). O teste post-hoc de Newman-Keuls indicou (p<0,05) que o grupo de animais que recebeu melatonina e não passou pela privação de sono obteve o maior tempo explorando o objeto novo em relação a todos os outros grupos e o menor tempo de exploração do objeto familiar em relação aos animais que receberam clonazepam e não passaram pela privação de sono. O grupo da melatonina que passou pela privação de sono explorou mais o objeto novo em relação ao grupo da melatonina que não passou pela privação de sono e foi diferente estatisticamente do grupo da melatonina que passou pela privação de sono e explorou o objeto familiar. Com relação aos grupos que receberam clonazepam observou-se que no grupo clonazepam o tempo de exploração do objeto novo ou familiar foi semelhante, independentemente de haver ou não privação de sono. Além disso, houve menor exploração de ambos os objetos em relação os animais que receberam melatonina, com ou sem a privação de sono.
FIGURA 8 – Na memória de longo prazo, a mensuração do tempo em segundos de exploração, tanto do objeto novo quanto do familiar, dos animais que passaram pela privação de sono ou não (controle) e receberam a medicação conforme o grupo experimental de melatonina a (5 mg/kg), clonazepam (1mg/kg) e veículo (0,2 mL de água). Barras verticais denotam intervalos de confiança de 0,95. Sendo F2, 42 = 4.1487 e p<0,05.
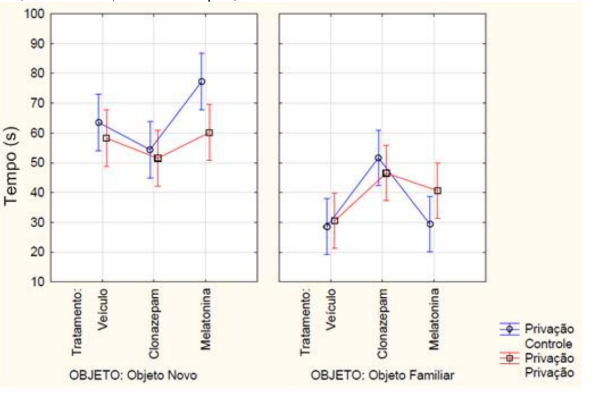
Fonte: Do autor.
Os animais tratados com melatonina que não passaram pela restrição de sono apresentaram o tempo de investigação do objeto novo significativamente maior que o dispendido com o objeto conhecido. Os animais tratados com clonazepam obtiveram maior tempo de investigação do objeto familiar e menor tempo de investigação do objeto novo. Isso demonstra que os animais tratados com clonazepam tiveram déficit na retenção da memória longa e provavelmente não se recordaram do objeto familiar, explorando os dois objetos, tanto o novo quanto o conhecido. Já os animais tratados com a melatonina se recordaram do objeto conhecido e exploraram mais o objeto novo.
Alguns autores relatam que há aumento no risco de demência e da doença de Alzheimer com o uso de benzodiazepínicos (INOUYE et al., 2014; ROSENBERG, 2015; IMFELD et al., 2015; GAGE et al., 2015). Apesar de serem muito relatados, os mecanismos envolvidos na deficiência da memória são pouco conhecidos. Testes em humanos demonstram que os benzodiazepínicos afetam negativamente a memória de longo prazo perto do momento do pico de concentração sanguínea do fármaco (BUFFETT-JERROTT; STEWART, 2002), porém a maioria dos artigos se limitam a descrever apenas que existe o déficit, sem explicar as possíveis causas.
Griffin et al. (2013) relataram que os benzodiazepínicos comprometem a memória de longo prazo em humanos. Além disso, Buffett-Jerrott e Sterwart em 2002 documentaram déficits cognitivos e perda de memória em humanos como efeitos indesejados de benzodiazepínicos.
Alguns autores relatam que a melatonina melhora a memória e previne danos, como relatado por Shen et al. (2002) que demonstra que reduziu as alterações da memória espacial e o dano oxidativo neural em camundongos tratados com Dgalactose. No presente estudo a melatonina não interferiu negativamente na memória dos animais, tanto memória de curto prazo, quanto memória de longo prazo.
CONCLUSÃO
A administração de melatonina não prejudicou a memória de curto ou longo prazo em ratos, quer tenham sido submetidos ou não à privação de sono. Em contrapartida, o clonazepam exerceu uma interferência negativa na memória de curto e longo prazo desses animais, independente da presença de privação de sono.
REFERÊNCIAS
ALMEIDA, R. P. C. Efeito da administração de bebida energizante no comportamento de ratos privados de sono. Dissertação (Mestrado em Ciências Médicas). Universidade de Brasília, Brasília, 2018.
ALONSO‐VALE, M. I. C. et al. Melatonin and the circadian entrainment of metabolic and hormonal activities in primary isolated adipocytes. Journal of Pineal Research, v.45, n.4, p.422-429, 2008.
AOKI, K. et al. Exogenous melatonin administration modifies cutaneous vasoconstrictor response to whole body skin cooling in humans. Journal of Pineal Research, v.44, n.2, p.141-148, 2008.
BALDWIN, D. S. et al. Benzodiazepines: risks and benefits. A reconsideration. Journal of Psychopharmacology, v.27, n.11, p.967-971, 2013.
BAYDAS, G. et al. Melatonin prevents gestational hyperhomocysteinemia‐associated alterations in neurobehavioral developments in rats. Journal of Pineal Research, v.44, n.2, p.181-188, 2008.
BENÍTEZ‐KING, G. Melatonin as a cytoskeletal modulator: implications for cell physiology and disease. Journal of Pineal Research, v.40, n.1, p.1-9, 2006.
BENITO, E.; BARCO, A. CREB’s control of intrinsic and synaptic plasticity: implications for CREB-dependent memory models. Trends in Neurosciences, v.33, n.5, p.230240, 2010.
BILLIARD, M.; BENTLEY, A. Is insomnia best categorized as a symptom or a disease? Sleep Medicine, v.5, p.S35-S40, 2004.
BRASIL. Ministério da Saúde, Agência Nacional de Vigilância Sanitária (ANVISA). Panorama dos dados do sistema nacional de gerenciamento de produtos controlados: um sistema para o monitoramento de medicamentos no Brasil. Boletim de Farmacoepidemiologia. Brasília (DF): Anvisa; 2011. Disponível em: http://www.anvisa.gov.br/sngpc/boletins/2011/boletim_sngpc_2edatualizada.pd
BUFFETT-JERROTT, S. E.; STEWART, S. H. Cognitive and sedative effects of benzodiazepine use. Current Pharmaceutical Design, v.8, n.1, p.45-58, 2002.
CARDINALI, D. P.; FREIRE, F. Melatonin effects on brain. Interaction with microtubule protein, inhibition of fast axoplasmic flow and induction of crystaloid and tubular formations in the hypothalamus. Molecular and Cellular Endocrinology, v.2, n.5, p.317-330, 1975.
CECON, E.; MARKUS, P. R. Relevance of the chronobiological and nonchronobiological actions of melatonin for enhancing therapeutic efficacy in neurodegenerative disorders. Recent Patents on Endocrine, Metabolic & Immune Drug discovery, v.5, n.2, p.91-99, 2011.
CECHELLA, J. L. et al. Diphenyl diselenide-supplemented diet and swimming exercise enhance novel object recognition memory in old rats. Age, v.36, n.4, p.9666, 2014.
DA SILVA, R. S. Introdução ao estagiamento do sono humano. Brazilian Journal of Epilepsy and Clinical Neurophysiology, v.2, n.3, p.187-199, 1996.
DAHLITZ, M. et al. Delayed sleep phase syndrome response to melatonin. The Lancet, v.337, n.8750, p.1121-1124, 1991.
DE FARIA, R. S. et al. Efeito do estresse crônico na memória espacial de curto e longo prazo em ratos Wistar. Health Sciences Journal, v.10, n.3, p.9-14, 2020.
DUBOCOVICH, M. L. et al. Molecular pharmacology, regulation and function of mammalian melatonin receptors. Frontiers in Bioscience, v.8, n.10, p.1093-108, 2003.
DURMER, J. S.; DINGES, D. F. Neurocognitive consequences of sleep deprivation. In: Seminars in Neurology. Thieme Medical Publishers, p.117-129, 2005.
ERGÜN, Y. et al. Co-administration of a nitric oxide synthase inhibitor and melatonin exerts an additive antidepressant-like effect in the mouse forced swim test. Medical Science Monitor, v.12, n.9, p.BR307-BR312, 2006.
FERNANDES, R. M. F. O sono normal. Medicina (Ribeirão Preto), v.39, n.2, p.157168, 2006.
GAGE, S. B. et al. Benzodiazepine use and risk of dementia: prospective population based study. Bmj, v.345, 2012.
GAGE, S.; PARIENTE, A.; BÉGAUD, B. Is there really a link between benzodiazepine use and the risk of dementia? Expert opinion on drug safety, v.14, n.5, p.733-747, 2015.
GALLACHER, J. et al. Benzodiazepine use and risk of dementia: evidence from the Caerphilly Prospective Study (CaPS). Journal of Epidemiology and Community Health, v.66, n.10, p.869-873, 2012.
GENOVESE, T. et al. Melatonin limits lung injury in bleomycin treated mice. Journal of Pineal Research, v.39, n.2, p.105-112, 2005.
GITTO, E. et al. Melatonin reduces oxidative stress in surgical neonates. Journal of Pediatric Surgery, v.39, n.2, p.184-189, 2004.
GOMES, F. V. Tratamento repetido com canabidiol atenua alterações comportamentais e moleculares em um modelo de esquizofrenia baseado no antagonismo dos receptores NMDA. 219 p. Tese (Doutorado) – Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2015.
GRAEFF, F. G.; GUIMARÃES, F. S. Fundamentos de psicofarmacologia. In: Fundamentos de Psicofarmacologia. p.238-238, 2000
GRIFFIN, C. E. et al. Benzodiazepine pharmacology and central nervous system– mediated effects. Ochsner Journal, v.13, n.2, p.214-223, 2013.
GRINGRAS, P. et al. Efficacy and safety of pediatric prolonged-release melatonin for insomnia in children with autism spectrum disorder. Journal of the American Academy of Child and Adolescent Psychiatry, v.56, n.11, p.948-957. e4, 2017.
GULYANI, S.; SALAS, R. E.; GAMALDO, C. E. Sleep medicine pharmacotherapeutics overview: today, tomorrow, and the future (Part 1: insomnia and circadian rhythm disorders). Chest, v.142, n.6, p.1659-1668, 2012.
HAEFELY, W. E. et al. The multiplicity of actions of benzodiazepine receptor ligands. Canadian Journal of Psychiatry. v.38, p.S102, 1993.
HUSSAIN, S. A. R. et al. Adjuvant use of melatonin for treatment of fibromyalgia. Journal of pineal research, v.50, n.3, p.267-271, 2011.
IDZIKOWSKI, C. Sleep and memory. British Journal of Psychology, v.75, n.4, p.439-449, 1984.
IKEGAMI, K. et al. Interconnection between circadian clocks and thyroid function. Nature Reviews Endocrinology, v.15, n.10, p.590-600, 2019.
IMFELD, P. et al. Benzodiazepine use and risk of developing alzheimer’s disease or vascular dementia: A case–control analysis. Drug Safety, v.38, n.10, p.909-919, 2015. INOUYE, S.; WESTENDORP, R.; SACZYNSKI, J. Link between Alzheimer’s disease and benzodiazepines suspected. Nursing Older People, v.26, n.10, p.13, 2014.
IWASHITA, H. et al. The melatonin metabolite N1‐acetyl‐5‐methoxykynuramine facilitates long‐term object memory in young and aging mice. Journal of Pineal Research, v.70, n.1, p. e12703, 2021.
IZQUIERDO, I.; MEDINA, J. H. The biochemistry of memory formation and its regulation by hormones and neuromodulators. Psychobiology, v.25, n.1, p.1-9, 1997.
JANSEN, J. M., et al. Medicina da noite: da cronobiologia à prática clínica [online]. Rio de Janeiro: Editora FIOCRUZ, 2007. 340 p. ISBN 978-85-7541-336-4. Disponível em: https://static.scielo.org/scielobooks/3qp89/pdf/jansen-9788575413364.pdf.
JEDDI, S. et al. O Efeito da Privação de Sono na Função Cardíaca e Tolerância à Lesão de Isquemia-Reperfusão em Ratos. Arquivos Brasileiros de Cardiologia, v.106, n.1, p.41-48, 2016.
KILLGORE, W. D. S. Effects of sleep deprivation on cognition. In: Progress in Brain Research. Elsevier, p.105-129, 2010.
LADER, M. Benzodiazepines revisited—will we ever learn? Addiction, v.106, n.12, p.2086-2109, 2011.
LAGNAOUI, R. et al. Benzodiazepine use and risk of dementia: a nested case–control study. Journal of Clinical Epidemiology, v.55, n.3, p.314-318, 2002.
LEÓN, J. et al. Inhibition of neuronal nitric oxide synthase activity by N1‐acetyl‐5methoxykynuramine, a brain metabolite of melatonin. Journal of Neurochemistry, v.98, n.6, p.2023-2033, 2006.
LYSENG-WILLIAMSON, K. A. Melatonin prolonged release. Drugs and Aging, v.29, n.11, p.911-923, 2012.
MACHADO, R. B. et al. Sleep deprivation induced by the modified multiple platform technique: quantification of sleep loss and recovery. Brain Research, v.1004, n.1-2, p.45-51, 2004.
MALHOTRA, S.; SAWHNEY, G.; PANDHI, P. The therapeutic potential of melatonin: a review of the science. Medscape General Medicine, v.6, n.2, 2004.
MALLICK, B. N.; SINGH, A. REM sleep loss increases brain excitability: Role of noradrenalin and its mechanism of action. Sleep Medicine Reviews, v. 15, n.3, p.165178, 2011.
MANNS, J. R. et al. Recognition memory and the human hippocampus. Neuron, v.37, n.1, p.171-180, 2003.
MANTOVANI, M. et al. Mechanisms involved in the antinociception caused by melatonin in mice. Journal of Pineal Research, v.41, n.4, p.382-389, 2006.
MARUICHI, M. D. et al. Avaliação da prevalência de insônia associada a medidas de higiene do sono em usuários do Centro de Saúde Escola Barra Funda Dr. Alexandre Vranjac. Arquivos Médicos dos Hospitais e da Faculdade de Ciências Médicas da Santa Casa de São Paulo, v.56, n.2, p.61-64, 2018.
MILLER, J. W.; SELHUB, J.; JOSEPH, J. A. Oxidative damage caused by free radicals produced during catecholamine autoxidation: protective effects of O-methylation and melatonin. Free Radical Biology and Medicine, v.21, n.2, p.241-249, 1996.
NEVES, G. M. et al. Transtornos do sono: visão geral. Revista Brasileira de Neurologia, v.49, n.2, p.57-71, 2013.
ORTEGA-MARTÍNEZ, S. A new perspective on the role of the CREB family of transcription factors in memory consolidation via adult hippocampal neurogenesis. Frontiers in Molecular Neuroscience, v.8, p.46, 2015.
PORCHERET, K. et al. Investigation of the impact of total sleep deprivation at home on the number of intrusive memories to an analogue trauma. Translational Psychiatry, v.9, n.1, p.1-13, 2019.
POYARES, D. et al. Chronic benzodiazepine usage and withdrawal in insomnia patients. Journal of Psychiatric Research, v.38, n.3, p. 327-334, 2004.
REPPERT, S. M.; WEAVER, D. R.; EBISAWA, T. Cloning and characterization of a mammalian melatonin receptor that mediates reproductive and circadian responses. Neuron, v.13, n.5, p.1177-1185, 1994.
REVEL, F. G. et al. Rodent models of insomnia: a review of experimental procedures that induce sleep disturbances. Neuroscience and Biobehavioral Reviews, v.33, n.6, p.874-899, 2009.
RIBEIRO, C. R. F.; SILVA, Y. M. G. P.; OLIVEIRA, S. M. C. de. O impacto da qualidade do sono na formação médica. Revista da Sociedade Brasileira de Clínica Médica, v.12, n.1, p.8-14, 2014.
ROSENBERG, P. B. Benzodiazepine exposure increases risk of Alzheimer’s disease. BMJ Evidence-Based Medicine, v.20, n.2, p.75-75, 2015.
SANTORO, Stella Donadon; PINATO, Luciana. Sono-vigília, aspectos de memória e melatonina em Síndrome de Williams-Beuren: uma revisão de literatura. Revista CEFAC, v. 16, p. 1980-1989, 2014.
SCHUMANN, T. F. et al. A Prevalência da insônia no meio médico e o uso de substâncias relacionadas. Revista de Saúde, v.11, n.1, p.67-76, 2020.
SEABRA, M. de L. V. et al. Randomized, double‐blind clinical trial, controlled with placebo, of the toxicology of chronic melatonin treatment. Journal of Pineal Research, v.29, n.4, p.193-200, 2000.
SHEN, Y. et al. Melatonin reduces memory changes and neural oxidative damage in mice treated with D‐galactose. Journal of Pineal Research, v.32, n.3, p.173-178, 2002.
SRINIVASAN, V. et al. Role of melatonin in neurodegenerative diseases. Neurotoxicity Research, v.7, n.4, p.293-318, 2005.
SUCHECKI, D. et al. Increased ACTH and corticosterone secretion induced by different methods of paradoxical sleep deprivation. Journal of Sleep Research, v.7, n.4, p.276-281, 1998.
TAMARKIN, L. et al. Effect of melatonin on the reproductive systems of male and female Syrian hamsters: a diurnal rhythm in sensitivity to melatonin. Endocrinology, v.99, n.6, p.1534-1541, 1976.
VAN HULZEN, Z. J. M.; COENEN, A. M. L. Paradoxical sleep deprivation and locomotor activity in rats. Physiology and Behavior, v.27, n.4, p.741-744, 1981.
VEDOVELLI, K. Efeitos do ambiente enriquecido nos níveis centrais e periférico de BDNF e sua relação com o desempenho na tarefa de reconhecimento de objetos em ratos. Dissertação (Mestrado). Pontifícia Universidade Católica do Rio Grande do Sul, 2011.
WICKBOLDT, A. T. et al. Sleep physiology, abnormal States, and therapeutic interventions. Ochsner Journal, v.12, n.2, p.122-134, 2012.
WIENER, R. C. Relationship of routine inadequate sleep duration and periodontitis in a nationally representative sample. Sleep Disorders, v.2016, 2016.
WIESENBERG, I. et al. Transcriptional activation of the nuclear receptor RZRα by the pineal gland hormone melatonin and identification of CGP 52608 as a synthetic ligand. Nucleic Acids Research, v.23, n.3, p.327-333, 1995.
WU, C. et al. The association between dementia and long-term use of benzodiazepine in the elderly: nested case–control study using claims data. The American Journal of Geriatric Psychiatry, v.17, n.7, p.614-620, 2009.
YAHYAVI-FIROUZ-ABADI, N. et al. Involvement of nitric oxide pathway in the acute anticonvulsant effect of melatonin in mice. Epilepsy Research, v.68, n.2, p.103-113, 2006.
YELESWARAM, K. et al. Pharmacokinetics and oral bioavailability of exogenous melatonin in preclinical animal models and clinical implications. Journal of Pineal Research, v.22, n.1, p.45-51, 1997.
ZHAO, R. et al. Decreased cortical and subcortical response to inhibition control after sleep deprivation. Brain Imaging and Behavior, v.13, n.3, p.638-650, 2019.
ZORUMSKI, C. F.; ISENBERG, K. E. Insights into the structure and function of GABAbenzodiazepine receptors: ion channels and Psychiatry. American Journal of Psychiatry, v.148, n., p.162, 1991.
1Discente de mestrado do Programa de Pós-Graduação Ciência Animal da Universidade Federal do Paraná – Setor Palotina. E-mail amanda.miola@gmail.com;
2Discente de graduação de Medicina Veterinária da Universidade Federal do Paraná – Setor Palotina. E-mail dehsilva96@gmail.com;
3Discente de graduação de Biologia da Universidade Federal do Paraná – Setor Palotina. E-mail mott.andressa@hotmail.com;
4Discente Discente de graduação de Medicina Veterinária da Universidade Federal do Paraná – Setor Palotina. E-mail brunabitencourt2016@gmail.com;
5Discente de mestrado do Programa de Pós-Graduação em Biotecnologia da Universidade Federal do Paraná – Setor Palotina. E-mail jocasaldeira@gmail.com;
6Discente Discente de graduação de Medicina Veterinária da Universidade Federal do Paraná – Setor Palotina. E-mail mykacd@hotmail.com;
7Docente do Curso Superior de Medicina Veterinária da Universidade Federal do Paraná, Setor Palotina. Doutora em Cirurgia Veterinária pela Universidade Estadual Paulista Júlio de Mesquita Filho. E-mail: prof.erica.guirro@gmail.com;
