REGISTRO DOI:10.69849/revistaft/th10249011705
Ruiz-Silva, C, Phd1
Longo, B 2
Moleiro, D 3
Leite, M.P.F 4
Ruiz-Silva, K.R 5
Resumo
O presente estudo foi realizado com o propósito de verificar o efeito da corrente elétrica de baixa intensidade e baixa freqüência, utilizando forma de onda quadrada simétrica bipolar em feridas cutâneas de ratos. O experimento utilizou 3 grupos de animais, todos com ferida cirúrgica de 8 mm de diâmetro na região do dorso, sendo um grupo controle, um segundo grupo tratado com intensidade de corrente de 30 µA (G30) e um terceiro grupo tratado com intensidade de corrente de 160 µA (G160), durante 30 minutos, imediatamente após a realização da lesão cirúrgica. Os grupos G30 e G160, foram estimulados com micro corrente utilizando frequência 0,3 Hz e largura de pulso de 1,6 s, Todos os animais foram clinicamente avaliados diariamente durante os 7 dias pós-cirúrgicos, e em seguida sacrificados. A região lesionada foi biopsiada, processada histologicamente e analisada por um sistema de tratamento digital de imagem (Leica Qwin). A análise estatística revelou que os grupos G30 e G160, apresentaram significativa redução de células inflamatórias (p<0,001) na região superficial da derme, quando comparados com o grupo controle, uma aceleração na proliferação de fibroblastos superficiais (p<0,05) em relação ao grupo controle. Verificou-se também diferença significativa na redução do diâmetro das feridas, nos períodos de 72 horas (p<0,05), 144 (p<0,01) e 168 horas (p<0,05) do grupo G160 em relação ao controle. Os animais do grupo G30 apresentaram significativa redução no diâmetro da ferida (p<0,05) em relação ao grupo controle, após 144 horas de cirurgia.
Introdução
A reparação tecidual é um fenômeno de grande interesse para os profissionais da área da saúde. Sua eficiência acelera o processo de reabilitação, com subseqüente retorno mais rápido ao trabalho, atividades de lazer e até o convívio social (Ruiz-Silva et al., 2016).
A mudança do perfil epidemiológico e o aumento da expectativa de vida da população levaram a um consequente aumento da complexidade de procedimentos cirúrgicos. A prevalência de doenças crônicas leva à necessidade de tratamentos contínuos e ocorrência de disfunções e dependência, e acelerar o processo de cicatrização diminui a permanência no ambiente hospitalar (Oliveira, 2019).
A reparação tecidual normal é uma integração de processos interativos dinâmicos que envolvem mediadores químicos; elementos figurados do sangue; produção de matriz extra celular e células parenquimatosas No processo de reparação, a regeneração e a cicatrização, devem ser considerados como eventos distintos, no entanto, ambos os processos estão ligados, ocorrendo conjuntamente . Os eventos de cicatrização podem ser divididos em inflamação, fase de formação de tecido de granulação com depósito de matriz extracelular e a remodelação tecidual (Ruiz-Silva et al., 2016; 2023).
A maioria dos livros – texto sobre cicatrização de feridas e reparação tecidual falha tanto ao discutir a fisiologia das correntes elétricas endógenas naturais na cicatrização de feridas quanto à aplicação de correntes elétricas externas (exógenas) para acelerar a cicatrização e a reparação de tecidos. (Ruiz-Silva et al., 2006, Couto; Ruiz-Silva, 2010; Lee, 2024)
Quando ocorre uma perda da continuidade do tecido superficial, ocorre uma alteração elétrica, chamada de corrente de lesão por -Matteucci (1830), Dubois-Reymond (1843) e Barker (1980), e a eletricidade endógena evita a área da lesão, para Nordenstron a cura provém de um pequeno estimulo elétrico aplicado na área lesionada (Ruiz-Silva et al., 2016). Trabalhos relatam o efeito da corrente elétrica de baixa intensidade na cicatrização de feridas, que resultaram na aceleração do processo cicatricial, e sugerem aumento na velocidade de cicatrização (Avendanõ-Coy, 2022), mais os efeitos, parâmetros e padronização de correntes ainda não foram estabelecidos, sendo os dados controversos no tocante a intensidade, e forma de onda da corrente. O uso da terapia com microcorrentes, sobre lesões cutâneas, tem o objetivo de normalizar o fluxo de correntes, objetivando o reparo e minimizando a dor evidencias confirmam a migração de células epidérmicas, fibroblastos, leucócitos e macrófagos por campos elétricos. (Ruiz-Silva et al., 2016; 2023).
Este trabalho é uma colaboração na busca de especificar os parâmetros mais efetivos na aplicação da micro corrente como fator coadjuvante para a diminuição do tempo de cicatrização de feridas e atenuação da sintomatologia causada por estas lesões objetivando melhor qualidade do tecido cicatricial.
Materiais e Métodos
Neste estudo utilizou-se de 21 ratos machos da raça Wistar (Rattus norvegicus variedade albinus), os quais foram pesados em balança analógica Bender®, verificando se peso corpóreo entre 200 – 250 g. Os animais permaneceram por um período de ambientação de 15 dias no biotério de passagem do Instituto de Pesquisa e Desenvolvimento (IP&D) da Universidade do Vale do Paraíba. Os mesmos foram mantidos em gaiolas (cinco animais por gaiola) em condições ambientais de temperatura e luminosidade, alimentados com dieta padrão Labina® e água ad libidum. O experimento foi realizado nos laboratórios de Biomodulação Tecidual e Laboratório de Fluorescência, do Instituto de Pesquisa e Desenvolvimento (IP&D) da Universidade do Vale do Paraíba. Os animais foram separados em um grupo controle (GC) (n=9) e dois grupos tratados com terapia com micro corrente, sendo um tratado com intensidade de corrente de 30 µA (G30) (n=6) e outro com intensidade de corrente de 160 µA (G160) (n=6).
Foi realizada a pesagem dos animais e administração de pré-anestésico Butorfanol (Torbugesic®, 2mg/kg) associado a Acepromazina 0,2% (Acepran®, 1mg/kg) ambos administrados em dose única, via intramuscular. Após 15 minutos foram administrados Zolazepan e Tiletamina (Zoletil 50®, 40 mg/kg). Os animais foram tricotomizados na região dorsal direita. Foi realizada uma incisão circular com o auxílio de instrumento para biopsia tipo “punch” estéril, com 8 mm de diâmetro, na região tricotomizada Figura 1).
Figura 1: Lesão cutânea em dorso de rato (0,5 cm2).
Para a realização deste estudo, utilizou-se um aparelho de micro eletro estimulação, protótipo que deu origem ao Phasys KLD biosistemas, o MTC, com amplificador de saída de corrente constante, com dois canais, forma de onda quadrada, bifásica, simétrica equilibrada. Os animais dos grupos G30 e G160 receberam terapia, com intensidade de corrente de 30 µA e 160 µA, respectivamente, durante 30 minutos imediatamente após a lesão cirúrgica, com eletrodos aplicados na forma quadripolar, com uma freqüência de 0,3 Hz com largura de pulso de 1,6 s (Figura 2).

Figura 2: Animais recebendo a Terapia com micro corrente.
Os animais do grupo controle não sofreram nenhum tipo de terapia pós-cirúrgica, sendo mantidos como controle. A região lesada dos animais foi acompanhada diariamente através avaliação clínica (diâmetro da ferida e presença de edema, exsudato e/ou crosta). Aos 7 dias pós-lesão todos os animais foram anestesiados e sacrificados com dose letal de cloreto de potássio a 10% (KCl, 4 ml/kg de peso corpóreo). Os valores de diâmetro das feridas foram expressos por média e erro-padrão, submetidos ao teste estatístico ANOVA. O nível de significância estabelecido foi de 5% (p<0,05). Para a qualificação e quantificação das áreas representativas de células inflamatórias, fibroblastos, neovascularização e colágenos, foram digitalizados três campos por lamina, em um total de três lamina por animal. Todas as imagens digitalizadas foram padronizadas quanto à intensidade de luz do microscópio e altura do condensador. Para definir o quadrante de medida, padronizo-se os Frames em: linha H= 280 e linha W=280, a fim de se obter uma imagem quantificada em 50.805 µm2, calibrada em Ipixel=0,805 µm, calculou-se então, a área ocupada pelas células inflamatórias, fibroblastos, adipocitos quando possuía, com o auxilio do Microscópio e programa Leica Qwin. O tecido lesado foi analisado em duas porções distintas, divididas em dois quadrantes de 50.805µm2 subseqüentes, uma partindo da superfície da derme é denominada superficial e a outra, logo abaixo denominada derme profunda.
Para analise dos resultados estatísticos utilizou se o programa Graf Pad Instat® aplicando o teste de comparação múltipla de Bonferroni, e obtivemos os resultados que estão expressos nos gráficos abaixo.
Resultados
Os resultados da análise do diâmetro das feridas pós 7 dias de cirurgia estão resumidos na figura 3.
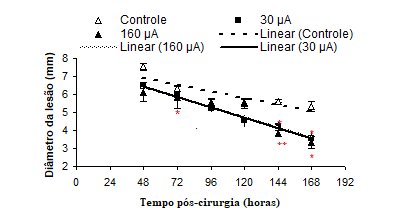
Figura 3: Diâmetro da lesão nos diferentes grupos entre 48 e 168 horas pós-cirurgia. Os dados estão expressos em média ± erro (* p<0,05, **p<0,01 em relação ao controle).
No período de 48 horas ocorreu uma redução do diâmetro da ferida nos animais estimulados com TMC (G30=6,42 mm2 e G160=6,13 mm2), pode-se notar que os animais apresentaram uma rápida contração da ferida em relação ao controle (GC=7,54 mm2), sendo que em 96 horas todos os grupos apresentaram uma média de diâmetro semelhante (GC=5,54 mm2, C30=5,25 mm2 e C160=5,50 mm2), após o desprendimento da crosta com 120 horas, o grupo tratado com 30 mA evoluiu melhor que os outros (GC=5,55 mm2, C30=4,53 mm2 e C160=5,50 mm2). No final do experimento os grupos estimulados apresentaram um fechamento superior que o controle (GC=5,35 mm2, C30=3,54 mm2 e C160=3,33 mm2).
O grupo 160 mA, comparado ao grupo Controle, apresentou diferenças significativas quanto à redução do diâmetro da lesão nos período de 72 horas (p<0,05), 144 (p<0,01) e 168 horas (p<0,05), enquanto que o grupo 30 mA apresentou diferença significativa no período de 144 e 168 horas (p<0,05).
Na analise histológica observa-se que na porção superficial do grupo controle ocorreu uma predominância de população de células inflamatórias, com média de contagem de 2.887 células correspondente a 5,7 % da área aferida, em relação a 779 células e 1,6% da área no G30 e 148 células e 0,3% da área no grupo G160, onde através do teste ANOVA encontrou-se diferença estatisticamente significativa entre o controle e os grupos tratados (p<0,001), figura 4.
Na região da derme denominada profunda (segundo quadrante de 50.805 µm2), foram observadas células inflamatórias em todos os grupos, porém sem diferença estatística entre elas.
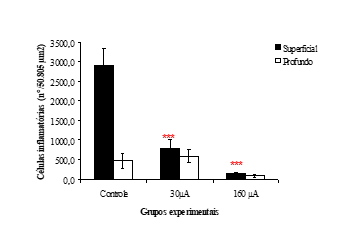
Figura 4: Número de células inflamatórias na derme (por área de 50.805 µm2) superficial e profunda, dos grupos tratados e controle. Os dados estão expressos em média ± erro (*** p<0,001 em relação ao grupo controle).
Na contagem de fibroblastos encontrou-se os resultados descritos graficamente na figura 5.
Constatou-se uma diferença significante (p<0,05) do número de fibroblastos superficiais na derme no grupo G160 (2295 células/50.805 µm2) com relação ao grupo GC (504 células/50.805 µm2), sendo que o grupo G30 (1276 células/50.805 µm2) não apresentou diferenças significantes.
Na região subseqüente mais profunda, encontrou-se um aumento do número de fibroblastos em todos os grupos, (G160 = 2034 células/50.805 µm2, G30 = 990 células/50.805 µm2, GC =1585 células/50.805 µm2), resultados sem diferenças significantes.
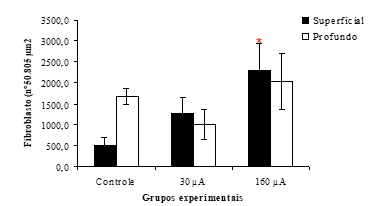
Figura 5: Número de fibroblastos encontrados na derme (por área de 50.805 µm2) superficial e profunda dos grupos tratados e controle. Os dados estão expressos em média ± erro (* p<0,05 em relação ao controle).
Na figura 6, estão expressas as contagens do número de vasos sanguíneos encontrados em cada região avaliada nos grupos deste experimento.
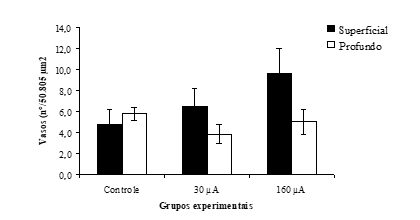
Notou-se angiogênese em todos os grupos, sendo mais acentuada superficialmente nos grupos tratados, na região profunda no grupo controle mais sem resultados significantes.
Figura 6: Número de vasos encontrados na derme (por área de 50.805 µm2) superficial e profunda, dos grupos tratados e controle.
Na analise do grau de evolução na cicatrização qualitativa, das amostras, utilizamos aspectos propostos por Wei Yu (1997).
No grupo não-tratado (GC), observou-se re-epitelização mínima, sem deposição de colágeno (figuras 7), com tecido de granulação com o predomínio acentuado de infiltrado inflamatório linfocitário superficial, demonstrando diferença significativa em relação aos grupos tratados (p<0,001) (figura 7), neovascularização discreta na derme profunda, e uma discreta proliferação fibroblástica, contendo células com núcleos ovalados na porção profunda da derme (Figuras 8). Observou-se ainda na superfície adipócitos atípicos em três animais (33,33%).
O grau de evolução na cicatrização, atribuído na análise dos animais do grupo GC, obteve média de 4,4 ± 0,4%.
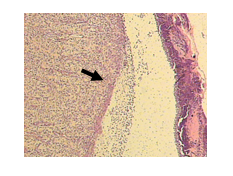
Figura 7: Fotomicrografia do grupo controle. Presença decélulas inflamatórias predominantemente superficiais (setas). H&E, 100x.
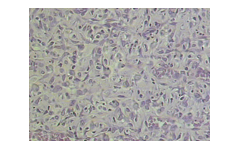
Figura 8: Fotomicrografia do grupo controle. Observa-se presença de fibroblastos com núcleo ovalado (setas). H&E, 400x.
Na derme de espécimes do grupo G30, foi observada a presença de tecido de granulação, menos freqüente que na região profunda da derme e matriz intercelular em maior quantidade que o grupo GC. Observou-se ainda discreta proliferação de vasos capilares dilatados e congestos, na superfície e quadrante inferior da derme (figura 9), demonstrando a neovascularização e ainda uma presença discreta de infiltrado inflamatório na porção mais profunda da derme (figura 9).
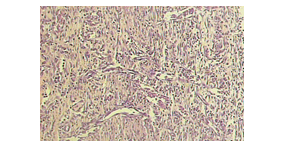
Figura 9: Fotomicrografia do grupo estimulado com 30 µA. Observa-se presença de vasos dilatados e congestos (setas) e algumas células inflamatória
Um aspecto comum a todos os animais foi a proliferação de fibroblastos caracterizados por células maduras cujos núcleos mostravam-se achatados (figuras 10) e a deposição de colágeno no centro da lesão mais acentuado na região reticular (figura 11) no quadrante inferior da derme. H&E, 200x.
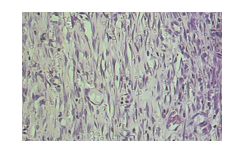
Figura 10: Fotomicrografia do grupo G30. Observa-se tecido de granulação e fibroblastos caracterizados por células fusiformes composta por núcleo achatado (seta), H&E, 400x
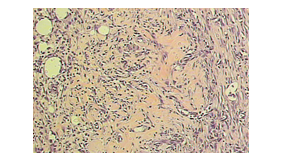
Figura 11: Fotomicrografia do grupo G30. Observa- se deposição de colágeno no centro da lesão, mais acentuado na região reticular (setas), H&E, 200x.
O grau de evolução na cicatrização, atribuído na análise do grupo G30, obteve média de 8,7 ± 1,3%.
Na análise do grupo G160 notou-se intensa neovascularização, apresentando capilares localizados próximos à superfície, onde se observou a presença de capilares dilatados e congestos, porém não foram observadas diferenças estatísticas.
O infiltrado inflamatório observado foi discreto. O tecido de granulação caracterizou-se ora por intensa proliferação de fibroblastos maduros (Figura 12) distribuídos em um tecido conjuntivo denso mais rico em fibras colágenas densas com orientação paralela a superfície da área de reparação, e ora pela presença de maior vascularização, porém de menor intensidade de hiperemia que a observada nos outros grupos, e em quantidade bem maior que o grupo estimulado com 30 µA. Apresentaram grande quantidade de colágeno denso composta por tecido conjuntivo em processo de maturação, com fibras desorganizadas superficialmente e já alinhados na porção mais profunda (figura 13). Em relação à epiderme, observou-se pavimentação de células epiteliais recobrindo a ferida, em todos animais deste grupo, caracterizando epitelização espessa.
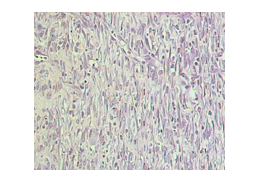
Figura 12: Fotomicrografia do grupo estimulado com 160 µA. Observa-se intensa proliferação fibroblásticas composta predominantemente por células de núcleo fusiforme (setas). H&E, 400x.
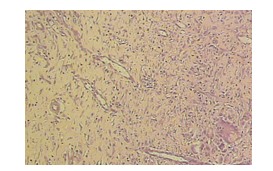
Figura 13 – Fotomicrografia do grupo estimulado com 160 µA . Observa-se colágeno denso composto por tecido conjuntivo em processo de maturação, com fibras desorganizadas superficialmente e alinhadas na porção mais profunda (setas), H&E, 200x.
Este grupo apresentou resultado estatisticamente significante quanto ao número de fibroblastos superficiais (p<0,05), e diminuição das células inflamatórias (p<0,001), quando comparado ao grupo controle.
O grau de evolução na cicatrização, atribuído na análise dos animais deste grupo, obteve média de 12,7 ± 0,3%, conforme .
Discussão
A reparação tecidual é um dos fenômenos mais importantes e interessantes dos seres vivos. A reparação, na sua forma mais abrangente, representa o esforço do organismo para manter um estado estável. Idealmente a reparação deve levar à formação de estruturas morfológicas que possam continuar realizando as atividades e funções fisiológicas.
Vários trabalhos relatam os efeitos do uso da corrente elétrica de baixa intensidade na cicatrização de feridas incisionais e excicionais. Na década de 60 Assimacopoulos (1964) obteve como resultado, um denso tecido conjuntivo rico em fibras colágenas hialinizadas e dispostas em paralelo, realizando tratamento com micro corrente, no presente estudo encontramos os mesmos resultados com apenas uma aplicação pós-cirurgia. A partir do resultado encontrado por Assimacopoulus (1964; 1968), diversos estudos, tanto em vivo (Ruiz-Silva, 2006; 2016) como em ex vivo (MITCHELL, 1976; CHENG, et al. 1982), foram realizados, para demonstrar, a eficiência da técnica e mecanismos de ação fisiológica, subsidiando a hipótese de trabalho que a TMC pode acelerar o processo de cicatrização.
Vários autores sugerem o aumento na velocidade de contração, fechamento e cicatrização da ferida nos primeiros dias, com a utilização da micro corrente (Ruiz-Silva, 2006; 2016), resultado obtido em nossa análise clínica nos animais tratados em relação o controle.
Apesar dos trabalhos anteriores, os efeitos, parâmetros e padronização de correntes ainda não foram estabelecidos. A literatura analisada mostra, dados controversos no tocante a intensidade, forma de onda da corrente (Ruiz-Silva, 2006; 2016), mas todos os casos evidenciaram resultados positivos na síntese de colágeno da derme, da epiderme, na espessura da ferida, utilizando correntes com intensidade entre 10 a 300 µA, motivo este pelo qual estabeleceu-se neste experimento duas intensidades nesta faixa, ou seja, 30 µA e 160 µA (Xu, 2021).
Os resultados do presente estudo sugerem que os animais controle apresentaram características fisiopatológicas coerentes com a normalidade, que resultaria em uma cicatrização convencional por segunda intenção. Por outro lado, mesmo que o quadro geral observado no grupo tratado também apresentasse uma tendência a uma cicatrização completa das lesões, esta foi diferente quando comparamos os resultados ao do controle ou entre si (30 µA e 160 µA), evidenciando que o uso da TMC resultou em uma bioestimulação da cicatrização das feridas, corroborando citações de Becker (1995).
Observou-se uma diminuição significante dos sinais inflamatórios nos animais tratados em relação ao grupo controle, estes aspectos podem representar um efeito antiinflamatório da TMC, pois ocorreu uma retração da ferida, desenvolvimento precoce da crosta, diminuição do edema, e nenhum animal apresentou exsudato e pus quando estimulado, corroborando com Morgareidge e Chipman (1990) que afirma que aumentando o campo elétrico das feridas obtemos a migração de células epidêmicas, fibroblastos, leucócitos e macrófagos para a margem ferida.
Monetta (1998), relata que a crosta interfere na contração da ferida dificultando a fase de cicatrização. Neste estudo os animais tratados desenvolveram crosta nas primeiras horas, e todos animais apresentaram crosta em 96 horas, sendo que os animais do grupo 30 µA perderam rapidamente.
Um outro dado importante a ser considerado foi a presença de intensa proliferação fibroblástica nos grupos tratados, principalmente o estimulado com 160 µA, quando comparado ao controle, fato que foi evidenciado por Feng et al. (1983). Onde indicaram maior atividade de fibroblastos. Demonstrou-se que, os fibroblastos são células aeróbicas e necessitam de oxigênio tanto para divisão como para síntese de colágeno.
Podemos observar um número maior de células fibroblásticas fusiformes, células estas que, caracterizam um tecido maduro no grupo tratado com 160 µA em relação ao grupo estimulado com 30 µA. Este aspecto indica uma aceleração no processo de proliferação de fibroblastos dos espécimes tratados com 160 µA. A proliferação de fibroblastos foi menor nos animais do grupo controle cujas células apresentavam núcleos ovalados, o que caracteriza um tecido mais jovem, representado por uma cicatrização mais lenta quando comparada ao do grupo tratado (ABLA, 1995).
Observou-se que o tecido conjuntivo se apresenta mais rico em fibras colágenas quando estimuladas com baixa intensidade, mais evidente com 160 µA, o que novamente seria explicado pelos resultados observados por Cheng et al. (1982) e constatados em estudos anteriores (Ruiz-Silva, 2006; 2016)
O grupo tratado com 160 µA apresentou uma neovascularização mais intensa que os outros grupos, apesar dos resultados não serem estatisticamente significativos, e esta em associação a uma proliferação fibroblástica intensa, onde maior a vascularização, maior o aporte sanguíneo. Este aspecto pode representar a manifestação do efeito da TMC sobre o tecido endotelial, o qual poderia ser resultante de uma maior liberação de mediadores químicos da proliferação celular conforme já relatados em estudos anteriores (CHENG et al., 1982).
O processo inflamatório no final de sete dias, foi menos intenso e aparentemente mais evoluído nas feridas tratadas que nas do controle, e menor ainda quando tratado com 160 µA, isso poderia ser explicado pelo inicio mais precoce do processo em feridas estimulada, Young (1988), afirma que durante a fase proliferativa o número de células inflamatórias diminui, enquanto o numero de células endoteliais e fibroblastos aumentam. Estes últimos são de grande importância no reparo de pele, não só porque são os principais produtores da matriz extracelular, mas também por que se contraem, reduzindo o tamanho da lesão (YOUNG, 1988).
Uma resposta inflamatória deficiente, assim como a diminuição dos fibroblastos na ferida reduz em muito a deposição do colágeno (SIMÔES et al.,1985), os resultados notados nos animais tratados com TMC demonstram a eficiência da técnica na diminuição da resposta inflamatória e na estimulação da síntese de colágeno.
De acordo com os resultados estatísticos os grupos tratados com micro corrente, 160 µA e 30 µA , apresentaram diferenças significativas (P<0,001), quanto à redução de células inflamatórias superficiais demonstrando a aceleração do processo cicatricial superficial dos grupos tratados com TMC, e que os mesmos encontram-se em fase mais avançada de cicatrização, principalmente o grupo estimulado com 160 µA. Esse resultado é justificado pelo estado adiantado no reparo destas lesões, pois a literatura demonstra que a proliferação celular diminui com redução gradual do tamanho dos fibroblastos. Concomitante há um lento aumento na resistência elástica da ferida, pois as fibras colágenas sofrem maior interligação aumentando sua espessura e compactação (Ruiz-Silva, 2006; 2016).
Segundo a análise qualitativa (WEI YU, 1997), obteve-se um ganho no processo de cicatrização com a utilização da micro correntes, o grupo tratado com 160 µA obteve 65,4% de ganho e o grupo 30 µA 49,5% em relação ao grupo controle. Os resultados corroboram com estudos feitos em humanos onde, o grupo tratado mostrou uma melhora da taxa de cicatrização de 1,5 a 3,5 vezes na velocidade da resposta curativa que o grupo controle (WATSON; 1998).
Os resultados obtidos permitem afirmar que, a micro corrente em breve deverá se tornar modalidade de uso contínuo para os profissionais da área da saúde. Entretanto, o conhecimento de dosimetria e de mecanismos de ação desta técnica, exigem estudos investigacionais mais detalhados.
Conclusões
O uso da TMC com intensidades de 30 mA e 160 mA, e freqüências de 0,3 Hz e 0,8 Hz, promove em uma única sessão imediatamente após a cirurgia, aceleração do processo cicatricial, quando analisado clinicamente.
A analise histológica, apresentou resultados estatisticamente significativos quanto à efetividade na redução do número de células inflamatórias dos dois grupos tratados (30 mA e 160 mA), e também no aumento do número de fibroblastos superficiais com a utilização de corrente de 160 mA.
Podemos afirmar que e uma excelente opção para o pós cirúrgico imediato, mais devemos fazer novos estudos com maior número de animais e maior período de avaliação, bem como um estudo aplicando a micro terapia celular a cada 48hs, para utilizarmos a terapia como protocolo de tratamentos.
Oliveira HMB de S, Santos AM de JF dos, Madeira MZ de A, Andrade EMLR, Silva GRF da. Avaliação do risco para o desenvolvimento de lesões perioperatórias decorrentes do posicionamento cirúrgico. Rev Gaúcha Enferm [Internet]. 2019;40(spe):e20180114. Available from: https://doi.org/10.1590/1983-1447.2019.20180114
Sonnewend, D., Oliveira, J. L. R., Ruiz-Silva, C. ., Nicolau, R. A., Zângaro, R. A., & Pacheco, M. T. T. (2005). Avaliação do efeito da microterapia celular sobre o processo inicial da cicatrização de feridas em ratos.
Avendaño-Coy J, López-Muñoz P, Serrano-Muñoz D, Comino-Suárez N, Avendaño-López C, Martin-Espinosa N. Electrical microcurrent stimulation therapy for wound healing: A meta-analysis of randomized clinical trials. J Tissue Viability. 2022 May;31(2):268-277. doi: 10.1016/j.jtv.2021.12.002. Epub 2021 Dec 4. PMID: 34903470.
Ruiz-Silva, C; Longo, B. Criolipolise de Placas e Microcorrentes: O futuro da Harminização Corporal. 5 Congresso Internacional Cientifico Multidisciplinar de Estética, 1 Edição. São Paulo, Triall Editorial, 2023
WEI, YU; NAIM, J. O.; LANZAFAME, R. J. Effects of photostimulation on wound healing in Diabetic Mice. Lasers Surg. Med. v.20, p.56-63, 1997.
ASSIMACOPOULUS, D. Wound healing promotion by the use of negative electric current. Ann Surg v.34, p.423-431. 1968.
ASSIMACOPOULUS, D. Low intensity negative eletric current in treatment of ulcers of the leg due to chronic venous insufficiency. The American Jornal Of Surgery, v.115, p. 683-687, 1968.
Ruiz-Silva, Carlos. Efecto antiinflamatorio de la micro corriente en los procesos iníciales de la cicatrización de heridas en ratas. 2016. Tese (Doutorado em Ciências Biomedicas) – Instituto Universitario Italiano de Rosario, Rosario, Argentina, 2016. https://iunir.edu.ar/postgrado/doctorado/resumen/166
Ruiz-Silva, C. Efeito da corrente elétrica de baixa intensidade em feridas cutâneas de ratos. Univap, São Jose dos Campos, SP. 2006 https://biblioteca.univap.br/dados/000001/00000171.pdf
Xu, Xinkai, et al. “Effects of electrical stimulation on skin surface.” Acta Mechanica Sinica (2021): 1-29.
Lee, Hana, et al. “Bioelectric medicine: unveiling the therapeutic potential of micro-current stimulation.” Biomedical Engineering Letters 14.3 (2024): 367-392.
Avendaño-Coy, Juan, et al. “Electrical microcurrent stimulation therapy for wound healing: A meta-analysis of randomized clinical trials.” Journal of Tissue Viability 31.2 (2022): 268-277
Cheng N, Van Hoof H, Bockx E, Hoogmartens MJ, Mulier JC, De Dijcker FJ, De Loecker W (1982) The effects of electric currents on ATP generation, protein synthesis, and membrane transport of rat skin. Clin Orthop Relat Res 171:264–272
ABLA, L.E.F.; ISHIZUKA, M.M.A. Fisiopatologia das feridas. In: Ferreira LM. Manual de cirurgia plástica. São Paulo: Atheneu. p. 5-11, 1995.
BECKER, R.. The basis for microcurrent electrical therapy in conventional medical practice. Jornal of advancement in Medicine;, v.8 , n.2, 1995.
FENG, L.J et al. Blood flow changes and leukocyte mobilization in infection: comparison between ischemia and well-perfused skin. Surg Forum, v.34, p.603, 1983.
MITCHELL, P. Vectoral chemistry and the molecular mechanism of chemiosmotic coupling: Power transmission by proticity. Biochem Soc Trans., v.4, p.400-406. 1976.
MONETTA, L. Análise evolutiva do processo de cicatrização em úlceras diabéticas, de pressão e venosas com uso da papaína. 1998. Dissertação (Mestrado) – Escola de Enfermagem/USP. Ribeirão Preto (SP).
MORGAREIDGE, K.R. ; CHIPMAN, R.D. Microcurrent Therapy . Physical Therapy Today , p. 50-53, Spring 1990.
NORDENSTROM, B. Biologically closed electrical circuits: activation of vascular interstitial closed electric circuits for treatment of inoperable cancers. J Bio electricity v. 3, p.137-153.1984.
SIMÕES, M.J. et al. Aspectos ultra estruturais do processo de reparação de pele de ratos albinos. Rev. Paul. Méd., v.103, n.3, p.123-126,1985.
YOUNG, S.R. The effect of therapeutic ultrasound of the biological mechanismo involved in dermal repair. 1988. 412f. (PhD Thesis) University of London.
WATSON, T. Estimulação Elétrica para a cicatrização de feridas. In: KITCHEN, S.; BAZIN, S. Eletroterapia de Clayton.10. ed. . São Paulo: Ed. Manole, 1998.
1,3,4,5 Faculdade CTA
1,2,Faculdades Integradas da Amazônia
4 Centro Universitário Leonardo da Vinci
