REGISTRO DOI: 10.5281/zenodo.7916350
Celso Fernandes Batello¹
Profa. Dra. Vânia d’Almeida²
RESUMO
Essa dissertação apresenta, com o apoio de fundamentação teórico-prática, o cenário em que se insere a problemática em questão, O efeito antioxidante in vitro dos medicamentos homeopáticos Arsenicum album, Cuprum metallicum, Manganum e Zincum metallicum. Demonstra-se, nos capítulos iniciais, de fundamentação teórico-bibliográfica, a Homeopatia e a Oligoterapia como técnicas terapêuticas, bem como a importância dos fenômenos oxidativos, para uma melhor compreensão dos fenômenos orgânicos, notadamente na gênese de várias doenças. Demonstra-se ainda, experimentalmente, a ação antioxidante dos medicamentos homeopáticos em diferentes diluições, comparativamente a melatonina em diversas concentrações sobre a peroxidação lipídica em homogenato de cérebro de ratos, mensurada através da dosagem de malondialdeído obtidas pela técnica de absorbância. Para a análise dos resultados, foram utilizados os testes de Kruskal-Wallis e de Múltiplas Comparações de Dunn, que revelaram haver diferenças significativas entre os grupos experimentados. Verificou-se um maior efeito inibidor da peroxidação lipídica com a melatonina 1M, vindo a seguir a melatonina 0,5 M, o Cuprum metallicum C12, o Cuprum metallicum C30, o Arsenicum album C30, melatonina 0,25 M, o Manganum C30 e o Arsenicum album C12. Comprovou-se que a melatonina possui efeito inibidor da peroxidação lipídica in vitro, sendo por isso adotada como referência. O fato novo, contudo, surge a partir da constatação da significativa inibicão da peroxidação lipídica obtida com o uso de medicamentos homeopáticos, algumas vezes com diluições que suplantam o número de Avogadro, como no caso do Cuprum metallicum C30, Arsenicum album C30 e o Manganum C30, em ordem decrescente de ação. Esse trabalho chama a atenção para a possibilidade da existência de um mecanismo de ação antioxidante do medicamento homeopático diverso da conhecida relação dose e efeito.
ABSTRACT
This dissertation, with the support of a theoretical practical foundation, presents the scenario where is inserted the problematic in question: The Antioxidant Effect in vitro of Homeopathic Medicines Arsenicum album, Cuprum metallicum, Manganum and Zincum metallicum. It is demonstrated in the first chapters, of theoretical bibliographical substantiation, the Homeopathy and Oligotherapy as therapeutics techniques, as well as the importance of oxidation phenomena for a better comprehension of the organic phenomena, mainly in the in the genesis of many diseases. It is also experimentally demonstrated the homeopathic medicines antioxidant action in different dilutions in comparison with melatonine in various concentrations over the lipidic peroxidation in homogenate of mice brains measured through the malondialdehyde dosage obtained through the absorbance technique. For the analysis of the results the Kruskal-Wallys and Dunn’s Multiple Comparisons tests were realized, that revealed significant differences among the experimented groups. It was verified a greater lipidic peroxiadtion inhibiting effect with melatonine 1M, followed by melatonine 0.5M, Cuprum metallicum C12, Cuprum Metallicum C30, Arsenicum album C30, melatonine 0.25M, Manganum C30 and Arsenicum album C12. It was proved that the melatonine has an in vitro lipidic peroxidation inhibiting effect, and so being adopted as reference. However the new fact arises from the observation of the significant lipidic peroxidation inhibition obtained with the usage of Homeopathic medicines, sometimes with dilutions that supersede the Avogadro number, as in the cases of Cuprum metallicum C30, Arsenicum album C30 and Manganum C30 in decreasing action order. This work calls the attention for the possibility of existence of na antioxidant mechanism action of homeopathicmedicine different from the known cause effect relationship
1 INTRODUÇÃO
Este trabalho foi idealizado a partir do pressuposto de que, se o medicamento homeopático possui ação terapêutica e/ou preventiva, talvez, parte desta ação decorra de uma ação antioxidante.
Alicerçado em Hahnneman, parágrafo 20, Justificativa para a experimentação:
“Não somos capazes de descobrir essa força imaterial que se encontra latente na essência íntima dos medicamentos apenas com os esforços da razão. Só pela experiência (experimentação), podemos observar claramente os fenômenos que ela provoca quando age sobre o organismo sadio (experimentação no homem são)” (Pustiglione, 2001).
Analogamente, irá se fazer uma experimentação, somente que in vitro, para verificar a possível ação antioxidante do medicamento homeopático em homogenato de cérebro de ratos, comparativamente à melatonina, especificamente na peroxidação lipídica. Como medida dessa ação antioxidante, vai-se dosar o malondialdeído (MDA), resultante das reações de peroxidação lipídica.
Pretende-se demonstrar experimentalmente, in vitro, a ação do medicamento homeopático numa etapa específica da cascata das espécies reativas de oxigênio, a peroxidação lipídica, com o intuito de tentar-se compreender, laboratorialmente, e por inferência, os efeitos desse medicamento no homem são.
Pretende-se ainda que esse trabalho crie possibilidades para a experimentação do medicamento homeopático nas outras etapas da cadeia oxidativa, bem como em outros setores experimentais, a fim de se fazer ver que é possível realizar trabalhos em Homeopatia dentro dos moldes científicos atualmente aceitos.
O trabalho respaldou-se nas obras da literatura existente nas áreas envolvidas, enfatizando-se que em momento algum apresentaram-se conflitantes, muito pelo contrário, pareceram sinérgicas.
Embora eminentemente experimental, esse trabalho também irá-se valer de pesquisa de natureza bibliográfica.
1.1 História da Medicina
A tentativa de aliviar e curar as dores e o sofrimento data dos tempos imemoriais e se confunde com a própria história da humanidade.
Entretanto, com Hipócrates a Medicina perdeu seu vínculo com a Filosofia e a Teurgia, tornando-se ciência e arte. Segundo Maffei (1978):
“A medicina é considerada uma arte e uma ciência ao mesmo tempo, sendo considerada um ramo da Biologia. Se indagarmos: Como e como apareceu a medicina?, verificaremos que a Medicina nasceu com o homem; de fato, desde o seu aparecimento sobre a Terra, o Homem foi vítima ou testemunha do sofrimento e, por isso, sempre procurou observar as doenças que o afligiam e dar-lhes os remédios.
Hipócrates, que viveu de 460 a 373 a.C., em pleno século de Péricles, época de grandes nomes como Sófocles e Eurípedes, Aristófanes e Píndaro, Sócrates e Platão, Heródoto e Tucídides, Rhide e Polignoto, era dotado de elevado espírito de observação, o que lhe possibilitou reunir dados numa compilação que recebeu o nome de Aforismas e formar a base para os conhecimentos médicos atuais. Por esse motivo, Hipócrates foi chamado “Pai da Medicina” (Maffei, 1978).
Hipócrates criou a “Medicina Científica”e com este cabedal de conhecimentos enunciou o preceito básico de cura: Similia similibus curantur (os semelhantes se curam pelos semelhantes). Diferente do Contrario contrarius curantur (os contrários se curam pelos contrários) (Duprat, 1982).
Se a medicina não fosse algo único, que engloba a Alopatia, a Homeopatia e outras técnicas terapêuticas existentes, após enunciar o princípio dos semelhantes, Hipócrates seria aclamado como o “Pai da Homeopatia”.
A cura pelos contrários foi defendida por Galeno. Por este método, utiliza-se o “anti”, isto é, diante de uma febre administra-se um antifebril, da presença de um verme, um anti-verme (anti-helmíntico) e de uma bactéria, um antibiótico (Demarque, 1981).
A cura pelos semelhantes foi definida por Hipócrates, quando enunciou o seguinte aforisma:
“A doença é produzida pelos semelhantes, e pelos semelhantes que a produziram (…) o paciente retorna à saúde. Desse modo, o que provoca a estrangúria que não existe, cura a estrangúria que existe; a tosse, como a estrangúria, é causada e curada pelo mesmo agente” (Duprat, 1982).
Hipócrates, dando um exemplo prático, cita um caso de cura de cólera com Veratrum album, que produz, no homem sadio, violenta gastroenterite com tendência à algidez, semelhante ao que ocorre no ataque colérico (Duprat, 1982).
Há os que acham que Hipócrates sequer existiu, entretanto, existem provas de que ele nasceu em Cós no ano de 460 a.C. e faleceu em 337 a.C. (Maffei, 1978).
A tradição informa que Hipócrates descendia de Esculápio, por linhagem paterna, e de Hércules, pelos antepassados da mãe. Entre os seus ancestrais contavam alguns reis e três célebres médicos, quais sejam Pródico de Cós, Hipócrates I e seu pai Heráclito, que lhe ensinou as primeiras noções científicas. Assim, era filho de Heráclito e Fenavita, ou Praxitea, da família dos Asclepíades, que vinham exercendo a Medicina por dezoito gerações. Hipócrates foi, sem dúvida alguma, um sábio, como Sócrates e outros (Maffei, 1978).
1.1.1 História da Homeopatia
A Homeopatia é o método terapêutico baseado na aplicação de uma lei farmacológica denominada Lei das Semelhanças ou princípio de similitude. (Tetau, 1980).
Essa lei foi enunciada por Hahnneman, criador da Homeopatia, médico nascido em Meissen (Saxen), em 1755. Samuel Christian Frédérich Hahnneman, em seu Ensaio sobre o novo princípio para descobrir as virtudes das substâncias medicinais, afirma: “Para curar radicalmente certas enfermidades crônicas, deve-se procurar remédios que provocam comumente no organismo humano uma doença análoga e a mais análoga quanto possível” (Tetau, 1980).
1.1.2 Hahnemann, “Pai da Homeopatia”
Hahnemann, considerado o “Pai da Homeopatia” , cursou medicina em Leipzig, tendo falecido em Paris com 88 anos. Seus restos mortais encontram-se no Cemitério Pere Lachaise, em Paris, cidade que se orgulha de guardar os despojos deste imortal humanista (Castro, 1980).
1.1.3 História da Homeopatia no Brasil
A Homeopatia foi introduzida no Brasil em 21 de novembro de 1840, pelo francês Benois Jules Mure (Castro, 1980).
Em 1918, através do decreto n.º 3.530, de 25 de setembro, o Instituto Hahnemanniano do Brasil foi reconhecido como entidade de utilidade pública, no artigo que diz: “Além das medicinas fornecidas pelas escolas oficiais ou equiparadas, a clínica homeopática será exercida pelos profissionais habilitados pelo Instituto Hahnemanniano” (Castro, 1980).
Em 1952, pelo Decreto n.º 1.552, de 08/07/1952, o ensino de Farmacotécnica Homeopática tornou-se obrigatório em todas as faculdades de Farmácia do Brasil (Castro, 1980).
1.1.4 Homeopatia e Alopatia
Como foi relatado, Hipócrates enunciou dois princípios de cura: contrario contrarius curantur e similia similibus curantur, ou seja, a cura pelos contrários, abraçada principalmente por Galeno, e a cura pelos semelhantes, adotada por Samuel Hahnemann, “Pai da Homeopatia”.
Hahnemann, na sua genialidade, percebeu que, se diluísse a substância ainda mais, a cura seria mais rápida, suave e duradoura. Daí a Homeopatia preconizar o uso de medicamentos que curam pelos semelhantes e em doses diluídas, que são potencializadas através de processos de succussão, caracterizando doses mínimas (Kent, 1980).
Na administração do medicamento homeopático leva-se em consideração todos os aspectos do indivíduo, ou seja, o físico, o psíquico e o mental, na tentativa de escolher aquele medicamento que aja na sua totalidade. O médico que nos primeiros casos já tenha podido escolher um medicamento que se aproxime do específico homeopático, poderá, nos casos subseqüentes, verificar a segurança do remédio escolhido, ou então descobrir o mais apropriado (Hahnemann, 1984).
1.2 Medicamentos
1.2.1 Medicamentos homeopáticos
Os medicamentos homeopáticos podem ser divididos em policrestos e medicamentos menores, segundo a sua patogenesia, que é a capacidade de provocar sintomas no indivíduo são. Os policrestos são aqueles que produzem uma gama de sintomas patogenéticos maior e mais acentuados do que os medicamentos menores. O termo policresto é formado por duas palavras gregas: muito e poderoso (Tetau, 1980).
A confecção do medicamento homeopático obedece as normas estabelecidas no país com o decreto n.º 57477-66, que dispõe sobre a manipulação, receituário, industrialização e venda de produtos industrializados em Homeopatia, portaria n.º 1180 de Agosto de 1997, conforme resolução n.º 23 de 06/12/1999 da Agência de Vigilância Sanitária Nacional (Farmacopéia Homeopática Brasileira).
Para melhor ilustrar o método, exemplifica-se a seguir:

Procedendo-se assim, sucessivamente a partir dos primeiros, obtém-se as subseqüentes potências decimais e centesimais.
Uma vez realizadas as referidas diluições, o medicamento homeopático deve ser submetido a um processo denominado dinamização, que consiste em succionar o frasco batendo o fundo do mesmo contra a palma da mão (sucção) ou, então, realizar o mesmo procedimento num equipamento especial destinado a este fim.
O termo diluição deve ser reservado para a série de operações sucessivas descritas com minúcia nas diversas edições do Organon, e que permitem diminuir cada vez mais a quantidade da substância medicamentosa (Demarque, 1981).
1.3. Procedência dos Medicamentos homeopáticos
Os medicamentos homeopáticos provêm dos três reinos existentes na natureza: animal, mineral e vegetal.
Como exemplo de medicamento extraído do reino animal, cita-se o veneno da cobra surucucu (Lachesis trigonogaster); do reino mineral, o cobre (Cuprum metalicum), o ouro (Aurum metalicum) e o mercúrio (Mercurius solubillis); e, finalmente, do vegetal, a Beladona, extraída da planta Atropa belladona. (Duprat, 1982).
1.4. O medicamento experimentado no homem são
Um dos princípios da Homeopatia é a experimentação no homem são, que determina que o mesmo medicamento que causa sintomas no sadio é que vai curar o enfermo pela Lei da Semelhança (Tetau, 1980).
Por conseguinte, a prática da Homeopatia pressupõe:
a. a experimentação de diferentes substâncias, efetuada pela administração no homem sadio. Neste sentido, pode-se dizer que a Homeopatia é um método experimental. O conjunto dos sinais observados no decorrer dessa experimentação, feita evidentemente em doses subtóxicas, tem o nome de patogenesia. Algumas dessas patogenesias decorrem de substâncias desprovidas de toda toxidade (carbonato de cálcio, sal marinho, sílica). Elas ressaltam a noção de sensibilidade particular de certos indivíduos.
b. emprego do medicamento em dose fraca, e mesmo muito fraca, infinitesimal, elevando-se muitas vezes além do número de Avogadro (Tetau, 1980).
Hahnemann experimentou diversos medicamentos e, após rigorosa observação, catalogou os sintomas e sinais produzidos por estas substâncias. no seu livro Matéria Médica Pura (Kent, 1980).
1.5 A ação do medicamento homeopático
De acordo com a Lei das Semelhanças, o medicamento homeopático, experimentado no homem são, causa sintomas físicos e mentais característicos, os quais foram registrados por Hahnemman no já mencionado livro Matéria Médica Pura.
Sabe-se que a escolha do medicamento homeopático é feita por um processo de exclusão, único e particular, no qual os sintomas do paciente devem coincidir o máximo possível com o do medicamento. Por isso, diz-se que um é o espelho do outro (Tetau, 1980).
O adágio hipocrático similia similibus curantur exprime um preceito que, mais explicitamente, assim se define: a substância medicamentosa capaz de determinar no organismo sadio um conjunto de distúrbios análogos aos existentes no organismo enfermo.
A ação curativa do medicamento homeopático manifesta-se por meio de um mecanismo que pode ser considerado sob dois pontos de vista: farmacodinâmico propriamente dito, que revela a dualidade da ação de toda substância medicamentosa segundo as doses empregadas, e biológico, que intervém na especificidade da defesa orgânica (Duprat, 1982).
Há muitos anos já é conhecida a dualidade de ação de todo medicamento e, sem citar Hahnemann, encontramo-la também nas conclusões a que chegaram diversos biologistas, tais como:
Claude Bernard: “Toda substância que, em pequenas doses, excita as propriedades ou funções de um elemento anatômico, em altas doses anula-as” (Duprat, 1982).
Brown-Séquard: “A excitação moderada de um elemento nervoso provoca exaltação (dinamogenia) das funções que dele dependem diretamente ou por reflexo; uma excitação forte pode abalar essas mesma funções” (Duprat, 1982)
Hugo Schultz: “Toda excitação provoca numa célula aumento ou diminuição de sua função fisiológica, proporcional à intensidade fraca ou forte da excitação” (Duprat, 1982).
Huchard:
“Basta dizer que abracei, aliás há muito tempo, apenas duas leis terapêuticas: a do tratamento e cura de número bastante grande de estados mórbidos com medicamentos que produzem sintomas análogos ao das doenças; e a dos medicamentos prescritos às vezes em doses diminutas, já que é verdade, como disse Pécholier, de Montepellier, que num medicamento há vários medicamentos, conforme diferentes doses” (Duprat, 1982).
Rudolf Arndt, pela da Lei de Biologia Fundamental, enuncia:
“Os pequenos estímulos provocam a atividade vital; os estímulos médios aumentam-na; os estímulos fortes jugulunam-na; os estímulos exagerados abolem-na. Essa lei é tirada da “Lei das sacudidelas”, de Pfluger, que fixa a ação das correntes elétricas fracas, médias e fortes” (Duprat, 1982).
Recorramos a alguns exemplos comuns, a fim de concretizar essas constantes farmacodinâmicas.
O ópio, em dose forte, é um depressor cérebro espinhal e acaba por produzir um sono comatoso, com relaxamento muscular; em pequena dose, estimula a atividade intelectual, nervosa e muscular, e age como ótimo excitante para manter a pessoa desperta (Duprat, 1982).
Com relação ao arsênico, em seu clássico tratado de terapêutica, diz Manquat:
“A ação do arsênico nos glóbulos vermelhos talvez seja a destruição, entretanto, nos doentes, parece agir de maneira diferente. Realmente, em doses reduzidas, esse medicamento estimula a fabricação de glóbulos vermelhos, que em dose forte, ele destrói” (Duprat, 1982).
Resumindo: o efeito da dose forte, que Hahnemann chamou primitivo, e outros autores, ativo, diz respeito à ação própria da substância medicamentosa, à sua virtude tóxica, é uma ação coerciva, de dominação. O efeito da pequena dose, que Hahnemann denominou secundário ou reativo, refere-se à ação própria do organismo, à sua reação de defesa, à sua libertação da ameaça tóxica das substâncias medicamentosas (Duprat, 1982).
A Ipeca, em dose forte, é um vomitório; em dose fraca, diluída e dinamizada, homeopática, torna-se um dos remédios para náuseas e vômitos. Há então inversão farmacológica para uma determinada dosagem (Tetau, 1980).
1.6 Experimentação dos medicamentos homeopáticos
Essa pesquisa baseou-se na experimentação in vitro dos seguintes medicamentos homeopáticos: Zincum metallicum, Cuprum metallicum, Arsenicum album e Manganum.
1.6.1 Zinco
O zinco é um metal de transição que desempenha inúmeras funções orgânicas, sendo um dos principais metais para o cérebro. Participa na formação da insulina, assim como atua no funcionamento de quase uma centena de enzimas do sistema denominado zinc-finger, controlando e ativando grande quantidade de hormônios (Halliwell e Gutteridge, 1989).
Encontra-se o zinco abundantemente na secreção prostática, no líquido seminal, o que sugere haver relação de causa e efeito entre a deficiência de zinco e a hiperplasia benigna de próstata (Hendler, 1990).
Abundante na natureza, porém combinado com enxofre ou sílica, o Zincum metallicum pode ser encontrado na França, Inglaterra, Índia e Austrália. Até Hahnemann, que lhe deu seu verdadeiro lugar na terapêutica, quase não foi usado em Medicina. Graças a seus trabalhos, os homeopatas puderam obter deste remédio muitos êxitos (Lathoud, 1980).
1.6.2 Zincum metallicum
O zinco utilizado como medicamento homeopático recebe a nomenclatura latina Zincum metallicum.
O zinco é um metal sólido laminado, dúctil, branco azulado. Quebradiço quando seco e aquecido até 200º C, por isso deve-se conservá-lo à temperatura intermediária. À umidade fica coberto de ligeira capa de hidrocarboneto, que adere fortemente ao metal e impede a sua oxidação. Aquecido até o vermelho vivo, arde ao ar como bela chama verde e resulta em óxido de zinco, Zn-O (Lathoud, 1980).
O zinco atua sobre o conjunto de sistemas nervosos simpático e cérebro espinhal. Entretanto, sua ação recai particularmente sobre os plexos do tórax e sobre os grandes troncos e ramos nervosos que se distribuem pelo aparelho locomotor, que controla o movimento e a sensibilidade (Lathoud, 1980).
A atuação do zinco ocorre tanto na parte motora como na sensorial, primeiro e sobretudo no sistema nervoso. O que o ferro é para o sangue, o zinco é para o sistema nervoso (Lathoud, 1980).
1.6.3 Cobre
O cobre é um metal de transição encontrado em todos os tecidos, contudo mais elevado particularmente no cérebro e fígado.
O cobre atua como cofator em vários processos enzimáticos, como catalisador na síntese da hemoglobina, na conversão da tirosina em melatonina dos hormônios tireoideanos T3 e T4, na proteção estrutural da bainha de mielina e na síntese da elastina e do colágeno. Também integra a enzima superóxido dismutase, na citocromo-oxidase, na tirosinase e na dopamina beta hidroxilase (Torti, 1988).
1.6.4 Cuprum metallicum
O cobre utilizado como medicamento homeopático recebe a nomenclatura latina Cuprum metallicum.
O cobre é um metal de cor vermelha característica, muito maleável, dúctil e tenaz. Ao ar livre, cobre-se de uma capa verde de hidrocarbonato (verde acinzentado). É encontrado na natureza sobretudo em estado de purita de cobre e sulfato de ferro, freqüentemente associado a sulfatos de antimônio, prata, chumbo e arsênico, e também em estado de óxido e hidrocarbonato. Existe ainda na maioria dos alimentos vegetais e animais (Lathoud, 1980).
O cobre atua seletivamente sobre a medula espinhal e o sistema nervoso simpático, exercendo marcada influência em todo o organismo. Age também nas inervações sensitiva e motora e na inervação trófica, afetando profunda e diretamente a nutrição (Lathoud, 1980).
1.6.5 Arsênico
O arsênico é um metal tóxico, cujas fontes de contaminação são óleos combustíveis, inseticidas e tintas. Sua eliminação ocorre pela urina.
Dos metais tóxicos, o arsênico é dos menos perigosos. Contudo, os arsênicos inorgânicos e as formas trivalentes são mais tóxicos. Sistemicamente, quando absorvidos por via oral, podem ocasionar vasodilatação. Em grandes doses, o arsênico pode ocasionar efeitos deletérios no sistema cardiocirculatório como destruição dos capilares e arteríolas, bem como necroses miocárdicas. Já no trato gastrointestinal pode provocar graves lesões com hemorragias severas, alterações da proliferação celular (Lathoud, 1980).
A aplicação em Homeopatia decorreu de observações toxicológicas do arsênico sobre o ser humano, sendo utilizado nessas circunstâncias, claro, diluidamente, quando já não se observam estes mesmos efeitos.
1.6.6 Arsenicum album
O arsênico utilizado como medicamento homeopático recebe a nomenclatura latina Arsenicum album.
O Arsenicum album, anídrico arsenioso, ácido arsênico ou arsênico branco, vulgarmente chamado arsênico, cuja fórmula é: AS2O3, é o mais importante dos compostos do arsênico. Raramente encontrado no estado natural, no geral é obtido por combustão do arsênio sulfuro de ferro ou de outros minerais arseníferos de cobalto ou níquel. Apresenta-se como um pó branco cristalizado, bastante parecido com açúcar, é inodoro, de sabor ligeiramente ácido, porém uma séria acridez se desenvolve com o tempo. Pulverizado sobre o fogo, decompõe-se e produz odor aliáceo característico. É solúvel somente em 82 partes de água fria, 140 partes de álcool a 95ºC e 5 partes de glicerina. As 3 primeiras dinamizações se obtém geralmente por trituração e as restantes mediante diluições (Lathoud, 1980).
Em geral, o Arsenicum album é usado como agente terapêutico de grande potência e difusão. Sua esfera de ação é imensa: “abarca todo o organismo e dada a sua localização eletiva sobre o sistema nervoso simpático, o afeta significativamente. Pode dizer-se que se irradia a todos os sistemas orgânicos”. (Espanet apud Lathoud, 1980).
Em uma palavra, a ação deste policresto sem par é indefinida desde os estágios benignos (irritação débil), até a extrema caquexia (ação completa, crônica) (Lathoud, 1980).
1.6.7 Manganês
O manganês é um metal de transição, que participa da molécula da superóxido dismutase mitocondrial, donde se pode inferir a sua relevante importância no mecanismo endógeno de controle do estresse oxidativo e da peroxidação lipídica (Torti, 1988).
O manganês atua como cofator na síntese da biotina, da acetilcolina, do colesterol, hormônios tireoideanos, da tiamina, da vitamina C e da protrombina, assim como age como ativador da peptidase, da arginase e também no metabolismo da glicose e na absorção e transporte do cobre (Hendler, 1990).
1.6.8 Manganum
O manganês utilizado como medicamento homeopático recebe a nomenclatura latina Manganun.
O Manganun, metal branco acinzentado, duro, quebradiço, inalterável ao ar livre, à temperatura normal apresenta-se sob uma capa de petróleo. Ao ar quente, reveste-se rapidamente de uma capa de óxido. Decompõe-se lentamente na água fria, mais rapidamente em ebulição. Quando é pulverizado, esta descomposição é muito rápida, ainda que em temperatura normal. É encontrado em muitos minerais em estado de óxido, silicato, fosfatos, sulfuros, às vezes em cinzas de plantas, em ossos e também no sangue. (Lathoud, 1980).
Para o uso homeopático, emprega-se manganês metálico pulverizado e com ele preparam-se as três primeiras dinamizações por trituração hahnemanniana (Lathoud, 1980).
Acetato de manganês, ou Manganum aceticum, tem profunda ação sobre o sistema nervoso, a pele e os ossos, acompanhado de um estado de anemia grave e debilidade intensa (Vanier, 1979).
1.7 Espécies Reativas de Oxigênio – ERO
1.7.1 Origem do oxigênio
As moléculas de oxigênio diatômico na atmosfera terrestre são as maiores promotoras de reações nas células vivas. É, portanto, apropriado começar com alguns comentários sobre o oxigênio, somente depois serão feitas considerações sobre a natureza e definição dos radicais livres.
Exceto aqueles organismos que são especialmente adaptados para viver sob condições anaeróbicas, todos os animais e plantas requerem oxigênio para uma eficiente produção de energia (Halliwell e Gutteridge, 1989).
O surgimento do oxigênio deve ter sido acompanhado pelo aparecimento da camada de ozônio (O3) na alta atmosfera, e a absorção dos efeitos danosos da radiação ultravioleta pela camada de ozônio provavelmente permitiu a evolução dos mais complexos organismos terrestres (Halliwell e Gutteridge, 1989).
1.7.2 O metabolismo do oxigênio
O oxigênio é o elemento que, na classificação periódica dos elementos químicos, pertence à família 6A, cujo número atômico e massa atômica são 8 e 16, respectivamente, e que possui 8 elétrons distribuídos nas suas camadas orbitárias.
Normalmente, em torno de 95 a 98% do oxigênio absorvido pelos organismos aeróbicos é reduzido, formando-se água na cadeia respiratória através do transporte de elétrons na mitocôndria, bem como no retículo endoplasmático, onde o sistema enzimático citocromo, no processo de fosforilação oxidativa, procede a redução tetravalente do O2 pelo sistema citocromo oxidase, fornecendo simultaneamente 4 elétrons para o oxigênio, que se reduz diretamente à água:
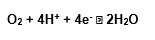
As fontes que cedem os cátions de hidrogênio e os elétrons para a reação são, basicamente, o NADH, o FADH e a ubiquinona ou coenzima Q (Halliwell e Gutteridge, 1989).
Todavia, como já referido, de 2 a 5% do O2 é reduzido univalentemente, processo em que uma molécula recebe apenas 1 elétron, o qual vai ocupar um dos orbitais externos, ao mesmo tempo em que o outro continua não parelhado, produzindo intermediários altamente reativos, denominados Espécies Reativas de Oxigênio – ERO, que algumas vezes constituem os radicais livres. Forma-se, destarte, a primeira espécie tóxica reativa de oxigênio, o superóxido, conforme esquema:
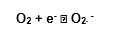
1.7.3 Radical livre
Radical livre é qualquer espécie capaz de existência independente e que contenha um ou mais elétrons desemparelhados, ou seja, elétrons presentes individualmente em orbitais atômicos ou moleculares (Halliwell e Gutteridge, 1985).
Um elétron desemparelhado pode se associar com átomos isolados (hidrogênio, íons metálicos), ou, ainda, com moléculas (açúcares, proteínas, lipídeos, DNA), o que resulta em um processo de relevância biológica (Slater, 1984, Halliwell, 1987).
Por outro lado, os radicais livres já foram relacionados a várias doenças humanas e participam como componentes fundamentais em muitas, o que mostra quão grande é o dano oxidativo causado por eles (Halliwell e Gutteridge, 1985).
1.7.4 Peróxido de hidrogênio
Uma outra forma de ERO é o peróxido de hidrogênio.
O peróxido de hidrogênio, embora seja uma espécie não muito reativa, é um agente capaz de inativar enzimas, principalmente por oxidação de grupamentos tióis essenciais. Seu maior poder oxidante, entretanto, é indireto: como gerador do radical hidroxila (HO∙ ) e pela interação com o radical superóxido (O2∙ –). Nesse caso, ele é um potente oxidante e, em concentrações suficientes, pode matar qualquer célula, sendo que na presença de ferro sua toxidade pode aumentar de 10 a 1000 vezes (Eaton, 1991).
Existem 2 tipos de enzimas que removem o peróxido de hidrogênio. São elas a catalase e a glutationa peroxidase (Halliwell & Gutteridge, 1989).
Sob a ação da glutationa peroxidase, o peróxido de hidrogênio reage com a glutationa reduzida, oxida-se e forma duas moléculas de água e glutationa oxidada.

A glutationa oxidada é novamente reduzida (regenerada) por ação da enzima glutationa redutase. Observa-se que, para o perfeito funcionamento da glutationa peroxidase, é fundamental a presença do selênio e, para a atuação de glutationa redutase, deve haver a presença de vitamina B2.
Sob a ação da catalase, também há formação de água, além do oxigênio molecular. Tem-se, então, a seguinte reação:
Catalese
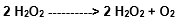
O HO∙ pode ser gerado nas células por exposição às radiações ionizantes, a partir de outras espécies de oxigênio, bem como pelas Reações de Fenton e de Haber-Weiss, mediadas por íons metálicos.
1.7.5 Reação de Fenton
A mistura de peróxido de hidrogênio e Fe2+ reage com muitas moléculas orgânicas, como foi primeiramente observado por Fenton, em 1894. A reatividade é devida à formação do radical hidroxila (Halliwell e Gutteridge, 1989).
Complexo intermediário
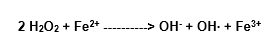
Traços do Fe3+ ficam disponíveis para reagir de novo com o H2O2, embora tal reação seja muito lenta em pH fisiológico:
Complexo intermediário
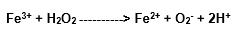
A simples mistura do sal de ferro com o peróxido de hidrogênio, pode, certamente, formar no sistema biológico, sob certas circunstâncias, uma série de reações oxidativas (Halliwell e Gutteridge, 1989).
1.7.6 Reação de Haber-Weiss
Esta reação ocorre na presença de sais de ferro ou de cobre, conforme o esquema:
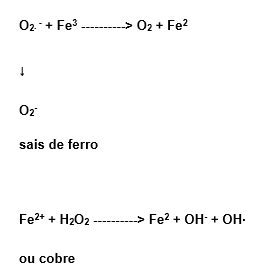
Os complexos ferrosos são capazes de catalisar a formação do radical hidroxila (OH∙ ), visto serem providos de baixa massa molecular, além da facilidade do O2∙ – e do H2O2 de liberarem íons de ferro cataliticamente ativos, provenientes de proteínas. Assim, o aumento da geração de O2∙ – e H2O2 pode criar condições que levam à formação do OH∙ (Halliwell e Gutteridge, 1985).
1.8 Outras Condições Fisiológicas
As espécies reativas ainda podem ser produzidas pelo aproveitamento de compostos da dieta (Ames, 1989).
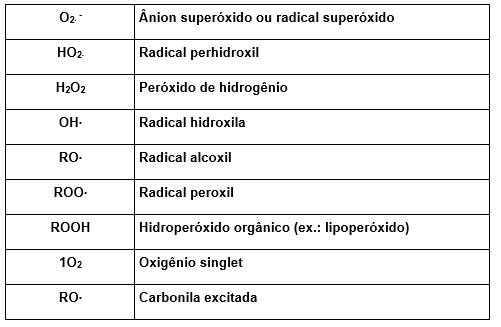
Segue tabela com as principais espécies reativas de oxigênio (Sies, 1991).
Tabela1 : Espécies Reativas de oxigênio – ERO
1.9 ERO e sistemas antioxidantes
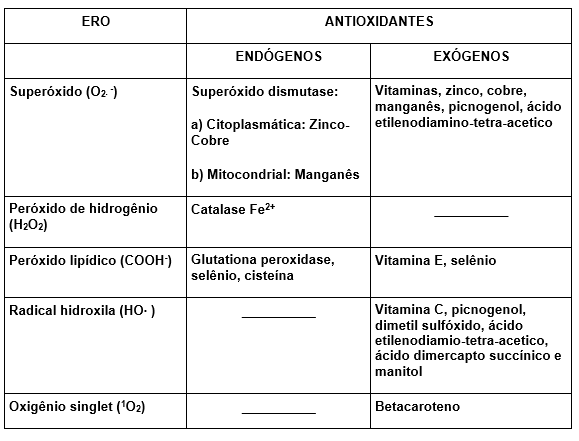
Nem todas as ERO possuem sistemas que as desativem. Para algumas ERO existem sistemas desativadores endógenos, enquanto para outras, antioxidantes externos, ou mesmo ambos.
Os antioxidantes externos são também denominado de scavengers ou varredores de ERO (Halliwell e Gutteridge, 1989).
Segue tabela das ERO relacionadas aos seus respectivos antioxidantes.
Tabela 2: Espécies reativas de oxigênio e antioxidantes
1.10 Formação das ERO
As ERO podem ser altamente tóxicas quando em excesso, seja por produção elevada, seja por dificuldade por parte do organismo em neutralizá-las. São formadas a partir do oxigênio, que constitui um verdadeiro paradoxo, pois ao mesmo tempo que gera e sustenta a vida, pode, por outro lado, ser letal (Halliwell e Gutteridge, 1989).
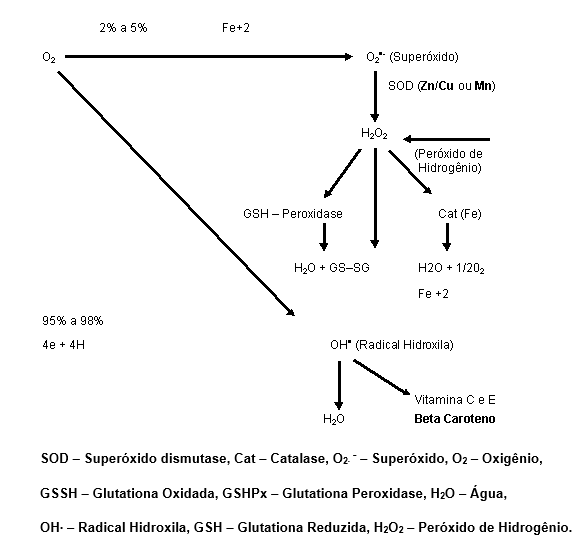
Primeiramente forma-se o radical superóxido (O2∙ –), que pode ser dismutado em peróxido de hidrogênio (H2O2) ou mesmo através de ação catalítica, pela atuação da enzima superóxido dismutase (SOD).
No organismo existem duas SODs principais, uma citoplasmática, que é a CuZnSOD e outra, mitocondrial, que é a MnSOD, esta contendo Manganês e aquela contendo Cobre-Zinco na mesma molécula.
A importância da SOD pode ser demonstrada pelo fato de ser a enzima mais abundante do organismo, ao mesmo tempo em que também é a quinta proteína mais abundante neste mesmo organismo (Halliwell e Gutteridge, 1989).
O gráfico seguinte demonstra como ocorre a formação das ERO.
1.11 Ação das ERO nos sistemas biológicos
O homem é, provavelmente, a resultante de processos evolutivos de organismos unicelulares e anaeróbicos. O ganho do ambiente terrestre por organismos mais complexos só foi possível com o aparecimento do oxigênio e o desenvolvimento da camada de ozônio, que possibilitaram a absorção de parte da radiação solar ultravioleta, fator limitante para a vida, que durante muito tempo permaneceu confinada ao ambiente aquático. Com a diminuição da radiação ultravioleta, causadora de danos aos organismos vivos, o ambiente terrestre passou a ser compatível com a vida, desencadeando a aceleração do processo evolutivo (Halliwell e Gutteridge, 1989).
Como resultado dessas mudanças, o homem permaneceu com remanescentes de seu sistema anaeróbico, razão pela qual o oxigênio que se respira – e que é tão importante para manter a vida, em circunstâncias diferenciadas – pode ser causa de morte ou do desenvolvimento de doenças, uma vez que se trata de um dos mais importantes geradores de radicais livres dentro do organismo (Halliwell e Gutteridge, 1989).
As ERO por reagirem com a maioria das moléculas do organismo, são capazes de interferir nos processos biológicos, causando diversas doenças, mutações, envelhecimento, entre outras alterações (Halliwell e Gutteridge, 1985).
1.11.1 Isquemia e reperfusão
A isquemia decorre da obstrução inicial do fluxo sangüíneo, por exemplo, devido ao clampeamento arterial por determinado período de tempo, fato que provoca sofrimento tecidual por hipoxigenação. Com o desclampeamento, ocorre a reperfusão tecidual determinando a brusca chegada do oxigênio e nutrientes ao tecido, com significativo aumento dos radicais livres, fenômeno de extrema importância, principalmente durante os primeiros 60 a 90 segundos, já que lesa a área reperfundida, ocasionando microinfartos (Halliwell e Gutteridge, 1989).
Tecidos hipoximiados ou isquemiados sobrevivem por períodos variáveis, dependendo da natureza do tecido em questão.
Se o período de isquemia ou hipoxia for curto, a injúria tecidual pode ser minimizada com a reintrodução de nutrientes. A reintrodução de O2 na isquemia ou hipoxia tecidual longa poderia causar injúria tecidual adicional (injúria de reoxigenação), que é, em parte, mediada por radicais de oxigênio (Halliwell e Gutteridge, 1989).
A isquemia e reperfusão podem ocorrer nas cirurgias cardíacas, onde a reoxigenação pode acarretar arritmias graves com lesões extensas, devido ao choque paradoxal do oxigênio, que provoca depleção de ATP durante a isquemia, formando hipoxantina ou xantina, que funcionam como substrato para a enzima xantina oxidase (XO), precursora do ácido úrico, que, nestes casos, age como antioxidante.
Durante a reoxigenação, através da reperfusão, ocorre a produção de radicais livres com seus efeitos deletérios, piorando a isquemia (Halliwell e Gutteridge, 1985).
A xantina oxidase é produzida a partir da xantina desidrogenase na presença do íon Ca2+, gerando radicais livres que vão lesar os tecidos, por isso preconiza-se o uso de antioxidantes como a SOD ou o manitol antes do desclampeamento arterial.
1.11.2 Doenças Neurológicas
Tem-se observado que traumatismos crânio-encefálicos causam injúria cerebral ou de medula espinhal. O chumbo pode, por sua vez, provocar degeneração que envolve reações com radicais livres, como a lipoperoxidação.
Isquemia cerebral ou hipoxia, seguida de reperfusão, deve também estimular a lipoperoxidação (Halliwell e Gutteridge, 1989).
O cérebro tem três características importantes:
1- É muito rico em ácidos graxos polinsaturados, que agem como substrato para a formação de peróxidos lipídicos;
2- É o órgão mais rico em ferro livre, que age formando o radical hidroxila;
3- É formado por células que não se reproduzem, os neurônios, que atingem sua maturidade em torno dos 30 anos de idade e, posteriormente, vão sendo perdidos fisiologicamente na razão de 10.000 a 100.000 por dia.
Outro mecanismo que contribui para a injúria cerebral após a hipoxia/isquemia é a não produção tissular de aminoácidos neurotransmissores excitatórios, como o glutamato ou aspartato (Halliwell e Gutteridge, 1989).
Na doença de Parkinson, a maior parte dos trabalhos tem demonstrado que existe aumento dos radicais livres, principalmente nos núcleos do cérebro que vão produzir L-dopa e são principalmente citotoxinas e neurotoxinas, que agem nesse nível, aumentando a produção dos superóxidos (Halliwell e Gutteridge, 1985).
A doença de Alzheimer, demência senil, apresenta algumas características próprias, tais como: emaranhados neurofibrilares, neurônios fantasmas, depósito de lipoferrosina (pigmento formado pelo malondialdeído ligado à proteína), filamentos emparelhados, amiloidose (o precursor da proteína da amiloidose, APP, é um potente gerador de radicais livres), aumento da atividade das placas neuríticas e envelhecimento de algumas partes do cérebro, tais como: núcleos da raphe, hipocampo e locus ceruleus (Halliwell e Gutteridge, 1985).
O alumínio é o mais abundante metal da crosta terrestre e se está constantemente exposto a ele. A presença de altas concentrações de alumínio em cérebros de pacientes de Alzheimer sugere ser esta uma das causas de encefalopatia presente na doença (Halliwell e Gutteridge, 1985).
Duas das características patológicas da demência de Alzheimer, primeiramente observadas por Alois Alzheimer em 1906, são a presença de placas senis e de emaranhado neurofibrilar no cérebro. A ação do alumínio deve contribuir para as propriedades neurotóxicas, uma vez que o cérebro é sensível à reações dos radicais livres (Halliwell e Gutteridge, 1989).
1.11.3 Peroxidação Lipídica
A peroxidação lipídica é o processo através do qual as ERO agridem os ácidos graxos polinsaturados dos fosfolipídeos das membranas das células, desintegrando-as e permitindo, desta feita, a entrada dessas espécies nas estruturas intracelulares.
A fosfolipase, ativada pelas espécies tóxicas desintegra os fosfolipídeos, liberando os ácidos graxos não saturados (Halliwell e Gutteridge, 1989), resultando nas seguintes ações deletérias dos peróxidos lipídicos:
a) Ruptura das membranas celulares (bombas NA/K e Ca/Mg)
b) Mutações do DNA – ácido desoxiribonucléico
c) Oxidação dos lipídeos insaturados
d) Formação de resíduos químicos como o malondialdeído
e) Comprometimento dos componentes da matriz extracelular, proteoglicanos, colágeno e elastina
Os peróxidos lipídicos possuem poder de ação maior do que as outras espécies tóxicas primárias de O2 (O2∙ –, H2O2, OH∙ , O2), atingindo facilmente alvos mais distantes.
A lipoperoxidação deve ter também, um papel muito importante na proliferação celular, especialmente em células tumorais. Há autores que sugerem que os produtos da lipoperoxidação estão envolvidos no controle da divisão celular, sendo que a peroxidação de lipídeos está inversamente relacionada com o crescimento tumoral (Gonzalez, 1992).
1.12 Mecanismos antioxidantes
O oxigênio constitui um paradoxo no planeta, porque ao mesmo tempo que é indispensável à vida, pode, todavia, causar injúrias ao organismo (Halliwell e Gutteridge, 1985).
Os agentes antioxidantes não podem distinguir entre as espécies reativas de oxigênio que têm papel fisiológico e aquelas que estão causando danos. Por este motivo, sua ação pode, em alguns casos, não ser vantajosa para o organismo. Entretanto, é com o equilíbrio entre as espécies oxidantes e antioxidantes que o organismo poderá obter as condições para um melhor desempenho de suas funções, sendo que um distúrbio neste equilíbrio poderá resultar em uma série de processos patológicos (Bast et al., 1991).
De um modo geral, as seguintes estratégias têm de ser seguidas com o fato de aumentar a eficiência dos AO:
Estresse Oxidativo

1.13 Defesa antioxidante
Os antioxidantes que representam a defesa dos organismos contra as espécies reativas de oxigênio são divididos em dois tipos principais, os não enzimáticos e os enzimáticos.
1.14 Antioxidantes não-enzimáticos
Alguns nutrientes essenciais podem atacar diretamente os radicais de oxigênio. A vitamina E (alfa-tocoferol) é o maior antioxidante lipossolúvel presente em todas as membranas celulares e, portanto, atua na proteção contra a lipoperoxidação (Kay et al., 1986). Ela pode reagir diretamente com uma variedade de oxiradicais, como o superóxido, a hidroxila, etc., e também com o oxigênio singlet (Machlin e Bendich, 1987).
A vitamina E foi primeiramente relatada em 1922, nos Estados Unidos, por Evaris e Bishop, que demonstraram ser liposolúvel e também fator essencial para reprodução normal em ratos. A purificação deste fator revelou que ele é composto da família dos tocoferóis. Quatro tocoferóis são conhecidos, porém o alfa-tocoferol é o mais importante biologicamente e os termos alfa-tocoferol e vitamina E são quase intercambiáveis na literatura (Halliwell e Gutteridge, 1989).
Primeiramente, o alfa-tocoferol inativo reage com o oxigênio singlet e poderia, portanto, proteger a membrana contra essa espécie (Halliwell e Gutteridge, 1989).
Durante a sua ação antioxidante como chain-breaking (destruindo a cadeia de lipoperoxidação) nas membranas, o alfa-tocoferol é consumido e convertido em forma de radical (Halliwell e Gutteridge, 1989).
A vitamina E pode também proteger contra a peroxidação modificando a estrutura da membrana (Halliwell e Gutteridge, 1989).
A vitamina E, localizada perto do citocromo P-450 no fosfolipídeo da membrana, varre os radicais livres formados no citocromo P-450. A seguir, a vitamina C reduz o radical tocoferil. Em recente estudo realizado na Tufts University, ficou comprovada a poderosa ação imunoestimulante da vitamina C (Halliwell e Gutteridge, 1989).
A vitamina A, chamada vitamina da vista, foi descoberta há aproximadamente 2 mil anos, quando os gregos verificaram que o fígado dos animais continham algo que curava certas afecções dos olhos, por isso o nome retinol, devido à sua importância na visão. Foi a primeira vitamina a ser catalogada, daí o nome A (Halliwell e Gutteridge, 1989).
O retinol é essencial na dieta humana, onde é usualmente conhecido como vitamina A, uma das vitaminas lipossolúveis (Halliwell e Gutteridge, 1989).
Os carotenóides, principalmente o beta-caroteno, podem funcionar como precursores da vitamina A. São absorvidos pelos intestinos humanos, e devem também atuar como antioxidantes. Têm, portanto, duplo papel, diminuem a formação do oxigênio singlet in vivo, e ajudam a remover aqueles já formados (Halliwell e Gutteridge, 1989).
A vitamina A tem pouca ação antioxidante e é incapaz de agir sobre o oxigênio singlet, mas seu precursor, o beta-caroteno, é o mais eficiente ligante desta forma reativa de oxigênio encontrada na natureza e pode agir como antioxidante. O beta-caroteno, um pigmento presente em todas as plantas, pode ser encontrado em membranas celulares, inclusive nos lipossomos (Machlin e Bendich, 1987).
O ácido ascórbico puro é sólido, branco, cristalino e muito solúvel em água. Plantas e animais podem sintetizá-lo, com exceção de humanos, primatas e cobaias, que não conseguem e necessitam obtê-lo na dieta (Halliwell e Gutteridge, 1989).
O ácido ascórbico é necessário in vivo como cofator de várias enzimas, sendo as mais conhecidas a prolina-hidroxilase e a lisina-hidroxilase, envolvidas na biossíntese do colágeno. A deficiência do ascorbato na dieta humana causa o escorbuto. A mais impressionante propriedade química do ascorbato é a sua habilidade para agir como agente redutor (doador de elétrons) (Halliwell e Gutteridge, 1989).
A vitamina C (ácido ascórbico), é hidrossolúvel e também age contra os radicais livres e o oxigênio singlet. O ácido ascórbico participa ainda da regeneração da forma reduzida e antioxidante da vitamina E (Halliwell e Gutteridge, 1985).
As vitaminas A, C e E podem ser encontradas também em altas concentrações no plasma, nas glândulas adrenais, no cérebro, no fígado e nas células sangüíneas, entre outras regiões (Porta, 1988).
Existe, ainda, uma série de outros antioxidantes não enzimáticos que participam da defesa contra as espécies reativas do oxigênio nos sistemas biológicos como, por exemplo, a ubiquinona, a ceruloplasmina, o ácido úrico, a taurina, os flavonóides e outros compostos fenólicos de origem vegetal (Halliwell, 1990; Cutler, 1991; Sies, 1991).
A ubiquinona é muito utilizada para melhorar a função cardíaca nos casos de insuficiência cardíaca congestiva, isquemia do miocárdio, angina pectoris e hipertensão arterial. Tem sido utilizada na esclerose múltipla e na doença de Alzheimer. Encontra também atuação no diabetes mellitus, nas doenças periodontais e distrofias musculares, bem como nas disfunções do sistema imunológico (Halliwell e Gutteridge, 1985).
A glutationa (GSH) é um marcador da saúde celular e sua queda é indicativa de lesão oxidante. Seu déficit acarreta diminuição da resistência às drogas e radiações, da capacidade de reversão de tumores e da síntese do ascorbato em animais (Halliwell e Gutteridge, 1985).
A glutationa é um tripeptídio composto de aminoácidos não essenciais, descrita como um importante agente antioxidante (Ames, 1983; Halliwell e Gutteridge, 1985).
Como seria de esperar da química do oxigênio, a reação univalente, gera O2∙ –. O principal sistema de escape é observado através do complexo NADH-Coenzima Q redutase e das formas reduzidas da coenzima Q10 (Halliwell e Gutteridge, 1989).
O neutrófilo humano e vários outros tecidos (tecido nervoso, por exemplo) são ricos em taurina. Há várias proposições de que a taurina possui papel biológico e atua como antioxidante (Halliwell e Gutteridge, 1989).
1.14.1 A Melatonina
A melatonina é um antioxidante conhecido, produzido pela glândula pineal e seu principal hormônio foi descoberto por Lerner em 1958. Também é produzido em outros tecidos, tais como retina e intestino grosso (Guyton, 1973).
A glândula pineal é a primeira glândula endócrina a ser formada na fase embrionária. Funciona como “relógio biológico”, quando secreta a melatonina à noite, conjuntamente à outros neuropeptídeos (Maffei, 1978).
A secreção da melatonina é dez vezes maior à noite que durante o dia. Essa concentração diminui com o passar do tempo, atingindo seu ápice na adolescência, sendo que nos idosos corresponde somente à metade da dos jovens (Smith e Tier, 1990).
Quimicamente, a melatonina é designada por 5-acetil-5-metoxiserotonina, sendo derivada do aminoácido essencial triptofano, encontrado em alimentos protéicos tais como grãos, sementes e leguminosas.
Recentemente, a melatonina foi descrita como participante da função imune dos organismos e como um potente antioxidante. Exercendo a função de antioxidante, a melatonina parece desencadear uma proteção substancial contra os radicais livres que são gerados em uma variedade de situações experimentais, incluindo a injúria por esquemia/reperfusão. Por essa razão, ela vem sendo utilizada terapeuticamente em cirurgias e transplantes (Reiter e Maaestroni, 1999).
1.14.2 Minerais
Além destes, há vários nutrientes essenciais de origem mineral, que participam do processo antioxidante em associação com enzimas. São eles, zinco, cobre, manganês, selênio e ferro (Halliwell e Gutteridge, 1985).
1.14.3 Antioxidantes enzimáticos
Antioxidantes são quaisquer substâncias que, quando presentes em pequenas concentrações, comparadas com aqueles substratos oxidáveis, significativamente retardam ou inibem a oxidação deste substrato e podem agir em diferentes níveis da seqüência oxidativa (Halliwell e Gutteridge, 1989).
Em 1954, Gershman e Gilbert propuseram que a maioria dos efeitos danosos causados pelas concentrações elevadas de oxigênio nos organismos vivos podia ser atribuída à formação de radicais livres. Entretanto, essa idéia não despertou interesse de muitos pesquisadores até a descoberta, em 1968, de uma enzima que é específica para a remoção catalítica de um radical de oxigênio (Mc Cord e Fridovich, 1969). Essa enzima denominada superóxido dismutase, juntamente com outras duas – catalase e glutationa peroxidase – são as principais defesas antioxidantes que atuam nos organismos superiores (Halliwell e Gutteridge, 1989).
1.14.4 Enzimas
As enzimas superóxido dismutase, catalase e glutationa peroxidase representam a principal defesa endógena do organismo.
1.14.4.1 Superóxido Dismutase
É possível que a superóxido dismutase (SOD) seja substância com efeitos anti-envelhecimento reais, podendo atuar positivamente sobre todos os processos degenerativos (Hendler, 1990).
A superóxido dismutase (SOD) tem papel fundamental na defesa do organismo contra as espécies reativas de oxigênio, pois atua na remoção do radical superóxido. Antes da sua descoberta, a SOD já havia sido descrita por alguns autores como uma proteína que contém cobre, mas nenhuma atividade catalítica lhe havia sido atribuída (Halliwell e Gutteridge, 1985).
Após o trabalho de Mc Cord (1969), entretanto, com a determinação de sua função na dismutação do radical superóxido (O2∙ –), seu papel foi estabelecido, e até hoje, apesar de inúmeras pesquisas realizadas com esta enzima, nenhum outro substrato foi descrito, mostrando a sua especificidade para o superóxido (Halliwell e Gutteridge, 1985).
Em 1938, T. Monn e D. Keilin, na Inglaterra, descreveram uma proteína azul-verde, isolada do sangue bovino, que também continha cobre e chamaram-na de hemocupreína. Em 1953, uma proteína similar foi isolada do fígado do cavalo e denominaram hepatocupreína. Outras proteínas deste tipo foram isoladas, como o cérebro-cupreína, do cérebro. Em 1970, foi descoberto que as proteínas do eritrócito contêm tanto zinco como cobre. Nenhuma função enzimática foi detectada em nenhuma destas proteínas, então foi sugerido que elas serviriam como depósitos de metais. Contudo, em 1969, o trabalho de J. M. Cord e J. Fridovich, nos EUA, mostrou que a proteína do eritrócito pode remover cataliticamente o radical superóxido e, assim, identificaram essa função como a enzima superóxido dismutase (Halliwell e Gutteridge, 1985).
Existem diferentes tipos de SOD, dependendo do metal que atua como cofator em seu sítio catalítico, mas todas elas agem basicamente de acordo com a mesma reação descrita por Mc Cord e Fridovich em 1969:
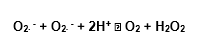
1.14.4.1.1 Superóxido dismutase dependente do cobre-zinco
A forma que contém cobre e zinco, denominada de superóxido dismutase cobre-zinco dependente (CuZnSOD), é muito estável e parece estar presente em praticamente todas as células eucarióticas (plantas ou animais) (Halliwell e Gutteridge, 1985).
Por outro lado, em células procarióticas como algas e bactérias, a atividade catalítica relacionada a CuZnSOD parece estar restrita a símbiose destes organismos com eucariotos onde a enzima está presente (Fridovich, 1978; Halliwell e Gutteridge, 1985).
A CuZnSOD eucariótica, também denominada SOD A, tem um peso molecular de 32000 e é constituída de duas subunidades protéicas idênticas, com um átomo de cobre e um de zinco em cada uma delas. É a forma citoplasmática da SOD, e suas propriedades têm sido marcadamente resistentes às modificações evolutivas, podendo-se distinguir a enzima obtida de fungos, plantas, aves e mamíferos com facilidade (Fridovich, 1977).
O cobre participa da reação de dismutação, passando alternadamente por oxidação e redução, conforme exemplo:
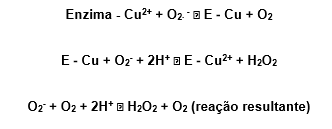
Por último, um outro mecanismo de ação também é possível, no qual o primeiro O2∙ – não reduz o íon cobre, mas forma um complexo com ele.
O Zn não funciona no sítio catalítico, mas aparece para estabilizar a enzima. Essa conclusão foi extraída de experiências nas quais os metais foram removidos dos sítios ativos e recolocados em outros, sozinhos ou em conjunto (Halliwell e Gutteridge, 1985).
1.14.4.1.2 Superóxido dismutase dependente do Manganês (MnSOD)
A superóxido dismutase dependente do manganês (MnSOD) é uma proteína de cor rosa, cujo peso molecular é de 40.000 e que contém manganês nos sítios ativos. A sua atividade diminui em pH alcalino. Não é inibida pelo cianeto, nem pelo di-etil-di-hidrocarbonato. É destruída pelo clorofórmio + etanol (não sobrevive ao métodos típicos da purificação para a CuZnSOD). A atividade da MnSOD em relação a CuZnSOD depende do tecido e das espécies onde atuam. A remoção do Mn dos sítios ativos causa perda da atividade catalítica, não podendo ser reposto por nenhum íon de transição, pois perde a sua atividade funcional. As seqüências de aminoácidos de todas as MnSOD, em todas as espécies, são parecidas e não estão relacionadas com a CuZnSOD (Halliwell e Gutteridge, 1989).
A superóxido dismutase dependente do manganês (MnSOD), encontrada em bactérias como E-coli e Streptococus mutans (Mc Cord et al., 1971; Fridovich, 1978), não aparenta ter nenhuma relação com a CuZnSOD contida no citoplasma de eucariotos, exceto por sua atividade catalítica.
Existe ainda a superóxido dismutase mitocondrial ou SOD B em tecidos humanos (Beckman et al., 1973), que é similar a MnSOD de procariotos, mas que possui quatro subunidades em vez de duas, e que tem peso molecular por volta de 80.000, possuindo também um átomo de manganês por subunidade. A forma mitocondrial da SOD é muito mais parecida com a MnSOD de procariotos, do que com a CuZnSOD (Fridovich, 1978).
1.14.4.1.3 Superoxido dismutase extracelular
Finalmente, há em tecidos humanos mais uma forma de SOD distinta das outras já descritas. Esta enzima possui peso molecular de 135.000 e é composta de quatro subunidades iguais ligadas mais covalentemente. Cada molécula parece conter quatro átomos de cobre, não sendo encontrados ferro ou manganês na enzima. Por estar presente principalmente em fluidos extracelulares como o plasma, foi denominada SOD extracelular (EcSOD). Sua atividade é pouco expressiva em comparação com as outras formas de superóxido dismutase (Marklund, 1982).
1.14.4.1.4 Particularidades
Com relação à atividade catalítica das diferentes formas de SOD, pode-se afirmar a CuZnSOD é inibida reversivelmente pelo cianeto e por H2O2 em concentrações acima de 10 uM (Fridovich, 1978), além de poder sofrer inativação pela exposição ao radical superóxido, enquanto a MnSOD não é inativada nas mesma condições (Sinet et al., 1981).
A forma CuZnSOD apresenta-se mais resistente à variações de temperatura e à desnaturação por substâncias como cloreto de guanidina, duodecil sulfato de sódio, ou uréia (Halliwell e Gutteridge, 1985). É também a mais resistente às variações de pH (Fridovich, 1978).
Os testes imunológicos têm sido mais utilizados para a quantificação de proteínas de CuZnSOD e MnSOD. Como estas proteínas são muito diferentes, os anticorpos não fazem reações cruzadas. Os testes são limitados em tecidos humanos, então servem como linhas mestras. São melhor avaliados no fígado, pois há maior concentração de SOD (Halliwell e Gutteridge, 1989).
1.14.4.2 Glutationa peroxidase
A enzima glutationa peroxidase (GPx) foi descoberta por Mills em 1959, em tecidos de mamíferos. Não se observa sua presença em plantas ou bactérias, embora possa ser encontrada em algumas algas e fungos (Halliwell e Gutteridge, 1985).
O substrato para o GPx é o tripeptídeo glutationa, encontrado na maioria dos animais, plantas, e até em algumas bactérias. A enzima catalisa a oxidação de glutationa reduzida (GSH) a glutationa oxidada (GSSG), usando o peróxido de hidrogênio:

A manutenção de níveis de GSH ocorre pela ação da enzima glutationa redutase (GSSG), novamente em sua forma reduzida (Cohen e Hochstein, 1963, Paglia e Valentine, 1967):
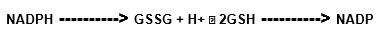
Apesar da GPx ser especifica para glutationa como doador de hidrogênio, ela pode aceitar outros peróxidos além do H2O2 (Beutler et al., 1974; Halliwell e Gutteridge, 1985), em reação que pode ser esquematizada como:
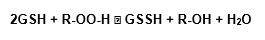
As células animais contêm dois tipos de glutationa peroxidase, sendo que um deles é selênio dependente, enquanto o outro não.
O primeiro tipo é capaz de reduzir qualquer hidroperóxido orgânico, além do H2O2. Essa forma possui peso molecular de 81.000, é uma proteína tetramérica e possui um átomo de selênio em cada subunidade (Forstron et al., 1978; Meera Khan et al., 1984; Mc Bridge et al., 1988).
A relação entre a atividade da GPx e o suprimento de selênio in vivo tem sido objeto de muita investigação experimental e clínica. Em humanos, a regulação gênica da enzima em linhagens de células mielóides (HL-60), mostrou ocorrer pós-transcricionalmente, sendo controlada pela disponibilidade de selênio (Chada et al., 1989).
O segundo tipo, que não depende do selênio, tem peso molecular de 35.000, é dimérico e está apto a reduzir qualquer hidroperóxido orgânico, menos o H2O2 (Meera Khan et al., 1984; Ciriolo et al., 1991).
A GPx tem alta atividade no fígado e eritrócitos, enquanto no cérebro, coração e pulmões sua atividade é moderada e no músculo é bastante reduzida (Cohen e Hochstein, 1963).
A GPx encontra alta atividade no fígado, moderada atividade no coração, pulmão e cérebro, e baixa atividade nos músculos (Halliwell e Gutteridge, 1989).
Na maioria dos animais, a enzima dependente de selênio é responsável pela maior parte da atividade da GPx, mas a proporção entre as duas formas varia muito entre as diferentes espécies, bem como de tecido para tecido em uma mesma espécie (Mannervik, 1985).
Em ratos, a distribuição da GPx tem sido extensamente estudada e, em hepatócitos a GPx selênio dependente está localizada principalmente no citosol e na matriz mitocondrial (Mannervik, 1985).
O pH ótimo para a GPx é próximo de 8,0, mas a enzima continua ativa com valores elevados. Sua atividade é mínima em pH abaixo de 6,0 (Mills, 1959; Paglia e Valentine, 1967).
1.14.4.3 Catalase
Enzima presente na maioria das células aeróbicas, sendo que em animais se encontra principalmente no fígado, rins e eritrócitos. Órgãos como cérebro, coração e músculo esquelético contém, no entanto, pequenas quantidades da enzima (Halliwell e Gutteridge, 1985; Masters e Crane, 1990).
Em mamíferos, como ratos e camundongos, a maior parte da atividade catalítica da enzima ocorre nos peroxisomos, sendo apenas uma pequena taxa de origem citopasmática ou reticular (Masters e Crane, 1990; Percy, 1984).
Em 1818, Thénard já havia observado que o peróxido de hidrogênio era decomposto por tecidos animais, com liberação de oxigênio. Após 83 anos, Loew estabeleceu que este efeito era devido a uma enzima específica que foi denominada catalase. Warbing, em 1923, sugeriu que a catalase contenha átomos de ferro. Em 1990, Geili e Helestrom encontraram evidência de que seu grupo prostético era a hematina (Percy, 1984).
O mecanismo de ação da catalase pode ser sumarizado da seguinte forma, segundo Chance (1952 a e b):

Se não neutralizado, o H2O2 interage com cátions de ferro (ou cobre), originando o íon hidroxila (inerte) e o radical livre hidroxila (ativo).
Embora o conhecimento sobre o mecanismo de ação da catalase in vitro seja antigo, até 1971 as informações sobre seu papel biológico in vivo eram ainda consideradas rudimentares (Chance e Oshino, 1971).
Os nutrientes mais importantes coadjuvantes da catalase são o ferro e os tocoferóis (vitamina E), que se acham distribuidos na membrana celular, na fase hidrofóbica (Halliwell e Gutteridge, 1985).
Após a identificação do intermediário primário de enzimas associadas com o peróxido de hidrogênio nos peroxissomos de frações de fígado de ratos, ricas em mitocôndrias, foi possível o estabelecimento da função deste complexo enzima-substrato também nos sistemas biológicos, sendo essa função significativamente peroxidativa (Chance e Oshino, 1971).
A catalase evita o acúmulo de metahemoglobina e decompõe e peróxido de hidrogênio, um produto tóxico do metabolismo, em água e oxigênio molecular (Chance e Oshino, 1971; Wieacker et al., 1980; Gaetani et al., 1989).
Além de seu papel como espécie reativa de oxigênio, e, portanto, causador de estresse oxidativo, o H2O2 em excesso causa oxidação da hemoglobina e, conseqüentemente, diminuição das concentrações de oxigênio, o que pode acarretar infecções, formação de úlceras e até necrose (Wieacker et al., 1980).
Apesar das reações envolvendo a catalase serem intensivamente estudadas desde o século passado, o mecanismo de ação exato da enzima ainda gera discussões e seu papel biológico continua sendo pesquisado. Sabe-se que além da ação na eliminação do peróxido de hidrogênio, a catalase atua também na oxidação de doadores de elétrons, como etanol, metanol, fenois, DOPA, epinefrina, quando o H2O2 se apresenta em baixas concentrações (Percy, 1984).
A enzima catalase tem peso molecular de 240.000 e, quando purificada, apresenta quatro subunidades, cada uma contendo um grupamento (Fe III – protoporfirina), ligado ao seu sítio ativo (Keilen e Hartree, 1945; Wieacker et al., 1980). A dissociação da molécula em suas subunidades, que ocorre facilmente quando se estoca a enzima, com congelamento e descongelamento, ou por exposição a ácidos ou bases, causa perda da sua atividade catalítica (Keilen e Hartree, 1945; Chance, 1952 a; Chance, 1952 b; Percy, 1984).
A atividade catalítica desta enzima pode ser inibida por superóxido, azida, cianeto de hidrogênio (HCN), não sendo entretanto, inibida por outros íons cianetos (CN–) (Chance, 1952 b). O inibidor mais usado, no entanto, é o aminotriazol, que tem sua ação sobre o composto I, sendo necessária a presença do peróxido de hidrogênio para que a inibição ocorra (Halliwell e Gutteridge, 1985).
1.14.4.3.1 Interação
Recentemente, foi descrita a inibição da catalase pela glutationa e por outros compostos com grupamento tiol, como o ditiotreitol (DTT), sendo que as formas reduzidas destes compostos possuem maior ação inibitórias que as oxidadas (Sun e Oberley, 1989).
Com relação ao pH, pode-se observar uma diminuição da atividade da enzima abaixo de pH 4,0. Na faixa de 4,0 a 8,5, a atividade da catalase permanece constante, sendo que acima desse valor volta a decair (Chance, 1952).
Experimentos têm sido realizados para avaliar a competição entre as enzimas catalase e glutationa peroxidase em eritrócitos.
Segundo alguns autores, a catalase é a enzima que se encarrega de fazer a conversão de altas concentrações de H2O2 em água e oxigênio. Quando o peróxido de hidrogênio está presente em baixas concentrações (condições fisiológicas normais), entretanto, a glutationa peroxidase é que se encarrega de transformá-la em água (Cohen e Hockstein, 1963; Sinet et al., 1975; Halliwell e Gutteridge, 1985).
Gaetani et al. (1989), por sua vez, afirmaram que a catalase e a GPx exercem a mesma atividade em eritrócitos humanos, e que a diminuição de uma das duas não acarretaria efeitos deletérios.
Tentando estabelecer a importância da catalase eritrocitária, Scott et al., (1991) usaram células humanas normais e acatalassêmicas para verificar se realmente a enzima tem um papel secundário no metabolismo do peróxido de hidrogênio, como afirmaram diversos autores (Cohen e Hochstein, 1963; Sinet et al., 1975; Halliwell e Gutteridge, 1985). Segundo eles, o uso de células acatalassêmicas provou a grande importância da catalase que pode ser a primeira na defesa contra o H2O2, já que o aumento ou diminuição de GSH (o que permitiria elevação da atividade de GPx), não alterou a atividade antioxidante geral nas células acatalassêmicas ou normais.
Ambos os sistemas parecem ter vantagens e desvantagens para o organismo. Enquanto a GPx é mais eficiente (tem maior afinidade pelo substrato), é multi funcional (reduz H2O2 livre e também outros peróxidos), lenta (limitada pela reciclagem do GSH), e metabolicamente dispendiosa, o CAT possui baixa afinidade pelo substrato, mas é extremamente rápida (Eaton, 1991). Assim, a CAT deve proteger as células de grandes quantidades de H2O2, e os baixos níveis endógenos devem ficar por conta da GPx, juntamente com o sistema enzimático dependente de GSH (Eaton, 1991).
1.15 Oligoelementos
Forsen, em 1897, elaborou a primeira definição científica de oligoelementos: “oligoelementos são elementos químicos que estão presentes na matéria vivente em concentrações iguais ou inferiores à 0,01% do peso corporal seco do organismo humano” (Torti, 1988).
A definição de Forsen é, sem dúvida alguma, importantíssima, porém só do ponto de vista quantitativo, uma vez não se referir aos processos metabólicos e bioquímicos dos oligoelementos (Torti, 1988).
1.15.1 Diferença Quantitativa
Um passo adiante à definição de Forsen foi a constatação da existência dos chamados oligoelementos essenciais, ou seja, indispensáveis à vida.
Para ser considerado essencial, um oligoelemento deve possuir as seguintes características:
1) deve estar presente em todo tecido sadio de todo organismo vivente;
2) sua concentração tecidual deve ser relativamente constante;
3) sua carência induz a alterações estruturais e fisiológicas de vários tipos;
4) previne ou corrige, através do seu aporte, as afecções mórbidas causadas pela sua carência (Torti, 1988).
É interessante ressaltar a semelhança ou analogia existente entre o oligoelemento e as vitaminas, principalmente no que se refere aos itens 1 e 2, visto que as vitaminas também induzem, quando da sua carência a alterações funcionais e estruturais, que podem ser prevenidas ou corrigidas com a sua administração.
Em função dessa semelhança, os oligoelementos recebem às vezes a denominação de “vitaminas inorgânicas” (Torti, 1988).
1.15.2 Cofatores
Uma grande parte de enzimas depende e requer um componente a mais para que suas proteínas enzimáticas possam exercer suas funções catalíticas. Esse componente adicional recebe a denominação genérica de cofator (Torti, 1988).
Os cofatores obedecem a uma divisão didática em grupos prostéticos, coenzimas, e atividades metálicas (Torti, 1988).
Um grupo prostético habitualmente pode ser considerado um cofator firmemente ligado à proteína enzimática, como pode ser observado com o núcleo porfirinico de hemoproteína peroxidase ou a flavina adenina dinucleotideo que é fortemente ligada à succinico desidrogenase (Mitropoulos, 1995).
O grupo de ativadores metálicos acha-se representado por cátions metálicos mono ou bivalentes como K+, Mn++, Mg2+, Ca2+ ou Zn2+, que são indispensáveis para as atividades de um grande número de enzimas. As suas ligações podem estar frouxas ou firmemente ligadas a uma proteína enzimática, provavelmente por quelação com grupos fenólicos aminados ou carboxilados. Entretanto, o Fe2+ ligado a um grupo de porfirina e o CO2, ligado ao complexo vitamínico B12, são classificados no grupo a que pertencem a porfirina e a vitamina B12 (Torti, 1988).
1.15.3 Processo Enzimático
Os oligoelementos são íons inorgânicos e sabe-se que uma grande parte das enzimas os contém na sua estrutura ou, no mínimo, precisam deles para atuar como tal (Torti, 1988).
Quando uma enzima contém na sua molécula um oligoelemento, diz-se que se trata de uma metaloenzima (Torti, 1988).
No que se refere ao mecanismo dos oligoelementos no contexto enzimático, acredita-se:
1) alguns oligoelementos tais como o cobre e o ferro desempenham uma função catalítica. Sua presença ne parte protéica da enzima estimula seu funcionamento.
2) alguns oligoelementos agem, enquanto íons metálicos, como fator de união entre o princípio ativo da enzima com o substrato que a torna-se ativada;
3) alguns oligoelementos agem como um poderoso centro de atração eletrônica, catalisando importantes reações de oxiredução (Maffei, 1978).
Levando-se em conta as considerações feitas, o presente trabalho pretende demonstrar experimentalmente a ação do medicamento homeopático, partindo da assertiva de que a Homeopatia pode se valer dos recursos e utilizar os mesmos procedimentos convencionalmente adotados pela ciência.
Um aspecto que se reveste de considerável relevância é a possibilidade de demonstrar a ação de um mecanismo (antioxidante) de modo diferente do usual emprego das doses ponderais, efeito possível pela diluição característica do medicamento homeopático, que muitas vezes está inclusive acima do número de Avogadro.
Outro ponto a ressaltar, consiste no fato de o trabalho abrir a perspectiva de novos estudos e pesquisas científicas, particularmente sobre as diversas etapas da cadeia oxidativa, dada a escassez de estudos sobre o tema. Ademais, a ampliação do conhecimento sobre o funcionamento da cadeia oxidativa certamente traria maior domínio sobre a utilização do medicamento homeopático na sua totalidade, podendo-se estender sua eficácia terapêutica também para outras áreas da medicina.
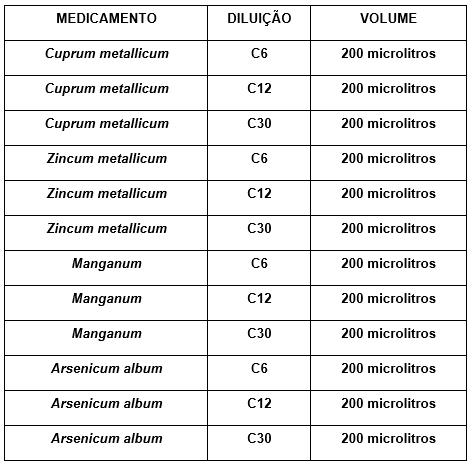
A escolha dos medicamentos homeopáticos Cuprum metallicum, Zincum metallicum e Manganum ocorreu por saber-se que esses elementos fazem parte da superóxido dismutase. A Zn-Cu superóxido dismutase atua no citosol, enquanto a Mn superóxido dismutase atua na mitocôndria. O medicamento homeopático Arsenicum album foi escolhido devido a sua patogenesia preencher as características de indivíduo estressado, fato que poderia resultar também em estresse oxidativo celular. Nesse sentido, pretendeu-se estabelecer relação de tais medicamentos entre si e com a melatonina, com as diluições 6 CH, 12 CH e 30 CH.
Pelo número de Avogrado, a partir da 12ª centesimal não mais existe matéria. As 6ª e 12ª centesimais contém somente traços do medicamento, o que evidencia a existência de outros mecanismos antioxidantes, além dos conhecidos decorrentes da ação de doses mínimas, altamente diluídas.
Ora, se o medicamento homeopático age in vitro, não obedecendo a Lei das Semelhanças, é muito provável que, submetido à tal lei, sua ação seja muito maior, uma vez que ele supostamente interfere na homeostase.
Por fim, o trabalho aponta para a viabilidade do intercâmbio entre as diferentes áreas da comunidade médico-científica, numa abordagem que se propõe a resgatar a unicidade da medicina e contemplar globalmente a saúde humana.
2 OBJETIVOS
O presente trabalho tem por objetivo investigar a atividade antioxidante dos medicamentos homeopáticos Arsenicum album, Cuprum metallicum, Zincum metallicum e Manganês, comparativamente à melatonina.
Para tanto, procedeu-se a:
1) Determinação da atividade inibitória de peroxidação lipídica em homogenato de cérebro de ratos utilizando-se a melatonina como padrão positivo.
2) Determinação da atividade inibitória de peroxidação lipídica em homogenato de cérebro de ratos utilizando-se os medicamentos homeopáticos Arsenicum album, Cuprum metallicum, Zincum metallicum e Manganum nas 6ª, 12ª e 30ª centesimais.
3) Comparação da ação antioxidante das diferentes concentrações da melatonina e dos medicamentos homeopáticos Cuprum metallicum, Zincum metallicum, Manganum e Arsenicum album.
4) Avaliação dos resultados para melhor compreensão do mecanismo de ação do medicamento homeopático.
3 MATERIAIS E MÉTODOS
3.1 Materiais
3.1.1 Animais
Foram utilizados ratos albinos da raça Wistar, provenientes do biotério do Departamento de Psicobiologia da Universidade Federal de São Paulo, onde eram mantidos à temperatura ambiente de 23 ± 2ºC, com ciclo claro-escuro de 12 horas e com livre acesso à água e comida (Pellets LABINA® ).
Os animais permaneceram alojados em gaiolas de plástico, sendo que cada gaiola continha seis animais, e foram divididos em grupos de 3 ratos machos jovens, sacrificados por decapitação. Os cérebros de todos os animais foram coletados para dosagens de malondialdeído para medida de lipoperoxidação.
3.1.2 Reagentes e equipamentos
Os seguintes reagentes utilizados nesse trabalho são de procedência de SIGMA Chemical Company (Saint Louis, Mo, USA): ácido tiobarbitúrico (TBA), ácido tricloroacético (TCA).
Os demais reagentes, fosfato de sódio (Na3PO4) e cloreto de sódio (NaCl), são de procedência de MERCK (Rio de Janeiro, Brasil).
Os experimentos foram realizados utilizando-se os seguintes aparelhos:
a) Espectrofotômetro Hitashi;
b) Centrífuga Sorvall RC-5B (Refrigerated Superspeed), da Du Pont Instruments;
c) Homogenizador de tecidos Potter nº B25357 em teflon, da Thomas, Philadelphia, USA.;
d) Balança Micronal, modelo B1600;
e) Balança Mettler, modelo AJ100;
f) Medidor de pH Metrohm Herisau, modelo E520;
g) Banho-maria Evlab, modelo EV015;
h) Agitador de tubos Phoenix, modelo AT56;
i) Agitador aquecedor magnético Fanen, modelo 258;
j) Pipetas automáticas Gilson-pipetman (P-20, P-200 e P-1000);
k) Banho-maria com agitação Dubnoff FANEN, modelo 145.
3.2 Métodos
3.2.1 Metodologia de pesquisa
A pesquisa valeu-se da experimentação dos medicamentos homeopáticos Arsenicum album, Cuprum metallicum, Zincum metallicum e Manganum, afim de se verificar sua ação antioxidante em homogenato de cérebro de ratos, comparativamente à melatonina, adotada como padrão positivo por tratar-se de potente antioxidante in vitro.
A experimentação serviu-se de medicamentos homeopáticos regulamentados no país, de acordo com o decreto n.º 57477-66, que dispõe sobre a manipulação, receituário, industrialização e venda de produtos utilizados em Homeopatia, portaria n.º 1180 de agosto de 1997, sob regulamentação da, conforme resolução n.º 23 de 06/12/1999 da Agência de Vigilância Sanitária Nacional. (Farmacopéia Homeopática Brasileira).
Os medicamentos foram fornecidos pela farmácia Argentum, por meio do farmacêutico Edson Godoy.
A amostragem constituiu-se de cérebros provenientes de grupos de 3 ratos jovens para cada experimento.
Procedeu-se a perfusão do cérebro com tampão Fosfato de Sódio 40mM, NaCl 140 mM e pH 7,4, tendo sido homogenizado com três volumes do mesmo tampão (w:v). O próximo passo foi centrifugar a 3000 rpm por 10 minutos.
O sobrenadante foi diluído na proporção de 1 para 4 volumes de tampão e incubado a 37ºC, por um período de 1 hora, com agitação com diferentes concentrações de melatonina ou medicamentos homeopáticos conforme as seguintes tabelas:
Tabela 3: Concentrações de melatonina utilizadas no ensaio
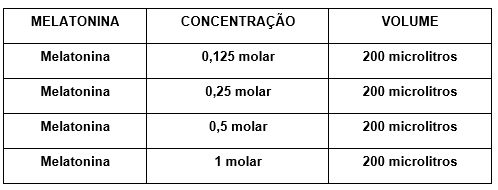
Tabela 4: Medicamentos utilizados e suas respectivas potências
Em seguida, 1ml da mistura foi retirado de todos os frascos em incubação e acrescido de 1ml de TCA 5%, que é igual ao MDA BASAL (tempo 0 da reação). Ao final da incubação juntou-se 1ml de sobrenadante com 1ml de TCA 5%. Todos os tubos foram centrifugados por 15 minutos a 10000 rpm. Finalmente, a 1 ml de sobrenadante foi acrescentado 1 ml de TBA a 0,67%. Os tubos foram fechados e em seguida colocados em banho-maria a 100 ºC por 20 minutos, sendo, posteriormente, colocados no gelo por 20 minutos.
A leitura foi feita em espectrofotômetro em 535nm, usando-se água destilada como branco.
Todas as dosagens foram realizadas em duplicata.
O cálculo dos níveis de malondialdeído (MDA) produzidos foi realizado considerando-se o coeficiente da extinção do molar (ε = 4,747), utilizando-se a seguinte equação:
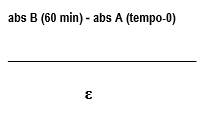
Onde:
A = tempo 0 (sem incubação)
abs = absorbância
B = média dos valores obtidos para as duplicatas da reação
(incubação por 60 minutos)
3.2.2 Método estatístico
Para análise dos resultados obtidos, foram utilizados testes não paramétricos, levando-se em consideração a natureza de distribuição dos valores das variáveis estudadas, ou a variabilidade das medidas estudadas. Foram aplicados os testes de Kruskal-Wallis (ANOVA) e de múltiplas comparações de Dunn. Estabeleceu-se em p ≤ 0,05 o nível de exigência para a hipótese de nulidade.
4 RESULTADOS
Com os valores obtidos experimentalmente, foi realizada a análise de variância para dados não paramétricos proposta por Kruskal-Wallis, cujo resultado mostrou haver diferenças significantes entre os vários grupos experimentais, P < 0,0001 (KW = 93,90).
Tabela 5: Valores obtidos na Análise de Múltiplas Comparações de Dunn

Uma posterior análise de múltiplas comparações de Dunn mostrou haver diferenças significativas entre os grupos experimentados, apresentando os seguintes resultados:
Tabela 6: nível de significância dos diferentes grupos de experimentações obtidos pela análise de múltiplas comparações de Dunn

A melatonina utilizada na concentração 0,125M não produziu inibição da peroxidação, sendo adotada, portanto, como parâmetro para as demais experimentações, seja da própria melatonina, em diferentes concentrações, seja dos medicamentos homeopáticos nas diversas diluições.
Pôde-se verificar que o maior efeito inibidor da peroxidação lipídica ocorreu com a melatonina 1 molar (30%), vindo a seguir a melatonina 0,5 molar (16,7%), o Cuprum metallicum C12 (13,4%), Cuprum metallicum C30 (11,7%) Arsenicum album C30 e melatonina 0,25 molar (8%) e Manganum C30 (7,5%).
Os demais grupos analisados não apresentaram diferenças significantes.
Observou-se que, dentre os medicamentos homeopáticos experimentados, o Cuprum metallicum C12 foi o que apresentou maior grau de inibição da peroxidação lipídica (13,4%).
Notou-se um significativo grau de inibição da peroxidação lipídica com o uso de medicamentos homeopáticos acima do número de Avogadro, tais como o Cuprum metallicum C30 e o Arsenicum album C30.
Na tabela 7 são apresentadas as médias das porcentagens de peroxidação lipídica obtidas para cada ensaio e no gráfico 1 são apresentados os níveis de inibição deste processo, obtidos para a melatonina e os medicamentos homeopáticos e que apresentam diferenças significantes.
Tabela 7: % de peroxidação lipídica em homogenato de cérebro de ratos experimentando os medicamentos homeopáticos Cuprum metallicum, Zincum metallicum, Manganum e Arsenicum album, comparativamente a Melatonina M 0,125 molar
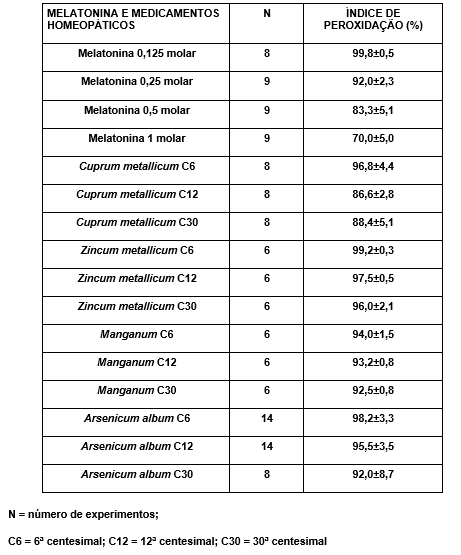
Gráfico 1:
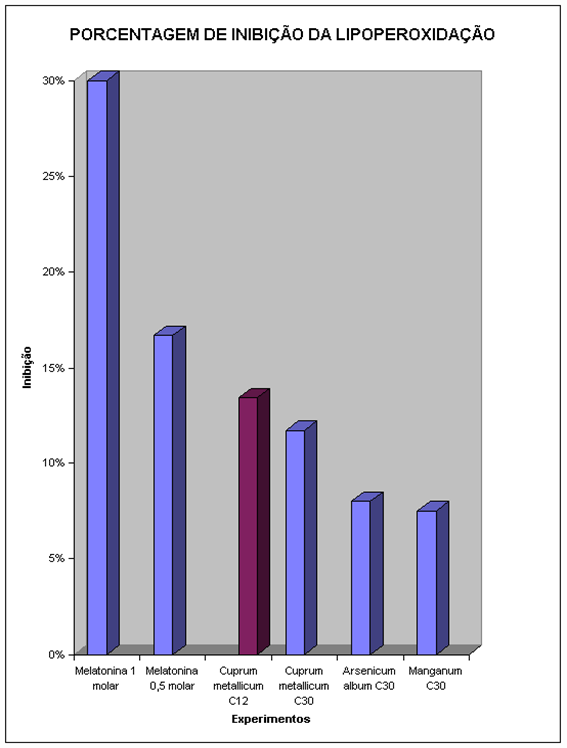
5 DISCUSSÃO
A pesquisa enfocou a utilização do medicamento homeopático com a finalidade de mensurar o provável efeito antioxidante desse mesmo medicamento em homogenato de cérebro de ratos na peroxidação lipídica comparativamente à melatonina, uma vez que a melatonina possui ação antioxidante comprovada in vitro.
Hahnemann, no capítulo IV, que fala sobre o poder farmacodinâmico das substâncias cita:
“Não somos capazes de descobrir esta força imaterial que se encontra latente na essência íntima dos medicamentos apenas com os esforços da razão. Só pela experiência (experimentação), que podemos observar claramente os fenômenos que ela provoca quando age no organismo sadio”. (Pustiglione, 2001)
Como a experimentação do medicamento homeopático ocorre sempre in vivo, seguindo a mesma linha de raciocínio, procurou-se fazer a experimentação in vitro.
O medicamento homeopático é utilizado em larga escala em todo o planeta, a despeito de se desconhecer o seu real mecanismo de ação, uma vez tais mecanismos não estarem ainda, perfeitamente elucidados.
A experimentação in vitro pode complementar o conhecimento da própria patogenesia do medicamento homeopático, bem como da sua ação nas diversas alterações orgânicas.
A reprodução desse efeito abre perspectivas para outros trabalhos que permitam uma melhor compreensão da ação do medicamento homeopático in vivo.
Neste trabalho verificou-se a ação antioxidante dos medicamentos homeopáticos Cuprum metallicum, Arsenicum album, Zincum metallicum e Manganum, comparativamente a melatonina, inibindo a lipoperoxidação sobre o homogenato de cérebro de ratos machos jovens.
A melatonina apresentou ação significante na inibição de peroxidação lipídica, por isso mesmo serviu como padrão comparativo de referência na utilização dos medicamentos homeopáticos em questão.
A escolha destes medicamentos homeopáticos decorreu do fato de serem constituintes da superóxido dismutase citoplasmática e mitocondrial, respectivamente. O Arsenicum album, por sua vez, foi escolhido por tratar-se de importante policresto, cuja patogenesia atende o perfil do indivíduo estressado psiquicamente, que eventualmente pode ocasionar estresse oxidativo celular. Estes elementos passaram por processo de trituração antes de serem diluídos, fato este que equivale dizer sofreram processo de succussão.
O trabalho demonstrou haver significância dos medicamentos homeopáticos Cuprum metallicum, Manganum e Arsenicum album como inibidor in vitro da peroxidação lipídica em homogenato de cérebro de ratos, comparativamente à melatonina em dose substancial, através da dosagem do malondialdeído.
Através de análise dos experimentos, observou-se, tomando como referência a melatonina 0,125 M, menor inibição da peroxidação lipídica. Ocorreu maior inibição da lipoperoxidação com o uso dos medicamentos homeopáticos Cuprum metallicum, Manganum e do Arsenicum album nas 6ª, 12ª e 30ª centesimais, não se observando, entretanto, o mesmo efeito para o Zincum metallicum.
A significância obtida através de experimentação do Cuprum metallicum e do Manganum pode ser explicada por agirem efetivamente em dose substancial nas superóxido dismutase citoplasmática e mitocondrial, respectivamente, talvez por ação de elemento traço.
Todavia, resta a indagação, que raciocínio lógico ou que modelo teórico deve ser elaborado para explicar a inibição da peroxidação lipídica na 30ª centesimal, que suplanta o número de Avogadro?
Observe-se ainda que, como a referida inibição ocorreu também com medicamentos cuja diluição suplanta o número de Avogadro, pode-se inferir a existência de mecanismos antioxidantes ainda desconhecidos, que devem ser desvendados.
Uma vez constatada a inibição da peroxidação lipídica em homogenato de cérebro de ratos in vitro, obtida com o uso de medicamentos homeopáticos, é de se supor um efeito antioxidante ainda maior quando utilizado in vivo, levando-se em consideração a totalidade sintomática do indivíduo.
Este trabalho levou em consideração somente a peroxidação lipídica, contudo, fica em aberto a possibilidade de se estudar a ação antioxidante dos medicamentos homeopáticos nas outras etapas de cascata das ERO.
De forma geral, o LPx é o resultado de desequilíbrio entre pró e antioxidante em favor dos primeiros (Harata et al., 1983; Kawase et al., 1989).
Os oxidantes são altamente importantes no mecanismo de ação de várias toxinas. O envolvimento dos oxidantes em várias doenças está bem estabelecido porém também não existe unanimidade à respeito (Halliwell e Gutteridge, 1989).
Filo e ontogeneticamente o organismo desenvolveu mecanismos de defesa antioxidante, possibilitando a adaptação de organismos superiores ao meio aeróbico, onde as 3 enzimas, superóxido dismutase, catalase e glutationa Peroxidase, são fundamentais para o equilíbrio pró e antioxidante. O uso de substâncias exógenas afim de manter o referido equilíbrio pode contribuir sobremaneira para a saúde humana.
A melatonina em dose substancial mostrou-se potente antioxidante inibindo satisfatoriamente a peroxidação lipídica. A idéia da utilização de melatonina em diferentes concentrações foi para dar suporte comparativo aos medicamentos homeopáticos, posto que a melatonina possui eficaz efeito antioxidante. (Halliwell e Gutteridge, 1989).
A confrontação dos medicamentos homeopáticos altamente diluídos com doses substanciais de melatonina, bem como com a descrição das suas respectivas patogenesias serve de subsídio, não só para melhor entendimento de seus efeitos antioxidantes, como também para se tentar melhor compreender as próprias patogenesias destes metais, podendo-se estender esta compreensão para as patogenesias dos medicamentos homeopáticos em geral.
Com relação à inibição da peroxidação lipídica obtida através de experimentação de medicamentos homeopáticos pode-se supor que tal fato se deva a ação de oligoelemento de tais medicamentos, ou mesmo através da própria ação homeopática descrita nas referidas patogenesias.
As espécies reativas do oxigênio estão envolvidas com uma gama imensa de reações fisiológicas, como também em processos de doenças hoje muito bem conhecidos.
Diante de tais processos, o organismo procura adaptar-se às condições do meio em que vive através da homeostasia, denominação introduzida na Biologia pelo fisiologista norte americano Walter Bradfort Cannon em 1916. A homeostasia é a propriedade hereditária do ser vivo de perdurar no tempo, mantendo o equilíbrio morfológico e funcional das suas células e tecidos. A homeostasia, por sua vez, é mantida por outra propriedade hereditária, a auto-regulação (Maffei, 1978).
A homeostasia e auto-regulação do genótipo constituem os mecanismos de adaptação e compensação do organismo aos agentes externos, influindo assim não só na época da manifestação de uma moléstia, como também no modo de evolução e ação terapêutica (Maffei, 1978).
Esta adaptação ocorre principalmente no que tange ao paradoxo do oxigênio. Os seres vivos evoluíram no sentido de passarem da condição de anaeróbios para a de aeróbios, que se deu às custas do desenvolvimento do eficaz sistema antioxidante, onde as enzimas superóxido dismutase, glutationa peroxidase e catalase desempenham papel fundamental para a preservação e perpetuação das espécies cujo metabolismo é aeróbico (Halliwell e Gutteridge, 1985).
Como o medicamento homeopático provavelmente atua restabelecendo a homeostasia, é possível que isso ocorra devido a ação antioxidante deste medicamento no homogenato de cérebro de ratos.
Admitindo-se que a Homeopatia baseia-se na experimentação in vivo, assumiu-se a possibilidade de demonstrar experimentalmente in vitro o efeito antioxidante do medicamento homeopático.
Cabe lembrar que, muito antes de Claude Bernard, Hanneman utilizou a experimentação in vivo, estabelecendo a partir daí a patogenesia (Tetau, 1980). Nessa perspectiva, pode-se afirmar, por analogia, a funcionalidade da experimentação in vitro.
Partiu-se da premissa de que a medicina é uma só, sendo variáveis, tão somente, as técnicas e os métodos terapêuticos utilizados por escolas distintas.
Disse Einsten:
“Todas as religiões, todas as artes, todas as ciências são ramos de uma mesma árvore, onde estas aspirações visam ao enobrecimento da vida humana, elevando-a acima das esferas da existência puramente material e conduzindo o indivíduo para a liberdade.” (Monteiro, 1982)
Desenvolveu-se um estudo controlado de cunho demonstrativo, que visou demonstrar a funcionalidade do método experimental in vitro.
Partiu-se do pressuposto de que, se o fenômeno da antioxidação acontece isolado, in vitro, nas condições verificadas, analogamente, existe uma considerável probabilidade de ser reproduzido no indivíduo como um todo, uma vez conhecido e avaliado o mecanismo pelo qual se dá sua ação.
A fim de delimitar adequadamente o estudo no universo em questão, procedeu-se a definição conceitual e operacional dos termos empregados e explicitou-se o enfoque sob o qual se assentaria a análise (Andrade, 1995).
Nesse sentido, o estudo concentrou-se na peroxidação lipídica, sugerindo, contudo, a necessidade de uma melhor compreensão das demais etapas da cadeia oxidativa, o que possibilitaria uma maior propriedade na aplicação do medicamento homeopático nas diversas doenças e alterações orgânicas.
O estudo objetivou ainda o dimensionamento da ação do medicamento homeopático no âmbito imediato da pesquisa experimental, para um melhor entendimento do seu uso na saúde humana.
Este trabalho abre perspectivas para uma melhor compreensão da ação do medicamento homeopático como antioxidante, bem como sobre a sua ação geral no organismo.
Convém ressaltar que, pelas características do experimento, torna-se impossível eleger-se o medicamento similimum que, supõe-se, tenha ação antioxidante mais efetiva quando administrado ao ser vivo, de forma a preencher a totalidade sintomática do indivíduo.
6 CONCLUSÕES
A melatonina mostrou maior eficácia na inibição da peroxidação lipídica em homogenato de cérebro de ratos na concentração 1 molar, vindo a seguir a melatonina 0,5 molar e a melatonina 0,25 molar.
A inibição da lipoperoxidação com o uso dos medicamentos homeopáticos ocorreu em escala decrescente, da seguinte maneira: Cuprum metallicum C12, Cuprum metallicum C30, Arsenicum album C30, Manganum C30 e Arsenicum album C12.
Os demais grupos analisados não apresentaram diferenças significantes.
Observou-se inibição significativa da lipoperoxidação com o uso de medicamentos homeopáticos acima do número de Avogrado, tais como o Cuprum metallicum C30 e o Arsenicum album C30.
O medicamento homeopático produziu inibição significativa de lipoperoxidação comparativamente à melatonina, demonstrando uma ação antioxidante in vitro, podendo-se inferir que, talvez, quando administrado segundo a Lei das Semelhanças, possam ocorrer respostas positivas no indivíduo nesse mesmo sentido.
7 Abreviaturas e Símbolos
CN Íon cianeto
CuZn SOD Superóxido dismutase dependente de cobre e zinco
DNA Ácido desoxiribonucléico
DOPA 3,4 – dihidroxifenilalanina
DTPA Ácido dietilenotriaminopentacético
Ec SOD Superóxido dismutase extracelular
ERO Espécies reativas de oxigênio
GPx Glutationa peroxidase
GSH Glutationa reduzida
GSSG Glutationa oxidada
Hb Hemoglobina
HCN Cianeto de hidrogênio; ácido cianídrico
H2O2 Peróxido de hidrogênio
HO∙ Hidroxila
KCN Cianeto de potássio
LPx Lipoperoxidação
MDA Malondialdeído
Mn SOD Superóxido dimutase dependente de manganês
NADP Nicotinamida adenina dinucleotídeo fosfato, forma reduzida
NADPH Nicotinamida adenina dinucleotídeo fosfato, forma oxidada
NBT Azul de nitrotetrazólio
O2 Dioxigênio; oxigênio molecular
O2∙ – Superóxido
1O2 Oxigênio Singlet
RNAm Ácido ribonucleico mensageiro
RO∙ Radical alcoxil
ROO∙ Radical Peroxil
ROOH Hidroperóxido Orgânico
SOD Superóxido dismutase
TBA Ácido tiobarbitúrico
TCA Ácido tricloroacético
REFERÊNCIAS
AMES, B.N. – Dietary carcinogens and anticarcinogens – oxygen radicals and degenerative diseases. Science, 221: 1256-1264, 1983.
AMES, B.N. & GOLD, L.S. – Endogenous mutagens and the causes of aging and cancer. Mutat. Res., 250: 3-16, 1991.
ANDRADE, M.M. – Como Preparar Trabalho para Cursos de Pós-Graduação. São Paulo. Ed. Atlas S.A., 1995, 118 p.
BAROLLO, C.R. Aos que se tratam pela Homeopatia. 4.ª edição. São Paulo. Editora Typus, 1989, 93 p.
BAST, A.; HAENEN, G.R.M.M.; DOELMAN, C.J.A. – Oxidants and antioxidants: state of the art. Am.J.Med., 91 (suppl 3C): 2S-13S, 1991.
BEUTLER, E.; WEST, C.: BEUTLER, B. – Electrophoretic polymorphism of glutathione peroxidase. Hum. Genet., 38: 163-169, 1974.
BRUNINI, C. Aforismos de Hipócrates. São Paulo. Typus IBEHE. 1998, 173, p.
CASTRO, D. Homeopatia e Profilaxia. São Paulo, Editoração Mauro Familiar Editora. 1980, 145 p.
CHADA, S.; WHITNEY, C.; NEWBURGER, P.E. – Post-transcriptional regulation of glutathione peroxidase gene expression by selenium in the HL-60 human myeloid cell line. Blood, 74 (7): 2535-2541, 1989.
CHANCE, B. – Effect of pH upon the reaction kinetics of the enzyme-substrate compounds of catalase. J. Biol. Chem., 194 (2): 471-481, 1952a.
_________ Effect of pH upon the reaction kinetics of the enzyme-substrate compounds of catalase. J. Biol. Chem., 194 (2): 483-496, 1952b.
CHANCE, B. & OSHINO, N. – Kinetics and mechanisms of catalase in peroxisomes of the mitochondrial fraction. Biochem.J., 122: 225-233, 1971.
CIRIOLO, M.R.; FISKIN, K. DE MARTINO, A.; CORASANITI, M.T.; NISTICO, G.; RTILIO, G. – Age-related changes in Cu, Zn superoxide dismutase, Se-dependent and –independent glutathione peroxidase and catalase activities in specific areas of rat brain. Mech. Ageing Dev., 61: 287-297, 1991.
COHEN, G. & HOCHSTEIN, P. – Glutathione peroxidase: the primary agent for the elimination of hydrogen peroxide in erythrocytes. Biochemistry, 2 (6): 1420-1428, 1963.
CUTLER, R.G. – Evolution of human longevity and the genetic complexity governing aging rate. Proc.Natl.Acad.Sci.USA, 72 (11): 4664-4668, 1975.
________ Human longevity and aging: possible role of reactive oxygen species. Ann.N.Y.Acad.Sci., 621: 1-28, 1991.
DEMARQUE, D.– Técnicas Homeopáticas. Buenos Aires, Ediciones Marecel, 1981, 328 p.
DUPRAT, H. A Teoria e a Técnica da Homeopatia, Rio de Janeiro. Gráfica Olímpica Editora, 1982, 198 p.
EATON, J.W. – Catalases and peroxidases and glutathione and hydrogen peroxide: mysteries of the bestiary. J.Lab.Clin.Med., 118: 3-4, 1991.
FORSTRON, J.W.; ZAKOWSKI, J.J.; TAPEL, A.L. – Identification of the catalytic site of rat liver glutathione peroxidase as selenocysteine. Biochemistry, 17 (13): 2639-2644, 1978.
FRIDOVICH, I. – The biology of oxygen radicals. Science, 201: 875880, 1978.
GAETANI, G.F.; GALIANO, S.; CANEPA, L.; FERRARIS, A.M.; KIRKMAN, H.N. – Catalase and glutathione peroxidase are equally active in detoxification of hydrogen peroxide in human erythrocytes. Blood, 73 (1): 334-339, 1989.
GERSCHMAN, R.; GILBERT, D.L.; NYE, S.W.; DWYER, P.; FENN, W.O. – Oxygen poisoning and X-irradiation: a mechanism in common. Science, 119: 623-626, 1954.
GONZALEZ, M.J. – Lipid peroxidation and tumor growth: an inverse relationship. Med.Hypotheses, 38 (2): 106-110, 1992.
GUYTON, A. C. – Tratado de Fisiologia Médica. 4.ª edição. Rio de Janeiro. Ed. Guanabara Hoogan S/A, 1973., 974 p.
HALLIWELL, B. – Oxidants and human disease: some new concepts. FASEB J., 1: 358-364, 1987.
_________ Oxidants and the central nervous system: some fundamnetal questions. Acta Neurol.Scand, 126: 23-33, 1989b.
_________ How to characterize a biological antioxidant. Free rad.Res.Commun., 9 (1): 1-32, 1990.
_________ Reactive oxygen species in living systems: source, biochemistry, and role in human disease. Am.J.med., 91 (suppl 3C): 14S-22S, 1991.
HALLIWELL, B. & GROOTVELD, M. – The measurement of free radical reactions in humans. FEBS Lett., 213 (1): 9-14, 1987.
HALLIWELL, B. & GUTTERIDGE, J.M.C. – Free radicals in Biology and Medicine. Oxford: Clarendon Press, 1985, 543 p.
_________ Free radicals in Biology and Medicine. Oxford: Clarendon Press, 1989, 543 p.
HALLIWELL, B.; HOULT, R.; BLAKE, D.R. – Oxidants, inflammation, and anti-inflammatory drugs. FASEB J., 2: 2867-2873, 1988.
HAHNEMANN, S. Matéria Médica Pura. 2.ª edição. New Delhi. Jain Publishing Co, 1920.
_________ Doenças Crônicas – Sua Natureza Peculiar e Sua Cura Homeopática. New Delhi. Jain Publishing Co., 1984.
HARMAN, D. –The aging process. Proc.Natl.Acad.Sci.USA, 78 (11): 7124-7128, 1981.
HENDLER, S.S. – Vitamin and Mineral Encyclopedia. San Diego. Simon e Schuski, 1990, 576 p.
KAY, M.M.B.; BOSMAN, G.J.C.G.M.; SHAPIRO, S.S.; BENDICH, A.; BASSEL, P.S. – Oxidation as a possible mechanism of cellular aging: Vitamin E deficiency causes premature aging and IgG binding to erythrocytes. Proc.Natl.Acad.Sci.USA 83: 2463-2467, 1986.
KENT, J. T. Filosofia Homeopática. Buenos Aires. Editorial Albatroz. 1980., 342 p.
LATHOUD. Matéria Médica Homeopática. Buenos Aires, Editorial Albatroz, 1980, , 868 p.
MACHLIN, L.J. & BENDICH, A. – Free radical tissue damage: protective role of antioxidant nutrients. FASEB J. 1: 441-445, 1987.
MAFFEI, W.E. Os Fundamentos da Medicina. 2.ª edição. São Paulo. Artes Médicas, 1978, 781 p.
MANNERVIK, B. – Glutathione peroxidase. Methods Enzymol., 113: 490-495, 1985.
MARKLUND, S.L. – Human copper-containing superoxide dismutase of high molecular weight. Proc.Natl.Acad.Sci.USA, 79: 7634-7638, 1982.
MASTERS, C. & CRANE, D. – Isozymes and the micro organization of organellar structure and function. In: Isozymes: Structure, Function, and Use in Bilogy and Medicine. Wilwy-Liss, Inc., 1990. P. 101-122.
McBRIDE, O.W.; MITCHELL, A.; LEE, B.J.; MULLENBACH, G.; HATFIELD, D. – Gene for seleniem-dependent glutathione peroxidase maps to human chromosomes 3, 21 and X. BioFactors, 1 (4): 285-292, 1988.
McCORD, J.M. & FRIDOVICH, I. – Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein). J.Biol.Chem., 244 (22): 6049-6055, 1969.
MEERA KHAN, P.; VERMA, C.; WIJNEN, L.M.M.; JAIRAJ, S. – Red cell glutathione peroxidase (GPX1) variation in Afro-Jamaican, Asiatic Indian and Dutch populations: is the GPX1*2 allele of “Thomas”variant an African marker? Hum.Genet., 66: 352-355, 1984.
MENETRIER, J. A medicina das funções. São Paulo. Organon, Bio Press, 2000, 222 p.
MILLS, G.C. – The purification and properties of glutathione peroxidase of erythrocytes. J.Biol.Chem., 234: 502-506, 1959.
MITROPOULOS, D. – Oligoterapia. Italy. Editorium Milano, 1994, 137 p.
MONTEIRO, I. – Reflexões Filosóficas. Ed. São Paulo. Alvorada, 1982, 124 p.
PAGLIA, D.E. & VALENTINE, W.N. – Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase. J.Lab.Clin.Med., 70 (1): 158-169, 1967.
PERCY, M.E. – Catalase: an old enzyme with a new roe? Can.J.Biochem.Cell Biol., 62: 1006-1014, 1984.
PORTA, E. Tissue lipoperoxidation and lipofuscin accumulation as influenced by age, type of dietary fat and levels of vitamin E in rats. Advances in the Biosciences, 64: 37-74, 1987.
_________ Role of oxidative damage in the aging process. In: CHOW, C.K., ed. Cellular Antioxidant Defense Mechanisms. Vol. III, Boca raton, FL: CRC Press, 1988. P. 1-52.
POZETTI, G. L. “Mecanismo de Ação do Medicamento Homeopático”. São Paulo, Revista de Homeopatia, 1986, 66 p.
PUSTIGLIONE, M. – “O Moderno” – Organon da Arte de Curar – Dr. Samuel Hahnemann – São Paulo – Ed. Typus, 2001, 320 p.
PUSTIGLIONE, M. & CARRILO JR., R. Organon da Arte de Curar de Samuel Hahnemann – Versão para o português sistematizada e comentada por Marcelo Pustiglione e Romeu Carrilo Jr. São Paulo, Homeopatia Hoje, 1994, 205 p.
REITER, J. R. & MAESTRONI, G. J. M. Melatonin in relation to the antioxidative defense and immune systems: possible implications for cell and organ transplantation. J. Mol. Med., 77:36-39, 1999.
SCOTT, M.D.; LUBIN, B.H.; ZUO, L.; KUYPERS, F.A. – Erythrocyte defense against hydrogen peroxide: preeminent importance of catalase. J.Lab.Clin.Med., 118: 7-16, 1991.
SIES, H. – Oxidative stress: from basic research to clinical application. Am.J.Med., 91 (suppl 3C): 31S-38S, 1991.
SINET, P.M.; MICHELSON, A.M.; BAZIN, A.; LEJEUNE, J.; JÉROME, H. – Increase in glutathione peroxidase activity in erythrocytes from trisomy 21 subjects. Biochem.Biophys.Res.Commun., 67 (3): 910-915, 1975.
SINET, P.M.; GARBER, P; JÉROME, H. – Inativaction of human CuZn superoxide dismutase during exposure to superoxide radical and hydrogen peroxide. Bull.europ.Physiopath.resp., 17 (suppl.): 91-97, 1981.
SLATER, T.F. – Free radical mechanisms in tissue injury. Biochem.J., 222: 1-15, 1984.
SMITH, L.; THIER, S.O. – Fisiologia. 2.ª ed. São Paulo. Panamericana, 1990, 1260 p.
SUN, Y. & OBERLEY, L.W. – The inibition of catalase by glutathione. Free Rad.Biol.Med., 7: 595-602, 1989.
TETAU, M. Homeopatia. 6.ª edição. São Paulo, Andrei. 1980, 175 p.
TORTI, A. Gli oligoelementi nel futuro terapêutico. Milão. Giuseppe Mario Ricchiuto Editore, 1988, 232 p.
VANNIER, L. Compendio de Matéria Médica Homeopática. Médico. Editorial Porrua. S. A. 1979.
VIJNOVSKY, B. Sintomas-Clave de La Materia Medica Homeopatica – Buenos Aires – Editorial Albatros. 1978, 250 p.
WIEACKER, P.; MUELLER, C.R.; MAYEROVA, A.; GRZESCHIK, K.H.; ROPERS, H.H. – Assignment of the gene coding for human catalase to the short arm of chromosome 11. Ann.Génét., 23 (2): 73-77, 1980.
¹Discente da FACIS – Faculdade de Ciências da Saúde de São Pauo-IBEHE – Centro de ensino superior em homeopatia.
²Orientadora.
