REGISTRO DOI: 10.5281/zenodo.8370843
Artêmio José Araruna Dias1; Fernando de Paiva Melo Neto2
Jéssika Jannyne Gomes de Lima1; Larissa Carvalho Pereira Buriti1
Luana Araújo Bacurau1 ; Daniel Araújo de Sena3
Maria Rebeca Celiao Batista Petronio1 ; Laíse Carvalho Pereira Buriti4
Marinna Karla da Cunha Lima Viana5 ; Bianca Etelvina Santos de Oliveira6
RESUMO
A doença de Alzheimer (DA), a mais prevalente dentre as síndromes demenciais, é alvo de pesquisas com a finalidade de investigação de suas etiologias e, assim, serem desenvolvidas intervenções que possam alterar a história natural da doença. Nesse sentido, as hipóteses verificadas nesta revisão, relacionam as alterações na microbiota do trato gastrointestinal e as repercussões locais, sistêmicas e neurológicas. O microbioma entérico tem efeitos benéficos na homeostase orgânica, com participação do sistema imunológico e da digestão dos alimentos, por exemplo. Porém, uma disbiose, ou seja, uma modificação quantitativa e qualitativa da flora intestinal, pode trazer prejuízos a diversos sistemas, inclusive ao Sistema Nervoso Central. Estudos em humanos e animais corroboram essa possibilidade, considerando os diferentes achados encontrados nas pesquisas feitas entre grupos separados, com e sem a DA.
Palavras-chave: Doença de Alzheimer; Trato Gastrointestinal; Microbioma Gastrointestinal.
ABSTRACT
Alzheimer’s disease (AD), the most prevalent of dementia syndromes, is the subject of research studies to investigate its etiologies and, thus, be developed as an intervention that prevents altering the history of the disease and its evolution. In this sense, the hypotheses verified in this review relate to changes in the gastrointestinal tract microbiota and as local, systemic and neurological repercussions. The enteric microbiome has beneficial effects on organic homeostasis, with participation of the immune system and food digestion, for example. However, a dysbiosis, that is, a quantitative and qualitative modification of the intestinal flora, can bring harm to several systems, including the Central Nervous System. Studies in humans and animals corroborate this possibility, considering the different findings between groups with and without AD.
Keywords: Alzheimer Disease; Gastrointestinal Tract; Gastrointestinal Microbiome.
INTRODUÇÃO
A Doença de Alzheimer (DA), causa mais comum de demência, é uma doença neurodegenerativa, causada por múltiplos fatores, e que apresenta comprometimento progressivo da memória como um dos principais sinais, além de perda cognitiva e imunodesregulação periférica e central 2,15,17. A DA por muito tempo esteve associada a infecções e imunossenescência. No entanto, estudos recentes avaliaram uma relação muito importante entre o eixo intestino-cérebro, revelando que a microbiota intestinal de pacientes com DA difere daquela de indivíduos sem a demência 2,17.
A microbiota intestinal compreende uma comunidade complexa de espécies de microrganismos que residem no ecossistema gastrointestinal e exercem uma relação de simbiose com o hospedeiro humano 28, 30. Através do eixo intestino-cérebro esse microbioma desempenha uma influência sobre o desenvolvimento e função do sistema nervoso central, incluindo a regulação do comportamento cognitivo, que é domínio mais afetado na doença de Alzheimer, consequentemente, é possível inferir que a disbiose – alterações que rompem o equilíbrio basal da microbiota intestinal – pode promover disfunção cognitiva e, assim, influenciar no desenvolvimento da DA 28, 30, 31, 32. O equilíbrio dos microrganismos residentes no trato gastrointestinal é regulado por fatores extrínsecos e intrínsecos, como hábitos alimentares e histórico genético 8. Nesse sentido, analisar o impacto da microbiota sobre a DA é extremamente válido para a uma melhor elucidação da fisiopatologia e, desse modo, de novas formas de tratamento e prevenção da doença 37.
A relação fisiopatológica entre a DA e as alterações à nível de sistema gastrointestinal ainda não estão completamente elucidadas, no entanto, existem diversas evidências, encontradas a partir de pesquisas realizadas com animais e seres humanos, que sugerem, principalmente associação à inflamação entérica por disbiose, o que causaria maior inflamação e neurodegeneração 1,2,7,14,17,31.
Uma das correntes de pesquisa diz respeito a alterações na flora microbiana intestinal, que teria implicação no sistema nervoso central, com prejuízos no eixo dos neurotransmissores 2, sistema imunológico 3,15, produção aumentada de citocinas 3,7, alteração de permeabilidade da barreira intestinal 11 e hematoencefálica 5,7,20. Há estudos que comprovam que tais desregulações entéricas culminam na presença de bactérias, ainda que em pequenas quantidades no sistema nervoso central, permitindo comparação, com indivíduos que não possuem DA 5. Ademais as evidências sugerem claras diferenças na composição da microbiota de pessoas portadoras e não portadoras da DA 6,15.
O entendimento dessa correlação intestino-cérebro permite desenvolver novas estratégias tanto na prevenção quanto no tratamento da doença de Alzheimer 2,4,21,28,32. Nesse contexto, surgem os antibióticos e a suplementação à base de probióticos como opções relevantes, uma vez que apresentam impactos benéficos ao organismo, tais como homeostase intestinal, diminuição dos danos neuronais e melhora da função cognitiva 2,21,25,32. Além disso, notou-se que a dieta e o estilo de vida têm grande influência nas alterações presentes no Alzheimer. A partir dessa observação, alguns estudos apontam a restrição calórica de longo prazo como modo de prevenir a expansão de micróbios que contribuem para o déficit cognitivo relacionado à idade. Entretanto, outras pesquisas também mostram que a ingestão de alguns tipos de carboidratos complexos, por exemplo, proporciona o aumento do metabolismo sistêmico e a redução da neuroinflamação 2,10,14.
Dentre outros fatores relativos às alterações do microbioma entérico, cabe destacar a produção de Lipopolissacarídeos (LPS), cujo resultado é maior inflamação local, ou seja, na mucosa intestinal, bem como também, induz a um maior estado inflamatório no sistema nervoso central 1,2,23,25,26,32. Ademais, nota-se modificações na permeabilidade da barreira hematoencefálica, o que promove invasão de moléculas e até microrganismos, favorecendo à neurodegeneração 22,38. O depósito de substância amilóide, achado característico da DA, está aumentado, possivelmente pelas diversas alterações que a disbiose produz 22-24.
Dessa forma, o presente estudo possui o objetivo de elucidar as hipóteses e implicações advindas da possível associação entre o desenvolvimento e a progressão da Doença de Alzheimer e as alterações do sistema gastrointestinal, sobretudo em relação à alterações da microbiota intestinal.
MATERIAIS E MÉTODOS Caracterização do estudo
O presente trabalho refere-se a um estudo de revisão, de caráter integrativo de literatura, acerca da participação das alterações da Microbiota Gastrointestinal na Doença de Alzheimer.
Local e período do estudo
O levantamento dos dados foi realizado em ambiente eletrônico, no período de fevereiro a março de 2021, através das bases de dados científicas: Biblioteca Virtual em Saúde (BVS), Scientific Electronic Library Online (SciELO) e United States National Library of Medicine (PubMed).
Critérios de inclusão e exclusão
Como critérios de inclusão para o presente estudo, foram utilizados: A) Produções científicas devidamente indexadas nas bases de dados BVS, SciELO e PubMed; B) Publicações que contivessem os descritores, verificados na Medical Subject Heading da National Library of Medicine (Mesh): “Alzheimer Disease”, “Alzheimer Dementia”, “Gastrointestinal Tract”, “Gastrointestinal Microbiome”, “Gastrointestinal Flora”, “Intestinal Microbiota”, “Intestinal Microflora” e suas variações, de forma isolada ou combinados através dos operadores booleanos “AND” e “OR”; C) Publicações entre os anos de 2016 e 2021; D) Textos disponibilizados de forma gratuita e na íntegra; E) Publicações nos idiomas português, inglês e espanhol; E) Estudos com o delineamento de ensaio clínico, coorte, série de casos, estudo transversal, estudo observacional, revisão sistemática de literatura e metanálise.
Por outro lado, foram excluídas as produções que não cumprissem algum dos critérios de inclusão, assim como, os estudos do tipo relato de caso, relato breve e artigo de revisão.
Procedimento da coleta de dados
Imagem 01 – Fluxograma de seleção dos artigos para composição do estudo.
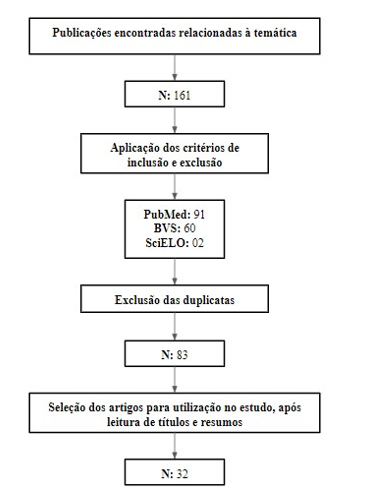
Fonte: Autoria própria, 2023.
Quadro 1 – Dados dos artigos utilizados para os resultados e discussão.
Autores Ano País Tipo de artigo Objetivos Rutsch A, Kantsjö JB, Ronchi F 2020 Canadá Revisão Fornecer uma visão geral do estado atual das pesquisas sobre o efeito da microbiota no eixo intestino-cérebro, na homeostase e nos estados de doença, com particular interesse nos diferentes metabólitos bacterianos envolvidos. Kesika P, Suganthy N, Sivamaruthi BS, Chaiyasut C 2020 Tailândia Revisão Compreender a relação entre o eixo intestino-cérebro e explorar os caminhos para a DA. Borsom EM, Lee K, Cope EK. 2020 Revisão Analisar as relações microbiológicas da microbiota intestinal com as alterações neurológicas. Além de descrever potenciais efeitos das terapêuticas neuro-metabólicas. Dodiya HB, Frith M, Sidebottom A, Cao Y, Koval J, Chang E, Sisodia SS. 2020 Estados Unidos Artigo original Determinar se essas reduções observadas na amiloidose Aβ cerebral são específicas de qualquer antibiótico de forma individual ou requerem os efeitos sinérgicos de vários antibióticos. Westfall S, Dinh DM, Pasinetti GM. 2020 Estados Unidos Artigo original Avaliar a presença e diferenças de microbiomas dependentes da região cerebral em indivíduos controle e com DA e a contribuição do viés do estudo. Askarova S, Umbayev B, Masoud AR, Kaiyrlykyzy A, Safarova Y, Tsoy A, Olzhayev F, Kushugulova A. 2020 Estados Unidos Artigo de revisão Analisando as ligações entre o microbioma intestinal, estilo de vida moderno, envelhecimento e DA. Honarpisheh P, Reynolds CR, Blasco Conesa MP, Moruno Manchon JF, Putluri N, Bhattacharjee MB, Urayama A, McCullough LD, Ganesh BP. 2020 Estados Unidos Artigo original Se o intestino carrega a carga Aβ antes do cérebro, destacando a interação do eixo intestino-cérebro em distúrbios neurodegenerativos. Zhu S, Jiang Y, Xu K, Cui M, Ye W, Zhao G, Jin L, Chen X. 2020 China Artigo de revisão Revisar o progresso nos estudos do eixo intestino-cérebro e explicar como as mudanças na microbiota intestinal alteram a função cognitiva, a fisiologia cerebrovascular e o desenvolvimento de doenças neurológicas e neuropsiquiátricas. Sun M, Ma K, Wen J, Wang G, Zhang C, Li Q, Bao X, Wang H. 2020 China Artigo de revisão Fornecer uma revisão das evidências que apoiam o papel das alterações ao longo do eixo cérebro-intestino-microbioma na patogênese da DA, com foco na concordância entre essas alterações e os mecanismos patogênicos descritos anteriormente. Cox LM, Schafer MJ, Sohn J, Vincentini J, Weiner HL, Ginsberg SD, Blaser MJ 2019 Estados Unidos Artigo original Demonstrar pela primeira vez que camundongos fêmeas Tg2576 apresentam melhora nas alterações da microbiota relacionadas à idade em comparação com irmãos da ninhada WT, e que o CR reverte alterações relacionadas à idade e Aβ na microbiota intestinal. Grochowska M, Laskus T, Radkowski M. 2019 Estados Unidos Artigo de revisão Fornecer uma atualização sobre a ligação entre a microbiota e a função cerebral no contexto de distúrbios neurológicos. D’Argenio V, Sarnataro D. 2019 Itália Artigo de revisão Analisar as últimas descobertas sobre o papel da microbiota intestinal na regulação do enovelamento de proteínas relacionado à patogênese do príon e da DA. Hoffman JD, Yanckello LM, Chlipala G, Hammond TC, McCulloch SD, Parikh I, Sun S, Morganti JM, Green SJ, Lin AL 2019 Estados Unidos Artigo original Determinar se o controle da composição e atividade microbiana intestinal por meio de uma intervenção dietética pode proteger as funções metabólicas sistêmicas através do eixo intestino-cérebro em camundongos APOE4 assintomáticos em comparação com seus irmãos de ninhada APOE3. Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, Codagnone MG, Cussotto S, Fulling C, Golubeva AV, Guzzetta KE, Jaggar M, Long-Smith CM, Lyte JM, Martin JA, Molinero-Perez A, Moloney G, Morelli E, Morillas E, O’Connor R, Cruz-Pereira JS, Peterson VL, Rea K, Ritz NL, Sherwin E, Spichak S, Teichman EM, van de Wouw M, Ventura-Silva AP, Wallace- Fitzsimons SE, Hyland N, Clarke G, Dinan TG 2019 Estados Unidos Artigo de revisão Dar ao leitor uma visão abrangente de como este campo ultrapassou as fronteiras da nossa compreensão sobre a influência da microbiota nos nossos corpos e nas nossas mentes, e o que ainda falta compreender para concretizar plenamente o potencial da medicina baseada na microbiota. Fox M, Knorr DA, Haptonstall KM. Ann N Y 2019 Estados Unidos Artigo de revisão Revisar como o microbioma mudou ao longo da história das principais transições de estilo de vida e, em seguida, revisar como os microrganismos residenciais do intestino humano, da cavidade oral, da cavidade nasal e do cérebro podem influenciar a patogênese da DA. Especificamente, revisamos evidências epidemiológicas que ligam a composição de micróbios em cada região do corpo ao risco e à etiologia da DA, os mecanismos pelos quais essa influência pode ocorrer e como as mudanças na composição dos micróbios em cada região do corpo ao longo da história humana podem ter aumentado o risco de DA. Sasmita AO 2019 Alemanha Artigo de revisão Destacar a importância da modificação do microbioma intestinal contra os sintomas e/ou causas de doenças neurodegenerativas, uma vez que a disbiose no intestino humano está implicada como uma das causas ou consequências das doenças neurodegenerativas. Haran JP, Bhattarai SK, Foley SE, Dutta P, Ward DV, Bucci V, McCormick BA 2019 Estados Unidos Artigo original Para compreender mais profundamente como os táxons bacterianos intestinais específicos estão associados à DA e até que ponto esses táxons alteram o equilíbrio da homeostase epitelial intestinal, exploramos a composição do microbioma de idosos em lares de idosos com DA, sem demência ou outros tipos de demência. Bostanciklioğlu M. 2019 Turquia Artigo de revisão Para responder a estas perguntas: De que forma a flora intestinal afeta a patogênese da DA? A restauração da flora bacteriana intestinal é uma opção de tratamento promissora para a neurodegeneração e a demência DA? E, finalmente, quais são os pontos de junção desta visão centrada no microbioma com outras teorias (inflamação, metabolismo energético, cálcio, etc.)? Shen L, Ji HF. 2019 China Artigo de revisão Discutir as evidências atuais sobre as associações entre a DA e a microbiota intestinal e fornecer perspectivas futuras. O objetivo é direcionar estrategicamente a microbiota intestinal como um novo território para combater a DA. Shimizu Y. 2018 Japão Artigo de revisão Resumir o conhecimento atual sobre o papel da microbiota intestinal na regulação do desenvolvimento da DA, osteoporose, sarcopenia e doenças cerebrais e cardiovasculares. La Rosa F, Clerici M, Ratto D, Occhinegro A, Licito A, Romeo M, Iorio CD, Rossi P. 2018 Itália Artigo de revisão Discutir diversas linhas de evidência que destacam o papel da microbiota intestinal no desenvolvimento de doenças neurodegenerativas, e em particular da DA, com foco no bem-estar intestinal como uma possível abordagem terapêutica. revisar criticamente o efeito da suplementação de ácidos graxos ômega-3 (AF) na composição da microbiota e, em seguida, na DA. Spielman LJ, Gibson DL, Klegeris A. 2018 Canadá Artigo de revisão Ilustrar duas vias implicadas no crosstalk entre a microbiota intestinal e o SNC envolvendo 1) o nervo vago e 2) a transmissão de moléculas sinalizadoras através do sistema circulatório e através da barreira hematoencefálica. Pellegrini C, Antonioli L, Colucci R, Blandizzi C, Fornai M. 2018 Itália Artigo de revisão Fornecer uma visão abrangente do conhecimento atual sobre o papel desempenhado pela microbiota entérica, pelo sistema imunológico da mucosa e pelo ENS, considerados como uma rede integrada, na fisiopatologia das principais doenças neurológicas, incluindo DP, DA, ELA e EM e seus distúrbios intestinais associados. . Zhuang ZQ, Shen LL, Li WW, Fu X, Zeng F, Gui L, Lü Y, Cai M, Zhu C, Tan YL, Zheng P, Li HY, Zhu J, Zhou HD, Bu XL, Wang YJ. 2018 China Artigo original Coletar e analisar as fezes de pacientes com DA e controles cognitivamente normais e descobriram que a composição da microbiota intestinal em pacientes com DA era diferente daquela dos controles normais. Szablewski L. 2018 Polônia Artigo de revisão Resumir o que se sabe sobre a microbiota gastrointestinal e sua relação com a DA. Liauchonak I, Dawoud F, Riat Y, Qorri B, Sambi M, Jain J, Kalaydina RV, Mendonza N, Bajwa K, Szewczuk MR. 2018 Canadá Artigo de revisão Fornecer uma visão geral dos papéis fisiológicos e fisiopatológicos na síndrome metabólica e suas patologias relacionadas, incluindo saúde cardiovascular, composição da microflora intestinal, funcionamento do trato gastrointestinal, síndrome do ovário policístico, câncer de pâncreas e distúrbios neurodegenerativos. Zhang L, Wang Y, Xiayu X, Shi C, Chen W, Song N, Fu X, Zhou R, Xu YF, Huang L, Zhu H, Han Y, Qin C. 2017 China Artigo original Comparar os microbiomas fecais e a composição fecal de ácidos graxos de cadeia curta (SCFAs) entre camundongos de tipo selvagem e modelo com DA em diferentes idades sob condições livres de patógenos específicos estritamente controladas, e também conduzir investigações microscópicas de estruturas intestinais. Westfall S, Lomis N, Kahouli I, Dia SY, Singh SP, Prakash S 2017 Canadá Artigo de revisão Analisar a relação da microbiota, probióticos e doenças neurodegenerativas no eixo cérebro-microbiota. Wu SC, Cao ZS, Chang KM, Juang JL. Nat Commun. 2017 China Artigo original Utilizar um modelo de Drosophila com DA para investigar o possível envolvimento da infecção intestinal na neurodegeneração. Jiang C, Li G, Huang P, Liu Z, Zhao B. 2017 China Artigo de revisão Discutir o papel do microbioma intestinal na DA e resumir os estudos realizados tanto em animais como em humanos que demonstram a contribuição das bactérias intestinais na disfunção cognitiva, especificamente no desenvolvimento da DA. Alkasir R, Li J, Li X, Jin M, Zhu B. 2017 China Artigo de revisão Nesta revisão, examinamos o papel da microbiota intestinal na manutenção da saúde, no processo de inflamação; e como está implicado em doenças metabólicas adquiridas e na morbilidade relacionada com o envelhecimento; destacando a demência, particularmente na regulação da DA. Hu X, Wang T, Jin F. 2016 China Artigo de revisão Resumir o que se sabe sobre a microbiota gastrointestinal e sua relação com a DA.
RESULTADOS E DISCUSSÃO Doença de Alzheimer (DA)
A doença de Alzheimer (DA) é uma doença neurodegenerativa, multifatorial, caracterizada por déficit cognitivo e comprometimento progressivo da memória. Essa doença é responsável por 80% dos casos de demência, afetando principalmente idosos 2. De acordo com o estudo de Carga de Doença Global (GBD), realizado em 2016, cerca de 43,8 milhões de pessoas no mundo sofriam de DA 2. Ademais, com base nas projeções do World Alzheimer Report 2015, o total de pessoas com DA duplicaria até 2030 e chegaria a marca dos 131,5 milhões em 2050 2. Ainda, de acordo com a Associação Brasileira de Alzheimer (ABRAz), no Brasil há cerca de 1,2 milhão de casos, sendo a maior parte deles ainda sem diagnóstico. Sendo assim, a Doença de Alzheimer possui abrangência global e é um importante problema de saúde pública.
Na fisiopatogênese da DA, é descrita a deposição de placas beta-amilóides (Aβ) e emaranhados neurofibrilares que são os responsáveis pela neuroinflamação, alteração da homeostase de eletrólitos e degeneração vascular e tecidual, levando à morte neuronal e, consequentemente, ao déficit cognitivo e comprometimento da memória 2. Além disso, cinco estudos evidenciam que o sistema digestório e o sistema nervoso central possuem íntima relação, tendo a microbiota intestinal um importante papel na cognição do hospedeiro, e sua disbiose associada ao envelhecimento um grande fator influente na neurodegeneração 3,4 .
Diante disso, o eixo intestino-cérebro tornou-se um novo alvo para a terapêutica da doença de Alzheimer, tendo em vista que o alzheimer se correlaciona com as bactérias disbióticas e com as irregularidades imunológicas, metabólicas e endócrinas associadas à sinalização disforme desse eixo 5. Assim,uma dieta pobre, aliada ao envelhecimento e à disfunção neuronal pioram o curso da doença. Desse modo, a modificação da composição microbiana do intestino pela ingestão de alimentos ricos em probióticos e prebióticos pode atuar como uma opção preventiva e terapêutica para a DA.
Microbiota intestinal
A microbiota intestinal humana é uma comunidade de microrganismos comensais e simbióticos composta por bactérias, vírus, fungos, leveduras e bacteriófagos constituída, sobretudo, por bactérias pertencentes a quatro filos dominantes: Firmicutes (51%), Bacteroidetes (48%), Actinobacteria e Proteobacteria (compõem o 1% restante) 1,28. Sua composição é regulamentada por fatores extrínsecos, incluindo hábito alimentar, estilo de vida e exposição precoce a infecções, bem como por fatores intrínsecos, como histórico genético, processos imunológicos, metabólicos e hormonais 8.
Muitas pessoas costumam pensar que o microbioma intestinal está ligado estritamente a questões de digestão e de absorção de nutrientes, contudo, esse contingente de microorganismos e os produtos do seu metabolismo desempenham um importante papel não somente à nível intestinal mas no corpo humano como um todo, haja vista que exercem influência em processos fisiológicos essenciais para a manutenção da saúde, como maturação e desenvolvimento do sistema imunológico, reações inflamatórias, defesa contra patógenos e até mesmo neurodesenvolvimento 1,32.
Nesse sentido, ao investigar o impacto do ecossistema gastrointestinal na função cerebral, estudos recentes encontraram fortes evidências de uma ligação entre a microbiota intestinal e a cognição 30. Dessa forma, é possível inferir que o microbioma gastrointestinal pode influenciar processos importantes para o desenvolvimento da doença de Alzheimer, posto que tal distúrbio neurológico tem como principal característica patológica o comprometimento cognitivo 31. Dentre as pesquisas que embasam essa hipótese, tem-se o estudo de Westfall et al, o qual fornece suporte para o papel da interação entre o intestino e o cérebro na modulação da progressão da DA 28.
Muitas são as pesquisas acerca da doença de Alzheimer e, apesar do grande esforço dos pesquisadores, ainda não se tem uma terapêutica capaz de tratar de forma eficiente tal patologia. Isso ocorre devido à compreensão limitada sobre o processo patológico de tal doença 24. Por isso a análise da doença de Alzheimer sob a ótica da influência da microflora intestinal torna-se extremamente necessária, pois pode permitir um nova visão da complexa fisiopatologia da DA, o que é muito importante para a elucidação de medidas preventivas como o diagnóstico precoce, a identificação de novos alvos terapêuticos e o desenvolvimento de novos medicamentos 31.
Evidências: o que os estudos sugerem?
A relação entre a fisiopatologia das alterações na microbiota e o desenvolvimento da doença de Alzheimer é alvo de estudos de diversas pesquisas e estudos clínicos no mundo. É fundamental destacar os principais resultados dos estudos originais publicados nos últimos cinco anos, que foram incluídos nas buscas realizadas pelo presente artigo, seguindo aos critérios de inclusão.
O estudo realizado por Shih-Cheng Wu e colegas, em que utilizaram cobaias de Drosophila portadora de DA, para investigar a possível relação entre a neurodegeneração e a infecção intestinal. Foi concluído que da mesma forma que lesões ou inflamações focais no sistema nervoso central, como o acidente vascular encefálico, induzem a migração de células do sistema imune para combater e minimizar o processo inflamatório, assim como infecções primariamente entéricas promovem também a migração de tais células, atravessando, deste modo, a barreira hematoencefálica 29.
Ademais, a invasão de bactérias no sistema nervoso das Drosophilas, observado pela equipe Shih-Cheng Wu, causou aumento da neurodegeneração, através de apoptose celular, o que promoveu aumento dos sinais característicos da DA 29.
Na pesquisa publicada por Hemraj B. Dodiya, em 2020, foi sugerido que a deposição cerebral de substância amilóide, está mais relacionada a um sinergismo de diversas bactérias intestinais, do que propriamente a alguma em específico 4.
A hipótese foi elencada a partir do experimento em ratos, no qual foram administrados antibióticos e antiprotozoarios (Gentamicina; Metronidazol, Vancomicina; Canamicina; Colistina), isolados e em combinação, além do grupo controle, sem medicação. Apenas no grupo que recebeu a combinação dos medicamentos é que se observou redução significativa de depósito amilóide cerebral, e nos grupos que receberam isoladamente não houve redução expressiva 4.
Os resultados propostos pelos estudos de Pedram Honarpisheh, em 2020, dizem respeito que a disfunção intestinal, com deposição amiloide, precede à cerebral. A desregulação da barreira epitelial intestinal produz agregação amiloide, que não é encontrada em autópsias intestinais de pacientes que não possuem DA 7.
Foi postulado, nesse estudo, que a agressão vascular e epitelial entérica pela agregação de substância amilóide, leva a fragilidade da barreira intestinal, marcada por redução da produção de muco e de E-caderina, ocorrendo, este processo antes da lesão cerebral. Há aumento também de citocinas e outros marcadores inflamatórios 7.
A pesquisa de restrição calórica em ratos, realizada por Laura M. Cox, em 2019, evidenciou que a colonização de bacterioides exacerba a deposição de Aβ Amilóide, bem como, o aumento do consumo de calorias aumenta a inflamação intestinal, favorecendo a redução da capacidade cognitiva 10.
Foi inferido também que os ratos portadores de DA, possuem maior vulnerabilidade à alterações à nível de sistema digestório, uma vez que foi observado que vias de disfunção da microbiota, como o metabolismo de aminoácidos, produção de antioxidantes e vitaminas, estava acompanhada de aumento de deposição amilóide 10. Ademais, os genes responsáveis pela produção aumentada de Isoleucina, produzia neurodegeneração relacionada à idade, nos animais testados. Outros genes relacionados ao aumento da inflamação intestinal, através da expressão de células inflamatórias, que também culminam em neurotoxicidade. Foi descrito que a senilidade está relacionada à disfunção da barreira intestinal, além de maior inflamação e liberação do sistema complemento. Todas as alterações foram minimizadas através de dieta restrita em calorias, no experimento realizado em ratos 10.
Outra pesquisa, deveras promissora, é a que foi concebida por Jared D. Hoffman, em 2019, a qual mostrou que a fibra Inulina induz o aumento da microbiota vantajosa e a redução da microbiota maléfica, além de minimizar a expressão de genes ligados à inflamação encefálica 13.
Os ratos cuja dieta possuía níveis elevados de Inulina, mostraram maior quantidade de Prevotella e Lactobacillus ssp, os quais estão interligados à homeostase e bom funcionamento de todo o sistema gastrointestinal e, por conseguinte, sistêmico, como metabolismo lipídico, sensibilização à insulina, eficiência das mitocôndrias 13. Foi postulado que a microbiota maléfica (incluindo: E. Coli; Turicibacter; Proteus), mostrou-se significativamente reduzida nos animais que estavam com suplementação de Inulina, em comparação aos do grupo controle. Outro achado foi relacionado à redução do quantitativo de Akkermansia spp., que leva ao aumento de enzimas degradadoras de mucina, reduzindo-a, e, portanto, enfraquecendo a barreira intestinal 13.
Os animais com suplemento de Inulina também apresentaram um considerável aumento de Scyll-Inositol, o qual inibe agregação amiloide; além de redução importante de Myo-Inositol no hipocampo, que induz inflamação e leva, deste modo, a lesões de SNC 13.
Outro estudo, dessa vez, em amostras de fezes de humanos, analisou a expressão genômica da glicoproteína P, considerado um indicador de funcionamento equilibrado do sistema gastrointestinal, em idosos de 108 instituições de lar permanente 17.
Foi constatado que as amostras fecais dos idosos portadores de DA, possuem menor expressão da glicoproteína P, além de haver menor sintetização de Butirato, a qual tem poder anti-inflamatório, fornece energia para as células epiteliais colônicas, fortalecimento da barreira hematoencefálica, além de função imunomodulatória 17.
Espécies bacterianas, como O. Splanchnicus; Odoribacter spp.; K. pneumoniae , B. fragilis, and E. lenta, foram encontradas em maior quantidade nos pacientes acometidos por DA, em conformidade com publicações anteriores. As bactérias que foram relacionadas ao aumento da expressão da glicoproteína P, são: Eubacterium, Clostridium, Butyrivibrio genera, que também, por sua vez, estão relacionadas à produção de Butirato. Em contrapartida, espécies, como Bacteroides dorei e Akkermansia glycaniphila, foram associados à inflamação intestinal 17.
A pesquisa, publicada por Zhen-Qian Zhuang, em 2018, também realizou análise a partir de amostras fecais de 43 pacientes portadores de DA e comparado com 43 pacientes não portadores, compatíveis em idade e gênero com o primeiro grupo. Foi encontrado que espécies de bactérias, como Bacteroides, Actinobacteria, Ruminococcus, Lachnospiraceae e Selenomonadales estavam em número aumentado no grupo dos idosos portadores de DA 24.
Algumas bactérias possuem papel na síntese cerebral de neurotransmissores, além de substâncias que marcam o bom funcionamento e de saúde cerebral, à exemplo da N-Acetilaspartate, relacionada ao Ruminococcus 24.
A publicação de Ling Zhang, de 2017, versou sobre a análise de amostras fecais de camundongos, inclusive acerca dos ácidos graxos de cadeia curta fecal, comparando-se dois grupos, sendo um selvagem, sem DA, e outro portador. Foi destacado que havia um número reduzido de ácidos graxos fecais, os quais foram relacionados à deposição amilóide 27.
O quantitativo de Ruminococcus e Butyricicoccus foi demonstrado deveras reduzido, em contraposição a Verrucomicrobia e Proteobacteria, além de B. pullicaecorum, que é um produtor de Butirato. Além disso, foi constatado que havia alteração no metabolismo de Butanoato e Piruvato 27.
Antibióticos, probióticos e dietas
A interação entre intestino e sistema nervoso central é considerada bidirecional, visto que, por meio do eixo intestino-cérebro há o desenvolvimento e manutenção das funções neuronais, enquanto que a disbiose intestinal pode ocasionar doenças neurológicas 34. Essa integração permite a comunicação entre a microbiota e o cérebro tanto por vias aferentes, citocinas e hormônios quanto por vias eferentes, as quais influenciam a composição microbiana, a fisiologia e a motilidade intestinal. Assim, torna-se possível a comunicação entre esses dois sistemas. A compreensão dessa relação favorece a identificação de novas estratégias terapêuticas 2.
No contexto de uso de antibióticos para avaliar a relação microbiota e Alzheimer, deve-se entender, primeiramente, que nem todos os antibióticos são capazes de ter efeitos no sistema nervoso central. A partir disso, estudos com a Minociclina, por exemplo, relataram seu potencial de atravessar a barreira hematoencefálica, além de inibir o processo de fosforilação da proteína tau, fibrilação do peptídeo beta-amilóide, a microglia pró-inflamatória e o dano e a morte neuronal 4. Outros estudos mostraram uma ruptura na barreira hematoencefálica no cérebro dos idosos e pacientes com Alzheimer, confirmando assim, a susceptibilidade a alguns fármacos 2,32. Enquanto isso, outros antibióticos, como o Metronidazol, também são detectáveis, porém a níveis muito baixos no cérebro, demonstrando, assim, que nem todos os antimicrobianos estão interligados nas alterações da microbiota na doença de Alzheimer 4.
No âmbito das estratégias terapêuticas do Alzheimer, também surge a opção de suplementação à base de probióticos, como forma de auxiliar na prevenção e no tratamento da doença. Essas bioterapias probióticas têm relevância na criação de um ambiente intestinal saudável, promovendo o equilíbrio das bactérias e a sua ação metabólica adequada 25,34. Estudos revelam que a suplementação de uma mistura probiótica em camundongos com doença de Alzheimer reduziu o estresse oxidativo, além de melhorar os problemas de saúde física, cognitiva e psicológica associados à doença, através da modulação da expressão de genes reguladores e elementos responsivos ao estresse oxidativo 2.
Enquanto isso, nos pacientes idosos diagnosticados com Alzheimer e com comprometimento cognitivo leve, os estudos clínicos mostraram que o leite probiótico suplementado melhorou a função cognitiva e o metabolismo da insulina 2. As pesquisas mostraram também que a suplementação de probióticos reduziu as ações dos marcadores pró-inflamatórios. Embora os resultados apontados sejam promissores, ainda se faz necessária uma maior quantidade de estudos que embasam o uso de suplementos alimentares à base de probióticos com a finalidade de melhorar o quadro clínico dos pacientes com Alzheimer 13.
Envelhecimento, dieta e estilo de vida sedentário, fatores ambientais, são alguns dos fatores que predispõem e agravam a patogênese da doença de Alzheimer. Nesse contexto, uma dieta pobre em nutrientes é capaz de contribuir para a modificação da composição da microflora do intestino, modulando a liberação de mediadores inflamatórios, visto que, sua estruturação depende diretamente da constituição dos carboidratos ingeridos. Os substratos dos componentes dessa dieta servem de energia e alimento para a sobrevivência da microbiota do hospedeiro 2.
Os carboidratos complexos, por exemplo, resistentes às enzimas digestivas do trato gastrointestinal humano, são suscetíveis ao processo de fermentação das colônias microbianas e os seus subprodutos metabólicos influenciam na saúde do hospedeiro. Os subprodutos metabólicos trazem impactos positivos ou negativos ao organismo humano. Inclusive, o CO2, CO, H2S, NH3 e ácidos graxos de cadeia curta exercem uma função essencial no âmbito saúde-doença, uma vez que regulam a homeostase da glicose, as vias inflamatórias, a resposta imune, o apetite e a supressão dos tumores 2.
Em relação à ingestão de inulina, que é uma fibra de carboidrato solúvel e não digerível, notou-se aumento do metabolismo sistêmico e redução da neuroinflamação. Além disso, evidências mostram a disfunção metabólica como fator contribuinte no processo de desenvolvimento da doença de Alzheimer de modo mais precoce. Tal fato demonstra a importância do uso de estratégias de intervenção nutricional que usam uma dieta prebiótica para acelerar, reduzindo o risco de neuroinflamação. Dessa forma, o tipo de alimentação consumida torna-se um fator relevante na regulação intestinal e evolução da patogênese da doença de Alzheimer 13.
Correlações entre: LPS, Depósito amilóide e Permeabilidade da Barreira Hematoencefálica
A deposição de substância amilóide, que consiste em um dos principais marcadores e achados encontrados na fisiopatologia da DA, está relacionada a alguns variados fatores, à exemplo de da produção de Lipopolissacarídeos (LPS), os quais fazem parte da constituição de bactérias gram negativas 27,36,38.
O LPS é normalmente produzido por bactérias que habitam o trato gastrointestinal saudável, no entanto, se há um desbalanço dessa produção, pode haver aumento sérico, se coexistir elevação da permeabilidade epitelial entérica 1,25,36. Portanto, LPS presente em amostra sanguínea, evidencia alterações de permeabilidade e disbiose,1,2,14,20,32 além de contribuir também para a maior permeabilidade da própria barreira intestinal,7,21,23 por redução da ativação do sistema de defesa da mucosa entérica 7,22.
Além disso, o próprio consumo de dietas mais ricas em gordura, também induzem a uma elevação do LPS, o qual passa a ser absorvido em maior quantidade, e por conseguinte, produz inflamação sistêmica e neurológica 23,25,24,32. Estudos em ratos demonstraram que a injeção de LPS no sistema ventricular de camundongos produziu lesões neurodegenerativas semelhantes às encontradas na DA 30. A produção de LPS também está até mesmo relacionada a expressão do fator inflamatório NF-Beta, corroborando com o componente inflamatório da doença 27,36. Os níveis plasmáticos de LPS em indivíduos portadores de DA foram colocados em alguns estudos até três vezes maior em comparação aos indivíduos sadios 30.
As alterações da composição da flora intestinal também estão associadas à maior acúmulo e deposição da própria substância amilóide 19,22-24. Algumas espécies de bactérias, como Proteobacteria, Bacteroidetes, Chloroflexi, Actinobacteria e Firmicutes, utilizam a proteína amiloide para diversas funções, inclusive para proteção contra o sistema imunológico do indivíduo hospedeiro 15,21.
A proteína é reconhecida pelo sistema imunológico, principalmente por NF-kb, TLR 1/2, Nod-like receptor-3 (NLRP3), CD14. A inflamação sistêmica, induzida pela quebra da integridade da mucosa intestinal, ativa a liberação de NF-kb, o que aumenta a deposição amilóide 21.
A inflamação entérica também se traduz, além das citocinas e dos outros mediadores inflamatórios, pelos estímulos aferentes e eferentes do Nervo Vago, os neurotransmissores associados, corroborando para o estado de inflamação e possui influência na mobilidade, secreção e fisiologia do sistema gastrointestinal 2,3,9,12,22. Por exemplo, a bactéria Lactobacillus rhamnosus 3,19 e Bifidobacterium 16 tem a capacidade de interferir na regulação de receptores gabaérgicos. Estudos clínicos evidenciaram indícios de melhora da função cognitiva em pacientes com DA após estímulos vagais, além de melhora em pessoas com depressão refratária 3,30.
A estimulação do reflexo do Nervo Vago pode desencadear na ativação macrofagocitária, o que está imbricada no desenvolvimento fisiopatológico de diversas doenças entéricas 14. Outros estudos evidenciaram efeitos do aumento de transtornos psiquiátricos na ablação do Nervo Vago, que antes era utilizada para tratamento de doença ulcerosa péptica 14. Pesquisas em ratos mostraram que estimulações gastrointestinais influenciaram no sistema de recompensa 14.
Os metabólitos secundários das bactérias intestinais, como os ácidos graxos de cadeia curta, estimulam as células neuroendócrinas intestinais a produzir neuropeptídeos, e neurotransmissores que alteram funções cerebrais 14,22,23.
A permeabilidade da barreira hematoencefálica (BHE), ao contrário do que se postulava há alguns anos, mostra-se hoje, como uma estrutura suscetível à invasão de diversas moléculas e organismos, como até mesmo bactérias 17,32. Há evidências de que em animais cuja permeabilidade intestinal esteja alterada haveria também maior permeabilidade da BHE, sugerindo, deste modo, que haja correlação entre a permeabilidade das duas barreiras 22,32.
CONCLUSÃO
A relação entre o desenvolvimento e a progressão da Doença de Alzheimer e alterações à nível de microbiota gastrointestinal, bem como as implicações fisiopatogênicas por elas desencadeadas sugerem, como analisado em estudos recentes, que existem caminhos factíveis que podem confirmar tal associação. Entretanto, novas pesquisas devem ser empreendidas no sentido de verificar as hipóteses, quantificar as evidências, e assim, obter-se resultados e explicações plenamente elucidativas e confirmatórias.
As perspectivas advindas de tal teoria reforçam a necessidade da evolução das pesquisas dos medicamentos, probióticos e dietas, que possam prevenir ou tratar a disbiose, e deste modo, influenciar na prevenção ou retardo da DA.
REFERÊNCIAS
[1]. The Gut-Brain Axis: How Microbiota and Host Inflammasome Influence Brain Physiology and Pathology. Rutsch A, Kantsjö JB, Ronchi F. Front Immunol. 2020 Dec 10;11:604179. doi: 10.3389/fimmu.2020.604179. eCollection 2020. PMID: 33362788 Free PMC article. Review.
[2]. Role of gut-brain axis, gut microbial composition, and probiotic intervention in Alzheimer’s disease. Kesika P, Suganthy N, Sivamaruthi BS, Chaiyasut C. Life Sci. 2021 Jan 1;264:118627. doi: 10.1016/j.lfs.2020.118627. Epub 2020 Oct 22. PMID: 33169684 Review.
[3]. Do the Bugs in Your Gut Eat Your Memories? Relationship between Gut Microbiota and Alzheimer’s Disease. Borsom EM, Lee K, Cope EK. Brain Sci. 2020 Nov 3;10(11):814. doi: 10.3390/brainsci10110814. PMID: 33153085 Free PMC article. Review.
[4]. Synergistic depletion of gut microbial consortia, but not individual antibiotics, reduces amyloidosis in APPPS1-21 Alzheimer’s transgenic mice. Dodiya HB, Frith M, Sidebottom A, Cao Y, Koval J, Chang E, Sisodia SS. Sci Rep. 2020 May 18;10(1):8183. doi: 10.1038/s41598-020-64797-5. PMID: 32424118 Free PMC article.
[5]. Investigation of Potential Brain Microbiome in Alzheimer’s Disease: Implications of Study Bias. Westfall S, Dinh DM, Pasinetti GM. J Alzheimers Dis. 2020;75(2):559-570. doi: 10.3233/JAD-191328. PMID: 32310171
[6]. The Links Between the Gut Microbiome, Aging, Modern Lifestyle and Alzheimer’s Disease. Askarova S, Umbayev B, Masoud AR, Kaiyrlykyzy A, Safarova Y, Tsoy A, Olzhayev F, Kushugulova A. Front Cell Infect Microbiol. 2020 Mar 18;10:104. doi: 10.3389/fcimb.2020.00104. eCollection 2020. PMID: 32257964 Free PMC article. Review.
[7]. Dysregulated Gut Homeostasis Observed Prior to the Accumulation of the Brain Amyloid-β in Tg2576 Mice. Honarpisheh P, Reynolds CR, Blasco Conesa MP, Moruno Manchon JF, Putluri N, Bhattacharjee MB, Urayama A, McCullough LD, Ganesh BP. Int J Mol Sci. 2020 Mar 3;21(5):1711. doi: 10.3390/ijms21051711. PMID: 32138161 Free PMC article.
[8]. The progress of gut microbiome research related to brain disorders. Zhu S, Jiang Y, Xu K, Cui M, Ye W, Zhao G, Jin L, Chen X. J Neuroinflammation. 2020 Jan 17;17(1):25. doi: 10.1186/s12974-020- 1705-z. PMID: 31952509 Free PMC article. Review.
[9]. A Review of the Brain-Gut-Microbiome Axis and the Potential Role of Microbiota in Alzheimer’s Disease. Sun M, Ma K, Wen J, Wang G, Zhang C, Li Q, Bao X, Wang H. J Alzheimers Dis. 2020;73(3):849-865. doi: 10.3233/JAD-190872. PMID: 31884474
[10]. Calorie restriction slows age-related microbiota changes in na Alzheimer’s disease model in female mice. Cox LM, Schafer MJ, Sohn J, Vincentini J, Weiner HL, Ginsberg SD, Blaser MJ. Sci Rep. 2019 Nov 29;9(1):17904. doi: 10.1038/s41598-019-54187-x. PMID: 31784610 Free PMC article.
[11]. Gut Microbiota in Neurological Disorders. Grochowska M, Laskus T, Radkowski M. Arch Immunol Ther Exp (Warsz). 2019 Dec;67(6):375-383. doi: 10.1007/s00005-019-00561-6. Epub 2019 Oct 1. PMID: 31578596 Free PMC article. Review.
[12]. Microbiome Influence in the Pathogenesis of Prion and Alzheimer’s Diseases. ‘Argenio V, Sarnataro D. Int J Mol Sci. 2019 Sep 23;20(19):4704. doi: 10.3390/ijms20194704. PMID: 31547531 Free PMC article. Review.
[13]. Dietary inulin alters the gut microbiome, enhances systemic metabolism and reduces neuroinflammation in an APOE4 mouse model. Hoffman JD, Yanckello LM, Chlipala G, Hammond TC, McCulloch SD, Parikh I, Sun S, Morganti JM, Green SJ, Lin AL. PLoS One. 2019 Aug 28;14(8):e0221828. doi: 10.1371/journal.pone.0221828. eCollection 2019. PMID: 31461505 Free PMC article.
[14]. The Microbiota-Gut-Brain Axis. Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, Codagnone MG, Cussotto S, Fulling C, Golubeva AV, Guzzetta KE, Jaggar M, Long-Smith CM, Lyte JM, Martin JA, Molinero-Perez A, Moloney G, Morelli E, Morillas E, O’Connor R, Cruz-Pereira JS, Peterson VL, Rea K, Ritz NL, Sherwin E, Spichak S, Teichman EM, van de Wouw M, Ventura-Silva AP,Wallace- Fitzsimons SE, Hyland N, Clarke G, Dinan TG. Physiol Rev. 2019 Oct 1;99(4):1877-2013. doi: 10.1152/physrev.00018.2018. PMID: 31460832
[15]. Alzheimer’s disease and symbiotic microbiota: an evolutionary medicine perspective. Fox M, Knorr DA, Haptonstall KM. Ann N Y Acad Sci. 2019 Aug;1449(1):3-24. doi: 10.1111/nyas.14129. Epub 2019 Jun 10. PMID: 31180143 Review.
[16]. Modification of the gut microbiome to combat neurodegeneration. Sasmita AO. Rev Neurosci. 2019 Nov 26;30(8):795-805. doi: 10.1515/revneuro-2019- 0005. PMID: 31095511 Review.
[17]. Alzheimer’s Disease Microbiome Is Associated with Dysregulation of the Anti-Inflammatory P-Glycoprotein Pathway. Haran JP, Bhattarai SK, Foley SE, Dutta P, Ward DV, Bucci V, McCormick BA. mBio. 2019 May 7;10(3):e00632-19. doi: 10.1128/mBio.00632-19. PMID: 31064831 Free PMC article.
[18]. The role of gut microbiota in pathogenesis of Alzheimer’s disease. Bostanciklioğlu M. J Appl Microbiol. 2019 Oct;127(4):954-967. doi: 10.1111/jam.14264. Epub 2019 Apr 15. PMID: 30920075 Review.
[19]. Associations Between Gut Microbiota and Alzheimer’s Disease: Current Evidences and Future Therapeutic and Diagnostic Perspectives. Shen L, Ji HF. J Alzheimers Dis. 2019;68(1):25-31. doi: 10.3233/JAD-181143. PMID: 30814354 Review.
[20]. Gut microbiota in common elderly diseases affecting activities of daily living.Shimizu Y. World J Gastroenterol. 2018 Nov 14;24(42):4750-4758. doi: 10.3748/wjg.v24.i42.4750. PMID: 30479462 Free PMC article. Review.
[21]. The Gut-Brain Axis in Alzheimer’s Disease and Omega-3. A Critical Overview of Clinical Trials. La Rosa F, Clerici M, Ratto D, Occhinegro A, Licito A, Romeo M, Iorio CD, Rossi P. Nutrients. 2018 Sep 8;10(9):1267. doi: 10.3390/nu10091267. PMID: 30205543 Free PMC article. Review.
[22]. Unhealthy gut, unhealthy brain: The role of the intestinal microbiota in neurodegenerative diseases. Spielman LJ, Gibson DL, Klegeris A. Neurochem Int. 2018 Nov;120:149-163. doi: 10.1016/j.neuint.2018.08.005. Epub 2018 Aug 14. PMID: 30114473 Review.
[23]. Interplay among gut microbiota, intestinal mucosal barrier and enteric neuro-immune system: a common path to neurodegenerative diseases? Pellegrini C, Antonioli L, Colucci R, Blandizzi C, Fornai M. Acta Neuropathol. 2018 Sep;136(3):345-361. doi: 10.1007/s00401-018- 1856-5. Epub 2018 May 24. PMID: 29797112 Review.
[24]. Gut Microbiota is Altered in Patients with Alzheimer’s Disease. Zhuang ZQ, Shen LL, Li WW, Fu X, Zeng F, Gui L, Lü Y, Cai M, Zhu C, Tan YL, Zheng P, Li HY, Zhu J, Zhou HD, Bu XL, Wang YJ. J Alzheimers Dis. 2018;63(4):1337-1346. doi: 10.3233/JAD-180176. PMID: 29758946
[25]. Human Gut Microbiota in Health and Alzheimer’s Disease. Szablewski L. J Alzheimers Dis. 2018;62(2):549-560. doi: 10.3233/JAD-170908. PMID: 29480188 Review.
[26]. The Biased G-Protein-Coupled Receptor Agonism Bridges the Gap between the Insulin Receptor and the Metabolic Syndrome. Liauchonak I, Dawoud F, Riat Y, Qorri B, Sambi M, Jain J, Kalaydina RV, Mendonza N, Bajwa K, Szewczuk MR. Int J Mol Sci. 2018 Feb 17;19(2):575. doi: 10.3390/ijms19020575. PMID: 29462993 Free PMC article. Review.
[27]. Altered Gut Microbiota in a Mouse Model of Alzheimer’s Disease. Zhang L, Wang Y, Xiayu X, Shi C, Chen W, Song N, Fu X, Zhou R, Xu YF, Huang L, Zhu H, Han Y, Qin C. J Alzheimers Dis. 2017;60(4):1241-1257. doi: 10.3233/JAD-170020. PMID: 29036812
[28]. Microbiome, probiotics and neurodegenerative diseases: deciphering the gut brain axis. Westfall S, Lomis N, Kahouli I, Dia SY, Singh SP, Prakash S. Cell Mol Life Sci. 2017 Oct;74(20):3769-3787. doi: 10.1007/s00018-017- 2550-9. Epub 2017 Jun 22. PMID: 28643167 Review.
[29]. Intestinal microbial dysbiosis aggravates the progression of Alzheimer’s disease in Drosophila. Wu SC, Cao ZS, Chang KM, Juang JL. Nat Commun. 2017 Jun 20;8(1):24. doi: 10.1038/s41467-017-00040-6. PMID: 28634323 Free PMC article.
[30]. The Gut Microbiota and Alzheimer’s Disease. Jiang C, Li G, Huang P, Liu Z, Zhao B. J Alzheimers Dis. 2017;58(1):1-15. doi: 10.3233/JAD-161141. PMID: 28372330 Review.
[31]. Human gut microbiota: the links with dementia development. Alkasir R, Li J, Li X, Jin M, Zhu B. Protein Cell. 2017 Feb;8(2):90-102. doi: 10.1007/s13238-016-0338-6. Epub 2016 Nov 19.PMID: 27866330 Free PMC article. Review.
[32]. Alzheimer’s disease and gut microbiota. Hu X, Wang T, Jin F. Sci China Life Sci. 2016 Oct;59(10):1006-1023. doi: 10.1007/s11427-016- 5083-9. Epub 2016 Aug 26.PMID: 27566465 Review.
1Acadêmico do Curso de Medicina do Centro Universitário Unifacisa, Campina Grande,Paraíba, Brasil;
2Acadêmico do Curso de Medicina do Centro Universitário de João Pessoa (UNIPÊ), João Pessoa, Paraíba, Brasil;
3Acadêmico do Curso de Medicina da Universidade Federal de Campina Grande (UFCG), Campina Grande, Paraíba, Brasil;
4Médica formada pelo Centro Universitário Unifacisa, Campina Grande , Paraíba, Brasil;
5Médica formada pelo Centro Universitário de João Pessoa (UNIPÊ), João Pessoa, Paraíba, Brasil;
6Neurologista do Centro de Referência em Esclerose Múltipla do Estado da Paraíba (CREMPB) e Docente do Curso de Medicina do Centro Universitário de João Pessoa (UNIPÊ), João Pessoa, Paraíba, Brasil. E-mail para contato: ararunadias@gmail.com
