GESTATIONAL DISORDERS: A STUDY ON HYDATIDIFORM MOLE
REGISTRO DOI: 10.69849/revistaft/ni10202411210721
Gabriela de Andrade Guarnieri1; Giovanna Gondin Pereira1; Ian Barone Fernandes1; Kainan Roberto Alvares1; Janaina Mendes Ferreira2
RESUMO
A mola hidatiforme (MH) é uma doença gestacional trofoblástica caracterizada pela proliferação anormal do trofoblasto, resultando em crescimento desorganizado das vilosidades coriônicas. Ela pode ser classificada como completa ou parcial e está associada a um risco aumentado de neoplasia trofoblástica. Este artigo foca nos distúrbios gestacionais, com ênfase na MH, explorando os fatores etiológicos, diagnóstico e opções de tratamento. O objetivo principal é evidenciar a MH como um distúrbio gestacional de alto risco, buscando aprimorar as abordagens diagnósticas e terapêuticas. A metodologia utilizada consistiu em uma revisão bibliográfica rigorosa que abrange todos os aspectos relacionados à patologia. Conclui-se que o acesso à informação sobre a MH é crucial, especialmente considerando o aumento dos casos, o que destaca a necessidade de um acompanhamento e tratamento adequados para essas pacientes
Descritores: Gestação; Distúrbios gestacionais; Mola hidatiforme; neoplasia trofoblástica.
ABSTRACT
Hydatidiform mole (HM) is a gestational trophoblastic disease characterized by abnormal proliferation of trophoblasts, resulting in disorganized growth of chorionic villi. It can be classified as complete or partial and is associated with an increased risk of trophoblastic neoplasia. This article focuses on gestational disorders, with an emphasis on HM, exploring etiological factors, diagnosis, and treatment options. The primary objective is to highlight HM as a high-risk gestational disorder, seeking to enhance diagnostic and therapeutic approaches. The methodology employed involved a rigorous literature review covering all aspects related to the pathology. It concludes that access to information about HM is crucial, especially given the rising number of cases, underscoring the need for appropriate monitoring and treatment for these patients.
KEYWORDS: Gestation; Gestational disorders; Hydatidiform mole; Trophoblastic neoplasia.
INTRODUÇÃO
Distúrbios gestacionais referem-se a uma variedade de condições médicas que podem afetar a gravidez, representando um desafio significativo para a saúde materna e fetal. Desde complicações comuns, como a pré-eclâmpsia, diabetes gestacional e gravidez ectópica, até condições mais raras, como a MH, esses distúrbios podem ter sérias implicações para a mãe e o bebê em desenvolvimento. Durante a gestação, o corpo passa por uma série de mudanças fisiológicas complexas para acomodar o crescimento do feto e sustentar uma gravidez saudável. No entanto, em algumas circunstâncias, esses processos podem ser interrompidos ou comprometidos, resultando em distúrbios gestacionais que exigem intervenção médica1.
Um dos distúrbios gestacionais mais graves, embora menos conhecidos, é a MH. Esta patologia é caracterizada por um desenvolvimento anormal do trofoblasto, resultando na formação de cistos líquidos em detrimento de um feto saudável. Existem duas variantes principais de MH: a completa, na qual não há formação fetal e o tecido placentário se desenvolve de forma irregular, e a parcial, caracterizada por uma combinação de desenvolvimento anômalo do tecido placentário e fetal. A MH demanda intervenção terapêutica imediata, pois pode evoluir para uma condição cancerosa (MH invasiva), com potencial de disseminação metastática para outros órgãos2, 3.
A doença trofoblástica gestacional é um distúrbio caracterizado pela proliferação de células anormais do tecido trofoblástico. Apresenta o quadro clínico benigno retratado pela MH parcial (MHP) e a MH completa (MHC), podendo também serem classificadas de formas malignas como neoplasia trofoblástica aguda (NTG) em mola invasora e metastática, coriocarcinoma maligno, tumor trofoblástico do sítio placentário (TTSP) e tumor trofoblástico epitelioide (TTE)3,4.
A epidemiologia deste transtorno acomete cerca de 1:200 mulheres no Brasil. Entre os fatores de risco estão os históricos de abortos espontâneos de repetição, relatos de infertilidade e, principalmente, ter sido acometida por uma gravidez molar anterior. Além disso, mulheres com idade avançada possuem maiores chances de desenvolver a MH, mesmo que a faixa etária não seja uma condição de risco4,5,6.
METODOLOGIA
Para se analisar os dados relacionados a doença trofoblástica gestacional foram utilizados artigos científicos realizando-se uma revisão bibliográfica extensa, sendo empregado fontes como Google acadêmico, PubMed e Scopus. A seleção dos artigos foi feita de forma meticulosa utilizando palavras-chave como Gestação Molar, Mola hidatiforme, Tratamento, Aspectos clínicos, de maneira que fosse filtrado por data entre 2010 e 2024 sempre visando os mais atualizados que abordassem de forma clara e bem formulada a respeito da MH e seus diferentes tipos. A análise dos artigos englobou também a avaliação da qualidade metodológica, consistência dos resultados e relevância para os objetivos do estudo. As informações foram condensadas e expostos de maneira a fornecer uma compreensão extensa das indagações a respeito da doença trofoblástica gestacional (DTG).
OBJETIVO
Este trabalho tem como objetivo explorar os desafios impostos pelos distúrbios gestacionais, como a MH, para a saúde materna e fetal. Pretende-se evidenciar a importância do diagnóstico precoce e do tratamento adequado, além de destacar a necessidade de maior conscientização. O estudo também visa identificar limitações devido à escassez de dados clínicos e a necessidade de pesquisas mais aprofundadas sobre as variantes da MH. O objetivo final é contribuir para um melhor entendimento e manejo desses distúrbios, promovendo desfechos mais positivos para as gestantes.
REVISÃO DA LITERATURA
Mola hidatiforme: etiologia
Estudos indicam que a MH completa diploide (MHC) ocorre quando um oócito anucleado é fertilizado por um espermatozoide haploide que se duplica, resultando em genes apenas paternos 46XX5,6.
A MH haploide é uma forma menos comum da condição, caracterizada pela presença de um conjunto haploide de cromossomos. Isso pode ocorrer quando o óvulo é fertilizado por um espermatozoide normal, mas o material genético do óvulo é perdido ou inativado. Nesse caso, o desenvolvimento do tecido trofoblástico é anormal, levando à formação de uma MH, porém, com apenas metade do material genético usual, resultando em um embrião inviável5,6.
Por outro lado, a MH diploide, ocorre quando o óvulo anucleado é fertilizado por um espermatozoide que duplica seu material genético. Esta condição resulta em um tecido trofoblástico com uma composição genética completa, mas exclusivamente paterna, resultando em uma proliferação anômala das células trofoblásticas. A presença de um genoma diploide, composto unicamente por genes paternos, é um fator chave para a formação da mola MHC, e a ausência de genes maternos impede o desenvolvimento normal do embrião6,7.
Na MHC, o processo de fertilização do oócito sofre uma mutação em que os genes maternos são depletados, mantendo-se apenas os genes paternos no desenvolvimento embrionário. Essa alteração genética desencadeia a proliferação exacerbada das células trofoblásticas, caracterizando a MHC. Existe um pequeno número de pacientes que apresentam uma predisposição hereditária, de origem autossômica recessiva, para MHC recorrente. Em casos assim, as mutações ocorrem em genes maternos como o NLRP7 e o KHDC3L, que possuem origem biparental diploide, sendo diferente da MHC esporádica, que é de origem androgenética típica6,7.
A MHP triploide pode ser causada pela falha na divisão meiótica no processo de gametogênese, gerando um espermatozoide diploide ou uma fertilização de um óvulo normal por dois espermatozoides – dispermia. Possui genes do pai e da mãe, porém está normalmente com 46 cromossomos do pai e 23 da mãe, resultando em um gameta com 69 cromossomos. A MHP é o único tipo de doença trofoblástica gestacional (DTG) que está associado à presença de um feto, com atividade cardíaca fetal, em algum momento da gestação 47,8.
Mulheres que tiveram uma MH anteriormente têm um risco aumentado de desenvolver a condição em gestações subsequentes. Além disso, mulheres com histórico de abortos espontâneos ou gestações molas também podem ter um risco elevado3.
Um aumento no risco de gestação molar é encontrado em mulheres acima de 45 anos, em jovens com idade abaixo de 16 anos, em gestações subsequentes a uma molar (aumento de 1% após uma gestação e de 15% a 20% após duas) e em mulheres com história pregressa de abortamentos espontâneos4.
Anormalidades cromossômicas, como a duplicação do genoma paterno, são comumente associadas a essa condição gestacional. Esta duplicação pode ocorrerdurante a fertilização, como no caso da fertilização de um óvulo por dois espermatozoides, ou durante a divisão celular inicial do embrião. Além disso, mutações genéticas hereditárias ou adquiridas podem aumentar o risco de MH, interferindo no desenvolvimento normal do embrião e da placenta4,9.
Mutação genética hereditária refere-se a alterações no DNA transmitidas de pais para filhos, predispondo o embrião a anomalias genéticas. Por exemplo, mutações em genes relacionados ao ciclo celular podem desequilibrar a gestação, favorecendo a ocorrência de MH. Já mutações genéticas adquiridas, ocorridas durante a vida, podem aumentar o risco da condição, influenciadas por fatores ambientais como exposição a substâncias tóxicas ou radiação4,6.
Outros fatores, como deficiências nutricionais, têm sido associados ao aumento do risco de MH. Baixo consumo de caroteno e vitamina A, bem como a exposição a agentes ambientais tóxicos, como produtos químicos ou radiação, podem contribuir para o desenvolvimento da condição4,10.
Manifestações clínicas
As manifestações clínicas predominantes associadas à MH incluem sangramento transvaginal, observado em aproximadamente 50% dos casos, caracterizado por uma grande variação de intensidades e tonalidades, acompanhada de pré-eclâmpsia antes da 20ª semana de gestação. Contudo, é importante ressaltar que uma minoria das pacientes apresenta modificações hematológicas significativas, como hemoglobina abaixo de 10g/dL. Adicionalmente, o crescimento uterino acelerado, resultado da hiperplasia trofoblástica, é observado em cerca de 20% a 50% dos casos. Em adição, a presença de cistos tecalúteos, diagnosticada em aproximadamente 20% das pacientes, reflete uma hiperestimulação ovariana pelo nível alto de hCG, potencialmente induzindo a complicações como torção ou ruptura ovariana6,12.
Sintomas menos frequentes abrangem a hiperêmese gravídica, decorrente de alterações dos níveis de estrógeno, progesterona e gonadotrofina coriônica. O hipertiroidismo, que ocorre em 5% das gravidas, onde o nível de hCG está maior que 400.000 mUI/mL e o nível de TSH estão menores que 0,01mU/L, as mulheres apresentam sintomas como tremores, fraqueza, sudorese, ansiedade e perda de peso12,13.
Outra complicação que pode surgir é a ocorrência de doenças trofoblásticas gestacionais persistentes, que ocorrem em aproximadamente 15% dos casos de mola hidatiforme completa. Essa condição se caracteriza pela invasão do tecido trofoblástico na parede uterina e pode levar a complicações mais graves, como hemorragias e necessidade de tratamento oncológico. Os sintomas podem incluir dor abdominal, além de sinais de anemia, resultantes de hemorragias internas. O monitoramento rigoroso dos níveis de hCG após a remoção da mola é crucial para detectar qualquer persistência da doença12,13.
Diagnóstico
Na MH, os níveis hormonais de gonadotrofina coriônica humana (hCG) estão significativamente elevados, excedendo 100.000 mUI/mL em muitos casos. O hormônio hCG é uma proteína produzida pela placenta, composta por duas partes: alfa e beta. A parte alfa é semelhante às regiões alfa de diferentes hormônios produzidos pela hipófise, como FSH, LH e TSH, o que pode causar resultados imprecisos em testes laboratoriais devido à reação cruzada. Além disso, níveis elevados de hCG podem agir de forma semelhante ao FSH e LH nos ovários, levando ao aumento deles (formação de cistos tecaluteínicos) e ao aumento do TSH na tireoide (hipertireoidismo). A parte beta, por outro lado, é específica do hCG14.
Contudo, o diagnóstico definitivo da MH é geralmente realizado por meio de exames de imagem, como a Ultrassonografia (US), onde 90% dos casos são confirmados. Durante a US, certas características específicas das diferentes molas podem ser identificadas, reforçando a suspeita diagnóstica14.
O diagnóstico por imagem pode ser realizado por US pélvica transvaginal, radiografia e tomografia computadorizada de tórax, tomografia de abdome total, ressonância nuclear magnética do cérebro e tomografia por emissão de pósitrons (PET-CT)15,16.
Na MHC há um crescimento anormal do tecido trofoblasto sem o desenvolvimento do embrião, no ultrassom sua imagem diferencia conforme a idade gestacional. Nos estágios iniciais, a MHC pode parecer com gestações anembrionadas ou abortos retidos. À medida que a gestação avança, após 10 semanas, os resultados de imagem típicos de MHC incluem uma aparência heterogênea no material intrauterino, com múltiplas estruturas císticas ou vesiculares15.
No entanto, a MHP é caracterizada pela presença de vacúolo placentário e um embrião malformado. O período ideal para o diagnóstico é a partir do terceiro mês de gestação, momento em que são observados espaçamentos placentários com áreas císticas. Quando o feto está vivo, são examinadas alterações relacionadas à triploidia, que envolve a restrição de crescimento fetal e alterações placentárias. Entretanto, na maior parte dos casos de MHP não é diagnosticada pela US, somente com o exame de anatomia patológica12,15.
A US transvaginal com Dopplerfluxometria tem como objetivo a análise de uma nova gestação ou a presença de restos molares após a realização da técnica de esvaziamento incompleta, além da diferenciação diagnóstica com outras anomalias malignas pélvicas11.
Enquanto a radiografia e a tomografia de tórax são importantes para a análise de metástases e micro metástases pulmonares em todos os pacientes com neoplasia trofoblastica gestacional (NTG) pós-molar, a tomografia de abdome total é utilizada para avaliação de metástases especialmente em fígado e rins, principalmente nos pacientes positivados para metástases pulmonares. Como a disseminação das metástases pode ocorrer por via hematogênica, faz-se necessário a realização da ressonância magnética cerebral, principalmente em casos de quimiorresistência e recidiva para identificação de sítios de manutenção da produção de hCG14.
A anatomia patológica também se apresenta como um método de diagnóstico de elevada capacidade, no qual geralmente se procede ao esvaziamento uterino, que envolve a remoção cuidadosa do conteúdo uterino através de um dispositivo de aspiração sob orientação ultrassonográfica ou histeroscopia, para a realização dos estudos de citologia e histopatologia visando identificar a MH. Alguns médicos incluem exames complementares, tais como análises genéticas e imuno-histoquímica13. Uma vez diagnosticada, a paciente é encaminhada para o tratamento adequado. A abordagem terapêutica varia de acordo com a gravidade da condição e o desejo reprodutivo da paciente14.
Tratamento e prognóstico
Assim que feita a identificação da MH, é de extrema importância e relevância para que se receba um tratamento adequado, o encaminhamento ao Centro de Referência, assim sendo indicado pela Federação Brasileira das Associações de Ginecologia e Obstetrícia, junto da Associação Brasileira de Doença Trofoblastica Gestacional (DTG). Estudos indicam que pacientes com DTG que são encaminhadas aos Centros de Referência (CR), tem dez vezes menor morbidade e mortalidade além de um melhor controle dos sintomas clínicos e menores complicações durante o tratamento. Existem espalhados pelo Brasil diversos CR localizados nas regiões sul, sudeste, centro-oeste, norte e nordeste do país. Em sua grande maioria são gratuitos e vinculados ao Sistema Único de Saúde, reunindo médicos com grande experiência na área e prontos a exercer a melhor conduta possível13,18.
A primeira conduta a ser tomada no tratamento é o esvaziamento uterino. O método mais utilizado é a vácuo aspiração elétrica para pacientes com desejo reprodutivo pelo fato de ter menor risco de lesões uterinas como perfurações ou sinequias, diferente da curetagem uterina, um método mais invasivo possivelmente lesivo. É de extrema importância o esvaziamento total do útero para que não ocorra sequelas e possíveis metástases malignas12.
Com o objetivo de garantir a qualidade no procedimento, é de rotina o Ultrassom pré e pós-operatório e a infusão de ocitocinas no início do procedimento para facilitar e minimizar o risco de perfuração intrauterina. As ocitocinas promovem a contração da musculatura uterina e dilatam o canal vaginal, sendo muito eficaz na prevenção de acidentes. Normalmente usados uma dose de 20 U em 500 ml de soro fisiológico ou soro glicosado 5%, infundindo 20 a 30 gotas/minuto. Na eventualidade de algum acidente, deve-se interromper a cirurgia e dar início a uma laparotomia12,17.
Os cuidados pré-operatórios que devem ser observados são baseados, além de uma anamnese detalhada e um exame físico, na realização de exames laboratoriais como hemograma, EAS, ALT, AST, HCG e tipagem sanguínea, pois o hemograma consegue verificar a serie vermelha da paciente, devido a hemorragias que ela pode apresentar como sintoma da doença, os outros exames hormonais são necessários para acompanhar riscos de a paciente ter uma hipertensão e se necessário a transfusão sanguínea. Algumas pacientes podem apresentar hipertiroidismo devido a consequências da MH, assim sendo necessário uma dosagem de hormônio TSH pré e pós-operatório. Normalmente há remissão espontânea do hipertiroidismo após 2 a 3 meses após o esvaziamento uterino. Também são realizados exames de imagem como Raio X de tórax e US como já citado, além do eletrocardiograma para avaliação das funções cardíacas12,15.
Na ocorrência de uma evolução da doença para uma NTG, o tratamento é baseado no seu grau de risco: para sistematizar as descrições dos tumores, é usada a classificação da Federação Internacional de Ginecologia e Obstetrícia (FIGO) tumores de baixo risco ou Estádio anatômico FIGO I, II e III e tumores de alto risco com Estádio anatômico FIGO IV. Para Figo I, I III é recomendada a utilização de monoquimioterapia (agente único) e para FIGO IV, poliquimioterapia (múltiplos agentes)19,20.
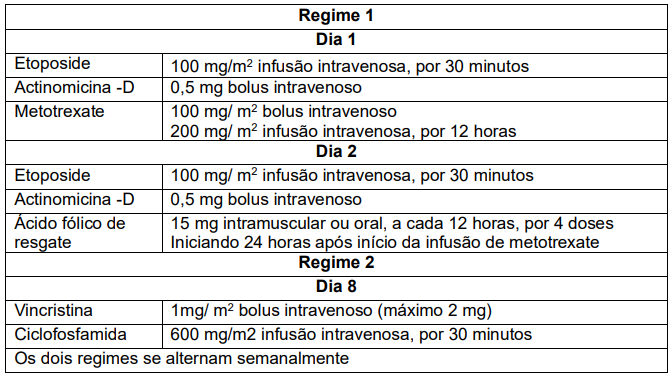
As principais drogas de baixa toxicidade no tratamento da NTG de baixo risco são o Metotrexato (MTX) e actinomicina D (Act-D). Algumas condições são contraindicadas para a utilização delas como hepatopatias, nefropatias e cistos tecaluteínicos ovarianos volumosos. Para o tratamento quimioterápico de alto risco, a combinação de drogas deve contar com etoposide, metotrexato (MTX) e actinomicina D (ActD), ciclofosfamida e vincristina, combinadas de formas diferentes em dias específicos do ciclo quimioterápico, conforme tabela15.
Faz-se necessária a utilização de anticoncepcionais durante a utilização dos agentes quimioterápicos com objetivo evitar uma gestação e para promover a proteção ovariana da toxicidade medicamentosa, principalmente em mulheres em idade fértil11.
A tabela 1 apresenta o uso de diferentes drogas quimioterápicas utilizadas no tratamento de neoplasias trofoblásticas gestacionais (NTG), especificamente em situações de alto risco. O tratamento envolve uma combinação de agentes como etoposide, metotrexato (MTX), actinomicina D (ActD), ciclofosfamida e vincristina. Esses fármacos são administrados em dias específicos dentro de um ciclo quimioterápico, de maneira alternada e cuidadosamente planejada, para maximizar a eliminação das células trofoblásticas anormais enquanto se minimizam os efeitos colaterais. As drogas de baixa toxicidade, como o metotrexato e a actinomicina D, são especialmente indicadas para casos de baixo risco. No regime de alto risco, a administração de etoposide e ciclofosfamida é combinada a esses agentes em ciclos específicos, oferecendo uma abordagem mais agressiva para combater a doença20, 21. (Tabela I). Drogas quimioterápicas 20
Considerações finais
Conclui-se que os distúrbios gestacionais, como a Mola Hidatiforme (MH), são particularmente graves devido à proliferação anormal de células trofoblásticas, influenciados por fatores como anomalias cromossômicas, mutações genéticas e níveis elevados de hCG. É fundamental que tanto as pacientes quanto os médicos analisem cuidadosamente as manifestações clínicas, pois todas as gestantes devem estar cientes de sintomas como sangramento vaginal e crescimento uterino anormal. O diagnóstico precoce, especialmente por meio de ultrassonografia, é crucial para a realização do tratamento adequado, que inclui esvaziamento uterino e cuidados especializados. Assim, a conscientização e o acesso ao tratamento são essenciais para mitigar os riscos associados a esses distúrbios gestacionais, destacando a necessidade de um enfoque proativo na saúde materna.
REFERÊNCIAS BIBLIOGRÁFICAS:
1. Pedraza DF, Lins ACL. Complicações clínicas na gravidez: uma revisão sistemática de estudos com gestantes brasileiras. Cien Saude Colet [Internet]. 2019 dez [citado 2024 mar 26]. Disponível em: http://cienciaesaudecoletiva.com.br/artigos/complicacoes-clinicas-na-gravidezuma-revisao-sistematica-de-estudos-com-gestantesbrasileiras/17454?id=17454
2. Almeida LO, Sousa EM, Ribeiro AC, Cavalcante DI, Feitosa FE, Coelho RA. MH parcial e completa: características clínicas e histológicas. Rev Med UFC. 2019 out-dez;59(4):46-50.
3. Lurain JR. Gestational trophoblastic disease: epidemiology, pathology, clinical presentation and diagnosis of gestational trophoblastic disease, and management of hydatidiform mole [Internet]. 2010 [citado 2024 mar 26]. Disponível em: https://www.ajog.org/article/S0002-9378(10)00853-7/fulltext
4. Braga A, Obeica B, Moraes V, Da Silva EP, Amim-Junior J, Rezende-Filho J. Doença trofoblástica gestacional. Rev Hosp Univ Pedro Ernesto [Internet]. 29 jul 2014 [citado 9 mar 2024];13(3).
5. Sun SY, Melamed A, Joseph NT, Gockley AA, Goldstein DP, Bernstein MR, et al. Clinical presentation of complete hydatidiform mole and partial hydatidiform mole at a regional trophoblastic disease center in the United States over the past 2 decades. Int J Gynecol Cancer. 2016;26(2):367-70.
6. Savage PM, Sita-Lumsden A, Dickson S, Iyer R, Everard J, Coleman R, et al. The relationship of maternal age to molar pregnancy incidence, risks for chemotherapy and subsequent pregnancy outcome. BJOG. 2021;128(2):222-30.
7. Fisher RA, Maher GJ. Genetics of gestational trophoblastic disease. Best Pract Res Clin Obstet Gynaecol. 2021 Jul;74:29-41.
8. Kou YC, Shao L, Peng HH, Rosetta R, del Gaudio D, Wagner AF, Al-Hussaini TK, Van den Veyver IB. A recurrent intragenic genomic duplication, other novel mutations in NLRP7 and imprinting defects in recurrent biparental hydatidiform moles. Mol Hum Reprod. 2008 Jan;14(1):33-40.
9. Lawler SD, Fisher RA, Pickthall VJ, Povey S, Evans MW. Genetic studies on hydatidiform moles. I. The origin of partial moles. Cancer Genet Cytogenet. 1982 Apr;5(4):309-20.
10. Parazzini F, La Vecchia C, Mangili G, Caminiti C, Negri E, Cecchetti G, Fasoli M. Dietary factors and risk of trophoblastic disease. Am J Obstet Gynecol. 1988 Jan;158(1):93-9.
11. Seckl MJ, Sebire NJ, Berkowitz RS. Gestational trophoblastic disease: ESMO clinical practice guidelines for diagnosis, treatment and follow-up [Internet]. 2010 [citado 2024 mar 27]. Disponível em: https://www.annalsofoncology.org/article/S0923-7534(19)31565-0/fulltext
12. Campos V, Paiva G, Barcellos M, Canelas AC. Fundamentos do diagnóstico e tratamento da gravidez molar. Med Cien Arte [Internet]. 2022 [citado 2024 mar 9];1(2):113-30. Disponível em: https://medicinacienciaearte.emnuvens.com.br/revista/article/view/24/20
13. Seckl MJ, Sebire NJ, Fisher RA, Golfier F, Massuger L, Sessa C; ESMO Guidelines Working Group. Gestational trophoblastic disease: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. Out 2013;24 Suppl 6:vi39-50.
14. Braga A, Sun S, Maestá I, Uberti E. Doença trofoblástica gestacional. FEBRASGO [Internet]. 2018 [citado 9 mar 2024];23. Disponível em: FeminaZ01Z-ZJanZ2019.pdf (febrasgo.org.br)
15. Ministério da Saúde (BR), Associação Brasileira de Doença Trofoblástica Gestacional. Linha de cuidados para doença trofoblástica gestacional [Internet]. Brasília: Ministério da Saúde; 2021 [citado 2024 mar 22]. Disponível em: https://portaldeboaspraticas.iff.fiocruz.br/biblioteca/linha-de-cuidados-paradoenca-trofoblastica-gestacional
16. Lima LLA, Parente RCM, Maestá I, Amim Junior J, Rezende Filho JF, Montenegro CAB, Braga A.* Correlações clinicorradiológicas em pacientes com doença trofoblástica gestacional. Radiol Bras. 2016 Jul/Ago;49(4):241–250
17. BRASIL. Alfredo de Almeida Cunha. Frebasgo. Urgências e emergências maternas. Guia para diagnóstico e conduta em situações de risco de morte materna. 2000. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/0105urgencias.pdf. Acesso em: 08 out. 2024.
18. FEBRASGO. Onde a paciente com mola deve ser tratada? [Internet]. 2017 [citado 2024 mar 22]. Disponível em: https://www.febrasgo.org.br/pt/notícias/item/206-onde-a-paciente-com-moladeve-ser-tratada]
19. FIGO Committee on Gynecologic Oncology. Staging classifications for gynecologic cancers. Int J Gynaecol Obstet. 2000;70(2):209-210.
20. Biscaro A, Braga A, Berkowitz RS. Diagnosis, classification and treatment of gestational trophoblastic neoplasia [Internet]. 2015 [citado 2024 mar 23]. Disponível em: https://portaldeboaspraticas.iff.fiocruz.br/biblioteca/recomendacoesassistenciais-para-prevencao-diagnostico-e-tratamento-da-hemorragiaobstetrica/
21. Ngan HY, Seckl MJ, Berkowitz RS, Xiang Y, Golfier F, Sekharan PK, et al. Update on the diagnosis and management of gestational trophoblastic disease. Int J Gynecol Obstet [Internet]. 2018 [citado 2024 mar 23]. Disponível em: https://obgyn.onlinelibrary.wiley.com/doi/10.1002/ijgo.12615
1Graduanda do Curso de Biomedicina do Centro Universitário das Faculdades Metropolitanas Unidas – FMU, Brasil.
2Biomédica, Docente do Curso de Biomedicina do Centro Universitário das Faculdades Metropolitanas Unidas – FMU, Brasil
