DIAGNOSIS OF GESTATIONAL DIABETES MELLITUS: AGE AS A RISK FACTOR
REGISTRO DOI:10.5281/zenodo.12768409
Silvia Roberta da Silva Brandão1,2
Suzianne da Silva Brandão Siqueira2
Pablo Forlan Cordeiro de Siqueira neto2
Giovana Brandão de Oliveira Lima3
Híveny Cavalcanti Paiva Oliveira1
Clinston Paulino de Almeida4
Morgana Vital de Araújo1
Resumo
A gestação é um processo que envolve inúmeras e complexas transformações morfofisiológicas no organismo da mulher devido ao processo de formação do feto, e o diabetes mellitus gestacional (DMG) é a complicação imediata materna mais comum. Portanto, o objetivo desse estudo foi diagnosticar DMG e investigar o ponto de corte de idade que maximiza a sensibilidade, a especificidade e a razão de chances para detecção de DMG. A partir disso, foi observado 20,22% de gestantes com diabetes com idade menor que 35 anos e 35,6% com idade superior a 35 anos, com uma razão de chance de é 2,18 vezes de uma mulher com idade igual ou superior a 35 anos desenvolver DMG do que uma mulher com idade inferior (p<0,05). Ao ser traçada a curva ROC, foi identificado um ponto de corte ótimo para a idade igual a 34,5 anos, com intervalo de confiança da área entre 0,470 e 0,651. Com isso, conclui-se que gestantes acima de 35 anos tem mais chances de desenvolver DMG, no entanto, sugere-se que outros estudos sejam realizados, uma vez que a literatura traz dados conflitantes, trazendo a possibilidade de um consenso sobre o fator de risco idade.
Palavras-chave: Gestação. Diabetes gestacional. Fator de risco.
Abstract
Pregnancy is a process that involves numerous and complex morphophysiological transformations in the woman’s body due to the process of fetal formation, and gestational diabetes mellitus (GDM) is the most common immediate maternal complication. Therefore, the aim of this study was to diagnose GDM and investigate the age cutoff that maximizes sensitivity, specificity, and odds ratio for detecting GDM. From this, it was observed that 20.22% of pregnant women with diabetes were under the age of 35 and 35.6% were over the age of 35, with an odds ratio of 2.18 times that of a woman aged equal to or over 35 years of age develop GDM than a woman younger than that (p<0.05). When the ROC curve was drawn, an optimal cutoff point was identified for age equal to 34.5 years, with a confidence interval for the area between 0.470 and 0.651. With this, it is concluded that pregnant women over 35 years of age are more likely to develop GDM, however, it is suggested that other studies be carried out, since the literature provides conflicting data, bringing the possibility of a consensus on the risk factor age.
Keywords: Pregnancy. gestational diabetes. risk Factor.
1 INTRODUÇÃO
A gestação é um processo que envolve uma série de mudanças fisiológicas no organismo feminino a fim de atender às demandas do feto, uma importante adaptação metabólica que ocorre nesse período e que interfere no desenvolvimento do Diabetes Mellitus Gestacional (DMG) é a resposta à insulina (PLOWS, 2018).
A produção e elevação dos níveis de hormônios como o lactogênio placentário, prolactina, cortisol, progesterona são responsáveis pela diminuição da ação insulínica (MARTINS; BRATI; BRUN, 2021), ocorrendo o desenvolvimento de resistência à insulina (RI) durante a segunda metade da gestação (BISNETA et al., 2020). Assim, a fisiopatologia do DMG advém da elevação dos hormônios hiperglicemiantes devido a uma alteração fisiológica provocada pelo próprio período gravídico e fatores ambientais ou genéticos (BISNETA et al., 2020, CAVALCANTI et al., 2018).
A disglicemia é a alteração metabólica mais comum na gestação. Estima-se que aproximadamente 16% dos nascidos vivos são gerados por mulheres que tiveram alguma forma de hiperglicemia durante a gravidez (International Diabetes Federation, 2019). Estudos mostraram um acometimento por DMG no mundo entre 2,4% a 7,2%e passou a ter prevalência de 18% conforme os critérios atuais, de grávidas atendidas pelo Sistema Único de Saúde (SUS) (SANTOS et al., 2020, NUNES et al., 2020, REICHENBACH et al., 2021, FEBRASGO, 2019).
O Ministério da Saúde indica idade superior a 35 anos como fator de risco para diabetes mellitus gestacional (DMG), enquanto a Sociedade Brasileira de Diabetes considera idade materna avançada, não determinando uma idade específica. Entretanto, a Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO) e outras entidades de saúde apresentam a idade acima de 25 anos como fator de risco para o desenvolvimento de DMG (BARROS et al. 2019, PEI et al., 2020).
Diante do exposto, esse estudo teve como objetivo diagnosticar DMG e investigar o ponto de corte de idade que maximiza a sensibilidade, a especificidade e a razão de chances para detecção de DMG.
2 METODOLOGIA
Trata-se de um estudo observacional retrospectivo de caso controle, que investigou a idade de gestantes com e sem DMG. Os dados foram coletados do sistema worklab web, que foram gentilmente cedidos do Laboratório de Análises Clínicas Suzianne Brandão/Serra Talhada-Pe. Foram inseridos no estudo resultados dos exames de todas as gestantes submetidas à glicemia de jejum e/ou TOTG no período de 2020 a 2023, independente da idade gestacional em que se encontravam. Os grupos foram divididos em <35 anos, ≥35 anos, < 25 anos e ≥25 anos.
Os parâmetros utilizados para DMG foram: valores acima de 92 mg/dL para glicemia em jejum, valores acima de 180 mg/dL após uma hora de sobrecarga glicídica e valores acima de 153 mg/dL após duas horas de sobrecarga glicídica no exame de glicemia pós-prandial ou TOTG.5
A partir dos dados coletados, foi construído um banco de dados em planilha no Microsoft Excel para analisá-los pelo programa Graph Pad Prism 5.0®. Para investigar a associação significante entre um determinado fator e o diagnóstico de glicemia instável foi aplicado o teste quiquadrado. A medida (estimador) usada para expressar o risco foi a razão de chances, ou odds ratios (OR). Para a identificação de um ponto de corte ótimo para a idade que maximizasse o risco do diagnóstico de glicemia instável foi usada a curva receiver operating characteristic (ROC). Além do teste de significância, foi obtido intervalo de confiança assintótico para a área sob a curva, para o qual se espera não conter o valor 0,5. Para determinar o ponto de corte foi utilizado o índice de Youden (J=sensibilidade (%) + especificidade (%) – 100, considerando o maior valor encontrado.
3 RESULTADOS
Da amostra de 223 gestantes, 178 tinham idade menor que 35 anos, e destas, 36 apresentaram DMG, representando 20,22%. Outra parte da população estudada, 45 gestantes tinham idade superior a 35 anos, sendo 16 gestantes com diagnóstico para DMG (35,6%). É considerado que a razão de chance de uma mulher com idade igual ou superior a 35 anos desenvolver DMG é 2,18 vezes maior que a razão de chance de uma mulher com idade inferior, apresentando uma diferença estatisticamente significante (p<0,05) (Tabela 1).
Tabela 1. Casos de gestantes em risco de desenvolver DMG no período de 2020 a 2022.
Variáveis Casos/Tamanho do grupo Incidência de glicemia instável p-valor do teste qui quadrado OR Idade <35 anos 36/178 20,22% 0,048 2,18 ≥35 anos 16/45 35,60% Idade <25 anos 12/57 21,05% 0,774 1,19 ≥25 anos 40/166 24,09%
Outra classificação foi realizada avaliando uma faixa etária menor e, então, 57 gestantes com idade menor que 25 anos e 166 gestantes com idade igual ou maior a 25 anos. Destas, com idade abaixo de 25 anos de idade, 12 (21,05%) apresentaram DMG, enquanto que o outro grupo, com idade igual ou maior que 25 anos, 40 gestantes (24,09%) tiveram diagnóstico positivo para DMG. Estima-se, então, que a chance de uma mulher com idade igual ou superior a 25 anos desenvolver DMG é de 1,19 vezes maior se comparada às mulheres que têm menos de 25 anos (Tabela 1).
A figura 1 traz a curva ROC, que identificou como ponto de corte ótimo para a idade igual a 34,5 anos, ou seja, esse é o ponto de corte que maximiza a razão de chances. A área sob a curva ROC (AUC) foi igual a 0,56, mostrando desempenho satisfatório do teste proposto com o novo ponto de corte da idade. Além disso, o intervalo de confiança da área variou entre 0,470 e 0,651 e embora a AUC tenha se apresentado acima da linha de nulidade, mostrou valor de p superior a 0,5, não sendo significante estatisticamente (Tabela 2).
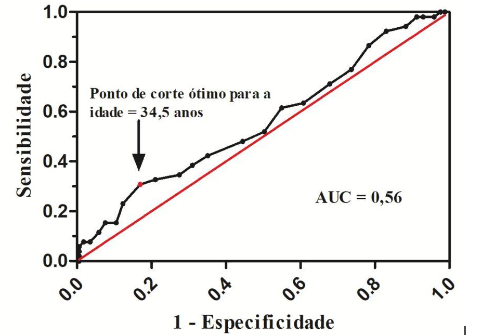
Figura 1. Curva ROC usando a idade como indicador de DMG. ROC = característica operacional do receptor. AUC = área sob a curva ROC.
Tabela 2. Análise de significância da área sob a curva ROC.
Área sob a curva ROC Erro Padrão p-valor assintótico Intervalo de confiança assintótico para a área sob a curva Limite inferior Limite superior 0,560 0,047 0,184 0.470 0.651
O teste de ponto de corte mostrou sensibilidade igual a 0,83 e (1-especificidade) = 0,301, que aponta uma especificidade igual a 0,170. Apresentar uma sensibilidade igual a 0,83 implica em dizer que 83% das gestantes com DMG seriam identificadas corretamente. Para o 1-especificidade igual a 0,301 diz que a probabilidade de falso-positivo seria de 30,1% dos casos que não tinham DMG e seriam classificados como positivos pelo teste usado.
A tabela 3 mostra diferentes valores de pontos de corte por idade, tendo 1-especificidade, a medida de falso positivo e a sensibilidade e a especificidade como critérios mais e menos estritos. São apresentados na tabela valores de idade que geram o teste menos estrito possível, sensibilidade 1,000 e especificidade 0,000, isso em relação ao teste mais estrito possível, com sensibilidade 0,000 e especificidade 1,000.
O ponto de corte 34,5 pode ser entendido como ótimo, uma vez que equilibra as necessidades de sensibilidade e especificidade, maximizando o risco para DMG. Utilizar as idades de 25 e 35 anos como fatores de risco pode ser visto como não ideais, uma vez que são critérios mais estritos.
Tabela 3. Pontos de corte da idade para testes com critérios mais estritos e menos estritos.
Critérios menos estritos Ponto de corte da idade 1-E Sensibilidade (S) Especificidade (E) Valor IC95% Valor IC95% 16.5 0,988 1,000 0.931 – 1.000 0,012 0.001 – 0.042 17.5 0,977 1,000 0.931 – 1.000 0,023 0.006 – 0.059 18.5 0,959 0,981 0.897 – 0.999 0,041 0.017 – 0.082 19.5 0,930 0,981 0.897 – 0.999 0,070 0.037 – 0.119 20.5 0,912 0,981 0.897 – 0.999 0,088 0.050 – 0.141 21.5 0,883 0,942 0.840 – 0.988 0,117 0.073 – 0.175 22.5 0,830 0,923 0.815 – 0.979 0,170 0.117 – 0.234 23.5 0,784 0,865 0.742 – 0.944 0,216 0.157 – 0.286 24.5 0,737 0,769 0.632 – 0.875 0,263 0.199 – 0.336 25.5 0,678 0,711 0.569 – 0.829 0,322 0.252 – 0.397 26.5 0,608 0,635 0.489 – 0.764 0,392 0.318 – 0.469 27.5 0,550 0,615 0.470 – 0.747 0,450 0.374 – 0.528 28,5 0,503 0,519 0.376 – 0.660 0,497 0.420 – 0.574 29,5 0,444 0,481 0.340 – 0.624 0,556 0.478 – 0.631 30,5 0,351 0,423 0.287 – 0.568 0,649 0.573 – 0.720 31,5 0,310 0,385 0.253 – 0.530 0,690 0.615 – 0.758 32,5 0,275 0,346 0.219 – 0.491 0,725 0.652 – 0.790 33,5 0,211 0,327 0.203 – 0.471 0,790 0.721 – 0.848 Ponto Ótimo 34,5 0,170 0,301 0.187 – 0.451 0,830 0.766 – 0.883 Critérios mais estritos 35,5 0,123 0,231 0.125 – 0.368 0,877 0.818 – 0.922 36,5 0,105 0,154 0.069 – 0.281 0,895 0.839 – 0.936 37,5 0,076 0,154 0.069 – 0.281 0,924 0.873 – 0.959 38,5 0,058 0,115 0.043 – 0.234 0,942 0.895 – 0.972 39,5 0,035 0,077 0.021 – 0.185 0,965 0.925 – 0.987 40,5 0,018 0,077 0.021 – 0.185 0,983 0.950 – 0.996 41,5 0,006 0,058 0.012 – 0.159 0,994 0.968 – 0.999 42,5 0,006 0,038 0.005 – 0.132 0,994 0.968 – 0.999 43,5 0,006 0,019 0.000 – 0.103 0,994 0.968 – 0.999 45,5 0,006 0,000 0.000 – 0.068
0,9940.968 – 0.999
* IC95%= intervalo de confiança com nível de confiança de 95%
4 DISCUSSÃO
Esse estudo mostrou que existe uma maior chance de mulheres com idade igual ou superior a 35 anos desenvolverem DMG. Esse dado corrobora com o estudo de Pei et al (2020), que demonstra características básicas de 589 mulheres com história de DMG e evidenciou que a maioria das gestantes com DMG tinham idade maior que 35 anos. Ao avaliar o impacto da idade materna nos resultados perinatais e neonatais, outro estudo ratifica que a idade materna avançada, acima de 35 anos, está mais associada a DMG (. KAHVECI; MELEKOGLU; EVRUKE; CETIN, 2018).
Um estudo transversal onde foram selecionadas 311 gestantes aleatoriamente e que identificou 5,1% dessas com DMG, identificou que a maioria tinha idade superior a 30 anos (ALI et al., 2016). Em um estudo de coorte retrospectivo que utilizou dados de prontuários médicos de 434 mulheres com síndrome de ovários policísticos, a idade média das pacientes com DMG foi de 29 anos, no que diz respeito à proporção de pacientes com idade ≥ 35 anos não apresentou diferença significante entre os dois grupos (OUYANG et al., 2018).
Em um estudo observacional, do tipo caso-controle, que avalia idade como fator de risco para DMG traz que a razão de chance de uma mulher com idade ≥25 anos desenvolver diabetes mellitus gestacional é 2,3 vezes maior. No entanto, a idade ≥22,5 anos foi identificada como ponto que maximiza a chance para a diabetes mellitus gestacional (PEI, L. et al., 2020).
A sociedade Brasileira de Diabetes e a Federação Brasileira das Associações de Ginecologia e Obstetrícia sugerem que há um aumento progressivo do risco de DMG com o aumento da idade, entretanto ainda temos dados divergentes na literatura, o que reitera a necessidade de estudos como esse, para o reconhecimento prévio dos fatores de riscos, o que torna relevante para prevenção de complicações (BARROS et al., 2019, SOCIEDADE BRASILEIRA DE DIABETES, 2020).
DMG está associada diretamente a repercussões negativas para o recém-nascido (RN), podendo levar a malformações fetais, macrossomias fetais, síndrome da angústia respiratória, hipoglicemia neonatal, aumento do desenvolvimento de doença cardiovascular, morte do bebê, entre tantas complicações (BATISTA et al., 2021).
Assim como para o RN, a gestante com DMG pode apresentar complicações, como síndromes hipertensivas, polidramnia, infecções, trabalho de parto prematuro, cetoacidose, necessidade de parto cirúrgico, risco de desenvolvimento de diabetes mellitus após a gestação, além de lesões vasculares nos rins e na retina. Além disso, as alterações metabólicas associadas à hiperglicemia poderão acarretar maior risco de abortamento entre as gestantes (SOCIEDADE BRASILEIRA DE DIABETES, 2020).
Dentre os fatores de riscos, além do aumento da idade, existe uma complexa interação de fatores genéticos e ambientais, obesidade ou ganho de peso excessivo durante a gravidez, deposição central excessiva de gordura corporal e histórico familiar em parentes de 1° grau, e a associação de mais de um desses fatores podem trazer maiores complicações para a saúde materna – infantil (SABINO et al., 2017).
5 CONCLUSÃO/CONSIDERAÇÕES FINAIS
O presente estudo constatou que gestantes acima de 35 anos apresentam 2,3 vezes mais chances de desenvolver DMG e identificou que o ponto de corte para DMG é 34,5 anos. A partir deste, sugere-se que outros estudos sejam realizados, a fim de complementar os estudos sobre idade como fator de risco, minimizando assim, possíveis vieses referentes aos métodos utilizados e trazendo a possibilidade de um consenso sobre o fator de risco de idade.
REFERÊNCIAS
ALI, A. D. et al. Prevalence and risk factors of gestational diabetes mellitus in Yemen. Int J of Women’s Health, v. 25, n. 8, p. 35-41, 2016. Available from: doi: https://doi.org/10.2147/IJWH.S97502.
BARROS, G. M. et al. Idade como fator de risco para diabetes mellitus gestacional. Cienc Cuid Saude, v. 18, n. 2, e45414, 2019. Available from: https://doi.org/10.4025/ciencuidsaude.v18i2.45414.
BATISTA, M. H. J. et al. Diabetes Gestacional: Origem, Prevenção e Riscos. Brazilian Journal of Development, v. 7, n. 1, p.1981-1995, 2021. Available from: https://doi.org/10.34117/bjdv7n1-135.
BISNETA, I. P. S. et al. Physiological changes in glucose uptake by GLUT-4 in Gestational Diabetes Mellitus. Research Society and Development, v. 9, n. 7, e857974783, 2020. Available from: https://rsdjournal.org/index.php/rsd/article/view/4783 doi: 10.33448/rsd-v9i7.4783.
CAVALCANTI, L. P. G. et al. Is the recent increment in attributable deaths to type-2 diabetes (T2D) associated with the latest chikungunya outbreak in a major epidemic area in Brazil?. Rev Soc Bras Med Trop., v. 51, n. 1, p. 63-65, 2018. Available from: doi: 10.1590/0037-8682-0440-2017.
FEBRASGO. Rastreamento e diagnóstico de diabetes mellitus gestacional no Brasil.
Femina, v. 47, n. 11, p. 786-796, 2019. Available from: <http://docs.bvsalud.org/>
INTERNATIONAL DIABETES FEDERATION. IDF Diabetes Atlas. 9th ed. Brussels, Belgium: 2019. Available from: https://diabetesatlas.org/upload/resources.
KAHVECI, B.; MELEKOGLU, R.; EVRUKE, I. C.; CETIN, C. The effect of advanced maternal age on perinatal outcomes in nulliparous singleton pregnancies. BMC Pregnancy and Childbirth, v. 18, p. 343, 2018. Available from: https://doi.org/10.1186/s12884-018-1984-x.
MARTINS, A. M.; BRATI, L. P.; BRUN, S. M. Tratamento para o diabetes mellitus gestacional: uma revisão de literatura. Revista GepesVida, v 7, n.16, 2021. Available from: < http://icepsc.com.br/ojs/index.php/gepesvida/article/view/447>.
NUNES, R. D. et al. Two criteria of oral glucose tolerance test to diagnose gestational diabetes mellitus. Rev assoc med bras., V. 66, n. 2, p. 139-145, 2020. Available from: http://dx.doi.org/10.1590/1806-9282.66.2.139.
PEI, L. et al. Early postpartum dyslipidemia and its potential predictors during pregnancy in women with a history of gestational diabetes mellitus. Lipids Health Dis., v. 19, n. 1, p. 220, 2020 Available from: https://doi.org/10.1186/s12944-020-01398-1.
PLOWS, J. F. et al. The Pathophysiology of Gestational Diabetes Mellitus. Int J Mol Sci., v. 19, n.11, p. 3342, 2018. Available from: https://www.mdpi.com/1422-0067/19/11/3342 doi: 10.3390/ijms19113342.
OUYANG, P. et al. Risk prediction of gestational diabetes mellitus in women with polycystic ovary syndrome based on a nomogram model. BMC Pregnancy and Childbirth, v. 23, n. 1, p. 408, 2018. Available from: doi: https://doi.org/10.1186/s12884-023-05670-x.
REICHENBACH, R. et al. Comparative analysis between prevention and treatment costs for gestational diabetes mellitus in primary and tertiary health care in a city in Southern Brazil. J Bras Econ Saúde, V. 13, n. 1, p. 21-30, 2021.
SABINO, K. C. V. et al. Gestantes portadoras de diabetes mellitus: características e vivência durante a gestação. Braz J Surg Clin Res., v. 20, n. 3, p. 137-141, 2017. Available from: http://www.mastereditora.com.br/bjscr.
SANTOS, P. A. et al. Gestational Diabetes in the Population Served by Brazilian Public Health Care. Prevalence and Risk Factors. Rev Bras Ginecol Obstet., v. 42, n. 1, p. 12–18, 2020.
SOCIEDADE BRASILEIRA DE DIABETES. Diretrizes da Sociedade Brasileira de Diabetes (2019-2020). São Paulo: A. C. Farmacêutica; 2020. 489p.
1E-mail: morgana_vital@hotmail.com
1Faculdade de Medicina de Olinda, Olinda, Pernambuco, Brasil.
2Laboratório Suzianne Brandão, Serra Talhada, Pernambuco, Brasil.
3Faculdade Mauricio de Nassau, Recife, Pernambuco, Brasil.
4Universidade Nacional de La Plata-UNLP, Buenos Aires, Argentina
