MOLECULAR CLINICAL DIAGNOSIS OF FEBRILE SYNDROMES IN THE WESTERN AMAZON: SYSTEMATIC REVIEW
REGISTRO DOI: 10.69849/revistaft/ra10202410132107
Jose Johnata Paiva de Melo1
Carolina Pontes Soares2
Cirley Maria Oliveira Lobato3
RESUMO
Introdução: As síndromes febris dengue, Chikungunya e Zika são consideradas arboviroses que podem ser transmitidas pelo mesmo vetor em regiões tropicais e subtropicais do mundo. Objetivo: Este trabalho de pesquisa tem como objetivo pesquisar e descrever sobre as arboviroses, incluindo as classificações e características que implicarão nas sintomatologia desta patologia que possui uma alta incidência no Brasil. Resultados: O Dengue vírus (DENV) e Zika vírus (ZIKV) pertencem ao mesmo gênero Flavivirus, possuem em sua estrutura genômica um RNA envelopado, em sentido positivo e de fita simples. Adicionalmente, o Chikungunya vírus (CHIKV) é um RNA vírus envelopado, em senso positivo e de cadeia simples, pertencente ao gênero Alphavirus. No Brasil o DENV circula desde a década de 80, com surtos anuais facilitado pela circulação de quatro sorotipos (DENV1- 4) com infecções, geralmente, sintomáticas podendo evoluir para manifestações hemorrágicas ou neurológicas fatais. O CHIKV foi inserido em 2014 causando epidemias e surtos, de uma doença debilitante podendo cursar em intensa artralgia, enquanto que o ZIKV ficou bastante conhecido depois do surto brasileiro em 2015, estando associado às consequências mais graves da infecção pelo vírus, com a Síndrome de Guillain-Barré e vários casos registrados de microcefalia em neonatos no surto. No estado do Acre há circulação simultânea dos três vírus, com predominância dos sorotipos DENV1-2, e foram registrados alguns casos de coinfecção. Conclusão: As arboviroses constituem um grave problema de saúde pública nas regiões subtropicais e tropicais por oferecem condições ecológicas favoráveis e apresentarem expressividade em morbidade e/ou mortalidade, sendo necessário estudos que fortaleçam e contribuam para melhoria da qualidade das informações e conscientização da população sobre as arboviroses e suas sintomatologias.
Palavras-chave: Dengue vírus, Chikungunya vírus, Zika vírus, RT-PCR
ABSTRACT
Introduction: Dengue, chikungunya and zika fever syndromes are considered arboviruses that can be transmitted by the same vector in tropical and subtropical regions of the world. Objective: This research work aims to research and describe arboviruses, including the classification and characteristics that will imply the symptoms of this pathology that has a high incidence in Brazil. Results: Dengue virus (DENV) and Zika virus (ZIKV) belong to the same Flavivirus genus and have in their genomic structure an enveloped, positive-sense, single-stranded RNA. Additionally, Chikungunya virus (CHIKV) is an enveloped, positive-sense, single-stranded RNA virus belonging to the Alphavirus genus. In Brazil, DENV has been circulating since the 1980s, with annual outbreaks facilitated by the circulation of four serotypes (DENV1-4) with infections that are generally symptomatic and can evolve to fatal hemorrhagic or neurological manifestations. CHIKV was introduced in 2014, causing epidemics and outbreaks of a debilitating disease that can lead to severe arthralgia. ZIKV became well-known after the Brazilian outbreak in 2015, and was associated with the most severe consequences of infection by the virus, with Guillain-Barré Syndrome and several cases of microcephaly recorded in newborns during the outbreak. In the state of Acre, there is simultaneous circulation of the three viruses, with a predominance of serotypes DENV1-2, and some cases of coinfection have been recorded. Conclusion: Arboviruses constitute a serious public health problem in subtropical and tropical regions because they offer favorable ecological conditions and present expressive morbidity and/or mortality. Studies are needed to strengthen and contribute to improving the quality of information and raising awareness among the population about arboviruses and their symptoms.
Keywords: Dengue virus, Chikungunya virus, Zika virus, RT-PCR.
1 INTRODUÇÃO
A maioria das arboviroses constituem grave problema de saúde pública em todo o mundo, principalmente, nas regiões subtropicais e tropicais por oferecem condições ecológicas favoráveis e apresentarem expressividade em morbidade e/ou mortalidade, neste sentido destacam-se, dentre as arboviroses, a dengue, Chikungunya e a febre do zika1,2,3,4,5.
O vírus da dengue (DENV) apresenta características antigênicas distintas devido a quatro sorotipos diferentes (DENV 1-4), no entanto, assim como o vírus da zika (ZIKV) pertencem ao mesmo gênero Flavivirus e família Flaviviridae, seus materiais genéticos são constituídos por uma fita simples de RNA de senso positivo, com aproximadamente 11kb de comprimento. São traduzidos em uma poliproteína que é clivada em três proteínas estruturais, a proteína C que constitui o capsídeo que reveste o núcleocapsideo com forma icosaédrico, a proteína E que forma o envelope estando relacionada com a entrada na célula hospedeira, a fusão lisossomal e a montagem viral, e a proteína prM que é precursora da membrana formando um complexo com a proteína E impedindo a entrada prematura do vírus na célula, e cliva, ainda, mais sete proteínas não estruturais (NS1, NS2A, NS2B, NS3, NS4A, NS4B e NS5)6,7,8,9,10.
A glicoproteína E de envelope é composta por três domínios relacionados ao processo de neutralização de diferentes anticorpos específicos e reação cruzada, ao centro da proteína o domínio I (DI) e os domínios II (DII) e III (DIII) subsequentes, que em conjunto com as proteínas de membrana prM desencadeiam a resposta imune do hospedeiro, portanto consideradas as mais imunogênicas1,7,8,9.
Embora muitos estudos descrevam a replicação flaviviral ocorrendo no citoplasma da célula hospedeira, um estudo tem sugerido que o núcleo celular poderia abrigar os antígenos do ZIKV, no entanto, as informações sobre a patogênese, ainda, são pouco conhecidas, acredita- se que repliquem-se ao infectarem células dendríticas e, posteriormente, disseminando-se para os linfonodos, corrente sanguínea, órgãos e tecidos11,12,13,14.
Assim que o sistema imune do hospedeiro reconhece a partícula infectante do DENV, os linfócitos B sofrem diferenciação em células secretoras de anticorpos e linfócitos B de memória. Na primeira infecção os anticorpos IgG neutralizam o sorotipo, garantindo a proteção a longo prazo, ao passo que, em uma segunda infecção, por um sorotipo diferente, reagem, a curto prazo, subneutralizando o antígeno, esse mecanismo é conhecido como reação cruzada, e em alguns casos propicia o agravamento da doença. Estudos apontam que há um aumento considerável de anticorpos IgM e IgG específicos de um Flavivirus reagindo de forma cruzada para outro Flavivirus de um mesmo grupo1,6,8,9,15.
O vírus da chikungunya (CHIKV) é membro da família Togaviridae e gênero Alphavirus, seu é genoma constituído por uma cadeia simples de RNA, de polaridade positiva, com tamanho aproximadamente de 12 Kb. Possui duas Fase de Leitura Aberta (ORF’s), a primeira codifica quatro proteínas não estruturais, nsP1, nsP2, nsP3 e nsP4 e, a segunda codifica três proteínas estruturais C, P62 (madura em E2 e E3) e E1 que se associam como um heterodímero, formando um dímero E1/E2 ou um trímero E1/E2/E3. A proteína estrutural C forma o núcleocapsideo, a E1 realiza fusão das membranas viral e hospedeiro, E2 liga-se ao receptor da célula hospedeira responsável pela diversidade de cepas virais, a E3participa na montagem das partículas virais e 6k é incorporada durante o brotamento viral16,17.
O CHIKV tem tropismo por fibroblastos da pele, podendo infectar também células dendríticas, macrófagos e monócitos, estas sinalizam ao sistema imune, que libera diversas citoquinas pró-inflamatórias e anti-inflamatórias (Interferons, Interleucinas e outras) para limitar a disseminação viral. Com o decorrer essas células adentram na corrente sanguínea, propagando-se diferentes tecidos e órgãos, dentre eles, cérebro, fígado, articulações e tecido muscular18,19, 20.
No Brasil essa tríade representam um sério problema de saúde pública devido, principalmente, às condições favoráveis para a reprodução do vetor (artrópode do gênero Aedes). A transmissão do vírus ocorre durante o repasto sanguíneo, a incubação no vetor dura em média 10 dias, sendo virêmico por toda vida. O período de incubação no homem infectado por DENV dura em média de 5 a 7 dias do início dos primeiros sintomas, enquanto que, na infecção por CHIKV em média de 3 a 7 dias, e na infecção por ZIKV em média 3 a 6 dias1,2,4,5.
Estudos tem descrito a possibilidade de transmissão do ZIKV por via sexual uma vez que foi encontrado a presença do vírus em fluidos corporais (urina, saliva, sêmem e fluidos vaginais). Também é possível ocorrer transmissão associada a transfusão sanguínea, uma vez que o RNA deste vírus foi detectado em doadores de sangue assintomáticos durante um surto entre 2013 e 2014, na Polinésia Francesa21,22,23.
Em geral essas arboviroses apresentam manifestações clínicas iniciais semelhantes como: febre, cefaleia, dor retro orbital, mialgia, artralgia, náuseas, vômitos, calafrios, erupção da pele, leucopenia e trombocitopenia. O DENV circula desde a década de 80, com surtos anuais, podendo manifestar-se de forma assintomática ou quando sintomática podendo ser caracterizada em três fases clínicas: a fase febril é conhecida como a febre clássica da dengue (FD), a fase crítica é caracterizada pela febre hemorrágica da dengue (FHD) podendo evoluir para a síndrome do choque da dengue (SCD) e ao óbito se não tratada com rapidez, e a fase de recuperação conhecida como período de convalescência. O CHIKV foi inserido em 2014 causando epidemias e surtos, de uma doença debilitante podendo cursar em intensa artralgia, enquanto que o ZIKV ficou bastante conhecido no Brasil depois do surto em 2015, estando associado às consequências mais graves da infecção pelo vírus, com a Síndrome de Guillain- Barré e vários casos registrados de microcefalia em neonatos no surto2,4,5,24,25.
No estado do Acre há registros da circulação simultânea de DENV1-2, sem confirmação para outro sorotipo, atualmente correm surtos anuais na região principalmente de dengue seguido de casos confirmados de Chikungunya, enquanto que em novembro de 2015 foram notificados os primeiros de Zika, o que resultou de janeiro a maio de 2016 em 1.269 casos suspeitos de zika26.
Atualmente vacinas e medicamentos antivirais específicos ainda não existem para essas arboviroses, o tratamento é sintomático, com o uso analgésicos e antipiréticos, evitando-se o uso de medicações que contenham salicilatos para evitar a indução hemorrágica2,4,26,25.
Quanto ao diagnóstico laboratorial pode ser realizado por métodos diretos e indiretos. Na fase aguda da doença os métodos diretos são mais eficientes, sendo possível identificar o genoma viral e seus componentes na amostra, tendo maior precisão e especificidade, embora, sejam menos acessíveis a sua realização devido aos altos custos para a realização. Já os métodos indiretos são uteis após o período de viremia, quando o sistema imune do indivíduo já produziu anticorpos IgM ou IgG, estes testes possuem alta sensibilidade e baixa especificidade, sendo mais acessíveis devido ao baixo custo para a sua realização2,26,27.
Dentre as técnicas empregadas destacam-se as técnicas sorológicas e moleculares, entre as mais usadas temos os ensaios imunoenzimáticos para captura de IgM (MAC ELISA) e de IgG (G-ELISA), os testes rápidos imunocromatografos atuam detectando IgM, IgG ou capturando antígeno viral NS1, e para identificação do genoma viral a técnica mais conhecida é a Reação em Cadeia da Polimerase de Transcrição Reversa (RT-PCR), podendo ser realizada em um formato em tempo real (RT-rPCR) para detectar simultaneamente vários arbovírus, tais como DENV, CHIKV e ZIKV28,20,29.
Os anticorpos IgM podem ser detectáveis no soro ou plasma com 3 a 5 dias do início dos primeiros sintomas, atingindo níveis máximos em 7 a 8 dias, após o sétimo dia ocorre a soroconversão período mais confiável para a detecção de anticorpos, com 1 a 2 meses vai diminuindo a titulação. Enquanto que os anticorpos do tipo IgG podem ser detectáveis em títulos muito baixos a partir de 4 dias, com pico em duas semanas perdurando por 2 a 3 anos após a infecção, o que possibilita a detecção da doença no período de convalescência29,30,31,32.
O Antígeno NS1 está presente na circulação sanguínea desde o primeiro dia de infecção até o início da soroconversão IgM para IgG (em média a soroconversão inicia-se após o sétimo dia), inclusive durante as reinfecções. O RNAv pode ser encontrado no período de viremia da doença em média de 0 a 5 dias do início dos primeiros sintomas, na urina permanece por mais de 10 dias e no sêmen por mais de dois meses33,34.
Os métodos sorológicos variam em sensibilidade e especificidade, em regiões endêmicas com circulação simultânea de diferentes arboviroses, podem ocorrer reações cruzadas, obtendo-se vários resultados falso-positivos, sendo necessário outros testes para confirmação. As técnicas moleculares são mais precisas e específicas tornam-se importantes para a detecção confiável2,4,29.
O diagnóstico clínico imediato aliado ao uso de técnicas de diagnóstico molecular preciso e específico podem confirmar definitivamente os vírus e sorotipos circulantes e as regiões endêmicas, auxiliando a vigilância epidemiológica na antecipação de medidas preventivas e de controle de potenciais agravos na comunidade35.
Este trabalho de pesquisa tem como objetivo descrever sobre as arboviroses, incluindo as classificação e características que implicarão nas sintomatologia desta patologia que possui uma alta incidência na amazõnia ocidental e atualmente no Brasil.
2. METODOLOGIA
Trata-se de revisão sistemática elaborada conforme as recomendações do Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA). A estratégia de busca foi elaborada utilizando uma combinação de termos de busca relacionados às arboviroses Além disso, foram utilizados operadores booleanos (por exemplo, ‘AND’) para maximizar a sensibilidade da busca. Sendo os descritores utilizados em todas bases de dados. Uma busca sistemática e abrangente foi conduzida em múltiplas bases de dados eletrônicas, incluindo National Library of Medicine (PubMed), Biblioteca Virtual em Saúde (BVS), Web of Science, Lilacs por descritores obtidas pelos Descritores em ciência da Saúde (DeCS) da BVS. Na Embase foram utilizados os termos (Artificial intelligence AND Neuroimaging AND Degenerative Diseases) de acordo com Emtree. Na Pubmed e BVS procurou-se utilizando os filtros: Free full text + timeline (2019-2023) + Humans. Na Web of Science, procurou-se utilizar open access + timeline (2019-2023) com os mesmos descritores. No Lilacs, a busca foi utilizando a timeline (2019-2023). Análise e leitura por título, resumo e assunto, com os mesmos descritores. Não houve restrições quanto ao tamanho da amostra ou à língua estrangeira.
3 RESULTADOS
1 VÍRUS DA DENGUE
Considerado um arbovírus (ARthropod BOrne VÍRUS), pois é transmitido por artrópodes, o DENGUE VÍRUS (DENV) pertence à família Flaviviridae e gênero Flavivirus e, há 4 sorotipos: DENV-1, DENV-2, DENV-3 e DENV-4, e todos podem causar tanto a forma clássica da doença quanto formas mais graves 8,9,36,37,38.
A recombinação de genótipos ou subtipos diferentes em um mesmo hospedeiro tem sido registrado em todos os 4 sorotipos e, embora os torne mais eficientes para adaptar-se, não significa que formam quasiespecies, mas sim diversidade genética6,7,9.
Este gênero tem mais de 70 espécies virais distribuídas em todo o mundo, principalmente em regiões de clima tropical e subtropical, podendo causar diversas doenças de forma endêmica, sendo, portanto, de grande relevância para a saúde pública7,8.
Sua morfologia é esférica com aproximadamente 40-50 nm de diâmetro, o seu genoma possui um núcleocapsideo icosaédrico composto por um capsídeo (C) envolto por uma membrana lipoproteica (M) derivada da célula hospedeira, com proteínas pré-membrana (prM) e de membrana e do envelope (E). A partícula viral completa tem uma densidade de 1,19 a 1,23 g/ml, podendo ser inativada por radiação ultravioleta (UV), aquecimento a 56° C por 30 minutos ou, ainda, por solventes lipídicos como, éter, ureia, aldeídos, lipases, proteases, clorofórmio e desoxicolato1,6,10.
É constituído por RNA simples de fita única com sentido positivo, com aproximadamente 11 kilobases (kb) de comprimento, dependendo do sorotipo tem aproximadamente 10.700 nucleotídeos e cerca de 3.400 aminoácidos (AA) e com uma única fase aberta de leitura (ORF) onde codifica uma poliproteína e por meio de clivagem constitui 3 proteínas estruturais: a proteína C (Figura 1) que forma o capsídeo, uma glicoproteína prM precursora da membrana da proteína M e a proteína E que formam o envelope e mais 7 proteínas não estruturais: (NS1, NS2A, NS2B, NS3, NS4A, NS4B E NS5)8,9,40,41,42
O fator de virulência pode estar associado há diversas regiões gênicas com alta frequência de mutações sendo os genes para as proteínas prM, E, NS1 e NS3 relevantes na infecciosidade8. A proteína C tem aproximadamente de 11 a 13 kDa e contém de 112 1 27 aminoácidos, contribui na formação do complexo ribonucleoproteico empacotando o RNA, é carregada positivamente com resíduos de lisina e arginina nas extremidades C-nascente e C- terminal, separados por uma região interna hidrofóbica, que atua como uma sequência sinal para a translocação da prM para o interior do lúmen do reticulo endoplasmático8,9.
A glicoproteína prM com cerca de 75 aminoácidos, 22 a 26 kDa e precursora da proteína M, é responsável por impedir que a proteína E sofra reorganização induzida por pH e fusão prematura pela via secretora. Seu segmento pr é clivado por uma protease celular furina, permitindo que a proteína M forme um dímero e fique ancorada no envelope e finalmente pr é liberado no extracelular. A maior proteína de superfície é a proteína E (Figura 1), tem cerca de 51 a 60 KDa, possui 12 resíduos conservados de cisteína, participa na estrutura viral, liga-se ao receptor celular do hospedeiro, sendo o principal alvo dos anticorpos neutralizantes, também tem se observado mutações o que pode aumentar a virulência das cepas, dessa forma o gene E tem sido o mais utilizado em estudos médicos6,8,43,44.
Com 354 aminoácidos a glicoproteína NS1, 46KDa, é a primeira proteína não-estrutural, pode ser encontrada no interior do retículo endoplasmático, associada a membrana celular e na forma solúvel no meio extracelular, sendo alvo da imunidade humoral do hospedeiro43,44.
NS2 tem duas proteínas NS2A com 218 a 231 aminoácidos e cerca de 22 KDa, contribui no processamento de NS1, já a NS2B tem aproximadamente 14,5 KDa, com 130 a 132 aminoácidos e, está envolvido no processo da protease do complexo NS2B-NS3, por conseguinte, NS3 (69 KDA) possui de 618 a 623 aminoácidos, interage com a proteína receptora do hospedeiro, além de possuir atividade helicase e de protease. NS4A (16KDa) e NS4B (27KDa) são proteínas hidrofóbicas, podem atuar como co-fatores nos complexos de replicação viral, no entanto, suas funções, ainda, são desconhecidas. NS5 (103 KDa) com 900 a 905 aminoácidos, sendo a maior proteína dos Flavivirus, atua como RNA polimerase e RNA dependente, além disso, participa na formação do terminal 5’ UTR do RNA7,40,16.
O DENV é flanqueado por duas regiões não codificadoras, 5’ UTR (~100 Pb) possui uma haste com uma alça acima e uma ramificação lateral e participa junto com o complexo NS3-NS5 e ação da metiltransferase da NS5 na tradução do genoma, enquanto que a extremidade terminal 3’ UTR (~450 Pb), possui uma haste-alça 3’ SL (Stem Loop) e diversos elementos repetidos de CS1 (complementary or cyclization sequences) e formam complexo que está envolvido na transcrição e replicação do RNA6,11,12,13.
Figura 1: Desenho esquemático da estrutura genômica, processamento de poliproteína e clivagem de proteínas do DENV
Fonte: Lindenbach, 2007, (Adaptado).
O DENV tem tropismo positivo por células fagocíticas, dentre elas, monócitos/macrófagos, células de Langerhans e células dendríticas, no entanto, estudos tem demonstrado infecção em linfócitos B, linfócitos T, células natural Killer, endoteliais, hepatócitos e neurônios12,45,46.
Liga-se a receptores celulares do hospedeiro por endocitose ao entrarem na célula sofrem trimerização da proteína E, devido pH baixo na região pré-lissomal, em seguida ocorre fusão com a membrana celular e, por conseguinte liberando o núcleocapsideo no citoplasma, então, o genoma, já dissociado do capsídeo, com uma única fita simples ORF de senso positivo codifica uma poliproteína que é processada pela serino-protease viral (NS2B/NS3) responsável pela clivagem de proteínas não estruturais: NS2A/NS2B, NS2B/NS3, NS3/NS4A, NS4A/2K e NS4B/NS5 e replicam o RNA viral na região da membrana do retículo endoplasmático (RE) e, a sinalize e furina do hospedeiro são responsáveis pela clivagem das proteínas estruturais: C/prM, prM/E, E/NS1 e 2K-NS4B, as quais juntamente com o RNA participam na maturação e secreção dos virions maduros, que ocorre no complexo de Golgi e, são liberados por exocitose. Ainda é desconhecido a enzima responsável pela clivagem da proteína NS1/NS2A9,11,47,48
Sobre a fisiopatologia da doença o vetor Aedes aegypti é um artrópode da família Culicidae com menos de 1 centímetro, encontrado em regiões tropical e subtropical. Oriundo do Egito e, posteriormente, difundido pelo mundo inteiro. No Brasil é, popularmente, conhecido como mosquito-da-dengue ou mosquito rajado, sendo o principal transmissor do DENV. Possui uma coloração castanha- escura, com abdómen escuro, podendo haver manchas branco-prateadas e suas pernas com faixas brancas. Tem preferência diurna, principalmente, ao início e fim do dia e, as fêmeas põem seus ovos a margem superficial da água, preferencialmente limpa, os mesmos, em fase embrionária podem sobreviver à desidratação por cerca de 1 ano. O ciclo de vida desde a oviposição até a fase adulta é de aproximadamente 10 dias divididos em: ovo, 4 fases de larva, pulpa e fase adulta, com vida média de 45 dias49,50,51.O DENV, dentre outros vírus, pode ser transmitido pelo dipitera Ae. albopictus, também conhecido como mosquito tigre ou mosquito da floresta, adapta-se melhor em zona rural e à volta das cidades, alimenta-se de sangue humano e de outros animais e a infecção viral ocorre principalmente no intestino médio, no entanto, a capacidade vetorial é menos eficiente, visto que, o Ae. aegypti é altamente antropofílico, peridomiciliar e a infecção viral ocorre no intestino médio disseminando para outros tecidos, não havendo um efeito patogênico direto para o vetor51,52.
Tanto o macho quanto a fêmea alimentam-se de néctar, seiva e sangue, podendo contrair o vírus com o sangue de um hospedeiro em fase de viremica, 4 a 12 dias, após um período de 8 a 12 dias já são infectivos por toda a sua vida. No homem, o vírus fica incubado de 2 a 15 dias, com médias de 5 a 7 dias, quando surgem os primeiros sintomas da doença51,52.
A fêmea do Ae. aegypti é a principal transmissora dos sorotipos do DENV e de tantos outros vírus, seguida do Ae. albopictus, ao serem fecundadas, necessitam de sangue para continuar a maturação dos ovos, podendo ocorrer transmissão vertical. Por meio de sua probóscide realiza sucção de sangue humano e, ao mesmo, tempo regurgitada secreção salivar com fatores de anticoagulação, evitando que o alimento coagule, desse modo, o vírus entra na corrente sanguínea do hospedeiro, essa transmissão é descrita como ciclo endêmico/epidêmico, já no ciclo enzoótico/selvagem envolve diferentes espécies de dipitera e hospedeiro vertebrado primata não humano53,54,55
Sabe-se que na infecção primária por um mesmo sorotipo do DENV, a resposta imune humoral ocorre de forma lenta e duradoura e, na infecção secundária, a titulação de anticorpos se elevam rapidamente, ambas infecções podem ser assintomáticas ou sintomáticas com a presença da forma clássica da doença: Febre do Dengue (FD) e, mesmo, a forma grave: a Febre hemorrágica do Dengue (FHD) e, mesmo, Síndrome do Choque do Dengue (SCD)2,56.
Ainda não está bem claro os mecanismos pelo qual o vírus causa a forma grave da doença, duas hipóteses tem sido propostas para explicar FHD/SCD, virulência do DENV e, a infecção secundária por um sorotipo diferente da primeira exposição15,57.
Estudos apontam uma maior virulência de algumas cepas de determinados sorotipos, sendo o DENV-2 altamente nocivo e, em regiões endêmicas pode ocorrer a coinfecção por diferentes sorotipos e, mesmo, múltiplas espécies de arbovírus41,57,58,59.
A hipótese da infecção secundária (sequencial) sugere a existência de anticorpos heterólogos antidengue da classe IgG, adquiridos ativa ou passivamente (via placentária) e, que juntamente com a participação de linfócitos B e T atuam de forma cruzada entre sorotipos diferentes, subneuttralizando epitopos, potencializando a infectividade (antibody dependent enhancement, ADE) e possibilitando a entrada viral nas células com receptores Fc , resultando em nível elevado da carga viral e, como consequência podendo levar a FHD/SCD, esse fenômeno imunológico é conhecido como “pecado antigênico original”15.
Em uma infecção secundária os linfócitos T de memória entram em contato com macrófagos infectados por sorotipo heterólogo, tendo uma resposta imune cruzada, estimulando a produção de diversas citocinas pró-inflamatórias e anti-inflamatórias e outros mediadores, como consequência aumentam a permeabilidade vascular, a trombocitopenia, a hemorragia contribuindo para a ocorrência da FHD. O FNT-α, uma citoquina pró-inflamatória, é encontrado em níveis altos, influenciando na secreção de histaminas pelos basófilos, na produção de fator de ativação plaquetária (PAF) e óxido nítrico (ON) contribuindo para o aumento da permeabilidade vascular, do extravasamento de plasma, e da plaquetopenia, enquanto, que a IL-6 elevada, uma citoquina anti-inflamatória, atua como um pirógenico e, influenciando, posteriormente, na destruição de plaquetas60,61,62,63 .
No entanto, essas hipóteses não esclarecem como casos de FHD/SCD podem ocorrer em infecções primárias e, não ocorrer em infecções secundárias, surge a hipótese da multicausalidade, integração de diversos fatores relacionados ao sorotipo, genótipo e sequencia de vírus infectante, também, fatores relacionados ao hospedeiro, como a idade, com maior risco para crianças e idosos, a etnia, com maior risco para brancos que negros, as doenças crônicas, como a anemia falciforme, a asma brônquica, a diabetes mellitus e fatores genéticos e a fatores relacionados ao ambiente epidemiológico, como a densidade populacional, a densidade e capacidade vetorial, a circulação viral e a suscetibilidade62,63
Quando sintomática, três fases clínicas da doença são caracterizadas, a fase febril, a fase crítica e a fase de recuperação56.
A fase febril, conhecido como Dengue clássico, é a forma mais comum da doença, manifestando-se com súbita febre de 39ºC a 40ºC, associada a cefaleia, mialgia, artralgia e dor retroorbitária, podendo apresentar, ainda, anorexia, náuseas, vômitos e, mesmo, diarreia. Aproximadamente, no terceiro dia da doença surge exantema máculo-papular, podendo atingir face, tórax e membros, gradativamente. Essa fase tem duração de terceiro a sete dias, com período de defervescência, podendo haver hemorragias, destacando-se, as petéquias, o epistáxi e a gengivorragia, seguido de prurido cutâneo e astenia. Aponta-se em exames laboratoriais a trombocitopenia, a linfocitose e ligeiro aumento das provas hepáticas2,56.
Na fase crítica, a FHD evolui após a defervescência podendo surgir sinais de alarme, como dor abdominal intensa e contínua à palpação, vômitos persistentes, sangramento de mucosa, hipotensão postural, poliserosite (derrame pleural/pericárdio e ascite), policitemia e letargia e/ou irritabilidade. Aos exames laboratoriais destaca-se a trombocitopenia inferior a 100,000 plaquetas/mm3, hipofibrinogênio e eritrocitosis acentuada. Com esses sinais e sintomas a FHD pode ser classificada em vários graus2,64,65
A FHD é classificada em quatro categorias de acordo com severidade dos sintomas e dos exames laboratorial, sendo que o grau III e IV caracteriza a SCD2,56:
Grau I – febre, cefaleia, dor retro orbitária, mialgia, artralgia, “prova do laço” positiva, leucopenia, trombocitopenia, sem evidência de extravasamento plasmático;
Grau II – febre, cefaleia, dor retro orbitária, mialgia, artralgia, “prova do laço” positiva, hemorragia espontânea, trombocitopenia < 100.000, hematócrito superior a 20% do valor normal;
Grau III – falência circulatória com pulso rápido e fraco, hipotensão, agitação, pele fria e viscosa, trombocitopenia < 100.000, hematócrito superior a 20% do valor normal e;
Grau IV – Choque profundo, com pressão e pulso indetectáveis, trombocitopenia < 100.000, hematócrito superior a 20% do valor normal.
Quando um volume de plasma é perdido devido a permeabilidade vascular pode se instalar, rapidamente, a SCD e, em um intervalo de 12 a 24 horas ao óbito ou a recuperação se realizado terapia antichoque adequada. Na fase recuperativa ou período de convalescência, pode ocorrer um rash cutâneo, o plasma extravasado é reabsorvido e a recuperação clinica é progressiva2,56.
Até o momento, não há tratamento antiviral específico para a dengue, e nem uma vacina disponível no mercado. A terapia é realizada com hidratação, repouso e medicamentos paliativos para a febre e dor. Diversas estratégias estão sendo realizadas para se prevenir a infecção pelo DENV, desde o controle do vetor, desenvolvimento de métodos diagnóstico mais robustos e a elaboração de uma vacina eficaz2,54,56.
CONTEXTO HISTÓRICO E EPIDEMIOLÓGICO
Cerca de 265 a 420 a.C, período da dinastia Chin, uma enciclopédia chinesa de doenças, sintomas e remédios, já havia descrito uma doença conhecida como “água envenenada” associada a insetos voadores com sintomas semelhantes aos da dengue. Durante os séculos XV a XIX, principalmente, com a expansão comercial e o aumento do comércio de escravos, o vetor espalhou-se pelo mundo e, vários surtos de uma doença similar à dengue estão registrados. Em 1635 surto nas Antilhas Francesas, em 1699 surto no Panamá, em 1779 surto no Egito, Cairo e Indonésia, em 1780 surto na Filadélfia37,66.
Estudos apontam que entre 1779 e 1916 ocorreram oito pandemias com duração de três a sete anos, abrangendo a África, as Américas, a Ásia, a Austrália e a Europa. Os primeiros surtos de dengue hemorrágica surgiram em 1953 nas Filipinas, em 1958 na Tailândia e em 1960 no Vietnam, confirmando a circulação de vários sorotipos em uma mesma região e possivelmente atribuído às transformações geoambientais causadas pela pós guerra mundial66,67.
Entre os anos de 1955 a 2007, estima-se que ocorreram mais de 50 milhões por ano, de casos de infecções por dengue, reportados em mais de 60 países. Nas Américas Central e Sul, entre as décadas de 60 e 70 houve erradicação do Ae. Aegypti, no entanto, com passar dos anos as medidas foram descontinuadas, causando reinfestação com surtos cíclicos de a cada 3-5 anos, destacando-se a epidemia em Cuba, em 1981, com manifestação da FHD/SCD resultando em 344.203 casos notificados e 158 óbitos2,59.
No Brasil, em 1982 foram registrados clínica e laboratorialmente os primeiros casos de dengue sorotipos DENV-1 e DENV-4 na cidade de Boa Vista, Roraima. Em 1990 surgiu o DENV-2, em 2001 o DENV-3 ambos na cidade do Rio de Janeiro. Atualmente circulam simultaneamente os quatro sorotipos de DENV, com predomínio do tipo DENV-468,69.
Em 2018, foram notificados 265.934 casos prováveis de dengue no país, destes, 174.724 (65,7%) foram confirmados, sendo, 3.616 casos de dengue com sinais de alarme, 321 casos de dengue grave e 155 óbitos. Em comparação ao mesmo período, em 2017, foram registrados 239.389 casos prováveis de dengue, 2.709 casos de dengue com sinais de alarme, 293 casos de dengue grave e 185 óbitos. Evidenciam-se com as maiores taxas de incidência de casos prováveis de dengue em 2018, as regiões Centro-Oeste, com 635,9 casos/100 mil habitantes e, o Nordeste, com 118,5 casos/100 mil habitantes. Entre as Unidades da Federação, destacam-se Goiás, com 1.249,1 casos/100 mil habitantes, Rio Grande do Norte, com 679,5 casos/100 mil habitantes e Acre, com 814,7 casos/100 mil habitantes70.
No Acre, no ano de 2016 foram notificados 7.446 casos prováveis de dengue, destes, 750 (10%) confirmados, 4.538 (61%) descartados, 1.087 (15%) foram encerrados como inconclusivos por terem excedido o tempo oportuno de encerramento (60 dias) e 1.071 (14%) estão em investigação aguardando confirmação ou descarte. Em comparação ao mesmo período, em 2015, houve uma redução de 30% das notificações, foram notificados 10.672 casos, destes, 4.495 (42%) confirmados, 5.634 (53%) descartado e 543 (5%) foram encerrados como inconclusivos. Não houve registro de FHD/SCD e óbito27. Com relação ao sorotipo circulante, em 2016, foram identificados 20 casos de DENV-2, sem confirmação para outro sorotipo e, em 2015, 4 casos identificados de DENV-1, sem confirmação para outro sorotipo71.
II VÍRUS DA CHIKUNGUNYA
O vírus da chikungunya (CHIKV) é do gênero Alphavirus da família Togaviridae, estando no grupo Alphavirus do velho mundo, pertencente ao complexo de vírus da floresta de Semliki, com base nas características genéticas e antigênicas semelhantes, sendo considerado uma arbovirose16,17,18,72.
Mede aproximadamente 65-70 nm de diâmetro em forma esférica. Possui capsídeo icosaédrico composto por 240 monômeros de proteínas e, uma envelope lipídico revestido por 80 partículas proteicas agrupadas por heterodímeros de glicoproteínas E1 e E2. Seu genoma (Figura 2) é constituído por uma cadeia simples de RNA de sentido positivo, com aproximadamente 12 Kb, possui duas extremidades, 5’ limitada com uma 7-metilguanosina e na outra ponta a 3′ com poliadenilada. Existem duas ORF’s, a primeira codifica proteínas não estruturais, nsP1, nsP2, nsP3 e nsP4 e, a segunda codifica proteínas estruturais C, P62 (madura em E2 e E3) e E1 que se associam como um heterodímero, formando um dímero E1/E2 ou um trímero E1/E2/E318,19,20,72
A proteína nsP1 é necessária para o encapamento viral, tem ação enzimática MTase, podendo associar-se com proteínas de membrana. A nsP2 possui três domínios: N-terminal com ação helicase, GTPase e ATPase, C-terminal atividade de protease cliva proteínas não estruturais e o terceiro domínio tem ação enzimática MTase. A nsP3 necessária para a síntese de RNA e acredita-se estar associada à virulência. A nsP4 auxilia na replicação genômica e transcrição subgenômica 26s19,20,73,74.
A proteína estrutural C forma o núcleocapsideo, a E1 realiza fusão das membranas viral e hospedeiro, E2 liga-se ao receptor da célula hospedeira responsável pela diversidade de cepas virais, a E3 participa na montagem das partículas virais e 6k é incorporada durante o brotamento viral73,74.
Figura 2: Estrutura Genômica do CHIKV
Fonte: Weaver, 2015, (Adaptado).
O CHIKV possui um único sorotipo e, três genótipos conhecidos, o genótipo Ocidental ou do Oeste Africano (WAf) Oriental ou do Leste/Centro/Sul Africano (ECSA) e o genótipo Asiático e a Linhagem do Oceano Indico (IOL). Diversos estudos tem associado diversas manifestações clínicas neurológicas, doença em neonatos e mesmo óbitos a Linhagem IOL, sendo considerada bastante virulenta75,76.
No ciclo de replicação, a proteína E2 liga-se ao receptor da celular hospedeira e sofre endocitose. E1 libera um peptídeo hidrofóbico que se insere na membrana endossomal, estimulando a liberação do núcleocapsideo no citoplasma que, posteriormente se desintegra liberando o genoma, ligando aos ribossomos como RNAm, dando início a tradução de proteínas, formando uma fita de RNA de sentido negativo que após transcrição torna-se RNA de senso positivo, então, as novas partículas virais são montadas e, posteriormente, uma nova partícula viral infectante é liberada por exocitose18,19,20,74.
O CHIKV possui tropismo por fibroblastos da pele, infectando, também, células dendríticas, macrófagos e monócitos. As células infectadas sinalizam ao sistema imune, que libera diversas citoquinas pró-inflamatórias e anti-inflamatórias (Interferons, Interleucinas e outras) para limitar a disseminação viral. Com o decorrer essas células adentram na corrente sanguínea, propagando-se diferentes tecidos e órgãos, dentre eles, cérebro, fígado, articulações e tecido muscula74,75,76,77.
O CHIKV pode ser transmitido ao ser humano e outros animais pela picada de fêmeas infectadas dos mosquitos Ae. aegypti, habitualmente, peridomiciliar e do Ae. albopictus, geralmente, em zona rural e peri-urbana. Existem casos de transmissão vertical em intraparto de gestantes virêmicas e recentemente foi observado a presença de CHIKV no leite materno, podendo provocar infecção neonatal grave (atraso no desenvolvimento mental, paralisia cerebral e microcefalia)4,78,79.
O período de incubação no homem, é em média de três a sete dias com variação de um a doze dias, com período de viremia de até dez dias com média de dois dias antes do início dos primeiros sintomas, perdurando por mais oito dias. A incubação no vetor dura em média dez dias, sendo virêmico por toda vida80,81.
Cerca de 70% dos pacientes infectados pelo CHIKV, desenvolvem sintomas quando comparados as demais arboviroses. Os sintomas na fase aguda ou febril são parecidos ao da dengue, febre aguda (>39ºC), cefaleia, náusea, mialgia, artralgia ou poliartralgia acompanha ou não de edema e exantema com ou sem prurido, diferindo na intensidade da artralgia4,80,81.
Na fase subaguda, geralmente, a febre desaparece e a artralgia pode persistir ou agravar, incluindo poliartrite distal e tenossinovite hipertrófca subaguda em falanges, punhos e tornozelos levando a Síndrome do túnel do carpo. Além disso, pode surgir lesões purpúricas, vesiculares e bolhosas4,82,83.
A fase grave acomete, com maior frequência, crianças, idosos com mais de 65 anos e pacientes com comorbidade associadas (história de convulsão febril, diabetes, asma, insufciência cardíaca, alcoolismo, doenças reumatológicas, anemia falciforme, talassemia e hipertensão arterial sistêmica)4,83. É caracterizada por persistência dos sintomas da fase subaguda, principalmente a dor articular (com ou sem edema), a dor musculoesquelética, a dor neuropática, a limitação de movimentos, síndrome do túnel do carpo83,84.
Em alguns casos pode ocorrer, ainda, uma forma atípicas da doença, com manifestações clínicas neurológicas (meningoencefalite, encefalopatia, convulsão, síndrome de Guillain- Barré, Síndrome cerebelar, paresias, paralisias e neuropatias), oculares (neurite óptica, iridociclite, episclerite, retinite e uveíte), cardiovascular (miocardite, pericardite, insuficiência cardíaca, arritmia e instabilidade hemodinâmica), na pele (hiperpigmentação por fotossensibilidade, dermatoses vesículo bolhosa e ulcerações aftosa-like), nos rins (nefrite e insuficiência renal aguda) e outros (discrasia sanguínea, pneumonia, insuficiência respiratória, hepatite, pancreatite, síndrome da secreção inapropriada do hormônio antidiurético e insuficiência adrenal)4,81,82,85.
Ainda não existe tratamento antiviral específico para chikungunya, a terapia é paliativa, com hidratação, repouso e a administração de dipirona ou paracetamol e, em alguns casos tramadol. Não é indicado os anti-inflamatórios não hormonais (AINH) devido ao risco de sangramento aumentado4,81,82,83,85.
i CONTEXTO HISTÓRICO E EPIDEMIOLÓGICO DA CHIKUNGUNYA
A palavra Chikungunya é proveniente da língua banto de grupo étnico da província MaKonde (Tanzânia), refere-se posição curva do paciente devido a dor articular debilitante, durante um surto febril em 1952. Desde então, infectou pessoas na África, Ásia, Europa e as Américas85,86.
O primeiro caso autóctone nas Américas foi relatado em 2013, na Ilha de Saint Martin. No Brasil foi descrito em setembro de 2014 no estado do Amapá e, posteriormente, um genótipo diferente foi identificado no estado da Bahia87,88.
Em 2017, foram registrados 185.593 casos prováveis de chikungunya em comparação com 87.687 casos prováveis registrados no país em 2018, uma incidência de 42,1 casos/100 mil habitantes, destes, 68.962 (78,6 %) foram confirmados e 26.771 foram descartados. A região Sudeste apresentou o maior número de casos prováveis com 52.966 (60,4%) casos em relação ao total do país, seguido das regiões Centro-Oeste com 13.862 (15,8 %) casos, Nordeste com 11.287 (12,9 %) casos, Norte com 9.315 (10,6 %) casos e Sul com 257 (0,3 %) casos. Em 2018, foram confirmados laboratorialmente 39 óbitos, e existem 42 óbitos sob investigação, no mesmo período, em 2017 foram 192 óbitos e existem 37 sob investigação70.
No estado do Acre, em 2016 entre as semanas epidemiológicas 1 a 18 (03/01/2016 a 07/05/2016) foram notificados 844 casos suspeitos de febre chikungunya, destes, 656 (78%) casos foram na cidade de Rio Branco. Em comparação, no mesmo período de 2015 nenhuma notificação foi registrada para chikungunya27.
A partir de março de 2016 o Laboratório Central de Saúde Pública – LACEN, passou a realizar sorologia para detecção do anticorpo IgM para o diagnóstico de CHIKV. Das 407 amostras enviadas, 29 (7%) foram reagentes, 361 (89%) não reagente, 10 (2%) indeterminado e 07 (2%) não foram testadas. As amostras coletadas anteriormente a esse período foram analisadas no o Laboratório de referência da Região Norte Instituto Evandro Chagas27.
III VÍRUS DA ZIKA
O vírus da zika (ZIKV) é considerado uma arbovirose emergente, pertence ao gênero Flavivirus e à família Flaviviridae, estando relacionado com os vírus da dengue, febre amarela, vírus do Nilo Ocidental e encefalite japonesa89,90.
O ZIKV possui RNA de fita simples e senso positivo, tem aproximadamente 11kb de comprimento, contendo 10.794 nucleotídeos que codificam 3.419 aminoácidos. Dentre as 3 proteínas estruturais (C, prM e M) e as 7 proteínas não estruturais (NS1, NS2A, NS2B, NS3, NS4A, NS4B e NS5) a mais imunogênica (Figura 1), do ZIKV é a glicoproteína E, que é dividida em três domínios (DI, DII e DIII), importantes no processo de neutralização e reação cruzada, sendo que todos apresentam elevada afinidade por diferentes anticorpos específicos89,90,91.
Embora muitos estudos descrevem a replicação flaviviral ocorrendo no citoplasma da célula hospedeira, um estudo tem sugerido que o núcleo celular poderia abrigar os antígenos do ZIKV74. As informações sobre a patogênese, ainda, são pouco conhecidas, acredita-se que repliquem-se ao infectarem células dendríticas e, posteriormente, disseminando-se para os linfonodos, corrente sanguínea, órgãos e tecidos92,93.
A transmissão do ZIKV ocorre por meio da picada de mosquitos do gênero Aedes, tendo sido o vírus isolado em espécies como, Ae. africanus, Ae. aegypti e Ae. hensilli mantendo o ciclo enzoótico. No ser humano o Ae. aegypti e o Ae. albopictus tornam-se potencial vetor na transmissão93,94,95.
Diversos estudos apontam presença de ZIKV em fluidos corporais (urina, saliva, sémem e fluidos vaginais) que podem estar envolvidos na transmissão por via sexual21. Também é possível ocorrer transmissão associada a transfusão sanguínea, uma vez que o RNAv foi detectado em doadores de sangue assintomáticos durante um surto entre 2013 e 2014, na Polinésia Francesa23.
Foi detectado RNAv no leite materno de duas mães infectadas pelo ZIKV, mas não houve replicação viral na cultura de células. Não existem, até o momento, estudos que descrevam a transmissão pelo leite materno22.
O período de incubação no homem varia entre 3 a 12 dias após a picada do mosquito, os primeiros sintomas podem iniciar entre 3 e 6 dias. Durante esta fase é possível realizar o diagnóstico específico para ZIKV pelo RT-rPCR, iniciado o período de viremia surge os anticorpos IgM, podendo ser realizados testes sorológicos34.
As manifestações clínicas podem variar dependendo da localidade, inicialmente os sintomas são semelhantes aos de outras arboviroses, sem maiores complicações. A febre é baixa, podendo chegar, em alguns casos, a 39ºC cedendo de 1 a 2 dias após o surgimento de exantema, que persiste de 2 a 14 dias, além disso, é referido mialgia, artralgia e dor lombar discretas e conjuntivites, geralmente, sem secreção purulenta. Anorexia, náuseas, vômitos, vertigem e dor retro orbital podem surgir de forma inespecífica. Ainda há poucas informações sobre as alterações hematológicas, embora, haja relatos de casos que descrevem um aumento da desidrogenase lática e da proteína C reativa e discreta leucopenia e trombocitopenia97.
Outras manifestações estão sendo observadas em associação com a infecção por ZIKV. Em 2013, na Polinésia Francesa, durante um surto de infecção por ZIKV, foi registrado um aumento na prevalência de casos de Síndrome de Guillain-Barré (SGB. Em outubro de 2015, na região nordeste do Brasil, durante um surto de ZIKV foi observado durante a gestação, defeitos congênitos, insuficiência placentária, restrição de desenvolvimento intrauterino, morte fetal, e aumento no número de casos de recém-nascidos com microcefalia98. Esta é diagnosticada após o nascimento pela medida do perímetro cefálico, no sexo feminino, será ≤ 31,5 centímetros, e no sexo masculino ≤ 31,9 centímetros. Em caso de microcefalia grave o perímetro cefálico e menor ainda (Figura 3)26. Com relação à coinfecção, em 2014, na Nova Catalunha foram descritos dois casos coinfecção de DENV e ZIKV99.
No momento ainda não existem vacinas e nem medicamentos antivirais específicos, o tratamento é sintomático, com o uso analgésicos e antipiréticos, deve-se evitar medicações que contenham salicilatos para evitar a indução hemorrágica. Os suspeitos de SGB devem ser monitorados em unidades de terapia intensiva, podem ser empregados a plasmaferese ou imunoglobulina hiperimune intravenosa, os casos de microcefalia devem ser acompanhados por profissionais preparados5,24.
Figura 3: Comparação do perímetro cefálico em recém-nascidos com microcefalia
Fonte: Center of Disease Control and Prevention (CDC – EUA, 2016, Adaptado).
i CONTEXTO HISTÓRICO E EPIDEMIOLÓGICO ZIKA
O ZIKV foi isolado pela primeira vez, em 1948, em um macaco sentinela Reshus, durante pesquisa sobre a febre amarela da selva, na Floresta de Zika, Uganda. Em 1948 o vírus foi isolado em mosquitos da espécie Aedes africanus, na mesma floresta. Em 1956 estudos demonstraram que o Ae. aegypti, alimentado artificialmente, transmitia o vírus para macacos e ratos100.
Estudos realizados na Nigéria, durante 1968 e 1971-1975, isolaram o vírus de humanos, 40% tinham anticorpos neutralizantes. Casos foram relatados na Indonésia durante o ano 1977- 1978, e reapareceu novamente em um surto na Micronésia em 2007 com 49 infectados101-3. Em 2013 ressurgiu na Polinésia Francesa com cerca de 300 pacientes infectados98.
No Brasil, durante maio de 2015, o primeiro caso foi notificado como uma doença exantemática, devido à semelhança dos sintomas com o da dengue, caracterizada como “Síndrome Dengue-Like”90. Em 2017, foram registrados 17.593 casos prováveis de doença aguda pelo vírus Zika no país, em comparação a 2018 foram registrados 8.680 casos prováveis, destes, 3.984 (45,9%) casos foram confirmados, sendo que a região Sudeste apresentou o maior número de casos prováveis com 3.149 casos (36,3%), seguido das regiões Nordeste com 2.425 casos (27,9%), Centro-Oeste com 1.733 casos (20,0%), Norte com 1.326 casos (15,3%) e Sul com 47 casos (0,5%)70.
No estado do Acre, os primeiros casos suspeitos de zika foram notificados em novembro de 2015, o que resultou em 42 casos suspeitos até início de janeiro de 2016, todos no município de Rio Branco. Em 2016 de janeiro a maio registrou-se 1.269 casos suspeitos distribuídos nas cidades de Acrelândia, Bujari, Capixaba, Cruzeiro do Sul, Epitaciolândia, Feijó, Manuel Urbano, Plácido de Castro, Porto Acre, Senador Guiomard, Sena Madureira, Xapuri, Rio Branco e Tarauacá. Do total entre os anos de 2015 e 2016, 14 (1%) dos casos foram confirmados pelo Instituto Evandro Chagas, 1 caso confirmado pelo laboratório LABCO NOÛS, 17 (1%) descartados e 1.279 (98%) seguem em investigação epidemiológica e ou laboratorial até o momento27.
DIAGNÓSTICO CLÍNICO E LABORATORIAL DAS ARBOVIROSES
No diagnóstico clínico diferencial a maioria das arboviroses tem manifestações clínicas iniciais similares, para tanto foram categorizadas em síndromes clínicas: a síndrome febril, síndrome exantemática febril, síndrome hemorrágica febril, síndrome dolorosa abdominal, síndrome do choque e a síndrome meníngea2,4,5,56.
No entanto, com o decorrer do tempo, podem levar a sintomas específicos, em casos de dengue pode manifestar-se como um dos primeiros sintomas da febre intensa, podendo evoluir para FHD e, mesmo, a SCD. A artralgia crônica se manifesta, geralmente, nos casos de Chikungunya, podendo conduzir a incapacidade persistente. Nos casos de zika estudos têm descrito diversos acometimentos neurológicos como a SGB e as malformações congênitas. Daí um diagnóstico diferencial, rápido e preciso se torna essencial para que o paciente inicie o tratamento imediatamente (Tabela 1)2,4,5,56.
Tabela 1: Diagnóstico diferencial das síndromes febris.
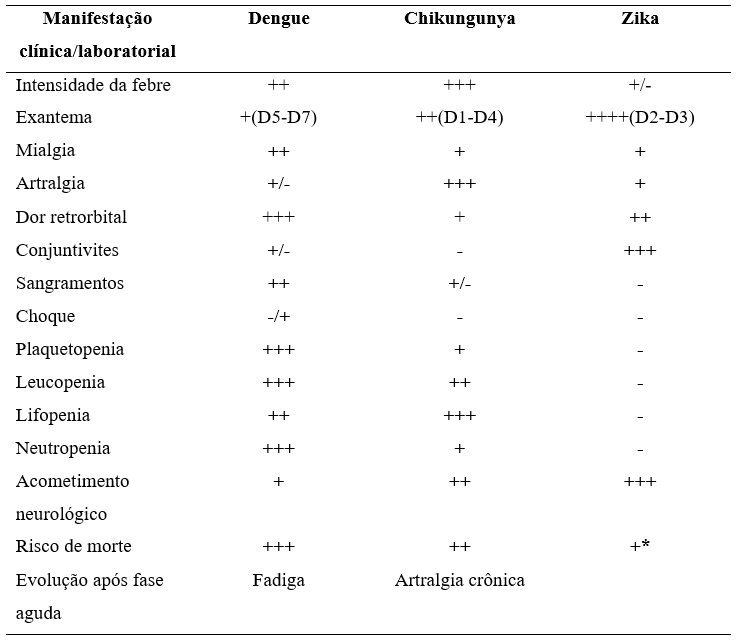
Fonte: (Ministério da Saúde. Dengue: Diagnóstico e manejo clínico: adulto e criança, 2016, Brito e Cordeiro, 2016, adaptado).
+++=70-100% dos pacientes; ++=40-69%; +=10-39%; +/-=<10%; -=0%.
*Pode haver risco de morte nos casos neurológicos como a SGB decorrente de Zika ou para crianças com malformações congênitas graves.
DIAGNÓSTICO LABORATORIAL ESPECÍFICO
As arboviroses por terem sintomas iniciais inespecíficos podem ser facilmente confundidas, tornando o diagnóstico clínico diferencial bastante difícil. Com isso faz necessário o diagnóstico laboratorial, principalmente, em regiões endêmicas onde há circulação simultânea desses vírus25. Recentemente uma pesquisa realizada em Recife entre 2015 e 2016, constatou que 60% dos pacientes com sintomas característicos da dengue estavam, de fato, com chikungunya ou zika. Isso demonstra que nem sempre a clínica do paciente reflete o real agente infeccioso, daí a importância do diagnóstico laboratorial especifico104.
DIAGNÓSTICO SOROLÓGICO E MOLECULAR
O diagnóstico específico das infecções por arboviroses pode ser realizado por métodos diretos e indiretos. Na fase aguda da doença os métodos diretos são mais eficientes, sendo possível identificar o genoma viral e seus componentes na amostra, tendo maior precisão e especificidade, embora, sejam menos acessíveis a sua realização devido aos altos custos para a realização. Já os métodos indiretos são uteis após o período de viremia, quando o sistema imune do indivíduo já produziu anticorpos IgM ou IgG, estes testes possuem alta sensibilidade e baixa especificidade, no entanto, são mais acessíveis devido ao baixo custo para a sua realização28,29
A técnica de isolamento consiste em inocular soro de pacientes, em período de viremia, em linhagens celulares de camundongos ou de mosquitos (Ae. albopictus – clone C6/36), após o vírus ser isolado, é identificado por imunofluorescência, a partir de anticorpos monoclonais especifico para o vírus, a confirmação laboratorial pode viral variar de 7 a 12 dias28,29.
Dentre os testes sorológicos, os métodos de inibição da hemaglutinação (IH), fixação do complemento (FC), teste de neutralização (TN) requerem coleta de amostras pareadas e, além disso, exibem alta reatividade cruzada28,29. Já os ensaio imunoenzimáticos para captura de IgM (MAC ELISA) e de IgG (G-ELISA), e os testes rápidos imunocromatografos atuam detectando IgM, IgG ou capturando antígeno viral NS1, atualmente estes tem sido os ensaios imunoenzimáticos mais utilizados devido ao baixo custo e facilidade de execução29,97.
A desvantagens dos testes sorológicos é a elevada ocorrência reações cruzadas, principalmente, pelo DENV após uma infecção secundária com outras arboviroses do mesmo gênero, inclusive de pessoas que não tiveram contato com o vírus mas foram vacinados com a febre amarela, gerando resultados falso-positivos. 29,30,30
A detecção de ácidos nucleicos virais é realizada pela técnica molecular da Reação em Cadeia da Polimerase de Transcrição Reversa (RT-PCR), pode ser concebida em um formato one step para detectar simultaneamente outros arbovírus, tais como DENV, CHIKV e ZIKV, faz análises qualitativas e consiste em duas etapas principais: a transcrição reversa do RNAv em DNA de fita simples (cDNA) e a conversão em DNA de fita dupla e sua amplificação89,97. A RT-PCR em tempo real (rRT-PCR) é uma variação aprimorada do RT-PCR, faz análises quantitativas do genoma viral nos fluidos orgânicos e consiste em apenas uma única etapa, incluindo uma sonda e iniciadores (primers) que se ligam às regiões dos genes de interesse31,32. Ambas técnicas de PCR tem alta precisão e especificidade, no entanto, podem apresentar reações cruzadas, falsos-negativo devido à pouca especificidade de primers para os Flavivirus, alto custo dos kits comerciais, de equipamentos, pessoal especializado (Tabela 2) 31,32,89,97
Tabela 2: Vantagens e desvantagens dos principais métodos sorológicos e moleculares.
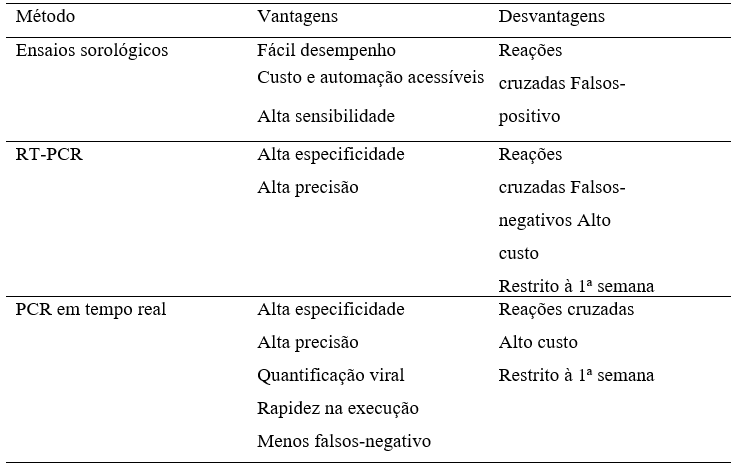
Fonte: Peelling et al., 2010 (Adaptado).
Os anticorpos IgM podem ser detectáveis no soro ou plasma com 3 a 5 dias do início dos primeiros sintomas, atingindo níveis máximos em 7 a 8 dias, após o sétimo dia ocorre a soroconversão período mais confiável para a detecção de anticorpos, com 1 a 2 meses vai diminuindo a titulação. Enquanto que os anticorpos do tipo IgG podem ser detectáveis em títulos muito baixos a partir de 4 dias, com pico em duas semanas perdurando por 2 a 3 anos após a infecção, o que possibilita a detecção da doença no período de convalescência33,34.
O Antígeno NS1 está presente na circulação sanguínea desde o primeiro dia de infecção até o início da soroconversão IgM para IgG (em média a soroconversão inicia-se após o sétimo dia), inclusive durante as reinfecções31.
O RNAv pode ser encontrado no período de viremia da doença em média de 0 a 5 dias do início dos primeiros sintomas, na urina permanece por mais de 10 dias e no sêmen por mais de dois meses33,96
O uso de técnicas de diagnóstico molecular embora tenham alto custo, são consideradas mais precisas e especificas para confirmar definitivamente o agente etiológico dessas síndromes febris, dessa forma, poderiam ser identificado os vírus e sorotipos circulantes e as regiões endêmicas, auxiliando a vigilância epidemiológica na antecipação de medidas preventivas e de controle de potenciais agravos na comunidade35.
CONCLUSÃO
A partir da busca na literatura, em bases de dados, como etapa principal para realização deste estudo, na qual foram identificados e analisados 97 artigos, verificou-se a necessidade a e de um maior investimento e incentivo a estudos relacionados às arboviroses. As arboviroses constituem um grave problema de saúde pública nas regiões subtropicais e tropicais por oferecem condições ecológicas favoráveis e apresentarem expressividade em morbidade e/ou mortalidade.
No Brasil a tríade DENV, CHIKV e ZIKV representam um sério problema de saúde pública devido em condições favoráveis para a reprodução do vetor. O uso de técnicas de diagnóstico molecular embora tenham alto custo, são consideradas mais precisas e específicas para confirmar definitivamente o agente etiológico dessas síndromes febris, dessa forma, pode ser identificado os vírus e sorotipos circulantes e as regiões endêmicas, auxiliando a vigilância epidemiológica na antecipação de medidas preventivas e de controle de potenciais agravos na população.
Mediante aos resultados é necessário estudos que fortaleçam e contribuam para melhoria da qualidade das informações e conscientiação da população sobre as arboviroses e suas sintomatologias.
REFERÊNCIAS BIBLIOGRÁFICAS
1 Guzman MG, Halstead SB, Artsob H, Buchy P, Farrar J, Gubler DJ, et al. Dengue: a continuing global threat. Nat Rev Microbiol. 2010;8(12 Suppl):7-16.
2 World Health Organization (WHO). Dengue guidelines for diagnosis, treatment, prevention and control: new edition [Internet]. Geneva: WHO; 2009 [atualizado em 14 de setembro de 2018; citado 2019, 24 de abril]. Disponível em: https://www.who.int/tdr/publications/ documents/dengue-diagnosis.pdf.
3 Pialoux L, Gaüzère BA , Jaureguiberry S, Strobel M. Chikungunya, an epidemic arbovirosis. Lancet Infect. Dis. 2007;7(5):319-27.
4 Ministério da Saúde (MS). Chikungunya: manejo clínico [Internet]. Brasília: MS; 2017 [atualizado em 14 de setembro de 2018; citado 2019, 24 de abril]. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/chikungunya_manejo_clinico.pdf.
5 Pan America Health Organization, World Health Organization (PAHO/WHO). Guidelines for surveillance of Zika virus disease and its complications [internet]. Washington: PAHO/WHO; 2016 [atualizado em 14 de setembro de 2018; citado 2019, 24 de abril]. Disponível em: http://iris.paho.org/xmlui/bitstream/handle/123456789/28405/978927 5118948
_eng.pdf?sequence=1&isAllowed=y.
6 Santos NSO, Romanos MTV, Wigg MD. Introduction to virology human. 2th ed. Rio de Janeiro; Guanabara Koogan; 2008. 290–330 p.
7 Holmes EC, Worobey M, Rambaut A. Philogenetic evidence for recombination in dengue virus. Mol Biol Evol. 1999;16(3):405-9.
8 Lindenbach BD, Rice CM. The Flavivirus: structure, replication and evolution. Academic. 2003;59(1):23-61.
9 Lindenbach BD, Thiel HJ, Rice CM. Flaviviridae: The Viruses and Their Replication. Fields Virology. 2007;5(1):1101-52
10 Blitvich BJ, Firth AE. Insect-specific flaviviruses: A systematic review of their discovery, host range, mode of transmission, superinfection exclusion potential and genomic organization. Viruses. 2015;7(4):1927-59.
11 Sampath A, Padmanabhan R. Molecular target for flavivirus drug discovery. Antiviral Res. 2009;81(1):6-15.
12 Clyde K, Kyle JL, Harris E. Recent Advances in Deciphering Viral and Host Determinants of Dengue Virus Replication and Pathogenesis. J Virol. 2006; 80(23):11418-31.
13 Bartensclager R, Miller S. Molecular aspects of Dengue virus replication. Future Microbiol. 2008;3(2):155-65.
14 Alvarez DE, Lella EAL, Fucito S, Gamarnik AV. Role of RNA structures present at the3´UTR of dengue virus on translation, RNA synthesis, and viral replication. Virology. 2005;339(2):200-12.
15 Halstead SB. Observations related to pathogensis of dengue hemorrhagic fever. VI. Hypotheses and discussion. Yale J Biol Med. 1970;42(5):350-62.
16 Forrester NL, Palacios G, Tesh RB, Savji N, Guzman H, Sherman M, et al. Genome-scale phylogeny of the alphavirus genus suggests a marine origin. J Virol. 2012;86(1):2729–38.
17 Rupp JC, Sokoloski KJ, Gebhart NN, Hardy RW. Alphavirus RNA synthesis and non- structural protein functions. J Gen Virol. 2015;96(9):2483-500.
18 Strauss JH, Strauss EG. The alphaviruses: gene expression, replication, and evolution. Microbiol Ver. 1994;58(3)491-562.
19 Weaver SC, Winegar R, Manger ID, Forrester NL. Alphaviruses: population genetics and determinants of emergence. Antiviral Research. 2012; 94(3):242-57.
20 Weaver SC, Lecuit M. Chikungunya virus and the global spread of a mosquito-borne disease. N Engl J Med. 2015;372(13):1231-9.
21 Musso D, Roche C, Robin E, Nhan T, Teissier A, Cao-Lormeau VM. Potential sexual transmission of Zika virus. Emerg Infect Dis. 2015;21(2):359-61
22 Besnard M, Lastère S, Teissier A, Cao-Lormeau VM, Musso D. Evidence of perinatal transmission of Zika virus, French Polynesia, December 2013 and February 2014. Euro Surveill. 2014:19(13):20751.
23 Musso D, Nhan T, Robin E, Roche C, Bierlaire D, Zisou K, et al. Potential for Zika virus transmission through blood transfusion demonstrated during an outbreak in French Polynesia, November 2013 to February 2014. Euro Surveill. 2014;19(19):20761.
24 Ansar V, Valadi N. Guillain-Barré syndrome. Prim Care. 2015;42(2):189-93.
25 Shankar A, Patil A, Skariyachan S. Recent perspectives on genome, transmission, clinical manifestation, diagnosis, therapeutic strategies, vaccine developments, and challenges of zika virus research. Front Microbiol. 2017;8:1–14.
26 Centers for Diase Control and Prevention (CDC). Congenital Zika Syndrome & Other Birth Defects [internet]. Geórgia: CDC; 2016 [atualizado em 14 de setembro de 2018; citado 2019,
24 de abril]. Disponível em: https://www.cdc.gov/pregnancy/zika/testing-follow-up/zika- syndrome-birth-defects.html.
27 Secretaria Estadual de Saúde (SESACRE). Boletim da Dengue, Chikungunya e Zika vírus [internet]. Acre: SESACRE; 2016. [atualizado em 12 de junho de 2016; citado 2019, 04 de abril]. Disponível em: http://saude.ac.gov.br/wps/wcm/connect/1b01f5804d7818ec98 1efb1 a15eb5101/Boletim+N+13.pdf?MOD=AJPERES&CONVERT_TO=url&CACHEID=1b01f5 804d7818ec981efb1a15eb5101.
28 Peeling RW, Artsob H, Pelegrino JL, Buchy P, Cardosa MJ, Devi S, et al. Evaluation of diagnostic tests: dengue. Nat Rev Microbiol. 2010;8(12 Suppl):30-7.
29 Lanciotti RS, et. al. Rapid Detection and Typing of Dengue Viruses from Clinical Samples by Using Reverse Transcriptase-Polymerase Chain Reaction. J Clin Microbiol. 1992;30(3):545- 51.
30 Centers for Diase Control and Prevention (CDC). Testing for Dengue Virus [internet]. Geórgia: CDC; 2016 [atualizado em 14 de setembro de 2018; citado 2019, 24 de abril]. Disponível em: https://www.cdc.gov/dengue/healthcareproviders/testing/index.html? CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fdengue%2Fclinicallab%2Flaboratory.html.
31 Singh RK, Dhama K, Karthik K, Tiwari R, Khandia R, Munjal A, et al. Advances in diagnosis, surveillance, and monitoring of zika virus: An update. Front Microbiol. 2018;8:1– 17.
32 Moreli ML, Costa VG. A systematic review of molecular diagnostic methods for the detection of arboviruses in clinical specimens in Brazil and the importance of a differential diagnosis. Virol Disc. 2013;1(1):1-8.
33 Calvet GA, Santos FB, Sequeira PC. Zika virus infection: Epidemiology, clinical manifestations and diagnosis. Curr Opin Infect Dis. 2016;29(5):459-66.
34 Musso D, Gubler DJ. Zika virus. Clin Microbiol Rev. 2016;29(3):487-524.
35 Mardekian SK, Roberts AL. Diagnostic Options and Challenges for Dengue and Chikungunya Viruses. Biomed Res Int. 2015;3(1):1-8.
36 Messina JP, Brady OJ, Scott TW, Zou C, Pigott DM, Duda KA, et al. Global spread of Dengue virus types: mapping the 70 year history. Trends Microbiol. 2014;22(3): 138-46.
37 Vasilakis N, Weaver SC. The History and Evolution of Human Dengue Emergence. Adv Virus Res. 2008;72(1):1-76.
38 Kyle JL, Harris E. Global spread and persistence of Dengue. Annu Rev Microbiol. 2008;62(1):71-92.
39 Huang YJ, Higgs S, Horne KM, Vanlandingham DL. Flavivirus-mosquito interactions. Viruses. 2014;6(11):4703-30.
40 Chambers TJ, Hahn CS, Galler R, Rice CM. Flavivirus Genome, Organization, Expression and Replication. Annu Rev Microbiol. 1990;44(1):649-88
41 Santos CLS, Bastos MMA, Sallum MAM, Rocco IM. Molecular characterization of dengue virases type 1 and 2 isolated from a concurrent human infection. Rev Inst Med Trop S Paulo. 2003;45(1):11-6
42 Henchal EA, Putnak JR. The Dengue Viruses. Clin Microbiol Rev. 1990;3(1):376-96.
43 Bartensclager R, Miller S. Molecular aspects of Dengue virus replication. Future Microbiol.2008;3(2):155-65.
44 Huang YJ, Higgs S, Horne KM, Vanlandingham DL. Flavivirus-mosquito interactions. Viruses. 2014;6(11):4703-30.
45 Kuhn RJ, Zhang W, Rossmann MG, Pletnev SV, Corver J, Lenches E, et al. Structure of dengue virus: implications for flavivirus organization, maturation, and fusion. Cell. 2002;108(5):717-25.
46 Alvarez DE, Lella EAL, Fucito S, Gamarnik AV. Role of RNA structures present at the 3´UTR of dengue virus on translation, RNA synthesis, and viral replication. Virology. 2005;339(2):200-12.
47 Zhou Y, Mammen MP, Klungthong C, Chinnawirotpisan P, Vaughn DW, Nimmannitya S, et al. Comparative analysis reveals no consistent association between the secondary structure of the 3´untranslated region of dengue viruses and disease syndrome. J. Gen. Virol. 2006;87(9):2595-603.
48 Markoff, L. 5´- and 3´- Noncoding Regions in Flavivirus RNA. Adv. Virus Res. 2003;59(1):177-228.
49 Clemons A, Haugen M, Flannery E, Tomchaney M, Kast K, Jacowski C, et al. Aedes aegypti: an emerging model for vector mosquito development. Cold Spring Harb Protoc. 2010;10(1):1-17.
50 Jansen CC, Beebe NW. The dengue vector Aedes aegypti: what comes next. Microbes Infect. 2010;12(4):272-9
51 Joshi V, Sharma RC, Sharma Y, Adha S, Sharma K, Sing H, et al. Importance of socioeconomic status and tree holes in distribution of Aedes mosquitoes (Diptera: Culicidae) in Jodhpur, Rajasthan, India. J Med Entomol. 2006;43(2):330-6.
52 McBride WJ, Bielefeldt-Ohmann H. Dengue viral infections; pathogenesisand epidemiology. Microbes infect. 2000;2(9):1041-5
53 Wang, Ni H, Xu R, Barrett AD, Watowich SJ, Gubler DJ, et al. Evolutionary relationships of endemic/epidemic and sylvatic dengue viruses. J Virol. 2000;74(7):3227–34.
54 Whitehead SS, Blaney JE, Durbin AP, Murphy BR. Prospects for a dengue virus vaccine. Nat Rev Microbiol. 2007;5(7):518-28.
55 Rothman AL. Dengue: defining protective versus pathologic immunity. J Clin Invest. 2004;113(7):946-51.
56 Ministério da Saúde (MS). Dengue: Diagnóstico e manejo clínico: adulto e criança [Internet]. Brasília: MS; 2016 [atualizado em 14 de setembro de 2018; citado 2019, 24 de abril]. Disponível em: http://portalarquivos2.saude.gov.br/images/pdf/2016/janeiro/14/dengue- manejo-adulto-crianca-5d.pdf.
57 Rosen L. The Emperor’s New Clothes revisited, or reflections on the pathogenesis of dengue hemorrhagic fever. Am J Trop Med Hyg. 1977;26(3):337-43.
58 Araújo FM, Nogueira RM, Araújo JM, Ramalho IL, Roriz ML, Melo ME, et al. Concurrent infection with dengue virus type-2 and DENV-3 in a patient from Ceará, Brazil. Mem Inst Oswaldo Cruz. 2006;101(8):925-8.
59 Guzman MG, Kouri G. Dengue haemorrhagic fever integral hypothesis: confirming observations, 1987-2007. Trans R Soc Trop Med Hyg. 2008;102(6):522-3.
60 Martina BEE, Koraka P, Osterhaus ADME. Dengue virus pathogenesis: an integrated view. Clin microbiol rev. 2009;22(4):564.
61 Figueiredo LTM. Patogenia das infecções pelos vírus do dengue. Medicina, Ribeirão Preto. 1999;32(1):15-20.
62 Srikiatkhachorn A. Plasma leakage in dengue haemorrhagic fever. Thromb Haemost. 2009;102(6):1042-9
63 Guzman MG, Vázquez S, Kouri G. Dengue: where are we today? Malays J Med Sci. 2009;16(3):4-11.
64 George FHM. Abordagem Clínica para casos de dengue. In: saúde D-Gd, editor. Lisboa: Ministério da saúde; 2008.
65 Guzman MG, Halstead SB, Artsob H, Buchy P, Farrar J, Gubler DJ, et al. Dengue: a continuing global threat. Nat Rev Microbiol. 2010;8(12 Supl):7-16.
66 Weaver SC, Vasilakis N. Molecular evolution of dengue viruses: contributions of phylogenetics to understanding the history and epidemiology of the preeminent arboviral disease. Infect Genet Evol. 2009;9(4):523-40.
67 Howe, GM. A world geography of human diseases. Med Hist. 1979;23(2):242-3.
68 Câmara FP, Theophilo RLG, Santos GT, Pereira SRFG, Câmara DCP, Matos RRC. Estudo retrospectivo (histórico) da dengue no Brasil: características regionais e dinâmicas. Rev Soc Bras Med Trop. 2007;40(2):192-6.
69 Osanai CH, Travassos RAP, Tang AT, Amaral RS, Passos AD, Tauil PL. Dengue Outbreak in Boa Vista, Roraima. Preliminary report. Rev Inst Med Trop São Paulo.1983;25(1):53-4.
70 Ministério da Saúde (MS). Boletim Epidemiológico: Monitoramento dos casos de dengue, febre de chikungunya e doença aguda pelo vírus Zika até a Semana Epidemiológica até a semana 52 de 2018 [Internet]. Brasília: MS; 2019. [atualizado em 14 janeiro 2019; citado 2019, 04 de abril]. Disponível em: http://portalarquivos2.saude.gov.br/images /pdf/2019/ janeiro /28
/2019-002.pdf.
71 Ministério da Saúde (MS). Dengue: notificações registradas no sistema de informação de agravos de notificação: Acre: Casos Prováveis por Ano notificação segundo Sorotipo [Internet]. Acre: MS; 2019. [atualizado em 04 de abril de 2019; citado 2019, 26 de abril]. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sinannet/cnv/denguebac.def.
72 Cleton N, Koopmans M, Reimerink J, Godeke GJ, Reusken C. Come fly with me: review of clinically important arboviruses for global travelers. J Clin Virol. 2012;55(3):191-203.
73 Delang L, Li C, Tas A, Quérat G, Albulescu IC, Burghgraeve DT, et al. The viral capping enzyme nsP1: a novel target for the inhibition of Chikungunya virus infection. Sci Rep. 2016;22(6):31819.
74 Kumar S, Mamidi P, Kumar A, Basantray I, Bramha U, Dixit A, et al. Development of novel antibodies against non-structural proteins nsP1, nsP3 and nsP4 of Chikungunya virus: potential use in basic research. Arch Virol. 2015;160(11):2749-61.
75 Presti AL, Lai A, Cella E, Zehender G, Ciccozzi M, et al. Chikungunya virus, epidemiology, clinics and phylogenesis: a review. Asian Pac J Trop Med. 2014;7(12):925-32.
76 Sudeep AB, Parashar D. Chikungunya: an overview. J Biosci. 2008;33(4):443-9.
77 Coffey LL, Forrester N, Tsetsarkin K, Vasilakis N, Weaver SC. Factors shaping the adaptive landscape for arboviruses: implications for the emergence of disease. Future Microbiol. 2013;8(2):155-76.
78 Chompoosri J, Thavara U, Tawatsin A, Boonserm R, Phumee A, Sangkitporn S, et al. Vertical transmission of Indian Ocean Lineage of Chikungunya virus in Aedes aegypti and Aedes albopictus mosquitoes. Parasit Vectors. 2016;23(9):227.
79 Campos GS, Bandeira ACA, Rocha VFD, Dias JP, Carvalho RH, Sardi SI. First detection of Chikungunya virus in breast milk. The Pediatr Infect Dis J. 2017;36(10):1015-17.
80 Kam YW, Ong EK, Rénia L, Tong JC, Ng LF. Immuno-biology of Chikungunya and implications for disease intervention. Microbes Infect. 2009;11(14-15):1186-96.
81 Lum FM, Ng LF. Cellular and molecular mechanisms of Chikungunya pathogenesis. Antiviral Res. 2015;120:165-74.
82 Miranda IA, Oliveira CC, Poian AT. Molecular mechanisms involved in the pathogenesis of alphavirus-induced arthritis. BioMed Research International. 2013;2013(1):1-11.
83 Suhrbier A, Jaffar-bandjee MC, Gasque P. Arthritogenic Alphaviruses an overview. Nat Rev Rheumatol. 2012;8(7):420-9.
84 Schilte C, Staikowsky F, Couderc T, Madec Y, Carpentier F, Kassab S, et al. Chikungunya virus-associated long-term arthralgia: a 36-month prospective longitudinal study. PLOS Negl Trop Dis. 2013;7(3):e2137.
85 Walling AD, Dickson G. Guillain-Barré syndrome. Am Fam Physician. 2013;87(3):191-7.
86 Robinson MC. An epidemic of virus disease in Southern Province, Tanganyika Territory, in 1952-53: Clinical features. 1955;49(1):28-32.
87 Cunha RV, Trinta KS. Chikungunya virus: clinical aspects and treatment – A Review. Mem Inst Oswaldo Cruz. 2017;112(8)523-31.
88 Figueiredo ML, Figueiredo LT. Emerging alphaviruses in the Americas: Chikungunya and Mayaro. Rev Soc Bras Med Trop. 2014;47(6):677-83.
89 Kuno G, Chang GJ. Full-length sequencing and genomic characterization of Bagaza, Kedougou, and Zika viroses. Arch Virol. 2007;152(4):687-96.
90Cook S, Holmes EC. A multigene analysis of the phylogenetic relationships among the flaviviruses (Family: Flaviviridae) and the evolution of vector transmission. Arch Virol. 2006;151(2):309-25.
91 Buckley A, Gould EA. Detection of virus-specific antigen in the nuclei or nucleoli of cells infected with Zika or Langat virus. J Gen Virol. 1988;69(Pt 8):1913-20.
92 Diamond MS, Shrestha B, Mehlhop E, Sitati E, Engle M. Innate and adaptive immune responses determine protection against disseminated infection by West Nile encephalitis virus. Viral Immunol. 2003;16(3):259-78.
93Marchette NJ, Garcia R, Rudnick A. Isolation of Zika virus from Aedes aegypti mosquitoes in Malaysia. Am J Trop Med Hyg. 1969;18(3):411-5.
94 Ledermann JP, Guillaumot L, Yug L, Tided M, Machieng P, Pretrick M, et al. Aedes hensilli as a potential vector of Chikungunya and Zika viruses. PLoS Negl Trop Dis. 2014;8(10):e3188.
95 Grard G, Caron M, Mombo IM, Nkoghe D, Ondo SM, Jiolle D, et al. Zika virus in Gabon (Central Africa) – 2007: a new threat from Aedes albopictus? PLoS Negl Trop Dis. 2014;8(2):e2681.
96 Pinto VLJ, Luz K, Parreira R, Ferrinho P. Zika Virus: A Review to Clinicians. Acta Med Port. 2015;28(6);760-5.
97 Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ, et al. Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. Emerg Infect Dis. 2008;14(8):1232–9.
98 Oehler E, Watrin L, Larre P, Leparc-Goffart I, Lastere S, Valour F, et al. Zika virus infection complicated by Guillain-Barre syndrome-case report, French Polynesia, December 2013. Euro Surveill. 2014;6(19):20720.
99 Dupont-Rouzeyrol M, O’Connor O, Calvez E, Daurès M, John M, Grangeon JP, et al. Co infection with Zika and dengue viruses in 2 patients, New Caledonia, 2014. Emerg Infect Dis. 2015;21(2):381-2.
100 Dick GW, Kitchen SF, Haddow AJ. Zika virus. I. Isolations and serological specificity. Trans R Soc Trop Med Hyg. 1952;46(5):509–20.
101 Macnamara FN. Zika virus: a report on three cases of human infection during an epidemic of jaundice in Nigeria. Trans R Soc Trop Med Hyg. 1954;48(2):139–45.
102 Boorman JP, Porterfield JS. A simple technique for infection of mosquitoes with viruses; transmission of Zika virus. Trans R Soc Trop Med Hyg. 1956;50(3):238–42.
103 Moore DL, Causey OR, Carey DE, Reddy S, Cooke AR, Akinkugbe FM, et al. Arthropod- borne viral infections of man in Nigeria, 1964–1970. Ann Trop Med Parasitol 1975;69(1):49- 64.
104 Magalhaes T, Braga C, Cordeiro MT, Oliveira ALS, Castanha PMS, Maciel APR, et al. Zika vírus displacement by a chikungunya outbreak in Recife, Brazil. PLoS Negl Trop Dis. 2017;11(11):1-13.
105 Ministério da Saúde (MS). Sistema de Informação de Agravos de Notificação: Ficha de Investigação Dengue e Chikungunya [Internet]. Brasília: MS; 2016 [atualizado em 12 de setembro de 2017; citado 2019, 24 de abril]. Disponível em: http://www.saude.pr.gov.br/ arquivos/File/FICHA_DENGCHIK.pdf.
106 Teixeira MG, Costa MC, Barreto ML, Mota E. Dengue and dengue hemorrhagic fever epidemics in Brazil: what research is needed based on trends, surveillance, and control experiences? Cad Saude Publica. 2005;21(5):1307-15.
107 Marques CDL, Duarte ALBP, Ranzolin A, Dantas AT, Cavalcanti NG, Gonçalves RSG, et al. Recommendations of the Brazilian Society of Rheumatology for diagnosis and treatment of Chikungunya fever. Part 1 – Diagnosis and special situations. Rev Bras Reumatol. 2017;57(2):421-37.
108 Costa CA, Thézé J, Komninakis SCV, Sanz-Duro RL, Felinto MRL, et al. Spread of Chikungunya Virus East/Central/South African Genotype in Northeast Brazil. Emerg Infect Dis. 2017;23(10):1472-4.
109 Ruckert C, Weger-Lucarelli J, Garcia-Luna SM, Young MC, Byas AD, Murrieta RA, et al. Impact of simultaneous exposure to arboviruses on infection and transmission by Aedes aegypti mosquitoes. Nat Commun. 2017;8(1);15412.
110 Le Coupanec A, Tchankouo-Nguetcheu S, Roux P, Khun H, Huerre M, Morales-Vargas R, et al. Co-Infection of Mosquitoes with Chikungunya and Dengue Viruses Reveals Modulation of the Replication of Both Viruses in Midguts and Salivary Glands of Aedes aegypti Mosquitoes. Int J Mol Sci.2017;18(8):e1708.
111 Furuya-kanamori L, Liang S, Milinovich G, Magalhaes RJS, Clements ACA, Hu W, Brasil P, et al. Co-distribution and co-infection of chikungunya and dengue viruses. BMC Infect Dis. 2016;16(84):1-11.
112 Mukherjee S, Dutta SK, Sengupta S, Tripathi A. Evidence of dengue and Chikungunya virus co-infection and circulation of multiple Dengue serotypes in a recent Indian outbreak. Eur J Clin Microbiol Infect Dis. 2017;36(11):2273-9.
113 Clinical and Laboratory Standards Institute (CLSI). Collection, transport, preparation and storage of specimens for molecular methods; approved guideline. CLSI document MM13-A. Pennsylvania, USA: CLSI, 2005.
1Mestrado em ciências da saúde
Enfermeiro da secretaria Estadual de saúde do Acre
saudedohomemestadual@gmail.com
2Pós-doutorado em ciências morfológicas
Fisioterapeuta
Universidade Federal do Acre
carolina.soares@ufac.br
3Doutora em Saúde Pública/ Médica Infectologista
Universidade Federal do Acre
cirley.lobato@ufac.br
Contato: saudedohomemestadual@gmail.com
