REGISTRO DOI: 10.5281/zenodo.10499271
João Soares Felício
Davi Lucas das Chagas Cardoso
Gustavo Tavares Lima
Karem Mileo Felicio
Natercia Neves Marques de Queiroz
RESUMO:
O COVID-19 é uma doença que assola o mundo, sua fisiopatologia envolve reações inflamatórias em diversas partes do organismo. A Diabetes Mellitus é uma doença crônica caracterizada pela incapacidade de metabolizar glicose adequadamente, desencadeando diversas complicações, dentre as quais podemos destacar as inflamações. Tendo em vista que o COVID-19 cursa com um quadro inflamatório agudo, ao somar-se a um quadro inflamatório crônico pré-existente do paciente portador de Diabetes resulta em uma exacerbação dos sintomas, impactando no desfecho durante a infecção do SSARS-CoV-2. O presente estudo tem por objetivo realizar uma coleta de dados sobre o impacto e desfecho da infecção pelo SARS-CoV-2 neste grupo de risco. A metodologia desse levantamento foi uma revisão narrativa de literatura, reunindo dados expostos em trabalhos científicos acessados pelos motores de pesquisa acadêmica: Scientific Electronic Library Online (SciELO), e Publications of Medical Analysis and Retrieval System Online (PubMed), com objetivo de responder a pergunta norteadora “pacientes com diabetes mellitus são mais propensos ao óbito quando hospitalizados por COVID-19?”. No campo da busca de dados, foram selecionados os seguintes Descritores em Ciências da Saúde (DeCS): COVID-19; Diabetes; Mortalidade; Desfecho.
Palavras-chave: COVID-19. Diabetes. Mortalidade. Desfecho.
ABSTRACT:
COVID-19 is a disease that plague’s the world, its pathophysiology involves inflammatory reactions in different parts of the organism. Diabetes Mellitus is a chronic disease characterized by inability to metabolize glucose properly, triggering several complications, highlighting inflammation. Bearing in mind that COVID-19 courses with an acute inflammatory condition, when added to a pre-existing chronic inflammatory condition of the patient with diabetes, it leads to an exacerbation of symptoms, impacting the outcome during the SARS-CoV-2 infection. The present study aims to collect data on the impact and outcome of SARS-CoV-2 infection in this risk group. The methodology of this survey was a narrative review of literature, gathering data exposed in scientific studies accessed by academic search engines: Scientific Electronic Library Online (SciELO), and Publications of Medical Analysis and Retrieval System Online (PubMed), in order to answer the guiding question “Are patients with diabetes mellitus more likely to die when hospitalized by COVID-19?”. In the field of data search, the following Health Sciences Descriptors (DeCS) were selected: COVID-19; Diabetes; Mortality; Outcome.
Keywords: COVID-19. Diabetes. Mortality. Outcome.
1. INTRODUÇÃO
A maior pandemia nos últimos 100 anos teve início nas primeiras semanas de dezembro de 2019 na cidade de Wuhan, China uma série de casos com sintomas de tosse seca, febre, mal- estar e dispneia (LI; KUO; SHIN, 2020) levou a descoberta de um novo coronavírus, diferente do MERS-CoV e do SARS-CoV (ZHU et al, 2019), denominado SARS-CoV2 é o sétimo membro da família dos coronavírus a infectar humanos (WU et al, 2020)
O vírus tem como principal porta de entrada em células humanas a enzima conversora de angiotensina 2 (ECA2), assim como o SRAG-CoV (responsável por uma epidemia, principalmente no continente asiático entre 2002 e 2003 que infectou cerca de 8000 pessoas) (CHAN-YEUNG; XU, 2003), que é expressa principalmente em células dos alvéolos pulmonares, miócitos cardíacos, células do endotélio vascular, dentre outras (WALLS et al, 2020 e ZHANG et al, 2020)
Com a rápida disseminação via gotículas (COOK, 2020), fômites (WANG; GUOQIANG, 2020) e presumivelmente aerossóis (BROWN et al, 2020) e o crescente número de casos, em 11 de março de 2020 a Organização Mundial da Saúde (OMS) declarou a infecção pelo SARS-COV2 (COVID-19) e a síndrome respiratória aguda grave causada por ele (SARS- CoV-2) uma situação de pandemia.
Em 04 de abril de 2021, pouco mais de 1 ano após do início da disseminação, foram diagnosticados 131.196.109 casos que causaram 2.851.973 mortes (JOHN HOPIKINS, 2021), sendo 12.984.956 casos diagnosticados no Brasil, com 331.433 mortes, respectivamente (BRASIL, 2021).
Evidências sugerem uma ligação entre a ECA2 e as ilhotas pancreáticas no mecanismo de controle da glicose, com a desregulação do sistema renina-angiotensina-aldosterona (SAR) contribuindo para o aparecimento da diabetes mellitus tipo 2 (DM2), além disso, a infecção pelo COVID-19 pode causar hiperglicemia em pacientes já diabéticos por dano em células pancreáticas que expressem a ECA2. (GRAUS-NUNES; SOUZA-MELLO, 2018 e YANG et al, 2010)
O controle agressivo dos níveis de glicemia mostra uma atenuação acentuada na mortalidade, porém o uso de insulina eleva significativamente a mortalidade por aumento na inflamação sistêmica e lesões de órgãos alvo levando a condições como insuficiência renal aguda (IRA), internação em unidade de terapia intensiva (UTI), necessidade de ventilação mecânica (VM) e hipoglicemia (YU et al, 2021), além disso, o próprio estado diabético do paciente já é fator que aumenta a mortalidade em cerca de 217 % em comparação com um indivíduo não diabético (BARONE et al, 2020), portanto a escolha dos medicamentos que serão utilizados em pacientes diabéticos é fundamental na recuperação desses.
1.1. JUSTIFICATIVA
A presente revisão de literatura é relevante por compilar e relacionar dados clínicos em pacientes com alto risco de mortalidade para o COVID-19, além de prover análise sobre o uso de antidiabéticos, necessidade de controle glicêmico e complicações em pacientes diabéticos num cenário de pandemia onde o aparecimento de um novo agente infeccioso deixa profissionais de saúde com pouco embasamento teórico para propor terapias e medidas de suporte
OBJETIVOS
1.1.1. Geral
Analisar as literaturas disponíveis, discutir dados e avaliar a mortalidade de pacientes portadores de DM2 hospitalizados por COVID-19 em relação àqueles pacientes não diabéticos hospitalizados pela COVID-19.
1.1.2. Específicos
- Avaliar a relação entre DM2 e a mortalidade por COVID-19
- Demonstrar uso de Antidiabéticos em pacientes com COVID-19
- Discutir o uso de antidiabéticos em pacientes com hiperglicemia internados por COVID-19
- Prover dados para futuras pesquisas sobre o tema
2. REFERENCIAL TEÓRICO
Em 26 de dezembro de 2019 um paciente de 41 anos deu entrada no Hospital Central de Wuhan, China, 6 dias após o início dos sintomas, referia opressão torácica, tosse não produtiva, dor e fraqueza há aproximadamente 1 semana, não possuía histórico de diabetes, tuberculose ou hepatite, uma avaliação etiológica afastou o vírus influenza, Chlamydia pneumoniae e Mycoplasma pneumoniae, assim como adenovírus humanos. Coleta de fluido obtido por lavado broncoalveolar e posterior análise de RNA por sequenciamento meta- transcriptômico no laboratório do centro de saúde pública de Shangai mostraram uma semelhança (identificação de nucleotídeos de 89.1%) com a SARS símile que afeta morcegos (SL-CoVZC45), sendo a sequência genômica determinada e confirmada por processo de reação da transcriptase reversa seguida pela reação em cadeia da polimerase (RT-PCR) (WANG et al, 2015 e WU et al, 2020).
COVID-19
Os coronavírus (CoV) – são integrantes da sub família Coronavirinae, família Coronaviridae que é parte da ordem Nidovirales – causam vários surtos de pneumonia mortal ao redor do mundo, sendo os mais conhecidos o surto de SARS-CoV com início na cidade de Foshan, China em 16 de novembro de 2002 sendo relatados 8096 casos até maio de 2004 e uma taxa de mortalidade de cerca de 10% (774 óbitos) (INSIDER, 2021), o surto de MERS-CoV com início na cidade de Jedá, Arábia Saudita em junho de 2012 tendo 2566 casos reportados até dezembro de 2020 e 882 óbitos (taxa de mortalidade de 34%) (OMS, 2021).
2.1.1. História dos Coronavírus (CoV)
Os coronavírus (CoV) – são integrantes da sub família Coronavirinae, família Coronaviridae que é parte da ordem Nidovirales – são vírus de RNA que causam infecção em mamíferos e aves, possuem envelope viral e uma partícula viral que se assemelha a uma coroa, portanto a origem do nome (do latim corona), foram descobertos na década de 1960 em pacientes que apresentavam quadro semelhante à uma gripe comum (FAN et al, 2019; SU et al, 2016)
São causadores de vários surtos de pneumonia mortal ao redor do mundo, sendo os mais conhecidos o surto de SARS-CoV com início na cidade de Foshan, China em 16 de novembro de 2002, sendo relatados 8096 casos até maio de 2004 e uma taxa de mortalidade de cerca de 9.2% (774 óbitos) (INSIDER, 2021) e o surto de MERS-CoV com início na cidade de Jedá, Arábia Saudita em junho de 2012 tendo 2566 casos reportados até dezembro de 2020 e 882 óbitos (taxa de mortalidade de 34%) (ORGANIZAÇÃO MUNDIAL DA SAÚDE, 2021), além da atual pandemia do SARS-CoV2. (TANG, COMISH e KANG, 2020) (SU et al, 2016) (WANG, 2020)
Outros 4 CoV de menor potencial patogênico são conhecidos por infectar humanos (HCoV-NL63, HCoV-229E, HCoV-OC43 e HKU1) que causam apenas leves/moderadas infecções de vias aéreas superiores (VAS) em imunocompetentes, porém podem levar a quadros mais graves em crianças e idosos. Os CoV são vírus que até pouco tempo eram patógenos com grande relevância veterinária, mas com baixo impacto na saúde humana, após os surtos supracitados e a epidemia recente de SARS-CoV2 esta visão tem mudado (TORTORICI, VEESLER, 2019; HOEK, PYRC e BERKHOUT, 2006)
2.1.2. Características dos Coronavírus
A subfamília Coronavirinae subdivide-se em 4 gêneros: α, β, γ e δ, sendo que o gênero β possui ainda 4 linhagens: A, B, C, D (figura x), o vírion dos CoV possui ao menos 4 proteínas estruturais: Spike (S), Envelope (E), Membrana (M) e Nucleocapsídeo (N) (figura 2x). O SARS-CoV2 é um vírus de fita simples de RNA envelopado com um comprimento de 29.881 bases proteicas com 9860 aminoácidos, a entrada na célula hospedeira pelo vírus é mediada por uma glicoproteína transmembrana Spike (S) que formam homotrímeros projetando-se desde a superfície viral, S compreende 2 subunidades funcionais responsáveis pela ligação com a célula hospedeira (subunidade S1) e fusão das membranas viral e celular (subunidade S2), na maioria dos CoV, S é clivada entre as subunidades S1 e S2. O receptor utilizado pelo SARS-CoV2 é diferente do utilizado pelo MERS-CoV, o DPP4 e igual ao utilizado pelo SARS-CoV, a enzima conversora de angiotensina 2 (ECA2) e possui uma afinidade maior ao receptor que o SARS-CoV (TANG, COMISH e KANG, 2020) (CUI, 2018)
A proteína S é conservada durante o ciclo de reprodução dos coronavírus que infectam humanos, e está envolvida no reconhecimento do receptor, adesão viral e entrada nas células hospedeiras sendo assim é um alvo para o desenvolvimento de medicamentos contra os CoV e futuras pesquisas (WALLS et al, 2020) (TORTORICI; VEESLER, 2019) (ZHANG et al, 2020) (HUANG et al, 2020) (WU et al, 2020)
O hospedeiro natural do SARS-CoV2 é muito provavelmente o morcego, possuindo de 86,9% a 96% de semelhança na sequência de nucleotídeos comparado a coronavírus símiles ao SARS como o ZC45, ZXC21 e RaTG3 (ZHU et al, 2020) (LU et al, 2020) (TANG,COMISH e KANG, 2020), porém ainda não foi identificado qual seria o hospedeiro intermediário, porém acredita-se ser o pangolim, já que em análises feitas nesses animais, descobriu-se um vírus com semelhança nucleotidica de 85.5% a 92.4% tais análises ainda carecem de maiores estudos. (Adicionar referência).
O SARS-CoV2 utiliza a ECA2 para adentrar células do epitélio respiratório, além disso, esta enzima também é encontrada em outros órgãos como coração, rim, trato gastrointestinal e testículos. Apesar de ser expressa em diversos órgãos ainda não é totalmente explicado porque os pulmões são os órgãos mais acometido por infecções pelo SARS-CoV2, supõe-se que devido à grande área de superfície (o que aumenta o número de células possuidoras do receptor, quantitativamente) ou por serem reservas de vírus que segundo estudo de ZHAO et al (2020) onde foram analisadas 43.134 células de 8 pulmões de doadores de órgãos, chegou a conclusão que a ECA2 é expressa em 0.64% de todas as células pulmonares, porém 83% das células que expressam a ECA2 são pneumócitos (células alveolares) tipo II, cerca de 1.4+- 0.4% de todas os pneumócitos tipo II expressaram a ECA2. (MONDA et al, 2020) (CRACKOWER, 2002) (DING et al, 2004)
Recentemente, têm-se observado o aparecimento de diversas mutações do SARS- CoV2, tais mutações ocorrem principalmente na proteína S (spike), no domínio do receptor que faz a ligação com a célula hospedeira. As principais variantes encontradas até o presente estudo são 3 (de um total de 15) (HASSAN, 2020):
B.1.1.7: Também conhecida como 20I/501Y.V1 ou VOC 202012/01, detectada inicialmente no Reino Unido em setembro de 2020, compreende uma mutação na porção ligante do domínio do receptor na posição 501 onde o aminoácido asparagina (N) é substituído pela tirosina (Y), sendo assim a mutação denominada N501Y. Além disso, também se inclui a deleção da posição 69/70 o que leva a uma mudança conformacional na proteína spike e a mutação P681H, essas mutações supõe-se que tenham ocorrido espontaneamente. Esta variante é considerada mais transmissível e mais mortal do que o SARS-CoV2 original. (CDC, 2021) (VIROLOGICAL, 2021) (COVARIANTS, 2021)
B.1.351: Também conhecida como 20H/501Y.V2, foi originalmente identificada na África do Sul em outubro de 2020 e inclui mutações como K417N, E484K e N501Y, porém diferentemente da B.1.1.7, essa variante não possui a deleção na posição 69/70, atualmente é a variante predominante na Zâmbia e não há evidências que há um aumento na transmissibilidade ou mortalidade em relação ao SARS-CoV2 original (CDC,2021) (COVARIANTS, 2021)
Linhagem P.1: Também conhecida como 20J/501Y.V3, reportada pela primeira vez em janeiro de 2021 em passageiros desembarcando no aeroporto Haneda no Japão provenientes do Brasil, concentrada principalmente na cidade de Manaus, estado do Amazonas, em janeiro de 2021 foi encontrada em 42% das amostras de RT-PCR analisadas (total de 31) entre 15 e 23 de dezembro de 2020. (VIROLOGICAL, 2021) (COVARIANTS, 2021)
Outras variantes de menor importância são: 20E (EU1), 20A.EU2, 20C/S:452R, 20C/S:484K, 20A/S:484K, 20A/S:439K, S:667H.Robin1, S:677P.Pelican, 20A/S:98F,20C/S:80Y, 20B/S:626S e 20B/S:1122L
2.1.3. Epidemiologia
O SARS-CoV2 no momento do presente estudo encontra-se em todos os países do mundo, exceto a República Popular Democrática da Coréia (Coréia do norte), onde fontes oficiais indicam um total de zero casos, porém, devido à falta de transparência na mídia, os números não podem ser confirmados, fontes não oficiais indicam que cerca de 200 soldados norte- coreanos já morreram devido ao SARS-CoV2 (DAILY NK, 2021). O vírus chegou à Antártica, o último local que ainda não havia sido contaminado, no final de dezembro de 2020 (USA TODAY, 2021).
Os países com maior número de casos absolutos, de acordo com WORLDOMETER (2021), são (em 25/03/2021) em ordem:
Estados Unidos (30.768.873 casos), Brasil (12.324.765), Índia (11.846.082), Rússia (4.492.692) e França (4.424.087).
E os países com mais casos relativos à população de acordo com WORLDOMETER (2021) (casos por milhão de habitantes) (em 25/03/2021) são:
Andorra (151,083), Montenegro (141,677), Chéquia (139,448), San Marino (131,948) e Eslovênia (126,826).
A taxa de incidência mundial não foi encontrada nas pesquisas realizadas, a mortalidade é de aproximadamente 35,22 óbitos/100.000 habitantes e a letalidade de 2,2%, segundo BRASIL (2021), a taxa de incidência no Brasil é de 5.862,6 casos/100.000 habitantes, a mortalidade é de 144,4 óbitos/100.000 habitantes e a letalidade é de 2,5%. No estado do Pará, também segundo BRASIL (2021) a incidência é de 4.719,9 casos/100.000 habitantes, a mortalidade é de 116,4 óbitos/100.000 habitantes e a mortalidade é de 2,46%.
Inicialmente pensava-se que a transmissão ocorria de modo animal-humano, com os primeiros casos sendo registrados no mercado atacadista de frutos do mar de Huanan em Wuhan na China, no entanto após algumas investigações, verificou-se que alguns dos pacientes infectados com o SARS-CoV2 não havia visitado o mercado, portanto aventou-se a possibilidade de contágio humano-humano através do ar, por tosse, espirro, gotículas e aerossóis, porém ainda não foi provado que este é um modo de contágio efetivo, acontece que caso esse modo não seja plausível, não se explicaria a rápida disseminação do vírus mesmo sem contato próximo como ocorreu em um restaurante em Guangzhou, onde 10 pessoas de 3 famílias diferentes foram contaminadas com o vírus, devido a corrente de ar impulsionada por um aparelho de ar condicionado. Além disso, nos EUA foram encontrados vírus em amostras de fezes o que levanta a possibilidade de transmissão fecal-oral. (BROWN et al, 2020; COOK et al, 2020; HOLSHUE et al, 2020; LOFTI, HAMBLIN e REZAEI, 2020; LU et al, 2020; THE NEW YORK TIMES, 2020; WANG; GUOQIANG, 2020;)
A transmissão ocorre também com pacientes que sejam portadores do vírus SARS-CoV2, porém assintomáticos e sem nenhum achado radiológico. O período de incubação é de cerca de 5.2 dias com um percentil de 95% de 12.5 dias (CHAN et al, 2020; HUANG et al, 2020; LOFTI; HAMBLIN e REZAEI, 2020; ROTHE, 2020)
2.1.4. Classificação de severidade
Usualmente o COVID-19 é divido em 3 estágios, de acordo com a severidade da doença (CNN, 2021) (CENTER FOR DISEASE CONTROL AND PREVENTION, 2021) (GANDI; LYNCH e RIO, 2020).
- Leve: Podem ser assintomáticos ou apresentarem sintomas leves como febre, tosse, faringite, mal-estar, cefaléia, mialgia, congestão nasal, anosmia e raramente diarréia e podem ser tratados com medicamentos sintomáticos, não necessitando acompanhamento hospitalar
- Moderada: Sinais de infecção de via aérea baixa, dispnéia, porém com saturação sanguínea de oxigênio (SatO2) maior que 94%, normalmente requerem alguma atenção hospitalar pontualmente. Podem cursar com alterações radiológicas em exames como Raio-X (Rx) e Tomografia Computadorizada (TC), a alteração mais comumente vista em pulmão em TC é o aspecto de vidro fosco (YUAN, et al., 2020)
- Severa/Crítica: São pacientes que desenvolvem dispnéia grave(Frequência respiratória maior que 30 incursões por minuto), SatO2 menor que 94%, necessidade de oxigênio suplementar e acompanhamento em Unidade de Terapia Intensiva, podem cursar com insuficiência hepática, injúria renal aguda, repercussões cardiovasculares e neurológicas.
2.1.5. Fatores de Risco
Alguns fatores de risco para o desenvolvimento de doença severa e morte são (CENTER FOR DISEASE CONTROL AND PREVENTION, 2021) (LI et al, 2020): Câncer Insuficiência Renal Crônica (IRC) Doença Pulmonar obstrutiva crônica (DPOC) Síndrome de Down, Anemia Falciforme Doenças Cardiovasculares (incluindo hipertensão) Estado Imunosuprimido Obesidade (incluindo obesidade severa) Gravidez Idade avançada (maior que 65 anos) Altos níveis de citocinas (IL-2R, IL-6, IL-10 e TNF alfa) Altos níveis de Lactato, Diabetes Mellitus.
2.1.5.1. Diabetes Mellitus
A Diabetes Mellitus, em especial a tipo 2, é um fator de risco para o desenvolvimento de formas moderadas, graves/críticas de COVID-19 e óbito, porém, até o presente momento não existem evidências que indiquem que pacientes diabéticos (PPDM) possuem maior risco de contrair COVID-19. (CENTER FOR DISEASE CONTROL AND PREVENTION, 2021) (AMERICAN DIABETES ASSOCIATION, 2021) (PINTO, BERTOLUCI, 2020) (SOCIEDADE BRASILEIRA DE DIABETES, 2021).
Além disso, pacientes com hiperglicemia durante a internação, têm risco aumentado de mortalidade além de um pior desfecho funcional, têm maiores chances de necessitarem de cuidados intensivos (UTI), um tempo de internação hospitalar aumentado e maior número de reinternações em relação a pacientes normoglicêmicos. Também têm maior risco de desenvolverem infecções tanto adultos como pacientes pediátricos (UMPIERREZ et al, 2002) (SILVA et al, 2018) (CALLIARI, ALMEIDA e NORONHA, 2020) (LEITE, LOCATELLI e NIECE, 2010)
Um melhor embasamento teórico é um dos objetivos deste trabalho, que buscou artigos, publicações, sites e livros que possam elucidar o risco aumentado de PPDM desenvolverem formas graves de COVID-19 e uma maior taxa de óbito vista nesses pacientes.
2.1.6. Patogênese
Após a entrada na célula mediada pela proteína spike e ECA2, o SARS-CoV2 realiza o desenvelopamento para reproduzir-se, daí segue com transcrição, replicação, montagem dos novos vírus e exocitose. Porém, ao desenvelopar-se há dano ao DNA da célula hospedeira e conjuntamente com partículas virais ativam-se os receptores de reconhecimento de padrões (PRR), por sua vez, há o recrutamento de caspases 1 e 11 (CASP1 e CASP11), além da proteína transmemebrana 173 (TMEM173) que via fator regulatório de interferon 3 (IRF3), Fator nuclear nK, e Gasdermina N terminal (GSDMD-N) levarão à morte celular regulada (RCD) por piroptose, que diferentemente da apoptose (morte celular fisiológica e “silenciosa”), ativará o sistema imunológico de modo mais considerável devido a sinais intracelulares, Padrões moleculares associados a patógenos (PAMPS) e Padrões moleculares associados a danos (DAMPS). (TANG, COMISH e KANG, 2020)
Deste modo haverá uma imensa liberação de citocinas pró-inflamatórias como IL1, IL6 e IL18, DAMPS como HMGB1 e ativação de linfócitos T, B, células NK, macrófagos, neutrófilos e células dendríticas, esses, eventualmente levarão à inflamação e desordens imunes e de coagulação e o que chamamos de tempestade de citocinas (ou hipercitocinemia) (ou síndrome da liberação de citocinas) que é, segundo FARSALINOS, BARBOUNI e NIAURA(2020), um fenômeno caracterizado pela liberação aumentada de citocinas pro-inflamatórias que pode ocorrer em resposta a infecções e pode levar a Síndrome da angústica respiratória aguda (SARA). FARSALINOS, BARBOUNI e NIAURA (2020) e CONTI et al (2020) também citam que a tempestade de citocinas poderia explicar a fisiopatologia do COVID-19 severo e os achados histopatológicos post mortem de pacientes que tiveram COVID-19.
O dano exacerbado causado ao DNA da célula hospedeira por ação direta do vírus e partículas virais levarão à sepse e choque séptico em pacientes com alta liberação de fatores pró-inflamatórios, PAMPS, DAMPs e ativação de células de defesa.
Na figura 1 observa-se o processo de entrada na célula hospedeira, via ECA2, as ativações de PRR, Caspases 1 e 11, TMEM173, GSDMD-N, IRF3 e NF-kB levando a piroptose, liberação de fatores pró-inflamatórios, ativação de células de defesa.
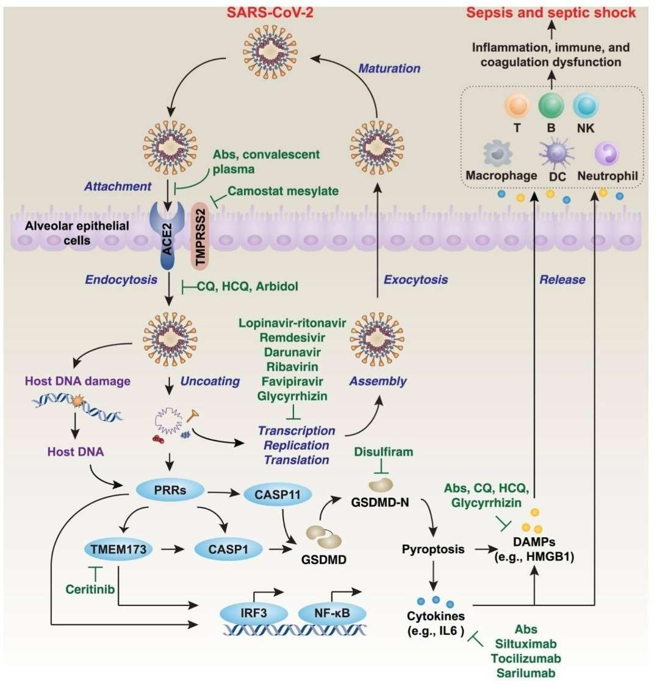
Figura 1 – Mecanismos de Entrada na célula hospedeira, replicação e exocitose, além de ativação de fatores pró-inflamatórios, e possíveis mecanismos de interferência de medicamentos (em verde) (TANG, COMISH e KANG, 2020)
2.1.7. Características Clínicas
Segundo Byambasuren, et al (2020), cerca de 17% das pessoas infectadas pelo SARS- CoV2 não desenvolveram sintomas (assintomáticas) porém ainda são capazes de transmitir o vírus a outras pessoas (ROTHE et al, 2020) (NATURE, 2021), entre aqueles 83% os sintomas mais frequentes, segundo GOVERNO DO PARÁ (2021), são:
- Febre (56,6%)
- Tosse (53,7%)
- Dor de garganta (37,4%)
- Cefaleia (31,1%)
- Dispneia (24,6%)
- Mialgia/Artralgia (16.,7%)
- Coriza (13,8%)
- Diarreia (8,6%)
- Náuseas/Vômitos (3.9%)
O total ultrapassa 100% pois os pacientes são em sua maioria multissintomáticos e apresentam mais de 1 sintoma.
Alguns outros sintomas comuns também observados são alterações no olfato e paladar podendo chegar a anosmia e ageusia, rash cutâneo e conjuntivite. (CENTERS FOR DISEASE CONTROL AND PREVENTION, 2021) (MAYO CLINIC, 2021)
As comorbidades mais frequentes entre os que contraíram o SARS-CoV2 segundo GOVERNO DO PARÁ (2021) são:
- Cardiopatia (3,86%)
- Diabetes não especificada (2,90%)
- Pneumopatias (0,55%)
- Asma (0,55%)
- Doença Renal (0,32%)
- Imunodeficiência (0,31%)
- Obesidade (0,29%)
- Doença Neurológica (0,11%)
Espinosa et al (2020) concluiu que 12,7% dos pacientes analisados que foram diagnosticados com COVID-19 possuíam 1 ou mais comorbidades, dos quais, 4% foram a óbito. As comorbidades mais frequentes foram: Hipertensão, Cardiopatia crônica, Diabetes, Malignidade, Doença pulmonar obstrutiva crônica (DPOC) e Asma. Concluiu também o desfecho óbito era 2,4x maior no grupo que possuía 1 ou mais comorbidades (com um intervalo de confiança de 95% entre 1,7 e 3,3x).
2.1.8. Métodos diagnósticos
O método padrão ouro para diagnósticos da infecção atual do SARS-CoV2 é o RT-PCR (reação da transcriptase reversa seguida pela reação em cadeia da polimerase) devido a sua capacidade de detectar partículas genômicas virais ao invés de partes do vírus (antígenos) ou anticorpos, porém alguns outros métodos podem ser úteis para diagnóstico, seguimento e triagem de pacientes que já foram infectados ou tenham suspeita de infecção vigente. (THE CENTRE FOR EVIDENCE-BASED MEDICINE, 2021)
Os grandes desafios para a criação de novos testes são aliar características como a confiabilidade (sensibilidade, especificidade, possibilidade de reações cruzadas), custo, velocidade de resultado e que possam ser operados sem a necessidade de uma grande infraestrutura. (YUCE, OZKAYA e GASIA, 2020)
- RT-PCR
É o método padrão ouro para o diagnóstico de infecção pelo SARS-CoV2 pois procura material genético do vírus, funciona baseado em 2 processos: a conversão do RNA para um DNA complementar (cDNA) utilizando a enzima trancriptase reversa (RT), a partir daí há o aumento de cópias deste cDNA com primers específicos para determinadas regiões virais, e com marcadores fluorescentes pode-se marcar essas regiões virais específicas, assim podendo-se quantificar a amostra de acordo com as regiões marcadas. O primeiro kit para teste RT-PCR SARS-CoV2 foi anunciado em 11 de janeiro de 2020 por institutos malaios.
As limitações do RT-PCR incluem alto custo, necessidade de infra-estrutura de laboratório para ser realizada, pode-se ter como resultado um falso negativo que ocorre principalmente após a primeira semana de infecção devido à descida do vírus da oro/nasofaringe ou devido a pouco RNA na amostra coletada seja por má técnica ou nos primeiros dias de infecção e não oferece informações sobre infecções prévias. Em contrapartida é o método mais sensível e o único que pesquisa por material genético na amostra, JUNG et al. (2020) também concluiu em seus estudos que não há reações cruzadas com outros vírus utilizando as amplificações para as regiões RdRp/Orf1 e N do SARS- CoV2. (THERMO FISCHER SCIENTIFIC, 2021) (FROM THE DESK OF THE DIRECTOR-GENERAL OF HEALTH MALAYSIA, 2021) (OLIVEIRA et al, 2020)
- Detecção de anticorpos
Os anticorpos são proteínas produzidas pelo organismo humano frente à infecções por organismos como vírus e bactérias. Existem no total 5 tipos de anticorpos (ou imunoglobulinas), sendo elas: IgA, IgE, IgD, IgM e IgG. O IgM é o primeiro anticorpo produzido durante uma infecção é o IgG é o mais comum e mais abundante no soro, são secretados na corrente sanguínea e nas mucosas prevenindo a entrada do vírus nas células agem neutralizando e facilitando a fagocitose do vírus. Existem dois principais métodos para esta detecção: o LFA (Lateral flow type assays) e o ELISA (Enzyme-linked immunosorbent type assays).
O teste pelo método LFA consiste em uma caixa de cassete que recobre uma membrana de polímero e que possui uma janela para colocação da amostra, a amostra (sangue, soro, plasma) é colocada na área de coleta do teste rápido e move-se pela membrana de polímero dentro do cassete por forças capilares, chegando à primeira faixa (IgG ou IgM, anticorpos etiquetados com partículas de ouro aderem-se molécula alvo (anticorpo humano a ser analisado) e à 1ª faixa caso a molécula alvo exista, e a amostra segue seu caminho pela membrana de polímero até a faixa final (2ª faixa caso seja o teste de apenas 1 anticorpo ou 3ª faixa caso seja o teste para 2 anticorpos) que é o controle. Espera-se que, mesmo que não haja moléculas alvo na amostra que reajam nas linhas, as moléculas de ouro cheguem à última faixa e sejam acumuladas lá, que no caso é a faixa de controle. O aparecimento de uma indicação visual nesta faixa é sinal que o teste foi válido. Tem a vantagem de poder ser operado por pessoas minimamente capacitadas ou mesmo leigas (é semelhante a um teste de gravidez), baixo preço e razoável confiabilidade, alguns testes de fabricantes como ScanWell Health/INNOVITA e Aytu BioScience, Inc./Orient Gene Biotech têm aproximadamente 90% de sensibilidade e 100% de especificidade. (DACHUAN, 2020) (LOEFFELHOLZ e TANG, 2020) (OLIVEIRA et al, 2020) (YUCE, OZKAYA e GASIA, 2020).
O teste pelo método ELISA é realizado com moléculas sintéticas com antígenos semelhantes ao SARS-CoV2 em uma superfície de plástico, então o material da amostra do paciente é adicionado à essa superfície, caso haja antibióticos na amostra a ligação com o antígeno sintético ocorre, o excesso de amostra é lavado e o substrato removido. Em uma segunda etapa, adiciona-se anticorpos anti-humanos marcados que se ligarão ao complexo antígeno-anticorpo e utilizando uma reação enzimática haverá mudança de cor. A superfície plástica é então lida por um espectrômetro que avaliará a presença e concentração de anticorpos no teste. Há também o método que utiliza quimioluminescência (CLIA ou ELISA-modificado) que os anticorpos anti-humanos são marcados com moléculas quimioluminescentes e gerará luz quando interagir com o complexo antígeno-anticorpo. (LOEFFELHOLZ e TANG, 2020) (OLIVEIRA et al, 2020) (YUCE, OZKAYA e GASIA, 2020).
No entanto, o método de pesquisas de anticorpos tem as suas limitações, a principal é a reação cruzada, como observada por OKBA et al. entre o SARS-CoV2 e o MERS-CoV se utilizando a proteína Spike (S). Os anticorpos levam tempo até serem produzidos, portanto um exame de anticorpo negativo, principalmente se realizado no início de uma infecção, não descarta a possibilidade de contágio pelo vírus, segundo LOEFFELHOLZ e TANG (2020) pode-se levar até 14 dias para a geração de anticorpos detectáveis. Pacientes que normalmente não produzem grandes quantidades de anticorpos (como em casos de imunossupressão) podem apresentar um teste falso-negativo. Por outro lado, os testes de anticorpos são muito importantes por poderem atestar contato prévio com o SARS-CoV2 (IgG positivo por exemplo), o teste LFA pode ser realizado por leigos com uma rápida instrução além de não necessitarem de infraestrutura dedicada para sua análise. (CASSANITI et al, 2020) (YUCE, OZKAYA e GASIA, 2020)
- Detecção de antígenos
Segundo BRITANNICA (2021), antígeno é uma substância capaz de ativar uma resposta imune, em especial linfócitos e são divididos em 2 principais tipos: Heteroantígenos (de um organismo sem parentesco biológico) e autoantígenos (antígenos do próprio corpo). Diferente do RT-PCR um teste de detecção de antígeno não busca genoma do vírus e sim fragmentos virais (ex.: Proteína Spike ou o núcleocapsídeo), esse tipo de teste tem uma vantagem em relação ao teste de anticorpos pois pode detectar as partículas virais antes da formação de anticorpos sendo assim mais preciso em fases iniciais da infecção. Podem ser realizados tanto pelo método LFA (teste rápido) quanto pelo método ELISA. Alguns testes possuem certas limitações como falso negativo em pacientes que estejam tomando Biotina (>10mg/dia), coleta de amostra incorreta ou inadequada para análise (pouco material viral na amostra) e assim como o RT-PCR não é capaz de atestar exposição e/ou doença prévia. (FACULDADE DE CIÊNCIAS MÉDICAS UNICAMP, 2021) (U.S. FOOD AND DRUG ADMINISTRATION, 2021)
2.1.9. Vacinas
Apesar da comunidade científica ter conhecimento da família dos coronavírus há mais de duas décadas, não houve empenho na criação de ferramentas contra esse patógeno, tornando o desenvolvimento de vacinas contra o COVID-19 uma das armas mais importantes no combate da pandemia. Considerando os aspectos infecciosos da doença, a possibilidade de disseminação de forma assintomática, a grande capacidade de contaminação e mortalidade, surgiu a urgência pelo desenvolvimento de uma vacina capaz de frear o impacto do COVID-19 na saúde pública (LI et al, 2020).
Com avanço em uma velocidade extraordinária, estão em pesquisa, segundo OMS (2021), 268 vacinas, sendo 84 delas atualmente em fase de testes clínicos, dessas são:
Subunidade de Proteína Viral: 27 Vetor Viral Não Replicante: 12 Vacinas de DNA: 10
Vacinas de Vírus Inativo: 11 Vacinas de RNA: 11
Vetor Viral Replicante: 4
Vacina de Partículas Semelhantes ao Vírus: 4
Vetor Viral Replicante + Célula Apresentadora de Antígeno: 2 Vírus Atenuado: 2
Vetor Viral Não Replicante + Célula Apresentadora de Antígeno: 1
Os estágios do desenvolvimento de vacinas são divididos em testes pré-clínicos e clínicos, no total de 5 etapas. A primeira são testes pré-clínicos realizados em animais. A segunda etapa é a fase 1 dos testes clínicos, composta por um pequeno número de voluntários, a fim de avaliar a segurança e a dose eficaz do imunizante. A fase 2 dos testes clínicos amplia a quantidade de voluntários em centenas, com o objetivo de determinar a dose final. A fase 3 compreende acima de 1000 participantes, com diversificação da população, analisando a eficácia da vacina, sendo essa fase feita normalmente sob estudo randomizado. A última, fase 4, quando ocorre o licenciamento e liberação da vacina para população em geral, incluindo pacientes em grupos de riscos, após a comprovação de eficácia e seguridade dos testes anteriores (KAMIDANI, ROSTAD e ANDERSON, 2021).
Atualmente 14 vacinas se encontram na fase 3 de teste clínico e apenas 5 estão na fase 4, sendo estas últimas a CoronaVac, da Sinovac; BBIBP-CorV, da Sinopharm; ChAdOx1-s-(AZD1222), da Astrazeneca; mRNA-1273, da Moderna; e BNT162 (3 LNP-mRNAs) Cominarty, da Pfizer/BioNTech (OMS, 2021).
A CoronaVac, do laboratório chinês Sinovac, é uma vacina de vírus inativo feita a partir do cultivo do patógeno em células Vero, sendo então inativado. Por impasses de biossegurança nesse método, o desenvolvimento da vacina sofreu dificuldades (LIMA, ALMEIDA e KFOURI, 2021). Historicamente as vacinas feitas com células Vero foram as primeiras a serem aceitas para uso em seres humanos pela OMS, sendo produzida a partir de uma linha contínua de células extraídas do rim de um macaco verde africano em 1962, sendo até hoje a forma mais usada de produção de substratos para vacinas (KIESSLICH e KAMEN; 2020).
A vacina, também chamada de PiCoVacc, foi elaborada a partir de células Vero infectadas a partir da variante CN2 do SARS-CoV-2, originário da China, e outras 10 variantes encontradas na Itália, Reino Unido, Espanha e Suíça, inativada utilizando beta-propiolactona (LI et al, 2020; GAO et al, 2020).
Durante a fase 1 e 2 do desenvolvimento da Coronavac, foram analisados os efeitos em grupos populacionais de 18 a 59 anos e acima de 60 anos com doses de 1,5μg, 3μg e 6μg divididos em duas doses, com intervalo variando de 14 e 28 dias entre as injeções, tendo um total de 1166 participantes. Sua eficácia foi anunciada inicialmente como 50%, 65%, 78% e 91% antes da publicação de seu estudo próprio, porém foi dita como superior a 95% para a detecção de anticorpos para o SARS-CoV-2 em pacientes vacinados com duas doses de 3μg com intervalo de 28 dias, cursando reações adversas leves em poucos participantes, evidenciando boa tolerância (ZHANG et al, 2021; WU et al, 2021; KIM, MARKS e CLEMENS, 2021).
A vacina da Sinopharm (BBIBP-CorV), em colaboração com o Instituto Beijing de Produtos Biológicos, também é uma vacina de vírus inativado, com processo de produção semelhante ao PiCoVacc, usando a variante HB02 com inativação por meio da beta-propiolactona, sendo a primeira desse tipo a chegar na fase 3 de testes clínicos. A BBIBP-CorV se demonstrou eficaz na fase 1 de testes clínicos com 96 participantes, utilizando duas doses, resultando em resposta humoral contra o SARS-CoV-2 42 dias após as aplicações sem reações adversas graves (LI et al, 2020; YADAV, 2021).
O laboratório assegura 79% de eficácia, sendo liberado para uso emergencial, juntamente com a CoronaVac, em 22 de julho de 2020. Posteriormente, em 12 de outubro de 2020, a Sinopharm recebeu pedidos de 70.000 unidades para vacinação nas regiões de Wuhan e Beijing (KIM, MARKS e CLEMENS, 2021; ZHAO et al, 2020).
A vacina ChAdOx1-s-(AZD1222), desenvolvida pelo laboratório Astrazeneca, em conjunto com a universidade de Oxford, Inglaterra, é composta por vetores virais não replicante derivado de um adenovírus de chimpanzé. Este vetor viral expressa a proteína S do SARS-CoV-2, induzindo a resposta humoral para produção de anticorpos em 91 a 100% dos participantes da fase 1 e 2 dos testes clínicos após 14 dias da aplicação, apresentando IgG detectável após 28 dias. Os efeitos adversos da AZD1222 eram atenuados pelo uso profilático de paracetamol, porém durante a fase 3 de teste clínicos surgiu um efeito adverso grave de mielite transversa, posteriormente descartada a possibilidade de relação com a vacina (LIMA, ALMEIDA e KFOURI, 2021; ZHAO et al, 2020).
Sua eficácia inicialmente era de 70% em mais de 11.000 voluntários, porém alcançou 90% após a redução da primeira dose pela metade, mantendo plena a segunda dose em outros 2.741 participantes (LI et al, 2020).
A vacina mRNA-1273, desenvolvida pelo laboratório americano Moderna, codifica a proteína S estabilizada do SARS-CoV-2 mediada por RNA mensageiro, induzindo a produção de anticorpos neutralizantes em todos os participantes da fase 1 e 2 dos testes clínicos, cursando com eventos adversos autolimitados (LIMA, ALMEIDA e KFOURI, 2021).
A estabilização da proteína S é feita substituindo os aminoácidos 986 e 987 por prolina, um aminoácido não essencial, para manter a conformação pré-fusional. Além disso, os nucleotídeos foram alterados para aumentar a tradução, seu tempo de meia vida e prevenir a ativação de genes associados a interferon (LI et al, 2020).
Sua eficácia é superior quando usado em dose de 100μg, alcançando 94,1% na fase 3 de testes clínicos com 30.420 participantes, produzindo anticorpos com quantidade mais elevada do que pacientes previamente infectados e recuperados do COVID-19, com a vantagem de possibilitar a inclusão de diversas variantes de mRNA para diferentes proteínas virais em uma única vacina. Porém, possui como desvantagem exigir um armazenamento resfriado abaixo de -20ºC (YADAV, 2021; HAYNES, 2021; KIM, MARKS e CLEMENS, 2021).
A BNT1612, também conhecida como “Cominarty”, desenvolvida pelo laboratório americano Pfizer, em parceria com a BioNTech alemã, a BNT162 é uma vacina de RNA mensageiro. Existem 4 variantes da vacina, a BNT162a1, BNT162c2, BNT162b1 e BNT162b2. As duas últimas são vacinas de mRNA com nucleosídeos modificados. A BNT162b1 codifica um Domínio Receptor Obrigatório (RBD) da proteína S do SARS-CoV-2. A BNT162b2 codifica a proteína S por completo (OMS, 2021; LI et al, 2020).
Os resultados dos testes da fase 1 e 2 da BNT162b1 mostraram maior eficácia e segurança na dose de 30 a 50ug, divididas em duas injeções com intervalo de 21 dias. A BNT162b2 também apresentou resultados semelhantes, com eficácia de 95% para apresentação de anticorpos em um estudo com cerca de 43.448 participantes, com poucos efeitos adversos, no qual apenas 1 desenvolveu a forma severa do SARS-CoV- 2 entre o grupo não-placebo (LI et al, 2020; POLACK et al, 2020).
No geral, os participantes dos 1 e 2 de testes clínicos com a BNT162 demonstraram expressão de anticorpos com títulos até 2,8 vezes maiores do que os soros convalescentes de COVID-19. A vacina incluiu nos testes clínicos da fase 3 a população de 12 a 17 anos. Sua maior desvantagem é a necessidade de conservação em temperaturas inferiores a -70ºC (LIMA, ALMEIDA e KFOURI, 2021; POLACK et al, 2020; KIM, MARKS e CLEMENS, 2021).
DIABETES MELLITUS
“Diabetes” é um termo criado em 250 a.c. por Apollonius de Memphis que significa “passar através”, referindo uma doença que drena fluidos corporais acima da capacidade de consumo de um indivíduo, relacionado ao sintoma de poliúria. Porém, essa descrição foi mencionada em tempos muito mais remotos, datados aproximadamente em 1550 a.c. em um papiro egípcio, descrevendo uma doença rara que causaria poliúria e uma rápida perda de peso. Apenas por volta do século 11 o termo “Mellitus”, mel em latim, foi adicionado após a constatação do gosto adocicado da urina (DIABETES.CO.UK, 2021).
Estima-se que, no mundo, 422 milhões de pessoas têm diabetes, levando cerca de 1,6 milhões de óbitos todos os anos, sendo a quinta maior causa de morte (INTERNATIONAL DIABETES FEDERATION, 2021; SOCIEDADE BRASILEIRA DE DIABETES, 2021a). No Brasil, 7,6% da população tem DM, sendo 50% destes não diagnosticados, tendo taxa de mortalidade de 30,1/100.000 habitantes (SOCIEDADE BRASILEIRA DE DIABETES, 2021b). Cerca de 90% de todos os casos de Diabetes são do tipo 2 (COSTA et al, 2017). A incidência de diabetes é cerca de 6,4 vezes maior nas populações de 60 a 69 anos em relação à faixa etária de 30 a 59 anos. Os índices de mortalidade também têm um aumento exponencial, chegando a ser 448 vezes maior em maiores de 60 anos em relação a menores de 29 anos (SOCIEDADE BRASILEIRA DE DIABETES, 2021a).
2.1.10. DM1 e DM2
A Diabetes Mellitus (DM) está diretamente relacionada com a disponibilidade e eficiência da insulina no corpo, somado com alterações no metabolismo do carboidrato.
O Diabetes Mellitus tipo 2 (DM2) é causada por uma resistência periférica à insulina, que leva a mecanismos contra regulatórios à glicogenólise e gliconeogênese, causando assim a condição de hiperglicemia. Posteriormente, devido haver grande demanda de glicose pelas células musculares e lipídicas periféricas, a quantidade de insulina endógena é reduzida, agravando a condição (MOINI, 2019).
A Diabetes mellitus tipo 1 (DM1) é uma doença autoimune (ou idiopática), menos frequente que a DM2, é causada pela destruição das células beta (β) pancreáticas normalmente levando à deficiência absoluta de insulina, enquanto a DM2 é causada pela disfunção progressiva na produção de insulina associada à resistência insulínica, ou seja, deficiência quantitativa e qualitativa. O raciocínio antigo de classificar a DM1 como uma doença de crianças e adolescentes e a DM2 como uma doença de adultos é errado e deve ser repensado, pois apesar de sim, a DM1 ser mais comum em crianças e DM2 mais comum em adultos, atualmente vê-se a ocorrência mais frequente de ambos os tipos em quaisquer faixas etárias. Os critérios para diagnóstico de DM podem ser vistos no quadro 1 abaixo. (ADA, 2021; DABELEA, 2014; DEFRONZO, 2004; GOLBERT et al., 2019; MAYER-DAVIS, 2017)

Quadro 1: Critérios laboratoriais para diagnóstico de DM – Fonte: ADA, 2021.
2.1.11. Fatores de Risco para a DM
Idade acima de 45 anos, Índice de Massa Corpórea (IMC) acima de 25, medida da circunferência abdominal maior que 94cm para homens e 80cm para mulheres, histórico de tratamento anti-hipertensivo, valores prévios de medida de glicose maiores que 100 e história de diabetes na família são preditores de risco para desenvolvimento de DM (JANGHORBANI, ADINEH e AMINI, 2014).
2.1.12. Tratamento
A DM é uma doença incurável, porém há tratamentos que propiciam melhora da qualidade de vida, previnem de eventos agudos de descontrole glicêmico, como sendo cetoacidose diabética e estado hiperosmolar hiperglicêmico, e retardam o desenvolvimento de acometimentos crônicos, tais como aterosclerose, retinopatia diabética e neuropatia diabética (GUTHRIE e GUTHRIE, 2004). Atualmente as opções de tratamento incluem mudança de hábitos de vida e medicamentos antiglicemiantes, compostos pelas classes: Insulinas, Biguanidas, Sulfonilureias, Tiazolidinedionas (ou Glitazonas), Inibidores da Dipeptidil Peptidase-4 (DPP-4), Análogos do Peptídeo Semelhante a Glucagon-1 (GLP-1) e Inibidores do Co-Transportador Sódio-Glicose-2 (SGLT-2) (TAN et al, 2019).
A insulina é um hormônio produzido e armazenado pelas células Beta pancreáticas, sendo liberada em presença de glicose. O Transportador de Glicose Tipo 2 promove a passagem da glicose para o meio intracelular, permitindo uma cascata metabólica que resulta na despolarização de membrana e a exocitose de insulina, chamada de Secreção de Insulina Estimulada por Glicose (GSIS). Posteriormente, a insulina é transportada nos vasos sanguíneos, agindo em tecidos adiposos e musculares, provocando a expressão do Transportador de Glicose Tipo 4, reduzindo a quantidade de glicose sérica, inibindo efeitos catabólicos e estimulando a glicogênese (THEVIS, THOMAS e SCHÄNZER, 2009).
A classe de medicamento da insulina é classificada de acordo com o tempo de ação e duração, sendo dividida em: Insulina de ação ultrarrápida, insulina de ação rápida, insulina de ação intermediária, insulina de ação longa e ultralonga (SOCIEDADE BRASILEIRA DE DIABETES, 2021c). Atualmente, o manejo da hiperglicemia do paciente crítico e não crítico hospitalizado é por meio da insulinoterapia, o que demonstrou maior eficiência e eficácia para seu controle (SOCIEDADE BRASILEIRA DE DIABETES, 2021d).
Apesar de alguns estudos sugerirem que a insulina poderia aumentar a presença de citocinas pró-inflamatórias, agravando o quadro inflamatório do SARS-Cov-2 (YU et al, 2021), mais estudos são necessários para avaliar se há este efeito em pacientes.
Biguanida é uma classe de antiglicemiantes que engloba a buformina, fenformina e metformina. Esta última é o medicamento mais prescrito para o tratamento de DM, atuando em fatores que aumentam a expressão de Transportadores de Glicose, suprime a gliconeogênese hepática e reduz relativamente os níveis de LDL e Triglicerídeos. (TAN et al, 2019)
A metformina age fosforilando a Proteína Quinase Ativada por Monofosfato de Adenosina (AMPK) nos hepatócitos, otimizando o metabolismo de glicose e lipídios. Essa ativação leva a fosforilação da ECA2 que, teoricamente, pode alterar a conformação dos Spikes do SARS-CoV-2, reduzindo a adesão do vírus nos receptores de ECA2 (SHARMA, RAY E SADASIVAM, 2020).
As sulfoniluréias atuam bloqueando os canais de potássio sensíveis ao ATP em células Beta pancreáticas, promovendo assim uma cascata metabólica semelhante ao da presença da glicose, resultando na liberação de insulina. Descobertas em 1942, é a primeira classe de antiglicemiantes orais a serem usadas na prática ambulatorial. São divididas em primeira, segunda e terceira geração, tendo a glibenclamida como a representante mais comercializada atualmente (ASHCROFT, F. M. 1996; HIRST et al, 2013; COLAGIURI et al, 2018).
Estudos in vitro sugerem que a Gliclazida, sulfoniluréia de segunda geração, possui efeito inibitório na proteína E do SARS-CoV-2, influenciando negativamente em sua virulência, afetando sua montagem e liberação em células infectadas (TOMAR e ARKIN, 2020). Outro estudo relata que o uso de sulfonilureias não causa impacto no curso ou no desfecho do COVID-19 (SINGH et al, 2021).
As glitazonas (ou Tiazolidinedionas) promovem modulação dos fatores de transcrição PPAR-gama, responsáveis pela expressão de genes como lipoproteína lipase, receptor de LDL- 1 e proteína transportadora de ácidos graxos. Sua modulação resulta na absorção de compostos lipídicos em tecidos adiposos, protegendo outros tecidos incluindo fígado e pâncreas de ácidos graxos livres. Somado a isso, possui efeito indireto no aumento da expressão adipocinas sensíveis à insulina e reduz os genes responsáveis por adipocinas que induzem a resistência à insulina, tais como o Fator de Necrose Tumoral Alfa (TNF-ALFA) (NANJAN et al, 2018).
Em um estudo, é proposto que os potenciais benefícios do uso da pioglitazona podem reduzir os efeitos inflamatórios em curso do SARS-CoV-2 por meio da regulação da liberação de TNF-Alfa (JAGAT, KALYAN e SUBIR, 2020). Há, porém, carência de estudos associando o uso de glitazonas ao desfecho do COVID-19.
Os inibidores de Dipeptil Peptidase 4, tem a sua ação neste receptor que é um regulador da glicose pós-prandial, agindo na degradação do GLP-1, promovendo a redução da secreção de insulina e desregulando o metabolismo de tecido adiposo visceral, além de aumentar a inflamação dos adipócitos e resistência à insulina. As gliptinas inibem esse processo, retardando a inativação do GLP-1 (IACOBELLIS, 2020; TAN et al, 2019).
O DPP-4 também foi identificado na proteína Spike do MERS-Cov, sendo assim presumido que os inibidores de DPP-4 oferecerem proteção contra o COVID-19 por meio da inativação desses receptores (IACOBELLIS, 2020).
O GLP-1 atua na GSIS em células Beta-pancreáticas, fechando os canais de potássio sensíveis ao ATP através de uma cascata metabólica, que resulta na despolarização de membrana, ativando os canais de cálcio dependente de voltagem, estimulando a exocitose de insulina. Além disso, possui impacto na modulação da motilidade gástrica, inibição de secreção de glucagon e regulação do apetite. (SMITH et al, 2019, PABREJA et al, 2014)
Os análogos de GPL-1 possuem efeito anti-inflamatório por via de inibição do TNF- ALFA e IL-6, sendo sugerida a proteção de órgãos com expressão de receptores de GLP-1, a citar pulmão, coração, rins e cérebro. Surgem, porém, controvérsias do uso terapêutico do GPL- 1 em pacientes acometidos de COVID-19, tendo em vista que sua aplicação tem relação provável com o aumento da expressão de receptores de ECA2, sendo necessário maiores estudos com foco nesses parâmetros (STOIAN et al, 2020; BELANČIĆ, KRESOVIĆ e DIJAN, 2021).
Os inibidores de SGLT2 agem promovendo maior excreção de glicose por via renal, além de prevenir a liberação de citocinas pro-inflamatórias como IL-6. Essa classe de medicamento tem efeito cardioprotetor por inibir a atividade da bomba sódio-potássio, entretanto, também promove a liberação de ECA2, o que é considerado controverso ao tratamento do COVID-19 (GUPTA E KUNAL 2020).
São necessários mais estudos sobre os efeitos do uso dos inibidores de SGLT2 em curso do COVID-19, sendo seu uso questionável sobre o risco e manejo de desidratação e cetoacidose diabética euglicêmica (CHATTERJEE, S. 2020).
COVID E DM
Pacientes em tratamento de DM2 têm um aumento relativo da expressão da enzima conversora de angiotensina (ECA) (ZHU, 2020), que se supõe estar ligado ao uso de glitazonas (FANG, KARAKIULAKIS e ROTH, 2020). A expressão da ECA é encontrada difusamente em vários tecidos do corpo, em especial no pulmão, coração e rins, além de estar presente no tecido endócrino e exócrino do pâncreas, possibilitando ligação com o SARS-CoV-2, levando a provável dano das ilhotas de langerhans, responsáveis pela produção e regulação da insulina e glucagon, além de levantar hipóteses quanto efeitos pleiotrópicos ligados ao metabolismo da glicose, causando alterações glicêmicas e agravamento da Diabetes (YANG et al, 2009; RUBINO et al, 2020)
Somado a isso, a DM aumenta os riscos de desenvolver reações inflamatórias devido a hiperglicemia, dessa forma agravando as reações causadas pelo vírus, que são compreendidas como danos teciduais mediados por reação inflamatória. Além disso, a DM não controlada aumenta as concentrações de glicose nas vias aéreas e altera a permeabilidade da trama vascular do pulmão (CHEE, TAN e YEOH, 2020).
Um estudo analisou 7337 pacientes admitidos em 19 hospitais de Hubei, no qual 13% eram portadores de DM2, dentre os quais apresentaram maior incidência de dispnéia, fadiga e lesões pulmonares evidenciadas em Tomografia Computadorizada (TC). Esse estudo também relata um elevado índice de mortalidade de pacientes com DM2, sendo de 7,8%, em relação a pacientes não diabéticos, de 2,7% (ZHU et al, 2020).
Por outro lado, o controle glicêmico adequado evidencia relativa redução da mortalidade em pacientes com COVID, diminuindo reações inflamatórias mediadas por Interleucina 6 (IL-6) (ZHU et al, 2020). O uso de corticóides sendo empregado no tratamento de COVID pode apresentar riscos, além do já estabelecido risco trombótico (MISHRA e MULANI, 2020), também a hiperglicemia induzida por corticosteróides, principalmente no uso indiscriminado em médias e altas doses (SALVIANO et al, 2020).
3. MATERIAL E MÉTODOS
3.1. TIPO DE ESTUDO
O presente estudo se qualifica como revisão bibliográfica narrativa de literatura (RNL) utilizando procedimentos técnicos para coleta, análise, revisão e discussão da literatura embasada em materiais já produzidos, principalmente artigos científicos e contemplando também (mas não somente) livros, manuais e sites. Serão analisados dados coletados que abordem o tema e que apresentem o embasamento teórico-metodológico para o desenvolvimento da pesquisa, culminando em uma análise narrativa dos desfechos.
3.2. LOCAL DA PESQUISA
Para coleta de dados serão utilizados artigos científicos encontrados nas bases de dados Medical Literature Analysis and Retrieval System Online (PubMed – MEDLINE) e Scientific Electronic Library Online (SciELO), além de livros, sites e estudos nas áreas de virologia, imunologia, endocrinologia e metabologia publicados em língua inglesa, espanhola e portuguesa, tendo como base a seguinte pergunta norteadora: “Pacientes com diabetes mellitus são mais propensos ao óbito quando hospitalizados por COVID-19?”
No campo da busca de dados, serão selecionados os seguintes Descritores em ciências da saúde(DeSC): COVID-19; Diabetes; Mellitus; Mortality; Mortalidade, Clinical Aspects; Aspectos Clínicos; Profile e Perfil. Sistematizando e otimizando a busca utilizando também operadores booleanos como (mas não limitando-se a): “COVID-19” [and] “Diabetes”, “COVID-19” [and] “Mortality”.
3.3. CRITÉRIOS DE INCLUSÃO
Artigos científicos, livros e sites selecionados a partir dos DeCS supracitados; Artigos científicos, livros e sites publicados entre 2019 e 2021;
Estudos primários (originais) Revista Indexada
3.4. CRITÉRIOS DE EXCLUSÃO
Artigos Científicos, livros e sites duplicados e/ou incompletos; Publicações em outras línguas além da inglesa, espanhola e portuguesa; Estudos com metodologia duvidosa e/ou incompleta;
Fator de impacto das publicações menor que 5.0 (cinco)
3.5. ANÁLISE DE DADOS
Será realizada análise descritiva qualitativa por leitura flutuante e posterior leitura minuciosa de artigos, livros, estudos e sites para obter resposta para a pergunta norteadora da pesquisa e, assim, discutir e comparar resultados coletados nas revisões bibliográficas com o intuito de confirmar os objetivos deste estudo. A discussão dos dados objetivos será realizada de forma descritiva, possibilitando ao leitor uma avaliação da aplicabilidade da revisão da literatura elaborada de forma a atingir o objetivo desta monografia.
3.6. ASPECTOS ÉTICOS
O presente projeto por ser uma revisão de literatura não será submetido à avaliação do Comitê de Ética em Pesquisa, de acordo com a Resolução 466/12 do Conselho Nacional de Saúde (CNS), pois não são oferecidos riscos. Porém, todos os preceitos éticos estabelecidos pela (ABNT, NBR 14724, 2001) serão respeitados no que se refere a zelar pela legitimidade das informações transcritas na medida em que, se não forem de própria autoria, serão citados e referenciados de acordo com a norma da instituição.
4. RESULTADOS
As pesquisas nos bancos de dados disponíveis reuniram 6620 artigos, dentre os quais foram submetidos à seleção seguindo os critérios de inclusão e exclusão descritos anteriormente. A análise final reduziu o total de artigos para 22, como descrito no quadro 1.
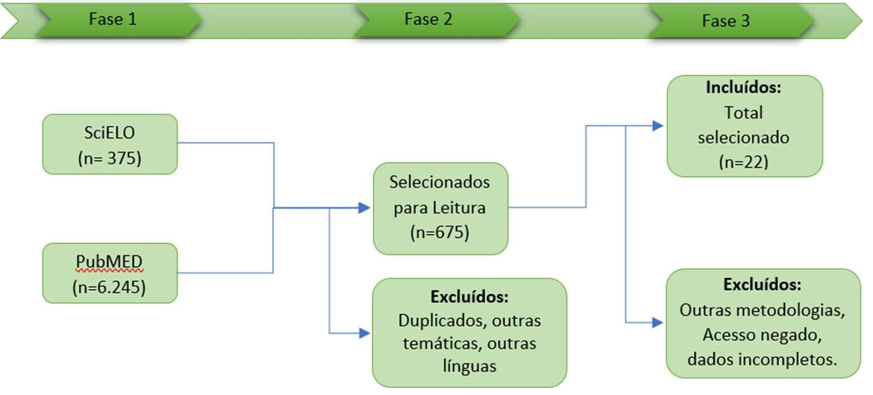
Quadro 1: Escolha dos artigos.
Fonte: Elaboração dos autores
O estudo reuniu as informações clínicas de pacientes diagnosticados com COVID-19 na China, República da Coreia, Estados Unidos da América (EUA), Irã, Itália, Reino Unido e Turquia. Posteriormente, destacamos os casos de DM cursando durante a infecção do SARS- CoV-2, relacionando os valores totais de número de casos diagnosticados com DM + COVID- 19 e o valor absoluto de mortos.
Dentre os 22 artigos, 16 continham as informações completas de diagnóstico e desfecho, evidenciando os óbitos de pacientes, portadores ou não de DM, por SARS-CoV-2. Entre os 16 artigos, 9 possuem p-valor estabelecido igual ou menor que 0.05, tendo a área de estudo China, República da Coreia, EUA e Turquia destacando a validade das informações numéricas do estudo, sendo estes os de nº 2, 7, 13, 14, 16, 18, 20, 21 e 22. Os 7 outros artigos com informações completas e p > 0.05 ou não estabelecido são Chineses e Iranianos.
No total, os artigos abrangem o número de 75.906 pacientes, incluindo os estudos que apenas consideram casos de fatalidade, como os artigos nº 4 e 9. Desta forma, esse número não pode ser relacionado diretamente a quantidade de óbitos, que soma 25.981.
Nos 16 estudos completos, 48.382 pacientes foram diagnosticados com SARS-CoV-2, 1.768 possuíam ou foram diagnosticados com DM durante a infecção do COVID-19, 1.812 tiveram óbito como desfecho, dentre os quais 332 eram portadores de DM. Isso infere que a taxa de mortalidade geral entre os pacientes com COVID-19 é em torno de 3,75%, enquanto a taxa de mortalidade dos pacientes com COVID-19 e portadores de Diabetes Mellitus é de 18,78%. O número de pacientes diabéticos representa 3,65% da população infectada.
Levando em consideração, os 9 artigos completos com p ≤ 0.05, o número de pacientes com COVID-19 é de 2.760, dos quais 489 são portadores de DM. O número de óbitos foi de 481, sendo 185 pacientes infectados pelo SARS-CoV-2 e DM.
Quadro 3: Números de artigos por país
Fonte: Elaboração dos autores
Quadro 4: Número de artigos por número de participantes
Fonte: Elaboração dos autores
5. DISCUSSÃO
De acordo com IDF (2021), CDC (2021) e SBD (2021), a porcentagem de pacientes diabéticos infectados por COVID-19 é igual ou muito próxima à de pacientes não portadores de diabetes infectados por COVID-19, ainda não é muito bem esclarecido se o fato de ser portador de DM é um fator que aumenta o risco de infecção, porém estudos recentes apontam não haver aumento da infectividade em relação à população não-DM.
O que ocorre, porém é o agravo dos sintomas do COVID-19 em PPDM, ocorre principalmente devido à DM ser um estado de inflamação constante que sobreposto ao quadro inflamatório causado pelo SARS-CoV2 leva a um aumento no número de citocinas pró-inflamatórias e piorando os sintomas. Quadros mais graves de hiperglicemia parecem estar ligados a mais severos quadros inflamatórios no COVID-19, porém ainda é carente de estudos se a glicemia poderia ser utilizada como marcador inflamatório nesses casos. (MARQUES et al., 2020)
Ainda não há estudos suficientes que relatem o acompanhamento do estado pós infecção de pacientes com COVID-19, tais estudos são de grande importância pois permitem avaliar se há transmissibilidade após o período de 14 a 21 dias que é tido como a janela de tempo que o vírus ficaria transmissível, alguns autores apontam que alguns pacientes, em especial aqueles que tiveram uma forma grave/crítica da doença podem permanecer com resultados de teste RT-PCR positivos mesmo muitas semanas após a alta o que poderia indicar uma fonte de infecção (HE, et al., 2020 e PAN, et al., 2020)
Os estudos analisados nesta monografia confirmaram o agravo dos casos quando mostram maior severidade dos sintomas dos PPDM infectados pelo SARS-CoV2 em relação aos grupo não-DM, além disso, a somação de diversas comorbidades como hipertensão arterial sistêmica (HAS) e doença cardiovascular (DCV) demonstrou maiores chances de óbito. (DU et al., 2020; XU et al., 2020 e ZHOU et al., 2020)
A DM mostrou-se ser uma das mais prevalentes comorbidades em pacientes que as tinham. Pacientes com DM também tinham chances maiores de necessitarem de UTI, ventilação mecânica e de desenvolverem infecção secundária (geralmente nosocomial). (ZHOU et al., 2020)
Foram os pacientes então, divididos em 2 grupos para fins estatísticos: o grupo não portador de DM e infectado pelo SARS-CoV2 (Grupo 1) e o grupo portador de DM e infectado pelo SARS-CoV2 (Grupo 2)
A taxa de mortalidade também foi significativamente (p ≤ 0.05) maior na maioria dos artigos analisados, o que demonstra uma associação positiva verdadeira comum entre ser infectado pelo SARS-CoV2 e concomitantemente ser portador de DM. A taxa de mortalidade entre os infectados pelo SARS-CoV2 varia ficando na média de 3.75% dentro dos indicadores de mortalidade mundiais, nacionais e regionais segundo a OMS (2021), BRASIL (2021) e GOVERNO DO PARÁ (2021), a taxa de mortalidade do COVID-19 em pacientes portadores de DM, no entanto não é encontrada amplamente nas estatísticas oficiais dos governos, porém foi analisada neste estudo e chegou-se ao valor de 18.78%.
WU, MCGOOGAN (2020) demonstraram uma taxa de letalidade de 2,3% com uma amostra de 44.672 casos, porém, em pacientes críticos foi observada uma taxa de letalidade de 49.0% e uma letalidade elevada também em pacientes com comorbidades, 7.3% para pacientes portadores de diabetes mellitus
Em 93,7% dos artigos analisados (15 de 16) foi vista uma mortalidade maior no Grupo 2 em relação ao Grupo 1. Apenas 1 (ABRISHAMI, et al., 2020) mostrou o contrário, a letalidade foi maior no Grupo 1 em relação ao Grupo 2. Os próprios autores citam algumas limitações para o artigo em que analisaram a mortalidade de pacientes com IRC e COVID- 19 e abarcavam comorbidades como o DM, citam que não foi estudado o tempo de início de sintomas dos pacientes internados e que a amostra foi pequena (43 pacientes) o que pode ter influenciado os resultados, além disso, 75% dos pacientes eram portadores de doença cardiovascular o que pode ter alterado os resultados diferenciando dos esperados pela média da literatura.
As taxas de mortalidade do Grupo 1 variaram entre 2,3% em THE NOVEL CORONAVIRUS P.E.R. EPIDEMIOLOGY TEAM (2020) e 61,5% em YANG et al.(2020) tendo uma mediana de 24,45%, porém com amostras variando entre 27 e 44.672 pacientes. Observou-se uma mortalidade média de 3,75%.
Já as taxas de mortalidade do Grupo 2 variaram entre 7,2% em THE NOVEL CORONAVIRUS P.E.R. EPIDEMIOLOGY TEAM (2020) e 100% em YUAN et al.(2020) tendo uma mediana de 39,35%, porém com amostras variando entre 5 e 1.102 pacientes. Observou-se uma mortalidade média de 18,78%.
É importante lembrar que muitos pacientes com DM têm outras comorbidades o que eleva a taxa de mortalidade, nesse sentido, seria importante mais estudos focando apenas em pacientes portadores de DM sem outras comorbidades para que somente o fator DM possa ser analisado. Ademais, outro fator influenciador é o tempo de doença, é sabido que a DM tende a apresentar mais complicações com o avançar do tempo de doença, entre elas microangiopatia levando a neuropatias, nefropatias e retinopatias e macroangiopatia que pode levar a Acidente Vascular Cerebral (AVC), Infarto agudo do miocárdio (IAM) e Doenças cardiovasculares (DCV). Tais fatores: associação de outras comorbidades e tempo de doença (DM) não foram abordados nos artigos analisados, assim sendo torna-se difícil analisar somente o fator DM. (DESHPANDE, 2008)
A diferença nas taxas de mortalidade dos diferentes grupos variou de 2,4% em XU et al. (2020) a 63,0% em YUAN et al. (2020), no entanto, vale notar que o primeiro utilizou uma amostra de 239 pacientes com COVID-19, enquanto o segundo, uma amostra de 27 pacientes o que pode ter influenciado nos resultados.
Em estatísticas governamentais, a taxa de mortalidade do SARS-CoV2 nos países do estudo (China, Irã, República da Coreia, Estados Unidos da América e Turquia) são de: China: 4,75%; Irã: 3,27%; República da Coreia: 1,65%; EUA: 1,81% e Turquia: 0,92%. Valores os quais encontram-se próximos à média geral para o Grupo 1 encontrada nos artigos analisados (3.75%).
Haja visto que BRASIL (2021) afirma que há um sobre risco (SR) maior para hospitalizações em pacientes portadores de DM e infectados com SARS-CoV2 de 4,2 e para óbitos para este mesmo grupo de 5,2. Baseado nisso, o Ministério da saúde brasileiro decidiu por incluir as pessoas portadoras de DM como possuidoras de comorbidades prioritárias para receberem as vacinas disponibilizadas por este órgão.
As sociedades especializadas em DM indicam um maior cuidado por parte de PPDM quanto à prevenção, medidas de distanciamento social, utilização de máscaras e práticas de higiene haja visto que enquanto não é possível a vacinação de toda a população essas medidas são vistas como únicas formas de diminuir o contágio pelo SARS-CoV2. (IDF, 2021e SBD, 2021)
6. CONCLUSÃO
A presente revisão narrativa de literatura avaliou a mortalidade em pacientes internados com COVID-19, dentre estes, examinou-se a presença de comorbidades em especial a Diabetes Mellitus (DM1 e DM2), com base nos artigos analisados, pode- se verificar uma correlação positiva verdadeira comum entre o aumento da mortalidade em pacientes internados por COVID-19 e tais pacientes serem portadores de Diabetes Mellitus. Apesar de pacientes portadores de DM não terem maiores chances de se infectar pelo SARS- CoV2, há sim maiores chances de desenvolverem formas graves/severas da doença, este nível de gravidade está associado à uma maior mortalidade em relação aos níveis leve e moderado mesmo em pacientes não portadores de DM. A mortalidade de pacientes internados com COVID-19 portadores de DM é significativamente maior do que a mortalidade de pacientes internados com COVID-19 não portadores de DM em absoluta maioria dos artigos analisados. É indistinguível o aumento da mortalidade e o tipo da Diabetes (DM1 ou DM2).
Tal correlação não é muito bem explicada fisiopatologicamente nos artigos abordados, porém há algumas hipóteses para tentar elucidar tal relação, entre elas destacam-se o estado imunossupressor causado pela DM previa, outras comorbidades normalmente associadas com a DM (a citar: obesidade, doenças cardiovasculares e renais), o agravamento da hiperglicemia em casos graves de COVI-19 e a tempestade de citocinas agravada pelo estado pró-inflamatório prévio causado pela hiperglicemia.
O controle glicêmico em pacientes com COVID-19 que não estejam internados pode ser realizado com antiglicemiantes orais (AGO) ou subcutâneos (AGS). Entretanto, não deve ser realizado deste modo em pacientes internados, recomendações de sociedades especializadas nacionais e estrangeiras, indicam a utilização de insulina para efetuar este controle. Existem algumas recomendações (para pacientes ambulatoriais) que sugerem a interrupção do tratamento com Metformina (risco de acidose láctica) e inibidores de SGLT2 (risco de cetoacidose diabética) e maiores controles naqueles que fazem uso de análogos de GLP1 e inibidores de DPP4, quaisquer alterações nas prescrições devem ser realizadas pelo médico assistente. Há a necessidade de vigilância rigorosa de níveis glicêmicos e hidratação em pacientes diabéticos que cursem com infecção pelo SARS- CoV2. Existem poucos estudos para melhor certificar a segurança da utilização de AGO em pacientes com COVID-19 devido ao aparecimento recente do vírus, mais estudos são
necessários sobre o tema para avaliar a seguridade e se necessária, a mudança nas recomendações e protocolos de controle glicêmico em pacientes internados.
Devido ao aparecimento recente do SARS-CoV2 e às diversas variantes surgidas, novos estudos são de extrema importância para acompanhamento, tratamento e cuidados pós infecção pelo vírus, em especial naqueles pacientes mais delicados e que necessitem de mais atenção clínica como é o caso dos pacientes portadores de Diabetes Mellitus. Desta forma a sociedade acadêmica pode ter em seu arsenal melhor base de dados para tomada de decisões que balizem o uso terapêutico de antiglicemiantes. Assim, este estudo trouxe uma compilação de dados que busca auxiliar futuras pesquisas sobre o tema.
REFERÊNCIAS
ABRISHAMI, A. et al.. Clinical and Radiologic Characteristics of COVID-19 in Patients With CKD. Iranian Journal of Kidney Diseases, Online, v. 14, n. 4, Jul./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32655021/. Acesso em: 30 mar. 2021.
ADA. American Diabetes Association – Classification and Diagnosis of Diabetes. Disponível em: https://care.diabetesjournals.org/content/38/Supplement_1/S8. Acesso em: 31 mar. 2021.
AMERICAN DIABETES ASSOCIATION. How COVID-19 Impacts People with Diabetes. Disponível em: https://www.diabetes.org/coronavirus-covid-19/how-coronavirus- impacts-people-with-diabetes. Acesso em: 26 mar. 2021.
ASHCROFT, F. M. Mechanism of Glycaemic Effects of Sulfonylureas. Hormone and Metabolic Research, online, v. 28, n. 09, p. 456-463, set./1996. Disponível em: https://doi.org/10.1055/s-2007-979837. Acesso em: 30 mar. 2021.
BARONE, M. T. U. et al. COVID-19 associated with diabetes and other noncommunicable diseases led to a global health crisis, Diabetes Research and Clinical Practice, Online, v. 171, n. 1, p. 1-10, dez./2020. Disponível em: https://doi.org/10.1016/j.diabres.2020.108587. Acesso em: 18 jan. 2021.
BARRON, E. et al.. Associations of type 1 and type 2 diabetes with COVID-19-related mortality in England: a whole-population study. The Lancet Endocrinal, Online, v. 8, p. 813-822, ago./2020. Disponível em: https://doi.org/10.1016/S2213-8587(20)30272-2. Acesso em: 30 mar. 2021.
BELANČIĆ, A.; KRESOVIĆ, A.; DIJAN, M. T.. Glucagon-like peptide-1 receptor agonists in the era of COVID-19: Friend or foe?. Clinical Obesity, online, v. 11, n. 2, jan./2021. Disponível em: https://doi.org/10.1111/cob.12439. Acesso em: 30 mar. 2021.
BRITANNICA. Antigen. Disponível em: https://www.britannica.com/science/antigen. Acesso em: 30 mar. 2021.
BROWN, J. et al. A quantitative evaluation of aerosol generation during tracheal intubation and extubation, Anaesthesia, Online, v. 76, n. 2, p. 174-181, out./2020. Disponível em: https://associationofanaesthetists- publications.onlinelibrary.wiley.com/doi/10.1111/anae.15292. Acesso em: 17 jan. 2021.
BYAMBASUREN, O. et al. Estimating the extent of asymptomatic COVID-19 and its potential for community transmission: Systematic review and meta-analysis. Official Journal of the Association of Medical Microbiology and Infectious Disease Canada, Online, v. 5, n. 4, p. 223-234, dez./2020. Disponível em: https://jammi.utpjournals.press/doi/10.3138/jammi-2020-0030. Acesso em: 27 mar. 2021.
CALISKAN, T.; SAYLAN, B.. Smoking and comorbidities are associated with COVID-19 severity and mortality in 565 patients in Turkey: a retrospective observational study. Rev. Assoc. Med. Bras., Online, v. 66, n. 12, dez./2020. Disponível em: http://doi.org/10.1590/1806-9282.66.12.1670. Acesso em: 30 mar. 2021.
CALLIARI, Luis Eduardo; ALMEIDA, Flávia J.; NORONHA, Renata Maria. Infections in children with diabetes?. J. Pediatr. (Rio J.), Porto Alegre, v. 96, n. 1, p. 39-46, mar./2020. Disponível em: http://dx.doi.org/10.1016/j.jped.2019.09.004 . Acesso em: 16 mar. 2021.
CASSANITI, I. et al. Performance of VivaDiag COVID-19 IgM/IgG Rapid Test is inadequate for diagnosis of COVID-19 in acute patients referring to emergency room department. J Med Virol., Online, v. 92, n. 10, p. 1724-1727, out./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32227490/. Acesso em: 30 mar. 2021.
CENTER FOR DISEASE CONTROL AND PREVENTION. People with Certain Medical Conditions. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/need-extra- precautions/people-with-medical-conditions.html. Acesso em: 26 mar. 2021.
CENTER FOR DISEASE CONTROL AND PREVENTION. Science Brief: Emerging
SARS-CoV-2 Variants. Disponível em: https://www.cdc.gov/coronavirus/2019- ncov/more/science-and-research/scientific-brief-emerging-variants.html. Acesso em: 24 mar. 2021.
CENTER FOR DISEASE CONTROL AND PREVENTION. Symptoms of Coronavirus. Disponível em: https://www.cdc.gov/coronavirus/2019-ncov/symptoms- testing/symptoms.html. Acesso em: 26 mar. 2021.
CHAN, J. F. et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, Online, v. 395, n. 10223, p. 514-523, fev./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31986261/. Acesso em: 26 mar. 2021.
CHAN-YEUNG, M.; XU, R. SARS: Epidemiology. Respirology, Online, v. 8, n. 1, p. 9-14, nov./2003. Disponível em: 30https://onlinelibrary.wiley.com/doi/full/10.1046/j.1440- 1843.2003.00518.x. Acesso em: 18 jan. 2021.
CHATTERJEE, S. SLGT-2 inhibitors for COVID-19 – A miracle waiting to happen or just another beat around the bush?. Primary Care Diabetes, Online, v. 14, n. 5, p. 564-565, mai./2020. Disponível em: https://doi.org/10.1016/j.pcd.2020.05.013. Acesso em: 3 mar. 2021.
CHEE, Y. J.; TAN, S. K.; YEOH, E. Dissecting the interaction between COVID-19 and diabetes mellitus. J Diabetes Investig, Online, v. 11, n. 5, p. 1104-1114, set./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32558211/. Acesso em: 2 mar. 2021.
CHUNG, S. M. et al. The Risk of Diabetes on Clinical Outcomes in Patients with Coronavirus Disease 2019: A Retrospective Cohort Study. Diabetes Metab J, Online, v. 44, p; 405-413, maio de 2020. Disponível em: https://doi.org/10.4093/dmj.2020.0105. Acesso em: 30 mar. 2021.
CNN. Even ‘mild’ Covid-19 can be a lengthy, challenging illness. Disponível em: https://edition.cnn.com/2020/10/08/health/covid-19-symptoms-mild-moderate-severe- wellness/index.html. Acesso em: 26 mar. 2021.
COLAGIURI, S. et al. The place of glicazide MR in the evolving type 2 diabetes landscape: A comparison with other sulfonylureas and newer oral antihyperglycemic agents. Diabetes Research and Clinical Practice, online, v. 143, p. 1-14, maio/2018. Disponível em: https://doi.org/10.1016/j.diabres.2018.05.028. Acesso em: 30 mar. 2021.
CONTI, P. et al. Induction of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19 (COVI-19 or SARS-CoV-2): anti-inflammatory strategies. J Biol Regul Homeost Agents, Online, v. 34, n. 2, p. 327-331, mar./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32171193/. Acesso em: 26 mar. 2021.
COOK, T.M. Personal protective equipment during the coronavirus disease (COVID) 2019 pandemic – a narrative review. Anaesthesia, Online, v. 75, n. 7, p. 920-927, abr./2020. Disponível em: https://associationofanaesthetists- publications.onlinelibrary.wiley.com/doi/full/10.1111/anae.15071. Acesso em: 17 jan. 2021.
CORONAVÍRUS BRASIL. Painel Coronavírus. Disponível em: https://covid.saude.gov.br/. Acesso em: 17 jan. 2021.
COSTA, A. F. et al. Carga do diabetes mellitus tipo 2 no Brasil. Cad. Saúde Pública, Rio de Janeiro, v. 33, n. 2, e00197915, 2017. Disponível em https://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2017000205011&lng= pt&nrm=iso. Acesso em 09 mar. 2021. Epub 30-Mar-2017. https://doi.org/10.1590/0102- 311×00197915.
COVARIANTS. CoVariants. Disponível em: https://covariants.org/variants/S.501Y.V3. Acesso em: 24 mar. 2021.
COVID-19 MAP – JOHN HOPKINS CORONAVIRUS RESOURCE CENTER. COVID-19
Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins. Disponível em: https://coronavirus.jhu.edu/map.html. Acesso em: 17 jan. 2021.
CRACKOWER, M. A. et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature, Online, v. 417, n. 1, p. 822-828, jun./2002. Disponível em: https://www.nature.com/articles/nature00786. Acesso em: 22 mar. 2021.
CUI, Jie; LI, Fang; SHI, Zheng-li. Origin and evolution of pathogenic coronaviruses. Nature Reviews Microbiology, Online, v. 17, n. 3, p. 181-192, dez./2018. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7097006/. Acesso em: 21 mar. 2021.
DABELEA, D. et al. Prevalence of Type 1 and Type 2 Diabetes Among Children and Adolescents From 2001 to 2009. JAMA, Online, v. 311, n. 17, p. 1778-1786, mai./2014. Disponível em: https://jamanetwork.com/journals/jama/article-abstract/1866098. Acesso em: 31 mar. 2021.
DACHUAN, L. et al. Evaluations of serological test in the diagnosis of 2019 novel coronavirus (SARS-CoV-2) infections during the COVID-19 outbreak. European Journal of Clinical Microbiology & Infectious Diseases, Online, v. 39, n. 1, p. 2271-2277, jul./2020. Disponível em: https://doi.org/10.1007/s10096-020-03978-6. Acesso em: 30 mar. 2021.
DAILY NK. Sources: Almost 200 soldiers have died from COVID-19. Disponível em: https://www.dailynk.com/english/sources-almost-200-soldiers-have-died-covid-19/. Acesso em: 25 mar. 2021.
DEFRONZO, R. A. Pathogenesis of type 2 diabetes mellitus. Med Clin North Am., Online,v. 88, n. 4, p. 787-835, jul./2004. Disponível em: https://pubmed.ncbi.nlm.nih.gov/15308380/. Acesso em: 31 mar. 2021.
DIABETES.CO.UK. Diabetes History. Disponível em: https://www.diabetes.co.uk/diabetes- history.html. Acesso em: 2 mar. 2021.
DING, Y. et al. Organ distribution of severe acute respiratory syndrome (SARS) associated with coronavirus (SARS‐CoV) in SARS patients: implications for pathogenesis and virus transmission pathways. The Journal of Pathology, Online, v. 203, n. 2, p. 622-630, mai./2004. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7167761/. Acesso em: 22 mar. 2021.
DU, R. et al. Predictors of mortality for patients with COVID-19 pneumonia caused by SARS-CoV-2: a prospective cohort study. Eur Respir J 2020, Online, v. 55, mar./2020. Disponível em: https://doi.org/10.1183/13993003.00524-2020. Acesso em: 30 mar. 2021.
EBEKOZIEN, O. A. et al.. Type 1 Diabetes and COVID-19: Preliminary Findings From a Multicenter Surveillance Study in the U.S.. Diabetes Care, Online, v. 43, p. 83-85, ago./2020. Disponível em: https://doi.org/10.2337/dc20-1088. Acesso em: 30 mar. 2021.
ESPINOSA, O. A. et al. Prevalence of comorbidities in patients and mortality cases affected by SARS-CoV2: a systematic review and meta-analysis. Rev. Inst. Med. trop. S. Paulo, Online, v. 62, n. 43, p. 1-8, jun./2020. Disponível em: https://doi.org/10.1590/s1678- 9946202062043 . Acesso em: 26 mar. 2021.
FACULDADE DE CIÊNCIAS MÉDICAS UNICAMP. Funções imunológicas de um antígeno. Disponível em: https://www.fcm.unicamp.br/fcm/cipoi/imunologia- celular/overview/funcoes-imunologicas-de-um-antigeno. Acesso em: 30 mar. 2021.
FAN, Y. et al. Bat Coronaviruses in China. Viruses, Online. v. 11, n. 3, p. 210-210, mar./2019. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6466186/. Acesso em: 21 mar. 2021.
FANG, L.; KARAKIULAKIS, G.; ROTH, M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?. The Lancet, Online, v. 8, n. 4, p. 21-21, abr./2020. Disponível em: https://www.thelancet.com/journals/lanres/article/PIIS2213- 2600(20)30116-8/fulltext. Acesso em: 3 mar. 2021.
FARSALINOS, Konstantinos; BARBOUNI, Anastasia; NIAURA, Raymond. Systematic review of the prevalence of current smoking among hospitalized COVID-19 patients in China: could nicotine be a therapeutic option?. Intern Emerg Med., Online, v. 15, n. 5, p. 845-852, mai./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7210099. Acesso em: 27 mar. 2021.
FROM THE DESK OF THE DIRECTOR-GENERAL OF HEALTH MALAYSIA. Laboratory Readiness for Detecting the 2019 novel coronavirus (2019-nCoV) infection in Malaysia. Disponível em: https://kpkesihatan.com/2020/02/13/laboratory-readiness-for- detecting-the-2019-novel-coronavirus-2019-ncov-infection-in-malaysia/. Acesso em: 29 mar. 2021.
GANDHI, Rajesh T; LYNCH, John B; RIO, Carlos Del. Mild or Moderate Covid-19. N Engl J Med, Online, v. 383, n. 18, p. 1757-1766, out./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32329974/. Acesso em: 26 mar. 2021.
GAO, Q. et al. Rapid development of an inactived vaccine for SARS-CoV-2. Science, online, v. 369, n. 6499, p. 77-81, jul. 2020. Disponível em: https://doi.org/10.1126/science.abc1932. Acesso em: 30 mar. 2021.
GOLBERT, A. et al. Diretrizes da Sociedade Brasileira de Diabetes 2019-2020: Classificação e diagnóstico do diabetes mellitus. 1. ed. Online: Clannad, 2019. p. 19-20.
GOVERNO DO PARÁ. Coronavírus no Estado do Pará. Disponível em: https://www.covid-19.pa.gov.br/public/dashboard/41777953-93bf-4a46-b9c2-3cf4ccefb3c9. Acesso em: 10 mar. 2021.
GRAUS-NUNES, Francielle; SOUZA-MELLO, Vanessa. The renin-angiotensin system as a target to solve the riddle of endocrine pancreas homeostasis. Biomedicine & Pharmacotherapy, Online, v. 109, n. 1, p. 639-645, out./2018. Disponível em: https://doi.org/10.1016/j.biopha.2018.10.191. Acesso em: 17 jan. 2021.
GUPTA, K.; KUNAL, S. SGLT-2 inhibitors as cardioprotective agents in COVID-19. Heart & Lung, Online, v. 49, n. 6, p. 875-876, set./2020. Disponível em: https://doi.org/10.1016/j.hrtlng.2020.09.002. Acesso em: 2 mar. 2021.
GUTHRIE, R.A., GUTHRIE, D.W. Pathophysiology of Diabetes. Critical Care Nursing Quartely, online, v. 27, n. 2, p. 113-125, abr./2004. Disponível em: https://doi.org/10.1097/00002727-200404000-00003. Acesso em: 30 mar. 2021.
HASSAN, S. S. et al. Molecular conservation and differential mutation on ORF3a gene in Indian SARS-CoV2 genomes. Genomics, Online, v. 112, n. 5, p. 3226-3237, jun./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7291963/. Acesso em: 24 mar. 2021.
HAYNES, B.F. A New Vaccine to Battle Covid-19. N Engl J Med, online, v. 384, p. 470- 471, fev. 2021. Disponível em: https://doi.org/10.1056/NEjMe2035557. Acesso em: 30 mar. 2021.
HIRST, J. A. et al. Estimating the effects of sulfonylurea on HbA1c in diabetes: a systematic review and meta-analysis. Diabetologia, online, v. 56, p. 973-984, mar./2013. Disponível em: https://doi.org/10.1007/s00125-013-2856-6. Acesso em: 30 mar. 2021.
HOEK, Lia Van Der; PYRC, Krzysztof; BERKHOUT, Ben. Human coronavirus NL63, a new respiratory virus. FEMS microbiology reviews. Online, v. 30, n. 5, p. 760-773, jun./2006. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7109777/. Acesso em: 22 mar. 2021.
HOLSHUE, M. L. et al. First Case of 2019 Novel Coronavirus in the United States. N Engl J Med, Online, v. 382, n. 10, p. 929-936, mar./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32004427/. Acesso em: 26 mar. 2021.
HUANG, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, Online, v. 395, n. 10223, p. 497-506, fev./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31986264/. Acesso em: 26 mar. 2021.
HUANG, Y. et al. Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19. Acta Pharmacologica Sinica, Online,v. 41, n. 1, p. 1141-1149, ago./2020. Disponível em: https://www.nature.com/articles/s41401- 020-0485-4.pdf. Acesso em: 11 fev. 2021.
IACOBELLIS, G. COVID-19 and diabetes: Can DPP4 inhibition play a role?. Diabetes Research and Clinical Practice, Online, v. 162, mar./2020. Disponível em: https://doi.org/10.1016/j.diabres.2020.108125. Acesso em: 3 mar. 2021.
INSIDER. How SARS terrified the world in 2003, infecting more than 8,000 people and killing 774. Disponível em: https://www.businessinsider.com/deadly-sars-virus-history-2003- in-photos-2020-2. Acesso em: 3 fev. 2021.
INTERNATIONAL DIABETES FEDERATION. IDF Diabetes Atlas 9th Edition 2019. Disponível em: https://www.diabetesatlas.org/en/. Acesso em: 3 mar. 2021.
JAGAT, M. J.; KALYAN, G. K.; SUBIR, R.. Use of pioglitazone in people with type 2 diabetes mellitus with coronavirus disease 2019 (COVID-19): Boon or bane?. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, online, v. 14, n. 5, p. 829-831, out./2020. Disponível em: https://doi.org/10.1016/j.dsx.2020.06.015. Acesso em: 30 mar. 2021.
JANGHORBANI, M.; ADINEH, H.; AMINI, M.. Evaluation of the Finnish Diabetes Risk Score (FINDRISC) as a Screening Tool for the Metabolic Syndrome. The Review of Diabetic Studies, Online, v. 10, n. 4, p. 283-292, fev./2014. Disponível em: https://doi.org/10.1900/RDS.2013.10.283. Acesso em: 2 mar. 2021.
JUNG, Y. et al. Comparative Analysis of Primer–Probe Sets for RT-qPCR of COVID-19 Causative Virus (SARS-CoV-2). ACS Infect. Dis, Online, v. 6, n. 9, p. 2513-2523, ago./2020. Disponível em: https://pubs.acs.org/doi/10.1021/acsinfecdis.0c00464#. Acesso em: 30 mar. 2021.
KAMIDANI, S.; ROSTAD, C.; ANDERSON, E.J.. COVID-19 vaccine development: a pediatric perspective. Current opinion in Pediatrics, online, v. 33, n. 1, p. 144-151, fev./2021. Disponível em: https://doi.org/10.1097/mop.0000000000000978. Acesso em: 30 mar. 2021.
KEMPEGOWDA, P. et al.. Effect of COVID-19 on the clinical course of diabetic ketoacidosis (DKA) in people with type 1 and type 2 diabetes. Endoc. Connect, Online, mar./2021. Disponível em: https://doi.org/10.1530/EC-20-0567. Acesso em: 30 mar. 2021.
KIESSLICH, S.; KAMEN, A.A. Vero cell upstream bioprocess development for the production of viral vectors and vaccines. Biotechnology advances, online, v. 44, nov. 2020. Disponível em: https://doi.org/10.1016/j.biotechadv.2020.107608. Acesso em: 30 mar. 2021.
KIM, J.H.; MARKS, F.; CLEMENS, J.D. Looking beyond COVID-19 vaccine phase 3 trials. Nature Medicine, online, v. 27, p 205-211, fev. 2021. Disponível em: https://doi.org/10.1038/s41591-021-01230-y. Acesso em: 30 mar. 2021.
LEITE, S. A. O; LOCATELLI, Simone B; NIECE, Sabrina P. Impact of hyperglycemia on morbidity and mortality, length of hospitalization and rates of re-hospitalization in a general hospital setting in Brazil. Diabetol Metab Syndr., Online, v. 2, n. 49, p. 1-4, jul./2010. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2912825/. Acesso em: 25 mar. 2021.
LI, L. et al. Association of clinical and radiographic findings with the outcomes of 93 patients with COVID-19 in Wuhan, China. Theranostics, Online, v. 10, n. 14, p. 6113-6121, maio de 2020. Disponível em: https://doi.org/10.7150/thno.46569. Acesso em: 30 mar. 2021.
LI, Q. et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infection Pneumonia. N Engl J Med, Online, v. 382, n. 13, p. 1199-1207, mar./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31995857/. Acesso em: 24 mar. 2021.
LI, X. et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. The Journal of Allergy and Clinical Immunology, Online, v. 146, n. 1, p. 110-118, jul./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32294485. Acesso em 14 jan.2021.
LI, Y. et al. Coronavirus vaccine development: from SARS and MERS to COVID-19. Journal of Biomedical Science, Online, v. 27, n. 1, p. 104, dez./2020. Disponível em: https://doi.org/10.1186/s12929-020-00695-2. Acesso em: 5 mar. 2021.
LIMA, E.J.F.; ALMEIDA, A.M.; KFOURI, R.A. Vaccines for COVID-19 – state of the art. Revista brasileira de saúde materna infantil, online, v. 21, supl. 1, p. 13-19, fev. 2021. Disponível em: http://dx.doi.org/10.1590/1806-9304202100s100002. Acesso em: 30 mar. 2021.
LIU, Yen-chin; KUO, Rei-lin; SHIN, Shin-ru. COVID-19: The first documented coronavirus pandemic in history. Biomedical Journal, Taiwan, v. 43, n. 1, p. 328-333, mai./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7199674/pdf/main.pdf. Acesso em: 14 jan. 2021.
LOEFFELHOLZ, Michael J; TANG, Yi-wei. Laboratory diagnosis of emerging human coronavirus infections – the state of the art. Emerg Microbes Infect., Online, v. 9, n. 1, p. 747-756, dez./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32196430/. Acesso em: 30 mar. 2021.
LOFTI, Melika; HAMBLIN, Michael R.; REZAEI, Nima. COVID 19: Transmission, prevention and potential therapeutic opportunities. Clínica Chimica Acta, Online, v. 508, n. 1, p. 254-266, mai./2020. Disponível em: www.doi.org/10.1016/j.cca.2020.05.044. Acesso em: 26 mar. 2021.
LU, J. et al. COVID-19 Outbreak Associated with Air Conditioning in Restaurant, Guangzhou, China, 2020. Emerg Infect Dis, Online, v. 26, n. 7, p. 1628-1631, abr./2020. Disponível em: https://dx.doi.org/10.3201/eid2607.200764. Acesso em: 25 mar. 2021.
LU, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet, Online, v. 395, n. 10224, p. 565- 574, fev./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7159086/. Acesso em: 22 mar. 2021.
MAYER-DAVIS, E. J. et al. Incidence Trends of Type 1 and Type 2 Diabetes among Youths, 2002–2012. The New England Journal of Medicine, Online, v. 376, n. 15, p. 1419- 1429, abr./2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28402773/. Acesso em: 31 mar. 2021.
MAYO CLINIC. Coronavirus disease 2019 (COVID-19) – Symptoms. Disponível em: https://www.mayoclinic.org/diseases-conditions/coronavirus/symptoms-causes/syc- 20479963. Acesso em: 26 mar. 2021.
MISHRA, G.P.; MULANI, J. Corticosteroids for COVID-19: the search for na optimum duration of therapy. The Lancet, Online, v. 9, n. 8, p. 8, nov./2020. Disponível em: https://doi.org/10.1016/s2213-2600(20)30530-0. Acesso em: 1 mar. 2021.
MOINI, J. Epidemiology of Diabetes: Pathophysiology of Diabetes. 1. ed. EUA: Elsevier, 2019. p. 25-43.
MONDA, V. M. et al. ACE2 and SARS-CoV-2 Infection: Might GLP-1 Receptor Agonists Play a Role?. Diabetes Therapy, Online, v. 11, n. 1, p. 1909-1914, ago./2020. Disponível em: https://link.springer.com/article/10.1007%2Fs13300-020-00898-8. Acesso em: 22 mar. 2021.
NANJAN, M. J. et al.. Thiazolidinediones as antidiabetic agents: A critical review. Biooganic Chemistry, online, v. 77, p. 548-567, abr./2018. Disponível em: https://doi.org/10.1016/j.bioorg.2018.02.009. Acesso em: 30 mar. 2021.
NATURE. What the data say about asymptomatic COVID infections. Disponível em: https://www.nature.com/articles/d41586-020-03141-3. Acesso em: 27 mar. 2021.
O’MALLEY, G. et al. COVID-19 Hospitalization in Adults with Type 1 Diabetes: Results from the T1D Exchange Multicenter Surveillance Study. The Journal of Clinical Endocrinology & Metabolism, Online, v. 106, n. 2, p. 936-942, jan./ 2021. Disponível em: https://doi.org/10.1210/clinem/dgaa825. Acesso em: 30 mar. 2021.
OGAWA, J. et al. The Progression of SARS Coronavirus 2 (SARS-CoV2): Mutation in the Receptor Binding Domain of Spike Gene. Immune Netw., Online, v. 50, n. 5, p. 41-41, out./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7609167/. Acesso em: 24 mar. 2021.
OLIVEIRA, B. A. et al. SARS-CoV-2 and the COVID-19 disease: a mini review on diagnostic methods. Revista do Instituto de Medicina Tropical de São Paulo, Online, v.62, n. 44, p. 1-15, jun./2020. Disponível em: http://dx.doi.org/10.1590/s1678-9946202062044. Acesso em: 29 mar. 2021.
OMS. Draft landscape and tracker of COVID-19 candidate vacines. Disponível em: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Acesso em: 30 mar. 2021.
ONDER, G.; REZZA, G.; BRUSAFERRO, S.. Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy. JAMA, Online, mar./2020. Disponível em: https://doi.org/10.1001/jama.2020.4683. Acesso em: 30 mar. 2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. Middle East respiratory syndrome. Disponível em: http://www.emro.who.int/health-topics/mers-cov/mers-outbreaks.html. Acesso em: 8 fev. 2021.
PABREJA, K. et al. Molecular mechanisms underlying physiological and receptor pleiotropic effects mediated by GLP-1R activation. British Journal of Pharmacology, online, v. 171, n. 5, p. 1114-1128, mar./2014. Disponível em: https://doi.org/10.1111/bph.12313. Acesso em: 30 mar. 2021.
PAN, F. et al. Different computed tomography patterns of Coronavirus Disease 2019 (COVID-19) between survivors and non-survivors. Nature, Online, jul./2020. Disponível em: https://doi.org/10.1038/s41598-020-68057-4. Acesso em: 30 mar. 2021.
PINTO, Lana C.; BERTOLUCI, Marcello C. Type 2 diabetes as a major risk factor for COVID-19 severity: a meta-analysis. Arch. Endocrinol. Metab., São Paulo, v. 64, n. 3, p. 199-200, jun./2020. Diponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S2359- 39972020000300199&lng=en&nrm=iso. Acesso em: 26 Mar. 2021
POLACK, F.P. et al.. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med, online, v. 383, p. 2603-2615, dez. 2020. Disponível em: https://doi.org/10.1056/NEjMoa2034577. Acesso em: 30 mar. 2021.
ROTHE, C. et al. Transmission of 2019-nCoV Infection from Asymptomatic Contact in Germany. The New England Journal of Medicine, Online, v. 382, n. 1, p. 970-971, jan./2020. Disponível em: https://www.nejm.org/doi/10.1056/NEJMc2001468. Acesso em: 26 mar. 2021.
RUBINO, F. et al.. New-Onset Diabetes in Covid-19. N Engl J Med 2020, online, v. 383, n. 8, ago./2020. Disponível em https://doi.org/10.1056/NEJMc2018688. Acesso em: 30 mar.2021.
SALVIANO, C. M. T. et al. Hiperglicemia Induzida por Corticosteróide: Uma Revisão Integrativa. Visão Acadêmica, Online, v. 21, n. 1, p. 60-71, mar./2020. Disponível em: https://revistas.ufpr.br/academica/article/download/73670/40719#:~:text=A%20hiperglicemi a%20induzida%20por%20corticosteroides,prolongadas%2C%20predisposi%C3%A7%C3% A 3o%20a%20infec%C3%A7%C3%B5es%2C%20hiperglicemia. Acesso em: 2 mar. 2021.
SHARMA, S.; RAY, A.; SADASIVAM, B.. Metformin in COVID-19: A possible role beyond diabetes. Diabetes Research and Clinical Practice, Online, v. 164, abr./2020. Disponível em: https://doi.org/10.1016/j.diabres.2020.108183. Acesso em: 2 mar. 2021.
SILVA, D. R. et al. Risk factors for tuberculosis: diabetes, smoking, alcohol use, and the use of other drugs. J. bras. pneumol., São Paulo, v. 4, n. 2, p. 145-152, mar./2018. Disponível em: https://www.scielo.br/scielo.php?script=sci_arttext&pid=S1806- 37132018000200145&lang=pt. Acesso em: 25 mar. 2021.
SINGH, A. K. et al. Non-insulin anti-diabetic agents in patients with type 2 diabetes and COVID-19: A Critical Appraisal of Literature. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, online, v. 15, n. 1, p. 159-167, fev./2021. Disponível em: https://doi.org/10.1016/j.dsx.2020.12.026. Acesso em: 30 mar. 2021.
SMITH, N. K. et al. GLP-1: Molecular mechanisms and outcomes of a complex signaling system. Neurochemistry International, online, v. 128, p. 94-105, set./2019. Disponível em: https://doi.org/10.1016/j.neuint.2019.04.010. Acesso em: 30 mar. 2021.
SOCIEDADE BRASILEIRA DE DIABETES. CONTROLE DA HIPERGLICEMIA INTRA-HOSPITALAR EM PACIENTES CRÍTICOS E NÃO CRÍTICOS. Disponível
em: https://www.diabetes.org.br/publico/images/pdf/hiperglicemia-intrahospitalar-versao- final.pdf . Acesso em: 30 mar. 2021.
SOCIEDADE BRASILEIRA DE DIABETES. Dados epidemiológicos do diabetes mellitus no Brasil. Disponível em: https://www.diabetes.org.br/profissionais/images/SBD_Dados_Epidemiologicos_do_Diabetes_-_High_Fidelity.pdf. Acesso em: 4 mar. 2021.
SOCIEDADE BRASILEIRA DE DIABETES. Epidemiologia e prevenção do diabetes mellitus. Disponível em: https://www.diabetes.org.br/profissionais/images/pdf/diabetes-tipo- 2/001-Diretrizes-SBD-Epidemiologia-pg1.pdf. Acesso em: 2 mar. 2015.
SOCIEDADE BRASILEIRA DE DIABETES. Insulina. Disponível em: https://www.diabetes.org.br/publico/diabetes/insulina. Acesso em: 30 mar. 2021.
SOCIEDADE BRASILEIRA DE DIABETES. Notas de esclarecimentos da Sociedade Brasileira de Diabetes sobre o coronavírus (COVID-19). Disponível em: https://www.diabetes.org.br/notas-de-esclarecimentos-da-sociedade-brasileira-de-diabetes- sobre-o-coronavirus-covid-19/#:~:text=Pessoas com diabetes não tem,maior gravidade da COVID-19. Acesso em: 26 mar. 2021.
SRIDHAR, C. et al.. Predictors of Mortality in Adult Population Admitted with COVID-19: A Retrospective Cohort Study from New York City. Western Journal of Emergency Medicine, Online, v. 21, n. 04, jul./2020. Disponível em: https://doi.org/10.5811/westjem.2020.6.47919. Acesso em: 30 mar. 2021.
STOIAN, A. P. et al.. Incretin-Based Therapies Role in COVID-19 Era: Evolving Insights. Journal of Cardiovascular Pharmacology and Therapeutics, online, v. 25, n. 6, p. 494- 496, jul./2020. Disponível em: https://doi.org/10.1177/1074248420937868. Acesso em: 30 mar. 2021.
SU, S. et al. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses. Trends in Microbiology, Online, v. 24, n. 6, p. 490-502, mar./2016. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7125511/. Acesso em: 21 mar. 2021.
TAN, S. Y. et al.. Type 1 and 2 diabetes mellitus: A review on current treatment approach and gene therapy as potential intervention. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, online, v. 13, n. 1, p. 364-372, fev./2019. Disponível em: https://doi.org/10.1016/j.dsx.2018.10.008. Acesso em: 30 mar. 2021.
TEAM, T.N.C.P.R.E.. The Epidemiological Characteristics of na Outbreak of 2019 Novel Coronavirus Diseases (COVID-19) – China, 2020. CCDC Weekly, Online, v. 2, n. 8, fev. 2020. Disponível em: http://dx.doi.org/10.46234/ccdcw2020.032. Acesso em: 30 mar. 2021.
THE CENTRE FOR EVIDENCE-BASED MEDICINE. What tests could potentially be used for the screening, diagnosis and monitoring of COVID-19 and what are their advantages and disadvantages?. Disponível em: https://www.cebm.net/covid-19/what-tests- could-potentially-be-used-for-the-screening-diagnosis-and-monitoring-of-covid-19-and-what- are-their-advantages-and-disadvantages/. Acesso em: 29 mar. 2021.
THE NEW YORK TIMES. How Coronavirus Infected Some, but Not All, in a Restaurant. Disponível em: https://www.nytimes.com/2020/04/20/health/airflow- coronavirus-restaurants.html. Acesso em: 25 mar. 2021.
THERMO FISCHER SCIENTIFIC. Basic Principles of RT-qPCR. Disponível em: https://www.thermofisher.com/br/en/home/brands/thermo-scientific/molecular- biology/molecular-biology-learning-center/molecular-biology-resource-library/spotlight- articles/basic-principles-rt-qpcr.html. Acesso em: 29 mar. 2021.
THEVIS, M.; THOMAS, A.; SCHÄNZER, W.. Insulin. Em: THIEME, D.;
HEMMERSBACH, P. Doping in Sports: Biochemical Principles, Effects and Analysis, online, v. 195, p. 209-226, set./2009. Disponível em: https://doi.org/10.1007/978-3-540- 79088-4_10. Acesso em: 30 mar. 2021.
TOMAR, P. P. S.; ARKIN, I. T.. SARS-CoV-2 E protein is a potential ion channel that can be inhibited by Glicazide and Memantine. Biochemical and Biophysical Research Communications, online, v. 530, n. 1, p. 10-14, set./2020. Disponível em: https://doi.org/10.1016/j.bbrc.2020.05.206. Acesso em: 30 mar. 2021.
TORTORICI, M. Alejandra; VEESLER, David. Chapter Four – Structural insights into coronavirus entry. Advances in Virus Research, Online, v. 105, n. 1, p. 93-116, dez./2019. Disponível em: https://doi.org/10.1016/bs.aivir.2019.08.002. Acesso em: 9 fev. 2021.
U.S. FOOD AND DRUG ADMINISTRATION. CareStart COVID-19 Antigen Rapid
Diagnostic Test for the Detection of SARS-CoV-2 Antigen. Disponível em: https://www.fda.gov/media/142919/download. Acesso em: 30 mar. 2021.
UMPIERREZ, G. E. et al. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Metab., Online, v. 87, n. 3, p. 978- 982, mar./2002. Disponível em: https://pubmed.ncbi.nlm.nih.gov/11889147/. Acesso em: 26 mar. 2021.
USA TODAY. With dozens of cases reported in Antarctica, COVID-19 has now infected every continent. Disponível em: https://www.usatoday.com/story/news/health/2020/12/22/covid-19-antartica-all-continents- infected-coronavirus/4014371001/. Acesso em: 25 mar. 2021.
VIROLOGICAL. Genomic characterisation of an emergent SARS-CoV-2 lineage in Manaus: preliminary findings. Disponível em: https://virological.org/t/genomic- characterisation-of-an-emergent-sars-cov-2-lineage-in-manaus-preliminary-findings/586. Acesso em: 24 mar. 2021.
WALLS, A. C. et al. Structure, Function, and Antigenicity of the SARSCoV-2 Spike Glycoprotein, Cell, online, v. 183, n. 6, p. 1735, dez./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7102599/. Acesso em: 17 jan. 2021.
WANG, C. et al. A novel coronavirus outbreak of global health concern. Lancet, Online, v. 395, n. 10223, p. 470-473, jan./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7135038/. Acesso em: 22 mar. 2021.
WANG, Juan; GUOQIANG, Du. COVID-19 may transmit through aerosol. Irish journal of medical science, online, v. 184, n. 4, p. 1143-1144, mar./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7094991/. Acesso em: 14 jan. 2021.
WANG, W. et al. Discovery, diversity and evolution of novel coronaviruses sampled from rodents in China. Virology, Online, v. 474, n. 1, p. 19-27, jan./2015. Disponível em: https://pubmed.ncbi.nlm.nih.gov/25463600/. Acesso em: 2 fev. 2021.
WANG, Y. et al. Clinical Course and Outcomes of 344 Intensive Care Patients with COVID-19. American Journal of Respiratory and Critical Care Medicine, Online, v. 201, n. 11, jun./2020, Disponível em: https://doi.org/10.1164/rccm.202003-0736LE. Acesso em: 30 mar. 2021.
WORLDOMETER. COVID-19 CORONAVIRUS PANDEMIC. Disponível em: https://www.worldometers.info/coronavirus/. Acesso em: 25 mar. 2021.
WU, F. et al. A new coronavirus associated with human respiratory disease in China. Nature, online, v. 579, n. 7798, p. 265-269, fev./2020. Disponível em: https://www.nature.com/articles/s41586-020-2008-3.pdf. Acesso em: 14 jan. 2021.
WU, Z. et al. Safety, tolerability, and immunogenicity of an inactived SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo- controlled, phase 1/2 clinical trial. The Lancet Infectious Diseases, online, v. 21, n. 4, abr. 2021. Disponível em: https://doi.org/10.1016/S1473-3099(20)30987-7. Acesso em: 05 abr.2021.
XU, J. et al. Clinical course and predictors of 60-day mortality in 239 critically ill patients with COVID-19: a multicenter retrospective study from Wuhan, China. Critical Care, Online, jul./2020. Disponível em: https://doi.org/10.1186/s13054-020-03098-9. Acesso em: 30 mar. 2021.
XU, P. P. et al. Risk factors for adverse clinical outcomes with COVID-19 in China: a multicenter, retrospective, observational study. Theranosticis, Online, v. 10, n. 14, maio 2020. Disponível em: https://doi.org/10.7150/thno.46833. Acesso em: 30 mar. 2021.
YADAV, U.C.S. Vaccines and drugs under clinical trials for prevention and treatment of COVID-19. VirusDisease (2021), online, p. 1-7, mar. 2021. Disponível em: https://doi.org/10.1007/s13337-020-00650-7. Acesso em: 30 mar. 2021.
YANG, J. et al. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetologica, Online, v. 47, Número, p. 193-199, mar./2009. Disponível em: https://doi.org/10.1007/s00592-009-0109-4. Acesso em: 2 mar. 2021.
YANG, J. et al. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol., Online, v. 47, n. 3, p. 193-199, set./2010. Disponível em: https://pubmed.ncbi.nlm.nih.gov/19333547/. Acesso em: 17 jan. 2021.
YANG, Q. et al. Effect of hypertension on outcomes of adult inpatients with COVID-19 in Wuhan, China: a propensity score-matching analysis. Respiratory Research, Online, jul./2020. Disponível em: https://doi.org/10.1186/s12931-020-01435-8. Acesso em: 30 mar. 2021.
YANG, X. et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. The Lancet, Online, v. 8, p. 475-481, maio 2020. Disponível em: https://doi.org/10.1016/S2213- 2600(20)30079-5. Acesso em: 30 mar. 2021.
YE. W. et al. Dynamic changes of D-dimer and neutrophil-lymphocyte count ratio as prognostic biomarkers in COVID-19. Respiratory Research, Online, jul./2020. Disponível em: https://doi.org/10.1186/s12931-020-01428-7. Acesso em: 30 mar. 2021.
YU, B. et al. Insulin Treatment Is Associated with Increased Mortality in Patients with COVID-19 and Type 2 Diabetes. Cell Metabolism, Online, v. 33, Número, p. 65-77, jan./2021. Disponível em: https://doi.org/10.1016/j.cmet.2020.11.014. Acesso em: 3 mar. 2021.
YUAN, M. et al. Association of radiologic findings with mortality of patients infected with 2019 novel coronavírus in Wuhan, China. PLOS ONE, Online, mar./2020. Disponível em: https://doi.org/10.1371/journal.pone.0230548. Acesso em: 30 mar. 2021.
YUCE, Meral; FILIZTEKIN, Elif; OZKAYA, GASIA, Korin COVID-19 diagnosis —A review of current methods. Biosensors and Bioelectronics, Online, v. 172, n. 1, p. 1-16, out./2020. Disponível em: https://doi.org/10.1016/j.bios.2020.112752. Acesso em: 29 mar. 2021.
ZHANG, H. et al. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target, Intensive Care Med, online, v. 46, n. 4, p. 586-590, mar./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7079879/. Acesso em: 17 jan. 2021.
ZHANG, Y. et al. Safety, tolerability, and immunogenicity of an inactived SARS-CoV-2 vaccine in healthy adults 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. The Lancet Infectious Diseases, online, v. 21, n. 2, p. 181-192, fev. 2021. Disponível em: https://doi.org/10.1016/S1473-3099(20)30843-4. Acesso em: 30 mar. 2021.
ZHAO, J. et al. COVID-19: Coronavirus Vaccine Development Updates. Frontiers in Immunology, online, v. 11, dez. 2020. Disponível em: https://doi.org/10.3389/fimmu.2020.602256. Acesso em: 30 mar. 2021.
ZHAO, Y. et al. Single-cell RNA expression profiling of ACE2, the receptor of SARS-CoV-2. American Journal of Respiratory and Critical Care Medicine, Online, v. 202, n. 5, p. 756-759, set./2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32663409/. Acesso em: 22 mar. 2021.
ZHOU, F. et al.. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet, Online, v. 395, p. 1054-1062, mar./2020. Disponível em: https://doi.org/10.1016/S0140-6736(20)30566-3. Acesso em: 30 mar. 2021.
ZHU, L. et al. Association of Blood Glucose Control and Outcomes in Patients with COVID- 19 and Pre-existing Type 2 Diabetes. Cell Metabolism, Online, v. 31, p. 1068-1077, jun./2020. Disponível em: https://doi.org/10.1016/j.cmet.2020.04.021. Acesso em: 3 mar.2021.
ZHU, Na et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. The New England Journal of Medicine, Online, v. 382, n. 8, p. 727-733, fev./2020. Disponível em: https://www.nejm.org/doi/full/10.1056/nejmoa2001017. Acesso em: 14 jan. 2021.
