INFANT MOTOR DEVELOPMENT AND THE TEST OF INFANT MOTOR PERFORMANCE (TIMP): A REVIEW ON EARLY ASSESSMENT AND CONTEXTUAL RISK FACTORS
REGISTRO DOI: 10.69849/revistaft/fa10202502182258
Eloá Maria Dos Santos Chiquetti1,
Nadia Cristina Valentini2
RESUMO
A taxa de sobrevida em recém-nascidos com complicações perinatais vem aumentando devido a melhoria dos cuidados e avanços na tecnologia nesta área, e como consequência o aumento de desordens neurocomportamentais. O diagnóstico precoce é importante devida a intensa plasticidade neural dos primeiros anos, favorecendo que a intervenção inicie o mais rápido possível, otimizando os resultados interventivos. A identificação depende do uso de escalas validadas confiáveis, com comprovada sensibilidade e especificidade. Portanto, os objetivos desta revisão narrativa são discutir o referencial teórico sobre a evolução do desenvolvimento motor infantil, da importância do contexto para o desenvolvimento no primeiro ano de vida, as características do bebê de risco, os instrumentos de avaliação do desenvolvimento motor em bebês prematuros e a termo nos primeiros meses de vida, e a descrição e validade do Test of Infant Motor Performance para crianças no Brasil e no mundo. Método: A busca online nas bases Medline, LILACS, Google Scholar, PubMed e SciELO foi realizada entre janeiro de 2024 a janeiro de 2025 abrangendo publicações em 145 artigos, 13 livros, e três documentos oficiais de órgãos governamentais. Esta revisão narrativa aborda os seguintes tópicos: (1) Origem e evolução do desenvolvimento motor infantil; (2) Importância do contexto para o desenvolvimento; (3) Características do bebê prematuro; (4) Instrumentos de avaliação do desenvolvimento motor em bebês prematuros e a termo nos primeiros meses de vida; e o (5) o Test of Infant Motor Performance. Conclusões: Este estudo de revisão ressalta a importância de uma avaliação precoce e precisa do desenvolvimento motor infantil, bem como a necessidade de compreender os marcos do desenvolvimento motor, os fatores que podem impactá-lo, como as condições de cuidado, a estimulação ambiental e as práticas culturais. Nesse contexto, a utilização de escalas de avaliação validadas e confiáveis é fundamental para a detecção precoce dessas condições, permitindo intervenções mais eficazes e oportunas.
Palavras Chave: desenvolvimento infantil, desenvolvimento motor, avaliação motora, fatores de risco, prematuros.
ABSTRACT
The survival rate of newborns with perinatal complications has increased due to advancements in medical care and technology. As a result, there has been a rise in neurobehavioral disorders among these infants. Early diagnosis is crucial, given the brain’s intense neural plasticity during the first few years of life, which facilitates early intervention and optimizes outcomes. Identifying these disorders relies on the use of reliable, validated scales that have demonstrated sensitivity and specificity. This narrative review aims to discuss several key areas: the theoretical framework regarding the evolution of infant motor development, the importance of contextual factors for development during the first year of life, the characteristics of at-risk infants, and the instruments used to assess motor development in both preterm and full-term infants during the first months of life. Additionally, this review examines the description and validity of the Test of Infant Motor Performance (TIMP) in both Brazil and worldwide. Method: An online search was conducted in the Medline, LILACS, Google Scholar, PubMed, and SciELO databases from January 2024 to January 2025. The search included 145 articles, 13 books, and three official government documents. This review covers the following topics: (1) The origin and evolution of infant motor development; (2) The importance of context for development; (3) The characteristics of preterm infants; (4) Instruments for assessing motor development in preterm and full-term infants during the first months of life; e (5) The Test of Infant Motor Performance (TIMP). Conclusions: This review emphasizes the importance of early and accurate assessment of motor development in children. Understanding motor development milestones and the factors that may influence them—such as care conditions, environmental stimulation, and cultural practices—is essential. In this context, the use of validated and reliable assessment tools is crucial for the early detection of developmental delays, enabling more effective and timely interventions.
Keywords: child development, motor development, motor assessment, risk factors, preterm.
INTRODUÇÃO
O desenvolvimento motor é considerado como mudanças em um sistema complexo ao longo do tempo, iniciando na concepção e perdurando até a vida adulta, resultante da interação de múltiplos componentes. Os componentes consistem em fatores intrínsecos, como força muscular, peso corporal, controle postural, e desenvolvimento cerebral do bebê, e fatores extrínsecos, como a condição ambiental e os requisitos específicos da tarefa (Hadders-Algra, 2018; Dusing et al, 2013b). O bebê gera movimento para atender às demandas da tarefa a ser realizada dentro de um ambiente específico. A capacidade do bebê em atender essas demandas determina a capacidade funcional do mesmo (Dusing, 2016). Portanto, o desenvolvimento motor depende de integridade do sistema sensório motor e da interação do bebê com o ambiente e das demandas específicas da tarefa no contexto ao qual ele está inserido (Clark; Metcalfe, 2002). O ambiente e a tarefa contribuem para moldar os movimentos usados para realizar uma ação intencional (Adolph; Franchak, 2017). Portanto, ao invés de maturação do sistema nervoso central moldar o movimento, é o repertório primário de ações com que os indivíduos nascem que são utilizados para moldar o seu próprio desenvolvimento neurológico ( Hadders-Algra, 2018).
No primeiro ano de vida, o desenvolvimento motor é uma manifestação importante da integridade e funcionalidade do sistema nervoso central (Flehmig, 2002). Os bebês desenvolvem habilidades através de uma conexão entre seus sistemas sensoriais e motores. Os bebês recém-nascidos já são capazes de interpretar informações sensoriais e usá-las para modificar movimentos e organizar o sistema de controle postural, baseado nas demandas da tarefa (Dusing, 2016). O desenvolvimento motor típico é representado por períodos de ajuste e variabilidade das atividades motoras realizadas pelo bebê (Hadders-Algra, 2018), porém as aquisições motoras em bebês a termo e pré-termo seguem trajetórias diferentes (Borba; Saccani; Valentini, 2013; Formiga et al., 2015). A prematuridade representa um risco para o desenvolvimento, o que pode comprometer o ritmo e a qualidade da aquisição motora com repercussões na primeira infância, pois os bebês prematuros têm um alto risco de sofrer lesões neurológicas, o que pode resultar em desordens motoras e cognitivos graves (Einspieler et al., 2016).
Estudos reportam que os bebês expostos precocemente ao ambiente extra uterino apresentam risco aumentado de implicações do neurodesenvolvimento com incapacidades futuras, e a incidência aumenta com a diminuição do peso e da idade gestacional ao nascer ( Kato et al., 2016; Van Hus et al., 2014) . O relatório “Born too Soon”, divulgado pela Organização Mundial da Saúde (2012), revela a alta prevalência de partos de crianças prematuras (11,7%) em relação a todos os partos realizados no País, gerando preocupação sobre a qualidade de vida destas crianças.
A sobrevida de prematuros repercute sobre o crescimento e desenvolvimento dessas crianças, despertando interesse e preocupações quanto a necessidade da identificação precoce de problemas e o encaminhamento interventivo (Saccani; Valentini, 2012). No Brasil 11,5% dos nascimentos são de bebês prematuros, o que exige uma série de cuidados tanto no diagnóstico como na assistência (seguimentos) desses bebês.
Desvios de desenvolvimento motor podem ser um primeiro sinal de desordem ou atraso motor, que podem ser detectados tanto em bebês a termo e quanto pré-termo no primeiro ano de vida (Barbosa et al, 2005), as quais não necessariamente possuem diagnóstico neurológico. Desfechos negativos ao longo do tempo, com deficiências leves ou severas, estão entre os principais problemas de desenvolvimento nos bebês considerados de risco, como os prematuros, com baixo peso e com complicações neonatais (Formiga et al., 2017). Diante disso, compreender o processo de desenvolvimento e aquisições motoras do bebê, seja a termo ou prematuro, vem a ser uma forma consistente para a detecção de desordens motoras.
As principais aquisições motoras, os marcos motores, podem ser usados como parâmetros em diferentes escalas e protocolos de avaliação do desenvolvimento da criança; reforçando a importância da identificação da cronologia destes e da necessidade de reconhecer os requisitos necessários para atingi-los, bem como identificar os desvios e anormalidades. Porém, a identificação de crianças com atrasos e déficits sutis é um desafio para clínicos e pesquisadores, visto que a avaliação do desenvolvimento motor da criança pode ser ineficaz quando utilizada somente a descrição clínica (Santos; Araújo; Porto, 2008).
O desenvolvimento do motor no primeiro ano de vida é rápido e extenso e é influenciado por fatores biológicos, ambientais e sociais (Spittle; Doyle; Boyd, 2008). Logo, o diagnóstico precoce é muito importante para que a intervenção inicie o mais rápido possível, considerando que a plasticidade acelerada dos primeiros anos de vida otimiza os resultados interventivos. Entretanto, observa-se carência de estudos que descrevem a trajetória motora de bebês até 4 meses de idade corrigida. E no Brasil, o diagnóstico precoce de alterações no desenvolvimento motor nessa faixa etária é agravado pela escassez de instrumentos para avaliação padronizados e validados para os bebês brasileiros. A falta de instrumentos validados resulta no uso de normas e categorizações internacionais, ainda mais gravemente sem as devidas adaptações para a aplicação em contextos culturalmente distintos (Mendonça; Sargent; Fetters, 2016; Saccani; Valentini, 2013).
Isso é preocupante, pois a literatura sobre o desenvolvimento motor aponta variações transculturais nas aquisições motoras (Godamunne et al., 2014; Krogh et al., 2012; Lohaus et al., 2014; Mendonça; Sargent; Fetters, 2016; Saccani; Valentini, 2012, 2013; Wang et al., 2017). Essas pesquisas reportam a possível influência socioculturais e econômicas da população estudada.
Pesquisas nacionais procuram verificar atraso no desenvolvimento motor em bebês brasileiros e identificar os fatores associados a estes atrasos, no entanto, com amostras pouco representativas. Com bebês nos primeiros meses de vida e prematuros o Test of Infant Motor Performance (TIMP) é um exemplo de instrumento mais utilizado nestas pesquisas ( Araújo; Eickmann; Coutinho, 2013; Formiga Et Al., 2017; Formiga; Linhares, 2009; Gasparin et al., 2012; Guimarães et al., 2011; Nicolau et al., 2011; Raniero; Tudella; Mattos, 2010; Santos et al., 2017). Destaca-se o uso do TIMP para avaliar o desempenho motor de bebês prematuros em unidades de terapia intensiva a partir de 34 semanas de idade gestacional, e de bebês a termo até 4 meses de idade corrigida.
O TIMP foi desenvolvido nos Estados Unidos e se configura como um teste do comportamento motor funcional, sensível a mudanças relacionadas à idade no desempenho motor e complicações médicas (Barbosa; Campbell; Berbaum, 2007; Byrne; Campbell, 2013; Campbell; Wright; Linacre, 2002). O TIMP apresenta boas propriedades psicométricas, com validade de conteúdo, confiabilidade inter e intra-avaliadores e capacidade de discriminar bebês com baixo e alto risco de desempenho motor de crianças americanas (Campbell; Hedeker, 2001) e brasileiras (Chiquetti; Valentini; Saccani, 2020; Chiquetti; Valentini, 2020; Chiquetti; Nobre; Valentini, no prelo). Portanto o TIMP se configura em num instrumento de apoio à pesquisa de detecção precoce de desordens neuromotores, bem como para medir desfechos de intervenção motora precoce. É um dos instrumentos de avaliação motora mais utilizado em Unidade de Terapia Intensiva Neonatal, tanto no Brasil quanto em diferentes países, e recentemente foi incluído nas diretrizes de diagnóstico precoce e intervenção para paralisia cerebral nos Estados Unidos (Byrne; Noritz; Maitre, 2017). Portanto, os objetivos desta revisão narrativa é discutir o referencial teórico a respeito da evolução do desenvolvimento motor infantil, da importância do contexto para o desenvolvimento no primeiro ano de vida, as características do bebê de risco, e os instrumentos de avaliação do desenvolvimento motor em bebês prematuros e a termo nos primeiros meses de vida, a descrição e validade do Test of Infant Motor Performance para crianças no Brasil e no mundo.
DESENVOLVIMENTO
A busca online nas bases Medline, LILACS, Google Scholar, PubMed e SciELO foi realizada entre janeiro de 2024a janeiro de 2025 abrangendo publicações em 145 artigos, 13 livros, e três documentos oficiais de órgãos governamentais. Esta revisão narrativa aborda os seguintes tópicos: de: (1) Origem e evolução do desenvolvimento motor infantil; (2) Importância do contexto para o desenvolvimento; (3) Características do bebê prematuro; (4) Instrumentos de avaliação do desenvolvimento motor em bebês prematuros e a termo nos primeiros meses de vida; e o (5) o Test of Infant Motor Performance.
1) Origem e Evolução do Desenvolvimento Motor Infantil
Com o avanço tecnológico dos equipamentos de ultrassonografia, na década de 80, foi possível análises mais precisas dos movimentos fetais, através de observações longitudinais do desenvolvimento desses movimentos (Einspieler; Marschik; Prechtl, 2008; Lüchinger et al., 2008), sendo que esses movimentos estão intimamente relacionados com o desenvolvimento do sistema nervoso. O desenvolvimento do cérebro humano é caracterizado por eventos ontogenéticos dependentes da idade, que se iniciam na fase fetal e continua até a idade adulta (Hadders-Algra, 2004). O desenvolvimento começa nas primeiras semanas de gestação com a proliferação de neurônios nas camadas germinais próximas aos ventrículos. As primeiras conexões sinápticas são formadas por volta da quinta semana de gestação (Tau; Peterson, 2010). Em seguida, os neurônios migram de maneira ordenada para seus locais de destino e começam a se diferenciar. A diferenciação neuronal inclui a formação de dendritos e axônios, a produção de neurotransmissores e sinapses.
A proliferação neuronal (rápido crescimento do número de células nervosas) ocorre entre quatro e doze semanas de gestação, e a migração desses neurônios para os locais onde exercerão suas funções ao longo da vida tem um pico de atividade entre doze semanas de gestação e o nascimento. A sinaptogênese (organização) inicia-se por volta 18 semanas de gestação e continua após o nascimento, até a adolescência. Por volta 29 semanas de gestação ocorre o início da mielinização que se estende até a vida adulta (Zomignani; Zambelli; Antonio, 2009). Uma propriedade extraordinária do desenvolvimento do cérebro é que ele consiste não apenas na criação de elementos, mas também na eliminação dos mesmos. Aproximadamente metade dos neurônios criados sofrem apoptose, em particular durante meados da gestação. A modelagem do sistema nervoso por esses fenômenos é conduzida por processos neuroquímicos e atividade neural. Os elementos neurais que melhor se ajustam ao ambiente persistem, permitindo assim uma adaptação do cérebro ao seu próprio ambiente (HADDERS-ALGRA, 2004). A figura 1 apresenta os principais eventos do desenvolvimento cerebral adaptada de Tau e Peterson (2010).
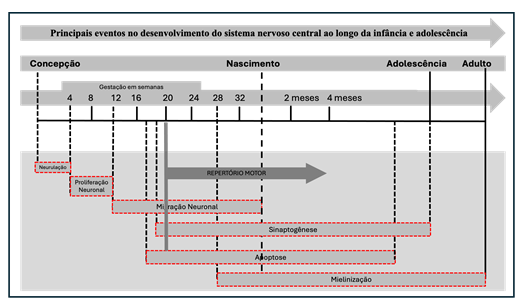
Figura 1 – Principais eventos no desenvolvimento do sistema nervoso central adaptado de Tau e Peterson (2010).
Entre as semanas 36 e 40 de idade gestacional, a proporção do volume cerebral total que contém matéria branca mielinizada aumenta de 1 a 5% (Tau; Peterson, 2010). No entanto, nesta fase as células neurais podem ser suscetíveis à hipóxia perinatal ou à isquemia, o que pode interromper os tratos neurais da substância branca nos lobos frontal e temporal acarretando lesões irreversíveis como paralisia cerebral. Neste período, a exposição do cérebro em desenvolvimento às toxinas ambientais, abuso de drogas, deficiências nutricionais e prematuridade, da mesma forma pode interromper a mielinização e, portanto, predispor a desfechos negativos a níveis cognitivos, no neurodesenvolvimento e comportamentais (Tau; Peterson, 2010; Zomignani; Zambelli; Antonio, 2009). As lesões mais comuns neste período são a leucomalácia periventricular, a hemorragia intraventricular e encefalopatia da prematuridade (Volpe, 2009a, 2009b). Somando-se as dificuldades de autorregulação do fluxo sanguíneo cerebral periventricular que os bebês prematuros apresentam, eles se tornam mais susceptível a essas lesões.
Concomitantemente ao desenvolvimento cerebral surgem os movimentos fetais. A partir da 8ª semana de idade gestacional o bebê já apresenta um vasto repertório de padrões de movimentos espontâneos gerados endogenamente produzidos em diferentes partes do cérebro (Einspieler, Marschik, Prechtl, 2008). Em estudo prévio pesquisadores observaram que até a 10ª semana de idade gestacional os movimentos fetais são: movimentos isolados de braço e movimentos isolados de perna, movimentos gerais, soluços e sobressaltos. Com 12 semanas de idade gestacional observou-se movimentos de sobressaltos, contato da mão na face, retroflexão, antero-flexão e rotação de cabeça, respiração, bocejo e espreguiçar. Com 14 semanas o bebê inicia a sucção e deglutição, e com 20 semanas os movimentos de olhos já estão presentes. A maioria dos padrões de movimentos fetais desenvolvem-se durante a primeira metade da gestação e continuam após o nascimento (Einspieler; Marschik; Prechtl, 2008; Lüchinger et al., 2008). A tabela 1 mostra os períodos do surgimento dos movimentos fetais traduzida e adaptada de Ferrari e colegas (2004).
Tabela 1. Primeiras ocorrências de padrões específicos de movimento fetal
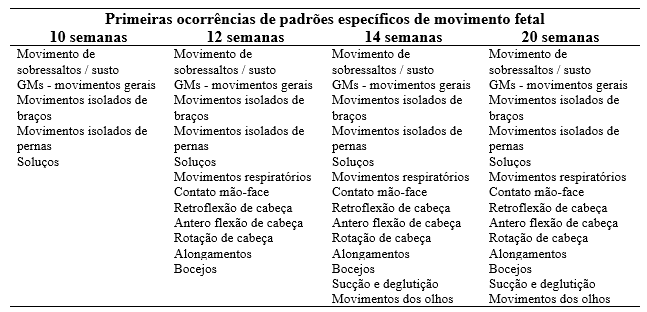
Nota: Tabela adaptado de Ferrari et al (2004); Movimentos de sobressaltos: contração muscular rápida e involuntária desencadeada por estímulos acústicos, visuais ou táteis súbitos, inesperados, e ou repentinos; GMs: General movements ou movimentos gerais são movimentos espontâneos, complexos e variáveis envolvendo todo corpo
Após o nascimento, novas funções são adicionadas ao este repertório intrauterino, como por exemplo respostas vestibulares e visuais, reações de retificação e os reflexos (devido aos inputs somatossensoriais) (Dusing, 2016). Entretanto, o repertório motor do bebê nos primeiros dois meses após a idade de termo é uma continuação do comportamento fetal (Einspieler; Marschik; Prechtl, 2008). Um bebê recém-nascido suga sua mão e o mamilo da mãe, orienta os olhos em direção a luz, segue objetos em movimento apenas com os olhos, orienta a cabeça e olhos em direção ao som. O peso da cabeça em relação ao restante do corpo, e a insuficiente força muscular para agir contra a gravidade, são limitações para a realização de movimentos organizados, funcionais e com pobre controle postural. Ao sugar o bebê utiliza uma sinergia funcional através da postura de flexão, adução de membros superiores e os membros inferiores estendidos, permitindo uma estabilidade e consequentemente facilitando a coordenação de sução, deglutição e respiração (Campbell, 2012). Através desses movimentos o bebê começa a se relacionar com o ambiente.
Quase não há mudanças na forma e no padrão dos movimentos nas primeiras semanas após o nascimento, apesar das profundas mudanças nas condições ambientais (Einspieler; Prechtl, 2005; Lüchinger et al., 2008). Esses padrões de movimentos específicos são chamados “general movements” (GMs), que são movimentos espontâneos que envolve todo o corpo em uma sequência variável de movimentos de braços, pernas, pescoço e tronco, com início e fim graduais variando em intensidade, velocidade e amplitude de movimento (Einspieler et al, 2016), que mantêm suas características por várias semanas após o nascimento. Posteriormente, esse padrão de movimento fetal desaparece e é substituído por um padrão de movimento transitório qualitativamente diferente, que é logo seguido por comportamentos manipulatórios (Ferrari et al., 2004).
Até cerca de 6 a 9 semanas de idade pós-termo os GMs são chamados de “writhing movements”, são caracterizados por amplitude pequena á moderada e por velocidade lenta á moderada, com sequência variável de movimentos do braço, perna, pescoço e tronco. Eles aumentam e diminuem em intensidade, força e velocidade, e têm um começo e um fim graduais. Por volta de 9 semanas de idade pós termo, época da grande transformação, um novo tipo de movimentos gerais aparece: os “fidgety movements” (Einspieler; Peharz; Marschik, 2016). São pequenos movimentos de velocidade moderada e aceleração variável do pescoço, tronco e membros em todas as direções. Eles são contínuos na criança acordada, exceto durante a agitação e o choro. Eles podem ser concorrentes com outros movimentos, e podem ser vistos das 9 semanas pós idade de termo e estão presentes até os 4 meses, momento em que iniciam os movimentos voluntários e antigravitacionais (Einspieler; Marschik; Prechtl, 2008), onde ele traz suas mãos à linha média e as manipula, faz manipulação das roupas e tenta alcançar um objeto, porém sem sucesso para agarrar.
O bebê se torna mais adaptado às exigências ambientais a partir do terceiro mês, pois ocorre uma transformação de várias funções neurais. O aumento da força muscular do bebê, e consequentemente mudança no controle postural, gera outras transformações importantes como, por exemplo, o movimento da cabeça, o fortalecimento do padrão de sução, melhor controle visual, a vocalização, o sorriso e as expressões de prazer social durante a interação mãe e bebê (Einspieler; Marschik; Prechtl, 2008; Prechtl, 2007).
Estudos prévios fornecem evidências que o controle postural do bebê muda frequentemente durante a emergência de novos comportamentos, e a medida que aumenta a experiência aumenta a estabilidade (Dusing et al., 2013). O controle postural é um exemplo de ação motora que os bebês utilizam ao interagir com o ambiente, perceber informações sensoriais e aprender novas habilidades (Dusing, 2016). Os autores propõem que a complexidade do controle postural fornece informações perceptuais que ajudam o bebê a selecionar algumas estratégias mais eficientes. Somente as estratégias selecionadas são usadas regularmente, o que é refletido com um aumento do controle postural. Com a maturação, experiência, coordenação e interação de múltiplos sistemas, surgem novas sinergias funcionais podendo assim ser mensuradas (Campbell, 2012).
Nos primeiros meses o fator essencial para a evolução do movimento é o surgimento dos mecanismos reflexos e as reações de retificação, que contribuirá para a modificação dos movimentos primitivos sinérgicos para movimentos voluntários especializados, e o aperfeiçoamento de um tônus muscular que gradualmente se modifica para vencer a ação da gravidade (Tudella, et al, 2021). Esse mecanismo reflexo postural promoverá o controle da cabeça no espaço, como por exemplo os bebês devem aprender a controlar a cabeça em posição vertical, enquanto respondem às mudanças de marcha impostas ao serem carregados pelo cuidador (Dusing, 2016), além de promover a coordenação da cabeça com o tronco, e do tronco com os membros, através da adaptação entre músculos agonistas e antagonistas, sucedendo de acordo com as exigências ambientais (Tudella, et al, 2021).
Porém existe uma variabilidade individual entre os bebês de mesmo grupo etário. Essas mudanças ocorrem durante um período relativamente curto. O aumento da força muscular torna os movimentos mais eficazes; a ativação de posturas antigravitacionais e orientação do bebê no espaço, bem como o início da interação social com a mãe, são sinais de uma adaptação ontogênica mais efetiva ao novo ambiente (Hadders-Algra,2018). O organismo se adapta aos requisitos internos e externos durante cada estágio de desenvolvimento. Portanto, em diferentes idades, estamos lidando com o sistema nervoso qualitativamente diferente. Essas diferenças compreendem a estrutura, bem como o repertório funcional (Einspieler; Marschik; Prechtl, 2008). Entretanto, os bebês prematuros apresentam pouca variabilidade de movimento e controle postural diminuído em comparação aos bebês a termo (DUSING, 2016), e essa diminuição de estratégias de controle postural limita a adaptação desses bebês ás mudanças nas demandas das tarefas, resultando em atraso de aquisição motoras, como por exemplo o controle de cabeça e o alcance (Dusing et al., 2013).
Em cada postura, o desenvolvimento do controle antigravitacional ocorre primeiro nos músculos extensores de uma determinada articulação, antes do desenvolvimento dos músculos flexores. Por exemplo, o bebê aprende a usar a musculatura extensora da região cervical contra gravidade, elevando a cabeça quando em prono, antes de ser capaz de levantar a cabeça contra a gravidade em supino, o que requer controle muscular flexor antigravitacional. No entanto, para desenvolver controle completo e equilibrado em uma articulação, se faz necessário ação de ambas as musculaturas, agonistas e antagonistas. Na direção do desenvolvimento, o controle da musculatura extensora contra a gravidade emerge antes da ação dos músculos flexores do tronco. Portanto, o bebê é capaz de adotar uma postura de apoio de cotovelos em prono aos 4 meses de idade, usando a musculatura extensora, antes de poder levar os pés à boca em posição supina aos 5 meses de idade, pois essa atividade requer o controle flexor do tronco (Hadders-Algra,2018).
2) Importância do Contexto
As transformações observadas ao longo do primeiro ano de vida mostram a complexidade, a dinâmica, não linearidade e a auto-organização do desenvolvimento. Evidencia também o quão suscetível o mesmo é, alterações físicas, motoras, cognitivas e sociais, bem como evidencia a interação e reciprocidade destes aspectos nas adaptações constante do indivíduo em seu ambiente (Gallahue; Ozmun; Goodway, 2013; Papalia; Olds; Feldman, 2009). Os bebês usam o repertório motor presentes no nascimento para moldar o próprio desenvolvimento cerebral (Hadders-Algra,2018). No período pós-natal imediato, o bebê sofistica comportamentos que influenciam poderosamente seu meio ambiente juntamente com fatores genéticos inatos, novos inputs sensoriais e respostas comportamentais, que irão atuar sobre um substrato cerebral ainda imaturo para estimular o desenvolvimento de circuitos neurais. Com o tempo, a experiência tem uma função cada vez mais relevante na formação de circuitos neurais (Tau; Peterson, 2010).
Os períodos críticos de plasticidade cortical ocorrem em ocasiões diferentes dos diversos sistemas (visual, auditivo, tátil e motor) e são intimamente dependentes e moldados pelas experiências e estímulos ambientais (Hadders-Algra, 2018). Desta forma, o desenvolvimento motor é determinado por uma série cumulativa de adaptações e interações entre os estímulos sensoriais e as restrições do indivíduo e de seu ambiente, mediante diferentes tarefas. Estas restrições definem e modelam o comportamento motor do indivíduo (Clark; Metcalfe, 2002; Papalia; Olds; Feldman, 2009). Durante a fase inicial de desenvolvimento o bebê usa informações aferentes fornecidas pela exploração do ambiente através dos movimentos gerados (Hadders-Algra, 2018; Heineman; Hadders-Algra, 2008). Essas experiências podem tanto potencializar quanto inibir o próprio desenvolvimento.
O bebê é sujeito aos estímulos provenientes do contexto ao qual se encontra, e que serão fundamentais no seu desenvolvimento. Pesquisas reportam a importância e influência dos fatores contextuais no desempenho do bebê, entre eles se destacam: a idade e práticas maternas, grau de instrução dos pais, renda familiar e oportunidades ambientais para o desenvolvimento (Borba; Pereira; Valentini, 2016; Freitas Et Al., 2013; Sales Nobre Et Al., 2012; Pereira; Valentini; Saccani, 2016; Valentini Et Al., 2019, 2021; Valentini; De Almeida; Smith, 2020; Zajonz; Müller; Valentini, 2008). Alguns autores relatam que no primeiro ano de vida as condições socioeconômicas (escolaridade dos pais e renda familiar) são os melhores indicadores de influência no desenvolvimento infantil, indicando que famílias com o nível socioeconômico baixo apresentam crianças com desenvolvimento abaixo da média (Bradley; Corwyn, 2002; Conger; Donnellan, 2007; Halpern et al., 2000; Panceri et al., 2020, 2022), entretanto resultados encontrados em estudos que compreendem a observação do ambiente foram mais consistentes e precisos do que os estudos que levam em conta apenas as variáveis socioeconômicas (Almeida et al., 2015; Borba; Pereira; Valentini, 2016; Miquelote et al., 2012; Saccani et al., 2013; Zajonz; Müller; Valentini, 2008).
As influências ambientais têm sido consideradas como os preditores independentes mais importantes dos desfechos a longo prazo, em bebês nascidos com fatores de risco biológico. Criar ambientes favoráveis é condicionado a quantidade e qualidade disponível de meios que possibilitem as interações entre o bebê e os seus cuidadores. Estudos reportam que o ambiente domiciliar faz parte de um conjunto de subsistemas que contribuem para o desenvolvimento motor de bebês (Abbott et al., 2000; Borba; Pereira; Valentini, 2016; Freitas et al., 2013; Miquelote et al., 2012; Pereira; Saccani; Valentini, 2016; Saccani et al., 2013). É através da mãe ou outro cuidador que o bebê inicia seus primeiros contatos com o mundo exterior, estabelecendo a partir de então, suas primeiras relações sociais. Diante disso, é pertinente que a qualidade da interação e manuseios da mãe, como forma de cuidado, de carregar o bebê, local de permanência durante o tempo acordado, brinquedos ofertados, bem como a qualidade do ambiente que esse bebê permanece, devem ser adequados. A forma como o ambiente físico é disposto no ambiente familiar e a interação com seus pais e/ou cuidadores, exerce forte influência sobre o seu desenvolvimento (Bartlett; Fanning, 2003).
Pela abordagem dos sistemas dinâmicos, a aquisição de novas habilidades motoras surge da interação entre criança, o ambiente e a tarefa (Thelen; Spencer 1998). Durante o desenvolvimento inicial, a forma como os bebês se move e interage com os objetos molda sua compreensão do mundo. A exploração gera ciclos de cognição-percepção-ação, que os bebês usam para aumentar seu repertório motor, gerando oportunidades de aprendizado e promovendo seu desenvolvimento (Dusing et al., 2013a). Além disso, o manuseio diário da mãe com o bebê, como trocar fraldas, dar banho, trocar as roupas, carregar no colo, a posição na qual o bebê é colocado para dormir bem como nos momentos acordado, também tem o potencial de aumentar ou impedir a aquisição de habilidades motoras entre os bebês.
Um bom exemplo é a questão da adoção da postura prono com o bebê. A postura em prono está relacionada ao controle cervical, sendo uma das primeiras experiencias motoras para a exploração ambiental. No entanto, as mães tendem a não adotar essa postura como a mais habitual no cotidiano, seja por insegurança, seja seguindo orientações quanto à adoção da postura supina como preferencial para a prevenção da morte súbita durante o sono (Bartlett; Fanning, 2003). Pesquisas mostram que bebês que não são acostumados a ficarem na postura de prono tendem a ter atraso na aquisição dos marcos motores, pois esses bebês têm menos oportunidades de exploração (Bartlett; Fanning, 2003). Outra prática materna muito comum é restringir bebês em carrinhos de bebê ou outros equipamentos por longos períodos (Silva; Santos; Gonçalves, 2006b). Portanto, um ambiente adequado, de qualidade, e com práticas maternas apropriadas é imprescindível para que o bebê tenha a possibilidade de exploração, movimentação e adaptação de forma suficiente às diferentes condições imposta pelo meio e pela tarefa que está desempenhando.
3) Características do Bebê Prematuro
O conceito de prematuridade implica na imaturidade para a vida extrauterina. A Organização Mundial de Saúde considera um bebê prematuro aquele que nasce antes de 37 semanas de idade gestacional (IG) ou menos de 259 dias desde o primeiro dia do último período menstrual da mulher (Mandy, 2022). Entretanto, a prematuridade é uma ampla gama de recém-nascidos com diferentes pesos e diferentes idades gestacionais. Quanto à idade gestacional a prematuridade é classificada como prematuridade tardia (34 semanas completas a 36 semanas e seis dias de IG), prematuridade moderada (32 semanas completas a 33 semanas e seis dias de IG) e prematuridade extrema (23 a 31 semanas e seis dias) (Shapiro-Mendoza; Lackritz, 2012). Quanto ao peso, bebês que nascem com peso inferior a 2500 gramas são considerados de baixo peso, com peso inferior à 1500g são denominados de muito baixo peso, e os com peso inferior à 1000g de extremo baixo peso (Rudge, 2005).
A literatura reporta que não apenas o peso ao nascimento é importante, mas também a sua relação com a idade gestacional e taxa de crescimento fetal observado através de curvas-padrão de crescimento próprias de cada população (Rudge, 2005; Fenton; Kim, 2013; Reis et al, 2020), sendo assim descrito em três categorias: AIG (bebês adequados para idade gestacional com o peso entre o percentil 10 e 90), PIG (bebês pequenos para idade gestacional com peso abaixo do percentil 10), GIG (bebês grandes para idade gestacional com peso acima do percentil 90).
Em 2020, estima-se que 13,4 milhões de bebês nasceram prematuros, representando mais de 10% de todos os bebês nascidos vivos em todo o mundo, afetando tanto países ricos como pobres, como os Estados Unidos e o Brasil respectivamente (Minstério Da Saúde, 2024), e a alta e crescente incidência de parto prematuro, associada à morte e deficiência, representa um impacto significativo na saúde pública em todos os países. A partir de dados do Sistema de Informações sobre Nascidos Vivos (Sinasc), no Brasil em 2020 de todos bebês nascidos vivos 11% eram prematuros. Complicações relacionadas à prematuridade é a principal causa de morte em crianças menores de cinco anos de idade, e em 2015 causaram aproximadamente um milhão de óbitos mundialmente (Liu et al., 2016).
Quanto as causas, o parto prematuro pode ser categorizado em espontâneo e indicado e/ou eletivo. Os partos espontâneos ocorrem naturalmente por trabalho de parto prematuro e/ou rotura prematura de membranas; já os partos prematuros indicados têm como causa mais frequente complicações da gestação que podem causar riscos à mãe e/ou ao feto, como por exemplo a pré-eclâmpsia (Lorain; Sibiude; Kayem, 2023). Relacionando as principais causas do parto prematuro indicado estão: 1) indicações maternas: obesidade, idade avançada, diabetes melitus, síndromes hipertensivas da gestação, placenta prévia; 2) indicações fetais: restrição do crescimento intrauterino, anomalias fetais, oligoâmnio ou polidrâmnio; 3) gestação múltipla (Menezes, 2023).
Os bebês a termo quando nascem apresentam respiração autônoma, choram quando estão com fome, sugam para se alimentar, digerem o leite, e possuem as funções fisiológicas complexas como trocas gasosas, controle da pressão arterial, metabolismo da glicose e regulação dos fluidos corporais. Entretanto os bebês que nascem prematuramente não apresentam a maturidade dos órgãos e sistemas apropriadamente, e comumente necessitam de apoio adicional para a sua sobrevivência. Diante disso, o grau de maturidade é um fator decisivo para os índices de mortalidade e das complicações a curto e longo prazo dos bebês prematuros (Behrman; Butler, 2007).
Quanto menor a idade gestacional, maiores os riscos para desfechos adversos graves no neurodesenvolvimento, sobretudo entre os que nascem com muito baixo peso e com idade gestacional inferior a 32 semanas (Faramarzi et al., 2023). Entre os principais desfechos desfavorável no período neonatal estão a leucomalácia periventricular (LPV), hemorragia periventricular e a displasia bronco pulmonar (DBP). Ambos são comuns em bebês prematuros, sendo a LPV é fortemente associada com desfechos perceptomotores, visuais, cognitivos e comportamentais adversos; e além de problemas no neurodesenvolvimento, a DBP também está associada com problemas no crescimento e saúde do bebê, sendo uma importante causa de morbidade a curto e longo prazo (Linsell et al., 2016; Rugolo, 2011).
Estudos reportam que quase metade dos recém-nascidos prematuros extremos que (Jarjour, 2015) sobrevivem, apresentam deficiências significativas no desenvolvimento neurológico a curto e longo prazo. Os resultados adversos de longo prazo incluem incapacidade intelectual (5% a 36%), paralisia cerebral (9% a 18%), cegueira (0,7% a 9%) e surdez (2% a 4%). Graus mais moderados de deficiência envolvendo cognição, comportamento e aprendizado são cada vez observados nos prematuros quando crianças, adolescentes e adultos jovens (Jarjour, 2015). Em um estudo de coorte com prematuros tardios na Inglaterra, os pesquisadores observaram que em comparação com os pares nascidos a termo, os lactentes prematuros apresentam o dobro do risco de incapacidade do desenvolvimento neurológico aos 2 anos de idade, com a maioria das deficiências observadas no domínio cognitivo (Johnson et al., 2015).
Quanto aos desfechos desfavoráveis a nível motor, em estudo prévio de revisão sistemática, os autores encontraram fortes evidências de que a hemorragia periventricular sozinha ou a combinação com leucomalácia periventricular em bebês prematuros foi preditivo de paralisia cerebral (LinselL et al., 2016).
4) Trajetória motora de bebês a termo e prematuros
O primeiro ano de vida é um período de grande plasticidade neural, onde ocorre a aquisição de variadas habilidades motoras. O desenvolvimento motor normal é representado pelo ajuste e variabilidade das atividades motoras realizadas pelo bebê. O ritmo e a sequência do desenvolvimento motor ocorrem de forma invariável e são sujeitos à maturação neural ( Hadders-Algra, 2005). As mudanças do comportamento motor ocorrem ao longo da vida, numa sequência descrita como sendo céfalo-caudal e próximo-distal, conforme ocorre maturação dos centros cerebrais superiores ( Hadders-Algra;2005; 2007) e em relação com as demandas das tarefas (Clark; Metcalfe, 2002; Newell, et al, 2003 ; Thelen, 2005 ).
Ao se considerar essa sequência, presume-se que o bebê tenha controle de cabeça em torno do terceiro mês de idade, seguindo do controle do sentar sem apoio por volta dos sete meses e o andar aos doze meses (Flehmig, 1987). Entretanto observa-se variabilidade no período desta aquisição, pois não depende apenas da idade da criança e da maturação neurológica, mas também das oportunidades da tarefa e o contexto (Clark.; Whitall, 1989; Newell, et al, 2003 ; Thelen, 2005), evidenciando relação intima entre a maturação neural e as experiências ambientais, mudanças maturacionais gerando assimilação dos estímulos ambientais (Campos, et al., 2005). O desenvolvimento neural é importante para que a criança atinja habilidades, entretanto alguns fatores como a interação com o ambiente e a prática, podem desempenhar interferência efetiva sobre o desenvolvimento motor. Um ambiente rico e desafiador, bem como tarefas adequadas, proporcionarão a aquisição de habilidades motoras (Oliveira; Almeida; Valentini; 2012). O recém-nascido a termo apresenta uma variedade de movimentos e estratégias de controle postural, já o bebé nascido prematuro demonstra movimentos repetitivos e simples, com limitado controle postural em comparação com o recém-nascido a termo (Valentini, et al, 2019).
O desempenho motor de bebês brasileiros nascidos a termo tem sido reportado com superior desempenho dos bebês pré-termo, embora se observe uma tendência de melhora no desempenho motor de lactentes pré-termo com o avançar da idade (Saccani; Valentini, 2010; Valentini; Saccani, 2011). Em geral, na ausência de outros distúrbios e com adoção da idade corrigida dos bebês pré-termo, o desenvolvimento motor pode ser equivalente ao de crianças nascidas a termo. Com a adoção da realização da idade corrigida, os bebês prematuros tendem a expressar semelhante desenvolvimento motor de habilidades amplas com os bebês a termo nas idades entre oito e 12 meses (Valentini et al., 2019.), entretanto muitas crianças pré-termo mesmo com correção da idade podem apresentar atraso (Formiga et al., 2015). Ainda mais a forma pela qual as crianças nascidas pré-termo alcançam suas habilidades funcionais parece ocorrer de modo diferente da observada em crianças a termo (Soares; Cunha; Tudella, 2014).
No primeiro ano de vida observa-se uma sequência progressiva de aquisição das habilidades motoras do bebê, com aumento do repertório motor e movimentos mais eficazes que se ajustam aos propósitos do bebê, evoluindo de um estágio menos organizado para um mais organizado (Thelen; Fogel, 1989). Neste período o desenvolvimento motor das crianças, muitas vezes não apresentam um padrão linear ao longo dos meses, observando-se períodos de maior e menor estabilidade na aquisição de habilidades motoras (Saccani; Valentini, 2012), e com semelhanças no desempenho motor entre os sexos, com curvas de desenvolvimento das aquisições posturais em prono, supino, sentado e em pé em padrão não linear, com maior número de aquisições entre os 6 e 9 meses de idade (Saccani; Valentini, 2012; Saccani; Valentini, 2015). Resultados semelhantes foram observados em outros países como Canadá (PIPER; DARRAH, 2021 ), Gana, Índia, Noruega e Estados Unidos da América (ONIS, 2006) e Taiwan (Lung et al., 2011).
Nos primeiros meses de vida a ação motora do bebê é praticamente atos reflexos, com pouca interação social. Os reflexos são responsáveis em auxiliar o bebê a adaptar-se na transição da vida intrauterina para o ambiente externo (Gallahue; Ozmun; Goodway, 2013; Haywood; Getchell, 2024). Ao nascimento do bebê alguns reflexos estão relacionados à sobrevivência (reflexo de sucção, de busca, liberação das vias aéreas), enquanto outros reflexos e/ou reações são precursores dos movimentos voluntários (endireitamento, proteção, marcha, nadar, engatinhar) (Flehmig, 1987; Gallahue; Ozmun; Goodway, 2013). Na luta permanente do bebê para conseguir sobreviver no ambiente ele necessita estabelecer uma relação constante entre o corpo e a força da gravidade para atingir postura ereta, entre elas o sentar com estabilidade. E a medida que os bebês crescem e adquirem novas habilidades motoras, seus comportamentos e interações com o mundo ao seu redor mudam, pois atingir novas habilidades motoras proporciona aos bebês acesso a novos tipos de informações e oportunidades de aprendizado (Libertus; Needham, 2010).
A aquisição de uma nova habilidade motora influencia diferentes domínios do desenvolvimento. Por exemplo, com aumento no controle postural aumenta o interesse dos bebês em objetos, alterando a forma como os bebês respondem e interagem o meio. E após o início da locomoção, os bebês se envolvem com maiores trocas interativas com a mãe, e expressam emoções (Libertus; Needham, 2010). À medida que a organização postural se desenvolve o bebê aprende, não só a antecipar possíveis perturbações vindas do meio, como também estabilizar seu movimento gerando o controle postural adequado às demandas (Case-Smith, 1996; Dusing, 2016). Embora o controle postural seja importante para o desenvolvimento de habilidades funcionais, a sua variabilidade e complexidade sustentam a capacidade do bebê em selecionar uma melhor estratégia para determinada função (Dusing, 2016).
A capacidade de orientar o corpo para receber informações do ambiente, permite que o bebê já nas primeiras semanas aprenda gradualmente a explorar e desenvolver habilidades inicialmente em posição supina. A combinação de experiências motoras iniciais somadas as informações sensoriais e crescente ganho no controle postural favorece o desenvolvimento de novas habilidades motoras, tais como o sentar e alcançar. A capacidade de sentar gera o aprendizado tátil sobre os objetos, as superfícies, e de habilidade de apoiar, empurrar, entre outras, colaborando na seleção de estratégias para estabilizar o corpo em diversas condições do contexto (Hadders-Algra, 2005; Harbourne; Stergiou, 2009)
No final do primeiro mês o bebê já é capaz de levantar o queixo da superfície de contato quando em posição de prono (Flehmig, 1987; Tecklin, 2008), e por volta do segundo mês o bebê é capaz de erguer a cabeça com uma melhora progressiva do controle cervical, proporcionando a capacidade de ampliação da visão e exploração do ambiente. Nesta fase estão presentes também os reflexos de Moro, Tônico Cervical Assimétrico, Galant entre outros, os quais são importantes para a obtenção de informações sensório motor e de organização de movimentos voluntários mais precisos (Flehmig, 1987; Tecklin, 2008). Na posição supina os bebes apresentam os chutes recíprocos que provocam certa perturbação da estabilidade nesta posição; e, quando puxado para sentar o bebê já é capaz de ajudar com a cabeça e variável níveis de flexão dos cotovelos (Shepherd; Buckup, 1996). No terceiro mês, na postura prona, o bebê á capaz de manter os braços estendidos, elevar o tronco da superfície e manter a cabeça elevada acima de 45º. Observa-se também o controle de cabeça quando colocado na postura sentado. Na postura supina o bebê persegue objetos quando estimulado visualmente em um ângulo de 180º, alcança objetos na linha média e apresenta elevação na frequência de chutes recíprocos (Dusing, Stacey C; Harbourne, 2010; Flehmig, 1987; Tecklin, 2008).
Aos quatro meses de idade o bebê já apresenta maior estabilidade e consequentemente equilíbrio tanto na postura prono quanto supino. Com o ganho de controle postural nesta idade observa-se uma ampliação nos movimentos de alcançar e agarrar objetos (Campos et al., 2005). Muitos bebês, nesta idade, sentam-se com apoio na região lombar, com controle da parte superiora do tronco, mas com pouco controle da parte inferior. Aos cinco meses o bebê adquire o controle gradual sobre a parte inferior do tronco (Gallahue; Ozmun.; Goodway, 2013), surge um importante apoio dos braços para frente, quando sentado, através da reação de proteção anterior (Flehmig, 1987). A partir desta idade, aos sete meses, os bebês vão adquirindo as habilidades locomotoras, começando pelo rolar, seguido pelo rastejar e posteriormente o engatinhar, inicialmente em bloco e posteriormente dissociado. Com oito a nove meses o bebê conquista a postura ereta, o que lhe permite uma maior exploração do meio ao seu redor, quando inicia o andar lateral apoiado nas mobílias, julgado como sendo a forma inicial de locomoção independente (Flehmig, 1987; Tecklin, 2008); ao final do primeiro ano de vida o bebê apresenta um maior controle e estabilidade da postura ortostática e inicia a marcha, alcançando estabilidade em todas as posturas por volta dos 18 meses de idade (Flehmig, 1987).
Bebês recém-nascidos a termo em posição supina, são capazes de elevarem as pernas e de realizarem chutes recíprocos, movimentam a cabeça livremente, e levam as mãos à boca, ao mesmo tempo. Já o recém-nascido prematuro faz tentativas de levantar as pernas algumas vezes, mas é incapaz de manter os membros fora da superfície do suporte e utilizam a mesma estratégia seguidamente, onde ao elevar as pernas fora da superfície de apoio o bebê rola para o lado, ele é incapaz de rodar a cabeça de um lado para o outro ou levantar uma perna de cada vez (Dusing, et al., 2009). O recém-nascido prematuro não apresenta variabilidade e complexidade comportamental, sendo que ambos são observados no bebê a termo (Dusing, et al., 2015; Dusing et al., 2013).
Os bebês em resposta às exigências ambientais usam o movimento para se organizar no ambiente, para comunicarem-se e interagirem fisicamente com pessoas e/ou com objetos bem como para alterar posturas ou o ajuste de posições. Movimentos também são usados como recurso para autoconsolar-se, como por exemplo, chupar o dedo (Dusing, 2016). O movimento ativo demonstra ser necessário para o desenvolvimento perceptivo motor adequado, todavia esta é uma área que é frequentemente problemática em crianças nascidas prematuramente. O controle postural pobre pode limitar as competências funcionais que são adquiridas durante o desenvolvimento (Campos; Santos, 2005). O controle postural é a condição necessária para o corpo ter estabilidade se orientar e se organizar no espaço. Portanto, os bebês prematuros (pré-termos) podem apresentar trajetória do desenvolvimento diferente dos recém-nascidos a termo; uma vez que estas trajetórias são distintas e que os mesmos podem apresentar riscos se faz necessário que sejam realizadas avaliações apropriadas para os mesmos (Valentini, et al., 2019). As avaliações são confiáveis se instrumentos apropriados forem utilizados na triagem e diagnóstico destes bebês.
5) Instrumentos de Avaliação do Desenvolvimento Motor em Bebês
Várias escalas, testes e inventários tem sido aplicado como ferramentas de tomadas de decisão, buscando estabelecer parâmetros de avaliação, classificação e diagnóstico de indivíduos, grupos, organizações ou programas. Frequentemente os profissionais da área da saúde abrem mão de diversos instrumentos de avaliação, tanto para diagnóstico clínico como em pesquisa, tornando-se uma conduta crescente no que diz respeito, principalmente, a triagem de bebês com risco para o desenvolvimento (Santos; Araújo; Porto, 2008).
As avaliações motoras em bebês tem várias finalidades, como discriminar os bebês com desenvolvimento típico dos com desordens motoras, avaliar as mudanças ao longo do tempo e predizer quais bebês poderão ter problemas futuros no seu desempenho motor (Spittle; Doyle; Boyd, 2008; Campbell, 2021). Estudos destacam que o primeiro ano de vida é um período crítico de grandes mudanças, porém é desafiador, pois nesse período o desenvolvimento é acelerado, variável e influenciado por diversos fatores (biológicos, ambientais e sociais) (Hadders-Algra, 2002; Hadders-Algra., 2005; Inguaggiato; Sgandurra; Cioni, 2017) e, portanto, importante que sejam identificados os bebês com desordens motoras precocemente para a efetivação de intervenções precoces (Clark; Whitall, 1989; Hadders-Algra, 2007; Thelen; Spencer, 1998).
No entanto, os bebês prematuros (pré-termos) desenvolvem de forma diferente dos recém-nascidos a termo, e se faz necessário que sejam realizadas avaliações apropriadas para os mesmos. A prematuridade apresenta trajetórias motoras diferenciadas dos bebês a termo, sendo, portanto, mais suscetível a categorizações incorretas serem de anormalidade e atraso. Mais complexo torna-se a avaliação dos comportamentos motores de criança exposta por longos períodos em ambiente de unidade de terapia intensiva (UTI) (Spittle et al., 2007; Valentini et al.,2019).
As avaliações motoras no período neonatal precisam ser válidas, confiáveis e projetadas para uso longitudinal desde a idade antes de termo até o período pós termo. Devem são adequadas para utilização em unidade de terapia intensiva neonatal (UTIN), padronizadas, que tenha um conjunto consistente e documentado de procedimentos para a aplicação, apresentar validade de critério e pontuação que garanta que todos os bebês possam ser avaliados em condições semelhantes (Noble; Boyd, 2012).
Os testes disponíveis avaliam principalmente as respostas comportamentais do bebê, reflexos, tônus muscular, observação das posturas antigravitacionais, movimentos espontâneos e interação social. Revisões sistemáticas apontaram alguns instrumentos de avaliação adequados para bebês pré-termos até quatro meses de idade corrigida, e os mais citados em pesquisas foram Assessment of Preterm Infants’ Behaviour (APIB), Neonatal Intensive Care Unit Network Neuro-behavioural Scale (NNNS), Neurobehavioural Assessment of the Preterm Infant (NAPI), Prechtl’s Assessment of General Movements (PAGMs) e Test of Infant Motor Performance, version 5 (TIMP) (Noble; Boyd, 2012). O TIMP foi um dos instrumentos que apresentou propriedades psicométricas mais fortes, melhor validade avaliativa, e o melhor preditor para detecção de disfunção motora (Noble; Boyd, 2012; Spittle; Doyle; Boyd, 2008).
6) Test of Infant Motor Performance – TIMP
Dentre esses instrumentos para os meses iniciais destacamos o TIMP (Test of Infant Motor Performance) é um instrumento que visa à avaliação da postura e do movimento de bebês a partir de 32 semanas de idade gestacional até quatro meses de idade corrigida. É resultado de mais de 20 anos de pesquisa, e foi desenvolvido para uso de profissionais com conhecimento em desenvolvimento motor e experiência em avaliação e intervenção motora. Até a data atual o TIMP passou por cinco versões, sendo que a primeira versão nominada de Supplemental Motor Test, com 27 itens, foi utilizada para estudar, em um ensaio clínico controlado, a eficácia de uma intervenção fisioterapêutica, através do método Neuroevolutivo, no desempenho motor de prematuros com alto risco para um desfecho motor (Girolami; Campbell, 1994). Essa primeira versão foi especialmente desenvolvida para esse estudo piloto, adicionada a Escala de Avaliação Comportamental Neonatal (Neonatal Behavioral Assessment Scale – NBAS) (Brazelton; Nugent, 2011), que avalia a qualidade do tônus muscular, nível de atividade do bebê e os reflexos (composta por 20 itens).
Porém, a NBAS por si só não era suficiente para atender adequadamente os efeitos hipotéticos da intervenção sobre a qualidade do controle postural funcional do bebê, já o Supplemental Motor Test (com 27 itens) foi desenvolvido para contemplar os padrões de movimentos espontâneos e induzidos, bem como o controle motor esperados em bebês saudáveis nascidos a termo e pré-termos com idade corrigida. O estudo mostrou que o instrumento, além de ser sensível a intervenção, foi também sensível à mudança do tempo. Com isso as pesquisadoras decidiram ampliar a faixa etária e adicionar itens qualitativos dos movimentos e do controle seletivo de braços e pernas do bebê, originando a Versão 2 com 53 itens (Campbell et al., 1993, 1995).
A versão 2 apresentava dois tipos de itens: 22 itens observados com respostas dicotômicas, e 31 itens provocados com escalas ordinais de cinco a seis níveis de respostas (Campbell et al., 1995). A primeira investigação em grande escala foi realizada com a versão 3 do TIMP, com 59 itens em escala ordinal (Campbell, 1999; Campbell; Hedeker, 2001; Murney; Campbell, 1998), que foram transformados em níveis de intervalos utilizando a análise psicométrica de Rasch (Campbell; Wright; Linacre, 2002). A análise revelou que alguns itens eram redundantes e que alguns não estavam em conformidade com o modelo esperado, ou seja, bebês mais velhos ou mais capazes deveriam receber escores mais altos em cada item em relação aos mais jovens ou menos capazes. Esses itens foram excluídos originando a versão 4 com 42 itens, sendo 13 itens observados com respostas dicotômicas e 29 itens provocados, com respostas em uma escala ordinal de quatro a sete níveis (Campbell; Wright; Linacre, 2002). A versão 5, que é a atual, contém os mesmos 42 itens da versão 4, porém apresenta um roteiro com fotos e uma padronização dos scores dos bebês em relação à sua idade, podendo ser utilizada para categorizar os bebês com desempenho motor típico e os atípicos (Campbell, 2012).
A abordagem do TIMP é baseada nas teorias dos sistemas dinâmicos, o qual enfatiza que o movimento emerge da interação de três fatores: o indivíduo, a tarefa, e o ambiente, e na abordagem teórica do controle motor (Shumway-Cook; Woollacott, 2007; Thelen, 1995). O indivíduo gera movimento para atender às demandas da tarefa a ser realizada dentro de um ambiente específico. Portanto, a capacidade do indivíduo em atender essas demandas determina a capacidade funcional do mesmo (Kamm; Thelen; Jensen, 1990; Thelen, 1995). Os bebês usam o movimento para se organizar com seu ambiente, para comunicar e interagir fisicamente com pessoas ou objetos, para alterar e/ou ajustar posturas, em responda às exigências ambientais, e para autoconsolar-se, como chupar o dedo (Kamm; Thelen; Jensen, 1990). O movimento ativo é necessário para um bom desenvolvimento perceptivo motor, e um controle postural pobre pode limitar as competências funcionais a serem adquiridas durante o desenvolvimento (Shumway-Cook; Woollacott, 2007).
A elaboração dos itens do TIMP foi baseada nos estudos de Brazelton (resposta orientada a estímulos e reações visuais e auditivas) em relação ao comportamento motor e movimentos espontâneos, bem como sobre o trabalho de Dubowitz (controle da cabeça na posição sentada ereta e quando suspenso na posição prona), e Amiel-Tison (controle postural em sentado e em decúbito lateral (Campbell et al., 1995). Dos estudos de Hadders–Algra e Penchtl a presença de movimentos balísticos (chamados “golpes” e “swats”), em sete a 10 semanas pós-termo, reflete quantidades crescentes de inervação recíproca em coordenação muscular. Entretanto, a ausência desses movimentos em uma idade apropriada pode ter significado diagnóstico de lesão encefálica (Hadders-Algra, 2004; Hadders-Algra et al., 1992; Hadders-Algra; Prechtl, 1992).
O TIMP avalia o controle da postura e a movimentação seletiva e espontânea do bebê, necessários para o desempenho motor funcional. Os itens do teste refletem os movimentos vivenciados pelo bebê em seu contexto, durante a sua interação com sua mãe e/ou cuidador, como por exemplo, no banho, nas trocas de fraldas e brincadeiras (Campbell 2005), e através de uma escala hierárquica de dificuldade, o teste avalia o ajuste entre o padrão de resposta do bebê e níveis de dificuldade de cada item. Os comportamentos motores no controle postural podem ser observados em quatro categorias funcionais: (1) sustentação da postura; (2) recuperação da postura; (3) as transições entre as posturas; e (4) a integração de posturas dinâmicas, como locomoção, manipulação e exploração (Shumway-Cook; Woollacott, 2007). O TIMP avalia comportamentos motores nas três primeiras categorias (Campbell et al., 1995). A diversidade de posicionamentos e de estímulos realizados nos itens do TIMP permite que o bebê demonstre o desempenho de suas habilidades em uma sucessão de tarefas e contextos ambientais (Campbell et al., 1993; Campbell; Wright; Linacre, 2002), pois a administração dos itens do teste desencadeia demandas de movimentos compatíveis com os manuseios próprios da interação mãe/bebê, como ocorre durante a troca de fraldas (levantamento e liberação das pernas enquanto bebê está na posição supina), troca de roupas (rolar o bebê de um lado para o outro movendo braços e pernas), hora do banho (suspensão ventral do bebê, mudança de lado), brincando (incentivar o bebê a realizar perseguição visual de um brinquedo, bem como orientar a cabeça em direção à um som, podendo ser a voz da mãe e/ou cuidador).
Os 13 itens da Escala de Observação são registrados através de observação direta do bebê, num período de 1 a 3 minutos, durante sua movimentação espontânea e com mínimo manuseio. As respostas são dicotômicas, cada item observado (presente) recebe o escore 1 e os itens não observados (ausentes) recebem o escore 0. Os 29 itens provocados apresentam resposta com até seis níveis hierárquicos de dificuldade, sendo escores de zero a seis (0-6). Os valores obtidos nos itens são somados para compor o escore total, o qual será comparado à tabela de padrões de desempenho motor presente no manual do teste. O escore Z será, então, calculado, tomando-se como base o escore total e o desvio-padrão esperado para cada idade corrigida. Consideram-se como casos de desenvolvimento atípico as crianças cujo escore Z for menor que – 0,5 desvio padrão (SD) e como desenvolvimento motor típico aquelas com escore Z maior ou igual a -0,5 desvio-padrão (SD) (Campbell, 2012).
Os equipamentos necessários para a realização do teste TIMP inclui um chocalho, brinquedo sibilante, bola vermelha brilhante, e um pano macio, e uma roda de cálculo da idade para a correção da idade para a prematuridade. O tempo médio de teste é de 33 minutos com uma variação de 20-45 minutos, incluindo as pausas. De acordo com o manual do TIMP, durante essas avaliações, os bebês deverão estar nos estados 3 (sonolento, olhos abrindo e fechando), 4 (acordado, olhos abertos e movimentos corporais mínimos) ou 5 (totalmente acordado, movimentos corporais vigorosos) definidos por Brazelton (Brazelton; Nugent, 2011).
Vários são os testes utilizados para triagem e diagnóstico de anormalidades do desenvolvimento, porém ao aplicá-los devemos conhecer suas vantagens e desvantagens, as propriedades psicométricas das mesmas e sua validade ao serem aplicados em determinadas faixas etárias, pois certos instrumentos apresentam caráter preditivo quando são aplicados em determinadas faixas etárias e/ou condições clínicas. Pesquisa reportam que o TIMP é uma ferramenta discriminativa, preditiva e apresenta capacidade de avaliar as mudanças ao longo do tempo (Barbosa et al., 2005; Campbell et al., 2002, 2006; Campbell; Hedeker, 2001; Guimarães et al., 2011; Chiquetti et al., 2018; Rose; Westcott, 2005; Barbosa; Campbell; Berbaum, 2007; Da Silva et al., 2014; NOVAK et al., 2017; Vanderlinden et al., 2023; Hornby et al., 2024 ).
Uma das fortes características do TIMP é que ele é um dos poucos instrumentos capazes de avaliar o desempenho motor de bebês prematuros, juntamente com o General Movements Assessment (GMA) (Spittle; Doyle; Boyd, 2008; Craciunoiu; Holsti, 2017; Hadders-Algra, 2021; Haffner; Sankovic, 2022). A validade concorrente do TIMP foi verificada comparando-se o seu escore bruto com os escores bruto da AIMS (r=0.66) aos três meses de idade corrigida (Campbell; Hedeker, 2001). Outro estudo comparou a correlação entre Bayle III e o TIMP demonstrando convergência entre o domínio motor e divergência nos domínios cognitivos e de linguagem do Bayle III e o TIMP (Campbell et al., 2013). A validade preditiva do TIMP tem sido estudada com uma variedade de instrumentos de avaliação, entre eles a AIMS (Campbell et al., 2002), o General Movements (Craciunoiu; Holsti, 2017), o BAYLE II (Kim; Lee; Lee, 2011), o Peabody Development Motor Scale-2 (Kolobe; Bulanda; Susman, 2004) e o Bruininks-Oseretsky Test of Motor Proficiency (Flegel; Kolobe, 2002).
O TIMP tem sido utilizado em várias pesquisas com o intuito de avaliar resultados de intervenções motoras e desfechos de ensaios clínicos randomizados, tanto em UTIs quanto a nível ambulatorial, predizer paralisia cerebral, comparar o desempenho motor de bebês nascidos a termo e pré-termo, orientar pais quanto ao melhor manejo com os bebes. O propósito inicial da criação do TIMP foi apresentar ao meio clínico/científico uma avaliação específica para bebês que fosse possível de ser realizada em ambiente de unidade de terapia intensiva, porém que apresentasse uma característica psicométrica para acompanhamento (follow-up) dos mesmos. Em revisões sistemáticas o TIMP foi considerado um instrumento que demonstrou validade de avaliação adequada neste ambiente, principalmente nos pré-termos (Byrne; Campbell, 2013; Spittle; Doyle; Boyd, 2008; Haffner; Sankovic, 2022).
O TIMP surgiu da necessidade de avaliar a eficácia de um programa de intervenção fisioterapêutica, através do Método Neuroevolutivo, na melhora do controle motor de prematuros (Girolami; Campbell, 1994). O estudo verificou que o TIMP demonstrou responsividade para os efeitos do programa (Gmmash; Effgen, 2019; Butera et al., 2024), bem como sobre a eficácia de um programa de fisioterapia domiciliar (Lekskulchai; Cole, 2001). Alguns autores sugerem que o TIMP seja realizado no início da vida em bebês pré-termo, pois os resultados podem ser usados para selecionar crianças para intervenções precoces (Byrne; Campbell, 2013; Hilderman; Harris, 2014; Lee; Galloway, 2012).
As autoras do TIMP analisaram a relevância ecológica do instrumento, e concluíram que as demandas impostas aos bebês durante a administração do TIMP são representativas das exigências ambientais típicas, como ao trocar o bebê o bebê, dar banho, e brincar (Murney; Campbell, 1998). E devido essa familiaridade com as demandas cotidianas, o TIMP é um instrumento que auxilia as mães no entendimento sobre o desenvolvimento de seus filhos, sendo, portanto, uma importante ferramenta com intuito de educar as mães sobre o desenvolvimento motor infantil (Goldstein; Campbell, 2008). A atuação e colaboração familiar é extremamente importante para o sucesso de qualquer intervenção. Dessa forma a orientação aos pais e cuidadores é parte integrante do tratamento. Pesquisadores utilizaram as filmagens dos itens do TIMP para demonstrar aos pais e/ou cuidadores como ocorre o desenvolvimento infantil, quais as formas de melhorar o desempenho motor de seus filhos, e ao término os pais foram capazes de descrever de que maneira iriam brincar com seus filhos, bem como dar continuidade aos exercícios interventivos (Dusing; Murray; Stern, 2008; Dusing; Van Drew; Brown, 2012). Os resultados desses estudos evidenciaram a capacidade do TIMP para educar as mães sobre o desenvolvimento motor infantil.
As propriedades psicométricas do TIMP o transformaram em um instrumento de apoio à pesquisa (Campbell et al., 2015; Lee; Han; Lee, 2012; Peyton; Schreiber; Msall, 2018), à prática clínica (Pai-Jun; Campbell, 2002), e a ação interventiva (Dusing et al., 2013; Hilderman; Harris, 2014; Ustad et al., 2016; Valizadeh et al., 2017). Por isso, estudos com o TIMP vem sendo realizados em diferentes países, como Holanda, China, Índia, Iran, Espanha, Colômbia, Austrália, Polônia, Canadá, Noruega e Brasil. Pesquisas com intuito de identificar precocemente a paralisia cerebral e acompanhar o desfecho pós intervenções (Barbosa et al., 2003; Barbosa; Campbell; Berbaum, 2007; Campbell et al., 2015; Campbell; Hedeker, 2001; Coker-Bolt et al., 2014; Guimarães et al., 2011; Lobo et al., 2013; Øberg et al., 2012; ROSE; Westcott, 2005; Snider et al., 2009, Naranjo Ruiz, 2022; Rodrigues et al., 2024); com bebês com síndrome de Down (Cardoso et al., 2015; Kloze; Brzuszkiewicz-Kuzmicka; Czyzewski, 2016; Moriyama et al., 2020; Johnson; Looper, 2021); em estudo com bebês nascidos de mães usuárias de crack e/ou cocaína (Gasparin et al., 2012); em bebês com doença cardíaca (Cheatham et al., 2015; Uzark et al., 2017; Campbell et al., 2019; Lisanti, 2023), e em bebês portadores de atrofia espinhal muscular tipo I (Finkel et al., 2008), pois são considerados de alto risco para atraso do desenvolvimento, portanto, a avaliação é recomendada.
Destaca-se que o uso do TIMP, nos países supracitados, tem sido feito com normas americanas, sem a validação transcultural. Para uma mensuração eficiente e confiável do desempenho motor, no contexto clínico e científico, torna-se indispensável a aplicação de testes validados, com comprovada fidedignidade, padronização e normatização (Pasquali, 2017).
O Teste da Performance Motora de Bebês Versão 5.1, desenvolvido por Campbell (2012),na sua versão para o português brasileiro traduzida por Golineleo, Barbosa e Martins, (2008), registrada sob direitos autorais pela Infant Motor Performance Scales, LLC, foi validado para bebês brasileiros provenientes de diferentes contextos culturais (Chiquetti; Valentini; Saccani, 2020; Chiquetti; Valentini, 2020; Chiquetti; Nobre; Valentini, no prelo). O primeiro estudo foi conduzido com 20 profissionais de saúde e 655 bebês brasileiros (entre 34 semanas de Idade Pós-Menstrual e 17 semanas de Idade Corrigida). Os autores reportaram alta concordância entre os especialistas com relação à clareza linguística e pertinência dos itens do teste, com índices de concordância elevados. Os autores também examinaram a confiabilidade inter-avaliador, intra-avaliador e teste-reteste, a qual também apresentou forte concordância nas etapas inter-avaliador, intra-avaliador, e estabilidade temporal. A consistência interna obtida na amostra brasileira foi excelente, e o teste também demonstrou alta capacidade de validade discriminante para identificar crianças em risco de atrasos. Outro aspecto extremamente relevante da validação nacional foi a capacidade preditiva do TIMP em relação a atrasos motores posteriores ao longo do primeiro ano de vida. Ainda mais os autores evidenciaram que a validade concorrente com a Alberta Infant Motor Scale foi aceitável aos 3 e 4 meses de idade (Chiquetti; Valentini; Saccani, 2020).
Em um segundo estudo, os autores da validação brasileira (Chiquetti; Valentini, 2020) examinaram o modelo unidimensional do TIMP e sua capacidade de explicar a variância nas respostas e hierarquia dos itens, focando em examinar os níveis de dificuldade e até que ponto os itens da TIMP de forma apropriado podem detectar diferentes níveis de função em bebês brasileiros. Neste estudo ficou claramente demonstrado a confiabilidade dos itens da TIMP e a precisão e sensibilidade do mesmo para detectar diferenças no desempenho de grupos distintos de bebês no Brasil. E finalmente em um terceiro estudo, Chiquetti e colaboradores estabelecem as normativas par ao uso em crianças no Brasil, com uma amostra representativa nacional (Chiquetti; Nobre: Valentini, no prelo).
Portanto, nos três estudos os autores evidenciaram forneceram evidências apropriadas da capacidade do TIMP de detectar diferentes níveis de desempenho motor nos primeiros 4 meses de vida, com grande sensibilidade também em detectar mudanças ao longo do tempo. Essas informações são cruciais em um instrumento para identificar bebês que necessitam de investigação clínica adicional e encaminhá-los para intervenções específicas. Destaca-se que compreender os níveis de dificuldade dos itens também é essencial para planejar a intervenção apropriada, com estratégias específicas que favoreçam o ganho no controle postural, beneficiando o melhor uso das informações perceptuais pelo bebê e acompanhando as mudanças no controle postural dos bebês.
CONCLUSÕES
Este estudo de revisão ressalta a importância de uma avaliação precoce e precisa do desenvolvimento motor infantil, particularmente em bebês de risco, como os prematuros. Embora a taxa de sobrevida de recém-nascidos com complicações perinatais tenha aumentado, o diagnóstico de desordens neurocomportamentais, como atrasos no desenvolvimento motor, déficits cognitivos e problemas comportamentais, continua sendo um grande desafio para os profissionais da saúde. Nesse contexto, a utilização de escalas de avaliação validadas e confiáveis, como o TIMP, é fundamental para a detecção precoce dessas condições, permitindo intervenções mais eficazes e oportunas.
Além disso, a revisão destacou a escassez de instrumentos validados no Brasil, o que dificulta a avaliação precisa, já que o uso de normas de amostras populacionais com características socioculturais diferentes pode levar a erros na interpretação dos resultados. A compreensão do desenvolvimento motor infantil, especialmente nos primeiros meses de vida, é essencial, pois é nesse período que ocorrem as bases fundamentais para a motricidade, o controle postural e a coordenação. O contexto social, familiar e cultural, especialmente nos primeiros anos, exerce grande influência nesse desenvolvimento, podendo facilitar ou dificultar o alcance do potencial motor da criança.
Portanto, esta revisão reforça a necessidade de compreender não apenas os marcos do desenvolvimento motor, mas também os fatores que podem impactá-lo, como as condições de cuidado, a estimulação ambiental e as práticas culturais. O reconhecimento de como o contexto pode afetar o desenvolvimento é crucial para um diagnóstico mais preciso e para a implementação de intervenções que atendam às necessidades específicas de cada criança. A validação e difusão de instrumentos de avaliação como o TIMP, além de outras ferramentas adaptadas para a realidade brasileira, são passos fundamentais para melhorar a qualidade do diagnóstico e da intervenção, garantindo que todos os bebês, independentemente de seu contexto, tenham a melhor oportunidade de desenvolver seu potencial motor e cognitivo desde os primeiros meses de vida.
REFERÊNCIAS
ABBOTT, A. et al. Infant Motor Development and Aspects of the Home Environment. Pediatric Physical Therapy, v. 12, n. 2, p. 62–67, 2000.
ADOLPH, K. E.; FRANCHAK, J. M. The development of motor behavior. Wiley Interdisciplinary Reviews: Cognitive Science, v. 8, n. 1–2, p. e1430, jan. 2017.
ALMEIDA, T. G. A. et al. Comparações entre o desempenho motor e oportunidades de estimulação motora no ambiente domiciliar de lactentes residentes nas regiões Sudeste e Norte do Brasil. Fisioterapia e Pesquisa, v. 22, n. 2, p. 142–147, 2015.
ARAÚJO, A. T. DA C.; EICKMANN, S. H.; COUTINHO, S. B. Fatores associados ao atraso do desenvolvimento motor de crianças prematuras internadas em unidade de neonatologia. Revista Brasileira de Saúde Materno Infantil, v. 13, n. 2, p. 119–128, jun. 2013.
BARBOSA, V. M. et al. Comparison of Test of Infant Motor Performance (TIMP) Item Responses Among Children With Cerebral Palsy, Developmental Delay, and Typical Development. American Journal of Occupational Therapy, v. 59, n. 4, p. 446–456, 1 jul. 2005.
BARBOSA, V. M.; CAMPBELL, S. K.; BERBAUM, M. Discriminating infants from different developmental outcome groups using the Test of Infant Motor Performance (TIMP) item responses. Pediatric physical therapy, v. 19, n. 1, p. 28-39, 2007.
BARTLETT, D. J.; FANNING, J. E. K. Relationships of Equipment Use and Play Positions to Motor Development at Eight Months Corrected Age of Infants Born Preterm. Pediatric Physical Therapy, v. 15, n. 1, p. 8–15, 2003.
BEHRMAN, R. E.; BUTLER, A. S. Preterm birth : causes, consequences, and prevention. Washington, D.C.: National Academies Press, 2007.
BLENCOWE, H. et al. Born Too Soon: The global epidemiology of 15 million preterm births. Reproductive Health, v. 10, n. Suppl 1, p. S2, 15 nov. 2013.
BORBA, L. S. DE; PEREIRA, K. R. G.; VALENTINI, N. C. Preditores do desenvolvimento motor e cognitivo de bebês de mães adolescentes e adultas. Journal of Physical Education, v. 28, n. 1, p. e-2811, 17 dez. 2016.
BORBA, L. S.; SACCANI, R.; VALENTINI, N. C. Desenvolvimento motor de crianças nascidas pré-termo ea termo avaliadas com a escala motora infantil de alberta. Temas Desenvolv, v. 19, n. 105, p. 130-5, 2013.
BRADLEY, R. H.; CORWYN, R. F. Socioeconomic Status and Child Development. Annual Review of Psychology, v. 53, n. 1, p. 371–399, 28 fev. 2002.
BRASIL: Ministério da Saúde. Boletim Epidemiológico | Secretaria de Vigilância em Saúde e Ambiente | Volume 55 | N.º 13 | 30 set. 2024
BRASIL: Sistema de Informações sobre Nascidos Vivos (SISNAC), 2020
BRAZELTON, T. B.; NUGENT, J. K. Neonatal behavioral assessment scale. fourth ed. [s.l.] Mac Keith Press, 2011.
BUTERA, C. D. et al. Development and Initial Outcomes of the Interdisciplinary ‘Early Identification and Intervention for Infants Network’(Ei3) in Los Angeles. Journal of Clinical Medicine, v. 13, n. 23, p. 7442, 2024.
BYRNE, E.; CAMPBELL, S. K. Physical Therapy Observation and Assessment in the Neonatal Intensive Care Unit. Physical & Occupational Therapy In Pediatrics, v. 33, n. 1, p. 39–74, 28 jan. 2013.
CAMPBELL, M. J. et al. Neuromotor performance in infants before and after early open-heart surgery and risk factors for delayed development at 6 months of age. Cardiology in the Young, v. 29, n. 2, p. 100-109, 2019.
CAMPBELL, S. et al. Development of the test of infant motor performance. Physical Medicine and Rehabilitation Clinics of North America, v. 4, p. 541, 1993.
CAMPBELL, S. Test-Retest Reliability of the Test of Infant Motor Performance. Pediatric Physical Therapy, v. 11, p. 60–66, 1999.
CAMPBELL, S. K. et al. Construct Validity of the Test of Infant Motor Performance. Physical Therapy, v. 75, n. 7, p. 585–596, 1995.
CAMPBELL, S. K. et al. Validity of the Test of Infant Motor Performance for prediction of 6-, 9- and 12-month scores on the Alberta Infant Motor Scale. Developmental Medicine and Child Neurology, v. 44, n. 04, p. 263, 9 maio 2002.
CAMPBELL, S. K. The Test of Infant Motor Performance – Test User’s Manual Version 3.0 for the TIMP Version 5, 2012.
CAMPBELL, S. K. et al. Concurrent validity of the TIMP and the Bayley III scales at 6 weeks corrected age. Pediatric physical therapy : the official publication of the Section on Pediatrics of the American Physical Therapy Association, v. 25, n. 4, p. 395–401, 2013.
CAMPBELL, S. K.; HEDEKER, D. Validity of the Test of Infant Motor Performance for discriminating among infants with varying risk for poor motor outcome. The Journal of pediatrics, v. 139, n. 4, p. 546–51, 1 out. 2001.
CAMPBELL, S. K.; WRIGHT, B. D.; LINACRE, J. M. Development of a Functional Movement Scale for Infants. Journal of Applied Measurement, v. 3, n. 2, p. 190–204, 2002.
CAMPBELL, Suzann K. Functional movement assessment with the Test of Infant Motor Performance. Journal of Perinatology, v. 41, n. 10, p. 2385-2394, 2021.
CAMPOS, D.; SANTOS, D.; GONÇALVES, V. Importância da Variabilidade na aquisição de habilidades motoras. Revista Neurociências, v. 13, n. 3, p. 152–157, 2005.
CAMPOS, D.; SANTOS, D. C. C.. Controle postural e motricidade apendicular nos primeiros anos de vida. Fisioterapia em Movimento (Physical Therapy in Movement), v. 18, n. 3, 2005.
CARDOSO, A. C. DAS N. et al. Motor Performance of Children With Down Syndrome and Typical Development at 2 to 4 and 26 Months. Pediatric Physical Therapy, v. 27, n. 2, p. 135–141, 2015.
CASE-SMITH, J. Analysis of current motor development theory and recently published infant motor assessments. Infants & Young Children, v. 9, n. 1, p. 29-41, 1996.
CHEATHAM, S. L. et al. Early Results of Neurodevelopment Following Hybrid Stage I for Hypoplastic Left Heart Syndrome. Pediatric Cardiology, v. 36, n. 3, p. 685–691, 8 mar. 2015.
CHIQUETTI, E. M. dos S.; VALENTINI, N. C.; SACCANI, R. Validation and Reliability of the Test of Infant Motor Performance for Brazilian Infants. Physical and Occupational Therapy in Pediatrics, v. 40, n. 4, 2020.
CHIQUETTI, E. M.; VALENTINI, N. C. Test of infant motor performance for infants in brazil: Unidimensional model, item difficulty, and motor function. Pediatric Physical Therapy, v. 32, n. 4, 2020.
CHIQUETTI, Eloá Maria et al. Fatores de risco e desenvolvimento motor de bebês Pequenos para Idade Gestacional (PIG) a termo e pré-termo. Varia Scientia-Ciências da Saúde, v. 4, n. 1, p. 110-118, 2018.
CHIQUETTI; NOBRE; VALENTINI (no prelo). Population-based age standards for interpreting results on the Test of Motor Infant Performance for Brazilian babies.
CLARK, J. E.; METCALFE, J. S. THE MOUNTAIN OF MOTOR DEVELOPMENT: A METAPHOR. Motor development: Research and reviews, v. 2, p. 163–190, 2002.
CLARK, J. E.; WHITALL, J. What Is Motor Development? The Lessons of History. Quest, v. 41, n. 3, p. 183–202, dez. 1989.
COKER-BOLT, P. et al. Identifying premature infants at high and low risk for motor delays using motor performance testing and MRS. Journal of Pediatric Rehabilitation Medicine, v. 7, n. 3, p. 219–232, 1 jan. 2014.
CONGER, R. D.; DONNELLAN, M. B. An Interactionist Perspective on the Socioeconomic Context of Human Development. Annual Review of Psychology, v. 58, n. 1, p. 175–199, 6 jan. 2007.
CRACIUNOIU, O.; HOLSTI, L. A systematic review of the predictive validity of neurobehavioral assessments during the preterm period. Physical & occupational therapy in pediatrics, v. 37, n. 3, p. 292-307, 2017.
DA SILVA, A. J. et al. Factors related to motor developmental delay of newborns. Journal of Human Growth and Development, v. 24, n. 3, p. 320-327, 2014.
DUSING, S. C. et al. Intervention in the First Weeks of Life for Infants Born Late Preterm. Pediatric Physical Therapy, v. 25, n. 2, p. 194–203, 2013.
DUSING, S. C. et al. Early Complexity Supports Development of Motor Behaviors in the First Months of Life. Developmental Psychobiology, v. 55, n. 4, p. 404–414, 1 maio 2013
DUSING, S. C. Postural variability and sensorimotor development in infancy. Developmental Medicine & Child Neurology, v. 58, p. 17–21, mar. 2016.
DUSING, S. C.; MURRAY, T.; STERN, M. Parent Preferences for Motor Development Education in the Neonatal Intensive Care Unit. Pediatric Physical Therapy, v. 20, n. 4, p. 363–368, 2008.
DUSING, S. C.; VAN DREW, C. M.; BROWN, S. E. Instituting Parent Education Practices in the Neonatal Intensive Care Unit: An Administrative Case Report of Practice Evaluation and Statewide Action. Physical Therapy, v. 92, n. 7, p. 967–975, 2012.
EINSPIELER, C. et al. The General Movement Assessment Helps Us to Identify Preterm Infants at Risk for Cognitive Dysfunction. Frontiers in Psychology, v. 7, p. 406, 22 mar. 2016.
EINSPIELER, C.; MARSCHIK, P. B.; PRECHTL, H. F. R. Human Motor Behavior Prenatal Origin and Early Postnatal Development The Motor Repertoire of the Fetus. Journal of Psychology, v. 216, n. 3, p. 148–154, 2008.
EINSPIELER, C.; PEHARZ, R.; MARSCHIK, P. B. Fidgety movements – tiny in appearance, but huge in impact. Jornal de Pediatria, v. 92, n. 3, p. S64–S70, 1 maio 2016.
FARAMARZI, R. et al. Predicting neurodevelopmental outcomes in preterm infants: A comprehensive evaluation of neonatal and maternal risk factors. Early Human Development, v. 184, p. 105834, 2023.
FENTON, T. R.; KIM, J. H. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics, v. 13, n. 1, p. 59, 20 dez. 2013.
FERRARI, F. et al. Prechtl’s method on the qualitative assessment of general movements in preterm, term and young infants. London: Mac Keith Press, 2004.
FINKEL, R. S. et al. The Test of Infant Motor Performance: Reliability in Spinal Muscular Atrophy Type I. Pediatric Physical Therapy, v. 20, n. 3, p. 242–246, 2008.
FLEGEL, J.; KOLOBE, T. Predictive Validity of the Test of Infant Motor Performance as Measured by the Bruininks-Oseretsky Test of Motor Proficiency at School Age. Physical Therapy, v. 82, n. 8, p. 762–771, 1 ago. 2002.
FLEHMIG, I. Texto e atlas do desenvolvimento normal e seus desvios no lactante : diagnostico e tratamento do nascimento ate o 18º mês. [s.l.] Atheneu, 2002.
FORMIGA, C. et al. Desenvolvimento motor de bebês pré-termo e a termo de 0 a 6 meses de idade. Pediatria Moderna, v. 51, n. 12, 2015.
FORMIGA, C. K. M. R. et al. Predictive models for preterm infants’ early motor development: a longitudinal-prospective study. Journal of Human Growth and Development, v. 27, n. 2, p. 189–197, 6 set. 2017.
FORMIGA, C. K. M. R.; LINHARES, M. B. M. Avaliação do desenvolvimento inicial de crianças nascidas pré-termo. Revista Escola de Enfermagem USP, v. 43, n. 2, p. 472–480, 2009.
FREITAS, T. C. B. et al. Family socioeconomic status and the provision of motor affordances in the home. Brazilian journal of physical therapy, v. 17, n. 4, p. 319–27, 1 ago. 2013.
GALLAHUE, D. L.; OZMUN, J. C.; GOODWAY, J. D. Compreendendo o desenvolvimento motor-: bebês, crianças, adolescentes e adultos. AMGH Editora, 2013.
GMMASH, Afnan S.; EFFGEN, Susan K. Early intervention therapy services for infants with or at risk for cerebral palsy. Pediatric Physical Therapy, v. 31, n. 3, p. 242-249, 2019.
GASPARIN, M. et al. Comportamento motor oral e global de recém-nascidos de mães usuárias de crack e/ou cocaína. Revista da Sociedade Brasileira de Fonoaudiologia, v. 17, n. 4, p. 459–463, dez. 2012.
GIROLAMI, G. L.; CAMPBELL, S. K. Efficacy of a Neuro-Developmental Treatment Program to Improve Motor Control in Infants Born Prematurely. Pediatric Physical Therapy, v. 6, n. 4, p. 175–184, 1994.
GODAMUNNE, P. et al. Comparison of performance of Sri Lankan and US children on cognitive and motor scales of the Bayley scales of infant development. BMC Research Notes, v. 7, n. 1, p. 300, 16 maio 2014.
GOLDSTEIN, L. A.; CAMPBELL, S. K. Effectiveness of the Test of Infant Motor Performance as an educational tool for mothers. Pediatric physical therapy : the official publication of the Section on Pediatrics of the American Physical Therapy Association, v. 20, n. 2, p. 152–9, jan. 2008.
GUIMARÃES, C. L. N. et al. Desenvolvimento motor avaliado pelo Test of Infant Motor Performance: comparação entre lactentes pré-termo e a termo. Rev Bras Fisioter, v. 15, n. 5, p. 357–62, 2011.
HADDERS-ALGRA, M. General movements: A window for early identification of children at high risk for developmental disorders. The Journal of pediatrics, v. 145, n. 2 Suppl, p. S12-8, 1 ago. 2004.
HADDERS-ALGRA, M. Development of postural control during the first 18 months of life. Neural plasticity, v. 12, n. 2–3, p. 99- 108; discussion 263–72, 2005.
HADDERS-ALGRA, M. The Neuronal Group Selection Theory: a framework to explain variation in normal motor development. Developmental Medicine & Child Neurology, v. 42, n. 8, p. 566–572, 13 fev. 2007.
HADDERS-ALGRA, M.; PRECHTL, H. F. R. Developmental course of general movements in early infancy. I. Descriptive analysis of change in form. Early Human Development, v. 28, n. 3, p. 201-213, 1992.
HADDERS-ALGRA, M. Early human motor development: From variation to the ability to vary and adapt. Neuroscience & Biobehavioral Reviews, v. 90, p. 411–427, 1 jul. 2018.
HADDERS-ALGRA, M. Early diagnostics and early intervention in neurodevelopmental disorders—age-dependent challenges and opportunities. Journal of clinical medicine, v. 10, n. 4, p. 861, 2021.
HARBOURNE, R. T.; STERGIOU, Nicholas. Movement variability and the use of nonlinear tools: principles to guide physical therapist practice. Physical therapy , v. 89, n. 3, p. 267-282, 2009.
HAFFNER, D. N.; SANKOVIC, Alexandra. A Neurologist’s Guide to Neonatal Neurodevelopmental Assessments and Preterm Brain Injury. In: Seminars in pediatric neurology. WB Saunders, 2022. p. 100974.
HALPERN, R. et al. Risk factors for suspicion of developmental delays at 12 months of age. Jornal de Pediatria, v. 76, n. 6, p. 421–8, 15 nov. 2000.
HAYWOOD, Kathleen M.; GETCHELL, Nancy. Life span motor development. Human kinetics, 2024.
HEINEMAN, K. R.; HADDERS-ALGRA, M. Evaluation of Neuromotor Function in Infancy–A Systematic Review of Available Methods. Journal of Developmental & Behavioral Pediatrics, v. 29, n. 4, p. 315–323, ago. 2008.
HORNBY, B. et al. Identifying Opportunities for Early Detection of Cerebral Palsy. Children, v. 11, n. 5, p. 515, 2024.
HILDERMAN, C. G. E.; HARRIS, S. R. Early Intervention Post-Hospital Discharge for Infants Born Preterm. Physical Therapy, v. 94, n. 9, p. 1211–1219, 1 set. 2014.
INGUAGGIATO, E.; SGANDURRA, Giuseppina; CIONI, Giovanni. Brain plasticity and early development: Implications for early intervention in neurodevelopmental disorders. Neuropsychiatrie de l’Enfance et de l’Adolescence, v. 65, n. 5, p. 299-306, 2017.
JARJOUR, I. T. Neurodevelopmental Outcome After Extreme Prematurity: A Review of the Literature. Pediatric Neurology, v. 52, n. 2, p. 143–152, 1 fev. 2015.
JOHNSON, S. et al. Neurodevelopmental outcomes following late and moderate prematurity: a population-based cohort study. Archives of disease in childhood. Fetal and neonatal edition, v. 100, n. 4, p. F301-8, 1 jul. 2015.
JOHNSON, R.; LOOPER, J.; FISS, A.. Current trends in pediatric physical therapy practice for children with Down syndrome. Pediatric Physical Therapy, v. 33, n. 2, p. 74-81, 2021.
KAMM, K.; THELEN, E.; JENSEN, J. L. A dynamical systems approach to motor development. Physical therapy, dez. 1990.
KATO, T. et al. Extremely preterm infants small for gestational age are at risk for motor impairment at 3years corrected age. Brain and Development, v. 38, n. 2, p. 188–195, fev. 2016.
KIM, S. A.; LEE, Y. G. Y. J.; LEE, Y. G. Y. J. Predictive Value of Test of Infant Motor Performance for Infants based on Correlation between TIMP and Bayley Scales of Infant Development. Annals of Rehabilitation Medicine, v. 35, n. 6, p. 860, 1 dez. 2011.
KLOZE, A.; BRZUSZKIEWICZ-KUZMICKA, G.; CZYZEWSKI, P. Use of the TIMP in Assessment of Motor Development of Infants With Down Syndrome. Pediatric Physical Therapy, v. 28, n. 1, p. 40–45, 2016.
KOLOBE, T. H.; BULANDA, M.; SUSMAN, L. Predicting Motor Outcome at Preschool Age for Infants Tested at 7, 30, 60, and 90 Days After Term Age Using the Test of Infant Motor Performance. Physical Therapy, v. 84, n. 12, p. 1144–1156, 1 dez. 2004.
KROGH, M. T. et al. Cultural differences in infant development during the first year: A study of Danish infants assessed by the Bayley-III and compared to the American norms. European Journal of Developmental Psychology, v. 9, n. 6, p. 730–736, nov. 2012.
LEE, E.-J.; HAN, J.-T.; LEE, J.-H. Risk factors affecting Tests of Infant Motor Performance (TIMP) in pre-term infants at post-conceptional age of 40 weeks. Developmental Neurorehabilitation, v. 15, n. 2, p. 79–83, abr. 2012.
LEE, H.-M.; GALLOWAY, J. C. Early Intensive Postural and Movement Training Advances Head Control in Very Young Infants. Physical Therapy, v. 92, n. 7, p. 935–947, 1 jul. 2012.
LEKSKULCHAI, R.; COLE, J. Effect of a developmental program on motor performance in infants born preterm. The Australian journal of physiotherapy, v. 47, n. 3, p. 169–76, 1 jan. 2001.
LIBERTUS, K.; NEEDHAM, A. Teach to reach: The effects of active vs. passive reaching experiences on action and perception. Vision Research, v. 50, n. 24, p. 2750–2757, dez. 2010.
LINSELL, L. et al. Prognostic factors for cerebral palsy and motor impairment in children born very preterm or very low birthweight: a systematic review. Developmental Medicine & Child Neurology, v. 58, n. 6, p. 554–569, jun. 2016.
LISANTI, A. J. et al. Developmental care pathway for hospitalised infants with CHD: on behalf of the Cardiac Newborn Neuroprotective Network, a Special Interest Group of the Cardiac Neurodevelopmental Outcome Collaborative. Cardiology in the Young, v. 33, n. 12, p. 2521-2538, 2023.
LOBO, M. A. et al. Grounding Early Intervention: Physical Therapy Cannot Just Be About Motor Skills Anymore. Physical Therapy, v. 93, n. 1, p. 94–103, 2013.
LOHAUS, A. et al. Gross and Fine Motor Differences Between Cameroonian and German Children Aged 3 to 40 Months. Journal of Cross-Cultural Psychology, v. 45, n. 8, p. 1328–1341, 9 set. 2014.
LORAIN, P.; SIBIUDE, J.; KAYEM, G. Parto prematuro: epidemiología, factores de riesgo y evaluación del riesgo en pacientes asintomáticas. EMC-Ginecología-Obstetricia, v. 59, n. 4, p. 1-11, 2023.
LÜCHINGER, A. B. et al. Fetal Onset of General Movements. Pediatric Research, v. 63, n. 2, p. 191–195, 1 fev. 2008.
LUNG, F.‐W. et al. Maternal mental health and childrearing context in the development of children at 6, 18 and 36 months: a Taiwan birth cohort pilot study. Child: care, health and development, v. 37, n. 2, p. 211-223, 2011.
MAJNEMER, A.; SNIDER, L. A comparison of developmental assessments of the newborn and young infant. Mental Retardation and Developmental Disabilities Research Reviews, v. 11, n. 1, p. 68–73, fev. 2005.
MANCINI, M. C. et al. Efeito moderador do risco social na relação entre risco biológico e desempenho funcional infantil. Revista Brasileira de Saúde Materno Infantil, v. 4, n. 1, p. 25–34, mar. 2004.
MANDY, George T. Preterm birth: Definitions of prematurity, epidemiology, and risk factors for infant mortality. UpToDate, Waltham, MA, 2022.
MENDONÇA, B.; SARGENT, B.; FETTERS, L. Cross-cultural validity of standardized motor development screening and assessment tools: a systematic review. Developmental Medicine & Child Neurology, v. 58, n. 12, p. 1213–1222, dez. 2016.
MENEZES, A. Z. A. P.. Trabalho de parto prematuro em hospitais municipais: uma revisão sistemática. Brazilian Journal of Health Review, v. 6, n. 5, p. 19712-19731, 2023.
MIQUELOTE, A. F. et al. Effect of the home environment on motor and cognitive behavior of infants. Infant Behavior and Development, v. 35, n. 3, p. 329–334, 1 jun. 2012.
MORIYAMA, C. H. et al. Systematic review of the main motor scales for clinical assessment of individuals with Down syndrome. Developmental neurorehabilitation, v. 23, n. 1, p. 39-49, 2020.
MURNEY, M. E.; CAMPBELL, S. K. The ecological relevance of the Test of Infant Motor Performance elicited scale items. Physical therapy, v. 78, n. 5, p. 479–89, maio 1998.
NARANJO RUIZ MG, Mónica et al. Translation and Cross-Cultural Adaptation of the Test of Infant Motor Performance to Colombian Spanish. Revista Ciencias de la Salud, v. 20, 2022.
NEWELL, Karl M.; LIU, Yeou-Teh; MAYER-KRESS, Gottfried. A dynamical systems interpretation of epigenetic landscapes for infant motor development. Infant Behavior and Development, v. 26, n. 4, p. 449-472, 2003.
NICOLAU, C. M. et al. Desempenho motor em recém-nascidos pré-termo de alto risco. Journal of Human Growth and Development, v. 21, n. 2, p. 327–334, 2011.
NOBLE, Y.; BOYD, R. Neonatal assessments for the preterm infant up to 4 months corrected age: a systematic review. Developmental medicine and child neurology, v. 54, n. 2, p. 129–39, 1 fev. 2012.
NOVAK, I. et al. Early, accurate diagnosis and early intervention in cerebral palsy: advances in diagnosis and treatment. JAMA pediatrics, v. 171, n. 9, p. 897-907, 2017.
ØBERG, G. K. et al. Study protocol: an early intervention program to improve motor outcome in preterm infants: a randomized controlled trial and a qualitative study of physiotherapy performance and parental experiences. BMC Pediatrics, v. 12, n. 1, p. 546, 15 dez. 2012.
OLIVEIRA, S. M. S.; ALMEIDA, C. S.; VALENTINI, N. C.. Physiotherapy program in applied motor development in babies healthy family environment. Revista da Educação Física/UEM, v. 23, p. 25-35, 2012.
ONIS, M.. Avaliação das diferenças de sexo e heterogeneidade na obtenção de marcos motores entre populações no WHO Multicentre Growth Reference Study. Acta paediatrica , v. 95, p. 66-75, 2006.
PANCERI, C. et al. Neonatal Adverse Outcomes, Neonatal Birth Risks, and Socioeconomic Status: Combined Influence on Preterm Infants’ Cognitive, Language, and Motor Development in Brazil. Journal of Child Neurology, v. 35, n. 14, 2020.
PANCERI, C. et al. Motor development in the first year of life predicts impairments in cognition and language at 3 years old in a Brazilian preterm cohort of low-income families. Frontiers in Neuroscience, v. 16, 2022.
PAPALIA, Diane E.; OLDS, Sally Wendkos; FELDMAN, Ruth Duskin. O Mundo da Criança-: Da Infância à Adolescência. AMGH Editora, 2009.
PASQUALI, L. Psicometria: Teoria dos testes na psicologia e na educação. Editora Vozes Limitada. Petrópolis RJ, 2017
PEREIRA, K. R.; VALENTINI, N. C.; SACCANI, R. Brazilian infant motor and cognitive development: Longitudinal influence of risk factors. Pediatrics International, v. 58, n. 12, p. 1297–1306, 1 dez. 2016.
PEYTON, C.; SCHREIBER, M. D.; MSALL, M. E. The Test of Infant Motor Performance at 3 months predicts language, cognitive, and motor outcomes in infants born preterm at 2 years of age. Developmental Medicine & Child Neurology, 2018.
PRECHTL, H. F. R. General movement assessment as a method of developmental neurology: new paradigms and their consequences. Developmental Medicine & Child Neurology, v. 43, n. 12, p. 836–842, 13 fev. 2007.
PIPER, M.; DARRAH, J.. Motor Assessment of the Developing Infant-E-Book: Motor Assessment of the Developing Infant-E-Book. Elsevier Health Sciences, 2021.
RANIERO, E. P. E.; TUDELLA, E.; MATTOS, R. S. Padrão e ritmo de aquisição das habilidades motoras de lactentes pré-termo nos quatro primeiros meses de idade corrigida. Revista Brasileira de Fisioterapia, v. 14, n. 5, p. 396–403, out. 2010.
REIS, Z. et al. Premature or small for gestational age discrimination: international multicenter trial protocol for classification of the low-birth-weight newborn through the optical properties of the skin. JMIR Research Protocols, v. 9, n. 7, p. e16477, 2020.
ROSE, R. U.; WESTCOTT, S. Responsiveness of the Test of Infant Motor Performance (TIMP ). Pediatric Physical Therapy, v. 17, n. 3, p. 219–224, 2005.
RODRIGUES, D. et al. Motor performance of Indian preterm infants as compared to the US population on the Test of Infant Motor Performance (TIMP). Early Human Development, v. 195, p. 106056, 2024.
RUDGE, M. V. C. Avaliação do peso dos recém-nascidos: o que é normal ou anormal. Revista Brasileira de Ginecologia e Obstetrícia, v. 27, n. 6, p. 299–300, jun. 2005.
SACCANI, R. et al. Associations of biological factors and affordances in the home with infant motor development. Pediatrics international : official journal of the Japan Pediatric Society, v. 55, n. 2, p. 197–203, abr. 2013.
SACCANI, R.; VALENTINI, N. C. Reference curves for the Brazilian Alberta Infant Motor Scale: percentiles for clinical description and follow-up over time. Jornal de pediatria, v. 88, n. 1, p. 40–7, 4 nov. 2012.
SACCANI, R.; VALENTINI, N. C. Cross-cultural analysis of the motor development of Brazilian, Greek and Canadian infants assessed with the Alberta Infant Motor Scale. Revista Paulista de Pediatria, v. 31, n. 3, p. 350–358, set. 2013.
SALES NOBRE, F. S. et al. Affordances Em Ambientes Domésticos E Desenvolvimento Motor De Pré-Escolares. Pensar a Prática, v. 15, n. 3, p. 652–668, 1 out. 2012.
SANTOS, R. S.; ARAÚJO, A. P. Q. C.; PORTO, M. A. S. Diagnóstico precoce de anormalidades no desenvolvimento em prematuros: instrumentos de avaliação. Jornal de Pediatria, v. 84, n. 4, p. 289–299, ago. 2008.
SANTOS, V. et al. Late preterm infants’ motor development until term age. Clinics, v. 72, n. 1, p. 17–22, 2017.
SHAPIRO-MENDOZA, C. K.; LACKRITZ, E. M. Epidemiology of late and moderate preterm birth. Seminars in fetal & neonatal medicine, v. 17, n. 3, p. 120–5, 1 jun. 2012.
SHUMWAY-COOK, A.; WOOLLACOTT, M. H. Motor control : translating research into clinical practice. [s.l.] Lippincott Williams & Wilkins, 2007.
SILVA, P.; SANTOS, D.; GONÇALVES, V. Influência de práticas maternas no desenvolvimento motor de lactentes do 6o ao 12º meses de vida. Revista Brasileira de Fisioterapia, v. 10, n. 2, p. 225–231, 2006.
SHEPHERD, Roberta B.; BUCKUP, Hildegard Thiemann. Fisioterapia em pediatria. In: Fisioterapia em pediatria. 1996. p. 422-422.
SNIDER, L. et al. Prediction of motor and functional outcomes in infants born preterm assessed at term. Pediatric physical therapy : the official publication of the Section on Pediatrics of the American Physical Therapy Association, v. 21, n. 1, p. 2–11, 2009.
SOARES, D. DE A.; CUNHA, A. B.; TUDELLA, E. Differences between late preterm and full-term infants: Comparing effects of a short bout of practice on early reaching behavior. Research in Developmental Disabilities, v. 35, n. 11, p. 3096–3107, 1 nov. 2014.
SPITTLE, A. J.; DOYLE, L. W.; BOYD, R. N. A systematic review of the clinimetric properties of neuromotor assessments for preterm infants during the first year of life. Developmental medicine and child neurology, v. 50, n. 4, p. 254–66, 1 abr. 2008.
TAU, G. Z.; PETERSON, B. S. Normal Development of Brain Circuits. Neuropsychopharmacology, v. 35, n. 1, p. 147–168, 30 jan. 2010.
TECKLIN, Jan Stephen (Ed.). Pediatric physical therapy. Lippincott Williams & Wilkins, 2008.
THELEN, Esther. Dynamic systems theory and the complexity of change. Psychoanalytic dialogues, v. 15, n. 2, p. 255-283, 2005..
THELEN, Esther. Motor development: A new synthesis. American psychologist, v. 50, n. 2, p. 79, 1995.
THELEN, Esther; SPENCER, John P. Postural control during reaching in young infants: a dynamic systems approach. Neuroscience & Biobehavioral Reviews, v. 22, n. 4, p. 507-514, 1998.
TUDELLA et al Desenvolvimento motor no primeiro ano de vida. In: TUDELLA, Eloisa; FORMIGA, C. K. M. R. Fisioterapia neuropediátrica: abordagem biopsicossocial. São |Paulo, SP: Manole, 2021.
UZARK, K. et al. Infant Motor Skills After a Cardiac Operation: The Need for Developmental Monitoring and Care. The Annals of Thoracic Surgery, v. 104, n. 2, p. 681–686, 2017.
VALENTINI, N. C. et al. Motor trajectories of preterm and full term infants in the first year of life. Pediatrics International, 2019.
VALENTINI, N. C. et al. Early Detection of Cognitive, Language, and Motor Delays for Low-Income Preterm Infants: A Brazilian Cohort Longitudinal Study on Infant Neurodevelopment and Maternal Practice, Frontiers in Psychology, 2021.
VALENTINI, N. C.; DE ALMEIDA, C. S.; SMITH, B. A. Effectiveness of a home-based early cognitive-motor intervention provided in daycare, home care, and foster care settings: Changes in motor development and context affordances. Early human development, Ireland, v. 151 2020.
VANDERLINDEN, S. et al. Can items on the TIMP aide in determining the motor performance of children with severe cerebral palsy? A pilot study. Physiotherapy theory and practice, v. 39, n. 5, p. 1044-1051, 2023.
VAN HUS, J. W. et al. Motor impairment in very preterm‐born children: links with other developmental deficits at 5 years of age. Developmental Medicine & Child Neurology, v. 56, n. 6, p. 587-594, 2014.
VOLPE, J. J. Brain injury in premature infants: a complex amalgam of destructive and developmental disturbances. The Lancet Neurology, v. 8, n. 1, p. 110–124, 1 jan. 2009.
VOLPE, J. J. The Encephalopathy of Prematurity—Brain Injury and Impaired Brain Development Inextricably Intertwined. Seminars in Pediatric Neurology, v. 16, n. 4, p. 167–178, 1 dez. 2009.
WANG, C.-J. et al. Analysis of the Test of Infant Motor Performance data from 642 infants with a postconceptual age of 38-58 weeks. Chinese journal of contemporary pediatrics, v. 19, n. 12, p. 1252–1256, dez. 2017.
WORLD HEALTH ORGANIZATION. 2012
ZAJONZ, R.; MÜLLER, A.; VALENTINI, N.-. A influência de fatores ambientais no desempenho motor e social de crianças da periferia de porto alegre. Journal of Physical Education, v. 19, n. 2, p. 159–171, 2008.
ZOMIGNANI, A. P.; ZAMBELLI, H. J. L.; ANTONIO, M. Â. R. G. M. Desenvolvimento cerebral em recém-nascidos prematuros. Revista Paulista de Pediatria, v. 27, n. 2, p. 198–203, jun. 2009.
1Curso de Fisioterapia, Universidade Federal do Pampa, campus Uruguaiana, Uruguaiana, Rio Grande do Sul, Brasil
2Departamento de Educação Física, Fisioterapia e Dança, Universidade Federal do Rio Grande do Sul, Porto Alegre, Rio Grande do Sul, Brasil
