SURGICAL CORRECTION OF EXTRAHEPATIC PORTOSYSTEMIC SHUNT USING CELLULOSE BAND IN YORKSHIRE DOGS: CASE REPORT:
REGISTRO DOI: 10.69849/revistaft/ra10202410022210
Alessandra Oliveira Ghezzi Bittencourt¹
Me. Carolina Lakowicz²
Dr. Matheus Barbosa Gomes Cruz³
RESUMO
O desvio portissitêmico consiste numa anomalia vascular que cria uma comunicação entre um ou mais vasos do sistema portal com a veia cava caudal. Essa comunicação permite que parte do sangue que deveria ser metabolizado no fígado, chegue até a circulação sistêmica sem a devida metabolização, causando alterações de diversas desordens no paciente. O presente relato de caso refere-se ao tratamento cirúrgico de um paciente filhote, da raça Yorkshire Terrier, que apresentava déficit no crescimento, hiporexia, microhepatia, presença de cálculo de biurato de amônio em urinálise e alterações hematológicas, sendo diagnosticado após a realização de angiotomografia computadorizada, como portador de desvio portissitêmico extra-hepático congênito. A técnica cirúrgica escolhida para a correção foi a da utilização da banda de celofane, que realiza a oclusão progressiva do vaso por uma reação inflamatória adjacente à sua implantação. Essa oclusão progressiva é necessária para que a circulação seja restabelecida de maneira gradual evitando assim, que complicações sejam somadas ao quadro. A cirurgia foi realizada com sucesso e o pós-operatório do paciente transcorreu com sinais já esperados para técnica cirúrgica e sem grandes intercorrências.
Palavras-chave: Shunt portossistêmico. encefalopatia hepática. anomalia vascular.
ABSTRACT
Portosystemic shunt is a vascular anomaly that creates a communication between one or more vessels of the portal system and the caudal vena cava. This communication allows a portion of the blood that should be metabolized in the liver to bypass hepatic processing and enter the systemic circulation, resulting in various disorders in the patient. This case report refers to the surgical treatment of a Yorkshire Terrier puppy presenting with growth deficiency, hyporexia, microhepatia, the presence of ammonium biurate crystals in urinalysis, and hematological alterations. The diagnosis of extrahepatic congenital portosystemic shunt was established following computed angiography. The surgical technique chosen for correction involved the use of a cellophane band, which achieves progressive occlusion of the vessel through an inflammatory reaction adjacent to its implantation. This gradual occlusion is necessary to restore circulation slowly, thus avoiding additional complications. The surgery was performed successfully, and the postoperative course was uneventful, showing expected signs for the surgical technique employed.
Keywords: Portosystemic shunt, hepatic encephalopathy, vascular anomaly.
1. INTRODUÇÃO
O desvio portossistêmico consiste em uma anomalia de vasos que cria uma comunicação anormal vascular entre o sistema venoso portal e a circulação sistêmica. (TOBIAS, 2012; FOSSUM, 2014; WEISSE, 2017)
Essa anomalia pode ser considerada como rara e com maior prevalência em cães de raças pequenas e puras, como Yorkshire Terrier, Poodle, Schnauzer, Maltês, Shih-Tzu e Dachshund (KRAUN, 2014; VALLARINO et al., 2020).
Essa anomalia contribui para que uma porção do fluxo sanguíneo portal, proveniente de órgãos como o estômago, intestino, baço e pâncreas, que deveria ser direcionado totalmente para o fígado, seja lançado para a circulação sistêmica, sem que este sangue passe pela metabolização necessária (SANTOS, 2014; VALLARINO et al, 2020).
Caso o vaso anômalo do portador do desvio portissitêmico não seja tratado, este pode desenvolver problemas de ordem metabólica que trazem prejuízos ao seu desenvolvimento, podendo este apresentar sinais neurológicos, urinários e gastrointestinais, sendo necessário uma avaliação mais específica através de exames de imagem para identificar e tratar de maneira satisfatória (HAYASHI, 2020).
2. REVISÃO DE LITERATURA
O Desvio Portossistêmico apresenta-se como uma anomalia vascular que literalmente cria um desvio fazendo com que o sangue portal que provém do estômago, baço, intestino e pâncreas, seja desviado de seu caminho original, deixando de passar pelo processo de metabolização hepática e sendo despejado diretamente na circulação sistêmica. Esse desvio resulta num subdesenvolvimento hepático que por efeito cascata, desenvolve diversas alterações tanto no órgão quanto no sistema que deixa de receber o produto da metabolização hepática (NELSON & NELSON, 201, WEISSE 2017, FELICIANO, 2019).
Estes desvios são classificados como congênitos e adquiridos, intra e extra hepáticos, sendo os congênitos extra-hepáticos de maior incidência e observados em sua maioria em cães de raças pequenas tendo como raça de maior predisposição a Yorkshire Terriers (TOBIAS, 2012).
Para que haja uma melhor compreensão sobre esta afecção, faz-se necessária uma revisão de literatura sobre as funções do fígado e a anatomia vascular do sistema portal.
2.1 ANATOMIA E FISIOLOGIA DO FÍGADO CANINO
Anatomicamente localizado na porção torácica do abdômen, entre o 6º e o 12º espaço intercostal e obliquamente ao diafragma, o fígado é considerado a maior glândula do corpo. Sua estrutura é dividida em lobos, e recoberta por uma camada de peritônio mais externamente; a exceção da inserção do pâncreas e fissura portal; e por uma camada fibrosa delgada mais internamente (SISSON & GROSSMAN, 1975).
Em sua face diafragmática, apresenta uma conformação convexa quando observado crânio-caudalmente, em direção ao diafragma e notadamente côncava se observado em sua face visceral caudo-cranialmente, em direção aos outros órgãos (KONIG, 2011)
O tamanho do órgão pode sofrer variações a depender da espécie, peso corporal e idade do indivíduo avaliado, no entanto a média equivale a de 3% a 4% do peso corporal dos cães, sendo que no animal jovem, pela contribuição hematopoética torna-se relativamente maior, enquanto no animal idoso sofre considerável atrofia (KÖNIG, 2011 e CULLEN et al., 2016).
Nos cães, o fígado se apresenta dividido em lobos direito e esquerdo, divididos em medial e lateral, também por um lobo quadrado e um lobo caudado que abriga dois processos, o processo caudado e o processo papilar (FOSSUM, 2014).
Como glândula, o fígado possui função endócrina e exócrina, sendo a bile, o produto de sua secreção exócrina. Esta fica armazenada na vesícula biliar de onde é escoado pelos ductos biliares auxiliando na emulsificação das substâncias ricas em gordura antes de sua absorção (KÖNIG, 2011).
Além da produção de bile, o fígado também exerce importante funções na homeostase do organismo a partir do metabolismo de carboidratos, de lipídios e proteínas, de vitaminas, de hormônios endócrinos e realizando ainda funções de armazenamento de substâncias e de água, funções hematológicas, digestivas, detoxificantes e excretoras (SANTOS et al.,2020, WEISSE, 2017).
2.2 CIRCULAÇÃO HEPÁTICA
De acordo com FOSSUM, 2014, a circulação hepática (Figura 1) é suprida por sistemas de alta e baixa pressão. Dessa forma, observam-se drenagens provenientes de estômago, intestinos, pâncreas e baço, sendo direcionadas para a veia porta e o restante desse suprimento de sangue proveniente das artérias hepáticas. A artéria hepática é responsável pela nutrição do fígado e juntamente com a veia porta adentra o órgão em sua face visceral. Dentro do órgão, ambas se ramificam por todo o tecido hepático, acompanhando os tributários do ducto hepático e irrigando e nutrindo todo o parênquima hepático (Figura 2).
Aproximadamente 80% do volume sanguíneo que chega ao fígado é abastecido pelo sistema porta que junto, oferta 50% do oxigênio que chega ao órgão. O restante de sangue e oxigênio é levado ao fígado pela artéria hepática (BERENT, 2009).
Figura 1 Tributárias da veia porta em um cão: aspecto ventral
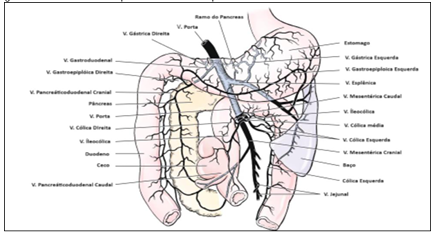
Evans & Lahunta, 2013. Adaptado
Figura 2 – Anatomia e Circulação hepática
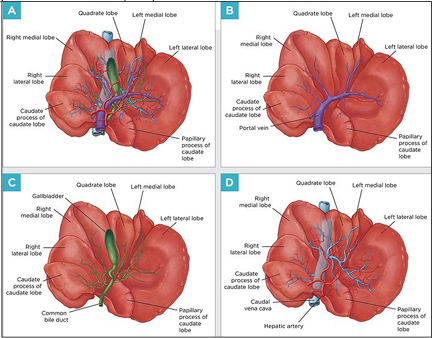
A – Anatomia do fígado. B – Irrigação sanguínea portal. C – Sistema biliar. D – Drenagem da circulação venosa e arterial. Fonte: Piegols & Mison, 2021
2.3 ANATOMIA VASCULAR DO SISTEMA PORTAL EM CÃES
Quando se observa a anatomia vascular do sistema portal de um cão, deparase primeiramente com uma veia calibrosa, a veia porta, que se bifurca formando os ramos direito e esquerdo e que auxiliará no suprimento dos lobos hepáticos central e direito (BERENT, 2009, TOBIAS, 2012).
Estas veias continuam a ramificar até que se transformem em vênulas que conduzirão o sangue pela tríade portal. A tríade portal é composta de um ramo de ducto biliar, uma vênula portal e uma arteríola hepática (figura 3). O sangue que vem da tríade portal percorre os sinusóides hepáticos, que são capilares que recebem o sangue da vênula porta e da arteríola hepática. Esses sinusóides possuem paredes permeáveis por onde o sangue consegue passar e chegar aos hepatócitos. Nos hepatócitos esse sangue será metabolizado e percorrerá um trajeto novamente pelos sinusóides, até chegar na veia hepática central do lobo hepático. Depois disso, será direcionado através de vênulas e veias hepáticas para a veia cava caudal, de onde segue para a circulação sistêmica (BERENT, 2009, TOBIAS, 2012).
Figura 3- Visualização da tríade portal em lóbulo hepático
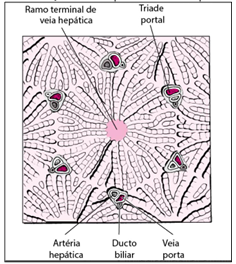
Fonte: https://encr.pw/Z21QU. Acesso em 27 nov. 2023.
Se por algum motivo, esse caminho até o hepatócito for interrompido por um vaso anômalo, esse sangue chegará à circulação sistêmica sem a devida metabolização, causando diversos problemas à saúde do paciente (BERENT, 2009, TOBIAS, 2012).
2.4 CLASSIFICAÇÃO DO DESVIO PORTOSSISTÊMICO
Por ser uma condição rara, o aparecimento de um desvio portossistêmico é relatado em cerca de 0,18% na população canina, sendo que se desenvolve em apenas 0,05% dos cães sem raça definida (TOBIAS, 2012).
Anatomicamente o desvio portossistêmico pode ser classificado como intra-hepático, mais comum em cães de raças grandes ou extra-hepático, comum em raças pequenas e de etiologia como sendo congênito ou adquirido. Além de sintomas específicos, o diagnóstico é fechado a partir de informações colhidas durante a anamnese, através de exames laboratoriais e de imagem (WEISSE, 2017).
Diversos tipos de desvios portossistêmicos em cães e gatos, dentre eles (figura 4) o portocaval intra-hepático, o portocaval extra-hepático, o porto ázigos extra hepático, entre outros. O que mais se observa em cães e gatos é que em aproximadamente 25 a 33% dos desvios portossistêmicos são intra-hepáticos enquanto 63 a 75% são extra-hepáticos (TOBIAS, 2012).
Atualmente sabe-se que a raça Yorkshire Terrier, possui uma probabilidade de herdar essa anomalia cerca de 35,9 vezes maior do que se avaliadas todas as outras raças suscetíveis. No entanto, apesar dessa constatação, ainda não foi possível identificar o mecanismo genético e o real processo hereditário que predisponha esta raça à esta anomalia venosa (HUNT, 2004; K. M. TOBIAS, 2003; WINKLER, BOHLING, TILLSON, WRIGHT, & BALLAGAS, 2003).
Figura 4 – Tipos de desvios portossistêmicos descritos em cães e gatos
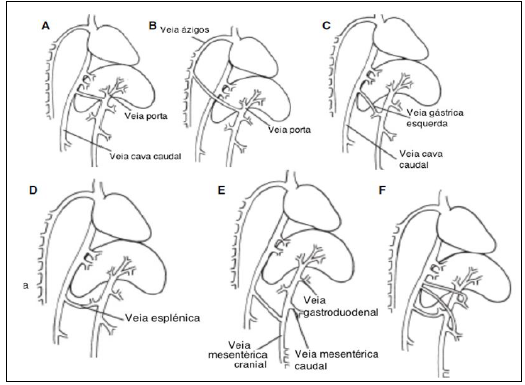
A – Veia porta a veia cava caudal. B – Veia porta a veia ázigos. C – Veia gástrica esquerda a veia cava caudal. D – Veia esplênica a veia cava caudal. E – Veia gástrica esquerda, mesentérica cranial, mesentérica caudal ou veia gastroduodenal a veia cava caudal. F – Combinações das veias anteriores Fonte: FOSSUM, 2014.
2.5 SINAIS CLÍNICOS
Os primeiros sinais observados estão relacionados ao baixo desenvolvimento do animal, quando é comum observar anorexia progressiva. Os portadores de desvio portossistêmico manifestam sinais relacionados a disfunção hepática, no entanto, alguns são assintomáticos e ao apresentarem microhepatia ou hipoalbuminemia é estabelecida a suspeita da afecção (RADLINSKY, 2013).
Além disso, o paciente pode desenvolver a encefalopatia hepática, que de acordo com MULLINS et al., 2022, é considerado um dos principais sintomas dos portadores de desvio portossistêmico e alterações do trato urinário inferior, que de acordo com TOBIAS, 2012, manifestam-se a partir de sintomas como hematúria, estrangúria, polaciúria ou obstrução urinária.
Em relação à encefalopatia hepática, ela é resultado da não filtração completa do sangue proveniente do trato gastrintestinal que deveria chegar ao fígado (COSTA, R.C. & DEWIEY, C. W., 2017).
O sangue não filtrado, pode conter toxinas provenientes do intestino, como a amônia. Estas toxinas provocam neurotoxicidade alterando equilíbrios de neurotransmissores e desencadeando os sintomas neurológicos da encefalopatia hepática como alteração do estado mental, comportamento anormal, andar compulsivo, compressão da cabeça contra paredes, déficits visuais e atividades convulsivas reativas (COSTA, R.C. & DEWIEY, C. W., 2017).
A amônia é formada a partir da ação, no intestino grosso, de bactérias coliformes anaeróbicas sobre proteínas. Grande parte dessa amônia, ao chegar nos hepatócitos, será convertida em ureia. No entanto, devido ao desvio portossistêmico, essa metabolização hepática não ocorre e essa amônia percorre diretamente a circulação sistêmica, sendo observada no plasma (MULLINS et al., 2022).
Além dos sinais neurológicos, pacientes que sejam acometidos pela encefalopatia hepática também podem apresentar perda de peso, anorexia, diarreia, poliúria e polidipsia (COSTA, R.C. & DEWIEY, C. W., 2017).
No trato urinário inferior, os sintomas tendem a aparecer quando a produção de ureia é diminuída, pelo aumento da excreção renal de amônia concomitante a uma redução do metabolismo do ácido úrico. Isso favorece a formação de cálculos de biurato de amônio podendo inclusive, estarem associados a bactérias oportunistas secundárias (TOBIAS, 2012).
Cães de raças pequenas como Yorkshires ou Malteses, que apresentem desvio portossistêmico extra-hepático podem ser completamente assintomáticos, ou com achados como um fígado pouco desenvolvido hipoglicemia (TOBIAS, 2020).
Para TOBIAS, 2012, aos pacientes portadores de desvios portossistêmicos do tipo porto ázigos ou porto frênicos, os sinais clínicos tendem a ser mais leves em virtude de os vasos anômalos serem comprimidos pelo diafragma no momento da respiração ou pela distensão gástrica comum após as refeições, o que acaba oferecendo uma melhor perfusão portal.
2.6 DIAGNÓSTICO
Para que o diagnóstico preciso, é necessário que exames sejam realizados e estes devem incluir hemograma e perfil bioquímico, avaliação de amônia com o paciente em jejum, avaliação fecal e de ácidos biliares pré e pós prandial (SANTOS et al., 2014).
Apesar de não ser um exame específico para a identificação da anomalia de vasos, o exame de ácidos biliares auxilia na suspeita da afecção. Deve ser realizado primeiramente com o paciente vindo de um jejum de 12 horas e após 2 horas de uma refeição rica em carboidratos (THRALL et al, 2015).
O exame ultrassonográfico auxilia identificar os vasos anômalos e a avaliar a velocidade do fluxo sanguíneo. Além disso, proporciona uma avaliação de todo o parênquima hepático e de todo sistema de irrigação do sistema portal, hepático e biliar (FELICIANO, 2019).
Considerada como sendo um exame de padrão ouro para avaliação de anomalias vasculares, a tomografia computadorizada é a técnica para se fechar o diagnóstico de desvio portossistêmico. Além da rapidez na execução do exame, suas imagens tridimensionais permitem tanto identificar quando localizar anatomicamente a origem e a inserção do vaso anômalo (JOHNSTON e TOBIAS 2018).
Além disso, por se tratar de um exame não invasivo, a tomografia permite diagnóstico rápido e possível de ser realizado em animais de qualquer espécie e tamanho, o que fornece possibilidade de se realizar um planejamento pré-operatório mais preciso, pela excelente visão da anatomia, do vaso anômalo e da circulação adjacente e avaliar outros órgãos identificando alterações que tenham relação com o problema, como a microhepatia ou a renomegalia (FOSSUM, 2014; KIM et al., 2013).
A eficácia da angiotomografia apresenta-se como 5,5 vezes maior quando comparada a ultrassonografia abdominal, na avaliação sobre a presença ou ausência de desvios portossistêmico congênitos (KIM, et al., 2013)
Quando se fala em resultados de exames laboratoriais, em hemograma pode-se identificar anemias provavelmente pelo déficit de ferro, por conta da própria lesão hepática que a anomalia do vaso ocasiona, sendo possível também identificar leucocitose por neutrofilia (SIMPSON et al., 1997).
Já em exame bioquímico, observa-se redução do trabalho de síntese e metabolização hepática devido à hipoalbuminemia, hipoproteinemia (PAEPE et al., 2007).
Também é possível identificar fosfatase alcalina e alanina aminotransferase aumentadas, hipocolesterolemia e redução da concentração de ureia plasmática (BERENT; TOBIAS, 2009).
Outro exame importante é da avaliação de ácidos biliares, sendo necessário realizar a coleta pré e pós prandial. Este exame é necessário porque avalia a capacidade do hepatócito em sintetizar estes ácidos, devolvendo-os à vesícula biliar ou para recirculação durante o processo digestivo (JERICÓ et al., 2015).
Com sintomas de poliúria e polidipsia, em exame de urinálise o paciente apresentará densidade baixa e coloração alterada, podendo inclusive ser identificada a presença de cristais de biurato de amônio pela não conversão da amônia em ureia (SASSAKI, 2001).
2.7 TRATAMENTO
O tratamento inclui abordagens médicas e cirúrgicas, que oferecem melhora na qualidade de vida do paciente, muitas vezes até preparando-o para a cirurgia de correção e oferecendo o suporte necessário para que o resultado seja o melhor possível (FOSSUM, 2014).
2.7.1 TRATAMENTO CLÍNICO
O tratamento clínico para desvio portossistêmico, não é curativo, tendo por objetivo controlar sintomas, estabilizando o paciente no pré-operatório ou, caso não seja possível de ser realizada a correção cirúrgica, sendo a opção de escolha (RADINSKY, 2013).
Dentre os resultados esperados com o tratamento clínico, busca-se reduzir a absorção de toxinas provenientes do intestino e a minimização de lesões oxidativas hepatocelulares em casos de infecções, alterações neurológicas ou hemorragia gastrointestinal (FOSSUM, 2014).
Dessa forma, através do tratamento clínico é instituído um protocolo que combine dieta hipoproteica, antibiótico para controle de bactérias produtoras de urease, como metronidazol, ampicilina ou neomicina, e lactulose oral ou retal (JOHNSTON e TOBIAS, 2018).
A lactulose, por ser um dissacarídeo osmótico e de ação laxativa, contribui para a redução da absorção da amônia pelo trato gastrointestinal, convertendo-a num cátion não absorvível pelas mucosas do cólon (FOSSUM et al., 2014).
A terapia anticonvulsivante será realizada de acordo com a necessidade ou limitação do paciente e pode ser realizada através da utilização de fármacos como o midazolam, fenobarbital, brometo de potássio ou sódio, e levetiracetam (MULLINS, 2018; JOHNSTON e TOBIAS, 2018). Hemorragias ou anemias podem exigir transfusão de eritrócitos, plasma ou sangue total (FOSSUM et al., 2014).
O manejo nutricional inclui o uso de rações específicas para doenças hepáticas na dieta. Através desse manejo, evita-se que ocorra transformação da proteína em amônia (DOS SANTOS et al., 2019; SERRANO, 2019).
Como no fígado acometido por um desvio portossistêmico, há um déficit de hepatócitos, algumas substâncias tóxicas ao organismo, deixam de ser metabolizadas. Dessa forma, é importante também que seja realizada suplementação de aminoácidos como a arginina e a glutamina, que sintetizam proteínas e a amônia, reduzindo riscos de intoxicação e de vitaminas A, D e K, vitaminas do complexo B, minerais como Ferro, que segundo HAND et al, 2010, podem sofrer alterações significativas em seu armazenamento e disponibilidade.
2.7.2 TRATAMENTO CIRÚRGICO
O tratamento cirúrgico tem o objetivo de ocluir o vaso anômalo e resgatar todo o sangue antes desviado por ele. Dentre as técnicas para se realizar a correção do desvio portossistêmico extra-hepático estão a ligadura direta, que implica em risco da hipertensão portal ou a oclusão progressiva do vaso anômalo (FOSSUM, 2014).
Das técnicas de oclusão progressiva destacam-se a banda de celofane e a colocação de anel ameróide. Apesar do anel ameróide ser a principal escolha, fatores financeiros podem justificar a escolha entre uma ou outra técnica. Em qualquer uma das técnicas, o desvio deve ser encerrado o mais próximo possível da sua comunicação com a veia cava (NELSON & NELSON, 2011; HUNT et al.; 2014; GREENHALGH et al.; 2014; FOSSUM 2014).
A técnica para a oclusão com o anel ameróide utiliza um dispositivo formado por um anel de caseína revestido por uma bainha de aço inoxidável (FOSSUM, 2014). A caseína é uma substância hidrófila e quando em contato com líquidos causa uma dilatação do anel. Concomitante a isso, o organismo inicia uma tentativa de isolar esse anel através da formação de tecido fibroso por reação a corpo estranho, resultando na oclusão progressiva do desvio portossistêmico (HUNT et al., 2014).
A técnica para a oclusão do vaso anômalo utilizando a banda de celofane, foi utilizada pela primeira vez em 1990, devido à falta de um material de uso médico e deve ser corretamente preparado e esterilizado para uso cirúrgico (FALLS et al., 2013). Tem o mesmo princípio da técnica do anel constritor ameróide e sua oclusão também ocorre pela fibrose tecidual (FOSSUM, 2014).
A banda de celofane é constituída por celulose regenerada ou pequenos pedaços de poliéster, gerando uma reação inflamatória no local, com características de um corpo estranho crônico. Como no anel ameróide, causa uma fibrose e sua construção gradual acontece geralmente em torno de 4 semanas (JOHNSTON e TOBIAS, 2018).
2.8 PROGNÓSTICO
As possíveis complicações em pós-operatório são o desenvolvimento de alterações neurológicas, incluindo convulsões de difícil controle, oclusão incompleta do vaso com possível persistência dos sinais clínicos, desenvolvimento de múltiplos desvios portossistêmicos adquiridos por hipertensão portal pós atenuação do desvio, coagulopatias e hipoglicemia (STRICKLAND et al., 2018).
Em relação à taxa de mortalidade, quando as técnicas são comparadas, percebe-se que a taxa de mortalidade em cães que receberam o anel ameróide é de 7%, nos que receberam a banda de celofane é entre 6 e 9%, enquanto nos pacientes onde foi realizada a ligadura direta, a taxa de mortalidade pode chegar até 32%. A principal causa de óbito é a persistência de graves sinais neurológicos, mesmo após 30 dias da cirurgia. (TOBIAS, 2012)
A curto prazo, outras causas de morte podem ser citadas, hemorragia intraoperatória, coagulopatia pós-operatória, a hipertensão portal, ulcerações gastrointestinais, peritonite, podendo inclusive haver uma hipoplasia portal incompatível com a manutenção da vida do animal (TOBIAS, 2012).
A longo prazo, ainda não há um consenso sobre o que seria a condição ideal do paciente que passou por cirurgia para correção do desvio portossistêmico. Há estudos que veem como desfavorável a manutenção da dieta hipoproteica em pacientes assintomáticos. Em outros estudos afirma-se que é possível considerar a disfunção hepática sanada, quando os resultados de exames de ácidos biliares ficarem abaixo de 40 µmol/l; o que pode ser refugado, uma vez que em pacientes portadores de desvios portossistêmico congênitos assintomáticos, observou-se concentrações de ácidos biliares pré e pós/ prandial inferiores a 20 µmol/l (TOBIAS, 2012).
Além disso, diversos fatores contribuem para a sobrevida longa do paciente como a disponibilidade de acompanhamento periódico, cujo objetivo é avaliá-lo através de exames em seu estado geral e do funcionamento de seu organismo (TOBIAS, 2012).
3. RELATO DE CASO
Foi atendido um cão da raça Yorkshire Terrier, macho não castrado, com idade de 8 meses e pesando 1,4 kg, com suspeita prévia de desvio portossistêmico extrahepático. A tutora do animal é médica veterinária e percebeu emagrecimento progressivo há cerca de três meses, observando além disso uma alteração em coloração e aspecto da urina. Durante a anamnese, relatou que o animal se alimentava de ração úmida tradicional e de ração seca da linha terapêutica hepática, ambas Royal Canin®. Paciente apresentava hipodipsia e hipofagia.
O paciente já havia realizado urinálise e exames de hemograma completo e bioquímico, com dosagem sérica normal para creatinina, FA, ALT. Urinálise apresentou densidade aumentada, cor amarelo escuro e aspecto turvo e discreto aumento de ureia. Paciente também havia realizado exame ultrassonográfico, no qual foi observada microhepatia e renomegalia com focos hiperecoicos.
No exame físico, apresentou frequência cardíaca 164 bpm, frequência respiratória 26 mpm, ausculta pulmonar limpa, temperatura retal de 38,7ºC e mucosas normocoradas. Apresentava-se normohidratado e com tempo de preenchimento capilar (TPC) de 2 segundos.
Foi solicitada angiotomografia computadorizada do abdome e exames hematológicos.
A tomografia abdominal foi realizada pelo método helicoidal – multislice – com o paciente em decúbito ventral. Foram adquiridas imagens em cortes transversais em janela/filtro tecidos moles (1 mm) e após a administração de contraste por via intravenosa (1 e 1 mm), fase arterial/portal e tardia. Na descrição dos órgãos, a tomografia mostra que quando avaliados os grandes vasos abdominais, ficou confirmada a presença de anomalia complexa em vaso localizado cranialmente no abdômen esquerdo (Figura 5), com origem em veia gástrica esquerda, que se divide em dois pontos distintos de comunicação anômala. A primeira comunicação anômala está referida como se dando pela inserção em formato da letra “C” em veia ázigos; a segunda comunicação anômala aparece em formato mais linear em veia frênica adjacente e à esquerda do diafragma. Por essa dupla anomalia, a veia porta estava reduzida na região porta hepática e media aproximadamente 0,31 cm, enquanto a região de maior valor mensurado do desvio portossistêmico propriamente dito antes da divisão, media 0,56 cm.
Figura 5 – Reconstrução 3D de angiotomografia abdominal de cão macho, raça Yorkshire Terrier, 8 meses apresentando desvio portossistêmico.
Observar vaso em formato de “C” e outro linear, ramos da veia gástrica esquerda e se ligando respectivamente a veias azigos e frênica.
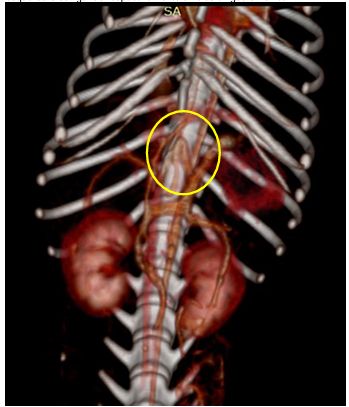
Fonte: acervo pessoal
Em relação ao fígado, a tomografia identificou microhepatia e foi possível observar que os rins se apresentavam subjetivamente aumentados, no entanto nenhuma alteração relevante foi indicada. Em vesícula urinária, foi observada presença de urólito medindo 0,3 cm de comprimento intraluminal.
Em relação aos exames hematológicos, foram observadas alterações com aumento em Fosfatase Alcalina (FA) (236 UI/L), indicativa de lesão hepática, hipoproteinemia (4,86 g/dL), e hipoglicemia (43 mg/dL) em decorrência dessa lesão hepática.
Com a confirmação do diagnóstico e exames laboratoriais compatíveis com a cirurgia, iniciou-se um protocolo pré-operatório profilático, visando a prevenção de eventos adversos pós-cirúrgicos. Dessa forma, iniciou-se a administração de Levetiracetan na dose de 20 mg/kg/BID por via oral dois dias antes da cirurgica, além de lactulose (0,5 ml/kg) por sete dias, e dieta com ração terapêutica hepática.
As bandas de celofane foram preparadas antes da cirurgia. Foi utilizado celofane de celulose incolor e este foi separado em tiras de aproximadamente 1 cm x 10 cm que foram dobradas três vezes, formando tiras espessas e flexíveis que passaram por esterilização prévia.
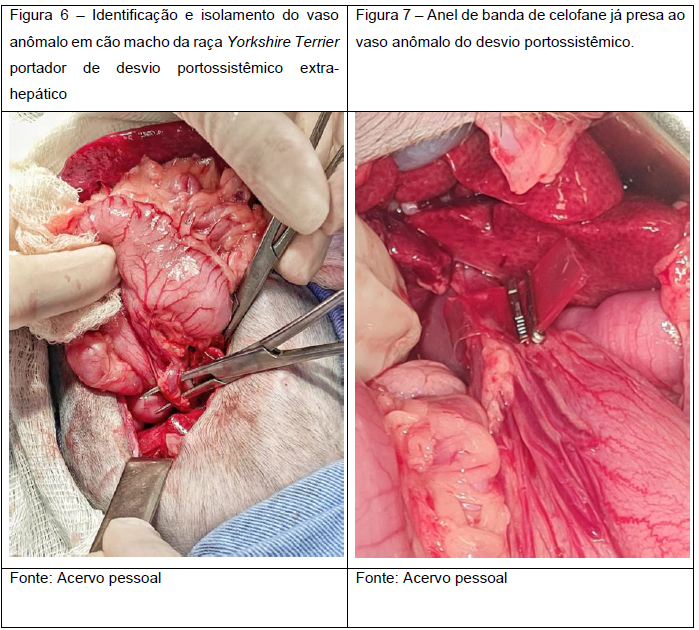
A cirurgia foi realizada 41 dias depois do primeiro atendimento. Na indução foram utilizados o remifentanil (10 mg/kg/h IV) e propofol (20 mg/kg/h IV), seguida de ampla tricotomia da região abdominal, antissepsia pré cirúrgica com Clorexidina degermante 2%. Seguiu-se com bloqueio analgésico guiado por ultrassom em músculo quadrado lombar bilateral, que bloqueia a sensibilidade dolorosa da parede abdominal e a musculatura abdominal. Para este bloqueio foi utilizada a Bupvacaína em dois pontos entre o músculo quadrado lombar e o músculo psoas, em direção ao corpo da vértebra. Após o bloqueio, foi feita a antissepsia cirúrgica com Clorexidina Alcoólica 0,2% e colocação dos campos cirúrgicos com auxílio de pinças Backaus. Realizada incisão em acesso pré-retro-umbilical com bisturi lâmina n°24. Divulsão do tecido subcutâneo com a tesoura de Mayo curva, sustentação da musculatura abdominal com pinça Allis, evidenciando a linha alba. Incisão em estocada em linha alba com bisturi, lâmina n° 11, e prolongamento da parede abdominal com a tesoura Mayo. Foi então feito o isolamento de fígado e baço com compressas estéreis, e identificada a veia cava caudal. Rebateu-se o duodeno e o pâncreas à esquerda, seguiu-se pela localização da artéria gástrica esquerda na curvatura gástrica menor. Foi realizada a lavagem de vísceras com solução fisiológica de NaCl 0,9% aquecida mantendo a região hidratada. Foi então identificado vaso anômalo (Figura 6) tendo origem na veia gástrica esquerda, seguindo sobre o esôfago e indo em direção a cavidade torácica, O vaso anômalo foi divulsionado com auxílio de pinça hemostática Kelly curva e depois disso, foi posicionada a banda de celofane e esta foi fixada com auxílio de dois grampos e pinça clampeadora (Figura 7). No mesmo procedimento cirúrgico, foi retirado um fragmento de fígado do lobo quadrado para biópsia hepática. Posterior a isso, realizou-se o reposicionamento dos órgãos em cavidade abdominal e seguiu-se com a sutura em musculatura abdominal em padrão interrompido de Sultan com fio absorvível Poligalatina 910 n° 3-0, sutura de tecido subcutâneo em padrão contínuo de Cushing com o mesmo fio e dermorrafia em padrão interrompido de Sultan com fio inabsorvível de nylon n° 2-0. Realizada a limpeza da ferida cirúrgica com gaze e Clorexidina degermante 2% e curativo oclusivo com gaze, roupa pós cirúrgica com uma atadura. Paciente encaminhado ao internamento para monitoramento. O fragmento hepático foi acondicionado em formol a 10% e enviado para exame histopatológico.
O procedimento foi realizado sem graves intercorrências. No transoperatório, o paciente apresentou bradicardia, hipotensão com pressão arterial sistólica de 40 mmHg e hipoglicemia com glicose em 50 mg/dl, sendo a bradicardia e a hipotensão corrigidas com a utilização de atropina na dose de 0,044 mg/kg e a hipoglicemia corrigida com a utilização de hidrocortisona na dose de 10 mg/kg. A glicose ainda apresentou uma nova baixa para 38 mg/dl e foi realizada glicose na taxa de 1 gota/kg.
Após a cirurgia, o paciente ficou em observação no internamento por quatro dias, recebendo atenção médica veterinária e sob tratamento com levetiracetam (20 mg/kg, VO, TID), dexametasona (0,1 mg/kg, IV, SID), dipirona (25 mg/kg, IV, TID), morfina (0,4 mg/kg, IV, TID), cefalotina (30 mg/kg, IV, TID), glutamina (0,1 ml/kg, VO, QID), lactulose (05 ml/kg, VO, TID), amoxicilina com clavulanato de potássio (20 mg/kg, SC, a cada 48h) nos dois primeiros dias, sendo acrescentado Cerenia® (0,1 mg/kg, SC, SID) e escopolamina (0,2 mg/kg, IV, SID) durante todo o período em que ficou internado.
No segundo dia após a cirurgia, o paciente apresentou queda abrupta de hematócritos (18%), que continuou em queda no terceiro dia (15%), leucocitose e neutrofilia, hipoalbuminemia e uremia. Pelos valores de hematócrito, foi indicada transfusão que ocorreu no mesmo dia. Os exames foram repetidos um dia após a transfusão e indicaram uma recuperação de células sanguíneas (hematócritos 33%) que se mantiveram dentro dos valores de referência nos dias seguintes à transfusão, o que permitiu que o paciente realizasse a continuidade do tratamento em ambiente residencial.
Para o tratamento residencial, o tutor foi instruído a manter o tratamento conforme prescrito, sendo indicado amoxicilina com clavulanato de potássio (20 mg/kg, VO, SID), Buscopan ® (25 mg/kg, VO, TID, por cinco dias), omeprazol (1 mg/kg, VO, SID, por sete dias), codeína (01 mg/kg, VO, QID, por sete dias) e lactulose por sete dias, mantendo a dieta com ração terapêutica hepática a qual já fazia uso. Manteve-se também a prescrição do levetiracetam (20 mg/kg/TID) por 15 dias, depois indicado administrar 20 mg/kg/BID.
Foi solicitado ao tutor que também fizesse uso de uma pasta oral com formulação contendo silimarina, sulfato de zinco e L-metionina (BID por 5 dias), cujo objetivo é proteção hepática.
Sete dias após a cirurgia o paciente retornou a clínica onde foram repetidos exames de imagem. No exame ultrassonográfico identificou processo inflamatório /infeccioso e/ou hepatopatia aguda, sinais de esplenomegalia, presença moderada de sedimento e de pelo menos um urólito em vesícula urinária além de sinais de peritonite em toda cavidade abdominal. Tais achados são compatíveis com o esperado do pós-operatório. Os exames laboratoriais foram repetidos em quinze dias após a cirurgia, indicando recuperação espontânea e estabilidade dos valores de hematócritos (38 %).
Em relação ao protocolo medicamentoso, iniciou-se o desmame do levetiracetam, com redução de 20% por semana.
Vinte e dois dias após a cirurgia, foi realizada a cistocentese para realização de de urinálise, a qual apontou a presença de cristais de biurato de amônio.
O exame histopatológico teve como resultado fígado apresentando Vacuolização hepatocelular compatível com degeneração glicogênica, centrolobular a mediozonal, hepatite linfoplasmicotária periportal leve, colestase multifocal e leve, hemossiderose multifocal e moderada.
De acordo com os comentários do patologista, foi observado um processo degenerativo de hepatócitos de acúmulo de bile, associado a inflamação discreta. Tal alteração, mesmo que inespecífica, se correlaciona a inúmeros distúrbios metabólicos. A presença de hemossiderina vem associada a processos congestivos, principalmente de origem cardíaca (Insuficiência Cardíaca Congestiva). A presença de material compatível com bilirrubina acumulada nos hepatócitos, indica um processo de colestase que pode estar associada a diversas origens, incluindo obstrução de vias biliares ou processos tóxicos. A colestase histológica pode não estar relacionada a colestase clínica e/ou icterícia, podendo ter correlação com o quadro do desvio portossistêmico do paciente, apesar de não serem observadas alterações histológicas específicas desta condição no fragmento analisado.
Até o final da coleta de dados, durante a vigência do estágio supervisionado, o paciente manteve-se sem intercorrências e demonstrando melhora em sua qualidade de vida.
4. DISCUSSÃO
Os desvios extra-hepáticos são relatados com maior frequência em raças miniaturas e puras, também observaram que a predominância se dá raças menores, tendo a raça Yorkshire Terrier uma predisposição de quase 40% a mais de apresentar o problema em relação às demais raças, com o aparecimento dos primeiros sinais clínicos antes do segundo ano de vida. Isso condiz com a raça, os achados e com a idade do paciente do presente relato (RADLINSKY, 2013; FOSSUM (2014; GREENHALGH et al.,2014; TOBIAS, 2018; MATIASOVIC et al., 2020).
Em seus estudos, GREENHALGH (2014) percebeu que os sintomas mais comuns se referem ao trato gastrointestinal, sistema nervoso central e urinário. O paciente apresentava anorexia e através dos exames de angiotomografia e da urinálise observou-se a presença de cálculo em vesícula urinária.
Em cães jovens o sinal neurológico mais presentes é o da encefalopatia hepática com sintomas que podem incluir desde prostração até crises convulsivas de difícil controle (KRAUN, 2014; VALLARINO, 2020).
O paciente acompanhado não demonstrou nenhuma alteração neurológica, nem antes e nem após a correção do desvio portossistêmico, tendo apenas sinais de déficit em crescimento, presença de cálculo em vesícula urinária, microhepatia e anorexia, o que condiz com o estudado por MENEZES et al., (2022) que atesta que tais sinais são compatíveis com o déficit de metabolização hepática do nitrogênio durante a síntese de proteínas.
STRICKLAND (2018) relata que cristais de biurato de amônio podem ser encontrados quando identificados cálculos vesicais através de exames de imagem e realizados exames de urinálise. Este fato pôde ser comprovado pela urinálise realizada no paciente, que identificou presença de cristais analisados e identificados como sendo de biurato de amônio.
Não foi realizada medicação pré-anestésica visando proteger o paciente de uma prorrogação da sedação, uma vez que devido à condição do desvio portossistêmico, a taxa de metabolização farmacológica poderia se alterar.
A técnica para a oclusão do vaso anômalo utilizando a banda celofane, tem o mesmo princípio da técnica do anel constritor ameróide e sua oclusão também ocorre pela fibrose tecidual. No paciente foi utilizada da técnica da banda de celofane, sendo observada através de exame de ultrassonografia uma peritonite, proveniente da reação do organismo à banda de celofane (FALLS et al., 2013; FOSSUM, 2014; JOHNSTON & TOBIAS, 2018).
Para os maiores riscos dentro do pós-operatório são de abdômen agudo nas primeiras 12h devido a hipertensão portal, e de convulsões de difícil controle, em até 5 dias após a cirurgia, oclusão incompleta do vaso com possível persistência dos sinais clínicos, desenvolvimento de múltiplos shunts adquiridos por hipertensão portal pós atenuação do desvio, coagulopatias e hipoglicemia. (TOBIAS, 2018; STRICKLAND et al., 2018)
O paciente apresentou hipoglicemia para a qual foi administrada dexametasona nos dois dias seguidos à cirurgia. Até o final do estágio curricular, o paciente ainda não havia realizado nova angiotomografia que comprovasse a total obstrução do vaso anômalo.
Conforme descrito por TOBIAS, 2018, brometo de potássio e levetiracetam podem ser utilizados em cães que apresentem convulsões antes da intervenção cirúrgica devido aos baixos efeitos hepáticos, sendo do médico veterinário a escolha do medicamento. O paciente foi submetido à tratamento profilático preventivo pré-operatório com levetiracetam e teve seu uso estendido no pós-operatório. A medicação foi retirada de modo lento e progressivo a cada 15 dias até seu desmame total e o paciente não apresentou nenhuma intercorrência de ordem neurológica.
Para TOBIAS, 2018 a curto prazo, também podem ser citadas como causas de morte hemorragia intraoperatória, coagulopatia pós-operatória, a hipertensão portal, ulcerações gastrointestinais, peritonite, podendo inclusive haver uma hipoplasia portal incompatível com a manutenção da vida do animal. O paciente não teve nenhuma intercorrência grave no transoperatório. No pós-operatório precisou de uma transfusão devido à uma anemia e apresentou peritonite. Ficou sob observação e tanto a anemia quanto a peritonite se corrigiram sem maiores problemas, confirmando o que o autor descreve.
O manejo nutricional inclui redução na ingestão de proteína e inclusão de rações específicas para doenças hepáticas na dieta. Através desse manejo, evita-se que ocorra conversão da proteína em amônia (DOS SANTOS et al., 2019; quanto SERRANO, 2019).
O paciente fez ajuste no manejo nutricional desde antes da cirurgia que se manteve no pós-operatório. Este manejo deve ser avaliado durante os acompanhamentos futuros e recebendo ajustes de acordo com as avaliações dos exames hematológicos e bioquímicos do paciente.
5. CONCLUSÃO
A cirurgia para corrigir o desvio portossistêmico do paciente apresentado foi considerada eficaz em todo seu processo, garantindo que todas as etapas envolvendo tratamento pré, trans e pós cirúrgico garantissem ao paciente melhora na qualidade de vida e no seu desenvolvimento.
O sucesso da cirurgia é mérito do bom trabalho multidisciplinar que envolveu uma equipe comprometida, contendo clínicos, cirurgiões, imaginologistas, anestesistas e estagiários que tinham conhecimento sobre o quadro.
Em qualquer cirurgia se faz necessário grande conhecimento, planejamento e habilidade do cirurgião. Em se tratando de desvios portossistêmicos os cuidados devem ser redobrados, uma vez que a região onde os vasos anômalos se inserem é cercada de estruturas nobres e vasos calibrosos.
O estágio supervisionado foi uma ferramenta de enorme aproveitamento, aprendizado e superação de diversas situações, o que contribui muito para o crescimento profissional. O aprendizado na tratativa com tutores, bem como o acompanhamento das cirurgias apenas reforçaram o quão gratificante é a profissão.
A convivência no meio hospitalar com equipe de profissionais multidisciplinar é de grande importância, uma vez que oferece a oportunidade de aprendizado em áreas correlatas e indispensáveis para o bom resultado no tratamento de cada paciente.
6. REFERÊNCIAS
BERENT, A. C.; TOBIAS, K. M. Veterinary Clinics Small Animal, v.39, p. 513-541, 2009.
CASE, L. P. Canine and feline nutrition: a resource for companion animal professionals /. — 3rd ed. United States of America. Mosby Elsevier. 2011
CULLEN, J. M.; VAN DEN INGH, T. S. G. A. M.; BUNCH, S. E.; ROTHUIZEN, J.; WASHABAU, R. J.; DESMET, V. J. Morphological classification of circulatory disorders of the canine and feline liver. In: WSAVA standards for clinical and histological diagnosis of canine and feline liver disease. Canadá: Elsevier, p. 141-156, 2006.
FELICIANO, M. A. R., Ultrassonografia em cães e gatos, MedVet, p. 264-323, 2019.
FOSSUM. T. W. Cirurgia de Pequenos animais. Rio de Janeiro: Elsevier Health Sciences, 2014.
GREENHALGH, S. N., et al. Long-term survival and quality of life in dogs with clinical signs associated with congenital portosystemic shunts after surgical or medical treatment. Journal of Veterinary Internal Medicine, 33(1), 149-158, 2014.
HAND, M. S.; THATCHER, C. D.; REMILLARD, R. L.; ROUDEBUSH, P.; NOVOTNY, B. J. Small Animal Clinical Nutrition. 5th edition. Marceline: Walsworth. 2010.
HAYASHI, Ayne Murata et al. Abordagem clínico-cirúrgica de desvio portossistêmico congênito em pequenos animais: quais as novidades? Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, São Paulo, v.18, n. 2, 2020.
HUNT GB. Effect of breed on anatomy of portosystemic shunts resulting from congenital diseases in dogs and cats: a review of 242 cases. Aust Vet J. 2004
JERICÓ, M. M.; ANDRADE NETO, J. P. KOGIKA, M. M.; In: Tratado de medicina interna de cães e gatos. Rio de Janeiro: Roca, 2015.
JOHNSTON, S. A.; TOBIAS, K. M. Hepatic Vascular Anomalies. Veterinary Surgery Small Animal. 2. ed. v. 2, p. 1852–1886, 2018.
KIM, S. E.; GIGLIO, R. F.; REESE, D. J.; REESE, S. L.; BACON, N. J.; ELLISON, G.
W. Comparison of computed tomographic angiography and ultrasonography for the detection and characterization of portosystemic shunts in dogs. Veterinary Surgery, v.37, n. 7, p. 655-663, 2013.
KONIG, H. E.; SÓTONYI, P., LIEBICH, H. G. Sistema digestório. In: Anatomia dos animais domésticos. Artmed, p. 321 – 388, 2011.
KRAUN MB, NELSON LL, HAUPTMAN JG, NELSON NC. Analysis of the relationship of extrahepatic portosystemic shunt morphology with clinical variables in dogs: 53 cases (2009-2012). J Am Vet Med Assoc. 2014 Sep 1;245(5):540-9.
MENEZES, T. Q. DE et al. Uso de anel constritor ameróide para oclusão gradual em shunts portossistêmicos extra-hepáticos congênitos caninos: Revisão. Pubvet, v. 16, n. 3, p. 1–10, mar. 2022.
MULLINS, R. A.; et al. Postattenuation neurologic signs after surgical attenuation of congenital portosystemic shunts in dogs: A review. Veterinary Surgery, v. 51, n. 1, p. 23-33, 2022. doi: 10.1111/vsu.13729.
Nelson NC, Nelson LL. Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Vet Radiol Ultrasound. 2011 SepOct;52(5):498-506. doi: 10.1111/j.1740-8261.2011.01827.
PIEGOLS & MISON, Surgical Management of Canine Liver Masses, todaysveterinarypractice.com, 2021
RADLINSKY, M. G. Surgery of the liver. In: FOSSUM, T. W. Small animal surgery. 4. ed. St Louis: Elsevier, p. 584-617, 2013.
SANTOS, R.O. et al. Shunt portossistêmico em pequenos animais. PUBVET, Londrina, V. 8, N. 18, Ed. 267, Art. 1781, setembro, 2014.
STRICKLAND, R. et al. Incidence and risk factors for neurological signs after attenuation of single congenital portosystemic shunts in 253 dogs. Veterinary Surgery, v. 47, n. 6, p. 745–755, ago. 2018.
TOBIAS, K. M. Help! My dog was diagnosed with a liver problem! Brochure. (2013).
TOBIAS, K. M.; JOHNSTON, S. A. Veterinary surgery: small animal. St.Louis, Mo.: Elsevier, 2012.
VALLARINO N. et al. Diagnostic value of blood variables following attenuation of congenital extrahepatic portosystemic shunt in dogs. Vet Rec. 2020 Oct 3;187(7):e48. doi: 10.1136/vr.105296. Epub 2019 Oct 29. PMID: 31662576.
WEISSE, C.; BERENT, A. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinger, S., Feldman, E., Cote, E., Eds.; Saunders: St Louis, MO, USA, 2017; pp. 1639–1658
WINKLER J.T., BOHLING M.W., TILLSON D.M., WRIGHT J.C., BALLAGAS A.J. Portosystemic shunts: diagnosis, prognosis, and treatment of 64 cases (1993-2001). J Am Anim Hosp Assoc. 2003 Mar-Apr;39(2):169-85.
¹ Discente do Curso Superior de Medicina Veterinária da Universidade Tuiuti do Paraná, mv.aleghezzi@borealvet.com.br
² Docente do Curso Superior de Medicina Veterinária da Universidade Tuiuti do Paraná, Mestre em Ciências Veterinárias pela Universidade Federal do Paraná, carolina.lacowicz@utp.br
³ Docente do Curso Superior de Medicina Veterinária da Universidade Tuiuti do Paraná, Doutor em Ciências Veterinárias, matheus.cruz@utp.br
