REGISTRO DOI: 10.5281/zenodo.10048507
Antônia Gerlissa da Cunha Monteiro1
Izabelle Sena da Silva2
Janara Vanessa Carneiro de Lima3
Osvaldo Neto Ferreira de Souza4
Coorientador: Profª Dra. Maria Tereza Fachin Espinar5
Orientador: Prof. Dr. Weison Lima da Silva6
RESUMO
A garantia da qualidade de um determinado produto ou medicamento e a manutenção deste para que se cumpra um prazo determinado de validade, está relacionado à promoção e à proteção de aspectos de saúde individual e coletiva. Objetivo geral: realizar uma revisão sistemática para identificar os problemas no controle e na análise de qualidade, relacionados aos produtos farmacêuticos recolhidos/descontinuados pela ANVISA nos últimos dez anos. Metodologia: trata-se de um estudo relacionado aos produtos farmacêuticos recolhidos pela ANVISA e sua relação com o controle de qualidade. Resultados e Discussão: Através do desenvolvimento desse estudo foi possível identificar os produtos farmacêuticos recolhidos/descontinuados pela ANVISA no mercado nacional, no período de 2013 a 2023, bem como os fatores relacionados ao recolhimento e descontinuação dos produtos farmacêuticos retirados de comercialização, evidenciando ainda, o papel do farmacêutico nas intervenções de controle e análise de qualidade, que contribuam para evitar problemas de recolhimento e descontinuação de produtos farmacêuticos. Considerações Finais: Através do desenvolvimento desse estudo foi possível evidenciar os aspectos relacionados ao controle de qualidade de medicamentos, bem como os medicamentos recolhidos e descontinuados entre 2013 e 2023 na literatura, os fatores que levaram a esse recolhimento ou descontinuação e o farmacêutico como protagonista nesse viés, sendo o profissional mais adequado para avaliar o cenário situacional proposto.
Palavras-chave: Controle de qualidade, Amostragem para Garantia da Qualidade de Lotes, Insumos farmacêuticos.
ABSTRACT
Guaranteeing the quality of a specific product or medicine and maintaining it within a specified period of validity is related to the promotion and protection of aspects of individual and collective health. General objective: to carry out a systematic review to identify problems in quality control and analysis related to pharmaceutical products recalled/discontinued by ANVISA in the last ten years. Methodology: this is a study related to pharmaceutical products collected by ANVISA and their relationship with quality control. Results and Discussion: Through the development of this study, it was possible to identify the pharmaceutical products recalled/discontinued by ANVISA in the national market, in the period from 2013 to 2023, as well as the factors related to the recall and discontinuation of pharmaceutical products withdrawn from sale, also highlighting, the role of the pharmacist in quality control and analysis interventions, which contribute to avoiding problems with recall and discontinuation of pharmaceutical products. Final Considerations: Through the development of this study, it was possible to highlight the aspects related to the quality control of medicines, as well as the medicines recalled and discontinued between 2013 and 2023 in the literature, the factors that led to this recall or discontinuation and the pharmacist as a protagonist in this bias, being the most appropriate professional to evaluate the proposed situational scenario.
Keywords: Quality control, Sampling for Batch Quality Assurance, Pharmaceutical inputs.
INTRODUÇÃO
A qualidade é compreendida como a combinação de aspectos que cercam um produto ou um serviço de uma determinada área de atuação existente, para suprir as necessidade ou expectativas do cliente ou usuário. Nesse contexto, o controle de qualidade visa manter as características essenciais para o funcionamento e eficiência de um produto (SILVA et al., 2017).
De acordo com Belini e Tosta (2023), a garantia da qualidade de um determinado produto ou medicamento e a manutenção deste para que se cumpra um prazo determinado de validade, está relacionado à promoção e à proteção de aspectos de saúde individual e coletiva. A qualidade do insumo medicamentoso entregue para a população utilizar, deve ser resultado de um criterioso conjunto de medidas industriais, construídas para que haja a garantia de que a qualquer momento, a produção desses lotes satisfaça as normativas de atividade, pureza, eficácia e segurança, sendo cuidadosamente verificada nos laboratórios estaduais e federais.
A realização dos testes que remetem ao controle de qualidade de produtos de vertente farmacêutica são habitualmente testes de repetição de amostragem de princípios ativos ou um número determinado de produtos farmacêuticos. Enquanto, nos laboratórios nacionais devem ser realizados e processados uma ampla amostragem de substâncias de produtos farmacêuticos e, portanto, devem seguir uma ampla variedade de métodos de ensaio (FACCI et al., 2020).
É evidenciado por Almeida, Silva e Souza (2012), que os Laboratórios Centrais de Saúde Pública (LACEN) e o Instituto de Controle de Qualidade em Saúde (INCQS), são os órgãos que mais se relacionam com a fiscalização do controle de qualidade medicamentoso. A importância desses órgãos e da fiscalização não está ligada apenas ao atendimento às necessidades do consumidor, mas também ao que está explicitado no código de defesa do consumidor (Lei 8.078/90) e no artigo 196º da Constituição Federal, que diz: “A saúde é direito de todos e dever do Estado, garantido mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal e igualitário às ações e serviços para sua promoção, proteção e recuperação”. Isto porque o consumidor não possui ferramentas para a avaliação da qualidade do medicamento a ser adquirido.
Pode-se citar ainda que o controle de qualidade está relacionado a parte das Boas Práticas de Fabricação (BPF). Ela tem o dever de certificar que os ensaios necessários e essenciais tenham sido executados e que os materiais não sejam liberados para utilização, ou os produtos liberados para venda ou fornecimento, até que a qualidade destes seja julgada satisfatória. Sendo assim, nota-se que controle de qualidade não deve estar limitado apenas às operações laboratoriais, mas também estar envolvido em todas as decisões relacionadas à qualidade do produto (GEYER; SOUSA; SILVEIRA, 2018).
Nesse seguimento, a importância do controle de qualidade de medicamentos passa pelo conhecimento de antecedentes históricos, de eventos ligados ao controle oficial de qualidade do sistema único de saúde (SUS), da fundamentação de legalidade do controle de qualidade de medicamentos, dos compêndios e farmacopeias usados para a sedimentação das especificidades dos produtos farmacêuticos, das referências em substâncias químicas, do sistema nacional de laboratórios de saúde pública, da rede brasileira de laboratórios de análises em saúde e do Programa Nacional de Inspeção em Indústrias Farmacêuticas e Farmoquímicas (FACCI et al., 2020). Com base nos argumentos apresentados o estudo é justificado para evidenciar necessidade do controle de qualidade e garantia da segurança do produto final para o consumidor.
Mediante a linha teórica da temática imposta, o controle de qualidade exerce um papel fundamental para garantir a viabilidade de um produto e a sua exposição e venda para o cliente, tendo em vista que este garante o cumprimento das legislações e critérios para a liberação após fiscalização, implicando em descontinuidade e retirada do mercado em caso de falha, justificando a necessidade do aprofundamento dessa temática como desenvolvimento desse estudo.
O objetivo geral desse estudo é realizar uma revisão sistemática para identificar os problemas no controle e na análise de qualidade, relacionados aos produtos farmacêuticos recolhidos/descontinuados pela ANVISA nos últimos dez anos. Tendo como objetivos específicos: Identificar os produtos farmacêuticos recolhidos/descontinuados pela ANVISA no mercado nacional, no período de 2013 a 2023; Explicar os fatores relacionados ao recolhimento/descontinuação dos produtos farmacêuticos retirados de comercialização pela ANVISA.; Evidenciar o papel do farmacêutico nas intervenções de controle e análise de qualidade, que contribuam para evitar problemas de recolhimento/ descontinuação de produtos farmacêuticos.
METODOLOGIA
Trata-se de um estudo relacionado aos produtos farmacêuticos recolhidos pela ANVISA e sua relação com o controle de qualidade. O estudo iniciará como uma revisão sistemática elaborada segundo o modelo PRISMA (preferred reporting items for systematic reviews and meta analyses). Serão analisados artigos com estudos publicados entre as seguintes datas 1° Junho de 2013 a 31 de junho de 2023, abrangendo um período de 10 anos.
Para realização desta revisão sistemática serão utilizadas as bases de dados PUBMED e Biblioteca Virtual em Saúde (BVS). O cruzamento foi realizado no idioma português brasileiro e inglês. Para buscas em português foram usadas as seguintes palavras-chaves: “Controle de qualidade”; “Amostragem para Garantia da Qualidade de Lotes”; “Insumos farmacêuticos”. Ambas separadas pelo operador boleano “and”.
A escolha de artigos foi realizada por quatro revisores independentes, analisando resultados procedentes da estratégia de pesquisa. Os artigos foram selecionados, inicialmente com base em seus títulos, resumos e conteúdo que atendiam ao período proposto para esta revisão. Todos os artigos escolhidos estão disponíveis online e em texto completo.
Foram inclusos estudos publicados dentro do período de tempo proposto, realizado com produtos farmacêuticos e vinculados a ANVISA; Estudo realizados no Brasil, tendo em vista que a ANVISA é um orgão Nacional Brasileiro; e estudos publicados no idioma português brasileiro e inglês.
Foram exclusos estudos observacionais com ano anterior ao proposto, realizados com outros produtos que não farmacêuticos; estudos em outro idioma diferente de português brasileiro e inglês; artigos de opinião, dissertações, teses, monografias e trabalhos de conclusão de curso.
A análise de dados foi realizada através dos estudos selecionados, relacionando o recolhimento e descontinuação de produtos farmacêuticos ao controle de qualidade, bem como o papel do farmacêutico acerca e as intervenções de controle e análise de qualidade como contribuintes para a resolução dessa problemática.
RESULTADOS E DISCUSSÃO
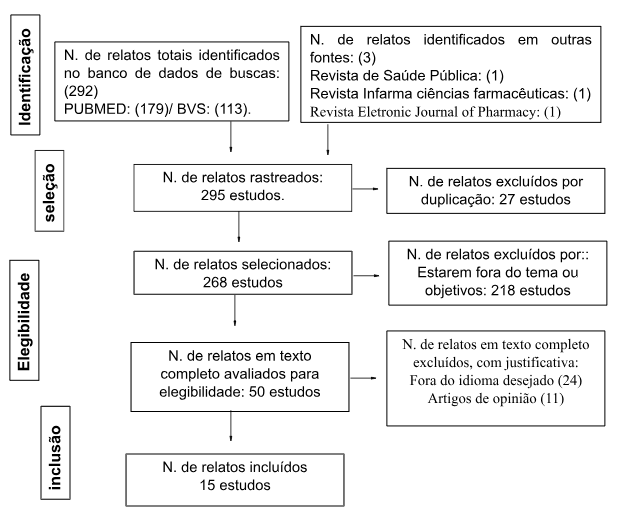
A estratégia de pesquisa seguiu o fluxograma de seleção de estudos do PRISMA (Figura 1). Após a realização da pesquisa foram encontrados nas bases de dados 356 estudos, sendo 189 do banco de dados PUBMED e 167 da BVS, levando em consideração as palavras-chaves mencionadas, sendo incluídos ainda 3 estudos relacionados ao tema da Revista de Saúde Pública, Revista Infarma ciências farmacêuticas e Revista Eletronic Journal of Pharmacy. Após a aplicação do corte temporal foram excluídos 67 estudos, restando 295 estudos para analises de títulos e resumos, sendo 27 excluídos por duplicação, restando 268 estudos. Contudo após análise 218 foram excluídos por estarem fora do tema e dos objetivos do trabalho. Restando 50 artigos para aplicação dos critérios de elegibilidade, dos quais 24 foram excluídos por estarem em outros idiomas e também 11 por se tratarem de estudos de opinião, resultando em 15 artigos pra análise e confecção de uma tabela com o resumo das principais características relacionadas ao tipo de estudo, métodos, objetivos e conclusões. Todas essas informações se encontram na Tabela 1.
Figura 1. Fluxograma da revisão sistemática no modelo PRISMA.
Fonte: Autores.
Tabela 1. Resumo dos principais artigos avaliados para esta revisão sistemática.
AUTORES/ ANO TÍTULO TIPO DE ESTUDO OBJETIVO RESULTADOS Sousa MG, Vieira VA, Vieira-Almeida EC. (2023). Recall de substancias medicamentosas e produtos farmacêuticos e impurezas de nitrosamin. Qualitativo de natureza exploratória. Realizar uma análise detalhada desse contaminante em insumos farmacêuticos ativos e medicamentos afetados. O estudo evidencia que em 2020 foram recolhidos 25% dos medicamentos por conter nitrosamin, sendo os medicamentos losartana e metformina os que apresentaram o maior número de lotes retirados do mercado. Corrêa PCRP, Chatkin JM, (2023). APO-vareniclina e citisina poderiam ser soluções para a escassez de vareniclina no Brasil? Editorial.
———————-Em 16 de julho de 2021, a Pfizer USA emitiu um recall voluntário de doze lotes de vareniclina distribuídos nos Estados Unidos e Porto Rico entre junho de 2019 e junho de 2021 devido à presença de nitrosamina. Aglio TC, Diniz V, Matos MFAV, et al. (2022). N-Nitrosaminas em medicamentos: um problema atual, uma realidade antiga. Estudo descritivo de base documental. Trazer informações relevantes sobre a origem e presença de N-nitrosaminas em medicamentos, assim como os limites aceitáveis, aspectos de legislação e métodos analíticos. Em 2018 foram recolhidos lotes de ranitidina com N-Nitrosaminas em sua composição. Em dezembro de 2019 foram recolhidos lotes de metformina. Pinto NN, Resende KA, Couto RO. (2020). Insumos farmacêuticos ativos irregulares no Brasil: análise descritiva de 2011 a 2019. Estudo analítico descritivo. Realizar análise descritiva dos IFA recolhidos no Brasil entre 20 11 e 2019, por meio do website da Anvisa na subseção de “produtos irregulares”. Dos 95 insumos irregulares avaliados, os antimicrobianos e os anti-hipertensivos (antagonistas de angiontensina II) apresentaram as maiores frequências de recolhimentos. Couto RO, Pereira LM, Mendes EM, Costa TES. (2020). ANVISA em ação: Recolhimento de domissaneantes irregulares durante a pandemia da Covid-19 no Brasil. Estudo descritivo. Apresentar uma análise descritiva dos produtos domissaneantes fiscalizados e recolhidos pela ANVISA no período entre 2017 a 2020. No ano de 2020 entre 222 ações de fiscalização da ANVISA em 23% foram recolhidos produtos saneantes utilizados para a limpeza de superficies e prevenção do Covid 19. Martins MAF, Scherer MDA, Lucchese G. (2022). Vigilância e controle de medicamentos abaixo do padrão, falsificados e não registrados: revisão integrativa. Revisão de literatura. Identificar as estratégias de atuação dos sistemas regulatórios na vigilância e controle de medicamentos abaixo do padrão, falsificados e não registrados em nível regional-global, especialmente quanto aos processos de recall. Os motivos de recall evidenciados no estudo foram a rotulagem/ embalagem incorreta, problemas na estabilidade, ineficácia terapêutica, contaminação e desvios na dosagem. Bazani VB, Silva ACF, Silva KP. (2021). Contaminação de produtos farmacêuticos pelo complexo BURKHOLDERIA- CEPACIA e seus possíveis impactos na saúde e na indústria. Revisão bibliográfica. Realizar uma revisão bibliográfica sobre casos de contaminação de produtos farmacêuticos pelo BcC ao redor do mundo e destacar quais são os possiveis impactos sanitários econômicos. No Brasil, em 2014, sete lotes de um enxaguante bucal foram recolhidos devido a contaminação por bactérias desse gênero em Minas Gerais. Kampf, G.; Todt, D.; Pfaender, S.; Steinmann, E (2020). Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. Estudo exploratório, descritivo. Resumir todos os dados disponíveis sobre a persistência de todos os coronavírus, incluindo os emergentes SARS-CoV e MERS-CoV, bem como os coronavírus veterinários, como o vírus da gastroenterite transmissível (TGEV), o vírus da hepatite do rato (MHV) e o coronavírus canino. Os produtos relacionados a desinfecção de superficies e prevenção da Covid 19 são recolhidos devido a ausência de autorização de aplicação de boas práticas no desenvolvimento do produto, bem como a quantidade adequada dos componentes. Shaikh T., Gosar A, Sayyed H. (2020). Nitrosamine Impurities in Drug Substances and Drug Products. Estudo analítico e quantitativo. Identificar e quantificar esses impurezas, portanto, precisa de um instrumento altamente sensível que pode detectar essas impurezas ao nível do traço em determinado limite provisório. Os fatores relacionadas ao recolhimento e descontinuidade de fármacos está relacionados a impurezas de nitrosaminas. Geyer ARC, Sousa VD, Silveira D. (2018). Quality of medicines: deficiencies found by brazilian health regulatory agency (Anvisa) on good manufacturing practices international inspections. Estudo descritivo, prospectivo. Avaliar os resultados dos testes estrangeiros da ANVISA inspeções nos dois anos anteriores (2015 e 2016), As principais motivações de recolhimento de IFA são a deficiência nas Boas Práticas de Fabricação (BPF), ausência de registro e contaminação por nitrosaminas. Mohiuddin AK (2020). The Excellence of Pharmacy Practice. Estudo exploratório, descritivo. Conhecer as funções do farmacêutico e suas contribuições para a comunidade. O estudo destaca que cabe ao farmacêutico verificar a preparação e rotulagem de produtos farmacêuticos, além de verificar entradas de pedidos, cobranças e inspeções. Pereira GC, Barbosa NA, Souza VO, (2020). Avaliação da qualidade dos comprimidos de ibuprofeno vendidos irregularmente no centro de Manaus em comparação aos medicamentos comercializados em drogarias. Estudo experimental. Analisar a qualidade dos medicamentos vendidos de forma irregular e fazer a comparação com os comercializados em drogarias, para dessa forma identificar os possíveis danos físicos que um armazenamento inadequado pode causar aos mesmos. Nas perspectivas apresentadas por esse estudo, o farmacêutico foi uma peça chave na integração e aplicação dos experimentos que verificam a eficácia dos medicamentos em pautas nesse estudo. Suwannaprom P, et al. (2020). Development of pharmacy competency framework for the changing demands of Thailand’s pharmaceutical and health services. Estudo qualitativo. Explorar as necessidades de serviços farmacêuticos na cadeia de abastecimento farmacêutico e as competências dos farmacêuticos para atender a essas necessidades. O farmacêutico exerce funções unificadas que visam a qualidade do produto e a conservação de sua eficácia, sendo o profissional qualificado para a avaliação situacional dessa questão. Ribeiro CC, Andrade GMM, Couto RO. (2018). Estudos de equivalência farmacêutica e perfil de dissolução comparativo de comprimidos contendo hidroclorotiazida. Estudo exploratório, de equivalencia. Realizar estudos de equivalência farmacêutica e perfil de dissolução comparativo de diversas marcas de medicamentos contendo HCTZ. Através da avaliação e aplicação de testes, bem como a contribuição avaliativa do farmacêutico, pode-se refletir a qualidade e confiabilidade dos medicamentos genéricos amplamente utilizados pela população brasileira. Costa EA, Araujo PS, Pereira MT, et al. (2017). Situação sanitária dos medicamentos na atenção básica no sistema unico de saúde. Estudo transversal, exploratório de natureza avaliativa. Caracterizar a situação sanitária de medicamentos na atenção básica, nas regiões brasileiras, quanto a requisitos tecnicos sanitários, responsável pela farmácia/ unidade de dispensação, controles ambientais, de armazenamentos e de fracionamento, controle de estoque e gerenciamento de resíduos, itens de segurança contra incendio e pani elétrica. O farmacêutico é tido como protagonista da farmacovigilancia quando relacionado ao controle de qualidade dos medicamentos, eficiência na dispensação.
Fonte: Autoria própria (2023).
Os produtos farmacêuticos recolhidos/descontinuados pela ANVISA no mercado nacional, no período de 2013 a 2023
Em um estudo acerca do recall de substâncias medicamentosas e produtos farmacêuticos relacionados a impurezas por nitrosamin, ficou evidenciado no ano de 2020 o recolhimento de 25% dos medicamentos do mercado por conter em sua composição nitrosamin, sendo os lotes de losartana e metformina os mais predominantes (SOUSA; VIEIRA; VIEIRA-ALMEIDA, 2023).
Concordante a isso, foi evidenciado através do estudo realizado por Aglio et al. (2022), acerca da problemática que a substância N-Nitrosaminas representa para a sociedade atual, ficou evidenciado o recolhimento em 2018 de diversos lotes do medicamento ranitidina devido a presença de N-Nitrosaminas em sua composição, destacando ainda que em dezembro de 2019 foram recolhidos inúmeros lotes de metformina pelo mesmo problema.
No Editorial desenvolvido por Corrêa e Chatkin (2023), acerca da APO-vareniclina e citisina, foi destacado que no ano de 2021, a Pfizer USA recolheu de forma voluntária 12 lotes de vareniclina distribuídos nos Estados Unidos e Porto Rico entre junho de 2019 e junho de 2021 devido à presença substancial da nitrosamina.
N-Nitrosoamina é um composto N-nitroso com um grupo funcional nitroso ligado ao átomo de nitrogênio. A presença de N-nitrosaminas em alimentos é conhecida há muito tempo e preocupa cientistas de todo o mundo há décadas devido às suas propriedades mutagênicas, genotóxicas e potencialmente cancerígenas observadas em diversos animais de laboratório, incluindo primatas (TUESUWAN; VONGSUTILERS, 2021).
Em um estudo Analítico e descritivo, realizado por Pinto, Resende e Couto (2020), acerca de insumos farmacêuticos ativos irregulares no Brasil, foi evidenciado o recolhimento pela ANVISA de insumos irregulares dentre os quais destacaram-se os anti-hipertensivos como os mais frequentemente recolhidos.
Em um outro viés, Couto et al. (2020), destaca o recolhimento pela ANVISA de domissaneantes irregulares durante a pandemia da Covid-19 no Brasil, ocorrendo no ano de 2020 entre 222 ações de fiscalização da ANVISA o recolhimento de 23% dos produtos saneantes utilizados para a limpeza de superfícies e prevenção do Covid 19.
Os fatores relacionados ao recolhimento/descontinuação dos produtos farmacêuticos retirados de comercialização pela ANVISA
Em um estudo relacionado a vigilância e controle de medicamentos abaixo do padrão, falsificados e não registrados, ficou evidenciado que os principais motivos para recolhimentos de insumos farmacêuticos associam-se a rotulagem ou embalagem incorreta, problemas na estabilidade, ineficácia terapêutica, contaminação e desvios na dosagem (MARTINS; SCHERER; LUCCHESE, 2022).
Em concordância ao citado Jabeen et al. (2019), evidenciam que a utilização de medicamentos não padronizados que entram no mercado com rotulagem imprecisa, contaminação, dosagens incorretas ou medicamentos contrafeitos e não registrados representam um problema de saúde pública mundial complexo e multifacetado.
Bazani, Silva e Silva (2021), evidenciaram através do seu estudo que no ano de 2014, no Brasil, houve o recolhimento de sete lotes de enxaguante bucal devido a contaminação por bactérias do gênero Burkholderia- Cepacia em Minas Gerais.
O gênero Burkholderia consiste em bactérias Gram-negativas encontradas no solo, na água e nas plantas. Pode colonizar temporariamente o trato respiratório e tornar-se um patógeno oportunista. O BcC é um contaminante importante na indústria farmacêutica porque forma biofilmes e pode aderir facilmente a equipamentos, tubulações e está presente em matérias-primas quando há umidade suficiente (ABDALLAH, et al., 2018).
No que se refere ao recolhimento de insumos farmacêuticos relacionados a desinfecção de superfícies, ficou evidenciado que durante a pandemia pelo Covid 19, estes tiverem seu recolhimento principalmente devido à ausência de autorização de aplicação de boas práticas no desenvolvimento do produto, bem como a quantidade adequada dos componentes adequada dos componentes (KAMPF et al., 2020).
Em um estudo descritivo e prospectivo realizado por Geyer, Sousa e Silveira (2018), acerca das inspeções realizadas pela ANVISA, foi destacado que as principais motivações que se associam ao recolhimento de insumos farmacêuticos são a deficiência nas Boas Práticas de Fabricação, a ausência de registro e contaminação pela substancia N-nitrosaminas, o que também é evidenciado pelo estudo de Shaikh, Gosar, Sayyed (2020), como um dos principais motivos de recolhimento.
O papel do farmacêutico nas intervenções de controle e análise de qualidade, que contribuam para evitar problemas de recolhimento/ descontinuação de produtos farmacêuticos
Em um estudo acerca das funções do farmacêutico e suas contribuições para a comunidade é destacado em seu decorrer que cabe ao farmacêutico a verificação e preparação da rotulagem de insumos farmacêuticos, cabendo ainda avaliar as entradas de pedidos, cobranças e inspeções (MOHIUDDIN, 2020).
De acordo com Pereira, Barbosa e Souza (2020), acerca da avaliação da qualidade dos comprimidos de ibuprofeno vendidos irregularmente no centro de Manaus em comparação aos medicamentos comercializados em drogarias, destacou o farmacêutico como um protagonista na integração e aplicabilidade dos experimentos que realizam a análise da eficácia dos medicamentos em pautas.
Concernente a isto, é evidenciado por Suwannaprom et al. (2020), que o farmacêutico exerce funções que influenciam diretamente na cadeia de abastecimento e no controle de qualidade dos insumos farmacêuticos, tendo em vista que suas ações corroboram na conservação e eficácia desses insumos, sendo ainda os profissionais mais indicado para avaliar o cenário-situacional.
No estudo desenvolvido por Ribeiro, Andrade e Couto (2018), acerca da equivalência medicamentosa, o farmacêutico exerceu um papel essencial na avaliação e aplicação de testes considerados importantes para essa avaliação, sendo possibilitado assim, se obter um parâmetro acerca da qualidade e confiabilidade dos medicamentos genéricos amplamente utilizados pela população brasileira.
Dentre as funções do farmacêutico no que se refere ao controle de qualidade das medicações, eficiência, dispensação e situação sanitária dos medicamentos na atenção básica do sistema de saúde, o farmacêutico exerceu seu papel através do protagonismo na farmacovigilância (COSTA et al. 2017).
CONSIDERAÇÕES FINAIS
Através do desenvolvimento desse estudo foi possível evidenciar os aspectos relacionados ao controle de qualidade de medicamentos, bem como os medicamentos recolhidos e descontinuados entre 2013 e 2023 na literatura, os fatores que levaram a esse recolhimento ou descontinuação e o farmacêutico como protagonista nesse viés, sendo o profissional mais adequado para avaliar o cenário situacional proposto.
REFERÊNCIAS
ABDALLAH, M.; ABDALLAH, H. A.; MEMISH, Z. A. Burkholderia cepacia complex outbreaks among non-cystic fibrosis patients in the intensive care units: A review of adult and pediatric literature. Burkholderia cepacia complex outbreaks among non-cystic fibrosis patients in the intensive care units: A revi. Le Infezioni in Medicina, Riyadh, v. 26, n. 4, p. 299-307, 2018. ISSN 4
AGLIO, T.C.; et al. N-Nitrosaminas em medicamentos: um problema atual, uma realidade antiga. Quim. Nova, Vol. XY, No. 00, 1-18, 2022.
ALMEIDA, N.A. S.; SILVA, C.E. L.; SOUZA, O.T. Dispersão espacial e mudança estrutural da indústria química no Brasil. Revista Cadernos de Economia, Chapecó, v. 16, n. 30/31, p. 36- 50, 2012.
BAZANI, V.B.; SILVA, A.C.F.; SILVA, K.P. Contaminação de produtos farmacêuticos pelo complexo BURKHOLDERIA- CEPACIA e seus possíveis impactos na saúde e na indústria. Semin Respir Crit Care Med. 2021; 19 (4): e20250184.
BELINI, F.H.; TOSTA, T.L. D. Na saúde e na doença: o trabalho na produção de medicamentos. Trabalho, Educação e Saúde, Rio de Janeiro, v. 21, 2023, e02096214.
CORRÊA, P.C.R.P.; CHATKIN, J.M.; APO-vareniclina e citisina poderiam ser soluções para a escassez de vareniclina no Brasil? J Bras Pneumol. 2023; 49(3): e20230185.
COSTA, E.A.; ARAUJO, P.S.; PEREIRA, M.T.; et al. Situação sanitária dos medicamentos na atenção básica no sistema único de saúde. Rev. Saúde Pública vol.51 (Sup. 2) São Paulo 2017 Epub 22-set-2017.
COUTO, R.O.; PEREIRA, L.M.; MENDES, E.M.; et al. ANVISA em ação: Recolhimento de domissaneantes irregulares durante a pandemia da Covid-19 no Brasil. Brazilian Journal of Health and Pharmacy, v. 2, n. 3, p. 54-67, 2020.
FACCI, J.; et al. Evolução da legislação e das técnicas analíticas aplicadas a estudos de estabilidade de insumos e produtos farmacêuticos. Revisão, Quím. Nova 43 (7), Jul 2020.
GEYER, A.R.C.; SOUSA, V.D.; SILVEIRA, D. Quality of medicines: deficiencies found by brazilian health regulatory agency (Anvisa) on good manufacturing practices international inspections. PLoS One. 2018;13(8):1-17.
JABEEN, S.; et al. Drug recall procedure in ASEAN countries. Res J Pharm Technol. 2019;12(12):6041-8.
KAMPF, G.; TODT, D.; PFAENDER, S.; et al. Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. Journal of Hospital Infection 104: 246-251, 2020.
MARTINS, M.A.F.; SCHERER, M.D.A.; LUCCHESE, G. Vigilância e controle de medicamentos abaixo do padrão, falsificados e não registrados: revisão integrativa. Rev Panam Salud Publica. 46, 2022.
MOHIUDDIN, A.K. The Excellence of Pharmacy Practice. Innov Pharm. 2020; 11(1): 10.24926/iip.v11i1.1662.
PEREIRA, L.M.; MENDES, E.M.; COSTA, T.E.S.; et al. ANVISA em ação: Recolhimento de domissaneantes irregulares durante a pandemia da Covid-19 no Brasil. Brazilian Journal of Health and Pharmacy, v. 2, n. 3, p. 54-67, 2020.
PINTO, N.N.; RESENDE, K.A.; COUTO, R.O. Insumos farmacêuticos ativos irregulares no Brasil: análise descritiva de 2011 a 2019. Vigil. sanit. debate 2021;9(1):61-70.
RIBEIRO, C.C.; ANDRADE, G.M.M.; COUTO, R.O. Estudos de equivalência farmacêutica e perfil de dissolução comparativo de comprimidos contendo hidroclorotiazida. Infarma, Ciencias farmacêuticas. 10.14450/ 2318-9312. v30.e1. a2018.pp 5-13.
SHAIKH, T.; GOSAR, A.; SAYYED, H. Nitrosamine Impurities in Drug Substances and Drug Products. Journal of Advances in Pharmacy Practices e-ISSN: 2582-4465, 2(1), 48-57, 2020.
SILVA, C.B.; et al. Desafios ao controle da qualidade de medicamentos no Brasil. Cad. saúde colet., (Rio J.) ; 25(3): 362-370, 2017.
SOUSA, M.G.; VIEIRA, V.A.; VIEIRA-ALMEIDA, E.C. Recall de substancias medicamentosas e produtos farmacêuticos e impurezas de nitrosamin. Brazilian Journal of Development, Curitiba, v.9, n.5, p.15576-15590, may., 2023.
SUWANNAPROM, P.; et al. Development of pharmacy competency framework for the changing demands of Thailand’s pharmaceutical and health services. Pharm Pract (Granada). 2020 Oct-Dec;18(4):2141.
TUESUWAN, B.; VONGSUTILERS, V. Nitrosamine Contamination in Pharmaceuticals: Threat, Impact, and Control. Journal of Pharmaceutical Sciences. 110, p. 3118−3128, 2021.
1Acadêmica de Farmácia. Centro universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus -AM, 69050-000 Email: antoniagerlissa19@gmail.com;
2Acadêmica de Farmácia. Centro universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus -AM, 69050-000 Email: senaizabelle@gmail.com;
3Acadêmica de Farmácia. Centro universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus -AM, 69050-000 Email: janaracl.jv@gmail.com;
4Acadêmico de Farmácia. Centro universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus -AM, 69050-000 Email: netovale977@gmail.com;
5Coorientadora,Professora, Doutora do Centro Universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus- AM, 69050-000 Email: maria.espinar@fametro.edu.br;
6Orientadora, Doutor do Centro Universitário FAMETRO Endereço: Av. Constantino Nery, 3204 – Chapada, Manaus- AM, 69050-000 Email: weison.silva@fametro.edu.br
