REGISTRO DOI: 10.5281/zenodo.10156615
Larissa Laila Ramos Lima
Luanna Cristina de Souza Silva
Orientadora: M.Sc Patricia Vellano
RESUMO
A patologia causada pelo coronavírus 2019 (COVID-19) resulta da infecção pelo coronavírus 2, provocando uma síndrome respiratória aguda grave (SARS-CoV-2). A COVID-19 é caracterizada por inflamação vascular, com evidência de elementos virais presentes nas células endoteliais. Pacientes hospitalizados, em particular, apresentam uma suscetibilidade significativa ao desenvolvimento de trombose venosa profunda (TVP). Na ausência de profilaxia adequada, a incidência global de TVP entre pacientes nosocomiais é de 0,9%, chegando a aumentar para 15% a 32% entre pacientes internados em unidades de terapia intensiva (UTI). A literatura que aborda o mecanismo patogenético da TVP em pacientes com COVID-19 ainda é limitada. Estabeleceu-se uma relação entre TVP e síndrome do desconforto respiratório agudo na influenza A H1N1, na qual se presumiu uma maior adesão de leucócitos às paredes das veias, devido à produção de moléculas inflamatórias. Assim, a anticoagulação empírica foi sugerida para todos os pacientes com síndrome do desconforto respiratório agudo grave. Existem várias razões pelas quais um paciente afetado pela COVID-19 pode apresentar predisposição a doenças trombóticas e tromboembólicas concomitantes. Informações preliminares indicam a presença de um estado de hipercoagulabilidade na COVID-19, com várias anormalidades hemostáticas, algumas das quais parcialmente conflitantes, sendo documentadas. Dentre essas anormalidades, destacam-se o aumento de dímero D e outros produtos de degradação da fibrina, elevação do fibrinogênio, tempo prolongado de tromboplastina parcial ativada, positividade para lúpus anticoagulante, entre outras, sugerindo a presença de formas de coagulopatia ainda não completamente compreendidas. Infere-se, portanto, que se torna imprescindível o estudo, cujo objetivo é realizar uma revisão bibliográfica detalhada sobre pacientes diagnosticados com COVID-19 que desenvolveram quadros clínicos de trombose venosa profunda. Trata-se de um trabalho de caráter qualitativo que se baseia em artigos científicos publicados no período de 2019 a 2022.
Palavras-chave: Cascata de coagulação – Covid-19 – Trombose – TVP – Hipercoagulabilidade.
ABSTRACT
The pathology caused by coronavirus 2019 (COVID-19) results from infection by coronavirus 2, leading to severe acute respiratory syndrome (SARS-CoV-2). COVID-19 is characterized by vascular inflammation, with evidence of viral elements present in endothelial cells. Hospitalized and immobilized patients, in particular, exhibit significant susceptibility to deep vein thrombosis (DVT). In the absence of adequate prophylaxis, the overall incidence of DVT among hospitalized patients is 0.9%, rising to 15% to 32% among intensive care unit (ICU) patients. The literature addressing the pathogenetic mechanism of DVT in COVID-19 patients is still limited. A relationship between DVT and acute respiratory distress syndrome in H1N1 influenza has been established, presuming increased adhesion of leukocytes to vein walls due to the production of inflammatory molecules. Thus, empirical anticoagulation has been suggested for all patients with severe acute respiratory distress syndrome. There are several reasons why a patient affected by COVID-19 may be predisposed to concomitant thrombotic and thromboembolic disorders. Preliminary data indicate the presence of a hypercoagulable state in COVID-19, with various hemostatic abnormalities, some of which are partially conflicting, being documented. Notable among these abnormalities are elevated D-dimer and other fibrin degradation products, elevated fibrinogen, prolonged activated partial thromboplastin time, positivity for lupus anticoagulant, among others, suggesting the presence of incompletely understood forms of coagulopathy. This study aims to conduct a detailed literature review on patients diagnosed with COVID-19 who developed clinical deep vein thrombosis (DVT). It is a qualitative study based on scientific articles published from 2019 to 2022.
Keywords: Coagulation Cascade – Covid-19 – Thrombosis – DVT- Hypercoagulability.
1. INTRODUÇÃO
A COVID-19 é uma doença que teve início em 17 de novembro de 2019, em Wuhan, na província de Hubei, na República Popular da China, sendo oficialmente declarada como pandemia em 11 de março de 2020. (FARIAS et al., 2021)
Inicialmente classificada como uma pneumonia grave de etiologia desconhecida, a COVID-19 apresentou uma ampla gama de manifestações clínicas, variando desde casos assintomáticos até óbitos.
Posto isso, foi cientificamente comprovado que essa doença, além de interferir no sistema respiratório, provoca complicações que podem se agravar – envolvendo o sistema cardiovascular, sistema vascular, os rins e dentre outros.
Uma complicação preocupante observada nos pacientes foi o surgimento de trombos, que futuramente se desenvolviam para quadros de embolia pulmonar. Conquanto, quadros como esse apresentam-se principalmente em pacientes graves, mesmo fazendo uso dos anticoagulantes de forma profilática.
A Covid-19 tem chamado atenção de especialistas vasculares, pois os sintomas estão ligados a inflamação do sistema vascular e a hipercoagulação que estimulam manifestações clínicas como vasculite de pequenos vasos, trombose micro e macro vascular de artérias e/ou veias. Com isso, é notório que a COVID-19 interfere negativamente no sistema hemostático, estando presente nele as proteínas de coagulação do sangue, os anticoagulantes naturais e o sistema de fibrinólise.
Devido ao grande número de casos graves causados pela COVID-19 e às suas manifestações clínicas relacionadas a complicações vasculares, torna-se imprescindível aprofundar a compreensão da relação entre a COVID-19 e a TVP, para o desenvolvimento de estratégias de prevenção, diagnóstico precoce e tratamento eficaz pois em determinadas situações, pode levar a desfechos fatais.
A pesquisa relaciona-se as problemáticas que a COVID-19 proporciona aos seus infectados e a possível coagulação sanguínea, acarretando a formação de trombos.
2. REFERENCIAL TEÓRICO
2.1. TROMBOSE VENOSA PROFUNDA
A Trombose Venosa Profunda (TVP) é uma eventualidade médica grave que geralmente é tratável. Isso pode ocorrer quando um coágulo de sangue se forma dentro de uma veia profunda, geralmente na perna, coxa ou braço. Se parte desse coágulo deslocar-se para os pulmões, existe a possibilidade do aparecimento da Embolia Pulmonar (EP), uma das complicações mais grave da TVP, colocando em risco a vida do paciente. Para evitar que mais coágulos cresçam e se formem, é primordial que os pacientes com TVP ou EP sejam diagnosticados e tratados o mais rápido possível (HUANG et al., 2020).
Os sintomas qualificadores incluem dor espontânea, inchaço na perna, pé e/ou tornozelo, vermelhidão e/ou mudança de cor na pele e aumento da temperatura no membro afetado. (MUGUET et al., 2022)
O corpo humano possui dois tipos principais de veias: veias superficiais localizadas nas camadas de gordura subcutânea e veias profundas encontradas próximas aos músculos e ao longo dos ossos. Quando ocorre a formação de coágulos sanguíneos nas veias profundas, é classificado como TVP. (DOUKETIS et al., 2022)
A preocupação principal surge quando um coágulo se desprende e percorre a corrente sanguínea, com potencial risco de desenvolver a embolia pulmonar. Um embolo pode se alojar nos pulmões, cérebro, coração ou em qualquer outro órgão, resultando em casos graves e, por vezes, fatais. (FARIAS et al., 2021)
Grande parte das pessoas com TVP não apresenta nenhum sintoma. A ocorrência de dor torácica ou falta de oxigênio devido a embolia pulmonar nessas pessoas pode ser o primeiro sinal da presença de um coágulo sanguíneo. Em outros casos, se uma veia profunda da perna é acometida, a panturrilha fica edemaciada e dolorida, sensível ao toque e quente. Dependendo das veias envolvidas, a deficiência pode se estender para todo o membro inferior. (CHEN et al., 2020).
As estatísticas indicam que a TVP é a principal causa de mortes súbitas em pacientes de UTI, devido a embolia pulmonar (EP), as quais muitas vezes não são diagnosticadas inicialmente, e culminam em lesões graves que se manifestam posteriormente. (H.P.C. ALBUQUERQUE & P.C. VIDAL et al., 1996)
Na maioria dos casos, os pacientes com TVP não apresentam sintomas, dificultando o diagnóstico precoce e o tratamento. No entanto, quando os sintomas estão presentes, eles servem como indicadores da forma mais grave de TVP, como baixa oxigenação e/ou dor torácica, indicando uma possível evolução para EP. (H.P.C. ALBUQUERQUE & P.C. VIDAL et al., 1996)
A ocorrência desta patologia, segundo alguns estudos, é demonstrada na população geral como 5 casos a cada 10.000 indivíduos anualmente, e no Brasil em torno de 0,6 a cada 1000 habitantes anualmente. Na Europa os índices chegam a 600 mil casos de trombose venosa profunda e embolia pulmonar anualmente. Nos Estados Unidos da América, são registrados 300 mil casos de trombose ao ano, sendo a TVP a terceira causa mais comum dentro das patologias cardiovasculares. Já no Brasil, os estudos mostram 122.096 internações por trombose, registradas em 2014, e um decréscimo desse índice para 113.817, em 2015 (BRANDÃO et al., 2018).
Pode-se citar fatores de risco para o surgimento da TVP, que incluem: idade, obesidade, neoplasias, gravidez, pós-parto, histórico de cirurgias recentes, histórico prévio de TVP, imobilidade, sexo, varizes nos membros inferiores, uso de anticoncepcionais orais e até mesmo distúrbios congênitos com deficiência de ATIII ou proteína C. (H.P.C. ALBUQUERQUE & P.C. VIDAL et al., 1996)
2.1.1. FISIOPATOLOGIA DA TVP
A fisiopatologia da TVP engloba inúmeros fatores, sendo as alterações na coagulação sanguínea, lesão endotelial e alterações no fluxo sanguíneo as principais. Ocorre a carência de suprimentos na parede venosa, onde são originados no sangue. Na veia será criado uma hipóxia, devido o único contato do oxigênio com o endotélio venoso ser pela circulação sanguínea. (ZA Duhailib, S. Oczkowski, K. Polok et al., 2022)
A hipóxia é a primeira via patogênica, juntamente com a lesão endotelial e a estase venosa. Para visualizar melhor a fisiopatologia, aplica-se a tríade de Virchow, onde refere-se ao mecanismo fisiopatológico mais essencial para criação da trombose, que são estase venosa, hipercoagulabilidade e lesão endotelial.
Hipoxemia Resulta da redução dos níveis de oxigênio no sangue arterial devido à desigualdade na relação ventilação/perfusão nas áreas afetadas, podendo ser medida pela gasometria.
Aumento do espaço mortoRefere-se à existência de áreas pulmonares com obstrução da circulação, mantendo a ventilação, caracterizando o distúrbio ventilação/perfusão, conhecido como espaço morto. Isso resulta em menor eliminação de CO2, levando ao aumento dos níveis circulantes deste gás. A hiperventilação compensatória elimina o excesso de CO2, levando a uma alcalose respiratória.
Aumento do trabalho ventilatórioA dispneia compensatória é uma resposta à hipoxemia tecidual que estimula os quimiorreceptores do seio carotídeo e aórtico. A liberação de agentes humorais pelo trombo (serotonina e histamina) aumenta a resposta aferente vagal.
PneumoconstriçãoResulta da redução do volume pulmonar devido à contração dos ductos alveolares, provocada pela ação da serotonina e das prostaglandinas liberadas pelo trombo.
Hipertensão PulmonarO bloqueio mecânico, liberação de agentes humorais vasoconstritores, fatores reflexos, hipoxemia e diminuição do volume do gás torácico levam à vasoconstrição reflexa nos vasos pulmonares, aumentando a resistência vascular pulmonar.
Redução do Débito CardíacoO principal mecanismo é a redução da pré-carga do ventrículo esquerdo devido ao bloqueio mecânico. A hipoxia pode levar a uma menor contratilidade do músculo cardíaco. Em embolias maciças, o choque cardiogênico é o extremo da redução do desempenho cardíaco
Modificações Patológicas da CoagulaçãoFatores inerentes ao sexo, idade e herança genética alteram o mecanismo da coagulação, aumentando o risco de TVP. Com o avanço da idade, há aumento progressivo do fibrinogênio e dos fatores VIII e X. Nos tumores malignos, traumatismos graves, diabetes mellitus e aumento do estrogênio, verifica-se elevação dos fatores de coagulação. Pacientes com neoplasias, estenose coronariana e diabetes apresentam diminuição da antitrombina III.
Alterações Anatômicas do Sistema VenosoO endotélio íntegro possui forte carga negativa que impede o depósito de células sanguíneas, assegurando condições fisiológicas com pouco atrito. Danos ao endotélio, como no surgimento de varizes e durante cirurgias traumatológicas, podem levar à formação de trombos.
Estase VenosaOcorre devido às alterações na viscosidade do sangue durante procedimentos cirúrgicos e a imobilidade do paciente.
CoagulaçãoPode ocorrer devido à lesão do endotélio dos vasos ou dos tecidos (sistema intrínseco e extrínseco).
Fluxo SanguíneoAlterações na viscosidade são fundamentais na patogênese da coagulação, onde a concentração das proteínas plasmáticas e o hematócrito influenciam a viscosidade do sangue.
Mecanismos PatogênicosA TVP resulta da desordem nos mecanismos que regulam o equilíbrio entre fatores estimulantes e inibidores da coagulação. Mecanismos patogênicos estimulam as alterações endoteliais, estase e diluição sanguínea, enquanto inibidores prejudicam a integridade do endotélio, da antitrombina III, da heparina e da fibrinólise, levando à formação do trombo.
2.2. COVID-19 E SUAS COMPLICAÇÕES
A patologia do coronavírus 2019 (COVID-19) é uma doença infecciosa extremamente contagiosa causada pelo SARS-CoV-2 (ORLANDI et al., 2020).
A COVID-19 pode causar lesões nos pulmões, fígado, rins, coração, vasos e outros órgãos (WANG et al., 2020). Em geral, os pacientes hospitalizados com COVID- 19 sofrem de lesões pulmonares graves e falência fatal de múltiplos órgãos, bem como anemia hemolítica. No entanto, lesões hepáticas, renais e cardíacas agudas, choque e encefalopatia hipóxica são sintomas menos comuns (CONSOLI et al., 2019). Alguns pacientes com COVID-19 também podem manifestar sinais de danos teciduais, incluindo rabdomiólise ou hemoptise, que levam a lesão celular, liberação de proteínas heme e acúmulo de heme nos tecidos do corpo.
A pandemia da COVID-19, causada pelo SARS-CoV-2, não apenas impactou o mundo com suas altas taxas de infecção e mortalidade, mas também revelou complicações graves associadas à doença, como TVP, síndrome respiratória aguda grave (SRAG), insuficiência respiratória, lesão cardíaca, insuficiência renal e complicações neurológicas, incluindo acidente vascular encefálico. Essas complicações agravam significativamente o quadro clínico da doença, aumentando sua complexidade e desafiando os profissionais de saúde, pois a cada novo caso podem surgir sintomas ainda mais graves.
Um paciente com COVID-19 que desenvolveu trombose venosa profunda (TVP) pode apresentar uma combinação de sintomas relacionados à infecção pelo vírus e à formação de coágulos sanguíneos. Alguns sinais e sintomas comuns de um paciente com COVID-19 que adquiriu TVP incluem:
- Dor e Inchaço nas Pernas: Uma das principais características da TVP é a dor persistente, sensação de peso ou desconforto nas pernas. O local afetado também pode ficar inchado.
- Vermelhidão e Calor na Área Afetada: A pele sobre a área onde o coágulo se formou pode ficar vermelha e quente ao toque.
- Dificuldade de Movimentação: Devido à dor e ao inchaço, o paciente pode ter dificuldade em movimentar a perna afetada.
- Veias Superficiais Inchadas e Visíveis: Em alguns casos, as veias superficiais próximas à superfície da pele podem ficar inchadas e visíveis.
- Sintomas Respiratórios Persistentes: Em casos mais graves, se o coágulo se desprender e viajar para os pulmões, o paciente pode apresentar sintomas respiratórios graves, como falta de ar, dor no peito e tosse com sangue. Isso pode indicar uma embolia pulmonar, uma complicação séria da TVP.
É importante notar que a TVP pode ser assintomática em alguns casos ou os sintomas podem ser leves, o que torna crucial a vigilância médica, especialmente para pacientes com COVID-19, que já estão em maior risco devido às anormalidades na coagulação sanguínea associadas à infecção. Em caso de contaminação pelo vírus que apresente qualquer um desses sintomas, é essencial procurar atendimento médico imediato para avaliação e tratamento adequados, quanto mais precoce o diagnóstico mais chances de uma intervenção rápida. A mobilização precoce, o uso de meias de compressão e a administração adequada de anticoagulantes são medidas preventivas vitais.
2.3. COVID-19 e TVP
Um estudo realizado na Suécia, publicado pela revista British Medical Jornal (BMJ), revelou que pacientes que contraíram COVID-19 aumentaram suas chances de desenvolver trombose até seis meses após a infecção. Além disso, a Sociedade Brasileira de Angiologia e Cirurgia Vascular (SBACV) destacou que 82% dos médicos especialistas associam casos de pacientes com COVID-19 à trombose nos membros inferiores. (MUGUET et al., 2022)
Um estudo da Sociedade Brasileira de Cardiologia indicou que o sangue de pacientes com COVID-19 tem maior propensão à coagulação devido à ativação do processo inflamatório e trombótico. A infecção provoca aumento de citocinas inflamatórias e distúrbios na coagulação, predispondo à formação de trombos. Isso aumenta a probabilidade de coágulos nos vasos sanguíneos, levando a condições como a TVP. Além disso, a doença respiratória aguda causada pelo vírus pode resultar em imobilização prolongada dos pacientes, outro fator de risco conhecido para o desenvolvimento da TVP. (MUGUET et al., 2022)
O agravamento em pacientes diagnosticados com COVID-19 está diretamente relacionado ao aumento dos problemas cardiovasculares. Isso ocorre devido ao excesso de citocinas, como a IL-6, que desencadeia uma resposta inflamatória intensa, aumentando o risco de formação de coágulos sanguíneos. Estudos indicam que o SARS- CoV-2 tem a capacidade de invadir células endoteliais, causando lesões e alterações nas paredes dos vasos sanguíneos, favorecendo a formação de coágulos. Em resposta à invasão viral, a disfunção endotelial impulsiona o desenvolvimento de trombose, ativando um estado hiper inflamatório. Isso leva à liberação de citocinas inflamatórias, como IL- 6, TNF-alfa e IL-2, que podem evoluir para a síndrome da tempestade de citocinas. (MUGUET et al., 2022)
A persistência da disfunção endotelial após a infecção pelo SARS-CoV-2 pode levar à formação de trombos mesmo meses após o diagnóstico da COVID-19, devido à perda do glicocálix e integridade celular. A ativação excessiva do sistema imunológico aumenta a viscosidade sanguínea, acumulando fibrinogênio e reduzindo o fluxo nos microvasos devido à hipóxia causada pelos danos pulmonares. (MUGUET et al., 2022)
O desequilíbrio no controle do Sistema Renina-Angiotensina-Aldosterona (SRAA), desencadeado pela ligação do vírus ao receptor da enzima conversora de angiotensina-2 (ECA-2) nas células endoteliais, resulta na formação de microtrombos e angiogênese reacional. Essas anormalidades no fluxo sanguíneo colaboram para a lesão endotelial vascular. (MUGUET et al., 2022)
A fusão da proteína spike do SARS-CoV-2 com a ECA-2 leva a um desarranjo do SRAA. O bloqueio do receptor ECA-2 está relacionado à formação acentuada de trombos e à expansão de seu tamanho, enquanto sua função amplificada apresenta efeito antitrombótico. Apesar do envolvimento da ECA-2 na ação do vírus, os fármacos que inibem o Sistema Renina-Angiotensina-Aldosterona não pioram o prognóstico da COVID-19, como discutido no artigo “A trombose venosa profunda pós-COVID-19 e seu manejo farmacológico”. (MUGUET et al., 2022)
A ativação da angiotensina II, resultante da fusão da proteína spike do SARS- CoV-2 com o receptor ECA-2, leva à produção de inibidores de plasminogênio do tipo 1, criando um estado pró-trombótico. O bloqueio do receptor ECA-2 demonstrou estar relacionado à formação acentuada de trombos e à expansão de seu tamanho, enquanto sua função amplificada apresenta efeito antitrombótico. (MUGUET et al., 2022)
É importante notar que, apesar do envolvimento da ECA-2 na ação do vírus SARS-CoV-2, os fármacos que inibem o Sistema Renina-Angiotensina-Aldosterona não contribuem para a piora do prognóstico da COVID-19. (MUGUET et al., 2022)
Figura 1
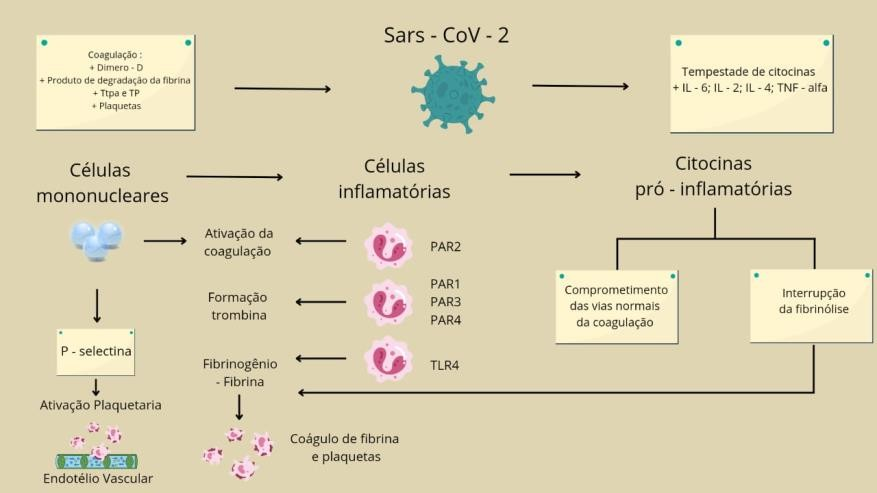
Figura 1 – o novo corona vírus, SARS-CoV-2, ativa o processo inflamatório e trombótico, e a infecção por ele causada está relacionada a aumento de citocinas inflamatórias (tempestade de citocinas) e distúrbios da coagulação, com predisposição a formação de trombos. As células mononucleares interagem com as plaquetas ativadas e a cascata da coagulação, que ativam as células inflamatórias por meio da ligação da trombina e do fator tecidual com receptores específicos ativados por protease e da ligação da fibrina ao receptor Toll-like 4. A ativação das células inflamatórias resulta na liberação de citocinas pró-inflamatórias, que levam a comprometimento das vias normais da coagulação e interrupção da fibrinólise. PAR: receptor ativado por protease; TLR4: receptor Toll-like 4; Ttpa: tempo de tromboplastina parcial ativada; TP: tempo de protrombina; IL: interleucina; TNFα; fator de necrose tumoral-α. Figura adaptada de: Levi M, van der Poll T.25
2.4. DÍMERO – D
Sob essa perspectiva, cerca de 43% a 60% dos pacientes com COVID-19 apresentam níveis altos de dímero D. Posto isso, pode-se afirmar que níveis mais elevados de dímero D são observados em pacientes com TEV em comparação a aqueles que não apresentam a TEV. A análise de regressão multivariada mostra que o nível de dímero D > 1570 ng/mL e o aumento do risco de TVP assintomática entre pacientes não gravemente doentes estão associados. (ZAINAB AL DUHAILIBA et al. 2022)
Em conseguinte, também é importante destacar que níveis altos de dímero D podem estar associados ao aumento da probabilidade de sangramentos, particularmente quando a trombocitopenia torna-se presente. Porventura, faltam estudos de precisão diagnóstica de alta qualidade, que resulta em uma interpretação cuidadosa – considerando o contexto clínico – para a análise do nível do dímero D. (ZAINAB AL DUHAILIBA et al. 2022)
3. CONCLUSÃO
Este estudo revelou uma incidência significativamente maior de quadros trombóticos em pacientes graves de COVID-19. Observou-se que a gravidade da doença é mais comum em pacientes hospitalizados e ficou perceptível que os sintomas da Trombose Venosa Profunda são visualizados após a doença já estar instalada no corpo humano, dificultando um tratamento mais resolutivo e prolongando o tempo de internação do paciente, sendo um dos riscos para novas crises de Embolia Pulmonar. A ausência da profilaxia correta complica o estado clínico, devido ao bloqueio do fluxo sanguíneo. O diagnóstico precoce da TVP é essencial, pois os sinais iniciais podem não ser evidentes, tornando o manejo clínico mais desafiador.
A relação entre COVID-19 e TVP continua a ser objeto de estudos intensivos. Embora algumas conclusões importantes tenham sido tiradas, é crucial notar que a compreensão sobre o tema está em constante evolução com novas pesquisas. Este estudo destaca a ligação entre o aumento do risco de coágulos em pacientes com COVID-19, associado à inflamação sistêmica e à resposta imunológica desregulada.
A imobilização prolongada e outros fatores relacionados ao estado de saúde dos pacientes hospitalizados aumentam o risco de TVP. Além disso, pacientes que se recuperaram da COVID-19 enfrentam um risco persistente de coágulos sanguíneos mesmo após a resolução dos sintomas agudos, devido à disfunção endotelial persistente e à inflamação crônica.
Portanto, infere-se que a profilaxia em ambientes hospitalares, como o uso de anticoagulantes é medida crucial para prevenir coágulos. Assim como a avaliação do risco individual e a implementação de estratégias de prevenção adequadas desempenham um papel fundamental na redução do agravamento da COVID-19 associado à TVP.
REFERÊNCIAS:
- BRANDÃO, Gustavo Muçouçah Sampaio et al. Direct oral anticoagulants for treatment of deep vein thrombosis: overview of systematic reviews. Jornalvascularbrasileiro, v. 17, p. 310-317, 2018.
- CamposJ. M.; ReisB. C. C. Trombose venosa profunda pós Covid-19: umarevisãointegrativa. Revista Eletrônica Acervo Médico, v. 7, p. e10020, 11 maio 2022.
- CHEN, Nanshan et al. Epidemiological and Clinical Characteristics of 99Casesof2019-NovelCoronavirus(2019-nCoV)Pneumonia in Wuhan, China.
- CONSOLI, Letizia et al. 2019 novel coronavirus (COVID-19) pneumonia complications: the importance of lung ultrasound. Journalofultrasound, p. 1-4, 2020.
- PIVETI FARIAS, C. .; MOREIRA ALVARENGA, V. .; SOUZA, M. C. A. de. Trombose venosa profunda em pacientes comCOVID-19::revisãointegrativadaliteratura.Revista de Saúde, [S. l.], v. 12, n. p. 20–25, 2021. DOI: 10.21727/rs.v12i3.2946. Disponível em: http://editora.universidadedevassouras.edu.br/index.php/RS/article/view/2946. Acesso em: 25 maio. 2023.
- MOTA, LP; SOUSA, MVA de.; GONÇALVES, JN de A. .; LEAL, NTB.; LEAL, LB.; NEGREIROS, ALB.; SILVA, . DH da.; PENHA, AAG da.; ALVES, NS.; FERREIRA, P. de F. .; LEAL, GL.; SOUSA, F. de A. da S. .; FREITAS, FV da S. .; SILVEIRA FILHO, ER da.; COSTA, JD da.; CARVALHO, MM de .; PEREIRA, MG de C. .; PEREIRA, SA.; SANTOS, JMF dos . Desenvolvimentode trombose empacientescominfecçãopor SARS-CoV-2.Investigação,Sociedade e Desenvolvimento , [S. l.] , v. 10, n. 9, pág. e52210918246, 2021. DOI: 10.33448/rsd-v10i9.18246. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/18246. Acesso em: 25 maio. 2023.
- Boccia, M.; et al. COVID-19andcoagulativeaxis:reviewofemergingaspectsinanoveldisease.Monaldi Arch Chest Dis., v. 90, n. 2, May 2020. Doi:10.4081/monaldi.2020.1300. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32425013/
- Bikdeli, B., Madhavan, M. V., Jimenez, D., Chuich, T., Dreyfus, I., Driggin, E.,… & Der Nigoghossian, C. (2020). COVID-19andthromboticorthromboembolicdisease:implicationsforprevention,antithrombotictherapy,andfollow-up. Journal of the American College of Cardiology, 75(23), 2950-2973.
- Centro de Informações em Saúde para Viajantes. (2021). Covid-19 e trombose. Brasília: Ministério da Saúde. Recuperado em 13 de maio de 2023, de https://catalogo.saude.gov.br/EducacaoEmSaudeVisualizar/28746
- ORLANDI, Martina et al. ThesystemicsclerosispatientintheCOVID-19era:thechallengingcrossroadbetweenimmunosuppression,differentialdiagnosis and long-term psychological distress. Clinical Rheumatology, v. 39, p. 2043-2047, 2020.
- VARGA, Zsuzsanna et al. EndothelialcellinfectionandendotheliitisinCOVID-19. The Lancet, v. 395, n. 10234, p. 1417-1418, 2020.
- Varga, Z. (2021). COVID-19andthromboticcomplications:frombasicmechanisms to clinicalpractices. Cham, Switzerland: Springer.
- Levi, M., Hunt, B. J., Thachil, J., & Iba, T. (Eds.). (2021). Coagulationandanticoagulation inCOVID-19. Cham, Switzerland: Springer.
- Sociedade Brasileira de Angiologia e de Cirurgia Vascular. (2020). Covid-19: Oqueocirurgiãovasculareangiologistaprecisasaber. São Paulo: Atheneu.
- Brasil. Ministério da Saúde. Secretaria de Atenção Primária à Saúde. (2020). Orientaçõesparadiagnóstico,tratamentoeprevençãodatrombosevenosaprofundaassociadaàCovid-19:versãopreliminar[Monografianotodoemmeioeletrônico].Brasília: Ministério da Saúde. Recuperado em 13 de maio de 2023, de https://www.gov.br/saude/pt-br/media/pdf/2020/maio/15/Orientacoes- para-diagnostico-tratamento-e-prevencao-da-trombose-venosa-profunda- associada-a-Covid-19-versao-preliminar.pdf
- Guimarães, M. C. C. (2021). TromboseeCovid-19:Umaanálisedasevidênciascientíficaseaimportânciadaatuaçãodofarmacêutico[Dissertaçãodemestrado, Universidade Federal de Minas Gerais]. Repositório Institucional UFMG. Recuperado em 13 de maio de 2023, de https://repositorio.ufmg.br/handle/1843/BUOS-BFGQK7
- HUANG, Chaolin et al. Clinical features of patients infected with 2019 novelcoronavirus in Wuhan,China. The lancet, v. 395, n. 10223, p. 497-506, 2020.
- Lima, L. L., Silva, F. A., & Pires, E. M. (2021). Trombose e Covid-19: revisãosistemáticadosaspectosepidemiológicoseclínicos.InAnaisdoXXCongressoBrasileirodeHematologia,HemoterapiaeTerapiaCelular[Trabalho apresentado em evento em meio eletrônico]. Recuperado em 13 de maio de 2023, de https://congresso.sbh
- Nascimento JHP, Gomes BFO, Carmo Júnior PRD, Petriz JLF, Rizk SI, Costa IBSDS, Lacerda MVG, Bacal F, Hajjar LA, Oliveira GMM. COVID-19eEstadoHipercoagulável:UmaNovaPerspectivaTerapêutica.Arq Bras Cardiol. 2020 Jun 1;114(5):829-833. Inglês, Português. doi: 10.36660/abc.20200308. PMID: 32491074; PMCID: PMC8386998
- WAGENER, Frank ADTG et al. Visandoosistemaheme-hemeoxigenaseparaprevenir complicações graves após infecções por COVID-19. Antioxidantes , v. 9, n. 6, pág. 540, 2020..
- WANG, Xinhui et al. Comorbid chronic diseases and acute organ injuries are strongly correlated with disease severity and mortality among COVID-19 patients: a systemic review and meta-analysis. Research, 2020.
- Farias, C. P; Alvaenga, V. M; Souza, M. C. A. Trombose venosa profunda empacientescomCOVID-19:revisãointegrativadaliteratura. Revista de Saúde 2021 Ago/Nov.; 12 (3): 20-25.
- DOUKETIS, J. D. Trombosevenosaprofunda(TVP). Disponível em:<https://www.msdmanuals.com/pt-br/casa/dist%C3%BArbios-do- cora%C3%A7%C3%A3o-e-dos-vasossangu%C3%ADneos/dist%C3%BArbios- venosos/trombose-venosa-profunda-tvp>.
- Doença causada pelo novo coronavírus (COVID-19) – OPAS/OMS | Organização Pan-Americana da Saúde. Disponível em: <https://www.paho.org/pt/doenca- causada-pelo-novo-coronavirus-covid-19>.
