REGISTRO DOI:10.5281/zenodo.10854765
Carolina Dias Oste1
Felipe Mingoranse Domingos1
Geovane Ferreira Lourenço1
João Paulo de Oliveira Souza1
Fernanda de Paula Roldi Vieira2
1 INTRODUÇÃO
O Complexo Gengivite Estomatite Felina (CGEF) é uma doença caracterizada pela resposta inflamatória bucal que pode favorecer úlceras periodontais e cálculos dentários, causando forte desconforto no animal. Gatos de diversas idades podem ser acometidos, porém geralmente os adultos menores de 8 anos são os que mais apresentam essa patologia (GRACIS et al., 2018 apud SOUSA et al., 2022). Sendo a segunda afecção bucal que mais acomete os felinos, o CGEF fica atrás somente da doença periodontal (DIEHL; ROSYCHUCK, 1993). A principal característica da doença são as lesões ulcerativas e/ou proliferativas na cavidade oral, afetando a gengiva, arco glossopalatino, e também áreas como lábios, língua e faringe (SOUSA FILHO, 2017).
A etiologia e patogenia ainda não são totalmente claras, porém tudo indica que vírus, bactérias, dietas inadequadas e estresse ambiental podem estar relacionadas a doença (PEREGO et al., 2020). Dentre os sinais clínicos, pode ser observado a anorexia, desidratação, disfagia, o ptialismo, a halitose, perda de peso, hemorragia e vocalização por conta da dor que pode ser intensa (COTA, SANTIAGO, 2020).
O diagnóstico pode ser feito através da anamnese e exame físico da região bucal do animal. O hemograma e exame bioquímico geralmente são realizados para detectar a causa da doença (PEREGO et al., 2020). O tratamento periodontal completo é mais indicado nesse caso, com extração dos dentes com sinais de reabsorção odontoclastica, buscando eliminar os focos de infecção. O uso de antibióticos em conjunto com o procedimento é indicado, tendo em vista a provável relação bacteriana com a etiologia da doença (NIZA; MESTRINHO; VIELA, 2004).
2 REVISÃO DE LITERATURA
2.1 ETIOLOGIA
A etiologia do CGEF ainda não é totalmente esclarecida, e os estudos apontam que os agentes causadores da inflamação podem ser multifatoriais (CAMY; FAHRENKRUG; GRACIS, 2010).
Placas bacterianas, vírus, infecções por Bartonella henselae, sistema imunológico comprometido (Vírus da imunodeficiência felina, FIV, e Vírus da leucemia felina, FeLV) são agentes apontados como possíveis desencadeadores para o complexo (LOMMER; VERSTRAETE, 2003; LYON, 2005). A estomatite caudal, caracterizada pela inflamação do arco glossopalatino, está comumente relacionada com o vírus do trato respiratório, como calicivírus e herpes vírus-1 (NIEMIEC, 2013).
As suspeitas de correlação de retroviroses com o CGEF se dá pelo fato da prevalência desses vírus em animais com a doença. Além disso, patologias como FIV e FeLV tendem a causar certa disfunção no sistema imunológico, o que poderia favorecer o desenvolvimento do complexo (OLDER et al., 2020). No entanto, os agentes infecciosos encontrados em animais acometidos pela doença, também são encontrados em animais negativos para as retroviroses, mostrando que essa relação é pouco consistente (QUIMBY et al., 2008).
Novas pesquisas mostram que a FIV, por exemplo, não afeta diretamente no desenvolvimento do CGEF como se pensava, nem causa diferença significativa na composição da microbiota oral do animal, tendo em vista que sua diversidade de microrganismos se manteve relativamente parecida em animais positivos e negativos para o retrovírus. No entanto, esses mesmos estudos apontam que a FIV, muito possivelmente, pode ter algum impacto na microbiota oral, o que vai depender de cada caso clínico.
Mesmo que não haja relação direta entre o CGEF e a FIV, foi demonstrado em pesquisas recentes que o complexo acomete mais animais machos e de vida livre, os quais tendem a ter comportamento agressivo e, por isso, estão mais expostos a essas infecções virais. Portanto, uma forma de prevenção seria a castração e a posse responsável desses animais, evitando que os mesmos fiquem muito tempo fora de casa e, consequentemente, expostos a esses agentes etiológicos (RAIZER, PINTO, CHUCRI, 2022).
Um estudo feito com 19 gatos controle e 23 gatos com CGEF,buscava identificar entre micróbios e genes hospedeiros associação entre calicivírus felino e gengiva crônica felina. Como resultado do estudo o único micróbio fortemente associado foi o calicivírus (CVF) – detectado em 21 dos 23 gatos afetados pelo CGEF e em nenhum gato controle- o calicivírus felino, segundo o estudo foi o único vírus encontrado em maior quantidade em gatos acometidos pelo CGEF. Durante o pré-tratamento havia calicivírus felino e após a resolução da doença esse agente não apresentava nos gatos, exceto 1. Esse gato que foi a exceção, foi detectado com o CVF diferente do detectado na amostra pós-tratamento, dessa forma sugere que o felino eliminou a infecção inicial e foi reinfectado com uma cepa distinta do vírus (FRIED et al., 2020).
Além da hipótese da relação entre vírus e bactérias com o desenvolvimento e manutenção do CGEF, a possibilidade do envolvimento direto ou indireto de fungos com a doença fez com que Krumbeck et al (2021) buscasse investigar a fundo a microbiota oral, dessa vez não focando somente nas espécies de bactérias, como a maioria das últimas pesquisas publicadas sobre o complexo feitas, mas também analisando as espécies fungicas que compunham a cavidade bucal.
Nesse estudo, um grande número de espécies de fungos foram encontrados (186), tendo Malassezia restrita, Malassezia arunalokei, Cladosporium penidielloides/salinae e Aspergillaceae sp. em maior número nas amostras de gatos CGEF. Enquanto isso, foi observado nas amostras de gatos saudáveis, a espécie Saccharomyces cerevisiae foi encontrada em maior abundancia.
Além disso, no bacterioma demonstrou que a Bergeyella zoohelcum é, possivelmente, um importante biomarcador de animais com a microbiota bucal saudável.
Os dados dessa pesquisa demonstram que os fungos também podem ter um papel fundamental no desenvolvimento e manutenção do CGEF, e portanto é necessário que se haja mais pesquisas e estudos acerca do assunto, visto que a relação fungica com o CGEF é algo pouco estudado até o momento.
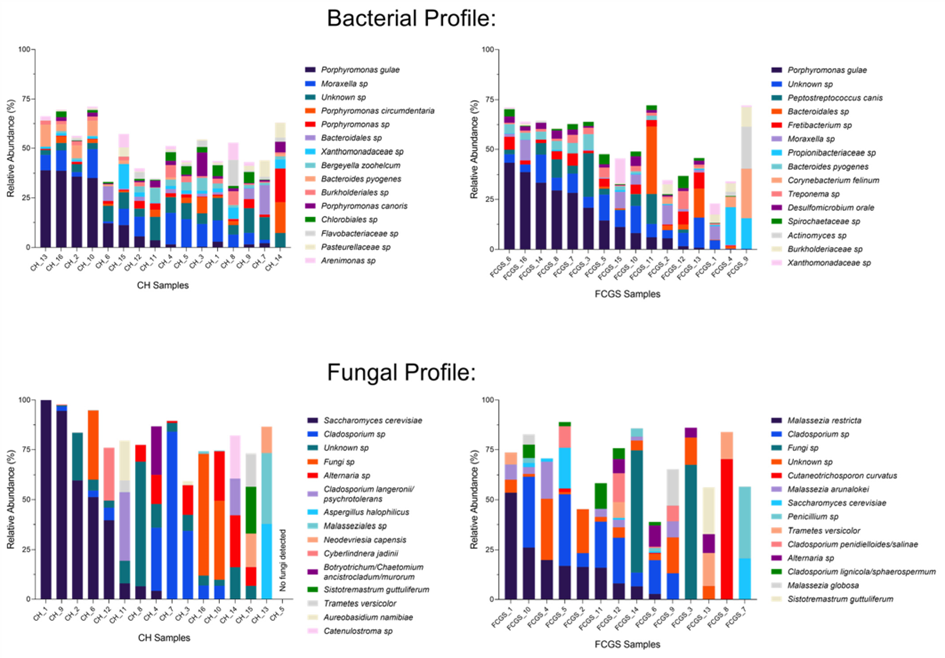
Figura 1 – Grafico dos taxons microbianos para bactérias (painés da parte superior) e para fungos (painés da parte inferior) em amostras orais dos gatos examinados. O lado esquerdo das figuras mostra o resultado dos gatos saudaveis, e as amostras do lado direto são dos gatos com CGEF. Cada coluna representa o perfil microbiano dos felinos. São apresentadas as 15 espécies mais abundantes de cada grupo, tendo as espécies mais recorrentes em primeiro. Fonte: KRUMBECK, (2021)
2.2 PATOGENIA
A patogenia do complexo gengivite-estomatite felino e seu fator desencadeante ainda é incógnito e divergente. Inicialmente, a alta taxa de proliferação bacteriana, constituída por microorganismos aeróbios Gram-positivos e por anaeróbios Gram-negativos, induzem a produção de toxinas, como a hialuronidases e enzimas lissossomais. Dessa forma, esses microorganismos associados ao fluxo de células inflamatórias, impulsionam a irritação dos tecidos orais. Nesse segmento, há uma reação inflamátória apresentando-se como edema, ulcerações e eritema, conduzindo a gengivite e propiciando o surgimento de cálculo dentário. Esse cálculo é composto por bactérias e outras substancias organicas, em conjunto a uma matriz inorganica, formada principalmente por hidroxiapatita, fosfóro e cálcio (oriundos da saliva ), formando assim, uma placa mineralizada. (GRUFFYDD-JONES,1991; HENNET,1997). Com isso, começa a ser produzido anticorpos após o sistema imunológico responder à inflamação gengival cronica, os plasmócitos e os linfócitos são as globulinas primárias e predominam nesta tipologia inflamatória. Nesse negmento, com o sistema inteiro ativado pelos anticorpos produzidos pelos plasmócitos que são reagentes contra a toxinas bacterianas, atraem células fagocíticas. Sendo assim, estas são causadoras de lesões nas membranas das células gengivais e pontencializam a permeabilidade vascular local, desencadeando intensa retração gengival (JOHNESSEE & HURVITZ, 1983; HARVEY, 1991; WHITE et al., 1992). A imunoglobina y-globulina apresenta-se em maior quantidade quando há uma resposta imunológica acentuada (UENO et al., 1996). De acordo com alguns estudos, as respostas inflamatórias – independente da etiologia – são análogos, e a infecção secundária por microorganismos estimula frequentemente um processo supurativo superficial, a qual obstaculiza a determinação da causa inicial (LOMMER; VERSTRAETE, 2003). Segundo Harley et al. (2003), os gatos com gengivite-estomatite manifestam elevado índice de concentrações séricas de imunoglobulina (lg) G, lgM e lgA, por outro lado as concentrações salivares de lgG e LgM são de maneira proporcional superiores às concentrações de lgA. A lgA tem como função neutralizar patógenos e toxinas, impedindo o crescimento de microorganimos e a sua aderencia na mucosa oral ou dentes, assim contribuem para o aumento do fator de defesa não-específico.
As inflamações causadas na cavidade oral são causadas pela presença do aumento de linfócitos e plasmócitos nos tecidos bucais afetados (ROLIM, 2017). O aumento de linfócitos T em comparação com linfócitos B, revela uma possível relação do CGEF com infecções virais (HARLEY; GRUFFYDD-JONES; DAY, 2010). Dentre os vírus mais apontados, estão o CVF, Herpesvírus felino (FHV), FeLV e FIV que, juntamente com bactérias causarão as inflamações.
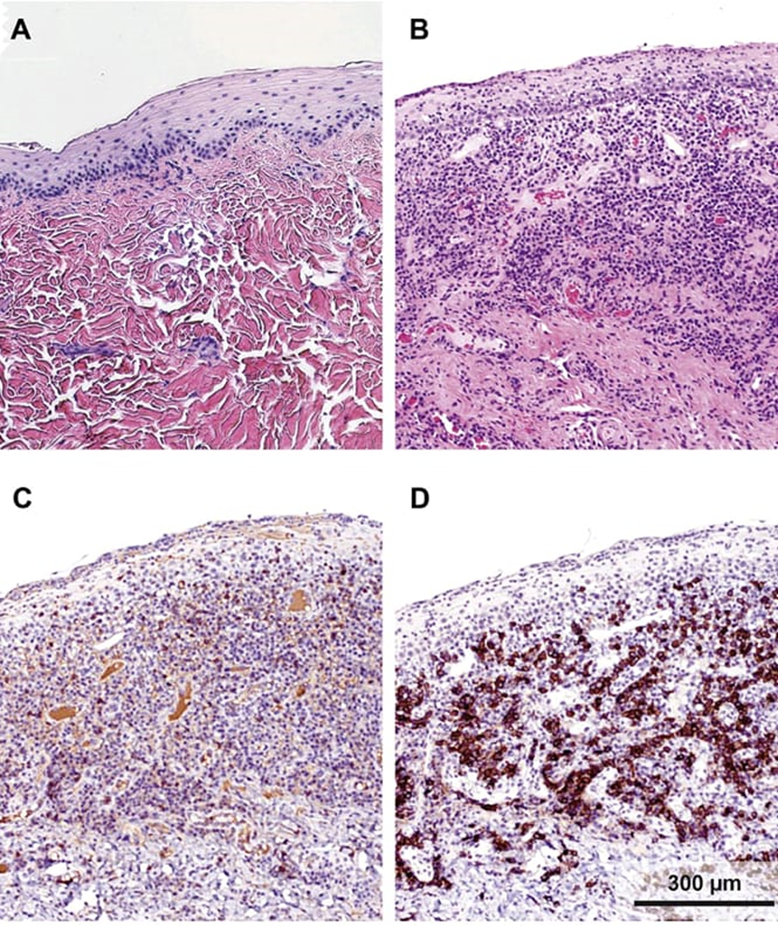
Figura 2 – Histologicamente a mucosa oral dos felinos, é formada pelo tecido epitelial escamoso com pouca presença de células inflamatórias (A). Já em gatos com CGEF, é notável a ulceração no epitélio com a presença de um infiltrado inflamatório que atinge células como granulócitos, linfócitos, plasmócitos e mastócitos (B). Com o uso da imuno-histoquímica da inflamação na mucosa é apresentado um grande índice de linfócitos T (C) e de linfócitos B que está localizada na submucosa (D). Fonte: LEE; VERSTRAETE; ARZI (2020).
2.3 SINAIS CLÍNICOS
Os sintomas iniciais são depressão ou agressividade, apatia, disfagia e anorexia. Com o tempo, há a perda de peso, desidratação, pelos com baixa qualidade, dificuldade ao abrir a boca, vocalização ao se alimentar, hemorragias, linfoadenomegalia mandibular e salivação excessiva. Portanto, para uma avaliação do local mais detalhada, pode ser necessário o uso de sedação (GRACIS et al., 2018 apud SOUSA et al., 2022).
As alterações que podem ser causadas na cavidade oral pela inflamação, são classificadas em quatro graus, dependente da gravidade que se encontra o animal. Geralmente, quanto mais idoso o felino é, maior será a gravidade de lesões na região bucal (WATERS, et al., 1993 apud GERALDO JUNIOR, 2010). O primeiro grau, o animal não apresenta desconforto ou hemorragia na boca, mas observa-se hiperemia gengival discreta. No segundo grau, a hiperemia gengival pode se tornar evidente, mas não ao ponto de ocorrer hiperplasia e ulceração, nessa fase, muitos animais já sentem incômodo na palpação. Já no terceiro, ocorre a perda dos dentes, com a hiperemia gengival evidente apresentando-se bastante avermelhada, com edema e erosões na gengiva, com possível sangramento gengival, ptialismo e desconforto. E no quarto grau, um estado muito avançado, apresenta uma hiperemia gengival muito aguda causando hiperplasia e/ou ulceração com perda de vários dentes, como os caninos e incisivos, e fragmentação facilitada do tecido gengival, com sangramento gengival constante.
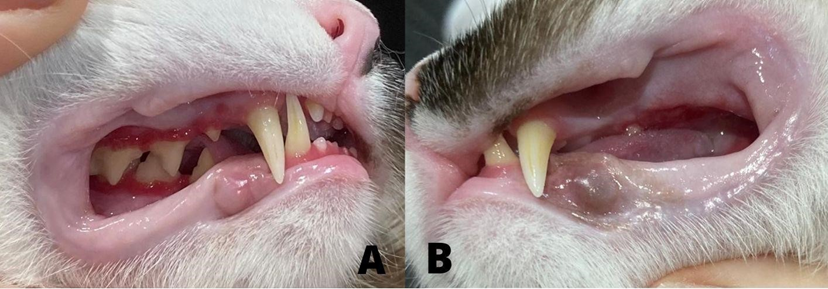
Figura 3 – Exodontia dos pré-molares, molares e incisivos, antes do tratamento (A) e após o tratamento(B). Fonte: SOUSA (2021).
2.4 DIAGNÓSTICO
Para o diagnóstico, é necessária uma anamnese completa, fazendo um resumo do histórico médico geral do animal, reunindo informações como doenças anteriores, medicação,
alimentação, estilo de vida do animal, vacinação, etc. Além disso, é preciso saber se o paciente teve doenças dentárias ou passou por tratamentos para afecção oral, bem como os resultados dos possíveis procedimentos. Seguidamente, é feito um exame geral da região bucal, onde o uso de anestesia pode se fazer necessário caso o animal esteja com muita dor e desconforto.
É necessário também saber se o paciente está com alguma infecção sistêmica concomitante, portanto é preciso ser feito os exames de hemograma completo e perfil bioquímico com proteinograma, pois gatos com CGEF apresentam hiperproteinemia
devido a hipogamaglobulinemia, além de exames para identificar retrovírus, calicivírus e herpesvírus.
Para fechar o diagnostico, pode ser feito o exame histopatológico da amostra de biópsia da cavidade oral, pois isso descarta outros possíveis agentes para as lesões. A elevada quantidade de linfócitos e plasmócitos maduros, caracterizam o CGEF (OLIVEIRA, 2017).
Ademais, a solicitação de exames radiográficos intraoral avaliará alterações orodentárias a serem encontradas, como lesões de reabsorção dentária (LR), raízes retidas, alterações ósseas ou periodontite, visto que podem passar discretamente em um exame físico (FARCAS et al., 2014; SILVA, 2021). Resultados deste diagnóstico, mostram que raízes retidas e lesões de reabsorção dentária há domínio em gatos com CGE.
2.5 TRATAMENTO
Para o tratamento da inflamação e dor, os anti-inflamatórios e analgésicos deverão ser prescritos em conjunto ao ato cirúrgico para uma rápida recuperação do felino. O gato deverá ser idealmente hidratado e alimentado o mais cedo possível, às vezes a utilização de sonda é raramente usada, frequentemente utilizada em animais muito pequenos, debilitados ou com doenças intercorrentes.
Após a operação, o acompanhamento do gato deverá ser de 1 a 3 semanas após a cirurgia, levando em consideração sua condição e dor. Para avaliar a inflamação e extensão de lesões é utilizado índices para o melhor acompanhamento do progresso do animal. Já os pacientes refratários devem-se analisar a dor, inflamação, infecções bacterianas e as possíveis modulações na resposta imune.
A terapia com corticosteroides é utilizada e reservada apenas para casos que não respondem a administração de AINEs. A prednisona é prescrita por via oral (0,5-1 mg/kg) e depois a administração da dose é reduzida em dias alternados. Outros tratamentos também são propostos como, lactoferrina, talidomida e laser, etc) mas não é certo sua eficácia.
O tratamento cirúrgico consiste na extração dos dentes infectados ou com lesões inflamatórias (periodontite, lesão de reabsorção dentária, infecção endodônticas), como também aquelas localizadas no local inflamado, a fim de eliminar os suportes de placa dental responsáveis pelas lesões ulcerativas. Dessa forma, o tratamento envolve extrações dentárias ou até mesmo endentulismo total. Nesse contexto, levando em consideração a localização e as lesões, a extração é geralmente dos pré-molares e molares, para isso um relatório de raio-X odontológico deve ser realizado para detectar qualquer lise óssea, qualquer reabsorção dentária, a fim de orientar e entender a maneira como deve ser realizada a extração dos dentes.
O tratamento a laser de dióxido de carbono (CO2), contém uma onda monocromática carregada com uma grande quantidade de energia luminosa, que por ela estimulará a emissão de radiação, que por sua vez pode refletir, transmitir, espalhar ou absorver no objetivo local, contribuindo para a extração dentária, diminuição da proliferação da mucosa oral. Além de ser programado para a incisão, excisão, cauterização, vaporização ou amputação dos tecidos da cavidade oral. No complexo o tratamento tem como objetivo a retirada dos tecidos proliferativos, estimular a proteção da fibrose tecidual e a diminuição de bactérias encontradas na mucosa afetada (BELLOWS 2013). Porém, com seus pontos positivos que contribuem nos tratamentos, não há estudos e pesquisas suficientes para o efeito totalmente beneficiário do laser de CO2 no CGEF (REITER et al. 2019).
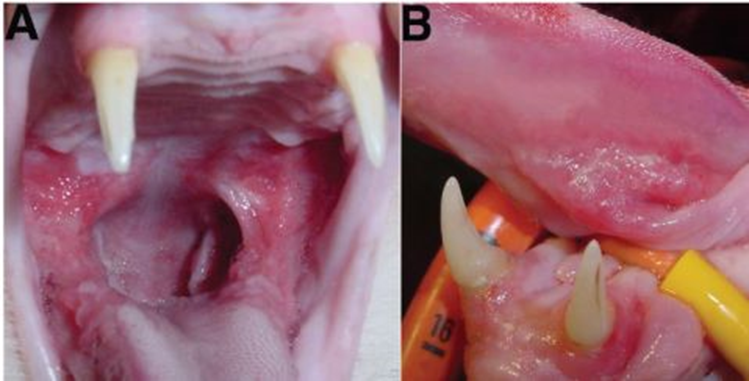
Figura 4 – a cavidade oral (A) e a área sublingual (B) de um gato com 5 anos de idade após 6 meses de tratamento com laser. Fonte: LEWIS, TSUGAWA, REITER, (2007).
Segundo Bellows (2013), há apenas um relato de caso clínico de um gato com complexo gengivite-estomatite refratária que foi submetido mensalmente por uma sessão de laser durante 3 meses consecutivos para retirada do tecido proliferativo, observando a resolução da inflamação sem retorno de tecido proliferativo um ano após o tratamento. (LEWIS, TSUGAWA & REITER, 2007). Junto ao tratamento com laser, foi administrada um gel de clorexidina e prednisona que acabou após 20 meses após o início do tratamento com laser. Dessa forma, a melhoria observada não pode está intimamente ligada com o tratamento a laser, deve-se relacionar com os outros tratamentos utilizados, porém a ablação das lesões do complexo gengivite estomatite felina com laser díodo e de CO2 auxilia na terapêutica adjuvante nos animais sujeitos a extrações dentárias e na presença de tecido proliferativo caudal. (LEWIS; TSUGAWA; REITER, 2007).
Um novo método de tratamento que vem sendo usado é o implante de ouro, que vem mostrando resultados promissores assim como o tratamento a laser. Sabe-se que o ouro influencia o número e também a função dos macrófagos, podendo atuar diretamente nos locais onde há alguma inflamação (PERSILLIN e ZIFF, 1966 apud ROVEREDO, 2018). Nessa pesquisa, é demonstrado como as partículas de ouro tem a capacidade de inibir as enzimas dos lisossomas das células que realizam fagocitose no tecido inflamado. Além de ser um bom condutor elétrico, o ouro não é um material que causa rejeição do organismo (JAEGER et al., 2006). Na mesma pesquisa, mostram resultados positivos em cães com alguma disfunção ou lesão motora, os quais foram submetidos ao tratamento com implantes de ouro 24 quilates em pontos de acupuntura. Eles apresentaram, depois do tratamento, melhora na capacidade motora e redução de dores.
2.6 PREVENÇÃO
Como a etiologia da doença não é muito conhecida, não sendo possível apontar causas atreladas ao seu desenvolvimento, é muito difícil estabelecer um protocolo certeiro de prevenção. Porém, alguns estudos recentes apontam que a incidência de gengivo estomatite é mais recorrente em gatos machos de vida livre, portanto a castração e a criação indoor ainda se mostra como uma forma de prevenção viável para esta e outras doenças (RAIZER; PINTO; CHUCRI, 2022).
A relação entre gengivite estomatite felina e o calicivírus é bastante significativa, a prevenção da infecção por CVF é complexa devido a existencia de portadores crônicos. Nesse contexto, os gatos curados não são imunizados e podem apresentar os sinais da doença novamente. Dessa maneira, as vacinas atenuadas contra a CVF são eficazes na prevenção e evitando o surgimento de sinais clínicos. No entanto, essa imunização não previne a infecção, ou seja, os gatos vacinados podem se infectar e não manifestar os sinais clínicos (AGUT et al., 2016).
3 CONSIDERAÇOES FINAIS
O complexo gengivite estomatite felina é uma doença que afeta a região bucal dos felinos, manifestando uma reação inflamatória com o favorecimento de ulceras peridentárias e cálculos dentários. Isso causa forte desconforto no animal, tendo em vista a intensa dor que ele pode sentir ao tentar se alimentar ou até mesmo beber água. Em função disso, sintomas como anorexia, desnutrição, desidratação, vocalização ao tentar se alimentar, dificuldade ao abrir a boca, salivação excessiva e até mesmo hemorragia, podem ser observados. Essa afecção afeta, geralmente, animais adultos menores que oito anos, mas ela pode afetar gatos de todas as idades, não tendo correlação com esses fatores, assim como sexo por exemplo. Esta é a segunda afecção bucal que mais afeta os felinos, ficando atrás totalmente da doença periodontal.
As lesões ulcerativas e/ou proliferativas na cavidade oral são a principal característica da doença. Elas afetam a gengiva, arco glossopalatino, e também áreas como lábios, língua e faringe. A etiologia e patogenia da doença ainda são incertas, e os estudos recentes apontam que o complexo não tem relação direta com FIV, FeLV ou CVF, porém a sua presença sempre é descrita e animais afetados com essa doença, assim como pequenas variações na sua microbiota oral.
Para o diagnostico, é preciso ser feito uma anamnese completa do local, observando a disposição das ulceras ao redor da cavidade bucal. Para isso, levando em consideração a severidade do quadro, o animal deve estar sedado, uma vez que o forte desconforto pode dificultar a avaliação detalhada dos ferimentos, o que é fundamental para detectar o CGEF, eliminando outras possíveis afecções bucais.
Além do exame físico, é preciso uma avaliação mais completa do organismo do animal, afim de descartar outras possíveis doenças, solicitando um hemograma completo, assim como um exame bioquímico com proteinograma.
Por conta da etiologia e patogenia não serem bem definidas, o tratamento não é totalmente eficaz. De início, busca-se controlar a inflamação e realizar uma limpeza da cavidade bucal, buscando eliminar possíveis agentes etiologicos que estejam causando a doença. Para isso, pode ser preciso realização de cirurgia de extração dos dentes molares e pré-molares, que são os mais afetados pela inflamação. Na maioria dos casos, a extração dos dentes aliada a utilização de antibióticos e anti-inflamatórios já revelam um resultado positivo, onde as inflamações diminuem. Porém, em grande parte dos casos, não há melhora mesmo depois da cirurgia.
Novas formas de tratamento vêm sendo pesquisadas, como o uso de laser no local das feridas ou o implante de ouro.
Uma das formas encontrada para tratar felinos com CGEF, é por meio de tratamento a laser, que estimula na região uma ação de diminuição do aumento de mucosa oral ou da extração dos dentes, ou até a retirada do tecido bucal inflamado. Entretanto, o tratamento não favorece inteiramente em gatos com CGEF, podendo contribuir na moderação da inflamação local.
O implante de ouro é uma forma de tratamento que também vem sendo estudada, por conta de ser um bom condutor elétrico e influenciar diretamente no número e funções dos macrófagos. Pesquisas em cães com disfunções motoras que passaram por implante de ouro em pontos de acupuntura revelaram resultados positivos no aumento de mobilidade e redução de dores.
O CGEF ainda é uma doença pouco estudada, tendo em vista que sua etiologia e patogenia não são bem definidas. Para isso, é necessário que haja mais pesquisas e estudos acerta da patologia, buscando novas formas de tratamento, fazendo com que seja possível estabelecer um protocolo de prevenção. Sabe-se que o complexo tende a afetar mais animais de vida livre, os quais também são infectados por retroviroses como FIV e FeLV e tendem a ter comportamento agressivo. Ainda que não haja correlação direta do CGEF com os vírus, é importante que haja uma prevenção por parte dos tutores, realizando a castração, vacinação e posse responsável, isso pode evitar a transmissão de patologias e, consequentemente, realizar uma manutenção da integridade e saúde dos seus animais.
4 REFERÊNCIAS
AGUDELO, A. Q. Caso clínico: Gingivoestomatitis felina de origen vira. Trabajo de práctica empresarial para optar por el título de Médica Veterinaria – Facultad de Ciencias Administrativas y Agropecuarias. Antioquia, 33 p, 2019.
AGUT, A. et al. Manual clínico de medicina interna en pequeños animales II.
BARBOSA, R. C. C. et al. Aspectos clínicos e laboratoriais do complexo gengivite-estomatite em gatos domésticos. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 70, p. 1784-1792, 2018.
BELLOWS J. Laser and Radiosurgery in Veterinary Dentistry. Veterinary Clinics of North America: Small Animal Practice. v. 43, n. 3, p. 651–668, 2013.
BOUTOILLE, F. La Gingivo-Stomatite chronique féline: état des lieux des connaissances. Bulletin de l’Academie Veterinaire de France, 2022.
CAMY, G.; FAHRENKRUG, P.; GRACIS, M.; Proposed guidelines on the management of feline chronic gingivostomatitis (FCGS) syndrome: A consensus statement. Consultation version September 19th European Congress of Veterinary Dentistry (ECVD), p. 23-25, 2010.
DIEHL, K.; ROSYCHUK, R. A. W. Feline gingivitis-stomatitis-pharyngitis. Veterinary Clinics of North America: Small Animal Practice, v. 23, n. 1, p. 139-153, 1993.
FARCAS, N. et al. Dental radiographic findings in cats with chronic gingivostomatitis (2002-2012). Journal of the American Animal Hospital Association, v. 244 n. 3:p. 339–345, 2014.
FRIED, W. A. et al. Use of unbiased metagenomic and transcriptomic analyses to investigate the association between feline calicivirus and feline chronic gingivostomatitis in domestic cats. American journal of veterinary research, v. 82, n. 5, p. 381-394, 2021.
HARLEY, R.; GRUFFYDD-JONES, T. J.; DAY, M. J. Immunohistochemical characterization of oral mucosal lesions in cats with chronic gingivostomatitis. Journal of comparative pathology, v. 144, n. 4, p. 239-250, 2010.
HENNET, C. E. Chronic gingiva-stomatitis in cats: long-term follow-up of 30 cases by dental extrations. Journal of Veterinay Dentistry, v. 14, n.1, p.14-21, 1997.
Improve international, p. 210-236, 2016.
JAEGER, G. T. et al. Double-blind, placebocontroleed trial of the pain-relieving effetcs of the impantation of gold beads into dogs with hip dysplasia. Veterinary Record. v. 158, n. 21, p. 722-726, 2006.
JÚNIOR, G.; ALBERTO, C. Avaliação da ocorrência do calicivírus felino e do herpesvírus felino tipo 1 em gatos com gengivite-estomatite crônicas naturalmente infectados pelo vírus da imunodeficiência felina. Tese de Doutorado. Universidade de São Paulo, 2010.
KRUMBECK, J. A. et al. Characterization of Oral Microbiota in Cats: Novel Insights on the Potential Role of Fungi in Feline Chronic Gingivostomatitis. Pathogens, v.10, ed.904, p.1-5, 2021.
LEE, D. B.; VERSTRAETE, F. J. M.; ARZI, B. An update on feline chronic gingivostomatitis. Veterinary Clinics: Small Animal Practice, v. 50, n. 5, p. 973-982, 2020.
LEWIS, J. R.; TSUGAWA, A. J.; REITER, A. M. Use of CO2 Laser as an Adjunctive Treatment for Caudal Stomatitis in a Cat. Journal of veterinary dentistry, v. 24, n. 4, 2007.
LOMMER, M. J.; VERSTRAETE, F. J. M. Concurrent oral shedding of feline calicivirus and herpesvirus 1 in cats with chronic gingivostomatitis. Oral Microbiology and Immunology, San Francisco, v.18, p.131-34; 2003.
LYON, K. F. Gingivostomatitis. Veterinary Clinics: Small Animal Practice, v. 35, n. 4, p. 891-911, 2005.
MIRANDA, K. M.; FREITAS, E. S. Relação entre o complexo gengivo-estomatite (GECF) e o vírus da imunodeficiência felina (FIV) e vírus da leucemia felina (FeLV), 2021.
NIEMIEC, B. A. Veterinary Periodontology. John Wiley & Sons, 2013.
NIZA, M. M. R. E.; MESTRINHO, L. A.; VIELA, C. L. Gengivo-estomatite crónica felina – um desafio. Revista Portuguesa de Ciências Veterinárias, v. 99, p. 127-25; 2004.
OLDER, C. E. et al. Influence of the FIV Status and Chronic Gingivitis on Feline Oral Microbiota. Pathogens, v. 9, 2020.
OLIVEIRA, J. R. A. Avaliação retrospectiva do tratamento de gengivoestomatite crônica felina em 80 casos clínicos. Dissertação de mestrado integrado em Medicina Veterinária – Universidade de Lisboa, Faculdade de Medicina Veterinária.Lisboa, 87 p., 2017.
PEREGO, E. S. et al. Complexo de gengivo-estomatite felina – revisão literária. Brazilian Journal of Animal and Environmental Research, 2020.
QUIMBY, J. M. et al. Evaluation of the association of Bartonella species, feline herpesvirus 1, feline calicivirus, feline leukemia virus and feline imunodeficiency virus with chronic feline gingivostomatitis. Journal of Feline Medicine and Surgery, v. 10, n. 1, p. 66-72, 2008.
RAIZER, L. M.; PINTO, L. J. C.; CHUCRI, T. M. Correlação do complexo gengivite-estomatite felina com o vírus da imunodeficiência felina: Revisão. PUBVET, v. 16, p. 183, 2021.
REITER, A. M. et al. Domestic feline oral and dental diseases. Wiggs’s Veterinary Dentistry: Principles and Practice, p. 439-461, 2019.
ROLIM, V. M. et al. Clinical, pathological, immunohistochemical and molecular characterization of feline chronic gingivostomatitis. Journal of Feline Medicine and Surgery, v. 19, n. 4, p. 403-409, 2017.
ROVEREDO, C. D. Tratamento do complexo-gengivite-estomatite-faringite felino com implantes de ouro: estudo clínico piloto. Dissertação de Mestrado, Universidade Lusófona de Humanidades e Tecnologias, Faculdade de Medicina Veterinária, 67 p., 2017.
SANTIAGO, M. P. K.; COTA, J. M. Complexo gengivite-estomatite-faringite linfoplasmocitária em felino – Relato de Caso, 2020.
SILVA, M. A. L. Avaliação retrospectiva da resposta ao tratamento cirúrgico da gengivoestomatite crónica em gatos infetados com o vírus da leucemia felina. Tese de Doutorado. Universidade de Lisboa, Faculdade de Medicina Veterinária, 2021.
SOUSA FILHO, R. F. et al. Feline gingivo stomatitis. Revista Brasileira de Higiene e Sanidade Animal, v.11, n. 2, 2017.
SOUSA, M. L. S. Complexo gengivite-estomatite-faringite em felino – Relato de caso. 2022.
SQUARZONI, P. et al. NIR Laser Therapy in the Management of Feline Stomatitis. SM Dermatology Journal, v. 3, n. 3, p. 1021, 2017.
1Docente, Departamento de Medicina Veterinária, Universidade Estadual de Maringá
2Docente, Departamento de Medicina Veterinária, Universidade Estadual de Maringá
