KAPPAPHYCUS ALVAREZZI SEAWEED FLOUR CARRAGEENAN: EXTRACTION AND CHARACTERIZATION
REGISTRO DOI: 10.5281/zenodo.8067611
Ionara Paula Lupatini 1
Luana Yasmin Locatelli2
Leandro Couto da Silva3
Matheus Antonio da Costa4
Cárin Fabíola Pensin5
Kelly Cristina Massarolo6
RESUMO
A Kappaphycus alvarezii é uma macroalga vermelha muito utilizada para obtenção de biofertilizantes e carragena. As algas são submetidas a processo físico para obtenção dos biofertilizantes, e são gerados subprodutos secos que contém carragena. A carragena é um polissacarídeo com ampla aplicação como espessante, gelificante, emulsificante e estabilizante na indústria de alimentos e farmacêutica. O objetivo do trabalho foi otimizar o método convencional de extração de carragena da alga Kappaphycus alvarezii e caracterizar o produto. Para isso, os subprodutos sólidos das algas, do processo de biofertilizantes, foram primeiramente caracterizados em relação a composição proximal e depois submetidos a extração de carragena pelo método convencional e por métodos experimentais. Nos experimentos foram modificadas variáveis nas etapas de branqueamento e secagem no processo de extração alcalino a frio, e avaliado a etapa de gelificação e remoção de água pelo processo de congelamento e descongelamento. Inicialmente, foi determinado a composição proximal da farinha de alga, e a caracterização das carragenas extraídas do subproduto da alga e comerciais foi realizada através da análise de FTIR e análise quantitativa de grupamento 3,6-anidro D-galactose. A farinha de alga apresentou 33,0% de cinzas, 11,8% de umidade, 0,5% de lipídios, 4,6% de proteínas e 50,1% de carboidrato. Os teores de 3,6-anidro D-galactose da k-carragena refinada comercial (45,7%) e das amostras dos testes 1 (extração convencional) (46,0%), 3 (42,2%), 4 (43,5%), 5 (41,5%) e 7 (38,8%) não apresentaram diferença significativa (p>0,05). A análise por FTIR demonstrou que todas as bandas geradas apresentam características de k-carragena, exceto o teste 4. Portanto, foi possível reduzir em 60h o processo de extração de carragena do subproduto de alga e obter produto com características de k-carragena refinada.
Palavras-chave: grupamento D-galactose, otimização de extração, polissacarídeo.
ABSTRACT
Kappaphycus alvarezii is a red macroalgae widely used to obtain biofertilizers and carrageenan. The algae are submitted to a mechanical process to obtain biofertilizers, and dry waste containing carrageenan is generated. Carrageenan is a polysaccharide widely used as a thickener, gelling agent, emulsifier and stabilizer in the food and pharmaceutical industries. The objective of this work was to optimize the conventional method of extracting carrageenan from the seaweed Kappaphycus alvarezii and to characterize the product. For this, the solid residues of algae, from the biofertilizer process, were first characterized in relation to the proximal composition and then subjected to carrageenan extraction by the conventional method and by experimental methods. In the experiments, variables were modified in the bleaching and drying steps in the cold alkaline extraction process, and the gelation and water removal step by the freezing and thawing process was evaluated. Initially, the proximal composition of the seaweed flour was determined, and the characterization of the carrageenans extracted from the seaweed residue and commercial ones was carried out through FTIR analysis and quantitative analysis of the 3,6-anhydrous D-galactose group. Seaweed flour had 33.0% ash, 11.8% moisture, 0.5% lipids, 4.6% proteins and 50.1% carbohydrates. The levels of 3,6-anhydrous D-galactose in commercial refined k-carrageenan (45.7%) and in test samples 1 (conventional extraction) (46.0%), 3 (42.2%), 4 (43.5%), 5 (41.5%) and 7 (38.8%) showed no significant difference (p>0.05). FTIR analysis showed that all bands generated had k-carrageenan characteristics, except for test 4. Therefore, it was possible to reduce the carrageenan extraction process from seaweed residue by 60 hours and obtain a product with refined k-carrageenan characteristics.
Keywords: D-galactose group, extraction optimization, polysaccaharide
1. Introdução
A macro alga vermelha Kappaphycus alvarezii é a mais cultivada no mundo, sendo a principal matéria-prima para a produção de k-carragena (FAO, 2018). Além disso, essa alga apresenta vitaminas, fibras, minerais, cerca de 3,3% de proteínas e baixo teor de gordura (RUDKE; DE ANDRADE; FERREIRA, 2020).
Em 2018, a produção mundial de algas marinhas alcançou a marca de 32,4 milhões de toneladas (FAO, 2020), no Brasil uma produção de 700 toneladas da Kappaphycus alvarezii, sendo que o cultivo em escala comercial desta macroalga foi introduzido pioneiramente no Rio de Janeiro em 2002 e em 2021 foi autorizado o cultivo em Santa Catarina pelo IBAMA, se tornando uma alternativa rentável para maricultores da região (PANORAMA DA AQUICULTURA, 2020).
O extrato da alga Kappaphycus alvarezii vem sendo utilizado como biofertilizante (GELLI et al., 2020) e o processo de obtenção desse extrato gera um sólido que contém carragena, um polissacarídeo linear sulfatado constituído por subunidades de β-D-galactose e 3,6-α-anidro-D-galactose, classificada de acordo com a posição e o número de grupos sulfato (PEREIRA, 2004). Carragena é um aditivo amplamente utilizado na indústria alimentícia como espessante, geleificante, emulsificante e estabilizante (RANGANAYAKI; SUSMITHA; VIJAYARAGHAVAN, 2014), na indústria farmacêutica como excipiente de medicamentos, devido a sua excelente compatibilidade e viscoelasticidade durante a compressão (CAMPO et al., 2009).
A carragena pode ser obtida como produto refinado ou semi-refinado. A refinada apresenta um gel claro, transparente com alto grau de pureza, já a semi-refinada é de baixo grau de pureza, se caracteriza por um gel opaco, com a presença de celulose e fibra. Os métodos empregados para extração de carragena refinada são processos complexos e caros, existem atualmente três métodos empregados sendo eles: drum drying, precipitação por álcool e gel press, onde a carragena é extraída da alga quando aquecida em água, sendo o resíduo removido por filtração e a carragena recuperada da solução por precipitação com álcool ou por congelamento e descongelamento (ADITIVOS & INGREDIENTES, 2011).
Com a intenção de reduzir os custos da extração, foi desenvolvido o processo de extração de carragena semi-refinada, conhecida como farinha de algas marinhas (ADITIVOS & INGREDIENTES, 2011). O processo de produção consiste em lavar as algas para remover compostos solúveis em solução alcalina e água, deixando a carragena e outras matérias insolúveis na estrutura do talo. O resíduo insolúvel, composto por carragena e celulose, é seco e moído para obtenção da carragena semi-refinada (MCHUGH, 2003).
As carragenas são diferenciadas de outros hidrocolóides por conter 3,6 anidro galactose e o número e posição dos grupos de éster sulfato, avaliando grupos funcionais através da espectroscopia no infravermelho com transformada de Fourier (FTIR) para identificar e caracterizar as carragenas. (MONTOLALU et al., 2008; ADITIVOS & INGREDIENTES, 2011).
Algumas características reológicas são afetadas pelos diferentes parâmetros, tais como temperatura, tempo e tratamentos utilizados nos processos de extração da carragena (MUÑOZ; FREILE-PELEGRÍN; ROBLEDO, 2004; HAYASHI; PAULA; CHOW, 2007a; HAYASHI et al., 2007b; REIS; YONESHIGUE-VALENTIN; DOS SANTOS, 2008; HUNG et al., 2009; PEREIRA et al., 2009a).
Visto que, as algas Kappaphycus alvarezii são utilizadas para a obtenção de biofertilizantes, e nesse processo gera um resíduo que pode conter alto teor de micro e macronutrientes (LAYEK, 2015), dentre eles carragena (HAYASHI, 2001; PEREIRA, 2004), otimizar métodos de extração de carragena desse subproduto é viável para melhorar o aproveitamento desse recurso natural e reduzir tempo de extração. Além disso, a caracterização das carragenas obtidas devem ser avaliados para evidenciar a possibilidade de aproveitamento deste subproduto para produção de carragena. Portanto, este trabalho teve como objetivo avaliar diferentes métodos de extração de carragena da alga Kappaphicus alvarezii, desidratada após obtenção de biofertilizantes, e avaliar as características dos produtos.
2. Material e métodos
2.1 Material
As algas vermelhas, utilizadas para extração da carragena, pertencem à espécie Kappaphycus alvarezii. O subproduto da alga seca foi disponibilizado por uma empresa situada no litoral sul do Rio de Janeiro, Brasil. A amostra (farinha de alga) passou por um processo de moagem e peneiramento para obter uma granulometria uniforme e padronizada com tamanho de partículas menores que 2 mm. A amostra utilizada como padrão de k-carragena refinada foi fornecida pela empresa IFF – International Flavors & Fragrances.
2.2 Extração convencional de carragena
A extração convencional de carragena é baseada em um tratamento alcalino a frio, seguido de um tratamento alcalino a quente e por fim extração aquosa (Figura 1). Para isso, inicialmente a amostra (20 g) foi hidratada com água por 1 h. Em seguida, foi adicionado uma solução de KOH 6%, e ficou em repouso em temperatura ambiente por 24 h. Após, a solução de KOH foi removida e a amostra foi exposta ao sol por 24 h para o branqueamento. Na sequência, a amostra foi lavada com água corrente até pH ± 8 e seca em estufa a 45 ºC até a massa constante. Esse tratamento foi identificado como tratamento alcalino a frio.
Em seguida, a amostra seca do tratamento alcalino a frio recebeu o tratamento alcalino a quente, onde a amostra foi novamente hidratada com água por 1 h, e depois foi adicionado uma solução de KOH 6%, onde ficou por mais 1 h. Posterior, a amostra permaneceu sob agitação por 2 h a temperatura de 80 ºC, na sequência foi realizada a lavagem da amostra em água corrente até pH ± 8, e secagem em estufa a 45 ºC/60 °C.
Após esses dois pré-tratamentos, foi realizada a extração aquosa para obtenção da carragena, no qual a amostra foi novamente hidratada por 1 h, em seguida foi processada com água para obter uma pasta, e realizada a extração sob agitação por 2 h à 80 ºC.
Posteriormente, a amostra foi filtrada, e ao filtrado foi adicionado KCl 0,2% para geleificação, e agitado por 15 min. Por fim, foi realizado o congelamento e descongelamento da amostra duas vezes para remoção da água e a secagem foi conduzida em estufa a 45 ºC por 12 h, na sequência, a temperatura foi aumentada para 60 ºC para secagem até a massa constante.
Figura 1: Fluxograma das etapas de extração convencional de carragena
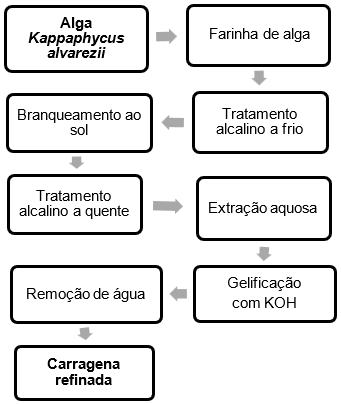
Fonte: Autores, 2023
2.3 Otimização do método de extração de carragena
Para otimizar o método foram conduzidos 7 testes de extração alterando a etapa de branqueamento e secagem da amostra no tratamento alcalino a frio, e avaliado a etapa de gelificação (adição de KCl 0,2%) e remoção de água pelo processo de congelamento e descongelamento, para reduzir o tempo de extração, conforme demonstrado na tabela 1.
Tabela 1 – Condições de otimização de extração de carragena da farinha de alga
Teste Branqueamento Secagem tratamento a frio Secagem tratamento a quente Gelificação Remoção água extração aquosa Secagem 1* Sol Sim Sim Sim Sim Estufa 2 Estufa Não Não Não Não Estufa 3 Estufa Sim Não Sim Sim Leito fluidizado 4 Estufa Sim Não Sim Não Estufa 5 Estufa Não Não Sim Sim Estufa 6 Estufa Não Não Não Sim Estufa 7 Sol Não Não Sim Sim Estufa
Fonte: Autores, 2023. *Processo convencional de extração de carragena refinada.
O teste 1 foi conduzido de acordo com a extração convencional, já o teste 2 a etapa de branqueamento foi substituída pela secagem em estufa, não foi realizada a secagem entre uma etapa e outra e também não foram realizadas as etapas de gelificação e remoção de água por congelamento. Nos testes 3 e 4 foi realizada a secagem da amostra ao final do tratamento alcalino a frio, a amostra não foi seca entre as etapas de tratamento alcalino a quente, porém no teste 3 foi realizado a etapa de gelificação e congelamento da amostra e secagem em leito fluidizado e no teste 4 foi realizada somente a etapa de gelificação, não realizando a remoção da água pelo processo de congelamento e descongelamento e secagem em estufa.
Os testes 5 e 6 foram conduzidos juntos, somente alterando a etapa de gelificação, no qual o teste 5 foi realizado a gelificação e o teste 6 não foi adicionado o KCl, as demais etapas foram as mesmas. O teste 7 foi realizado o branqueamento ao sol conforme teste 1, e não foram realizadas as etapas de secagem após os dois tratamentos, já o processo de gelificação e remoção de água foram mantidas, e realizada a secagem em estufa para obter o produto final. As amostras de carragenas obtidas foram analisadas conforme descrito na caracterização da carragena.
2.4 Caracterização da carragena
2.4.1 Composição proximal
O teor de umidade, cinzas totais, lipídios e proteínas (fator de conversão 6,25) da farinha de alga foi determinado de acordo com as metodologias descritas no Instituto Adolf Lutz (IAL, 2008) e Association Of Official Analytical Chemists (AOAC, 2000) e o teor de carboidratos determinado por diferença. As amostras foram trituradas a fim da redução do tamanho de partículas e todas as análises foram realizadas em triplicata.
2.4.2 Determinação de 3,6-anidro D-galactose
Para determinação de 3,6-anidro D-galactose das amostras de carragena extraída pelos diferentes métodos, foi utilizado frutose como padrão e construída uma curva de 0,02 à 0,06 mg/mL, a partir de uma solução estoque de 1 mg/mL. Foi pesado 100 mg de cada amostra em tubo Falcon, adicionado 40 mL de água destilada, hidrolisado em banho maria a 95 ºC até solubilização completa. Após resfriamento, o volume foi completado para 50 mL, em seguida, 2 mL da solução foi transferido para outro tubo e adicionado 1,5 mL de água, 0,25 mL de solução de Timol 5% e 2,5 mL de cloreto férrico 0,5%. Os tubos foram tampados, homogeneizados e levados ao banho maria a 80 ºC por 13 minutos. As amostras foram então resfriadas rapidamente em banho de gelo e adicionado 5 mL de etanol 96%, e homogeneizado novamente. A leitura foi realizada em espectrofotômetro da marca Kasvi, modelo K37-UVVis, em comprimento de onda de 635 nm (HAYASHI, 2001).
2.4.3 FTIR
As amostras de carragena obtidas pelos 5 métodos de extração e padrão comercial de k-carragena foram caracterizadas por espectrometria no Infravermelho por Transformada de Fourier – FTIR, com resolução 4 cm-1, na faixa de 4000 – 650 cm-1.
Todas as amostras, sólidas e secas, foram colocadas diretamente no equipamento e os espectros obtidos foram analisados com o software OriginPro 7.0. O espectro da k-carragena refinada comercial e das amostras obtidas pelos diferentes métodos de extração foram avaliados para identificar e caracterizar as carragenas (REYES, 2016, ANVISA, 2019).
3. Resultados e discussões
3.1 Composição proximal da farinha de alga
A farinha de alga apresentou teores de 33,0% de cinzas, 11,8% de umidade, 0,5% de lipídios, 4,6% de proteínas e 50,1% de carboidratos. Altos teores de cinzas podem ser em virtude desta alga não ter recebido nenhum processamento de lavagem. Esse processo que consiste em uma série de lavagens com água destilada permite a retirada de aproximadamente 75% dos sais que constituem as cinzas do produto (FAYAZ et al, 2005). Os teores lipídios (0,5%) demonstram que as algas marinhas apresentam baixo teor lipídico podendo ser um bom alimento alinhado à uma dieta de consumo de baixas calorias, e quanto às proteínas, os teores foram de 4,6%, valores interessantes para utilização dessa matéria-prima.
Em relação aos carboidratos, o farelo apresentou cerca de 50,1%, valores similares aos verificados no estudo de Rudke et al. (2020), 50,8 % de carboidratos. Esses valores demonstram que esse subproduto de alga apresenta carragena, já que a mesma é um carboidrato. Além disso, outro carboidrato presente em algas é a celulose (ADITIVOS & INGREDIENTES, 2011).
Os resultados de composição do subproduto de alga são similar aos verificado por Ariffin et al. (2017), o qual evidenciou teores de 2,5-5,7% para proteínas, 6,9-7,3% de umidade, 0,5-2,6 de lipídios e 29,4-30,9% de cinzas, mostrando que são boas fontes de proteínas, ricas em fibras e baixo teor de gorduras (BRASIL, 2014).
3.2 Otimização do processo de extração
O tempo necessário para obtenção de carragena refinada pelo método convencional é de aproximadamente 128 h. Com a proposta de otimização do processo de extração, foi possível reduzir o tempo em aproximadamente 60 h para obtenção do produto de interesse. Porém, algumas etapas são importantes para obtenção de carragena refinada do tipo kappa, sendo a etapa de gelificação essencial, pois a kappa é sensível ao íon potássio, resultando em géis mais rígidos. Isso pode ser observado nos testes 2 e 6, nos quais não foram realizadas a etapa de gelificação, e o produto final após secagem apresentou características de plástico, possivelmente celulose, componente presente nas algas (AI, 2022, HAYASHI, 2001).
O processo de branqueamento ao sol tem por finalidade branquear as amostras a fim de ter maior aceitação do consumidor. Essa etapa é viável quando aplicado em escala laboratorial. A proposta de avaliação da substituição do sol pela estufa foi para aplicação em escala industrial, e apresentou-se favorável, pois houve o branqueamento, além disso pode ser realizado com grandes quantidades e as condições climáticas não interferem no processo.
3.3 Determinação de 3,6-anidro D-galactose
Os testes 2 e 6 não foram avaliados em relação ao teor de galactose, devido a sua aparência de plástico após o processo de extração. Nas amostras de k-carragena refinada (padrão), da extração convencional (Teste 1) e as amostras resultantes do processo otimizado de extração (Testes 3, 4, 5 e 7) foram determinados o teor de galactose.
Conforme AI (2022), a carragena tipo kappa contém 28% a 35% de 3,6-anidro-galactose. As amostras analisadas apresentaram resultados próximos, porém maiores que a literatura. A amostra comercial obteve 45,7%, já as amostras dos testes 1, 3, 4, 5 e 7 obteve 46,0%, 42,2%, 43,5%, 41,5% e 38,8%, respectivamente. A diferença dos resultados obtidos com a literatura pode ser devido a diferença no método utilizado. No entanto, a análise estatística de todas as amostras demonstrou que não houve diferença significativa entre elas (p>0,05).
3.4 FTIR
A espectroscopia de FTIR é uma técnica fácil de executar, com a finalidade de caracterizar as estruturas de determinada amostra (PRADO-FERNÁNDES et al., 2003). A tabela 2, descreve as principais características estruturais das carragenas do tipo lambda, iota e kappa.
Tabela 2: Absorbâncias de espectros de infravermelho das diferentes carragenas
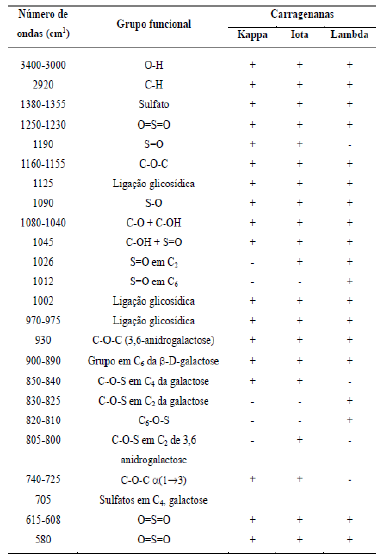
Fonte: PRADO-FERNÁNDES et al. (2003)
Os testes 2 e 6 também não foram realizados análise no FTIR, devido a sua aparência de plástico após o processo de extração. Os espectros gerados das diferentes amostras e padrão de k-carragena refinada podem ser observados na figura 2. Entre 1200-1250 observa-se banda característica de grupo éster sulfato (1), entre 900- 950 observa-se uma banda bem definida, característica de 3-6 anidro-galactose (2), seguida de uma banda característica de β-D-galactose-4-sulfato entre 850-900 (3) e outra banda entre 840-850, característico de 3,6-anidrogalactose-4-sulfato (4), e em 805 uma banda característica de 3,6 anidrogalactose-2-sulfato (5) (GÓMEZ-ORDÓÑEZ, RUPÉREZ, 2011). Portanto, todas as bandas geradas apresentam características de k- carragena. No entanto, o teste 4 não apresenta banda 1 e nem a 5, e a 2, 3 e 4 bem menos intensa.
O teste 4 apresentou a maior porcentagem de galactose, porém o seu espectro FTIR teve menor intensidade em algumas bandas no qual podemos caracterizar como k-carragena, isso demonstra a necessidade da etapa de remoção de água pelo processo de congelamento/descongelamento, visto que esse teste 4 foi o único que não foi realizada essa etapa (Tabela 1).
Figura 2: Espectros de infravermelho da carragena extraída da farinha de alga Kappaphycus alvarezii.
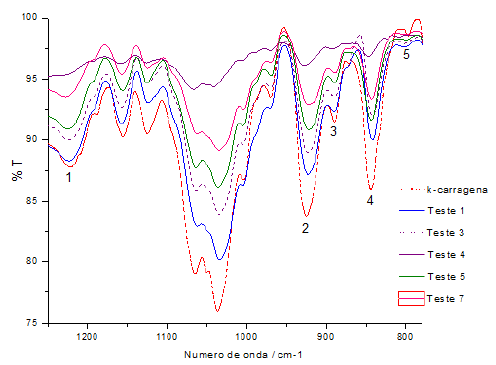
Fonte: Autores, 2023.
Portanto, pode-se evidenciar que a etapa de branqueamento ao sol do método convencional pode ser substituída pela secagem em estufa, que as etapas de secagem entre os tratamentos a frio e a quente não são necessárias, e as etapas de geleificação e remoção de água por congelamento/descongelamento são necessários para a obtenção de k-carragena.
Além disso, foi demonstrado que o subproduto da alga Kappaphycus alvarezii proveniente da obtenção de biofertilizantes, é a uma matéria-prima promissora para a obtenção de k-carragena.
CONCLUSÃO
As etapas da extração como geleificação e remoção de água por congelamento/descongelamento são essenciais para a obtenção de k-carragena refinada, e outras etapas como branqueamento e secagem entre os tratamentos podem ser retiradas do processo, contribuindo assim para redução do processo de extração em aproximadamente 60h. Como essas condições de extração foi possível obter k-carragena refinada, a qual foi confirmada pelas bandas características e teor de galactose similar a amostra padrão de k-carragena refinada.
Os resultados servem de subsídio para os desenvolvimentos de novas pesquisas, a fim de avaliar a aplicação das carragenas extraídas em diferentes produtos.
REFERÊNCIAS
AI – ADITIVOS INGREDIENTES. Os principais tipos comerciais de carragenas, 2011.
ANVISA, Farmacopéia Brasileira, 6ª ed. Brasilia, 2019.
AOAC: Association of official analytical chemists. OFFICIAL Methods of Analysis of Aoac International. 17th etd., AOAC International, Arlington, 2000.
ARIFFIN, FARAH DIYANA et al. Kandungan Makronutrien Rumpai Laut Merah
Kappaphycus alvarezii dan Kappaphycus striatum. Jurnal Sains Kesihatan Malaysia, v. 15, n. 2, p. 19-27, 2017.
BRASIL. MINISTÉRIO DA SAÚDE. Agência Nacional de Vigilância Sanitária. Guia
alimentar para a população brasileira. Brasília: Ministério da Saúde, 2. ed., 2014.
BILLING, S. L., ROSTAN, J., TETT, P., & MACLEOD, A. Is social license to operate relevant for seaweed cultivation in Europe? Aquaculture, v. 534, p. 736203, 2021.
CAMPO, V. L.; KAWANO, D. F.; SILVA, D. B.; CARVALHO, I. Carrageenans: biological properties, chemical modifications and structural analysis – a review. Carbohydrate Polymers, v. 77, n. 2, p. 167-180, 2009.
FAO, Food and Agriculture Organization of The United Nations. Aquaculture. 2018.
FAO, Food and Agriculture Organization of the United Nations. The state of world fisheries and aquaculture: Sustainability in Action. Rome, 2020.
FAYAZ, M. et al. Chemical Composition, Iron Bioavailability, and Antioxidant Activityof Kappaphycus alvarezii (Doty). Journal of Agricultural and Food Chemistry, p. 792 – 797, v. 53, 2005.
GELLI, V. C.; PATINO, M. T. O.; ROCHA, J. V.; BARBIERI, E.; MIRANDA-FILHO, K. C.; HENRIQUES, M. B. Production of the Kappaphycus alvarezii extract as a leaf biofertilizer: technical and economic analysis for the north coast of São Paulo-Brazil. Instituto de Pesca. 2020.
GÓMEZ-ORDÓÑEZ, E., RUPÉREZ, P., FTIR-ATR spectroscopy as a tool for polysaccharide identification in edible brown and red seaweeds,Food Hydrocolloids 25 1514e1520, 2011.
HAYASHI, L. Extração, teor e propriedades de carragena deKappaphycus alvarezii (Doty) Dotyex P. Silva, em cultivo experimental em Ubatuba, SP. São Paulo – SP, 2001.
HUNG, L.D.; HORI, K.; NANG, H.Q.; KHA, T.; HOA, L.T. Seasonal changes in growth rate, carrageenan yield and lectin content in the red alga Kappaphycus alvarezii cultivated in Camranh Bay, Vietnam. Journal of Applied Phycology, v.21, p.265-272, 2009.
IAL- Instituto Adolfo Lutz, Métodos físico-químicos para análise de alimentos, São Paulo, 2008
LAYEK, J.; DAS, A.; RAMKRUSHNA, G. I.; TRIVEDI, K.; YESURAJ, D.; CHANDRAMOHAN, M.; KUBAVAT, D.; AGARWAL, P. K.; GHOSH, A. Seaweed sap: a sustainable way to improve productivity of maize in North-East India. International Journal of Environmental Studies, 2015.
MCHUGH D.J. 2003. A guide to the seaweed industry. FAO Fisheries Technical Paper. Food and Agriculture Organization of the United Nations, Rome. 105pp
MONTOLALU, R.I.; TASHIRO, Y.; MATSUKAWA, S.; OGAWA, H. Effects of extraction parameters on gel properties of carrageenan from Kappaphycusalvarezii(Rhodophyta). Journal of Applied Phycology, v.20, p.525-526, 2008.
MUÑOZ, J. FREILE-PELEGRÍN, Y.; ROBLEDO, D. Mariculture of Kappaphycusalvarezii(Rhodophyta, Solieriaceae) color strains in tropical waters of Yucatán, México. Aquaculture, v.239, p.161-177, 2004.
PANORAMA DA AQUICULTURA. Depois do Rio de Janeiro e São Paulo, IBAMA permite o cultivo de Kappaphycus alvarezii no litoral de Santa Catarina. 2020.
PEREIRA, L. C. R. T. Estudos em macroalgas carragenófitas (Gigartinales, Rhodophyceae) da costa portuguesa – aspectos ecológicos, bioquímicos e citológicos. 2004. 325 p. Dissertação (Doutorado em Biologia) – Universidade de Coimbra, Coimbra, 2004.
PRADO-FERNÁNDEZ, J.; RODRÍGUEZ-VÁZQUEZ, J.A.; TOJO, E.; ANDRADE, J.M.; Quantitation of κ-, ι-, and λ-carrageenans by midinfrared spectroscopy and PLS regression. AnalyticaChimicaActa, v.480, p.23-37, 2003.
RANGANAYAKI, P.; SUSMITHA, S.; VIJAYARAGHAVAN, R. Study on metabolic compounds of Kappaphycus alvarezii and its in vitro analysis of anti-inflammatory activity. International Journal of Current Research and Academy. Review, v. 2, n. 10, p.157-166, 2014.
REYES, B. B. Caracterização e seleção de carragena comercial para aplicação em produto cárneo. Medianeira – PR,2016.
REIS, R.P.; YONESHIGUE-VALENTIN, Y.; DOS SANTOS, C.P. Spatialand temporal variationofHypneamusciformiscarrageenan (Rhodophyta – Gigartinales) from natural beds in Rio de Janeiro State, Brazil. Journal of Applied Phycology, v.20, p.1-8, 2008.
RUDKE, A. R.; DE ANDRADE, C. J.; FERREIRA, S. R. S. Kappaphycus alvarezii
macroalgae: An unexplored and valuable biomass for green biorefinery conversion. Trends in Food Science & Technology, v. 103, p. 214–224, 1 set. 2020.
1http://lattes.cnpq.br/4622602619028921
Afiliação Institucional: Descomplica Uniamérica Centro Universitário – Campus Biopark, Toledo-PR, Brasil
E-mail: lupatiniionara@gmail.com
2http://lattes.cnpq.br/7196133732556998
Afiliação Institucional: Descomplica Uniamérica Centro Universitário – Campus Biopark, Toledo-PR, Brasil
E-mail: luanalocatelli877@gmail.com
3http://lattes.cnpq.br/7208029245870086
Afiliação Institucional: Universidade Estadual do Oeste do Paraná – Unioeste Campus Toledo, Toledo-PR, Brasil
E-mail: leandro.c.s2@hotmail.com
4http://lattes.cnpq.br/3782309953762651
Afiliação Institucional: Universidade Estadual do Oeste do Paraná – Unioeste Campus Cascavel, Brasil
E-mail: matheus.costa@bioalgas.com.br
5http://lattes.cnpq.br/2725299207088799
Afiliação Institucional: Associação de Ensino, Pesquisa e Extensão – Biopark, Toledo-PR, Brasil
E-mail: carin.pensin@bpkedu.com.br
6http://lattes.cnpq.br/6589826002452203
Afiliação Institucional: Associação de Ensino, Pesquisa e Extensão – Biopark, Toledo-PR, Brasil
E-mail: kelly.massarolo@bpkedu.com.br
