MICROBIOLOGICAL CHARACTERIZATION OF BLOOD CULTURES IN NEONATES IN THE ICU OF A PUBLIC MATERNITY HOSPITAL IN CAMPINA GRANDE-PB
REGISTRO DOI: 10.69849/revistaft/cs10202502150158
Maria Lorenna Pessoa Fonsêca1
Rebeca Estefani de Oliveira Andrade Siqueira1
Jhonatan Siqueira do Nascimento1
Carlos Daniel de Araújo2
Italo Freitas Pereira3
Tiago Rafael Catão Ferreira4
Heronides dos Santos Pereira5
Patrícia Maria de Freitas e Silva5
Resumo
O diagnóstico precoce de septicemia numa UTI neonatal é fundamental na sobrevida dos neonatos. O presente trabalho objetivou realizar hemoculturas e avaliar o perfil de resistência das bactérias encontradas em recém-nascidos (RN) internados na UTI de uma maternidade pública em Campina Grande-PB sob CEP-UEPB nº 6.179.878/2023. Em 2023, 200 amostras sanguíneas de 186 neonatos foram estudadas. O maior número de solicitações para hemoculturas estava relacionado aos RN com nascimento prematuro (21%), seguidos daqueles em uso de procedimentos invasivos (18%). Foi encontrado crescimento bacteriano em 24% das amostras. Destas, foram isoladas bactérias Gram-positivas (80%) e Gram-negativas (20%), principalmente em RN com idade de 0-5 dias (46%) do sexo masculino (57,52%). Quanto às bactérias isoladas, houve prevalência de Staphylococcus coagulase negativa, seguido de Staphylococcus aureus e Staphylococcus aureus resistente à meticilina/oxacilina (MRSA). Quanto ao uso prévio de antibióticos, 51,50% dos neonatos não faziam uso de antibióticos no momento da coleta sanguínea. Porém, entre os neonatos positivados, 43,75% estavam em uso de antibióticos escolhidos empiricamente. Na UTI estudada, antes de se optar pela utilização de antibióticos de última escolha como carbapenêmicos e vancomicina, os antibiogramas realizados permitiram inferir que, em casos de antibioticoterapia empírica, os antibióticos indicados deveriam ser amoxicilina+clavulanato (Gram-positivos) e ciprofloxacino (Gram-negativos) por apresentarem menor perfil de resistência.
Palavras-chave: Sepse neonatal. Hemocultura. Antibioticoterapia. Resistência bacteriana.
Abstract
Early diagnosis of septicemia in a neonatal ICU is essential for the survival of newborns. This study aimed to perform blood cultures and evaluate the resistance profile of bacteria found in newborns (NBs) admitted to the ICU of a public maternity hospital in Campina Grande-PB under CEP-UEPB nº 6.179.878/2023. In 2023, 200 blood samples from 186 neonates were studied. The highest number of requests for blood cultures was related to newborns with premature birth (21%), followed by those undergoing invasive procedures (18%). Bacterial growth was found in 24% of the samples. Of these, Gram-positive (80%) and Gram-negative (20%) bacteria were isolated, mainly in newborns aged 0-5 days (46%) of the male sex (57.52%). Regarding the isolated bacteria, there was a prevalence of coagulase-negative Staphylococcus, followed by Staphylococcus aureus and methicillin/oxacillin-resistant Staphylococcus aureus (MRSA). Regarding the previous use of antibiotics, 51.50% of the neonates were not using antibiotics at the time of blood collection. However, among the positive neonates, 43.75% were using empirically chosen antibiotics. In the studied ICU, before opting for the use of last-choice antibiotics such as carbapenems and vancomycin, the antibiograms performed allowed us to infer that, in cases of empirical antibiotic therapy, the indicated antibiotics should be amoxicillin+clavulanate (Gram-positive) and ciprofloxacin (Gram-negative) because they have a lower resistance profile.
Keywords: Neonatal sepsis. Blood culture. Antibiotic therapy. Bacterial resistance.
1. INTRODUÇÃO
A sepse é um problema de saúde global, sendo a principal causa de óbito em pacientes neonatos internados em UTIs em todo o mundo. O diagnóstico precoce é um fator determinante para o sucesso do tratamento (SILVA & SOUSA, 2018).
Neste contexto, a hemocultura é considerada o “padrão-ouro” para diagnóstico de sepse, permitindo isolamento de patógenos microbianos como também fornecer o perfil de sensibilidade do microrganismo ao antimicrobiano, que é a chave para o tratamento adequado do paciente (SOUZA et al., 2019). Os hospitais devem realizar hemoculturas em neonatos para diagnosticar a sepse, mesmo sem sinais clínicos, evitando complicações fatais.
A sepse neonatal divide-se em: precoce ou tardia. A primeira manifesta-se até 48 horas de vida, neonatos infectam-se em período periparto, antes ou durante o parto, e a infecção é passada de mãe para o filho. A sepse neonatal tardia está ligada a fatores pós-natais, frequentemente ocorre pela transmissão horizontal, por fatores ambientais ou nosocomiais (MALAQUIAS et al., 2022).
Os principais agentes etiológicos da sepse precoce são: Streptococcus agalactiae, Escherichia coli e Listeria monocytogenes. Os agentes etiológicos da sepse tardia são bactérias Gram-positivas como Staphylococcus aureus, Staphylococcus coagulase-negativo, Enterococos; Bactérias Gram-negativas como Escherichia coli, Klebisiella pneumoniae, Enterobacter, Serratia, Pseudomonas e fungos como Candida (EBSERH, 2019).
Para obtenção de resultados precisos em hemoculturas, a fase pré-analítica do exame deve seguir os padrões de biossegurança para evitar contaminação durante a coleta, prevenindo resultados falso-positivos. (PRATES & COZAC, 2021).
Os resultados falso-negativos também impactam a saúde dos pacientes. Isso ocorre, principalmente, quando a antibioticoterapia é iniciada antes da coleta da amostra para realização do exame (SILVEIRA et al., 2020).
Este trabalho visa detectar, a partir de hemoculturas, neonatos com sepse internados na UTI de uma maternidade pública em Campina Grande – PB, a fim de contribuir para terapêutica eficaz do paciente, evitando o uso indiscriminado de antibióticos sem a devida testagem laboratorial prévia.
2. METODOLOGIA
2.1. Tipo de pesquisa
Tratou-se de uma abordagem quali-quantitativa com estudo transversal através de pesquisa descritiva, participativa e exploratória.
2.2. População e Amostra
Participaram do estudo 186 neonatos de ambos os gêneros, com idades de 0 a 65 dias de vida e que estavam internados na UTI neonatal da maternidade pública da cidade de Campina Grande-PB. Foram recolhidas 200 amostras de sangue para análises de hemocultura.
2.3. Dados obtidos
A coleta de dados foi realizada a partir de amostras sanguíneas coletadas e fichas aplicadas na maternidade que continham dados dos pacientes: data da coleta, gênero, idade, data de nascimento, uso de antibióticos, identificação do antibiótico em uso, justificativa da coleta, caso clínico do paciente, setor e leito de internação, responsável pela coleta e requisição de exame.
2.4. Hemocultura
As amostras de sangue coletadas dos neonatos na maternidade eram encaminhadas à UEPB em frascos específicos para hemocultura de recém-nascidos. Fichas com os dados dos pacientes devidamente preenchidos também eram entregues.
As hemoculturas foram realizadas através de semeios diários dos frascos de hemoculturas por 7 dias em placas de agar Sangue, agar Manitol Salgado, agar EMB (Kasvi) que eram incubadas em estufas bacteriológicas em temperatura de 35-37 ºC por 18-24 horas. As amostras semeadas em agar Chocolate (Kasvi) eram submetidas a atmosfera de microaerofilia. As leituras das placas eram realizadas diariamente até o sétimo dia ou até ocorrer crescimento bacteriano.
Laudos eram liberados para a maternidade dependendo da ausência ou presença de crescimento bacteriano. Havia três modelos de laudos: laudo parcial (3 dias de negatividade), laudo final para ausência de crescimento bacteriano (7 dias de negatividade) e laudo final positivo contendo antibiograma, conforme os resultados das hemoculturas.
2.5. Teste de sensibilidade aos antimicrobianos
As bactérias isoladas e identificadas foram submetidas a testes de sensibilidade aos antimicrobianos pelo método de Kirby-Bauer, segundo os padrões recomendados pelo BrCAST. Eram testados antibióticos em placas contendo meio de cultura agar Mueller Hinton (Kasvi). Os antibióticos testados para Gram-positivas eram: Amicacina, Amoxicilina, Amoxicilina + Clavulanato, Ampicilina, Azitromicina, Cefaclor, Cefalexina, Cefalotina, Cefalotina, Cefazolina, Cefepime, Cefoxitina, Cefuroxima, Ciprofloxacino, Clindomicina, Cloranfenicol, Eritromicina, Gentamicina, Imipenem, Linezolida, Meropenem, Oxacilina, Penicilina, Sulfametoxazol + trimethoprim, Teicoplanina, Tetraciclina, Vancomicina. Para as Gram-negativas: Amicacina, Amoxicilina, Amoxicilina + Clavulanato, Ampicilina, Aztreonam, Cefaclor, Cefalexina, Cefalotina, Cefazolina, Cefepime, Cefotaxima, Cefoxitina, Ceftazidima, Ceftriaxona, Cefuroxima, Ciprofloxacino, Gentamicina, Imipenem, Meropenem, Penicilina, Piperacilina Tazobactam, Sulfametoxazol + trimethoprim, Tobramicina.
2.6. Testes de identificação
Havendo crescimento bacteriano, provas de identificação das bactérias eram realizadas. Para bactérias crescidas no agar Manitol Salgado (Gram-positivas), era realizado o teste da Coagulase, com a finalidade de identificar Staphylococcus aureus. Para as bactérias Gram-negativas, eram realizadas provas bioquímicas cujos resultados identificavam espécie e gênero da bactéria. As provas bioquímicas foram realizadas em: agar TSI, Lisina, Ureia, SIM, MIO, Citrato e Fenilalanina.
2.7. Considerações éticas
O trabalho foi submetido ao Comitê de Ética em Pesquisa da Universidade Estadual da Paraíba. Do ponto de vista normativo, a pesquisa seguiu as normas propostas pela resolução 466/12 do Conselho Nacional de Saúde (CNS) envolvendo pesquisa em seres humanos. Aprovado em 13/07/2023 sob o número 6.179.878.
3. RESULTADOS E DISCUSSÕES
No ano de 2023, foram realizadas hemoculturas de 200 amostras clínicas de 186 neonatos que apresentaram sintomas característicos de septicemia internados na UTI de uma maternidade pública na cidade de Campina Grande – PB.
Figura 1 – Motivos para solicitações médicas para hemoculturas de neonatos da UTI de uma maternidade pública de Campina Grande-PB.
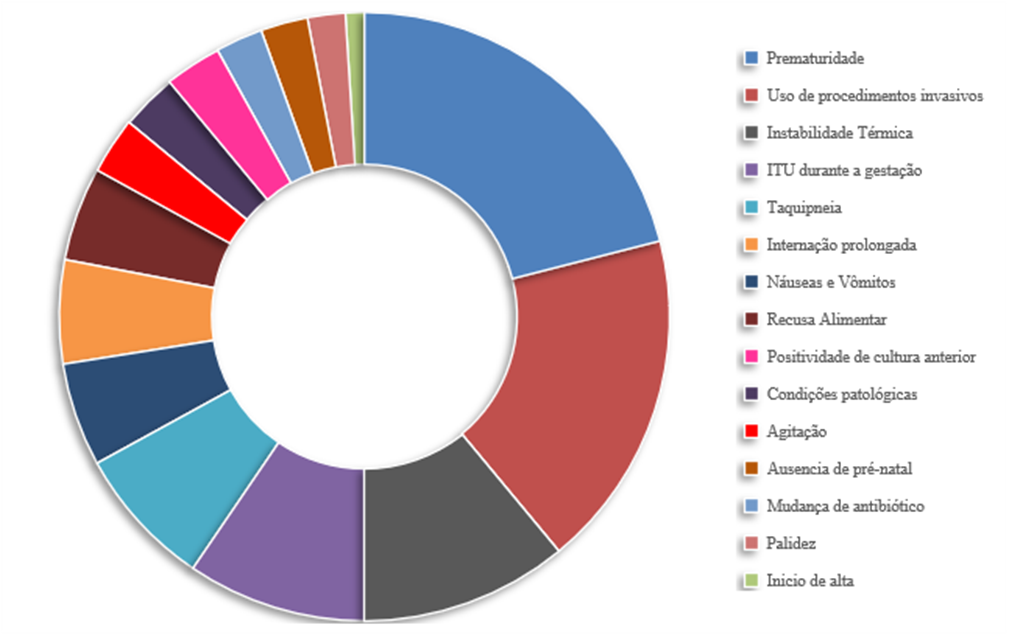
Fonte: Dados do autor, 2023.
Na Figura 1, estão demonstradas as motivações para solicitação das hemoculturas dos neonatos internados. O maior número de solicitações para hemoculturas estava relacionado aos recém-nascidos (RN) com nascimento prematuro (21%), seguidos daqueles em uso de procedimentos invasivos (18%), instabilidade térmica (11%), Infecção do Trato Urinário (ITU) materno durante a gestação (10%), taquipneia (7,5%), internação prolongada em ambiente hospitalar (6%), náuseas e vômitos (5,5%), recusa alimentar (5%), positividade em culturas anteriores (3%), condições patológicas como pneumonia e cardiopatia (3%), agitação (3%), ausência de pré-natal (2%), mudança de antibióticos (2%), palidez (2%) e inicio de alta para o paciente (1%). De modo semelhante, o autor Kim et al. (2020) em seu trabalho relata os sintomas característicos para sepse, entre eles: febre, letargia, taquipneia e recusa alimentar.
A prematuridade emerge como um dos fatores de risco para a sepse neonatal. Isto se deve à imaturidade fisiológica e imunológica dos recém-nascidos, tornando-os suscetíveis a infecções (SILVA, PEREIRA & OLIVEIRA, 2023).
Entre as principais razões para a solicitação de amostras para hemocultura na maternidade desta pesquisa, destacam-se os neonatos que passam por procedimentos invasivos como o uso de cateteres, ventilação mecânica e nutrição parenteral. Segundo a pesquisa de Feil et al. (2018) realizada com neonatos internados na UTIN do Hospital Santa Cruz, no Rio Grande do Sul, foi observada uma maior incidência de sepse neonatal em prematuros de baixo peso, especialmente naqueles submetidos a procedimentos invasivos e/ou que apresentavam longos períodos de internação. Portanto, destaca-se a relevância da coleta de hemoculturas em recém-nascidos com esses fatores de risco, a fim de investigar possíveis casos de septicemia oriundos de infecções por meio destes procedimentos.
Segundo Gabardo, Scheidemantel & Nisihara (2022), a Infecção do Trato Urinário (ITU) materna é um grande fator de risco para sepse neonatal. Em pesquisa realizada em Curitiba, os autores citados analisaram os fatores de risco de 304 RN assintomáticos e com suspeita de sepse neonatal e destes, 41 (13,5%) apresentaram sepse ocasionados por ITU durante a gestação.
Figura 2 – Idade dos neonatos que realizaram hemocultura em uma UTIN em maternidade pública de Campina Grande-PB.
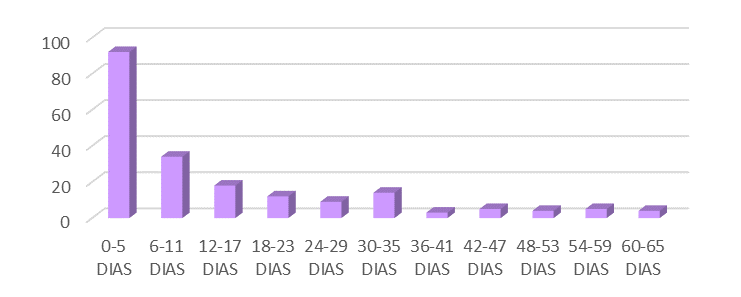
Fonte: Dados do autor, 2023.
Na Figura 2 estão demonstradas as faixas etárias dos neonatos internados na UTIN cujas hemoculturas foram coletadas no período estudado. Foram avaliados pacientes com até 65 dias. Houve maior solicitação de hemoculturas para neonatos na faixa etária entre 0-5 dias (46%), seguidos de 6-11 dias (17%), 12-17 dias (9%), 30-35 dias (7%), 18-23 dias (6%), 24-29 dias (4,5%), 42-47 dias (2,5%), 54-59 dias (2,5%), 60-65 dias (2%), 48-53 dias (2%) e 36-41 dias (1,5%).
Aguiar et al. (2021), analisou 1.114 neonatos que vieram a óbito por sepse, na faixa etária entre 0 e 27 dias de vida e, concluiu que os recém-nascidos de 1 a 6 dias de vida apresentaram maior prevalência entre as mortes por sepse (44,7%), seguidos da faixa etária 7 a 13 dias (26,4%). Isto demonstra a razão da maior solicitação de hemoculturas nos primeiros dias de vida no presente estudo.
Figura 3 – Caracterização do gênero dos neonatos que realizaram hemocultura internados em UTIN de uma maternidade pública em Campina Grande-PB.
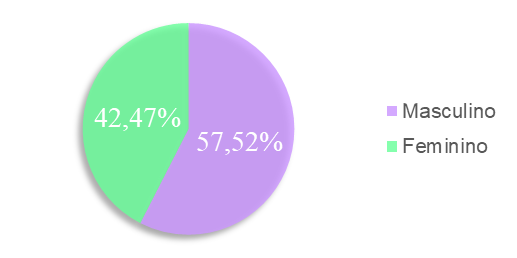
Fonte: Dados do autor, 2023.
Na Figura 3, observa-se maior incidência do gênero masculino com 57,52% dos casos das hemoculturas realizadas, enquanto o gênero feminino apresenta 42,47% dos casos.
Um estudo realizado na Universidade do Sul de Santa Catarina, por Gmach (2018), foram analisados 85 prontuários de pacientes internados na UTI neonatal, no período de 3 anos, tendo sido observado maior prevalência do gênero masculino com 51,8%, seguido de 48,2% do gênero feminino.
Segundo Cardoso e Castro (2021), em estudos realizados em Brasília, 433 neonatos internados na UTI preencheram critérios para sepse neonatal, concluindo-se predominância do gênero masculino com 54,73% enquanto o feminino com 45,27%, corroborando com estudos anteriores que também demonstraram uma maior prevalência deste grupo.
A prevalência entre os gêneros feminino e masculino é atribuída à genética e aos hormônios biológicos, destacando que uma das razões pelas quais as pessoas do gênero feminino tendem a sobreviver mais que as do gênero masculino estão relacionados à presença do segundo cromossomo X e à atuação do estrogênio, um dos hormônios mais proeminentes no organismo feminino, capaz de proteger os vasos sanguíneos e fortalecer o sistema imunológico contra diversas doenças. Em contraste, no gênero masculino, a testosterona hormonal aumenta o risco de desenvolver condições fatais (ZARULLI et al., 2018).
Figura 4 – Positividade de hemoculturas da UTI neonatal e sua distribuição entre Sepse Precoce e Sepse Tardia em uma maternidade pública em Campina Grande-PB.
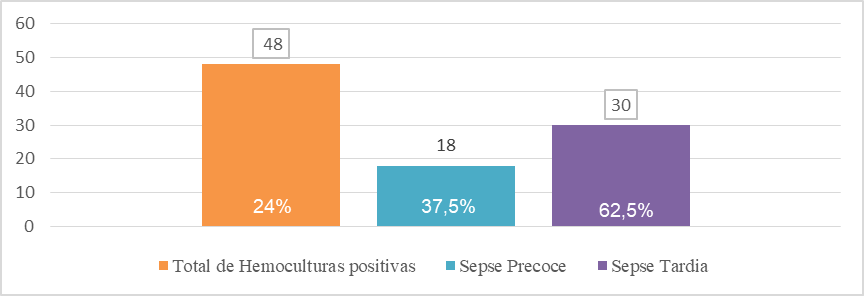
Fonte: Dados do autor, 2023.
De 200 amostras de hemoculturas coletadas da UTIN, 48 (24%) apresentaram crescimento bacteriano, sendo consideradas positivas para septicemias, enquanto 152 (76%) das hemoculturas apresentaram resultado negativo. As hemoculturas positivas estão divididas entre os neonatos portadores de Sepse Precoce (até os 3 primeiros dias de vida) (37,5%) e de Sepse Tardia (após 3 dias de vida) (62,5%) (Figura 4).
Em uma pesquisa realizada por Mulinganya et al. (2021), em Bukavu, foram analisadas 150 amostras de neonatos suspeitos de sepse. Dentre as amostras, 48 pacientes (32%) apresentaram hemoculturas positivas, resultados que se assemelham ao presente estudo. Outro estudo, conduzido por Lima (2022), em uma maternidade do Rio Grande do Norte, incluía 2.067 amostras clínicas de neonatos da UTIN, e resultou em 262 (12,68%) casos positivos e 1.805 (87,32%) negativos. Assim, de acordo com a literatura, pode-se notar que, embora ocorra suspeita da ocorrência de septicemia nos neonatos, considerando o número elevado de hemoculturas solicitadas, a predominância é de hemoculturas negativas.
No estudo realizado por Yusef et al. (2018), na Universidade de Ciência e Tecnologia da Jordânia, foram analisados 68 prontuários de neonatos que se encaixavam em casos de sepse. Dentre estes, 18 (28%) foram classificados como sepse precoce e 49 (72%) como sepse tardia, corroborando o maior número de casos de sepse tardia.
Figura 5 – Bactérias isoladas de hemoculturas da UTIN de uma maternidade pública em Campina Grande-PB no ano de 2023.
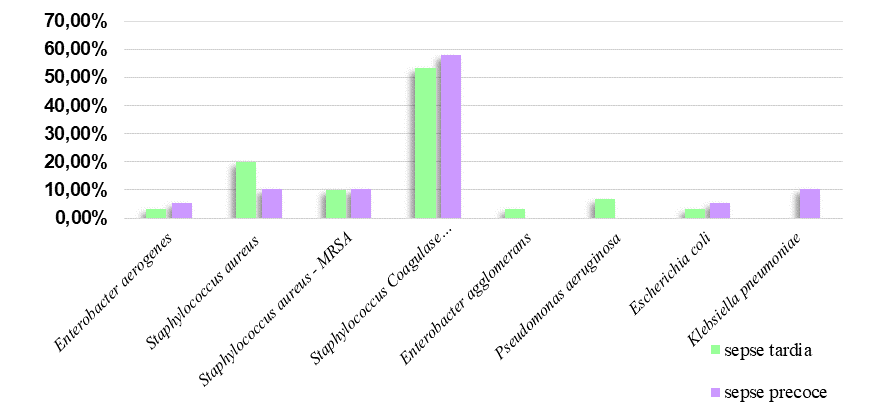
Fonte: Dados do autor, 2023.
A Figura 5 demonstra as espécies bacterianas isoladas das hemoculturas considerando sepse precoce e sepse tardia. Foram encontradas 50 cepas, distribuídas entre os dois tipos de sepse. Na Sepse Precoce, as cepas encontradas foram: Enterobacter aerogenes (5,27%), Escherichia coli (5,27%), Klebsiella pneumoniae (10,52%), Staphylococcus aureus (10,52%), Staphylococcus aureus resistentes à meticilina/oxacilina – MRSA (10,52%) e Staphylococcus coagulase negativa (57,89%). Já na Sepse Tardia foram encontradas: Enterobacter aerogenes (3,36%), Enterobacter agglomerans (3,36%), Escherichia coli (3,36%), Pseudomonas aeruginosa (6,66%), Staphylococcus aureus (20%), Staphylococcus aureus resistentes à meticilina/oxacilina – MRSA (10%) e Staphylococcus coagulase negativa (53,33%).
Neste estudo, Staphylococcus coagulase negativa foi amplamente predominante em ambos os tipos de sepse (média de 55,61%). Da mesma maneira que na pesquisa de Takeshita et al. (2019), na qual Staphylococcus coagulase negativa também foi o patógeno mais comumente isolado com 16,70%.
Em um estudo realizado por Nemvar, Havaei & Douraghi (2017), foram isoladas 183 amostras de Staphylococcus coagulase negativa, sendo a maioria da corrente sanguínea e destes, apenas 40 (21,85%) tinham associação com infecção. Os altos índices de contaminação podem ser atribuídos ao fato de que este microrganismo faz parte da microbiota da pele, porém, se torna particularmente relevante e oportunista em pacientes imunodeprimidos na UTI, especialmente quando são realizados procedimentos invasivos (BARROS, 2021).
Na presente pesquisa, ressalta-se maior prevalência de Staphylococcus coagulase negativa (53,33%) e uma menor prevalência de Escherichia coli (3,36%). De mesmo modo, de acordo com os estudos de Feil et al. (2018), os microrganismos presentes em maior frequência na sepse tardia são Staphylococcus coagulase negativa (35,71%), Enterobacter spp. (12,86%), Pseudomonas (10%), Staphylococcus aureus (8,57%) e menor prevalência para Escherichia coli (1,43%).
Tabela 1 – Perfil de resistência de Staphylococcus isolados em hemoculturas realizadas em neonatos da UTIN de uma maternidade pública de Campina Grande-PB, no ano de 2023.
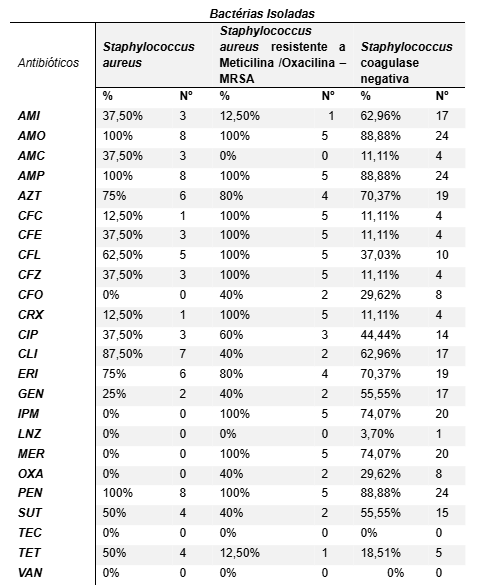
LEGENDA: AMI – Amicacina | AMO – Amoxicilina | AMC – Amoxicilina + Clavulanato | AMP – Ampicilina | AZT – Azitromicina | CFC – Cefaclor | CFE – Cefalexina | CFL – Cefalotina | CFZ – Cefazolina | CFO – Cefoxitina | CRX – Cefuroxima | CIP – Ciprofloxacino | CLI – Clindamicina | ERI – Eritromicina | GEN – Gentamicina | IPM – Imipenem | LNZ – Linezolida | MER – Meropenem | OXA – Oxacilina | PEN – Penicilina | SUT – Sulfametoxazol + trimetoprim | TEC – Teicoplanina | TET – Tetraciclina | VAN – Vancomicina.
Fonte: Dados do autor, 2023.
A Tabela 1 apresenta o perfil de resistência dos Staphylococcus, S. aureus resistentes à meticilina/oxacilina – MRSA, Staphylococcus coagulase negativa a uma variedade de antibióticos testados durante a pesquisa.
Dos isolados de Staphylococcus aureus, 100% foram resistentes a amoxicilina, ampicilina e penicilina, 87,50% a clindamicina, 75% a azitromicina e eritromicina, 62,50% a cefalotina, 50% a sulfametoxazol+trimetoprim e tetraciclina, 37,50% a cefalexina, cefazolina, amoxicilina + clavulanato, amicacina e ciprofloxacino, 25% a gentamicina, 12,50% a cefuroxima e cefaclor, em ordem decrescente. Não houve resistência (0%) ao cloranfenicol, imipenem, meropenem, teicoplanina, oxacilina, cefoxitina, linezolida e vancomicina.
Dos isolados de Staphylococcus aureus resistentes à meticilina/oxacilina – MRSA, houve 100% de resistência a amoxicilina, ampicilina, cefalexina, imipenem, cefalotina, meropenem, cefazolina, cefuroxima, cefaclor e penicilina, 80% a eritromicina e azitromicina, 60% a ciprofloxacino, 40% a cefoxitina, oxacilina, sulfametoxazol+trimetoprim, clindamicina, gentamicina, 12,50% a amicacina e a tetraciclina. Não houve resistência nenhuma (0%) a linezolida, amoxicilina+clavulanato, teicoplanina e vancomicina.
Dos isolados de Staphylococcus coagulase negativa, 88,88% foram resistentes à amoxicilina, ampicilina e penicilina, 74,07% a imipenem e meropenem, 70,37% a eritromicina e azitromicina, 62,96% a clindamicina e amicacina, 55,55% a gentamicina e sulfametoxazol+trimetoprim, 44,44% a ciprofloxacino, 37,03% a cefalotina, 29,62% a cefoxitina e oxacilina, 18,51% a tetraciclina, 11,11% a cefalexina, cefazolina, cefaclor, cefuroxima e amoxicilina+clavulanato e 3,70% a linezolida. Não houve resistência a teicoplanina nem a vancomicina.
Com base nas considerações de Brenno, Cunha & Teixeira (2022), Staphylococcus aureus é um patógeno frequentemente associado a infecções hospitalares. Entre as cepas de S. aureus, aquelas que são resistentes à meticilina/oxacilina (MRSA) vêm aumentando ao longo dos anos. Como evidência em sua pesquisa, das 95 amostras analisadas, 37 (38,9%) foram identificadas como MRSA.
Na pesquisa realizada por Silva et al. (2020), em Pernambuco, com relação ao perfil de resistência das S. aureus, pôde-se encontrar 100% de resistência a azitromicina, 75% a eritromicina e penicilina e 25% a ciprofloxacino e gentamicina. Esses resultados se assemelham ao da presente pesquisa, no qual houve 100% de resistência a penicilina, 75% a eritromicina e azitromicina e 25% a gentamicina.
Em casos de suspeita de septicemia, iniciar a antibioticoterapia empírica é crucial para reduzir riscos à vida do paciente. Porém, é essencial coletar amostras de sangue para cultura imediatamente antes do início da antibioticoterapia e, depois, quando for liberado o resultado do antibiograma, confrontar os resultados com os antibióticos utilizados. Conhecer o perfil de sensibilidade dos microrganismos na instituição é fundamental para o desenvolvimento de protocolos de terapia antimicrobiana. Evita-se assim, trocas frequentes de antibióticos e associações desnecessárias (BOAVENTURA et al., 2022).
Tabela 2 – Perfil de resistência de bactérias Gram-negativas isoladas em hemoculturas realizadas em neonatos da UTIN de uma maternidade pública de Campina Grande-PB em 2023.
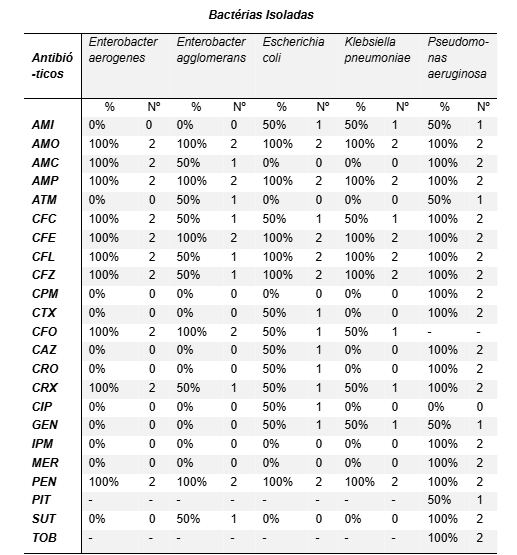
LEGENDA: AMI – Amicacina | AMO – Amoxicilina | AMC – Amoxicilina + Clavulanato | AMP – Ampicilina | AZT – Azitromicina | CFC – Cefaclor | CFE – Cefalexina | CFL – Cefalotina | CFZ – Cefazolina | CFO – Cefoxitina | CRX – Cefuroxima | CIP – Ciprofloxacino | CLI – Clindamicina | ERI – Eritromicina | GEN – Gentamicina | IPM – Imipenem | LNZ – Linezolida | MER – Meropenem | OXA – Oxacilina | PEN – Penicilina | SUT – Sulfametoxazol + trimetoprim | TEC – Teicoplanina | TET – Tetraciclina | VAN – Vancomicina.
Fonte: Dados do autor, 2023.
A Tabela 2 apresenta o perfil de resistência das bactérias Gram-negativas frente a uma variedade de antibióticos testados.
Dos isolados de Enterobacter aerogenes, 100% foram resistentes a amoxacilina+clavulanato, ampicilina, cefalotina, cefazolina, cefuroxima, cefaclor, penicilina, amoxacilina, cefalexina e a cefoxitina. Não houve resistência a amicacina, aztreonam, ceftazidima, ceftriaxona, ciprofloxacino, imipenem, sulfametoxazol+trimetoprim, cefepime, gentamicina, meropenem e cefotaxima, sendo assim, a linha terapêutica mais eficaz contra a espécie.
Dos isolados de Enterobacter agglomerans, 100% foram resistentes à ampicilina, cefalexina, cefoxitina, penicilina e amoxacilina, 50% a amoxacilina+clavulanato, aztreonam, cefalotina, sulfametoxazol+trimetoprim, cefazolina, cefuroxima e cafaclor. Não houve resistência a amicacina, ceftazidima, ceftriaxona, ciprofloxacino, imipenem, cefepime, gentamicina, meropenem e cefotaxima.
Dos isolados de Pseudomonas aeroginosa, 100% foram resistentes a amoxicilina+clavulanato, ampicilina, cefalexina, ceftazidima, ceftriaxona, imipenem, cefalotina, sulfametoxazol+trimetoprim, cefepime, meropenem, cefazolina, cefuroxima, cefaclor, penicilina, cefotaxima, amoxicilina e tobramicina, enquanto 50% a amicacina, aztreonam, gentamicina e piperacilina tazobactam. Não houve resistência a cefoxitina e ciprofloxacino.
Dos isolados de Escherichia coli, 100% foram resistentes a ampicilina, cefalexina, cefalotina, cefazolina, penicilina e amoxicilina, 50% a amicacina, ceftazidima, ceftriaxona, ciprofloxacino, gentamicina, cefuroxima, cefaclor, cefotaxima e cefoxitina. Não houve resistência a amoxicilina+clavulanato, aztreonam, imipenem, sulfametoxazol+trimetoprim, cefepime e meropenem.
E, por fim, dos isolados de Klebsiella pneumoniae, 100% foram resistentes a ampicilina, cefalexina, cefalotina, cefazolina, penicilina e amoxicilina, 50% a amicacina, cefoxitina, gentamicina, cefuroxima e cefaclor. Não houve resistência a amoxicilina+clavulanato, aztreonam, ceftazidima, ceftriaxona, ciprofloxacino, imipenem, sulfametoxazol+trimetoprim, cefepime, meropenem e cefotaxima.
Em consonância com o perfil de resistência da E. coli e K. pneumoniae identificado neste estudo, destaca-se a pesquisa de Andrade et al. (2021), realizado em Pernambuco, na qual foi identificado o perfil de resistência da E. coli com 100% de resistência à ampicilina e 80% de resistência à ceftriaxona, enquanto nenhuma resistência foi observada a imipenem e meropenem. No caso da K. pneumoniae, foi constatada uma taxa de resistência de 100% à ampicilina, mas nenhuma resistência foi identificada em relação a imipenem.
Ogushi (2022) demonstrou um perfil de resistência de 46,66% a Piperacilina Tazobactam. Esses resultados são semelhantes aos encontrados nesta pesquisa, nos quais a resistência da P. aeruginosa para Piperacilina Tazobactam foi de 50% e para Ceftazidima (100%).
Tabela 3 – Uso Prévio de Antibióticos em Neonatos no Momento da Coleta em uma maternidade pública em Campina Grande-PB.

Fonte: Dados do autor, 2023.
A Tabela 3 demonstra o uso prévio de antibióticos no momento da coleta em neonatos internados na UTIN da maternidade.
Das 200 amostras de hemocultura analisadas pela pesquisa, 97 (48,50%) correspondiam a recém-nascidos tratados previamente com antibióticos. Nesse grupo, observou-se uma positividade para crescimento bacteriano em 21 (10,50%) amostras, enquanto 76 (38%) apresentaram negatividade.
Embora a diferença seja sutil, a maioria das 200 amostras analisadas (51,50%) não estava em tratamento com antibióticos durante a coleta. Dentro desse grupo, houve crescimento bacteriano em 13,50% das amostras e ausência de crescimento em 38%.
No total, 48 amostras foram positivas para crescimento bacteriano, distribuídas entre neonatos em tratamento (10,50%) e aqueles sem tratamento (13,50%) com antibioticoterapia empírica.
Comparativamente, um estudo realizado por Salinas, Torres & Viana (2021) no Paraguai, que incluiu 57 pacientes com sepse internados na UTI, indicou que 15 (26,3%) estavam em uso prévio de antibióticos durante a coleta, enquanto 42 (73,7%) não faziam uso prévio. Assim como neste estudo, a maioria dos neonatos não estava em antibioticoterapia empírica.
Destaca-se uma maior positividade entre os neonatos sem uso de antibióticos no momento da coleta, aumentando as chances de isolar o patógeno. O início do uso de antibióticos antes da hemocultura desfavorece o isolamento bacteriano, inibindo seu crescimento e, consequentemente, comprometendo a identificação de uma possível septicemia. No entanto, em situações urgentes de hospitalização, como pneumonia e cardiopatias, o uso empírico de antibióticos pode ser necessário (MARINHO et al., 2020).
Esta pesquisa reforça a relevância da caracterização de sensibilidade e resistência aos antimicrobianos como uma ferramenta fundamental na abordagem clínica, permitindo a seleção de antibióticos específicos. A realização de antibiogramas é a chave para o tratamento correto e desempenhou um papel importante na adaptação do tratamento de cada paciente, visando a terapêutica adequada, o que garante a sobrevida dos neonatos (SOUSA et al. 2019).
4. CONCLUSÃO
Em casos de septicemia em neonatos em UTIs, a antibioticoterapia empírica de amplo espectro deve ser iniciada precocemente, o que nem sempre garante sucesso terapêutico. Daí a importância da coleta sanguínea para hemocultura antes do início da administração do antibiótico de forma a garantir um respaldo para o tratamento, caso haja necessidade de troca do antibiótico. Na UTIN estudada, os antibiogramas realizados das hemoculturas permitiram inferir que, em casos de necessidade de antibioticoterapia empírica, os antibióticos indicados seriam amoxicilina+clavulanato (para Gram-positivos) e ciprofloxacino (para Gram-negativos) por terem apresentado o mais adequado perfil de resistência aos antimicrobianos (16,20% e 10%, respectivamente), antes da utilização de antibióticos de última escolha como carbapenêmicos e vancomicina.
A aplicação deste modelo de estudo se faz necessário periodicamente neste e em outros serviços de saúde para evidenciar a realidade epidemiológica quanto a presença das infecções sistêmicas que atingem os neonatos, ratificando a importância de um protocolo de vigilância.
REFERÊNCIAS
AGUIAR, K, V, C, S.; SOUZA, G, K, O.; RABELO, M, F.; CARVALHO, J, J.; SAMPAIO, T, F.; SABA, J, M, B.; et al. Aspectos epidemiológicos dos óbitos por sepse neonatal no Estado da Bahia. Revista Eletrônica Acervo Saúde, v. 13, n. 6, p. 8, 2021.
ANDRADE, C. W. D. Q.; SILVA, K. S. B.; SANTANA, M. M. R.; OLIVEIRA, A. V. D.; GUIMARÃES, M. D.; NAUE, C. R. Etiologia e resistência de isolados bacterianos de hemoculturas da Sala de Cuidados Intermediários de um Hospital Universitário em Pernambuco. Research, Society and Development, v. 10, n. 7, p. 1-10, 2021.
BARROS, I. F.; SANTOS, M. F. R. D.; DE LIMA, J. F.; VALE, P. A. P. D.; NUNES, L. E. Infecções Por Staphylococcus Coagulase Negativa e o seu impacto nas IRAS. Revista Multidisciplinar em Saúde, v. 2, n. 2, p. 20, 2021.
BOAVENTURA, A.; SANTOS, I. D.; GOUVEIA, E.; CASELA, M. Perfil de sensibilidade e adequação do protocolo de antibioticoterapia empírica para pacientes com sepse em um hospital especializado em trauma do estado da Bahia. The Brazilian Journal of Infectious Diseases, v. 26, n. 1, p. 15, 2022.
BRENNO, G. D. L.; CUNHA, M. D. L. R. D.; TEIXEIRA, N. B. Avaliação de multirresistência e prevalência de MRSA e tipos de sccmec em Staphylococcus aureus isolados de hemoculturas. The Brazilian Journal of Infectious Diseases, v. 26, p. 52, 2022.
CARDOSO, L, R.; CASTRO, N, A, V. Sepse neonatal precoce: perfil clínico e epidemiológico dos pacientes incluídos em um protocolo de sepse neonatal. 36f. Tese (Iniciação Cientifica) – Centro universitário de Brasília – CEUB. Brasília, 2021.
EBSERH, Empresa Brasileira de Serviços Hospitalares. Protocolo Clínico: condutas médicas na Sepse Neonatal Precoce e Tardia, 2019.
FEIL, A. C.; KURTZ, T.; ABREU, P. D. O.; ZANOTTO, J. C.; et al. Sepse tardia em Unidade de Tratamento Intensivo Neonatal. Revista de Epidemiologia e Controle de Infecção, v. 8, n. 4, p. 450-456, 2018.
GABARDO, L. A.; SCHEIDEMANTEL, L, P; NISIHARA, R, M. O Desafio da Sepse Precoce em Recém-Nascidos Assintomáticos. Rev. AMRIGS, v. 66, n. 3, p. 788–793, 2022.
GMACH, J, C. Prevalência bacteriana e perfil de sensibilidade a antimicrobianos em culturas de uma unidade de terapia intensiva neonatal. 2018. 25f. Tese (Graduação em Medicina) – Faculdade do Sul de Santa Catarina. Tubarão, Santa Catarina, 2018.
KIM, F.; POLIN, R. A.; HOOVEN, T. A. Neonatal sepsis. BMJ, p. 3672–3672, 2020.
LIMA, C, A, C, N, R, A. Prevalência e perfil de resistência de isolados bacterianos de hemoculturas de recém-nascidos em unidade de terapia intensiva neonatal da maternidade escola Januário Cicco. 38 f. Monografia (Graduação em Biomedicina) – Universidade Federal do Rio Grande do Norte. Natal, Rio Grande do Norte, 2022.
MALAQUIAS, C. F. V; ARAÚJO, M. A; DONATO, C. S; SILVA, G. F. R; BELO, F. F. R; DINIZ, M. L. P; et al. Fatores de risco da sepse neonatal tardia: uma revisão narrativa. Revista Eletrônica Acervo Saúde, v. 15, n. 2, p. 01-05, 2022.
MARINHO, A. M. D. S.; AMARAL, A. S. D.; SANTOS, D. F. A.; PAULA, R. G. D. Protocolos Médico-Assistenciais em Neonatologia do Hospital e Maternidade Dona Regina. v. 2. Goiânia: Kelps, 2020.
MULINGANYA, G. M.; CLAEYS, M.; BALOLEBWAMI, S, Z.; BAMULEKE, B, A.; MONGANE, J, I.; BOELENS, J.; et al. Etiology of Early-Onset Neonatal Sepsis and Antibiotic Resistance in Bukavu, Democratic Republic of the Congo. Clinical Infectious Diseases, v. 73, n. 4, p. 976-980, 2021.
NEMVAR, A. E.; HAVAEI, S. A.; DOURAGHI, M. Caracterização molecular de isolados de Staphylococcus epidermidis Recuperados de pacientes internados em um hospital de referência no Irã. Arch Clin Infect Dis, v. 12, n.2, p. 2-5, 2017.
OGUSHI, C. F. Pseudomonas aeruginosa e Acinetobacter baumanni: perfil antimicrobiano atual das duas principais espécies de bacilos Gram negativos não fermentadores de glicose causadores de infecção em UTIS. 2022. 19f. Monografia (Graduação em Biomedicina) – Universidade Anhembi Morumbi, São Paulo, 2022.
PRATES, I. C. R; COZAS, E. E. Perfil Epidemiológico e o Gerenciamento do Uso Racional de Antibióticos na UTI Neonatal da Santa Casa de Anápolis. Brazilian Journal of Development. Curitiba, v.7, n.10, p. 98598, 2021.
SILVA, A. P. R. M; SOUSA, H. V. Sepse: importância da identificação precoce pela enfermagem. Revista Pró-UniverSUS, v. 9, n. 1, p. 97-100, 2018.
SILVA, C. F. E.; GONÇALVES, G. R.; SILVA, K. S. B.; LIMA, R. S. D.; NAUE, C. R. Perfil bacteriano de hemoculturas coletadas em pacientes internados na unidade de terapia intensiva de um hospital universitário do sertão de Pernambuco. Revista Uniandrade, v. 21, n. 2, p. 97–107, 2020.
SILVA, R. P. D. C.; PEREIRA, J. D. C.; OLIVEIRA, E. F. D. A Correlação Entre Procedimentos Assistenciais Invasivos E A Ocorrência De Sepse Neonatal. Revista Brasileira de Saúde Funcional, v. 11, n. 2, p. 261, 2023.
SILVEIRA, R. H; LIMA, K. G; SANTOS-BOROWICZ, C. H; SCHWAMBACH, K. H; BOCK, H. Resistance to antimicrobials and vancomycin treatment in neonatal sepsis in a hospital in Brazil. Rev Bras Farm Hosp Serv Saude, v. 11, n. 3, p. 2, 2020.
SOUZA, N. A; COELHO, C. G. V; MESQUITA, C. H. S; PIRES, F. G. B; ROSA, P. B; BRITO, I. L. P. Sepse neonatal – perfil microbiológico e sensibilidade antimicrobiana em um hospital no Nordeste do Brasil. RBAC, v. 51, n. 1, p. 46-51, 2019.
TAKESHITA, N.; ANH, N. Q.; PHUONG, D. M.; THANH, D. V.; THUY, P. P.; HUONG, M. T. L.; TAKAHASHI, M.; OHMAGARI, N. Assessment of Bacteremia in a Large Tertiary Care Hospital in Northern Vietnam: a Single-Center Retrospective Surveillance Study. Japanese Journal of Infectious Diseases, v. 72, n. 2, p. 118-120, 2019.
YUSEF, D.; SHALAKHTI, T.; AWAD, S.; ALGHARAIBEH, H.; KHASAWNEH, W. Clinical characteristics and epidemiology of sepsis in the neonatal intensive care unit in the era of multi-drug resistant organisms: A retrospective review. Pediatrics & Neonatology, v. 59, n. 1, p. 35-41, 2018.
ZARULLI, V.; JONES, J, A, B.; OKSUZYAN, A.; JACOBSEN, R, L.; CHRISTENSEN, K.; VAUPEL, J, W. Women live longer than men even during severe famines and epidemics. Proceedings of the National Academy of Sciences (PNAS), v. 115, n. 4, p. 832-840, 2018.
1Farmacêutica, Universidade Estadual da Paraíba (UEPB).
2Graduando do Curso de Farmácia da Universidade Estadual da Paraíba (UEPB).
3Médico, Faculdade de Ciências Médicas (AFYA).
4Médico, Universidad Cristiana de Bolívia San Pablo (Ucebol).
5Professor(a) Doutor(a) do Departamento de Farmácia da Universidade Estadual da Paraíba (UEPB). e-mail: mlorennafarmacia@gmail.com.br
