LABORATORY CHARACTERIZATION OF IRREGULAR ANTIBODIES AS A GUARANTEE OF TRANSFUSION SAFETY
REGISTRO DOI: 10.69849/revistaft/ra10202412202308
Maria Fernanda Ramalho Pereira Lemos1
Luane Silva Carvalho1
Ítalo Freitas Pereira2
Marta Gomes de Magalhães2
Heronides dos Santos Pereira3
Patrícia Maria de Freitas e Silva4
Resumo
As transfusões sanguíneas podem trazer riscos ao receptor, como transmissão de doenças e o desencadeamento do processo de aloimunização, o qual ocorre quando o organismo produz anticorpos em razão da exposição a um antígeno não próprio, seja por transfusão sanguínea, gestação ou abortos espontâneos, e em menor frequência por doenças autoimunes, fatores genéticos e a alimentação. Este estudo objetivou caracterizar os anticorpos irregulares de pacientes atendidos pelo Hemocentro Regional de Campina Grande – PB, com base nos prontuários, para viabilizar transfusões de sangue seguras. Tratou-se de um estudo transversal, descritivo e quantitativo, abrangendo o período de janeiro de 2022 a junho de 2024. A pesquisa dos AI foi realizada através da técnica de gel centrifugação (coombs indireto) e a identificação dos AI realizada através de um painel de hemácias, usando a técnica em tubos com hemácias fenotipadas. Entre os 72 pacientes incluídos, observou-se uma predominância do gênero feminino (68,06%; n=49) e da faixa etária de 61 a 80 anos (27,78%; n=20), com prevalência do grupo sanguíneo O positivo (36,12%; n=26). Quanto ao histórico transfusional, 41,7% (n=30) dos pacientes realizariam sua primeira transfusão. 45,83% (n=33) apresentaram apenas um anticorpo, enquanto 38,89% (n=28) tiveram especificidade indeterminada. Entre os anticorpos identificados (61,11%; n=44), o sistema Rh foi o mais frequente (23,61%; n=17), destacando-se o Anti-D (8,33%; n=6), enquanto a associação Anti-k + Kpb + Lub foi a mais comum (5,56%; n=4). Na categoria “1ª transfusão”, os aloanticorpos indeterminados prevaleceram (39,28%; n=11), enquanto Anti-D e Anti-E apareceram em 10,71% (n=3). Em pacientes politransfundidos, o Anti-K foi mais frequente (16%; n=4). Os resultados reforçam a relevância da identificação de aloanticorpos para maior segurança transfusional, permitindo estratégias personalizadas que reduzem os riscos de aloimunização.
Palavras-chave: Anticorpos Irregulares. Grupos Sanguíneos. Reações Transfusionais.
1 INTRODUÇÃO
A medicina transfusional tem como objetivo restaurar os componentes sanguíneos do organismo, sejam hemácias, plaquetas e/ou fatores de coagulação (Reis; Silva; Araújo, 2023). Entretanto, mesmo sendo uma forma de tratamento, o sangue pode apresentar riscos para o receptor, pois atua como um transmissor de doenças, além de poder desencadear reações transfusionais que podem acontecer durante ou após o processo, principalmente em pacientes hospitalizados, que necessitam em maior frequência das hemotransfusões (Benedetti et al., 2020).
Além dos antígenos do sistema ABO, outros antígenos também estão presentes na porção extracelular da membrana dos eritrócitos, sendo estes de interesse na clínica laboratorial (Benedetti et al., 2020). De acordo com a International Society of Blood Transfusion 360 antígenos eritrocitários são reconhecidos, os quais estão descritos em 47 sistemas de grupos sanguíneos. Esta diversidade antigênica é uma das causas da formação dos aloanticorpos (Franco, 2024).
Os anticorpos irregulares são produzidos como resultado de uma reação imunológica conhecida como aloimunização, que ocorre quando o sistema imune de um indivíduo é exposto a antígenos não próprios, geralmente introduzidos por meio de transfusões sanguíneas, gestações ou abortos espontâneos. Essa resposta leva à produção de anticorpos direcionados contra esses antígenos alheios, presentes nas superfícies das hemácias. Este processo é particularmente relevante em pacientes politransfundidos ou gestantes, devido à maior probabilidade de exposição repetida a antígenos incompatíveis (Dantas et al., 2024).
Santos et al. (2022) descreveram que além do grupo Rh, os antígenos dos sistemas Kell (K), Kidd (Jkᵃ e Jkᵇ), Duffy (Fyᵃ e Fyᵇ), MNS (S e s) e Diego (Dia e Dib) também são capazes de induzir a produção de anticorpos irregulares (AI), da classe IgG. Estes anticorpos, por sua vez, possuem alta importância transfusional, por serem responsáveis em causar reações hemolíticas graves nos pacientes (Caldas et al., 2020).
Assim, caso um paciente que apresenta um anticorpo irregular, como anti-Duffy, receba uma bolsa de sangue que contém na superfície da hemácia o antígeno Duffy, desenvolverá, certamente, uma incompatibilidade sanguínea, com consequências que podem se iniciar por uma hemólise intravascular até destruição de órgãos e, inclusive, a morte.
A pesquisa de anticorpos irregulares (PAI) é realizada conforme determina o artigo 227 da Portaria 158/2016, que redefine o regulamento técnico de procedimentos hemoterápicos no país. A Portaria de Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde Nº 5, publicada em 28 de setembro de 2017, determina a realização da pesquisa de 14 anticorpos anti-eritrocitários irregulares em doadores e receptores de sangue, bem como recomenda a utilização de métodos que confirmem a presença de anticorpos clinicamente significativos. Ademais, é recomendada a fenotipagem de antígenos eritrocitários no sangue do receptor dos sistemas Rh (E, e, C, c), Kell (K), Duffy (Fya, Fyb), Kidd (Jka, Jkb) e MNS (S, s), para pacientes aloimunizados ou aqueles que estão ou poderão ingressar em esquema de múltiplas transfusões (Brasil, 2017).
Os AI podem estar presentes em 0,3% a 2,0% da população em geral, embora esta prevalência possa estar aumentada entre 10% a 35% em determinados grupos de pacientes, principalmente os politransfundidos (Pinheiro et al., 2021).
Hendrickson e Tormey (2019) evidenciaram que aloanticorpos como o anti-Jk podem comprometer os resultados de transplantes renais provenientes de doadores Jk-positivos. Essa descoberta sublinha a relevância dos antígenos eritrocitários, que podem ser expressos não apenas nas hemácias, mas também em outros tecidos e órgãos. Assim, a identificação de anticorpos irregulares se torna essencial, especialmente em contextos de transplantes de órgãos, para prevenir reações imunológicas adversas que podem afetar o sucesso do procedimento e a saúde do receptor.
O estado clínico do receptor pode ser um fator determinante para a formação de anticorpos irregulares. Santander (2019) identificou evidências significativas em pacientes com anemia falciforme, especialmente aqueles que apresentavam quadros pró-inflamatórios no momento da transfusão, como a síndrome torácica aguda. Esses pacientes demonstraram uma maior propensão ao desenvolvimento de aloanticorpos. Esses achados ressaltam a importância de considerar o estado patológico e inflamatório do receptor como um fator de risco relevante para a aloimunização, evidenciando a necessidade de cuidados adicionais em pacientes com condições predisponentes.
Além disso, é relevante destacar que a dieta pode influenciar no desenvolvimento de anticorpos irregulares (AI) em determinados pacientes. Estudos apontam que certos componentes alimentares, como lectinas presentes em leguminosas, grãos e sementes, podem desencadear respostas imunológicas atípicas (Oliveira et al., 2022). Essas lectinas têm potencial para interagir com antígenos sanguíneos, ativando o sistema imunológico e levando à produção de anticorpos, especialmente em indivíduos com predisposição imunológica (Silva et al., 2022). Essa relação sugere que fatores dietéticos podem desempenhar um papel adicional na formação de AI, ampliando a complexidade do manejo transfusional em pacientes com risco elevado de aloimunização.
Independente da origem, a importância clínica dos AI em pacientes hospitalizados baseia-se na sua associação com reações hemolíticas. Nesse contexto, uma falha na detecção de um aloanticorpo pode levar à reação transfusional hemolítica aguda ou tardia, com intensidades variadas e prejudicar a condição clínica do receptor (Merchan; Cáceres; Becerra, 2021).
O presente estudo teve como objetivo identificar a prevalência e caracterizar os aloanticorpos dos pacientes atendidos pelo Hemocentro Regional de Campina Grande – PB, com base nos prontuários.
2 FUNDAMENTAÇÃO TEÓRICA
2.1 Antígenos eritrocitários: Histórico
Os antígenos eritrocitários são macromoléculas localizadas na superfície da membrana das hemácias e podem ser classificados em dois principais tipos de acordo com sua composição estrutural: de natureza carboidrato (glicoproteínas ou glicolipídeos) e de natureza proteica. Esses antígenos podem ser reconhecidos pelo sistema imunológico do receptor de concentrado de hemácias (CHAD) como elementos estranhos, potencialmente induzindo a formação de anticorpos contra eles em um processo conhecido como aloimunização (Tormey; Hendrickson, 2019).
A descoberta dos primeiros antígenos de grupos sanguíneos no início do século XX foi uma realização crucial para a imunologia e a transfusão sanguínea. Karl Landsteiner observou que as hemácias de certos indivíduos aglutinavam quando em contato com o plasma de outras pessoas, o que levou à identificação dos primeiros antígenos sanguíneos. A partir dessa observação, outros antígenos foram identificados, como os grupos MN, P1 e LW, através de pesquisas sistemáticas. Entretanto, a maior parte dos antígenos subsequentes foi descoberta após a detecção de aloanticorpos em casos clínicos, como reações transfusionais e complicações da doença hemolítica do feto e do recém-nascido (DHFRN). Exemplos incluem anticorpos anti-c, anti-e e anti-Fya, encontrados após reações transfusionais, e anticorpos como anti-D, anti-K e anti-Jka, associados à DHRN (Pereira; Siebert, 2020).
A maioria dos grupos sanguíneos foi identificada após a introdução do teste indireto de antiglobulina (TAI) na prática laboratorial, descrito por Coombs e colaboradores em 1945. Este teste, também conhecido como pesquisa de anticorpos irregulares (PAI) ou Coombs indireto, continua sendo crucial na detecção da maioria dos anticorpos eritrocitários da classe IgG, desempenhando um papel central na imunologia transfusional (Silva, 2022).
As funções desempenhadas pelos antígenos eritrocitários já são amplamente conhecidas e podem ser classificadas em diversas categorias, uma vez que muitos desses antígenos exercem mais de uma função. Entre essas destacam-se: proteínas estruturais (grupo Gerbich), de transporte (Diego, Kidd e Colton), receptores/moléculas de adesão (Duffy e MNS), função enzimática (Kell e Dombrock), de complemento (sistemas Chido/Rodgers e Knops),e funções regulatórias, dentre outras (Santander, 2019).
Figura 1 : Representação esquemática de antígenos de grupos sanguíneos conforme suas funções biológicas.
Fonte: Bonifácio; Novaretti (2009).
Contudo, o grande número e a diversidade estrutural dos antígenos de grupos sanguíneos ainda representam um desafio significativo para os estudos de aloimunização eritrocitária, dificultando a compreensão mais detalhada de suas implicações clínicas (Hendrickson; Tormey, 2019).
2.2 Sistemas de Grupos Sanguíneos
Um grupo ou sistema sanguíneo é definido pela presença ou ausência de antígenos específicos na superfície das hemácias. Esses antígenos são controlados por loci genéticos que geralmente estão intimamente ligados a genes homólogos, com poucas ou nenhuma recombinação entre eles. Os grupos sanguíneos apresentam características polimórficas bem definidas, sendo compostos por estruturas macromoleculares que podem ser de natureza proteica, glicoproteica ou glicolipídica (Barbosa, 2023).
A Sociedade Internacional de Transfusão sanguínea – ISBT, registra oficialmente 47 sistemas que contam com 360 antígenos eritrocitários reconhecidos. Entretanto, existem outras classificações como coleções e séries (Franco, 2024). Coleções são grupos de antígenos símiles bioquímicos, sorológicos ou geneticamente nos quais o caráter genético ainda não é bem esclarecido e por isso não podem ser classificados como sistemas. As séries são antígenos que não são classificados nem entre sistemas ou coleções, mas possuem baixa (700) ou alta frequência (901) na população (ISBT, 2023; Brasil, 2022).
Para a medicina transfusional, devido a frequência de antígenos na população, a alta imunogenicidade, além da probabilidade de seus respectivos anticorpos ocasionarem hemólise, os sistemas de grupos sanguíneos mais relevantes são: ABO, Rh (Rhesus), Kell, Duffy, Kidd, Lewis, MNS e Diego (Koury, 2018).
A Portaria de Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde, estabelecida pela Portaria 158/2016 e reforçada pela Portaria nº 5/2017, no artigo 177 § 18, determina a realização da fenotipagem para os antígenos eritrocitários nos sistemas Rh (E, e, C e c), Kell (K), Duffy (Fya e Fyb), Kidd (Jka e Jkb) e MNS (S e s) em pacientes aloimunizados, com o objetivo de identificar anticorpos anti-eritrocitários irregulares e realizar transfusões fenotipicamente compatíveis quando possível (Brasil, 2017).
2.3 Sistema ABO
O sistema de grupos sanguíneos ABO foi o primeiro a ser descoberto, em 1900, pelo médico e cientista Karl Landsteiner. Durante seus experimentos, ele realizou testes com o soro e as hemácias de diferentes amostras de sangue e observou que, em alguns casos, havia aglutinação, enquanto em outros não. Essa descoberta pioneira foi fundamental para a medicina transfusional, pois revelou a existência de diferentes tipos de sangue e a importância de compatibilidade entre doador e receptor (Miranda; Torres, 2018). Landsteiner descreveu os tipos A, B e O e seus colaboradores, Decastelo e Sturli, o tipo AB (Dornelles; Bordin; Santini, 2019).
Certamente, o sistema ABO ainda é o de maior importância sob o ponto de vista dos procedimentos transfusionais, sendo o grupo mais comum na população (Smart, Armstrong, 2020). Além disso, é o sistema em que os anticorpos, anti-A e anti-B, são os únicos a serem produzidos normalmente, e não dependem, como outros grupos sanguíneos, de exposição aos fatores de transfusão, transplante ou gravidez para serem desenvolvidos imunologicamente (Solanki; Chandra; Singh, 2020).
O sistema ABO define o sangue de uma pessoa entre um dos tipos: A, B, AB ou O, baseado na presença ou ausência de aglutinogênios na superfície da membrana celular da hemácia. Ou seja, uma pessoa que possui antígenos do tipo A na superfície dos eritrócitos é pertencente ao grupo sanguíneo A, assim como quem possui antígeno A e B é pertencente ao grupo AB. Enquanto que o sangue de tipo O não possui antígenos A e tampouco B em sua composição (Smart; Armstrong, 2020).
Os tipos sanguíneos no grupo ABO também possuem seus respectivos anticorpos, as aglutininas, que defendem o organismo dos antígenos não presentes na membrana da hemácia. No sangue de tipo A, o sistema imune produz anticorpos anti-B, que irão fazer a defesa em contato com sangue com antígenos B. A mesma lógica segue para sangue de tipo B, que possui anticorpos anti-A, e para o sangue tipo O que, por não possuir os antígenos A e B, a memória imunológica não possui reconhecimento desses antígenos e produz os dois tipos de anticorpos, anti-A e anti-B. Em contraste, o sangue AB possui os dois antígenos do sistema ABO, por isso não possui anticorpos anti-A e anti-B (Justino et al., 2021).
Os antígenos que compõem o sistema ABO também estão presentes nas glicoproteínas de membrana de outros tecidos, como na medula óssea e nos rins ou em secreções e fluídos corporais, como saliva, lágrimas, urina, sucos digestivos, leite e líquido amniótico (Valensuela; Morais; Ortega, 2023).
2.4 Sistema RH
O sistema Rh foi descoberto por Landsteiner e Wiener, na década de 40, quando perceberam que, ao injetar sangue do macaco do gênero Rhesus em cobaias, houve a produção de anticorpos para combater as hemácias introduzidas. Através dessa constatação, os cientistas concluíram que na membrana das hemácias do macaco Rhesus havia um antígeno, este foi denominado fator Rh (de Rhesus) devido à maneira como foi descoberto. Depois do ABO, é o mais importante na Medicina Transfusional (Rodrigues; Ribeiro, 2021).
Composto por 55 diferentes antígenos, o sistema Rh é o mais polimórfico dentre todos os demais sistemas. O locus RH é composto por 2 genes homólogos, RHD e RHCE, situados no cromossomo 1, que codificam, respectivamente, o antígeno D e os antígenos CE em diversas combinações (ce, cE, Ce ou CE). Herdados como haplótipos, o RHD e RHCE são expressos exclusivamente nos eritrócitos. A diversidade genética do locus RH foi revelada na última década, com o RHCE tendo 80 alelos e o RHD possuindo mais de 200, os quais codificam potencialmente antígenos variantes ou alterados devido a alterações de aminoácidos nas proteínas Rh (Brasil, 2022).
Três categorias variantes de D foram distinguidas em estudos sorológicos: D fraco, D parcial e DEL1 do tipo selvagem ou convencional. Os alelos RHD são categorizados por mutações que levam a mudanças qualitativas e/ou quantitativas em expressão do antígeno D. O fenótipo D fraco antigamente era designado como Dᵘ e definiam as hemácias que aglutinavam somente em fase da antiglobulina humana. Atualmente, é definido quando há uma reação de aglutinação fraca ou até mesmo negativa com o soro anti-D (≤ 2+), mas aglutinando moderada ou fortemente com a técnica de Coombs Indireto (também conhecida como pesquisa de D fraco). Fenótipos D parciais estão associados a substituições de aminoácidos na proteína RhD na superfície de eritrócitos e não possuem todos os epítopos D (Arnoni et al., 2021).
Em testes de classificação sanguínea, o fator Rh é testado junto do grupo ABO, pois são os grupos de antígenos mais frequentes no meio laboratorial, em decorrência da imunogenicidade de seus principais antígenos (D, C, c, E, e) que são capazes de estimular a produção de anticorpos de classe IgG, que podem ultrapassar a barreira placentária e ocasionar a DHFRN, além da ocorrência de seus anticorpos poder ocasionar reações hemolíticas imediatas devido à destruição extravascular dos glóbulos vermelhos em indivíduos politransfundidos que tenham se sensibilizado previamente (Filho et al., 2022).
Nessa classificação, leva-se em conta o antígeno RhD, verificando se o sangue testado possui ou não anticorpos em antissoro anti-RhD (Santiago, 2020). Se possui, ocorre o fenômeno de aglutinação, caso contrário a amostra de sangue permanece com aspecto homogêneo pois comprova a ausência de antígeno RhD na superfície dos eritrócitos (Rodrigues; Ribeiro, 2021).
2.5 Sistema KELL
O sistema Kell foi descrito pela primeira vez em 1946 por Robert Coombs e colaboradores, que, por meio do teste da antiglobulina humana direta, identificaram a sensibilização de hemácias de um recém-nascido com doença hemolítica perinatal causada por anticorpos maternos (Guimarães, 2019). Esse sistema é considerado o terceiro mais complexo entre os grupos sanguíneos existentes, devido a sua alta imunogenicidade e por seus antígenos já serem bem desenvolvidos em recém-nascidos. Ele é composto por 36 antígenos, entre eles KEL 1 (K), KEL 2 (k), KEL 3 (Kpa ), KEL 4 (Kpb), KEL 21 (Kpc), KEL 6 (Jsa) e KEL 7 (Jsb) que se classificam em antígenos de alta e baixa frequência, e estão distribuídos de acordo com a origem étnica populacional (ISBT, 2021).
Os antígenos do grupo sanguíneo Kell possuem expressão gênica de codominância. Entre eles, antígenos como Kpb, k e Jsb apresentam alta prevalência populacional, enquanto outros, como K, Kpa e Jsa, são menos frequentes (Guimarães, 2019). Esses antígenos estão localizados na glicoproteína Kell, codificada pelo gene Kel, situado no cromossomo 7 (Rodrigues; Ribeiro, 2021). O antígeno K é altamente imunogênico, e induz, na maioria das vezes de forma adquirida, a produção do anticorpo Anti-K. Esse anticorpo é comumente detectado em pacientes politransfundidos e está associado à doença hemolítica do recém-nascido (Quitério; Souza, 2018).
O sistema Kell é o terceiro mais antigênico, capaz de gerar uma isoimunização, como mencionado anteriormente e embora não corresponda ao maior percentual nas isoimunizações descritas, possui um importante papel uma vez que é capaz de ocasionar destruição eritrocitária, acarretando toda sintomatologia atribuída ao aumento de bilirrubina e a anemia, além de morte (Dantas et al., 2024).
2.6 Sistema DUFFY
O sistema Duffy foi descrito pela primeira vez em 1950 por Cutbush e colaboradores, que identificaram um novo anticorpo associado a uma reação transfusional hemolítica em um paciente hemofílico chamado Duffy, denominando-o anti-FY1 (anti-Fya). No ano seguinte, foi demonstrada a presença do antígeno antitético FY2 (Fyb) na superfície dos eritrócitos. Atualmente, o sistema Duffy, também conhecido como DARC (Duffy Antigen Receptor for Chemokines), é composto por cinco antígenos: Fyᵃ, Fyᵇ, Fy3, Fy5 e Fy6, sendo estes codificados pelo gene FY localizado no cromossomo 1q. No entanto, os antígenos de maior relevância clínica são o Fya e o Fyb, devido à sua alta imunogenicidade (Silva, 2018).
Os antígenos do sistema Duffy são expressos em uma glicoproteína quimiorreceptora, presente não apenas nos eritrócitos, mas também em outros tecidos, como rins, pulmões e cérebro. Esses antígenos estão bem desenvolvidos ao nascimento e apresentam comportamento variável (Silva, et al 2021). Os antígenos FY1 (Fya) e FY2 (Fyb) são responsáveis pelos fenótipos Duffy comuns encontrados em diferentes populações, distribuídos de acordo com a origem étnica. Em contraste, os antígenos FY3, FY5 e FY6 possuem alta frequência, sendo expressos por mais de 99% da população (Brasil, 2022).
O polimorfismo do sistema Duffy é utilizado para avaliação do impacto da seleção natural em diferentes regiões geográficas, uma vez que a mutação no gene FY confere proteção contra infecção por Plasmodium vivax. Em 1975, Miller e seus colaboradores mostraram que a proteína do grupo sanguíneo Duffy desempenhava um papel importante na invasão das hemácias pelo parasita da malária P. vivax (Hoher et al., 2018).
Enquanto o Plasmodium falciparum usa uma série de receptores da superfície eritrocitária para efetivar sua invasão, sabe-se que Plasmodium vivax e Plasmodium knowlesi dependem de uma interação com o antígeno Duffy, o que significa que hemácias que não possuem o antígeno não são invadidas por esses merozoítas, por serem inacessíveis a eles (Hoher et al., 2018). Dessa maneira, indivíduos com o fenótipo conhecido como Fy (a-b-), comum na África, mas raro em outras populações, são naturalmente resistentes à malária por P. vivax (Lara; Ramos; Silva, 2022).
Os anticorpos do sistema Duffy são geralmente IgG e clinicamente significantes, podendo fixar complemento. Os anticorpos para os antígenos do sistema são bem documentados em vários estudos e relatos de casos, sendo responsáveis por reações transfusionais imediatas e tardias bem como DHRN. Embora os casos de DHRN causados por anticorpos Duffy sejam relativamente leves, as reações transfusionais causadas por esses anticorpos são frequentemente graves (Santander, 2019).
O anticorpo anti-Fyᵃ é encontrado principalmente após transfusão e, menos frequentemente, como resultado de gravidez incompatível, quase nunca ocorre naturalmente. O anti-Fyᵇ é cerca de 20 vezes menos comum que o anti-Fyᵃ e geralmente está presente no soro em combinação com outros anticorpos (Hoher et al., 2018).
2.7 Sistema KIDD
O primeiro antígeno do Sistema Kidd foi descoberto em 1951, através do caso de uma paciente que desenvolveu anticorpos, até então desconhecidos, durante sua gestação, desencadeando no bebê uma DHRC fatal. A proteína foi denominada Jk, sendo o primeiro antígeno a ser descoberto no Sistema Kidd. As denominações Kidd e Jk surgiram, respectivamente, do nome da mãe e das iniciais da criança (Fabene, 2022).
Posteriormente, outros dois antígenos Jkb e jk3 foram descobertos. Dois anos após, em 1953, foi identificado o anticorpo anti-Jkb, em uma paciente que desenvolveu reação hemolítica pós-transfusional. No soro da paciente foi detectado um anticorpo identificado tanto Jk quanto Jkb, este anticorpo foi denominado anti-jk3 (Santander, 2019).
Os antígenos do grupo sanguíneo Kidd são produtos de um único gene JK ou SLC14A1. Este gene está localizado no locus 18q12-q21 e possui 389 aminoácidos. A glicoproteína codificada pelo gene possui função de transporte de ureia, que preserva a estabilidade osmótica e deformabilidade das hemácias. O transporte de ureia através da glicoproteína Kidd nas hemácias é feito de maneira rápida intra e extracelular para prevenção da desidratação quando os eritrócitos atravessam altas concentrações de ureia no vaso renal (Lara; Ramos; Silva, 2022).
Os antígenos do sistema Kidd não são exclusivamente eritrocitários, podem ser encontrados em células endoteliais renais, além de já terem sido encontrados em outros órgãos como: cólon, cérebro, próstata, fígado, pâncreas, bexiga e outros. O propósito exato do transportador de ureia em células não-eritróides e não-renais ainda continua desconhecido (Guimarães, 2019).
Anti-Jkᵃ e Jkᵇ são bem conhecidos por sua queda rápida e significativa na titulação para níveis tão baixos que são difíceis de serem detectados pelos métodos sorológicos de rotina. Isso ocorre devido ao que se chama de efeito de dose que acontece principalmente nos sistemas Rh, MNS, Kidd e Duffy. A maioria dos antígenos eritrocitários são herdados de maneira codominante. Um indivíduo que é heterozigoto para determinado sistema, no caso do sistema Kidd (Jka + e Jkb +), possui dose única para ambos os antígenos, um indivíduo homozigoto para Jkb (Jka- Jkb+) possui dose dupla de Jkb. O efeito de dose acontece quando um anticorpo reage mais fracamente ou então não reage com eritrócitos que apresentam dose única de um determinado antígeno. Dessa maneira, o indivíduo com anti-Jk, por exemplo, pode apresentar PAI negativo e provas de compatibilidade compatíveis se as hemácias testadas tiverem apenas expressão de Jkb (hemácias Jka- Jkb+) ou tiverem dose única de Jka (Jk a+b+). Nesses casos, a genotipagem garante a segurança transfusional e evita uma possível reação hemolítica tardia (Chaffin, 2019).
Portanto, é importante fazer um histórico prévio de anticorpos, para evitar uma reação hemolítica pós-transfusional do tipo tardia que pode acontecer devido a um anticorpo que estava abaixo do nível de detecção antes da transfusão (ANVISA, 2022).
2.8 Sistema DIEGO
O grupo sanguíneo Diego foi descrito por Miguel Larysse em 1955, e recebeu esse nome devido ao caso de uma paciente, a Sra. Diego, que deu à luz a uma criança com Doença Hemolítica do Recém-Nascido (DHRN). Larysse estudou o soro do bebê que ao nascer apresentava sinais clínicos hematológicos normais, mas naquela época a determinação de bilirrubina não foi realizada. Após 12 horas, a icterícia passou a se tornar mais evidente na criança, que com o tempo ficou cada vez mais severa, levando a criança a óbito três dias depois. O teste de antiglobulina realizado nas hemácias do recém-nascido deu positivo. Foram colhidas amostras de sangue da mãe Rh positiva e de seu bebê compatível com o grupo Rh para as análises, e foi concluído que, embora os glóbulos vermelhos do bebê estivessem em perfeito estado, foi excluída a incompatibilidade de Rh, mas foi suspeitado de uma possível ocorrência de fator sanguíneo de baixa incidência com seu correspondente anticorpo. Nesse mesmo ano, o pai da criança também teve seus glóbulos vermelhos testados contra o soro materno e uma forte aglutinação foi encontrada. Com isso, surgiu o nome de Sistema Diego (Lara; Ramos; Silva, 2022).
O sistema Diego é composto por 22 antígenos, classificados como de baixa ou alta frequência, destacando-se entre eles os Diᵃ/Diᵇ e Wrᵃ/Wrᵇ. A expressão desses antígenos é controlada pelo gene SLC4A1 que possui 20 exons e está localizado no cromossomo 17q21-q22 (Almeida et al., 2020).
Os antígenos do sistema de grupo sanguíneo Diego estão localizados na banda 3, a principal e a mais abundante proteína integral na membrana dos eritrócitos com 106 cópias por célula. Esta proteína é um permutador de cloreto / bicarbonato envolvida no transporte de dióxido de carbono dos tecidos aos pulmões. Encontra-se também no rim, onde está envolvido na secreção de ácido (Pinto; Domingos; Manuel, 2024).
Os anticorpos do sistema Diego são geralmente IgG, e reagem no teste da antiglobulina indireta. Tanto os anticorpos anti-Diᵃ quanto o anti-Diᵇ podem causar reações hemolíticas transfusionais e DHFRN. Entretanto estão mais relacionados à DHFRN que às reações transfusionais, sejam imediatas ou tardias. O anti-Diᵃ pode ocorrer sem que haja uma prévia sensibilização, porém há relatos de sua produção após a gestação (Souza et al., 2022).
O antígeno Diegoª (Diª) é conhecido como um antígeno de baixa incidência (0,01%) entre caucasianos, entretanto apresenta-se com incidência maior entre índios americanos (36%) e em populações asiático-mongolóides: chinês (5%), japonês (12%) e coreano (6,4- 14,5%). Recentemente, no Brasil, foi descrita uma prevalência de 75,7% na tribo indígena Parakanã (Pinto; Domingos; Manuel, 2024).
O Anti-Wrᵃ é um anticorpo relativamente comum em doadores e pacientes, a maioria precisa do TAI para que seja detectado, embora sejam relatados casos de aglutinação na fase salina. O Anti Wrᵃ já causou reações transfusionais graves (Santander, 2019).
2.9 Sistema LEWIS
Em 1946, Arthur Morant descreveu os primeiros exemplos de anti-Lewis (anti-Lea), ao analisar que o soro do Sr H.D.G. Lewis, apresentava um anticorpo que aglutinava 20% dos eritrócitos durante uma prova cruzada com um hemocomponente. Atualmente, o sistema Lewis é composto por 6 antígenos: Le(a), Le(b), Le(ab), Le(bH), ALe(b) e BLe(b). Sendo que o gene que codifica esta proteína, se encontra no cromossomo 19p-13.3, ligado ao locus C3 do sistema complemento (Lara; Ramos; Silva, 2022).
Para que haja a expressão fenotípica de antígenos Le, o gene Lewis (FUT3), localizado no cromossomo 19p-13.3 e o gene homólogo secretor (FUT2) produzem duas enzimas que agem sob a mesma substância e produzem os antígenos Leª e H, a interação desses últimos produz a especificidade do antígeno Leᵇ. Por essa razão, os sistemas ABO, H e LE são considerados associados (Barros et al., 2024).
O sistema de grupo sanguíneo Lewis é único, visto que seus antígenos são provavelmente sintetizados no epitélio intestinal, liberados como antígenos solúveis em fluidos corporais provenientes no plasma e adsorvidos nos eritrócitos, ou seja, seus antígenos não são intrínsecos aos eritrócitos. Lea e Leb, embora não sejam sintetizados pelas células vermelhas, mas são obtidas a partir do plasma, são considerados antígenos dos grupos sanguíneos porque eles foram reconhecidos pela primeira vez em células vermelhas (McCullough, 2021).
Os antígenos do sistema Lewis são amplamente distribuídos pelo corpo, encontrados no pâncreas, estômago, mucosas de intestino, músculo esquelético e outros (Sousa et al., 2024).
Os anticorpos anti-Lewis são predominantemente da classe IgM, o que impede sua passagem pela barreira placentária e, consequentemente, a ocorrência de doença hemolítica do recém-nascido (DHRN) grave. Além disso, presume-se que os antígenos de Lewis, embora presentes nas secreções fetais, geralmente não estão expressos nos glóbulos vermelhos do feto, contribuindo para a ausência de impacto significativo nesse contexto (Sousa et al., 2024).
Este sistema está raramente associado a casos de reação hemolítica transfusional, mas quando ocorrem essas reações são mais frequentes com o antígeno Lea do que com o Leb. Possivelmente, porque a maioria dos anticorpos Lewis não é ativa à temperatura corporal de 37°C, além de os antígenos do doador frequentemente neutralizarem os anticorpos Lewis do receptor. Outro fator relevante é a eluição dos antígenos Lea e Leb a partir de células vermelhas transfundidas em indivíduos com o fenótipo Le(a-b-) (Brasil, 2022).
2.10 Sistema MNS
O grupo MNS reconhece atualmente 50 antígenos e foi o segundo sistema sanguíneo a ser descrito, sendo de uma complexidade menor apenas que o sistema Rh. Foi descoberto por Karl Landsteiner e Philip Levine em 1927, quando recuperaram do soro de coelhos anticorpos anti-M e anti-N após implementação do teste da antiglobulina humana (Teste de Coombs). Vinte anos depois, em 1947, Walsh e Montgomery fizeram a descoberta do antígeno S, sendo apenas em 1951 a descoberta de seu par antitético, o ‘s’ (Quitério; Souza, 2019).
São os genes homólogos GYPA e GYPB os responsáveis pelo desencadeamento do grupo MNS. Eles estão situados no cromossomo 4 e codificam as proteínas de membrana integrais glicoforina A e glicoforina B, que atuam com recepção e adesão celular, bem como pontos de ancoragem para os antígenos do grupo MNS. Há também o gene GYPE, que possui alta homologia com GYPA e GYPB, aumentando as chances de recombinação entre si e formando glicoforinas híbridas (Costa; Leonidas, 2022).
Os antígenos MN podem ser identificados a partir da 9ª semana de gestação, apresentando-se bem desenvolvidos ao nascimento, sua presença em crianças não é incomum, embora sem importância clínica. Por outro lado, os antígenos do sistema MNS também são expressos em tecidos como o endotélio renal e o epitélio (Rosa, 2018).
Além dos antígenos M, N, S e s, que são mais comuns nesse grupo sanguíneo, há também o antígeno de alta prevalência U. O anticorpo contra esse antígeno (anti U) é encontrado na população negra e classificado como raro pois cerca de 1% dos 33 negros americanos e 1 a 35% dos negros africanos não apresentam o antígeno U, o que dificulta a busca por sangue compatível (BRASIL, 2022). Segundo Smart e Armstrong (2020), esses dados são ainda mais restritos, sendo o antígeno U gerador do fenótipo S-s-U, que se encontra em apenas 0.25% da população negra. Uma outra variante rara de U também dá origem ao fenótipo S-sU+, como resultado de uma mutação da GPB.
Os antígenos do sistema MNS são importantes na prática clínica por serem capazes de provocar reações transfusionais e doença hemolítica perinatal. Os anticorpos anti-M e anti-N não são relacionados a reações transfusionais, embora alguns casos raros foram relacionados ao anti-M. Entre os anticorpos MNS, anti-S é mais relacionado que anti-s de causar reações transfusionais, porém ambos podem ocasionar reações hemolíticas severas. Indivíduos S-s-U- ou S-s-U+var, quando expostos a hemácias U+, podem produzir aloanticorpo anti-U, o qual pode ocasionar reações transfusionais graves (Rosa, 2018).
2.11 Segurança Transfusional e a identificação de anticorpos irregulares
Os anticorpos dos grupos sanguíneos que possuem a capacidade de iniciar a hemólise dos glóbulos vermelhos podem causar reações transfusionais hemolíticas. Esses eventos podem ser imediatos e intravasculares, imediatos e extravasculares, ou tardios e extravasculares (Albuquerque, 2023).
Os anticorpos ABO são de classe IgM e são extremamente importantes nas provas de compatibilidade realizadas nos hemocentros. Por possuírem estrutura pentamérica são capazes de aglutinar as hemácias em meio salino e por essa razão também são chamados de completos. São chamados de naturais ou regulares por já serem esperados que estejam presentes no plasma dos indivíduos sem a necessidade de uma prévia sensibilização (Monteiro, 2022). Apesar da incompatibilidade ABO ser extremamente perigosa por causar reações hemolíticas agudas, os anticorpos desse sistema não são o foco deste estudo justamente por não se tratarem de anticorpos irregulares.
Os anticorpos irregulares são assim chamados porque não se espera que eles estejam presentes no plasma do indivíduo. Eles aparecem normalmente após transfusão sanguínea ou gestação cujos antígenos eritrocitários não-próprios são expostos ao sistema imune. Por não estarem presentes nas hemácias do paciente, os antígenos presentes nas hemácias do doador são considerados estranhos ao organismo e essa sensibilização estimula a produção de anticorpos direcionados contra esses antígenos. A presença de anticorpos irregulares em pacientes politransfundidos dificulta a obtenção de concentrado de hemácias compatíveis e pode acarretar em reações transfusionais imediatas (agudas) ou tardias. Para prevenção da ocorrência de reações transfusionais, a fenotipagem eritrocitária em pacientes politransfundidos é de suma importância (Santander, 2019).
Os anticorpos irregulares encontrados com maior frequência nos estudos direcionados são aqueles pertencentes aos sistemas Rh e Kell justamente por se tratarem dos dois sistemas mais imunogênicos. Outros anticorpos que também aparecem nesses estudos são os dos sistemas Duffy, MNS, Lewis e Kidd (Pinheiro et al., 2021). Souza et al. (2022) chamam a atenção para a frequência do sistema Diego possuir grandes variações no Brasil devido à miscigenação e por isso depende da população estudada.
Segundo Hendrickson e Tormey (2019) o fato da expressão de alguns antígenos eritrocitários não se restringir às hemácias, mas também serem expressos em outros órgãos torna a identificação de anticorpos irregulares relevante não somente em casos de transfusão sanguínea ou gestação, como também em casos de transplante de órgãos. Por exemplo, já foi descrito que a presença de aloanticorpos anti-Jk interferiram nos resultados de rins transplantados de doadores Jk-positivos.
Dessa forma, a aloimunização acarreta implicações negativas aos receptores politransfundidos. Além do aumento do risco de reação transfusional hemolítica, há também a possibilidade de ocorrência do aparecimento de anemia hemolítica autoimune, DHFRN e danos a tecidos transplantados. Indivíduos que já fizeram mais de uma transfusão sanguínea têm alta probabilidade de formar aloanticorpos eritrocitários isolados ou em combinação, autoanticorpos, e anticorpos contra antígenos de baixa frequência. Além desse fato, sabe-se que o surgimento de anticorpos irregulares está relacionado também à idade do paciente, ao número de transfusões recebidas e às diferenças antigênicas entre pacientes e doadores (Fabene, 2022).
Além das discrepâncias entre doador e receptor, outros fatores de risco para a ocorrência da aloimunização estão associados aos fatores genéticos de um subgrupo de indivíduos caracterizados como “good responders”, dessa forma fica impossível prever como os pacientes irão reagir antes de suas primeiras transfusões (Thonier, 2019).
Outro fato que afeta diretamente a aloimunização eritrocitária é o estado patológico dos receptores. Melo e colaboradores (2018) apresentaram evidências clínicas em pacientes com anemia falciforme que estavam com quadros pré – inflamatórios no momento da transfusão, principalmente a síndrome torácica aguda, que estes possuem maiores chances de desenvolverem anticorpos irregulares.
Somados a esses fatores ainda existem outras variáveis que podem servir como gatilhos para a aloimunização. Fatores intrínsecos aos próprios antígenos eritrocitários são pontos chaves no desenvolvimento de aloanticorpos. Os antígenos RhD, por exemplo, por possuírem tamanho e exposição maiores na membrana das hemácias que os antígenos do sistema Kell e Duffy, têm maior capacidade de desencadear anticorpos irregulares, por exemplo (Hendrickson; Tormey, 2019).
O conhecimento das frequências fenotípicas dos antígenos de glóbulos vermelhos em uma população é útil para criar um banco de dados de doadores e ajudar na busca de sangue compatível com o antígeno-negativo com mais rapidez além de prevenir a ocorrência da aloimunização (Romphruk et al., 2019).
2.12 Mapeamento de Antígenos nas Hemácias de Brasileiros
Mapear os antígenos presentes nas hemácias dos brasileiros representa um desafio importante e complexo, especialmente devido à diversidade genética da população e à falta de dados sistemáticos. A população brasileira é uma das mais geneticamente diversas do mundo, com uma composição que inclui descendentes de povos indígenas, africanos e europeus, resultando em uma variedade de antígenos e subtipos sanguíneos no país. Essa miscigenação contribui para a presença de fenótipos raros e dificulta a previsão de quais anticorpos irregulares podem estar presentes em diferentes segmentos populacionais (Monteiro et al., 2020).
Para superar esses desafios, seria fundamental realizar estudos epidemiológicos amplos que incluam populações de diferentes regiões e etnias, fornecendo dados detalhados sobre a prevalência de antígenos. Além disso, a introdução de genotipagem em larga escala em bancos de sangue permitiria uma triagem mais abrangente para antígenos raros, melhorando a compatibilidade de transfusões e a segurança dos pacientes. Esses avanços ajudariam a reduzir a aloimunização, um problema frequente em pacientes politransfundidos, e a garantir um atendimento transfusional mais seguro e eficaz para a população brasileira (Quirino et al., 2019).
Esse mapeamento imunológico é um objetivo valioso não só para a medicina transfusional, mas também para a imunologia e genética populacional no Brasil, permitindo uma compreensão mais profunda das interações entre genética e saúde em uma população tão diversa quanto a brasileira (Acosta et al., 2021).
3 METODOLOGIA
O estudo foi realizado com um delineamento transversal e descritivo, adotando uma abordagem quantitativa para a análise dos dados. Foram analisados os prontuários de 72 pacientes que apresentaram resultado positivo na pesquisa de anticorpos irregulares, no período entre janeiro de 2022 a junho de 2024.
Os dados foram coletados a partir da análise das fichas laboratoriais do Hemocentro, que registraram os resultados das amostras de sangue de pacientes com PAI positivo, provenientes tanto das 21 agências transfusionais atendidas pelo Hemocentro Regional de Campina Grande-PB, quanto do próprio Hemocentro.
Amostras de sangue recebidas no setor de imunohematologia do Hemocentro Regional de Campina Grande-PB foram submetidas à confirmação da presença de anticorpos irregulares e, posteriormente, à identificação destes anticorpos. Estas amostras de sangue tiveram as seguintes origens: foram coletadas de pacientes que seriam submetidos à transfusão sanguínea no próprio hemocentro ou eram provenientes de agências transfusionais que, por ocasião dos testes de compatibilidade sanguínea, detectaram presença de anticorpos irregulares em sangue de pacientes hospitalares.
O processamento destas amostras sanguíneas foi realizado utilizando dois métodos laboratoriais: o teste de Coombs Indireto (PAI) e o Painel de Hemácias. O teste de Coombs Indireto visou detectar a presença de aloanticorpos, podendo ter sido realizado através da técnica em tubos ou através da técnica em gel. O Painel de Hemácias permitiu identificar a especificidade dos anticorpos irregulares encontrados.
Os resultados laboratoriais, coletados como base para pesquisa, foram compilados e digitalizados em banco de dados eletrônico através de planilha Excel (Microsoft Office 2019, versão 64 bits). Em seguida, foi realizada uma análise estatística juntamente com um estudo descritivo para a caracterização da população estudada. Os dados foram descritos através de estatísticas descritivas, como frequências e percentuais.
O estudo respeitou as diretrizes e critérios estabelecidos pela Resolução 466 de 12 de dezembro de 2012, do Conselho Nacional de Saúde e foi aprovado pelo Comitê de Ética e Pesquisa da Universidade Estadual da Paraíba sob número 7.224.945 (CNS, 2012).
4 RESULTADOS E DISCUSSÕES
Foram analisados os prontuários dos pacientes atendidos no Hemocentro Regional de Campina Grande – PB, no período compreendido entre janeiro de 2022 a junho de 2024, com o objetivo de identificar os casos que apresentaram positividade para a pesquisa de anticorpos irregulares (PAI). Ao todo, foram evidenciados 72 pacientes com essa condição, cuja detecção é essencial para o adequado manejo transfusional e acompanhamento clínico.
No Gráfico 1, pode-se observar que, dentre os 72 pacientes estudados, o gênero feminino predominou em uma porcentagem de 68,06% (n=49), enquanto que o gênero masculino representou 31,94% (n=23). Além disso, o gráfico ilustra as faixas etárias dos pacientes analisados, abrangendo indivíduos com idades entre 0 a 100 anos. A maior taxa de positividade do teste foi observada na faixa etária entre 61 a 80 anos, correspondendo a 27,78% (n= 20) dos pacientes, seguida pela categoria “Ignorada” (23,61%; n=17) que representa a porcentagem de pacientes cujos prontuários não foram localizados, impossibilitando a identificação da faixa etária específica.
Gráfico 1: Distribuição de gênero e faixa etária dos pacientes com anticorpos irregulares atendidos no Hemocentro Regional de Campina Grande – PB.
Fonte: Dados da pesquisa, 2024.
Os achados dessa pesquisa foram corroborados pelas conclusões de Lopes e colaboradores (2024), que investigaram a incidência de aloanticorpos em pacientes transfundidos em hospitais atendidos pelo grupo GSH em São Luís, Maranhão. Entre os 53 pacientes com resultados positivos para PAI, constatou-se uma predominância do gênero feminino, com 67,9% (n=36), em comparação a 32,1% (n=17) do gênero masculino. Quanto à faixa etária, a maioria dos pacientes (n=31), tinham mais de 60 anos. Assim, os resultados de ambos os estudos mostram uma convergência, indicando maior prevalência de aloanticorpos em pacientes do gênero feminino e em faixas etárias mais avançadas.
Cruz et al. (2024) observaram no banco de sangue Hemolabor, em Goiânia – Goiás, um padrão de resultados semelhante aos supracitados, visto que a maioria, ou seja 67% (n= 136) dos pacientes com anticorpos irregulares eram do gênero feminino e tinham mais de 60 anos (53,7%). Evidenciando de forma positiva a consistência da pesquisa em questão.
A prevalência de pacientes do gênero feminino com anticorpos irregulares pode ser parcialmente atribuída à aloimunização provocada por gestações, onde o sistema imunológico da mãe é exposto a antígenos fetais (Benedetti et al., 2020). Além disso, fatores hormonais e genéticos também podem influenciar a resposta imunológica das mulheres, tornando-as mais suscetíveis a desenvolverem anticorpos irregulares (Adani et al., 2024). Assim, a intersecção entre as experiências gestacionais e a resposta imune feminina contribui para essa significativa associação observada na prática clínica.
De acordo com o estudo de Benedetti e colaboradores (2020) pacientes de idade avançada frequentemente apresentam uma maior incidência de anticorpos irregulares, o que pode ser atribuído a fatores como a redução da eficiência do sistema imunológico, que resulta em uma resposta menos robusta, tornando esses indivíduos mais vulneráveis e consequentemente mais suscetíveis a doenças que requerem transfusões de sangue, aumentando o risco de sensibilização a antígenos eritrocitários. Além disso, a exposição acumulada a infecções e procedimentos médicos ao longo da vida, juntamente com comorbidades como doenças autoimunes, contribui para o desenvolvimento de anticorpos irregulares nesse grupo etário.
O Gráfico 2 ilustra a distribuição dos grupos sanguíneos do Sistema ABO e o Fator Rh entre os pacientes com anticorpos irregulares positivos atendidos pelo Hemocentro Regional de Campina Grande – PB. Entre os 72 pacientes avaliados, o grupo O positivo predominou, representando 36,12% (n=26) dos casos, seguido pelo grupo A positivo com 23,61% (n=17).
Gráfico 2: Caracterização do sistema ABO e fator Rh dos pacientes com anticorpos irregulares atendidos no Hemocentro Regional de Campina Grande – PB.
Fonte: Dados da pesquisa, 2024.
Esses resultados coincidem com os achados de Kroger, Marinho e Anastácio (2024), que conduziram uma pesquisa no Hospital Júlia Kubitscheck, em Minas Gerais, na qual foram examinados 82 prontuários de pacientes com resultados positivos na pesquisa de anticorpos irregulares (PAI). A partir dessa análise, os dados revelaram que a maioria dos pacientes pertenciam ao grupo sanguíneo O positivo, representando 35% do total, seguido pelo grupo A positivo, que correspondia a 31%. Essa similaridade entre os estudos destaca a relevância dos grupos sanguíneos O e A positivo na caracterização do perfil dos pacientes com aloanticorpos.
No estudo realizado por Miranda (2024), foram compilados dados sobre transfusões sanguíneas de três unidades de um banco de sangue privado no Distrito Federal. A análise desses registros mostrou uma disparidade dos fenótipos sanguíneos ABO entre os 184 pacientes. O grupo sanguíneo O positivo foi o mais prevalente, com 28,80% (n= 53) dos casos, seguido pelo grupo A positivo, com 26,09% (n= 48). Os dados obtidos estão alinhados com a pesquisa em questão, que igualmente apontaram a maior prevalência dos grupos O positivo e A positivo, reforçando essa tendência nos perfis sanguíneos observada em diferentes populações.
A maior prevalência de anticorpos irregulares em pacientes com sangue O positivo seguido de A positivo está relacionada, principalmente, à sua alta representatividade na população. Esses dois grupos sanguíneos são os mais comuns em muitas regiões brasileiras, o que significa que pacientes com esses tipos são mais frequentemente submetidos a tratamentos que envolvem transfusões sanguíneas (Monteiro et al., 2020). Cada transfusão aumenta a possibilidade de contato com antígenos diferentes dos presentes no próprio sangue do paciente, levando o sistema imunológico a produzir anticorpos irregulares em resposta. Portanto, a predominância de anticorpos irregulares entre pacientes O positivo e A positivo refletem não uma particularidade intrínseca desses grupos, mas sim a sua maior frequência na população e a exposição recorrente a transfusões.
O Gráfico 3 demonstra a distribuição dos pacientes com anticorpos irregulares atendidos no Hemocentro Regional de Campina Grande – PB, conforme o histórico de transfusão sanguínea recebida. A maioria, representada por 41,7% (n=30) dos indivíduos, iriam realizar sua primeira transfusão quando apresentaram positividade para anticorpos irregulares. Em seguida, o grupo dos politransfundidos, com 34,7% (n=25) evidencia uma parcela significativa de indivíduos que já haviam sido expostos a múltiplas transfusões. Por fim, 23,6% (n=17) encontram-se na categoria “ignorado”, devido à falta de registro do histórico transfusional. Estes dados proporcionam uma visão geral do perfil transfusional dos pacientes, com destaque para a quantidade expressiva de indivíduos sensibilizados, inclusive aqueles que nunca haviam recebido transfusão. Isso ressalta a importância de se considerar o histórico transfusional para melhores práticas no manejo clínico.
Gráfico 3: Histórico transfusional dos pacientes com anticorpos irregulares positivos atendidos no Hemocentro Regional de Campina Grande – PB.
Fonte: Dados da pesquisa, 2024.
Falcão e colaboradores (2023), em estudo realizado no Banco de sangue Vita Hemoterapia na Bahia, identificaram a presença de aloanticorpos como o anti-M e o anti-Le, que na maioria das vezes não são clinicamente importantes, bem como autoanticorpos em pacientes com PAI positivo sem histórico transfusional. Entretanto, a maioria dos pacientes que apresentaram positividade para a pesquisa de anticorpos irregulares eram politransfundidos. De forma similar, Reis, Silva e Araújo (2023) destacam em sua pesquisa que a incidência de anticorpos irregulares pode ocorrer em aproximadamente 0,3% a 2% da população em geral. Essa taxa, no entanto, apresenta uma elevação significativa em pacientes politransfundidos, onde a aloimunização pode variar entre 10% a 35%.
A presença de aloanticorpos em pacientes que nunca receberam transfusões sanguíneas sugere que a sensibilização imunológica pode ocorrer por diversos fatores não relacionados à transfusão, como doenças autoimunes, fatores genéticos, alimentação e, em mulheres, por ocasião de gestações. Em condições autoimunes, o sistema imunológico pode reagir contra componentes do próprio organismo, promovendo uma predisposição à formação de anticorpos contra antígenos eritrocitários, ainda que esses pacientes nunca tenham sido expostos ao sangue alogênico. A predisposição genética também desempenha um importante papel, visto que certas populações têm uma maior diversidade de antígenos sanguíneos, aumentando a probabilidade de sensibilização. As populações africanas são um exemplo significativo, pois a sua diversidade genética é uma das maiores do mundo, o que resulta em uma gama extensa de fenótipos sanguíneos (Maryam et al., 2022). Quanto ao gênero feminino, a gestação é um dos fatores mais relevantes para a formação de aloanticorpos, uma vez que o sistema imunológico pode reconhecer os antígenos fetais como estranhos, levando à produção de anticorpos contra os mesmos (Carlin et al., 2023). Assim, estes anticorpos podem permanecer no organismo, sendo detectados mesmo em pacientes que nunca passaram por uma transfusão (Tormey; Hendrickson, 2019). Dessa forma, a identificação de aloanticorpos é crucial para evitar reações hemolíticas em eventuais transfusões futuras.
A ligação entre a nutrição e o sistema imunológico surgiu em meados da década de 70, quando testes imunológicos foram implementados como componentes de avaliação do estado nutricional (Rezende; Silva, 2020). Assim, a relação entre a alimentação e a formação de anticorpos irregulares em indivíduos sem histórico de transfusão é um campo de estudo com muitos questionamentos. Embora a dieta não tenha sido associada de forma direta à indução de anticorpos irregulares, estudos sugerem que, em casos específicos, certos componentes alimentares podem desencadear respostas imunológicas peculiares (Oliveira et al., 2022). As lectinas, por exemplo, são proteínas vegetais que se ligam a carboidratos presentes em várias células, incluindo glóbulos vermelhos, e podem teoricamente interagir com antígenos sanguíneos estimulando o sistema imunológico a formar anticorpos, especialmente em pessoas com predisposição imunológica (Silva et al., 2022).
As lectinas são encontradas em alimentos como legumes, grãos e sementes, e têm a capacidade de aglutinar células em ambiente controlado, o que é usado em alguns testes laboratoriais para identificar grupos sanguíneos (Nascimento et al., 2022). No entanto, a ingesta de alimentos ricos em lectinas e sua capacidade de desencadear uma resposta imunológica que resulte na produção de anticorpos irregulares clinicamente relevantes, como anti-Rh e anti-Kell ainda não foi bem compreendida e claramente comprovada, visto que não há evidências diretas de que a ingestão de tais alimentos induzam consistentemente a formação de aloanticorpos (Konozy; Dirar; Osman, 2024). Nesse contexto, as pesquisas imuno-hematológicas continuam investigando como diferentes estímulos, inclusive os dietéticos, podem interagir com o sistema imunológico em pessoas sem histórico transfusional ou gestacional.
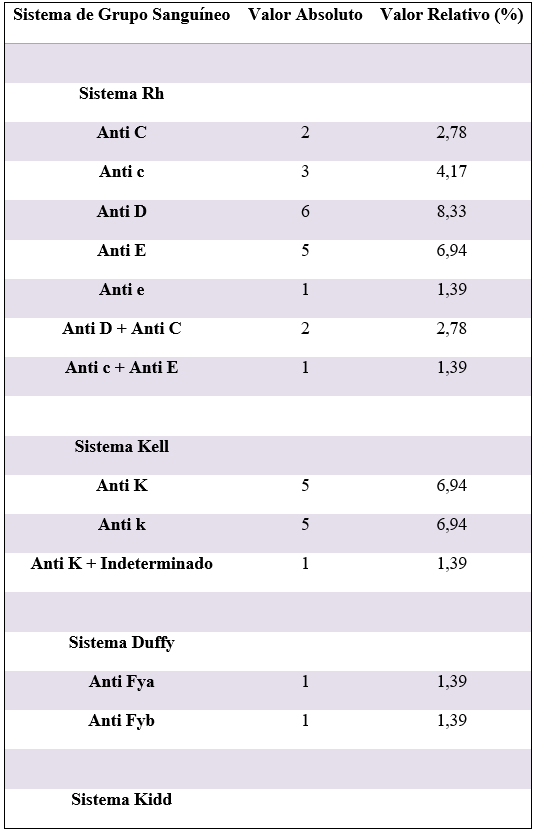
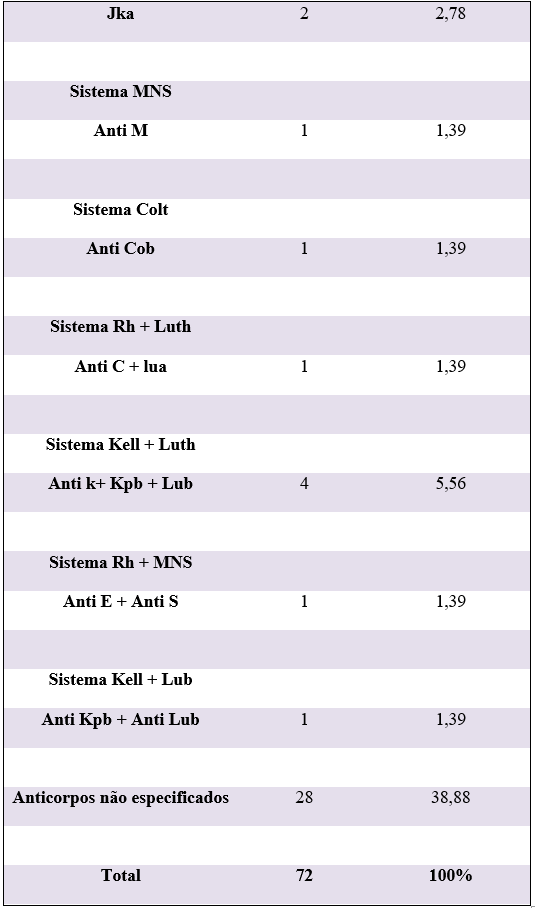
Na tabela 1 é possível notar a correlação entre a frequência e a classificação dos aloanticorpos de acordo com os diferentes sistemas de grupos sanguíneos. Os resultados mostram que 45,83% (n= 33) dos pacientes expressaram apenas um anticorpo, enquanto 9,72% (n=7) apresentaram dois e 1,39% (n=4) exibiram três anticorpos. Entre os 72 casos positivos para a pesquisa de anticorpos irregulares (PAI), 38,89% (n=28) não puderam ter sua especificidade determinada, seja devido a interferências, presença de autoanticorpos a frio, anticorpos contra antígenos de baixa frequência ou por motivos não esclarecidos. A análise dos AI identificados (61,11%; n=44) revelou que o sistema RH apresenta a maior frequência e diversidade de anticorpos irregulares, totalizando 23,61% (n=17) dos casos.
Tabela 1: Frequência de Aloanticorpos Identificados Em Pacientes Atendidos pelo Hemocentro Regional de Campina Grande – PB, segundo os Sistemas de Grupos Sanguíneos.
Fonte: Dados da pesquisa, 2024.
Dentro deste sistema, o Anti-D foi o mais prevalente, representando 8,33% (n=6) dos casos, seguido pelo Anti-E, com 6,94% (n=5). No sistema Kell, foram detectados 10 aloanticorpos, sendo que tanto o Anti-K (grande) quanto o Anti-k (pequeno) apresentaram uma frequência de 6,94% (n= 5) das ocorrências. Além disso, foram observadas combinações de aloanticorpos, sugerindo múltiplas sensibilizações em alguns pacientes. A associação Anti-k + Kpb + Lub, representa 5,56% (n= 4) dos casos, enquanto que Anti-D + Anti-C correspondeu a 2,78% (n= 2).
Os resultados deste estudo encontram suporte na pesquisa desenvolvida por Lima e colaboradores (2021) do Hemocentro Regional de Santa Maria (HEMOSM), Rio Grande do Sul, a qual teve como objetivo investigar a presença de anticorpos irregulares (AI) em pacientes atendidos durante o período da pandemia de COVID-19. Dos 15 resultados positivos, os mais prevalentes foram o Anti-D (3 casos), Anti-E (3 casos) e o Anti-Kell (3 casos), destacando a importância dos sistemas RH e Kell na prática transfusional, dada à sua relevância imunológica e potencial para causar reações adversas graves.
Similarmente, um estudo realizado em um hospital público do sul do Brasil, entre 2018 e 2022, identificou 220 aloanticorpos, com destaque para o Anti-D (54 casos), Anti-E (50 casos) e Anti-K (39 casos) (Wohlenberg et al., 2023). Em consonância com estes achados, Caitano et al. (2024) observaram em uma agência transfusional do extremo norte do Brasil, um perfil de resultados que se alinham aos da presente pesquisa, com destaque para a prevalência dos sistemas Rh (18,1%) e Kell (9,1%). Estes dados reforçam a consistência e confiabilidade dos resultados obtidos, evidenciando a relevância dos sistemas antigênicos RH e Kell, devido à sua significância clínica e alta frequência em diferentes regiões do país.
Em contrapartida, na pesquisa conduzida por Santos et al. (2022) na Santa Casa de Ourinhos, São Paulo, o perfil imunológico dos 67 pacientes com resultado positivo para a pesquisa de anticorpos irregulares, destacou a presença de 9 crioaglutininas (13,4%) e 8 anti-C (11,9%), evidenciando a diversidade de aloanticorpos identificados. Estes achados demonstram variações regionais nos perfis imunológicos, refletindo tanto as características populacionais locais quanto a complexidade da sensibilização imunológica em diferentes contextos transfusionais.
No presente estudo, a associação de aloanticorpos Anti-k + Kpb + Lub foi a mais prevalente, encontrada em 5,56% dos casos (n=4). Diferentemente dos achados desta pesquisa, Benetti et al. (2020) evidenciaram que, entre os 13,5% dos pacientes que apresentaram combinações de dois anticorpos, a associação Anti-D + Anti-C foi a mais frequente. Estes resultados ressaltam a variabilidade nas combinações imunológicas entre diferentes estudos e contextos, o que pode influenciar a complexidade da compatibilização sanguínea e a gestão transfusional.
Anticorpos irregulares são produzidos pelo organismo em resposta à exposição a antígenos eritrocitários não próprios, seja por transfusão sanguínea, transplantes de órgãos, gestação, abortos espontâneos, entre outros. A predominância dos aloanticorpos dos sistemas Rh e Kell, como Anti-D, Anti-E e Anti-Kell, observada neste e em vários estudos na literatura, está diretamente relacionada à alta imunogenicidade dos antígenos eritrocitários desses sistemas e sua capacidade de induzir uma rápida formação de anticorpos, o que aumenta a frequência da resposta imunológica e da formação de aloanticorpos em pacientes expostos (Barbosa et al., 2022).
Estes anticorpos possuem grande relevância clínica e transfusional, pois são capazes de causar reações hemolíticas graves nos pacientes, especialmente em situações de incompatibilidade materno-fetal. Nesses casos, pode ocorrer o desenvolvimento da eritroblastose fetal (EF) ou doença hemolítica do recém-nascido (DHRN), condições que comprometem a saúde do feto ou neonatal (Barbosa et al., 2022). Este risco enfatiza a importância da identificação precoce e do monitoramento regular de anticorpos irregulares, especialmente dos sistemas RH e Kell, em pacientes que requerem transfusões, como medida essencial para prevenir reações adversas e promover a segurança no processo transfusional. Dessa forma, uma gestão transfusional cuidadosa, com triagem detalhada de anticorpos e seleção de hemácias fenotipadas, torna-se fundamental, sobretudo, em pacientes previamente sensibilizados.
O Gráfico 4 exibe a frequência dos diferentes tipos de aloanticorpos identificados entre os pacientes atendidos no Hemocentro Regional de Campina Grande – PB, distribuídos em três categorias: 1ª Transfusão (barras amarelas), Politransfundidos (barras verdes) e Ignorado (barras marrons). O grupo dos “Indeterminados” aparece com destaque nas três situações analisadas, sendo mais prevalente entre os pacientes da categoria primeira transfusão, onde atinge 39,28% (n=11), indicando que muitos casos foram registrados sem uma especificação detalhada do anticorpo. Aloanticorpos específicos, como “Anti D” e “Anti E”, demonstraram uma maior significância na categoria de 1ª transfusão, aparecendo ambos em 10,71% (n=3) dos casos, sugerindo que esses anticorpos foram comumente detectados em pacientes que nunca haviam sido transfundidos. Enquanto que no grupo dos politransfundidos, o Anti-K foi o mais prevalente, ocorrendo em 16% (n=4) dos indivíduos analisados. Isso reflete a relevância deste aloanticorpo entre os pacientes que receberam múltiplas transfusões.
Gráfico 4: Perfil dos aloanticorpos identificados em pacientes atendidos no Hemocentro Regional de Campina Grande – PB de acordo com o histórico transfusional.
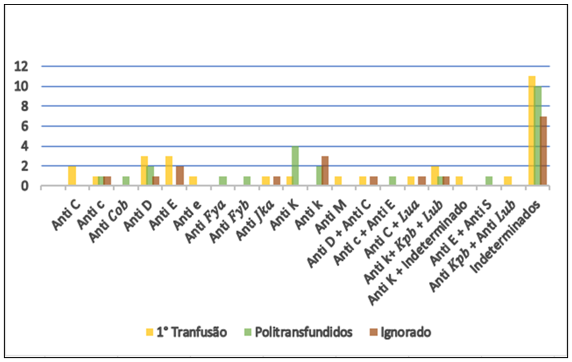
Fonte: Dados da pesquisa, 2024.
O estudo realizado por Oliveira e colaboradores (2022) sobre a frequência de anticorpos irregulares em pacientes atendidos no Centro Universitário Integrado de Saúde Amaury de Medeiros (CISAM) em Recife, Pernambuco, mostrou que o Anti-D foi o anticorpo mais frequentemente identificado, com 24 casos, seguido pelo Anti-E, com 7 casos. De maneira semelhante, a pesquisa realizada por Ni, Sun e Cong (2023) no Hospital afiliado à Universidade de Nantong, na China, destacou que, dos 131 casos positivos para anticorpos irregulares, 51,9% (n=68) estavam associados ao sistema Rh. Entretanto, os autores enfatizam que a alta prevalência desses anticorpos provavelmente está associada ao número significativo de pacientes politransfundidos atendidos pelas agências transfusionais incluídas no estudo, e não aos pacientes que nunca haviam sido transfundidos.
Hounogbé e colaboradores (2023) analisaram a incidência de anticorpos irregulares em 100 pacientes politransfundidos no Centro Hospitalar Universitário de Lomé, capital de Togo, na África. Entre os 13 pacientes com positividade na pesquisa de anticorpos irregulares (PAI), a maioria dos aloanticorpos foi direcionada contra antígenos do sistema Kell, com destaque para o anti-K, que foi o mais prevalente, encontrado em 18,52% dos casos. Por outro lado, o estudo redigido por Batista, Nakazawa e Paula (2021) no Hospital Municipal Vila Santa Catarina (HMVSC) em São Paulo, revelou que, dos 78 pacientes politransfundidos com PAI positivo, a maior parte dos aloanticorpos foi contra antígenos do sistema Rh, representando 43,8% dos casos. Essa diferença nos perfis imunológicos pode refletir fatores como a variabilidade genética entre as populações, visto que características genéticas regionais influenciam a distribuição de antígenos como Kell e Rh. Além disso, a disponibilidade e compatibilidade dos estoques de sangue em cada país, bem como as práticas de triagem e seleção de doadores, também exercem um impacto direto nesses resultados. Esses achados ressaltam a importância de monitorar cuidadosamente os pacientes politransfundidos, a fim de reduzir o risco de reações transfusionais e aprimorar a compatibilidade sanguínea.
Embora seja comum que os anticorpos irregulares sejam desenvolvidos como uma resposta imune a antígenos estranhos introduzidos por transfusões de sangue ou gestações, há situações em que o indivíduo desenvolve esses anticorpos sem exposição prévia conhecida a tais fontes (Rahimi-Levene et al. 2020). Em geral, essa produção espontânea é menos frequente. Na presente pesquisa, observou-se uma predominância de anticorpos anti-D e anti-E em 10,71% (n=3) dos pacientes que nunca haviam recebido transfusões, o que sugere uma influência de fatores genéticos e imunológicos. Além disso, é possível que reações cruzadas com epítopos de antígenos presentes em patógenos ambientais, como certas bactérias e vírus, ou mesmo em alimentos também possam, em raros casos, induzir a produção de aloanticorpos (Trier; Houen 2023). Este fenômeno vem sendo amplamente estudado na imunologia, pois a exposição constante do sistema imunológico a antígenos ambientais pode moldar a produção de anticorpos de maneira imprevisível, aumentando a complexidade da resposta imune.
Quanto à elevada prevalência do anti-Kell de 16% (n=4) entre os pacientes politransfundidos, esta pode ser respaldada por fatores relacionados à imunogenicidade do antígeno Kell e às transfusões repetidas. O antígeno K (grande) do sistema Kell, é conhecido por sua forte capacidade de induzir uma resposta imune, o que significa que mesmo uma exposição mínima pode desencadear uma resposta imunológica significativa (Folco et al., 2023).
Como os pacientes politransfundidos são repetidamente expostos a diversas unidades de sangue, a probabilidade de contato com antígenos Kell que não possuem, aumenta, resultando na sensibilização e produção de anticorpos dessa natureza. Além disso, essa prevalência pode ser agravada pelas práticas transfusionais que priorizam a compatibilidade ABO e RhD, enquanto antígenos menos comuns, como Kell, podem não ser considerados em todas as transfusões. Como resultado, a exposição a antígenos Kell não compatíveis se torna mais provável, levando à imunização desses pacientes. Assim, a seleção criteriosa de unidades de sangue que incluam a consideração de antígenos do sistema Kell poderia, portanto, reduzir o risco de formação de anticorpos e melhorar a segurança transfusional em pacientes politransfundidos (Dantas et al., 2024).

Embora sejam menos comuns, esses aloanticorpos, quando presentes, podem causar reações transfusionais adversas. Em pacientes politransfundidos, como aqueles com doenças crônicas, esses anticorpos raros podem dificultar a obtenção de sangue compatível, aumentando o risco de complicações. Enquanto que em gestantes sensibilizadas, especialmente em casos de anticorpos do sistema Rh e Kell, esses aloanticorpos podem atravessar a placenta e causar anemia fetal, afetando o desenvolvimento do bebê. Assim, o rastreamento e a identificação desses anticorpos são essenciais para “personalizar” transfusões e reduzir riscos, proporcionando um cuidado mais seguro e individualizado a pacientes, principalmente, de alto risco (Waldis et al.,2021).
5 CONSIDERAÇÕES FINAIS
- Entre os 72 pacientes analisados, observou-se a predominância do gênero feminino, representando 68,06% (n=49). Em relação à faixa etária, a maioria (27,78%; n=20) estava entre 61 e 80 anos.
- Quanto ao grupo sanguíneo, o O positivo foi o mais prevalente (36,12%; n=26), seguido pelo A positivo (23,61%; n=17).
- Dos pacientes que estavam realizando sua primeira transfusão, 41,7% (n=30) estavam sensibilizados, o que sugere sensibilização imunológica antes de qualquer exposição transfusional. Já 34,7% (n=25) eram politransfundidos, destacando a relação direta entre múltiplas transfusões e o risco aumentado de aloimunização.
- Quanto ao número de anticorpos, 45,83% (n=33) apresentaram apenas um aloanticorpo, enquanto 9,72% (n=7) exibiram dois e 1,39% (n=4) tinham três. Em 38,89% (n=28) dos casos positivos para a Pesquisa de Anticorpos Irregulares (PAI), a especificidade dos anticorpos não pôde ser determinada devido a interferências como autoanticorpos a frio, anticorpos contra antígenos de baixa frequência ou razões não esclarecidas.
- Entre os 44 anticorpos identificados (61,11%), o sistema Rh teve maior frequência, com Anti-D (8,33%; n=6) e Anti-E (6,94%; n=5) como os mais prevalentes.
- No sistema Kell, foram detectados 10 aloanticorpos, sendo que tanto o Anti-K (grande) quanto o Anti-k (pequeno) apresentaram uma frequência de 6,94% (n= 5) das ocorrências.
- Outras categorias com menor frequência incluíram Anti-Fyᵃ, Anti-Jkᵃ e Anti-C, cada um representando 1,39% dos casos.
- Associações de aloanticorpos também foram observadas. A combinação Anti-k + Kpb + Lub foi a mais prevalente (5,56%; n=4), seguida pela associação Anti-D + Anti-C (2,78%; n=2). Esses dados sugerem que associações envolvendo múltiplos aloanticorpos, embora menos comuns, têm relevância clínica importante, especialmente em pacientes politransfundidos, devido à maior complexidade no gerenciamento transfusional.
- Combinações raras, como Anti-C + Lua e Anti-E + Anti-S, foram registradas em apenas 1,39% dos casos (n=1).
- Na análise por categoria, os anticorpos indeterminados foram mais prevalentes entre os pacientes de primeira transfusão (39,28%; n=11).
- Aloanticorpos específicos, como “Anti D” e “Anti E”, demonstraram uma maior significância nesse grupo, aparecendo ambos com 10,71% (n= 3) dos casos, sugerindo que esses anticorpos foram comumente detectados em pacientes que nunca haviam sido transfundidos.
- Na categoria dos politransfundidos, o Anti-K foi o mais prevalente, ocorrendo em 16% (n= 4) dos indivíduos analisados. Isso reflete a relevância deste aloanticorpo entre os pacientes que receberam múltiplas transfusões.
- Este estudo reforça a importância do rastreamento e identificação de anticorpos clinicamente significativos em receptores de sangue, permitindo maior personalização nas estratégias transfusionais e, consequentemente, promovendo desfechos clínicos satisfatórios dos pacientes que dependem desse tipo de tratamento, minimizando os riscos de reações transfusionais associados à aloimunização.
REFERÊNCIAS
ACOSTA, A. X. et al. Genética no Sertão: entre natureza e cultura – uma abordagem interdisciplinar. Salvador: Editora da Universidade Federal da Bahia, 256p,2021. ISBN 978-65-5630-213-3.
ADANI, S. et al. Aloimunização de glóbulos vermelhos na gravidez: uma revisão da fisiopatologia, prevalência e fatores de risco. The Cureus Journal of Medical Science, v.16 n. 5, p. e60158, 2024.
ALBUQUERQUE, S. R. L. Manual de transfusão sanguínea. Manaus: Fundação Hospitalar de Hematologia e Hemoterapia do Amazonas, 75p. 2023.
ALMEIDA. S.N. et al. Frequência do antígeno dia e do anticorpo anti-dia em doadores de sangue, 2020.
ANVISA. Manual para o Sistema Nacional de Hemovigilância no Brasil. Revisão do “Marco Conceitual e Operacional da Hemovigilância: guia para a hemovigilância no Brasil”. Brasília, 2022.
ARNONI, C. P. et al. Diversidade de Variantes RHD em pacientes D-positivo que desenvolveram ANTI-D. Hematology, Transfusion and Cell Therapy, v. 43, p. S319, 2021.
BARBOSA, I. N. Q. Aloanticorpos eritrocitários não anti-RhD e sua associação com a Doença Hemolítica do Recém-nascido. Hematology, Transfusion and Cell Therapy, v. 45, p. S785, 2023.
BARBOSA, M. L. et al. Identificação de anticorpos irregulares em pacientes atendidos numa agência transfusional do grupo GSH em Teresina-PI. Hematology, Transfusion and Cell Therapy, v. 44, p. S422-S423, 2022.
BARROS, R. D. S. et al. O papel do fenótipo Lewis na classificação do status secretor em doadores de sangue. Hematology, Transfusion and Cell Therapy, v. 46, p. S852–S853, 2024.
BATISTA, P. S.; NAKAZAWA, C. Y.; PAULA, T. A. O. Prevalência de aloimunização eritrocitária em pacientes oncológicos em um hospital municipal de alta complexidade de São Paulo, 2021.
BENEDETTI, V. P. et al. Frequência de anticorpos irregulares identificados em pacientes atendidos em um hemonúcleo no sudoeste do paraná no ano de 2017. Arquivos de Ciências da Saúde da UNIPAR, v. 24, n. 3, 2020.
BONIFÁCIO, S. L.; NOVARETTI, M. C. Z. Funções biológicas dos antígenos eritrocitários. Revista Brasileira de Hematologia e Hemoterapia, v. 31, n. 2, p. 104-111, 2009.
BRASIL. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Atenção Hospitalar e de Urgência. Imuno-hematologia laboratorial / Ministério da Saúde, Secretaria de Atenção à Saúde, Departamento de Atenção Hospitalar e de Urgência. – Brasília: Ministério da Saúde, 2014.
BRASIL. Ministério da Saúde. Secretaria de Atenção Especializada à Saúde. Departamento de Atenção Especializada e Temática. Guia do cadastro nacional de sangue raro. Brasília: Ministério da Saúde,76 p, 2022.
BRASIL, Portaria de Consolidação N° 5, 28 de setembro de 2017. Sobre a consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde. Publicada no Diário Oficial da União, Brasília, 28 de setembro de 2017.
CAITANO, I. Y. S. et al. Frequência de anticorpos irregulares em uma agência transfusional do extremo Norte do Brasil. Hematology, Transfusion and Cell Therapy, v. 46, p. S912- S913, 2024.
CALDAS, A. S. et al. Anticorpos irregulares anti-eritrocitários em doadores de sangue. Revista Destaques Acadêmicos, v. 12, n. 3, 2020.
CARLIN, M. P. et al. Prevalência de aloimunização eritrocitária em pacientes atendidos em hospital privado do interior de São Paulo. Hematology, Transfusion and Cell Therapy, v. 45, p. S615, 2023.
CHAFFIN, J. Dosage Effect. Blood Bank Guy. 2019.
CORTEZ, A. J. P. Manual de hemoterapia. Colsan Associação Beneficente de Coleta de Sangue; p.99, São Paulo, 2022.
COSTA, C. S.; LEONIDAS, S. S. A importância dos grupos sanguíneos raros no abastecimento de bancos de sangue. 2022.
CRUZ, F. et al. Anticorpos irregulares e perfil epidemiológico de pacientes atendidos em um banco de sangue privado em Goiás. Hematology, Transfusion and Cell Therapy, v. 44, p. S465, 1 out. 2024.
DANTAS, I. L. S. et al. Doença hemolítica do feto e do recém-nascido por aloimunização Rh: Uma revisão de literatura. Research, Society and Development, v. 13, n. 7, p. e3213746248-e3213746248, 2024.
DOMENES, G. O. et al. Transfusão sanguínea: importância dos testes de triagem pré transfusionais. Revista Tópicos, vol. 1, nº 4. 2023.
DORNELLES, O. L. M.; BORDIN, P. H.; SANTINI, P. 1930: Karl Landsteiner. Salton, 2019.
FABENE, M. E. O. S. Desenvolvimento de anticorpos irregulares em pacientes politransfundidos. Trabalho de Conclusão de Curso (Bacharelado em Biomedicina) – Faculdade de Apucarana (FAP), Apucarana, 2022.
FALCÃO, S. et al. Frequência de anticorpos irregulares em pacientes atendidos pelo laboratório do Vita Hemoterapia da Bahia. Hematology, Transfusion and Cell Therapy, v. 45, p. S635-S636, 2023.
FILHO, P. S. P. S. et al. Doença hemolítica do recém-nascido (eritroblastose fetal): do diagnóstico ao tratamento. Research, Society and Development, v. 11, n. 4, p. e25911427377-e25911427377, 2022.
FOLCO, S. R. et al. Prevalência do antígeno K (KEL1) nos doadores de sangue do Hospital Santa Marcelina. Hematology, Transfusion and Cell Therapy, v. 45, p. S614-S615, 2023.
FRANCO, N. Pesquisadores britânicos descobrem novo grupo sanguíneo. Agência Brasil, 2024.
GUIMARÃES, H. C. T. Os sistemas de grupos sanguíneos kell, kidd e duffy. AC&T – Academia de Ciência e Tecnologia, 2019.
HENDRICKSON, J.E.; TORMEY, C.A. Understanding red blood cell alloimmunization triggers. American Society of Hematology. Education Program Book. vol.1, p. 446– 451, 2019.
HӦHER, G.; FIEGENBAUM, M.; ALMEIDA, S. Molecular basis of the Duffy blood group system. Blood Transfusion. vol. 16, n.1, p.93-100, 2018.
HOUNOGBÉ, A. S. et al. Evaluation of the prevalence of anti-erythrocyte alloimmunization in 100 polytransfused patients in Lomé, Togo. International Journal of Blood Transfusion and Immunohematology, v. 13, n. 2, p. 17-27, 2023.
INTERNATIONAL SOCIETY OF BLOOD TRANSFUSION. Red cell Immunogenetics and Blood Group Terminology (working group). Amsterdam, the Netherlands: 2021, Blood Group Terminology / Blood Group Allele Tables.
JUSTINO, R. G. N. et al. Conhecimento sobre a eritroblastose fetal em grupo de gestantes. Revista Multidisciplinar da Saúde, v. 3, n. 2, p. 16-23, 2021.
KONOZY, E. H.; DIRAR, A. I.; MAKARIM, E. M. O. Lectinas da família Araceae: Insights, distinções e caminhos futuros — Uma investigação de três décadas. Science Direct, 2024.
KOURY, W. K. Investigação da prevalência de anticorpos irregulares em doadores de sangue do Instituto Paranaense de Hemoterapia e Hematologia Ltda. 2018. Universidade de São Paulo, Ribeirão Preto, 2018. Tese de Mestrado.
KROGER, E.M.S.; MARINHO, A.J.F.; ANASTACIO, L.B. Presença de anticorpos irregulares em testes imuno-hematológicos de pacientes do Hospital Júlia Kubitscheck: avaliação do perfil dos pacientes e dos anticorpos identificados. Hematology, Transfusion and Cell Therapy, 2024.
LARA, B. S; RAMOS, C. F. de L.; SILVA, S. F. de J. Fenotipagem eritrocitária de antígenos pouco usuais e sua importância em transfusões sanguíneas. Trabalho de Conclusão de Curso (Graduação em Biomedicina) – Centro Universitário Una, Campus Aimorés, Belo Horizonte, 2022.
LIMA, F. Z. et al. Identificação de anticorpos irregulares em pacientes atendidos na agência transfusional do Hemocentro Regional de Santa Maria durante o período de pandemia de COVID-19. Hematology, Transfusion and Cell Therapy, v. 43, p. S321-S322, 2021.
LOPES, E. et al. Incidência de anticorpos irregulares em pacientes transfundidos em hospitais atendidos pelo Grupo GSH em São Luís-MA. Hematology, Transfusion and Cell Therapy, HEMO, v. 46, p. S790–S791, 2024.
MARYAM, D. U. et al. High prevalence of serological weak D phenotype and preponderance of weak D type 4.0.1. genetic variant in a Nigerian population: implications for transfusion practice in a resource-limited setting. Hematology, Transfusion and Cell Therapy, v. 44, p. 386–391, 2022.
MCCULLOUGH, J. Transfusion Medicine. In. ILSTRUP, Sara J. Blood Groups. 5th ed. WileyBlackwell. P. 135-167, 2021. Acesso restrito via base de dados Wiley Online Library.
MELO, W. E. S. et al. Aloimunização eritrocitária em pacientes com anemia falciforme atendidos no Hemocentro de Caruaru, Pernambuco, Brasil. Acta Biomedica Brasiliensia, v. 9, n. 1, p. 122-129, 2018.
MERCHAN, M. A. CÁCERES, E. X. U.; BECERRA, M. L. C. Anticuerpos irregulares en donantes de sangre. Revista Cubana de Hematología, Inmunología y Hemoterapia, v.37, n. 4, 2021.
MIRANDA, E.; TORRES, F. S. Uso de aulas práticas investigativas na consolidação da aprendizagem e vivência do método científico-uma abordagem sobre grupos sanguíneos do sistema ABO. Experiências em Ensino de Ciências, v. 13, n. 4, p. 323-338, 2018.
MIRANDA, G. K. A. Prevalência de anticorpos irregulares em pacientes politransfundidos. 2024. Monografia (Graduação em Biomedicina) – Centro Universitário Fasipe – UNIFASIPE, Sinop, 2024.
MONTEIRO, J. M. Testes Imunohematológicos Pré-Transfusão Sanguínea. 2022. Monografia (Graduação em Biomedicina) – Faculdade Pitágoras, Belo Horizonte, 2022.
MONTEIRO, L. A. et al. Frequências fenotípicas dos sistemas de grupos sanguíneos ABO, Rh e Kell em doadores de sangue da região metropolitana de Belém-PA. RBAC, v. 52, n. 4, p. 366-70, 2020.
NASCIMENTO, M. C. et al. Revisão bibliográfica: lectinas – aspectos gerais e seus benefícios à agroindústria. II Congresso Internacional de Inovação Científica para Agroindústria e Meio Ambiente, 2022.
NI, S.; SUN, Y.; CONG, L. Analysis of Specificity and Distribution Characteristics of Red Blood Cell Irregular Antibodies. Laboratory Medicine, v. 54, n. 5, p. 507-512, 2023.
OLIVEIRA, D. S. et al. Perfil de anticorpos irregulares em pacientes atendidas no Centro Universitário Integrado de Saúde Amaury de Medeiros. Hematology, Transfusion and Cell Therapy, v. 44, p. S482, 2022.
PINHEIRO, Clayton Josef Thomaz et al. A frequência e a importância da identificação de anticorpos sanguíneos em doadores de sangue com pesquisa de anticorpos irregulares positiva no estado do Amapá. Vigilância Sanitária em Debate: Sociedade, Ciência & Tecnologia, v. 9, n. 3, p. 77-83, 2021.
PINTO, A. D.; DOMINGOS, E. J.; MANUEL, I. G. Sistema Diego. 2024.
PEREIRA, L.; SIEBERT, T. Frequência fenotípica dos grupos sanguíneos ABO e fator RH em Santarém, Pará – Brasil. Revista Brazilian Journal of Development, Curitiba, v. 6, n. 10, p. 78472-78481, oct. 2020.
QUIRINO, M. G. et. al. Methods for blood group antigens detection: cost-effectiveness analysis of phenotyping and genotyping. Hematology, Transfusion and Cell Therapy, v. 41, p. 44-49, 2019.
QUITÉRIO, G. S.; SOUZA, S. A. G. de. Fenótipos sanguíneos raros no hemocentro de Ribeirão Preto. Monografia (Programa de Aprimoramento Profissional/CRH/SES- SP) – Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo – USP/Hemocentro, Ribeirão Preto, 2018.
RAHIMI‐LEVENE, N. et al. Red blood cell alloimmunization prevalence and hemolytic disease of the fetus and newborn in Israel: A retrospective study. Transfusion, v. 60, n. 11, p. 2684-2690, 2020.
REIS, S. S.; SILVA, M.V. C. M.; DE ARAÚJO, J. F. Os impactos dos erros transfusionais e riscos causados em pacientes. Brazilian Journal of Development, v. 9, n. 6, p. 19338- 19351, 2023.
REZENDE, G. S.; SILVA, V. de S. O papel da nutrição no sistema imunológico e sua relação com o COVID-19. Revista Gestão em Foco, n. 12, p. 231-244, 2020.
RODRIGUES, A. D.; RIBEIRO, L. R. Sistemas sanguíneos, incompatibilidade e procedimentos alternativos à transfusão. Brazilian Journal of Development, v. 7, n. 2, p. 13007-13027, 2021.
ROITT, Ivan. et al. Roitt Fundamentos de Imunologia. 13. ed. Rio de Janeiro: Guanabara Koogan Ltda, 513p, 2018.
ROMPHRUK, A.V.et al. Phenotype frequencies of Rh (C, c, E, e), M, Mia and Kidd blood group systems among ethnic Thai blood donors from the north‐east of Thailand. International Journal of immunogenetics. 2019.
ROSA, L. S. Teste de Antiglobulina Humana Indireto em Gestantes Aloimunizadas: Uma Revisão Sistemática. 2018. Monografia (Graduação em Farmácia) – UFSC, Universidade Federal de Santa Catarina.
ROSÁRIO, A. M. C. D. et al. Identification of irregular antibodies in blood donors from an Amazon state: frequency and relevance. Hematology, Transfusion and Cell Therapy, v. 45, p. S775, 2023.
SACRAMENTO, A. V. C. Anticorpo de especificidade indeterminada: Uma revisão de literatura. 2022. 8. Monografia. (Especialização em Hematologia e banco de sangue). Academia de Ciência e Tecnologia, São José do Rio Preto – SP. 2022.
SANTANDER, N. C. L. F. Principais anticorpos irregulares em politransfundidos: uma revisão de literatura. 2019. Monografia (Graduação em Biomedicina), Universidade Federal do Rio Grande do Norte, Natal, 2019.
SANTIAGO, E. B. Desenvolvimento de um teste rápido para determinação da tipagem sanguínea dos sistemas ABO e Rh. Dissertação (Mestrado em Ciências) – Universidade Tecnológica Federal do Paraná, Curitiba, 2020.
SANTOS, C. F. et al. A importância das investigações imunohematológicas a fim de evitar a aloimunização. Revista Científica de Saúde do Centro Universitário de Belo Horizonte (UNiBH). 2022.
SANTOS, E. F. G. D. et al. Perfil de especificidade e prevalência de anticorpos irregulares nos pacientes atendidos pela Santa Casa de Ourinhos de 2018 a 2022. Hematology, Transfusion and Cell Therapy, v. 44, p. S425-S426, 2022.
SILVA, A. R da. Padronização da genotipagem de alelos dos sistemas de grupo sanguíneo Diego, Dombrock e Duffy por PCR em tempo real na Fundação Hemominas. 2018. 78 f. Dissertação (Mestrado em Análises Clínicas e Toxicológicas) – Universidade Federal de Minas Gerais, Faculdade de Farmácia, Belo Horizonte, 2018.
SILVA, A. P. D. Análise dos aspectos imuno-hematológicos na condução da doença hemolítica perinatal no Hospital Naval Marcílio Dias. 2022.
SILVA, E. N. da. et al. Aspectos gerais das lectinas vegetais. Latin American Journal of Development, Curitiba, v. 4, n. 6, p. 1955-1964, nov./dez., 2022.
SILVA, T.C.P. et al. A importância da fenotipagem eritrocitária na prevenção da aloimunização. Belo Horizonte, 2021. Monografia (Graduação em Biomedicina), Centro Universitário Una Biomedicina, Belo Horizonte, 2021.
SMART, E.; ARMSTRONG, B. Blood group systems. ISBT Science Series, V. 15, S1, p. 123-150, 2020.
SOLANKI, A.; CHANDRA, T.; SINGH, A. Prevalence of red blood cell antibodies in whole blood donors: A single-centre experience in north India. Indian J Med Res, V. 152, p. 280-284, 2020.
SOUSA, A. et al. Evento raro de anticorpo anti-lea em indivíduos com fenótipo le (a-b+). relato de caso e discussão. Hematology, Transfusion and Cell Therapy, HEMO 2024. v. 46, p. S863–S864, 1 out. 2024.
SOUZA, P. et al. Frequência do antígeno Dia em acadêmicos de uma universidade do estado de Santa Catarina. Revista Brasileira de Pesquisa em Saúde/Brazilian Journal of Health Research, v. 24, n. 3, p. 39–45, 2022.
THONIER, V. Immuno-hematological findings in Delayed Hemolytic Transfusion Reaction (DHTR). Transfusion Clinique et Biologique. vol. 26, n.2, p.102-108, 2019.
TORMEY, C. A.; HENDRICKSON, J.E. Transfusion-related red blood cell alloantibodies: induction and consequences. Blood, The Journal of the American Society of Hematology, v. 133, n. 17, p. 1821-1830, 2019.
TRIER, NH; Houen, G. “Reatividade cruzada de anticorpos em doenças autoimunes.” International Journal of Molecular Sciences , vol. https ://doi.org /10.3390/ijms. 2023.
VALENSUELA, L. F.; MORAES, A. B. C. Fenótipos incomuns do sistema ABO: você realmente não é filho de um de seus pais?. 2023. Monografia. (Aperfeiçoamento/Especialização em Biomedicina) – Universidade São Francisco.
WALDIS, S. J. et al. Rh alloimmunization in chronically transfused patients with thalassemia receiving RhD, C, E, and K matched transfusions. Blood Advances, v. 5, n.3, p. 737-744, 2021.
WOHLENBERG, M. F. et al. Perfil de anticorpos irregulares identificados em pacientes atendidas por uma agência transfusional de porto alegre. Hematology, Transfusion and CellTherapy, v. 45, p. S616-S617, 2023.
1Discentes do Curso Superior de Farmácia da Universidade Estadual da Paraíba Campus I, e-mail: maria.ramalho95@gmail.com; luanecarvalho07@gmail.com
2Discentes do Curso de Medicina da Faculdade de Ciências Médicas (FCM), e-mail: freitasitalopereira@gmail.com; magalhaesmarta09@gmail.com
3Docente do Curso Superior de Farmácia da Universidade Estadual da Paraíba Campus I. Doutor em Recursos Naturais (PPGEGRN/UFCG), e-mail: heronidesp@servidor.uepb.edu.br
4Docente do Curso Superior de Farmácia da Universidade Estadual da Paraíba Campus I. Doutora em Biotecnologia em Saúde (RENORBIO/UFPB), e-mail: patriciafreitas@servidor.uepb.edu.br
