IDIOPATHIC BRONCHIECTASIS IN A YOUNG PATIENT WITHOUT CYSTIC FIBROSIS: CASE REPORT
REGISTRO DOI: 10.69849/revistaft/fa10202503182231
Priscila Pires Gonçalves1, Ana Carolina Mota de Sousa2,Carolina Moresi Vieira3, Geovana dos Santos Magalhães4, Levy Jessé Cabral da Silva Fernandes5, Mário Sérgio Monteiro Fonseca6
RESUMO
Introdução: A bronquiectasia é uma doença pulmonar crônica caracterizada por tosse, produção excessiva de escarro e exacerbações frequentes. Caracteriza-se por inflamação e infecção crônica das vias aéreas, com danos pulmonares progressivos. Está associada a distúrbios genéticos, autoimunes, infecciosos ou idiopáticos – quando não é possível detectar sua etiologia. Este relato descreve o caso de um homem jovem diagnosticado com bronquiectasia não fibrocística idiopática grave, com piora progressiva da função pulmonar e múltiplas exacerbações infecciosas. Relato de caso: Masculino, 37 anos, diagnosticado com bronquiectasia há 15 anos. Apresenta tosse secretiva diária, dispneia, hemoptise ocasional, astenia e fadiga crônica. Etiologias como fibrose cística, aspergilose broncopulmonar alérgica, tuberculose pulmonar ativa e imunodeficiências adquiridas foram excluídas. Colonização por Pseudomonas aeruginosa foi identificada, sendo submetido à terapia antimicrobiana visando erradicação. Ao longo dos últimos 5 anos, evolui com múltiplas exacerbações e necessidade de, em média, duas a três internações hospitalares ao ano, com piora progressiva da função respiratória, distorção importante da arquitetura pulmonar e hipertensão pulmonar, sendo encaminhado para transplante. Discussão: A exposição ambiental em um pulmão suscetível parece ser a melhor explicação para a bronquiectasia não fibrocística. Vale destacar a etiologia pós infecciosa como principal descrita na literatura, contribuindo com 20-32% dos casos. A doença leva a remodelação brônquica e progressiva redução da função pulmonar, especialmente em condições em que não é detectado sua causa subjacente, reduzindo a capacidade funcional do paciente e gerando grande impacto social e econômico. Estudo observacional destacou que até 37% dos pacientes podem ter seu manejo afetado quando possuem etiologia definida. Essa terapêutica incluirá, ainda, manejo sintomático e multidisciplinar, com foco no controle das exacerbações e reabilitação pulmonar. Conclusão: A análise desses casos é fundamental para aprofundar o entendimento da patogênese, identificar a etiologia e evidenciar o impacto na vida do paciente.
Palavras-chave: Bronquiectasias. Idiopática. Exacerbações.
Introdução
A bronquiectasia é definida clinicamente como uma doença pulmonar crônica heterogênea onde o paciente pode apresentar tosse, produção excessiva de escarro e exacerbações pulmonares frequentes, e radiologicamente identificada pelo alargamento anormal dos brônquios (CHALMERS et al., 2024).
Essa patologia está associada a vários distúrbios genéticos, autoimunes e infecciosos das vias aéreas, porém em uma parcela dos pacientes não é possível identificar a etiologia, sendo determinada então como causa idiopática (FLUME; CHALMERS; OLIVIER, 2018). Uma revisão sistemática identificou que em média 44,8% dos pacientes com bronquiectasia têm seu diagnóstico concluído como causa idiopática, podendo ter variações geográficas chegando a 80,7% (GAO et al., 2016).
Independentemente da causa subjacente, às características específicas da bronquiectasia são inflamação e infecção crônicas das vias aéreas, depuração mucociliar regionalmente prejudicada, hipersecreção de muco e obstrução de muco, bem como dano pulmonar estrutural progressivo (FLUME; CHALMERS; OLIVIER, 2018; McSHANE et al., 2013).
O caso a seguir descreve o quadro de um adulto jovem convivendo com a doença por aproximadamente 15 anos, que a despeito da exclusão das principais causas, não foi possível identificar sua etiologia, evoluindo com múltiplas internações hospitalares por exacerbações e infecções recorrentes, sem tratamento específico para reduzir a progressão da patologia. Um estudo observacional demonstrou que a intervenção terapêutica específica após identificação do fator etiológico afetou o tratamento em 37% dos pacientes com bronquiectasias, melhorando seu prognóstico (SHOEMARK; OZEROVITCH; WILSON, 2007).
Essa situação impacta diretamente a qualidade de vida do paciente, com progressiva limitação nas atividades diárias, fadiga, ansiedade relacionada à sua condição de saúde, bem como a sensação de estar constantemente doente. As infecções e internações recorrentes contribuem para multirresistência bacteriana com progressão de escalonamento antimicrobiano restrito além de um ciclo de deterioração da saúde física e mental.
Este relato de caso tem como objetivo descrever a sequência diagnóstica e de investigação do paciente, além de sua evolução desafiadora, para reflexão dos desfechos clínicos e sociais de uma doença progressiva e complexa.
Relato de caso
Paciente do sexo masculino, 37 anos, previamente hígido, iniciou seu quadro clínico há 15 anos com pneumotórax espontâneo, sendo diagnosticado com bronquiectasias. Não apresentava antecedentes de episódios infecciosos recorrentes na infância e negava exposições a fatores de risco significativos. Relatou histórico de tuberculose pulmonar tratada, mas sem confirmação laboratorial de Mycobacterium tuberculosis ou resultados positivos para bacilo álcool-ácido resistente (BAAR) em amostras de escarro. A partir de 2016, iniciou acompanhamento ambulatorial especializado para investigação etiológica.
A sintomatologia respiratória inicial foi caracterizada por tosse secretiva diária, dispneia aos médios esforços, dor torácica pleurítica intermitente e episódios ocasionais de hemoptise. Além disso, o paciente relatava fadiga e astenia, mas sem sinais sistêmicos como febre, artralgia, alterações cutâneas ou disfunções orgânicas, incluindo hepática, renal, tireoidiana ou cardíaca.
Diversos exames investigativos foram realizados, com resultados normais, incluindo: teste do cloreto no suor, espermograma, dosagem quantitativa de IgE, sorologias para hepatites virais, sífilis, HIV, pesquisa de BAAR e teste rápido molecular para Mycobacterium tuberculosis em amostras de escarro. O hemograma não revelou leucopenia ou eosinofilia. Esses resultados permitiram excluir etiologias como fibrose cística, aspergilose broncopulmonar alérgica, tuberculose pulmonar ativa e imunodeficiências adquiridas. No entanto, as culturas de escarro identificaram colonização por Pseudomonas aeruginosa.
A partir do diagnóstico e, especialmente, durante os períodos de exacerbações infecciosas, fez uso de agentes mucolíticos e broncodilatadores, por vezes associação de beta-agonistas e anti-muscarínicos de longa ação, em conjunto com fisioterapia para realização de técnicas de reabilitação pulmonar. Com o passar dos anos, passou a atingir nível III pela escala de dispneia Medical Research Council (MRC). Em paralelo, também fez uso de terapia antimicrobiana sistêmica e inalatória direcionada à Pseudomonas aeruginosa, visando à erradicação, com escarros subsequentes já sem evidência deste patógeno. As novas culturas de escarro dos últimos 3 anos, portanto, passaram a evidenciar germes pertencentes à microbiota mista, como Streptococcus sp. e Staphylococcus coagulase negativa. Em 2024, fora submetido à broncoscopia para coleta de lavado broncoalveolar, sendo então identificado crescimento de Staphylococcus aureus resistente à meticilina, o que resultou na inclusão de Vancomicina no esquema antimicrobiano.
Nos últimos cinco anos, o paciente apresentou uma piora progressiva da função respiratória, com redução significativa da qualidade de vida e múltiplas internações hospitalares por exacerbações infecciosas, ocorrendo em média duas a três vezes por ano. Além disso, foi observada uma expressiva perda de peso associado a sinais de sarcopenia, com atual índice de massa corporal (IMC) de 14,34 kg/m². O seguimento nutricional e endocrinológico foi iniciado. Um ecocardiograma recente já revelou sinais de disfunção diastólica, com fração de ejeção intermediária (49%) e sinais indiretos de hipertensão pulmonar.
A tomografia computadorizada (TC) de tórax mais recente (Figura 1) revela distorção arquitetural do parênquima pulmonar, com predomínio no pulmão esquerdo, caracterizada por múltiplas bronquiectasias, algumas com aspecto cístico e paredes espessadas, associadas a sinais de implantação mucóide, compatíveis com broncopneumopatia inflamatória/infecciosa ativa. Observou-se ainda estrias fibroatelectásicas esparsas nas bases pulmonares, com redução volumétrica do pulmão esquerdo e desvio do mediastino ipsilateral. Linfonodos mediastinais aumentados foram visualizados, medindo até 2,0 cm. O tronco da artéria pulmonar apresentou aumento do diâmetro (3,2 cm), sugerindo possível hipertensão pulmonar.
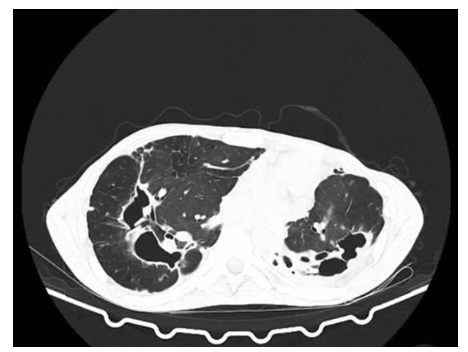
Figura 1: TC de tórax demonstrando dilatação cística e cilíndrica dos brônquios. Fonte: Acervo pessoal, 2025.
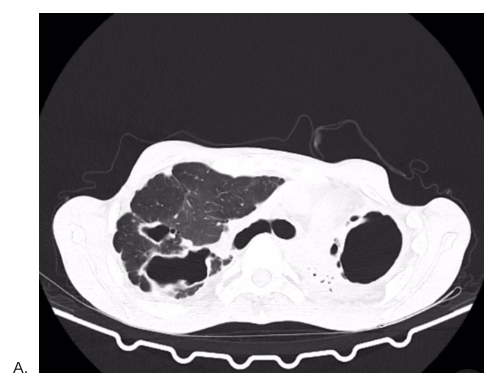
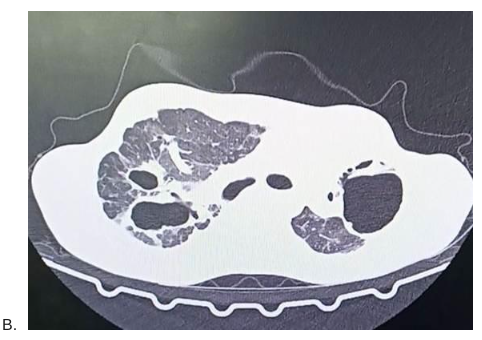
Figura 2: TC de tórax comparativa em fevereiro de 2025 (A) e agosto de 2023 (B), ambas já demonstrando alteração arquitetural significativa com redução volumétrica do pulmão esquerdo. Fonte: Acervo pessoal, 2025.
Atualmente, o paciente permanece poucos períodos oligossintomáticos. Foi prescrito terapia com azitromicina três vezes por semana, por período estendido, objetivando atingir seu efeito imunomodulador, porém com adaptação prejudicada devido queixa de sintomas dispépticos e diarreia. Devido às dificuldades de acesso implicadas ao paciente no âmbito do sistema público, possui dificuldade para manter seguimento com fisioterapia e reabilitação pulmonar para melhora na qualidade de vida. Logo, na ocasião de nova piora sintomática – dessaturação, piora da tosse, mudanças no padrão do escarro, queda do estado geral, febre – a antibioticoterapia é reintroduzida e, consequentemente, indicado internação hospitalar. Há 1 ano, o paciente foi encaminhado para avaliação junto à equipe de transplante pulmonar via terapia fora de domicílio (TFD) devido indisponibilidade deste tratamento em sua região.
Discussão
A bronquiectasia é definida clínico-radiologicamente pela dilatação irreversível dos brônquios proximais e médios, de etiologias diversas. A sua forma não associada à fibrose cística, anteriormente considerada uma doença órfã, tem apresentado maior relevância diagnóstica possivelmente impulsionada pela maior disseminação da tomografia de tórax de alta resolução (TCAR). Sua prevalência permanece desconhecida, embora esse achado seja identificado em cerca de 35% a 50% dos pacientes com doença pulmonar obstrutiva crônica (DPOC) grave e em 25% dos casos de asma grave. Nas sociedades industrializadas, sua incidência tem diminuído progressivamente, em grande parte devido ao acesso ampliado à antibioticoterapia e à vacinação (ADETILOYE et al., 2019; GIRÓN; GOLPE; MARTÍNEZ-GARCÍA, 2024; PEREIRA et al., 2019).
A exposição ambiental em um pulmão geneticamente suscetível parece ser a melhor explicação para a patogênese das bronquiectasias não fibrocísticas. Esse comprometimento está ligado à falha nas defesas pulmonares e modificação do microbioma pulmonar, reduzindo a eficácia na eliminação de partículas externas e gases tóxicos, culminando em um estado inflamatório crônico seguido de remodelação brônquica. O acometimento de pequenas vias aéreas, como bronquiolite e bronquiolectasias, podem preceder o seu aparecimento (PEREIRA et al., 2019).
Condições adquiridas que acometem difusamente o pulmão, como infecções por bactérias, micobactérias, vírus e fungos, representam uma das principais etiologias das bronquiectasias, corroborando com 20-32% dos casos. Além dessas, destacam-se doenças como DPOC, asma, aspergilose broncopulmonar alérgica, doenças autoimunes como artrite reumatoide, pneumonite inflamatória secundária ao refluxo gastroesofágico ou microaspiração crônica, imunodeficiências adquiridas, como o HIV, e exposição ambiental inalatória à fumaça ou produtos de combustão. Entre as causas congênitas, a fibrose cística é a mais relevante, seguida pela discinesia ciliar primária e por imunodeficiências primárias. Em alguns casos, entretanto, não é possível identificar o fator desencadeante do processo inflamatório, levando ao diagnóstico de bronquiectasia idiopática (IMAM; DUARTE, 2020; PEREIRA et al., 2019).
Determinar a etiologia requer exclusão da principal causa congênita que é a fibrose cística; um estudo retrospectivo de 1.000 pacientes no Canadá demonstrou que 7% dos pacientes foram diagnósticos com 18 anos ou mais de idade, apesar de ser uma doença que comumente afeta a população infantil (IMAM; DUARTE, 2020). Conforme o Protocolo Clínico e Diretrizes Terapêuticas para Fibrose Cística do Ministério da Saúde do Brasil (2024), o sistema único de saúde (SUS) oferece triagem neonatal para fibrose cística, realizado nos primeiros dias de vida do recém-nascido.
Uma revisão sistemática com inclusão de 338 publicações sobre bronquiectasias, destacou que a forma idiopática pode atingir até 80,7% dos estudos. Dentre esses, estudo observacional destacou que até 37% dos pacientes podem ter seu manejo afetado quando encontram a causa subjacente à bronquiectasia. Na maioria das diretrizes sobre esta patologia, é recomendado que sejam procedidos os exames investigativos, visto que pode ser instituída a terapêutica direcionada; apesar disso, estudos futuros ainda são necessários para determinar o real impacto da sua não identificação etiológica (CHALMERS et al., 2024).
Conforme demonstrado nesse caso clínico, as alterações mencionadas resultam em alteração da arquitetura pulmonar e sintomatologia respiratória crônica, caracterizada por tosse produtiva, dispnéia progressiva, infecções respiratórias recorrentes e aumento da frequência de hospitalizações. O estado inflamatório pulmonar crônico também pode desencadear sintomas sistêmicos como fadiga e perda ponderal. A Pseudomonas aeruginosa é um microrganismo frequentemente envolvido nessa condição, estando associada a maior gravidade e pior prognóstico (IMAM; DUARTE, 2020; GARCIA-CLEMENTE et al., 2020).
Nos países subdesenvolvidos, essa patologia ainda enfrenta desafios significativos devido às limitações de recursos diagnósticos e terapêuticos. Diversos fatores podem impactar negativamente a evolução da doença, incluindo pobreza, desnutrição, baixa cobertura vacinal, escassez de medicamentos, exposição a agentes tóxicos ambientais e alta prevalência de doenças infecciosas (ADETILOYE et al., 2019).
Por se tratar de uma doença pulmonar crônica com exacerbações frequentes, seu impacto social e econômico vem sendo cada vez mais estudado. Fatores como idade, dados espirométricos como VEF1%, infecção crônica por Pseudomonas aeruginosa e frequência de internações hospitalares estão ligados a um aumento significativo nos custos anuais relacionados à patologia (DE LA ROSA et al., 2016).
O tratamento exige acompanhamento especializado e manejo multidisciplinar. A reabilitação pulmonar desempenha um papel crucial no manejo da doença, com necessidade de acompanhamento longitudinal com fisioterapia para realização de técnicas de aumento do clearance mucociliar e prática regular de exercícios físicos para melhora da capacidade funcional, melhora da qualidade de vida e redução das exacerbações. Os pacientes exacerbadores têm aumento no número de hospitalizações e da mortalidade em 5 anos (PEREIRA et al., 2019; CHALMERS et al., 2024).
O controle sintomático pode incluir o uso de beta-agonistas de longa duração para pacientes com dispneia. Por outro lado, não há evidências suficientes para recomendar rotineiramente o uso de corticosteroides inalatórios, sendo seu uso mais bem aplicado a subgrupos específicos, como pacientes com DPOC ou asma. Agentes osmóticos, como a salina hipertônica inalatória, podem ser benéficos para indivíduos secretivos. Outros agentes mucolíticos, como a N-acetilcisteína, embora uma opção na prática clínica, não possui evidência científica robusta que demonstre benefício clínico. Vale ressaltar que as evidências aplicadas à fibrose cística não podem ser extrapoladas para bronquiectasias não fibrocística, exemplificado pelo uso contraindicado da terapia mucolítica com DNAse humana recombinante (rhDNAse) (ALTENBURG et al., 2015; IMAM; DUARTE, 2020; PEREIRA et al., 2019).
O manejo das exacerbações envolve antibioticoterapia direcionada, com ênfase em agentes contra Pseudomonas aeruginosa. A Sociedade Brasileira de Pneumologia e Tisiologia (2019) sugere que, em casos de primo-infecção, seja procedida a tentativa de erradicação precoce. Para tratamento ambulatorial, as quinolonas podem ser uma opção, enquanto internações hospitalares, quando necessárias, devem considerar a combinação de beta-lactâmicos com aminoglicosídeos parenterais, associada à terapia antimicrobiana inalatória por pelo menos três meses. Quanto aos macrolídeos, a azitromicina pode ser indicada para pacientes com pelo menos duas exacerbações anuais ou uma exacerbação grave, como terapia contínua recomendada entre seis e doze meses. Seu efeito imunomodulador envolve a redução da produção de muco, inibição da formação de biofilme bacteriano, supressão de mediadores inflamatórios e regulação do recrutamento de leucócitos. Contudo, é necessário realização de culturas de escarro para micobactérias não tuberculosas devido risco aumentado de resistência destes germes. Logo, para pacientes com sinais de doença avançada como hipertensão pulmonar, hipoxemia persistente e cor pulmonale, além daqueles que demandam uso de oxigenioterapia domiciliar, a opção terapêutica inclui encaminhamento ao transplante pulmonar.
Conclusão
Este relato ilustra o caso de um paciente jovem, sexo masculino, portador de bronquiectasia não fibrocística idiopática grave, com múltiplas internações hospitalares por exacerbações infecciosas, encaminhado para transplante pulmonar. Trata-se de uma patologia de grande impacto social e econômico e a análise aprofundada de casos como este é fundamental para expandir o conhecimento da sua patogênese, bem como aprimorar a identificação e tratamento das várias causas subjacentes. Destaca-se a necessidade de acompanhamento e manejo multidisciplinar com meta no controle sintomático, redução das exacerbações, reabilitação pulmonar e melhora da qualidade de vida.
Referências
ADETILOYE, Adebola et al. Challenges of diagnosing and managing bronchiectasis in resource-limited settings: a case study. Pan African Medical Journal, v. 32, n. 1, 2019.
ALTENBURG, J. et al. Non-cystic fibrosis bronchiectasis: clinical presentation, diagnosis and treatment, illustrated by data from a Dutch Teaching Hospital. Netherlands Journal of Medicine, v. 73, n. 4, p. 147-154, 2015.
BRASIL. Protocolo Clínico e Diretrizes Terapêuticas – Fibrose Cística. Brasília, 2024. Disponível em: http://www.saude.gov.br/pcdt-fibrose-cistica. Acesso em: 2 mar. 2025.
CHALMERS, J. D. et al. A systematic literature review of the clinical and socioeconomic burden of bronchiectasis. European Respiratory Review, v. 33, n. 173, 2024.
DE LA ROSA, David et al. Annual direct medical costs of bronchiectasis treatment: Impact of severity, exacerbations, chronic bronchial colonization and chronic obstructive pulmonary disease coexistence. Chronic Respiratory Disease, v. 13, n. 4, p. 361-371, 2016.
FLUME, P. A.; CHALMERS, J. D.; OLIVIER, K. N. Advances in bronchiectasis: endotyping, genetics, microbiome, and disease heterogeneity. The Lancet, v. 392, n. 10150, p. 880-890, 2018.
GAO, Y. et al. Aetiology of bronchiectasis in adults: A systematic literature review. Respirology, v. 21, n. 8, p. 1376-1383, 2016.
GARCIA-CLEMENTE, M. et al. Impact of Pseudomonas aeruginosa infection on patients with chronic inflammatory airway diseases. Journal of Clinical Medicine, v. 9, n. 12, p. 3800, 2020.
GIRÓN, R.; GOLPE, R.; MARTÍNEZ-GARCÍA, M. A. Bronchiectasis not due to cystic fibrosis. Medicina Clínica (English Edition), 2024.
IMAM, J. S.; DUARTE, A. G. Non-CF bronchiectasis: orphan disease no longer. Respiratory Medicine, v. 166, p. 105940, 2020.
MCSHANE, P. J. et al. Non–cystic fibrosis bronchiectasis. American journal of respiratory and critical care medicine, v. 188, n. 6, p. 647-656, 2013.
PEREIRA, M. C. et al. Consenso brasileiro sobre bronquiectasias não fibrocísticas. Jornal Brasileiro de Pneumologia, v. 45, p. e20190122, 2019.
SHOEMARK, A.; OZEROVITCH, L.; WILSON, R. Aetiology in adult patients with bronchiectasis. Respiratory medicine, v. 101, n. 6, p. 1163-1170, 2007.
1Médica residente do Programa de Residência em Clínica Médica do Hospital Universitário Getúlio Vargas (HUGV) da Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
2Médica residente do Programa de Residência em Clínica Médica do Hospital Universitário Getúlio Vargas (HUGV) da Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
3Graduanda de Medicina pela Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
4Graduanda de Medicina pela Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
5Graduando de Medicina pela Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
6Médico especialista em Pneumologia e Preceptor dos Programas de Residência Médica em Clínica Médica e Pneumologia do Hospital Universitário Getúlio Vargas (HUGV) da Universidade Federal do Amazonas (UFAM), Manaus, Amazonas, Brasil.
