REGISTRO DOI: 10.5281/zenodo.8435893
Silvia Mara Haluch1
Flávia Caroline Haluch 2
João Fernandes Dreher3
Daniela Florencio Maluf3
Resumo: Neste trabalho algumas bebidas industrializadas foram analisadas através da técnica de cromatografia gasosa para a pesquisa de monoaromáticos como o benzeno, tolueno, etilbenzeno e xilenos. Outros autores demonstram que em algumas condições a combinação de benzoato de sódio ou potássio ou ácido benzóico e ácido ascórbico podem produzir o benzeno em bebidas comerciais como sucos e refrigerantes pela descarboxilação dos conservantes principalmente com temperaturas mais elevadas. O benzeno comprovadamente induz uma ação carcinogênica e mutagênica e os demais monoaromáticos induzem efeitos sobre o sistema nervoso central e em outros órgãos. Algumas amostras não ocorreram reprodução dos dados para xilenos. Das 26 bebidas estudadas duas apresentaram benzeno nas concentrações de 17,65 e 19,7 µg.L-1 e duas tolueno nas concentrações de 342 e 272 µg.L-1 e uma amostra para etilbenzeno apresentando 357 µg.L-1. Normatizações mais específicas para esses compostos são de grande importância a fim de garantir a qualidade das bebidas industrializadas.
Palavras-chaves: benzeno, monoaromáticos, alimentos, bebidas.
Abstract: In this work, some industrialized drinks were analyzed by gas chromatography for the search monoaromatic with benzene, toluene, ethylbenzene and xylenes. Other authors there were shown that certain conditions the combination of potassium or sodium benzoate or benzoic acid and ascorbic acid may produce benzene in commercial beverages such as juices and soft drinks mainly by decarboxylation of preservatives at higher temperatures. Benzene induces a carcinogenic and mutagenic action and other monoaromatic induce effects on the central nervous system and other organs. Some samples there weren’t reproduction of data to xylenes. Of the 26 studied two beverages had benzene at concentrations of 17.65 and 19.7 μg.L-1 and two toluene at concentrations of 342 and 272 μg.L-1 and a sample having 357 μg.L-1 to ethylbenzene. Normalizations more specific for these compounds is very important to ensure the quality of industrial drinks.
Keywords: benzene, monoaromatic, foods, drugs, drinks.
INTRODUÇÃO
A presença de contaminantes químicos em alimentos pode promover vários danos, incluindo reações de hipersensibilidade e toxicidade, que podem ocorrer de forma aguda e crônica estimulando a ação carcinogênica (MIDIO; MARTINS, 2000).
Uma das substâncias que requerem grande atenção dos pesquisadores devido à sua toxicidade é o benzeno, um hidrocarboneto aromático largamente utilizado como matéria-prima para diversos produtos, como detergentes, gasolina e plásticos (BARATA et al., 2014).
O benzeno como os demais hidrocarbonetos são produtos derivados do petróleo e desta forma, são formados por uma mistura complexa de compostos orgânicos com predominância de hidrocarbonetos monoaromáticos (PENNER, 2000).
Esses hidrocarbonetos monoaromáticos são de grande preocupação no ambiente e são mais conhecidos como BTEX: benzeno, tolueno, etilbenzeno e isômeros do xileno (orto, meta e para) (TIBURTIUS, 2004).
Esses conjuntos são potencialmente impactantes para água, solo, ar e alimentos e com o agravante de estarem presentes no ecossistema incluindo na alimentação (SILVA et al., 2009).
De acordo com Andrade et al. (2012) os impactos ambientais dos BTEX estão relacionados com sua toxicidade, mobilidade e persistência no meio ambiente.
A quantificação desses compostos em diversas matrizes ambientais já está bem estabelecida (HELENO et al.,2010). Porém em matrizes alimentícias os BTEX necessitam de melhores normalizações e validações. Esses agentes são cancerígenos e causadores de diversos efeitos à saúde humana (ACGIH, 1998).
Durante o processo de fabricação das bebidas são adicionadas substâncias conhecidas como aditivos alimentares que desempenham diferentes funções de corantes que conferem apelo visual, espessantes e aromatizantes que melhoram as propriedades sensoriais e conservantes que retardam a degeneração dos produtos são apenas alguns exemplos das muitas funções exercidas pelos aditivos alimentares (SANCHEZ, 2008).
O ácido ascórbico (vitamina C) é um componente natural de muitos alimentos sendo também adicionado como suplemento vitamínico e antioxidante; o ácido benzóico é utilizado como conservante devido à sua propriedade antimicrobiana. Porém a combinação entre esses dois aditivos pode levar à formação de benzeno, composto orgânico nocivo à saúde. O benzeno pode ser produzido através da descarboxilação de ácido benzóico pelo ataque de um radical hidroxila gerado in situ, o que sugere que o benzeno pode também ser gerado em bebidas contendo esta combinação de aditivos (ICBA, 2006).
O ácido ascórbico ou vitamina C é uma molécula utilizada na hidroxilação de várias reações bioquímicas. É um poderoso antioxidante usado para transformar os radicais livres de oxigênio em formas inertes (NYMAN et a.l, 2010).
Desta forma, o benzeno pode acontecer nas bebidas cujas fórmulas contenham benzoato de sódio ou benzoato de potássio em conjunto com ácido ascórbico. Os valores podem aumentar também com a exposição à luz. Alguns estudos sugerem que o ácido eritritol pode também levar à formação de benzeno da mesma forma que o ácido ascórbico (GARDNER; LAWRENCE, 1993).
Ainda mais, a formação do benzeno, tolueno, etilbenzeno e xilenos podem ocorrer pelos efeitos de interação e reações de óxido-redução. Na exposição de mais substâncias, deve-se considerar a possibilidade de um composto interferir na ação do outro (GREGUS; KLAASSEN, 2001). Portanto, numa mistura de matérias primas alimentícias como sucos e refrigerantes, pode haver alterações nas estruturas (AZEVEDO, 2003).
Entre 1990 a 1991, um grupo de indústrias de bebidas não alcoólicas verificou que podiam ser encontrados teores elevados de benzeno em algumas bebidas quando submetidas a determinadas condições. Trabalhando em estreita colaboração com a US Food and Drug Administration (FDA), a indústria concluiu que, quando o ácido ascórbico (Vitamina C) era usado como ingrediente em conjunto com benzoato de sódio (como conservante), em de determinadas condições podia haver a formação de benzeno. Esta formação era mais elevada quando esta era armazenada durante longos períodos a altas temperaturas (ICBA, 2006).
A figura 05 demonstra a fórmula estrutural dos compostos estudados e do benzoato de sódio e do ácido benzóico.
Figura 05 – Estrutura química e identificação (CAS) dos hidrocarbonetos aromáticos.
FONTE: Adaptado MERCK (2007)
Em razão da possibilidade de se encontrar compostos monoaromáticos devido ao sinergismo entre matrizes de fabricação do produto, justifica-se o estudo dos BTEX como forma de controle de qualidade. O trabalho visa validar a técnica por cromatografia gasosa com detecção em FID utilizando hedspace em algumas bebidas comerciais.
MATERIAL E MÉTODOS
AMOSTRAS DE ESTUDO
As amostras de bebidas foram selecionadas de refrigerantes e sucos disponíveis comercialmente com algumas marcas líderes com os sabores de cola, limão, laranja, uva, morango, sucos normais e com soja, contendo açúcar. Apenas duas amostras analisadas são “zero açúcar” e uma água de coco. Totalizando 26 amostras de bebidas conforme descrito na tabela 01.
Tabela 01: Descritivo de amostras testadas
Amostras Tipo de amostras Amostra 1 Refrigerante de guaraná de 237 mL embalagem plástica. Amostra 2 Refrigerante de guaraná zero de 600 mL embalagem plástica. Amostra 3 Refrigerante de guaraná 250 mL embalagem plástica. Amostra 4 Refrigerante de guaraná 600 mL embalagem plástica. Amostra 5 Refrigerante de cola de 250 mL embalagem plástica. Amostra 6 Refrigerante de cola de 600 mL embalagem plástica. Amostra 7 Refrigerante de cola zero de 600 mL embalagem plástica. Amostra 8 Refrigerante de cola 237 mL embalagem plástica. Amostra 9 Refrigerante de limão 237 mL embalagem plástica. Amostra 10 Refrigerante de limão 600 mL embalagem plástica. Amostra 11 Refrigerante de limão 250 mL embalagem plástica. Amostra 12 Refrigerante de laranja 250 mL embalagem plástica. Amostra 13 Refrigerante de laranja e limão 290 mL embalagem plástica. Amostra 14 Refrigerante de laranja 237 mL embalagem plástica. Amostra 15 Refrigerante de framboesa 290 mL embalagem plástica. Amostra 16 Refrigerante de uva 237 mL embalagem plástica. Amostra 17 Refrigerante de uva 350 mL embalagem de lata. Amostra 18 Suco de laranja 200 mL embalagem longa vida. Amostra 19 Suco de soja uva 200 mL embalagem longa vida. Amostra 20 Suco de laranja 200 mL embalagem longa vida. Amostra 21 Sujo de morango 200 mL embalagem longa vida. Amostra 22 Suco de abacaxi 200 mL embalagem longa vida. Amostra 23 Suco de soja maçã 200 mL embalagem longa vida. Amostra 24 Suco de soja morango 200 mL embalagem longa vida. Amostra 25 Água de coco 200 mL embalagem longa vida. Amostra 26 Refrigerante de limão zero 2L embalagem plástica.
MÉTODO CROMATOGRÁFICO
Os parâmetros cromatográficos para a determinação dos hidrocarbonetos monoaromáticos estão listados na tabela 02. A metodologia utilizada para as análises foi de acordo com o EPA METHOD 3890, Revisão 0, September, 1987 (USEPA, 1987). A técnica empregada foi de cromatografia gasosa (CG) com detector FID (flame ionization detector) utilizando o cromatógrafo gasoso HP 5890 série II conforme figura 01A, com gás de arraste nitrogênio e injeção via hedspace manual para determinação das concentrações das soluções em teste.
Os gases usados foram o hidrogênio, nitrogênio e ar sintético, com grau de pureza igual ou acima de 4.7.
O volume de amostra utilizada no ensaio cromatográfico foi de 10 mL e transferida com micropipeta calibrada RBC para o frasco de Hedspace – vial de 20 mL com tampa rosca lacre – Part Number: 5188-2759 – Agilent Technologies. Realizar todas as amostras em duplicatas.
Após adição das amostras o vial fechado e mantido em estufa de 90ºC por 1 hora para a promoção do hedspace. Após esse período foi coletado 1000 microlitros do vapor com auxílio de uma seringa.
Tabela 02- Condições cromatográficas para determinação de BTEX via CG FID.
Equipamento Condições para as análises CromatógrafoColunaTemperatura do Injetor: HP 5890 série IIDB 624 Agilent 30 m x 0,5 mm FILM 3,0 μm220º C Temperatura do detector: 250º C Gás de arraste Nitrogênio 5.0 Rampa: Início de 40º C por 5 minutos10º C.min-1 até 180ºC180ºC por 5 minutos
Os padrões utilizados para o estabelecimento da curva de calibração foi da ACCUSTANDARD CLP- BTEX-10X PAK 2 mg.mL-1 em metanol, padrão ISO 34 e acreditado 17025/2005 armazenados em frasco Certan® conforme figura 01B. As micropipetas utilizadas nos ensaios foram calibradas na RBC (Rede Brasileira de Calibração – INMETRO).

Figura 01: 01 A – Cromatógrafo Gasoso HP 5890. 01B – Frasco Certan® do MRC
Fonte: Autor
Foi utilizado o programa “PEAK” instalado no cromatógrafo para identificar os picos do cromatograma, sendo a sequência: 1 – metanol, 2- benzeno, 3- tolueno, 4-etilbenzeno, 5 m,p-xilenos e 6 o-xileno, o que corresponde a sequência analítica convencional (Figura 02).
Figura 02: Cromatograma do padrão de 10 µg.L-1
VALIDAÇÃO DA TÉCNICA EM BEBIDAS E ESTATÍSTICA
Conforme o GUIA CGCRE 008 – Inmetro foram realizados curvas de calibração dos compostos estudados com padrão de referência certificado. Portanto, serão utilizadas curvas de calibração com regressão linear acima de 0,9 (correlação fortíssima) e média com desvio padrão entre as duplicatas.
Será usada média e desvio padrão entre os resultados em Excel. A calibração com mais de 5 pontos é considerada como uma maneira de estabelecer a exatidão de um sistema de medição, ou seja, o grau de concordância entre o resultado de uma medição e um valor verdadeiro convencional do mensurando. (CGCRE 08, 2010).
RESULTADOS E DISCUSSÃO
Curvas de calibração
As curvas de calibração realizadas com o padrão certificado são demonstradas na figura 03.
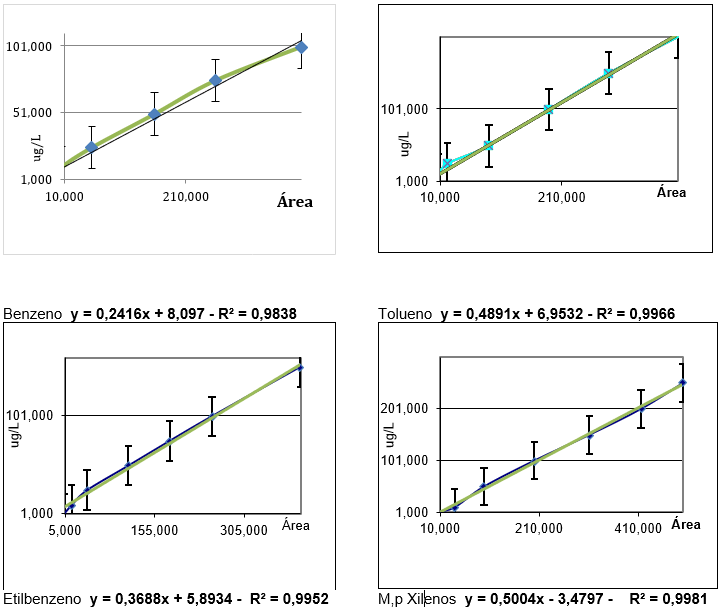
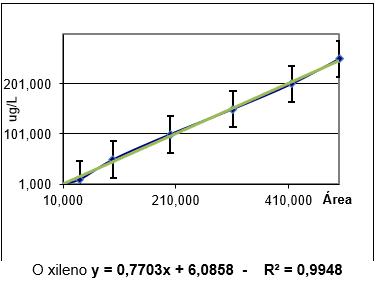
Figura 03 : Curvas de calibração
Testes de recuperação
Para testar a porcentagem de recuperação da técnica foi utilizada água potável fornecida pela empresa de saneamento do Paraná e o padrão analítico. Para ficar o mais próximo das amostras testadas foram acrescentadas glucose PA simulando bebidas adoçadas. As quatro primeiras amostras da tabela 03 a seguir são amostras contendo açúcar e as quatro últimas são isentas de açúcar.
Tabela 03: Dados de recuperação de contaminações das amostras.
Amostra Branco Água miliQ Amostra mg.L-1 Contaminação 0,5 mg.L-1 % Recuperação Com açúcar <1 µg.L-1 <0,001 0,452 90,4 Com açúcar <1 µg.L-1 <0,001 0,467 93,4 Com açúcar <1 µg.L-1 <0,001 0,487 97,4 Com açúcar <1 µg.L-1 <0,001 0,488 97,6 Sem açúcar <1 µg.L-1 <0,001 0,501 100,2 Sem açúcar <1 µg.L-1 <0,001 0,435 87,0 Sem açúcar <1 µg.L-1 <0,001 0,456 91,2 Sem açúcar <1 µg.L-1 <0,001 0,500 100,0
A figura 04 a seguir demonstra o cromatograma de uma amostra de refrigerante contaminado com o padrão.

Figura 04: Cromatograma de amostra de refrigerante utilizado para o teste de recuperação. 4A amostra o cromatograma de uma amostra de refrigerante e 4B a mesma amostra contaminada com 10 µg.L-1 de BTEX em metanol. Fonte: Autor.
Os resultados dos testes cromatográficos, realizados empregando cromatografia do “spike” apresentaram recuperações entre 90 a 100,2%, conforme APHA (2012) valores em conformidade se encontram entre 80 a 120% de recuperações.
Precisão intermediária e repetitividade
Conforme o Guia do Inmetro CGCRE 08 a precisão é avaliada sobre a mesma amostra ou padrões variando datas de ensaios e analistas. A tabela 04 e 05 a seguir demonstra as médias dos resultados obtidos de triplicatas do analista 1 e 2.
Segundo APHA (2012) os valores ideais de recuperação são até 20%.
Tabela 04 – Resultados entre dois analistas de amostra de uma amostra de água.
Parâmetros Analista 1- Resultados em µg.L-1 Analista 2 – Resultados em µg.L-1 Benzeno <1,0 <1,0 Tolueno <1,0 <1,0 Etilbenzeno <1,0 <1,0 m,p xilenos <1,0 <1,0 o xileno <1,0 <1,0
Conforme os dados analíticos ocorreram reprodução dos dados.
Tabela 05 – Resultado entre dois analistas de amostra de Amostra contaminada.
Parâmetros Analista 1- Resultados em mg.L-1 Analista 2 – Resultados em mg.L-1 % Diferença Benzeno 0,021 0,018 15,79 Tolueno 0,038 0,032 17,14 Etilbenzeno 0,121 0,119 16,67 m,p xilenos 0,01 0,011 8,69 o xileno <0,001 <0,001 0
Pelos dados apresentados e utilizando a estatística apresentada no guia do Inmetro CGCRE-08, o método demostra reprodução de dados e sendo ideal na análise dos compostos estudados.
PADRÕES DE REFERÊNCIA E SAÚDE HUMANA
Os órgãos responsáveis pela proteção da saúde do trabalhador determinaram o valor máximo dos hidrocarbonetos aromáticos em ambiente ocupacional visando à proteção do trabalhador. No Brasil, o Ministério do Trabalho estipulou valores de referência para ambientes do trabalho conforme Quadro 01.
O benzeno é um agente químico proveniente do petróleo bastante prejudicial à saúde e a exposição a este agente pode levar à leucemia mielóide aguda (LIMA, 2015).
Os BTEX são conhecidos agentes cancerígenos de mamíferos (MEDINSKY et al., 1994). A toxicidade do benzeno está relacionada com sua estabilidade e reatividade. Dentro do organismo o benzeno é metabolizado pelo fígado produzindo compostos que incluem fenol, catecol e hidroquinona, e um metabolismo secundário ocorre na medula óssea. Associado à produção de metabólitos tóxicos ocorre ainda a formação de radicais livres e acredita-se que eles contribuem para a toxicidade direta do benzeno (ATKINSON, 2008).
Quadro 01: Valores de referência ocupacional Brasil e comparação internacional.
Substância Portaria MTb 3214 NR 15 – Anexo 11 (mg.m-3) ACGIH – TWA-TLV (mg.m-3) ACGIH TLV-STEL (mg.m-3) Outras referências Benzeno Ausência 0,50 2,50 OSHA-TWA: 1,00 ppm OSHA-STEL: 5,00 ppm Tolueno 78 100 150 (EUA, NIOSH):2.000 ppm. Etilbenzeno 78 100 125 OSHA PEL/TWA: 100 ppm PEL/STEL: 125 ppm Xilenos 78 100 150 NIOSH 1000 ppm
OSHA: Occupational Safety and Health Administration; NIOSH – National Institute for Occupational Safety and; TLV – TWA– média ponderada pelo tempo de exposição para a jornada de 8h/dia, 40h/semana; TLV –STEL – concentração na qual os trabalhadores podem se expor, por um curto período, sem apresentar efeitos adversos. FONTE: BRASIL, 1995; ACGIH, 2001; ACIGH, 2003; HODGE, STERNER (1944).
No Brasil a Agência Nacional de vigilância sanitária (ANVISA) estipula valores máximos permitidos para consumo de água para os compostos estudados através da Portaria N. 2914 de 12 de dezembro de 2011 que dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade (BRASIL, 2011).
O CONAMA (Conselho Nacional do Meio Ambiente) possui uma Resolução No 357 de 17 de março de 2005, que dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes, e dá outras providências que indica valores de referência para águas superficiais incluindo classes de águas usadas como mananciais destinados a consumo humano. (BRASIL, 2005).
De acordo com o CONAMA 357 (2005) , águas doces classe especial, 1 e 2 são utilizadas para consumo humano após prévio tratamento.
Ainda no Brasil, o CONAMA também possui a RESOLUÇÃO CONAMA No 396, de 3 de abril de 2008, dispõe sobre a classificação e diretrizes ambientais para o enquadramento das águas subterrâneas e dá outras providências. (BRASIL, 2008).
A seguir o quadro 02 demonstra os valores de referência das principais normas Brasileiras para águas destinadas a consumo, águas superficiais, subterrâneas, efluentes descartados em rios destinados a consumo incluindo o CONAMA 430 (2011) e CONAMA 420 (2009), porém não constam na legislação Brasileira limites em alimentos dos compostos estudados.
Quadro 02: Valores de referência no Brasil.
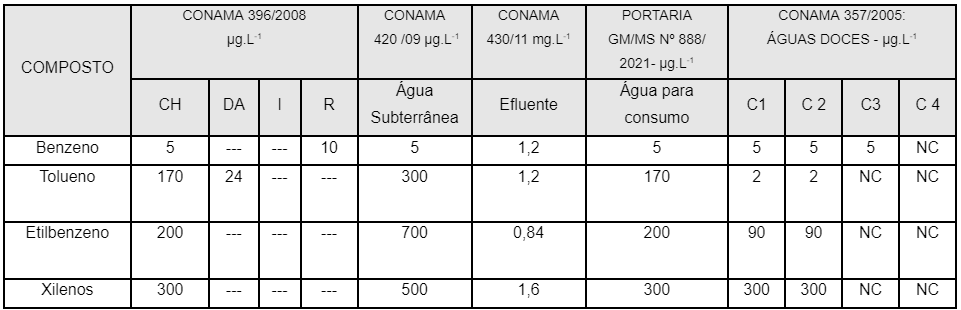
NC: Não consta DA: Dessedentação de Animais C = Classe CH: consumo humano
I: irrigação R: Recreação
Fonte: Brasil, 2008; Brasil, 2009; Brasil, 2021; Brasil, 2005.
Além da elevada toxicidade, os tais compostos aromáticos podem causar distúrbios neurológicos, alterações nas funções do sistema endócrino e lesões em órgãos como os rins e o fígado (HENDERSON, 1995).
De acordo Azevedo (2004) com a exposição ocupacional ou acidental a solventes orgânicos pode contribuir no aparecimento dos linfomas.
Estudos provam que a inalação de benzeno produz efeitos adversos no sistema nervoso central (AIVALIOTI et al., 2011). E gastrointestinal observado em ratos (GILMAN; GOODMAN; RALL, 1985).
Gamo et al. (2003) organizaram um ranking dos 12 maiores poluentes ambientais que ocorrem no Japão. Nesse estudo o benzeno foi classificado como a segunda substância (por ser carcinogênico) e o tolueno como a décima primeira substância em nível de risco para a saúde.
A principal forma de absorção dos BTEX por seres humanos é através da inalação, particularmente por fumar cigarros (FISHBEIN, 1985). Também ocorre essa inalação durante a exposição a vapores enquanto é realizado o abastecimento de veículos em postos de combustíveis. Pela ingestão de alimentos e pelo consumo de água representam uma pequena parcela (MEEK; CHAN, 1994).
De acordo com Wallace (1996) é importante se preocupar com ambiente com deficiência de circulação de ar. Segundo Weil (1975) o benzeno também é eliminado na forma inalterada pela via pulmonar.
O tolueno tem toxicidade sistêmica moderada a humanos. A inalação de grandes doses de tolueno pode provocar anormalidades de metabolismos como acidose, fraqueza muscular e arritmias cardíacas (HAMILTON; HARDY, 1974).
Os xilenos e etil benzenos provocam vasodilatação devido à liberação da histamina e da 5 –hidroxitriptamina, produzindo uma sensação de aquecimento no corpo e avermelhamento da face (TRUJILLO; DANG; STARK, 2003).
Segundo ASTDR 1995, Agency for Toxic Substances and Disease Registry, aproximadamente 95 % dos isômeros dos xilenos e etil benzenos são absorvidos e eliminados na urina sob a forma de metabólitos.
Como os compostos químicos orgânicos se acumulam nos lipídios dos organismos gerando uma estimativa do seu potencial de bioacumulação e bioconcentração (NEFF, 2002). Além disso, a maior hidrofobicidade do composto também facilita o seu transporte através de membranas biológicas, pelo fato de estas terem constituição lipoprotéica (BURATINI; BRANDELLI, 2008).
Compostos apolares precisam ser biotransformados ou polarizados antes de serem eliminados (GOODMAN; GILMAN, 1973).
Portanto, solventes orgânicos preferem tecidos ricos em gordura e SNC, e por fim os seus efeitos de ação farmacológica e tóxica serão nesses tecidos (KLAASEN, 1975). Para os compostos de estudo temos as reações de oxidação como oxidativas catalisadas pelo sistema enzimático dos microssomos ocorre na hidroxilação aromática do anel benzênico em fenol e ácido mucônico, o pirocatecol e hidroquinona (PARKE, 1978).
Desta forma os resultados dos testes nas amostras em estudos são apresentados na tabela 06 podemos observar que algumas amostras apresentaram altos desvios entre as duplicatas do parâmetro xilenos. As causas possíveis estão na instabilidade do anel aromático entre as variedades de meta, para e orto xilenos. Isso demonstra uma dificuldade analítica para essa substância nas matrizes estudadas e desta forma não realizaremos a comparação dos dados obtidos.
Os resultados da mesma tabela 06 sendo relacionando com o Quadro 02 observamos os valores para consumo de água potável duas amostras deram acima do limite estabelecido de 5 µg.L-1 para benzeno em 17,65 e 19,7 µg.L-1. Ambas as amostras de refrigerante acima do limite com sabor de cola (amostra 5) e de laranja (amostra 12) são do mesmo fabricante.
Tabela 06: Resultados analíticos das amostras testadas
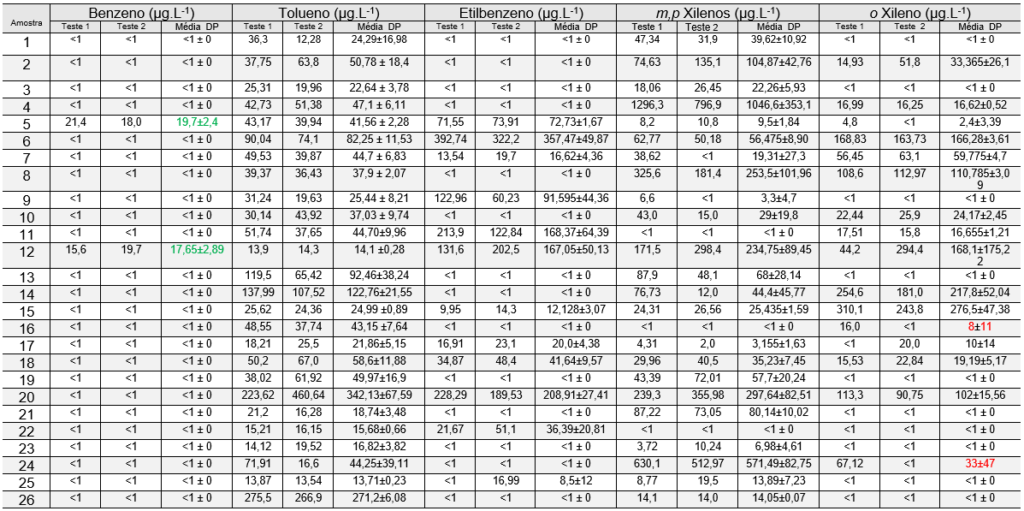
Para tolueno a amostra 20 (suco de laranja) e 26 (refrigerante de limão zero) apresentaram valores acima do limite de 170 µg.L-1 apresentando 342 e 272 µg.L-1.
Para etilbenzeno a amostra 6 (refrigerante de cola) apresentou valores acima do limite de 200 µg.L-1 apresentando 357 µg.L-1.
O benzoato de sódio foi o primeiro conservador (agentes bacteriostáticos e fungicidas) permitido pela legislação brasileira com a concentração máxima permitida para bebidas não alcoólicas gaseificadas e não gaseificadas é de 0,05g/100 mL (ANVISA, 2007).
Na União Européia, a concentração de benzoato de sódio permitida em bebidas é de no máximo 0,15 g/100 mL (WALKER; PHILLIPS, 2007).
Outro conservando muito utilizado é o ácido benzóico aplicado principalmente em bebidas ácidas, atuando pela introdução de prótons no citoplasma celular e é o conservante mais seguro, não implicando em toxicidade (KAWASE; COELHO; LUCHESE, 2008).
O ácido benzoico é menos utilizado que seu sal por apresentar menor solubilidade em meio aquoso e quimicamente, é produzido através do tolueno (NARAYANA et al., 1997).
Um estudo conduzido pelo químico Gardner e Lawrence (1993) para o FDA em 1990 e 1991, mostrou que o radical hidroxila, gerado pela redução catalisada por metal de oxigênio e peróxido por ácido ascórbico, pode atacar o ácido benzóico, removendo o dióxido de carbono para produzir benzeno em condições prevalentes em muitos alimentos e bebidas.
No final de 2005, o FDA recebeu alguns relatórios que evidenciam a presença de benzeno em níveis baixos em alguns refrigerantes contendo sais de benzoato e vitamina C. Assim, o Center for Food Safetu & Applied Nutrition (CFSAN) avaliou os níveis de benzeno em refrigerantes e outras bebidas. Grande parte das bebidas avaliadas continha benzeno em níveis bem abaixo das 5 µg.L-1 permitidas na água potável (FDA, 2006).
Até agora foram testados cerca de 200 refrigerantes, dos quais 10 produtos continham benzeno de duas a quatro vezes acima do limite de 5 µg.L-1 preconizado pelo FDA. Em sucos contendo ácido ascórbico, das 150 amostras testadas no Reino Unido, 38 apresentaram níveis de 1 a 10 µg.L-1. Na Austrália e Nova Zelândia em maio de 2006, 38 dos 68 produtos testados com ácido benzóico continham traços de benzeno que variam de 1 a 40 µg.L-1 (FDA, 2006).
Em outro estudo realizado por Sanchez (2008) nove amostras foram estudadas, incluindo refrigerantes, sucos e chás prontos para consumo e sucos concentrados o benzeno foi quantificado em sete amostras, com concentrações na faixa de 0,8 a 15 μg L-1. Quatro dessas amostras apresentaram concentração de benzeno acima do limite máximo estabelecido pela Agência Nacional de Vigilância Sanitária.
Dados da USDA (United States Department of Agriculture – Departamento de Agricultura dos Estados Unidos) mostraram um aumento de consumo de refrigerantes acima de 500% nos últimos 50 anos (CARMO, 2006).
Nesse sentido, a agência Norte americana de proteção ao meio ambiente elaborou em 1986 o Guidelines for the Health Risk Assesment of Chemical Mixtures que estabelece a avaliação de risco para a saúde quando se trata de mistura de produtos químicos (US EPA, 1986).
No Brasil, existe a Lei 10.144 (2013) da deputada Lúcia Dornellas, que foi publicada no Diário do Poder Legislativo e no Diário Oficial na qual proíbe a adição do conservante benzoato de sódio em algumas bebidas no Espírito Santo.
conclusões
O estudo em questão foi importante para demonstrar a necessidade da pesquisa em alimentos dos compostos estudados e uma normalização específica da ANVISA a fim de garantir a produção e comercialização de bebidas, e desta forma, garantir a qualidade para consumo humano.
Pelos dados obtidos e comparados com dados do ICBA, foi possível demonstrar que esse setor alimentício necessita atenção das autoridades e que realmente existe a presença de benzeno e outros aromáticos em bebidas comercializadas.
Esse foi apenas um estudo preliminar visto a variedade de produtos fornecidos por diversos fabricantes e a enorme complexidade de matérias primas.
Mesmo assim, foi um passo importante para a contribuição de dados para futuros estudos nessa área para controle de patologias veiculadas através dos alimentos.
AGRADECIMENTOS
Agradecemos a Navelab Comércio de Produtos para laboratórios pelo financiamento da publicação desse artigo.
REFERÊNCIAS BIBLIOGRÁFICAS
ACGIH, American Conference of Governmental Industrial Hygienists. Threshold Limit Values for Chemical Substances and Physical Agents and Biological Exposure Indices. Cincinnati, OH: ACGIH (1998).
ACGIH, American Conference of Governmental Industrial Hygienists. Documentation of Threshold Limit Values (TLV) for Chemical Substances and Physical Agents and Biological Exposure Indixes (BEI) Cincinnati, OH: ACGIH, 2001.
ACGIH, American Conference of Governmental Industrial Hygienists. TLVs e BELs: limites de exposição (TLVs) para substâncias químicas e agentes físicos e índices biológicos de exposição (BELs). Tradução da Associação Brasileira de Higienistas Ocupacionais. Campinas, 2003.
AIVALIOTI, M.; POTHOULAKI D.; PAPOULIAS, P.; GIDARAKOS. E. Removal of BTEX, MTBE and TAME from aqueous solutions by adsorption onto raw and thermally treated lignite, Journal Hazardous Materials, v. 207-208, p.136-146, 2011.
APHA, AWWA, WEF in: L.S. Clesceri, A.E. Greenberg, A.D. Eaton (Eds.), Standard Methods for the Examination of Water and Wastewater, 22th ed., American Public Health Association, 2012.
American Water Works Association, Water Environment Federation,Washington, DC, USA, 2012.
ANVISA – Agência Nacional de Vigilância Sanitária -Resolução da Diretoria Colegiada – RDC nº 5, de 15 de janeiro de 2007.
ANDRADE, J. A.; AUGUSTO, F.; JARDIM, I. C. S. F. Biorremediação de solos contaminados por petróleo e seus derivados. Eclética Química [online], v. 35, no .3, p. 17-43, 2012.
ATDSR. Agency for Toxic Substances and Disease Registry. Departament of Health and Human Services, Public Health Service. Toxicological profile for xylenes. ATDSR. Atlanta, 1995.
ATKINSON, T. J. A review of the role of benzene metabolites and mechanisms in malignant transformation: Summative evidence for a lack of research in onmyelogenous cancer types. International Journal of Hygiene and Environmental Health, In Press, Corrected Proof, 2008.
AZEVEDO, F. A. Toxicologia do Mercúrio. São Carlos: Rima, 292p., 2003.
AZEVEDO, F.A. e CHASIN, A.A.M. As Bases Toxicológica da Ecotoxicologia. 340p. São Paulo: Rima. 2004.
BARATA, C.S.; MITRI.S.; PAVESI M.; SAGGIORO E.; MOREIRA J.C. Benzeno: reflexos sobre a saúde pública, presença ambiental e indicadores biológicos utilizados para a determinação da exposição. Cad. Saúde Colet., Rio de Janeiro, 22 (4): 329-4; 2014.
BRASIL. Portaria nº 3214, Ministério do trabalho normas regulamentadoras, 20 de dezembro de 1995.
BRASIL, 2005 – Resolução CONAMA Nº 357/2005 – “Dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes, e dá outras providências”. Data da legislação: 17/03/2005 – Publicação DOU nº 053, de 18/03/2005, págs. 58-63.
BRASIL, 2008 – RESOLUÇÃO CONAMA No 396, Dispõe sobre a classificação e diretrizes ambientais para o enquadramento das águas subterrâneas e dá outras providências.” – Data da legislação: 03/04/2008 – Publicação DOU nº 66, de 07/04/2008, págs. 66-68.
BRASIL, 2009 – RESOLUÇÃO CONAMA No 420 “Dispõe sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e estabelece diretrizes para o gerenciamento ambiental de áreas contaminadas por essas substâncias em decorrência de atividades antrópicas” – Data da legislação: 28/12/2009 – Publicação DOU nº 249, de 30/12/2009, págs. 81-84.
BRASIL, 2011 – RESOLUÇÃO CONAMA No 430 “Dispõe sobre condições e padrões de lançamento de efluentes”, complementa e altera a Resolução no 357, de 17 de março de 2005, do Conselho Nacional do Meio Ambiente” – Data da legislação: 13/05/2011 – Publicação DOU nº 92, de 16/05/2011, pág. 89.
BRASIL 2021 – Portaria GM/MS Nº 888 de 04 de maio de 2021 (Dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade). ANVISA, 2021.
BURATINI, S. V.; BRANDELLI, A. Análise Estatística. In: Ecotoxicologia Aquática – Princípios e Aplicações. ZAGATTO, P. A. & BERTOLETTI (org.). E. São Carlos: Rima, p. 55-88. 2008.
CARMO, M. B. Consumo de doces, refrigerantes e bebidas com adição de açúcar entre adolescentes da rede pública de ensino de Piracicaba, São Paulo. Rev. Bras. Epidemiol. vol.9, no.1, p.121-130, 2006.
CGCRE 08 – Orientação sobre validação de métodos analíticos. DOQ – Revisão 03 – Fevereiro de 2010.
FISHBEIN. L. An overview of environmental and toxicological aspects of aromatic hydrocarbons II. Toluene Science of The Total Environment. v.42, p.267-288,1995.
FDA – Food and Drug Administration. Determination of Benzene in Soft Drinks and Other Beverages. Disponível: http://www.fda.gov/food. Acesso: 08 de novembro de 2015, 2006.
GARDNER, L. K & LAWRENCE G.D. Benzene Production from Decarboxylation of Benzoic Acid in the Presence of Ascorbic Acid and a Transition-Metal Catalyst. Washington, DC. Journal of Agricultural and Food Chemistry. v 41. n 5. May,. pp 693-695. 1993.
GAMO, M.; OKA, T.; NAKANISHI, J. Ranking the risk of 12 major environmental pollutants that occur in Japan. Chemosphere, v.53, p. 277-284, 2003.
GARDNER L.K; LAWRENCE, G.D. J. Agric. Fd. Chem. 1993, 41 (5), 693-695, 1993.
GILMAN. A. G; GOODMAN, L.S. RALL, T. W. The Pharmacological Basis of Therapeutics, 7th ed., Macmillan Publishing (Edit.), New York, 1985.
GOODMAN.L.S.; GILMAN, A.E.D. As bases farmacológicas da terapêutica. 4 Edição. Rio de Janeiro: Guanabara – Koogan, p. 8-10, 1973.
GREGUS, Z.; KLAASSEN, C. Mechanisms of Toxicity. New York. McGraw-Hill, Cap. 3 – p.35-81, 2001.
HAMILTON, A.; HARDY H. L. Industrial Toxicology. 3rd ed. Acton, Mass: Publishing Sciences Group, Inc. 1974.
HELENO, Fernanda F.; LIMA, Aniel C.; AFONSO, Robson J. C. F. and COUTRIM, Mauricio X. Otimização e validação de métodos analíticos para determinação de BTEX em água utilizando extração por headspace e microextração em fase sólida. Química Nova [online], v.33 (2), p. 329-336, 2010.
HENDERSON, R. F. Strategies for use of biological markers of exposure. Toxicology Letter, v. 82-83, p.379, 379, 1995.
HODGE, H.C.; STERNER, J. H. Tabulation of toxicity classes. American Industry Hygues Quarty., v. 10, p. 94-97. 1944.
ICBA – International Council of Beverages ASSOCIATIONS WASHINGTON, DC BRUSSELS · TOKYO – Documento Guia para Redução da Potencial Formação de Benzeno em Bebidas. Secretariat 2005-2006 UNESDA – Union of European Beverages Associations Boulevard Saint Michel 77-79, B-1040 Brussels, Belgium – Conselho do ICBA em 29 de Abril 2006.
KAWASE, K.Y.F; COELHO, G.L.V; LUCHESE, R.H. Uso de conservadores ácido benzoico e benzoato de sódio no controle de Alicybacillus ácidoterrestris em suco de laranja. Rev. de Ciência da Vida, RJ, EDUR. v. 28, n. 2, jul-dez, p. 53-62. 2008.
KLAASEN, C.D. Absorption, distribution and excretion of toxicants. In: CASARETT, L.J.; DOULL, J. Toxicology, the basic science of poison. New York: Macmillan Pub. Co., Inc., p. 30, 1975.
LIMA, J.P.R.C. – Fatores relacionados à leucemia mielóide aguda: Uma vista para o benzeno. Trabalho de conclusão de curso de Biomedicina. 15p. Centro Universitário de Brasília Faculdade de Ciências da Educação e Saúde. Graduação em Biomedicina. Brasília, 2015.
MEEK, M. E.; CHAN, E. K. L. Bis(2ethylhexyl)phthalate: Evaluation of risks to health from environmental exposure in Canada. Journal of Environmental Science and Health, Part C: Environmental Carcinogenesis and Ecotoxicology Reviews, v. 12(2), p. 179-187,1994.
MEDINSKY, M. A., L, T. L., CSANAGY, G. A., GARGAS, M. L., and BOND, J. A. In vivo metabolism of butadiene by mice and rats: a comparison of physiological model predictions and experimental data. Carcinogenesis, v. 15, p.1329–1340, 1994.
MERCK. Catálogo oficial de substâncias químicas –reagentes químicos. Merck.2005 a 2007.
MIDIO, A.F.; MARTINS, I.S. Toxicologia de alimentos. São Paulo: Varela, 295p, 2000.
NARAYANA, K.V.; VENKOT RAO V.V.; KANTA RAO, P. Catalysis. General, v.150, p.269, 1997.
NEFF, J. M. Bioacumulação em organismos marinhos. Editora: Elsevier Science. 460 p. 2002.
NYMAN, P. J; WAMER, W. G; BEGLEY T. H; DIACHENKO, G. W; PERFETTI, A. G. Evaluation of Accelerated UV and Thermal Testing for Benzene Formation in Beverages Containing Benzoate and Ascorbic Acid. Journal of Food Science. v 75. N 3. pp C263- C267. 2010.
PARKE, D. V. The biochemistry of foreign compounds. 5 edição. Oxford: Pergamon Press, p. 35-50, 1978.
PENNER, G. C. Estudos Laboratoriais da Contaminação do Solo por Gasolina com o Uso de Detector de Fotoionização. 2000, 109f. Dissertação. Programa de pós-graduação em Engenharia. Escola de Engenharia de São Carlos, Universidade de São Paulo, São Carlos – SP. 2000.
SANCHEZ, A. B. Determinação de benzeno em bebidas comerciais. Trabalho de conclusão de curso de Química. 32 p. Universidade Federal de Santa Catarina – UFSC. Centro CFM – Departamento de Química. Florianópolis, junho de 2008.
SILVA. F. L. N; SANTOS JR., J. R.; MOITA NETO, J. M.; SILVA, R. L. G. N.; FLUMIGNAN, D. L.; OLIVEIRA, J. E. Determinação de benzeno, tolueno, etilbenzeno e xilenos em gasolina comercializada nos postos do estado do Piauí. Química Nova, v.32 (1), p. 56-60, 2009.
TIBURTIUS, E. R. L.; PERALTA-ZAMORA, P.; LEAL, E. S. Contaminação de águas por BTEXs e processos utilizados na remediação de sítios contaminados. Química Nova , v.27 (3), p. 441-446, 2004.
TRUJILLO, F.; DANG, D.; STARK, T. Xylene Keratopathy: A Case Report and Review of the literature. Cornea, v. 22 (l), p. 88-90, 2003.
US EPA. U.S. Environmental Protection Agency. EPA 3890 – Metodologia de ensaio para análise e BTEX por Headspace, 1987.
US EPA – Environmental Protection Agency. Guidelines for the health: risk assessment of chemical mixtures, 1986.
WALLACE, L .; Environ. Health Perspect. P. 104,1996.
WALKER, M.; PHILLIPS, C.A. The effect of preservatives on Alicyclobaillus acidoterrestris and Propioni bacteriumcyclohexanicum in fruit juice. Food Control v.52, n°7, p. 286-288, 2007.
WEIL, E. Eléments de toxicologie industrielle. Paris: Masson et Cie, p. 17-40, 1975.
1Mestre em Ciências, Biomédica, Química e Biotecnologista. Pesquisadora e Consultora da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
2Estudante de Biomedicina da UPP – Universidade Pequeno Príncipe. Microbiologista, toxicologista e Gerente da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
3Químico e estudante de Engenharia ambiental. Sócio-gerente da Navelab Produtos para Laboratórios. joaodreher@gmail.com
4Farmacêutica Bioquímica, Profa . Drª da Universidade Tuiuti do Paraná (Curitiba, PR).
