REGISTRO DOI: 10.69849/revistaft/cs10202501311534
Beatriz Vieira Carrijo; Antonio Márcio Teodoro Cordeiro Silva; Ana Clara Lima Machado; Andressa Morgado Parreira; Bárbara Izarias Barbosa; Darlla Célia Khulman Martins Modesto; Gustavo Batista Oliveira; Kárita Fernanda de Oliveira Rodrigues Bravo; Rogério Gomes de Melo Filho; Vanessa Soares de Araújo
RESUMO
Os aneurismas cerebrais são dilatações focais das artérias cerebrais e podem ocorrer em qualquer idade e sexo. Muitos pacientes com aneurismas intracranianos (AI) são assintomáticos, contudo, a compressão de estruturas adjacentes ou eventuais rupturas de vasos podem levar a sérias complicações, dentre essas, destacam-se: vômitos, cefaleia em trovoada e convulsões. Quanto mais precoce o diagnóstico, menor são as complicações dos aneurismas e mais efetivos os tratamentos podem ser. Nesse contexto, a recorrência de casos de AI em familiares levanta suspeitas na comunidade científica quanto à possibilidade da correlação genética na patogênese da doença e na maior susceptibilidade desses indivíduos. Assim, diversos estudos demonstram regiões cromossômicas e polimorfismos genéticos que estão diretamente vinculadas com a predisposição ao desenvolvimento de aneurismas. Esta proposta trata-se de uma revisão sistemática que será desenvolvida por meio da pesquisa de estudos primários que, com seus objetivos, métodos e materiais, possibilita a reprodução por outros autores com vistas a reunir pesquisas científicas e demonstrar as evidências mais recentes sobre o fenômeno investigado. Compreender e identificar essa correlação torna-se imprescindível para o futuro do diagnóstico, tratamento e prognóstico de pacientes, o que possibilita reduzir o número de intervenções invasivas e melhorar a qualidade de vida dos pacientes.
Palavras chaves: Fatores genéticos; Suscetibilidade genética; Aneurisma intracraniano.
1. INTRODUÇÃO
Os aneurismas intracranianos (AI) são dilatações em forma de balão, geralmente, localizados em um ramo de uma artéria intracraniana (BAKKER et al., 2020), que usualmente ocorrem nos pontos de ramificação das principais artérias na base do cérebro (YU et al., 2020). A ruptura de um AI leva à hemorragia subaracnóidea (HSA), que gera alto percentual de incapacidade e mortalidade (LI et al., 2019). Aproximadamente, um terço dos pacientes que desenvolvem HSA morre e o outro terço permanece dependente para atividades diárias pelo resto da vida (BAKKER et al., 2020).
A prevalência do AI é de 2 a 5%, em todo o mundo, e, aproximadamente, 7% em adultos chineses, de 35 a 75 anos (LI et al., 2019). Embora a patogênese da AI tenha sido explorada e estudada por muitos anos, os mecanismos de sua formação, crescimento e ruptura permanecem amplamente desconhecidos.
Sendo o foco deste estudo compreender melhor a relação genética envolvida na susceptibilidade hereditária de pacientes com AI, devemos considerar o alto índice de casos de AI entre membros da mesma família, principalmente, de primeiro grau. Estudos mostram que irmãos apresentam seis vezes mais chances de desenvolver AI quando um deles já teve aneurisma, fortalecendo, assim, as hipóteses de que alguns indivíduos apresentam vulnerabilidade genética que os deixam mais suscetíveis para desenvolver a enfermidade (LIU et al., 2018)
Nesse cenário epidemiológico, em que se contabiliza os fatores de risco, a predisposição genética desempenha importante papel na doença, com herdabilidade de HSA de 41%, conforme estimado em um estudo com gêmeos (BAKKER et al., 2020). A prevalência de parentes de primeiro grau de pacientes com AI é de 2 a 6 vezes maior que a do grupo controle. Além disso, é conhecido que a história familiar pode ser um fator crucial que influencia o maior risco de ruptura do aneurisma ou um prognóstico ruim dos casos de AI.
Assim, muitos estudos genéticos foram realizados na tentativa de identificar genes de risco associados ao AI, durante os últimos anos (YU et al., 2020). Estudos baseados na genética familiar identificaram diversas variantes, com herança mendeliana, mas estudos de associação ampla do genoma (GWAS) identificaram várias variantes comuns, sugerindo um modelo poligênico de herança. O maior GWAS publicado, até hoje, envolvendo 2.780 casos e 12.515 controles, identificou seis loci de risco. Com base nesse GWAS, a explicação da herdabilidade, baseada em polimorfismo de nucleotídeo único (SNP), de aneurismas intracranianos, foi comprovada, variando de acordo com a população (BAKKER et al., 2020; HONG et al., 2019).
Diante do exposto, torna-se relevante entender a associação entre a susceptibilidade hereditária de pacientes com AI e a sua relação com os polimorfismos genéticos, por meio da avaliação de critérios clínicos e epidemiológicos na literatura científica mundial.
Esta revisão sistemática procura, pois, estabelecer a incidência e prevalência dos polimorfismos genéticos em indivíduos com AI, no Brasil e no mundo, a fim de identificar possíveis causas para a patogênese dessa doença ainda não totalmente esclarecida, apesar dos avanços tecnológicos na área.
Este estudo se justifica também por permitir encontrar evidências científicas de dados clínicos e epidemiológicos de inúmeros países, o que poderá ser norteador de políticas de saúde que tenham como anelo o diagnóstico precoce de AI em indivíduos com maior susceptibilidade genética e, por conseguinte, a redução das taxas de mortalidade dessa população em risco.
Assim sendo, a presente pesquisa, mediante uma revisão sistemática mundial, busca responder a seguinte questão de impacto universal na atualidade: Quais fatores genéticos estão associados ao aneurisma intracraniano em indivíduos com maior susceptibilidade hereditária?
2. OBJETIVOS
2.1 Objetivo geral
Investigar na literatura científica a associação entre indivíduos com susceptibilidade hereditária e os fatores genéticos envolvidos na patogênese do aneurisma intracraniano.
2.2 Objetivos específicos
- Identificar os polimorfismos genéticos relacionados à patogênese do AI.
- Compreender os aspectos hereditários envolvidos na gênese de AI em pacientes com relação de parentesco.
- Caracterizar a prevalência de pacientes com AI na mesma família e a sua relação com os polimorfismos genéticos.
3. MÉTODOS OU PERCURSO METODOLÓGICO
Trata-se de uma revisão sistemática da literatura científica que visa identificar, selecionar, avaliar e sintetizar as evidências relevantes disponíveis. A revisão sistemática se justifica porque muitos estudos sobre um determinado tema são concordantes, mas podem também apresentarem discordância, fato que aumenta a necessidade de análises conjuntas para que se possam gerar conclusões com maior segurança (SANTOS; CUNHA, 2013).
Este estudo é desenvolvido por meio da pesquisa de estudos primários que, com seus objetivos, métodos e materiais, possibilitam a reprodução por outros autores com vistas a reunir pesquisas científicas e demonstrar as evidências mais recentes sobre o fenômeno investigado (GREENHALGH, 1997).
O estudo seguirá as seguintes etapas: identificação do material (busca nas bases de dados científicas), seleção e elegibilidade (exclusão de registros duplicados e aplicação dos critérios de exclusão) e definição das publicações que serão analisadas como amostra final.
Estudos relevantes em seres humanos serão identificados nas bases de dados: PubMed do NCBI (National Center for Biotechnology Information, USA) e Periódicos CAPES, entre os anos de 2018 e 2022. Os descritores nos idiomas português e inglês a serem utilizados serão: polimorfismo genético e aneurisma intracraniano.
A seleção dos artigos seguirá os seguintes critérios de inclusão: artigos completos, publicados no período de 2018 a 2022, em estudos que envolvem seres humanos. Serão coletados os seguintes dados: local onde o estudo foi realizado, ano da publicação, período de coleta das amostras, aspectos genéticos associados ao aneurisma intracraniano e prevalência em familiares.
A presente proposta de pesquisa não necessita ser submetida ao Comitê de Ética em Pesquisa (CEP) da Pontifícia Universidade Católica de Goiás (PUC Goiás), pois os dados coletados serão provenientes de dados secundários e de acesso público, que, portanto, não fazem a abordagem de pacientes de forma direta e/ou indireta.
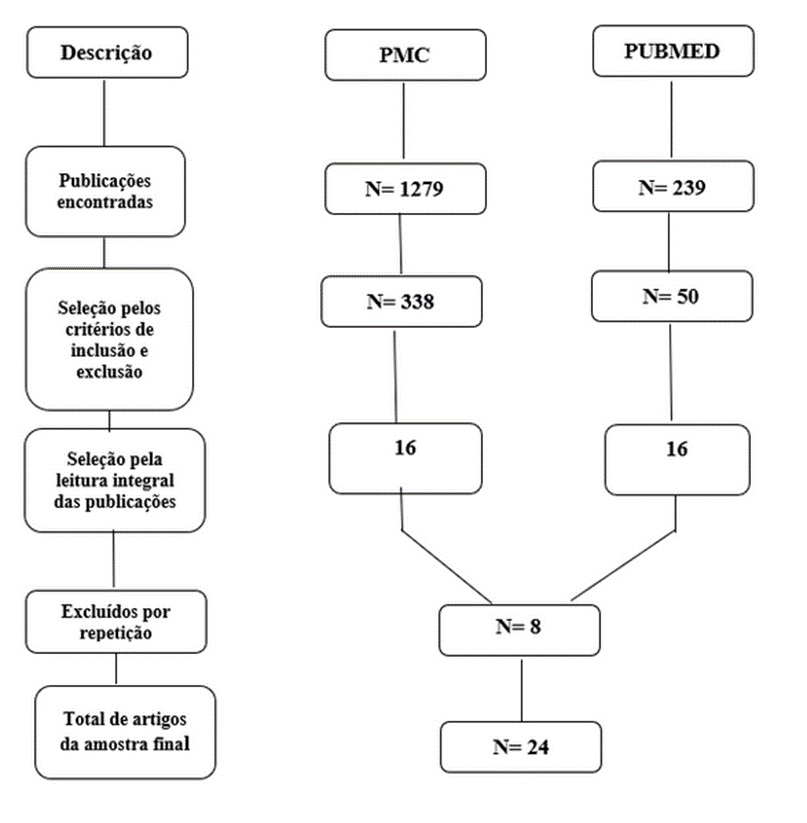
A pesquisa dos artigos nas bases de dados seguiu o protocolo PRISMA, conforme mostra o fluxograma (Figura 1).
Figura 1. Fluxograma baseado no modelo PRISMA com os resultados da seleção dos artigos. Revisão sistemática, 2023.
4. RESULTADOS
Foram encontrados 24 artigos, publicados entre 2018 e 2022, conforme demonstra o Quadro 1.
Quadro 1. Apresentação da síntese dos dados extraídos dos artigos. Revisão sistemática, 2023.
Autores Título Periódico Tipo de estudo (SAMUEL, et al., 2019) Genetic basis of intracranial aneurysm formation and rupture: clinical implications in the postgenomic era Journal of Neurosurgery- Neurosurgical Focus Revisão retrospectiva. (BAKKER et al., 2022) Genome-wide linkage analysis combined with genome sequencing in large families with intracranial aneurysms European Journal of Human Genetics Estudo analítico do tipo coorte em que foram selecionadas três famílias com múltiplos parentes de primeiro grau afetados com AI usando uma coorte de 937 pacientes com AI, da Universidade Medical Center na Holanda. (ZHOU et al., 2018) Genome-wide association analysis identifies new candidate risk loci for familial intracranial aneurysm in the French-Canadian population Scientific reports Estudo analítico do tipo coorte em que foram genotipados na população franco-canadense uma coorte de 257 pacientes familiares com AI e 1.992 controles. (ZHENG et al., 2021) MicroRNA-513b-5p targets COL1A1 and COL1A2 associated with the formation and rupture of intracranial aneurysm Scientific reports Estudo caso-controle retrospectivo realizado no Hospital Provincial de Fujian de 2018 a 2020. Um total de 100 casos de AI não rompido, 100 casos de AI rompida e 100 controles, foram incluídos neste estudo. (HONG et al., 2022) Fine-mapping of intracranial aneurysm susceptibility based on a genome-wide association study Scientific reports Estudo analítico longitudinal baseado em caso-controle com 250 pacientes adultos com AI e 296 controles que foram analisados de março de 2015 a dezembro de 2020. (BALDONCINI et al., 2022) Gene Polymorphisms Increasing the Risk of Intracranial Aneurysms: Interleukin-1β -511C>T (Part I) Acta Bio-medica: Atenei Parmensis Meta-análise que teve como objetivo investigar a ligação genética entre polimorfismos IL-1β (rs16944) -511C>T e a suscetibilidade a AI. (LUCIFERO et al., 2021) Gene Polymorphisms Increasing the Risk of Intracranial Aneurysms: Interleukin-6 -174G>C and -572G>C (Part II) Acta Biomed Meta-análise que teve como objetivo avaliar se e qual alelo IL-6 e suas variações estão relacionadas a um risco de formação de AI. (LI et al., 2019) Genetic polymorphisms and transcription profiles associated with intracranial aneurysm Aging Estudo analítico do tipo coorte que incluiu 20 indivíduos diagnosticados com AI no Hospital da Faculdade de Medicina de Tianjin. Dez indivíduos tiveram AI não rotos diagnosticados e os outros dez tiveram hemorragia subaracnóidea causada por ruptura de AI. (XU et al., 2021) Associations between Inflammatory Cytokine Gene Polymorphisms and Susceptibilities to Intracranial Aneurysm in Chinese Population BioMed Research International Estudo analítico do tipo coorte em que foram selecionados em janeiro de 2016 de hospitais da Província de Hunan, 768 participantes, incluindo 384 pacientes diagnosticados com AI e 384 indivíduos saudáveis. (CHEN et al., 2019) Replication of GWAS Loci Revealed an Increased Risk of BET1L and H19 Polymorphisms with Intracranial Aneurysm Disease Markers Estudo analítico do tipo caso-controle realizado entre 2008 e 2016 envolvendo 542 pacientes diagnosticados com AI e 588 participantes controle. (BAKER et al., 2020) Genome-wide association study of intracranial aneurysms identifies 17 risk loci and genetic overlap with clinical risk factors Nature genetics Meta-análise que averiguou indivíduos de ascendência europeia de 23 coortes diferentes, com base na plataforma de genotipagem e país. (LAARMAN et al., 2019) Chromatin Conformation Links Putative Enhancers in Intracranial Aneurysm–Associated Regions to Potential Candidate Genes Journal of the American Heart Association Estudo retrospectivo de pesquisa operacional. (HONG et al., 2019) Genomic Variations in Susceptibility to Intracranial Aneurysm in the Korean Population Journal of Clinical Medicine Estudo prospectivo observacional baseado em um estudo de coorte em que as informações foram derivadas do banco de dados de AVC do Chuncheon Sacred Heart Hospital (2015-2018). (HONG et al., 2019) Genome-Wide Association between the 2q33.1 Locus and Intracranial Aneurysm Susceptibility Journal of Clinical Medicine Estudo prospectivo baseado em uma coorte em que as informações foram derivadas do banco de dados de AVC do Chuncheon Sacred Heart Hospital (2015-2018). (SONG et al., 2022) Whole Exome Sequencing in Patients with Phenotypically Associated Familial Intracranial Aneurysm Korean Journal of Radiology Estudo prospectivo analítico de 28 pacientes entre os 638 pacientes com AI em um banco de dados coletado prospectivamente de um hospital da Coreia entre 2011 e 2018. (YU et al., 2020) The association of CDKN2BAS gene polymorphisms and intracranial aneurysm A meta-analysis Medicine Meta-análise retrospectiva que buscou identificar a associação do gene CDKN2BAS SNP e o aneurisma intracraniano. (JEON et al., 2018) Genetic Risk Assessment of Elastin Gene Polymorphisms with Intracranial Aneurysm in Koreans Neurologia medico chirurgica Estudo prospectivo do tipo caso controle que contou com 90 participantes diagnosticados com AI e 90 pacientes controle, a partir 2015 a 2016. (BROTIS et al., 2018) Collagen Type I A2 gene polymorphisms and susceptibility to intracranial aneurysms International Journal of Neuroscience Uma meta-análise foi realizada por meio de um modelo de ajuste de genótipos da Universidade da Flórida em dezembro de 2017 usando a abordagem de razão de chances generalizada. (ALG et al., 2018) Association of functional MMP-2 gene variant with intracranial aneurysms British Journal of Neurosurgery Estudo de associação genética do tipo caso-controle, realizado em uma população do Reino Unido com 1.409 pacientes com AI e 1290 controles, para determinar a associação do rs243865 C > T funcional SNP do gene MMP-2 com o AI. (MENG et al., 2019) The association between collagen gene polymorphisms and intracranial aneurysms Neurosurgical Review Estudo retrospectivo do tipo meta-análise, que foi realizado para avaliar a associação entre os SNPs do gene do colágeno e a incidência de AI em 2017. (LIU et al., 2018) TLR4 gene polymorphisms rs11536889 is associated with intracranial aneurysm susceptibility Journal of Clinical Neuroscience Estudo analítico retrospectivo do tipo caso-controle com o objetivo de rastrear polimorfismos funcionalmente relevantes no receptor toll-like 4 em 330 pacientes com o diagnóstico de AI e 313 controles. (HONG et al., 2018) Association of SOX17 Gene Polymorphisms and Intracranial Aneurysm World Neurosurgery Estudo transversal do tipo caso-controle que incluiu 187 pacientes com diagnóstico de AI e 372 indivíduos sob controle. Depois foi feita uma análise de associação genética no modelo linear generalizado para identificar associações entre 4 polimorfismos de nucleotídeo único e AI. (LI et al., 2019) Associations among Genetic Variants and Intracranial Aneurysm in a Chinese Population Yonsei Medical Journal Estudo do tipo caso-controle que envolveu um total de 765 indivíduos (incluindo 230 pacientes com AI e 535 controles) dos hospitais da província de Hunan, na China, de 2016 a 2018. (HU et al., 2020) Polymorphisms of Inflammatory Cytokine Genes and Risk for Intracranial Aneurysm Yonsei Medical Journal Revisão retrospectiva sobre estudos de associação humana entre polimorfismos de genes de citocinas inflamatórias e o risco de AI.
Todos os estudos encontrados foram estrangeiros, sendo analisadas, nos estudos, populações das seguintes nacionalidades: Holanda (1), Canadá (1), China (5), Coreia (4), Inglaterra (1), Estados Unidos (12).
Observou-se uma predominância de estudos de coorte realizados através de estudos de associação genômica ampla (GWAS) que mostraram diversos polimorfismos relacionados a genes do colágeno, elastina, metaloproteinases de matriz (MMPs) e citocinas inflamatórias. Nota-se que a presente revisão apresentou resultados significativos que revelam a importância dos polimorfismos genéticos na predisposição genética ao AI.
5. DISCUSSÃO
A patogênese do AI ainda não está clara, mas acredita-se que ocorra pela derivação da degeneração do fluxo sanguíneo de longo prazo (SAMUEL, et al., 2019). No entanto, as características de vários membros da mesma família acometidos por AI também sugerem que fatores genéticos desempenham um papel importante no início do quadro. Portanto, o AI é considerada uma doença complexa causada por herança poligênica e efeitos hemodinâmicos de degeneração adquirida. (MENG et al., 2019) (YU et al., 2020).
Além de fatores ambientais, incluindo tabagismo, álcool, hipertensão arterial sistêmica, diabetes mellitus e outros, alguns genes também estão relacionados a sua gênese e, dessa forma, o histórico familiar acaba desempenhando um papel importante dentre os vários fatores de risco. A prevalência de parentes de primeiro grau de pacientes com AI é 2 a 6 vezes maior que a do grupo controle, sugerindo que a predisposição genética provavelmente desempenha um papel em sua patogênese. (SONG et al., 2022).
Devido à complexidade do AI, os GWAS tornaram-se a estratégia predominante usada para procurar fatores genéticos associados a ele. Esses estudos usam várias coortes com pacientes diagnosticados com AI, principalmente descendentes de asiáticos ou europeus. No entanto, a existência de alguns genes cromossômicos identificados como verdadeiros fatores de risco para o rompimento de artérias intracranianas ainda precisam ser discutido devido à influência da estratificação populacional e fatores não genéticos de confusão. (YU et al., 2020).
Diante desse contexto, vários loci de risco foram descobertos em estudos de GWAS, sendo os principais: 8q11.23 (SOX17), 9p21.3- 23.1 (CDKN2A-CDKN2BAS) e 2q33.1 das coortes europeia e japonesa; 18q11.2 (RBBP8), 13q13.1 (STARD13-KL) e 10q24.326 das coortes finlandesa e japonesa; 1q23.1, 3p25.2, 7p21.2, 9q31.36e 4q31.22 (EDNRA) de duas coortes japonesas e 7p21.1 (HDAC9) de uma coorte com ascendência europeia. Estima-se que os loci de risco encontrados em cada estudo GWA representem apenas 4,1–6,1% da herdabilidade na respectiva coorte (ZHOU et al., 2018). Nesse mesmo contexto, um GWAS conduzido com populações europeias e japonesas revelou uma associação entre o gene SRY-box 17 (SOX17) e a formação de AI, o estudo revelou que os alelos G de rs10958409 e rs9298506 foram significativamente mais associados com AI na população do Leste Asiático e, portanto, são clinicamente significativos para a formação de AI. (HONG et al., 2018)
Em outros GWAS conduzido por Laarman et al., (2019) e Hong et al. (2022), foram identificados potenciais genes candidatos que podem desempenhar um papel no AI: SOX17, CDKN2B, MTAP, CNNM2, RPEL1, BET1, GATA6, GBA, TCF24, OLFML2A, e ARHGAP32 e alguns SNPs que estão localizados em 6 loci de risco genômico (4q31.23, 8q11.23- q12.1, 9p21.3, 10q24.32, 13q13 .1 e 18q11.2). Essas variantes genéticas podem causar uma resposta imune disfuncional e inflamação em sequências de DNA danificadas por substituição de aminoácidos ou mutações de ganho ou perda de função, o que afeta a formação dos AIs (CHEN et al., 2019).
Já no estudo de Meng et al. (2019), Li et al. (2019) e Zheng et al. (2021) foram analisados alguns genes de colágeno – um dos principais componentes da matriz extracelular da parede arterial que fornece resistência e elasticidade, desempenhando papel importante na manutenção da integridade arterial-, COL1A2 (21 SNPs), COL3A1 (7 SNPs), COL4A1 (6 SNPs) e COL4A2 (1 SNP). O polimorfismo rs1800255 em COL3A1 e o polimorfismo rs42524 no gene COL1A2 foi associado a um aumento significativo no risco de AI em pacientes japoneses, enquanto o polimorfismo rs1800255 no gene COL3A1 foi significativamente correlacionado com pacientes chineses com AI (HONG et al., 2019; BROTIS et al., 2018).
Apesar dos resultados obtidos anteriormente, um estudo com três grandes famílias holandesas com múltiplos parentes de primeiro grau afetados com AI, revelou através de um GWAS, seis variantes raras e prejudiciais para as quais todos os casos dentro de uma das famílias eram heterozigotos. Essas variantes foram p. Tyr87Cys em SYCP1, p.Phe1077Leu em FMNL2, p.Thr754Lys em TBC1D2, p.Arg321His em ZNF782, p.Arg979Trp em CCDC180, e P. Val125Met em NCBP1. Nenhuma das variantes mostrou associação com o status de AI, mostrando assim que mais estudos são necessários para caracterizar as consequências funcionais das variantes identificadas e seu papel nos mecanismos biológicos da AI (BAKKER et al., 2022).
Em outro estudo, Alg et al. (2018) avalia a família das MMPs, que são responsáveis pela quebra de proteínas da matriz extracelular que assumem um papel importante na remodelação vascular no tecido aneurismático humano, contribuindo assim para a patogênese do AI. Foi descoberto uma associação de AI com portadores do alelo T do SNP rs243865, mostrando assim uma hipótese forte de que esse SNP afeta a atividade da MMP-2, influenciando assim a vascularização, remodelação, formação, crescimento ou ruptura do AI. Além do destaque da função das MMPs na matriz extracelular, a elastina também assume um papel importante nesse meio, garantindo resistência da parede arterial cerebral, e, por isso, Jeon et al. (2018) revelou que o SNP rs2856728 no gene ELN da elastina foi significativamente associado com a formação de AIs.
Avaliando outro ponto de vista, o estudo de Lucifero et al., (2021) mostrou a importância dos SNPs em genes de citocinas inflamatórias e a sua relação com o desenvolvimento de AI. Interleucina 1 (IL1), interleucina 6 (IL6), interleucina 12 (IL12), e fator de necrose tumoral α (TNF-α) estão associados com AI em várias populações. Os resultados indicaram que os polimorfismos IL1A rs17561, IL12B rs3181216 e IL-1β rs16944 foram associados com AI único (BALDONCINI et al., 2022), enquanto os polimorfismos TNF-α rs1799964 e IL12B rs2195940 foram associados a AIs múltiplos em uma população chinesa (XU et al., 2021; HU et al., 2020).
6. CONCLUSÃO
Observou-se através das análises de todos os estudos, a presença de inúmeros polimorfismos nos mais variados genes relacionados à formação dos AI. Revelou-se a importância dessas alterações em elementos da matriz extracelular como o colágeno e elastina e o papel das citocinas inflamatórias, também assumindo uma relevância na patogênese do AI.
No entanto, mapear a herdabilidade para o AI é desafiador, porque variações genéticas únicas não podem ser responsáveis por todos os casos de AIs hereditários e, ainda mais, porque os aneurismas cerebrais são afetados por interações e componentes multifatoriais. Assim, o desenvolvimento de múltiplos modelos poligênicos compostos por variantes preditoras de AI deve ser buscado em estudos futuros.
Deste ponto de vista, vale ressaltar a importância da triagem precoce nos pacientes com histórico familiar de AI a fim de oferecer melhores informações genéticas para diagnósticos de AI e fornecer uma base mais completa para o próximo passo na compreensão da patogênese do AI.
7. REFERÊNCIAS
- ALG, Varinder S. et al. Association of functional MMP-2 gene variant with intracranial aneurysms: case-control genetic association study and meta-analysis. British Journal of Neurosurgery, v. 32, n. 3, p. 255-259, 2018.
- BAKKER, Mark K. et al. Genome-wide association study of intracranial aneurysms identifies 17 risk loci and genetic overlap with clinical risk factors. Nature genetics, v. 52, n. 12, p. 1303-1313, 2020.
- BAKKER, Mark K. et al. Genome-wide linkage analysis combined with genome sequencing in large families with intracranial aneurysms. European Journal of Human Genetics, v. 30, n. 7, p. 833-840, 2022.
- BROTIS, Alexandros G. et al. Collagen type-I A2 gene polymorphisms and susceptibility to intracranial aneurysms: a meta-analysis of genetic association studies. International Journal of Neuroscience, v. 128, n. 7, p. 640-653, 2018.
- CHEN, Yi; SIMA, Xiutian. Replication of GWAS loci revealed an increased risk of BET1L and H19 polymorphisms with intracranial aneurysm. Disease Markers, v. 2019, 2019.
- HONG, Eun Pyo et al. Association of SOX17 gene polymorphisms and intracranial aneurysm: a case-control study and meta-analysis. World Neurosurgery, v. 110, p. e823-e829, 2018.
- HONG, Eun Pyo et al. Fine-mapping of intracranial aneurysm susceptibility based on a genome-wide association study. Scientific Reports, v. 12, n. 1, p. 2717, 2022.
- HONG, Eun Pyo et al. Genomic variations in susceptibility to intracranial aneurysm in the Korean population. Journal of Clinical Medicine, v. 8, n. 2, p. 275, 2019.
- HONG, Eun Pyo; KIM, Bong Jun; JEON, Jin Pyeong. Genome-wide association between the 2q33. 1 locus and intracranial aneurysm susceptibility: an updated meta-analysis including 18,019 individuals. Journal of Clinical Medicine, v. 8, n. 5, p. 692, 2019.
- HU, Liming et al. Polymorphisms of inflammatory cytokine genes and risk for intracranial aneurysm: a systematic review and meta-analysis. Yonsei medical journal, v. 61, n. 5, p. 391, 2020.
- JEON, Jin Pyeong et al. Genetic risk assessment of elastin gene polymorphisms with intracranial aneurysm in Koreans. Neurologia medico-chirurgica, v. 58, n. 1, p. 17-22, 2018.
- LAARMAN, Melanie D. et al. Chromatin conformation links putative enhancers in intracranial aneurysm–associated regions to potential candidate genes. Journal of the American Heart Association, v. 8, n. 9, p. e011201, 2019.
- LI, Bingyang et al. Associations among genetic variants and intracranial aneurysm in a Chinese population. Yonsei medical journal, v. 60, n. 7, p. 651-658, 2019.
- LI, Mengqi et al. Genetic polymorphisms and transcription profiles associated with intracranial aneurysm: a key role for NOTCH3. Aging (Albany NY), v. 11, n. 14, p. 5173, 2019.
- LIU, Liang et al. TLR4 gene polymorphisms rs11536889 is associated with intracranial aneurysm susceptibility. Journal of Clinical Neuroscience, v. 53, p. 165-170, 2018.
- LUCIFERO, Alice Giotta et al. Gene Polymorphisms Increasing the Riskof Intracranial Aneurysms: Interleukin-6-174G> C and-572G> C (Part II). Acta Bio Medica: Atenei Parmensis, v. 92, n. Suppl 4, 2021.
- LUCIFERO, Alice Giotta et al. Gene Polymorphisms Increasing the Risk os Intracranial Aneurysms: Interleukin- 1β -511C>T (Part I). Acta Bio Medica: Atenei Parmensis, v. 92, n Suppl 4, 2021.
- MENG, Qingling; HAO, Qiang; ZHAO, Chuanjie. The association between collagen gene polymorphisms and intracranial aneurysms: a meta-analysis. Neurosurgical Review, v. 42, p. 243-253, 2019.
- SAMUEL, Nardin; RADOVANOVIC, Ivan. Genetic basis of intracranial aneurysm formation and rupture: clinical implications in the postgenomic era. Neurosurgical Focus, v. 47, n. 1, p. E10, 2019.
- SONG, Yunsun et al. Whole exome sequencing in patients with phenotypically associated familial intracranial aneurysm. Korean Journal of Radiology, v. 23, n. 1, p. 101, 2022.
- XU, Lu et al. Associations between inflammatory cytokine gene polymorphisms and susceptibilities to intracranial aneurysm in Chinese Population. BioMed Research International, v. 2021, 2021.
- YU, Ting et al. The association of CDKN2BAS gene polymorphisms and intracranial aneurysm: A meta-analysis. Medicine, v. 99, n. 49, 2020.
- ZHENG, Zheng et al. MicroRNA-513b-5p targets COL1A1 and COL1A2 associated with the formation and rupture of intracranial aneurysm. Scientific Reports, v. 11, n. 1, p. 14897, 2021.
- ZHOU, Sirui et al. Genome-wide association analysis identifies new candidate risk loci for familial intracranial aneurysm in the French-Canadian population. Scientific Reports, v. 8, n. 1, p. 4356, 2018.
