REGISTRO DOI: 10.5281/zenodo.8412291
Mariana Teixeira Custódio1; Dr. Wendel Luiz de Oliveira2; Cínthia Silva Moura Neca3; Vanessa regina rocha4; Edmárcio Olinto da Fonseca5; Denner Henrique Isaias Souza6; Renato Affonso da Silva7; Carlos Ananias Aparecido Resende8; Rafaela Camargos Rodrigues Machado9
INTRODUÇÃO
A medicina popular contribui com uma variedade de plantas que têm sido consideradas uma importante fonte de bioativos com atividade farmacológica, até mesmo antitumoral. Utilizando de vários modelos experimentais, tem sido demonstrado através de estudos que as plantas utilizadas na medicina popular possuem boa atividade farmacológica em testes in vivo e/ou in vitro [1-4]. Além de ensaios para comprovação da atividade farmacológica, são realizados também ensaios que verificam as contra-indicações, testes de toxicidade e mutagenicidade [5-10].
Visto que as plantas possuem compostos que podem interagir com o material genético a fim de causar danos, atualmente tem se aumentado o interesse pela pesquisa de agentes que possam ser mutagênicos, afim de serem estabelecidas doses que sejam seguras para consumo, sem grandes danos ao DNA. Em contrapartida existem os compostos que possuem atividade antimutagênica, que protege o DNA de possíveis interações toxicogenéticas, sendo também um grande alvo de pesquisas, com o objetivo de prevenir o aparecimento e desenvolvimento de tumores [11-14].
Para avaliar o efeito mutagênico e/ou antimutagênico de um composto natural, tem-se à disposição uma grande variedade de testes. Um dos ensaios mais utilizados é o teste do micronúcleo (MN) que é simples, rápido e eficiente para classificar essas substâncias, se tornando um atrativo pelas suas vantagens. Este teste consegue detectar alterações genômicas, onde os micronúcleos representam possíveis perdas cromossomais, sendo analisados em eritrócitos policromáticos de camundongos [11-13, 15-18].
A Eugenia uniflora L. (Myrtaceae), comumente conhecida como a cerejeira brasileira (ou pitangueira) , é pertencente à família Myrtaceae, sendo uma árvore perene que possui 100 gêneros e 3600 espécies. Com as condições certas, pode atingir 6 metros, sendo encontrada em países da América do Sul e atualmente cultivada na América Central, no Caribe, áreas tropicais dos Estados Unidos, Sudeste da Ásia, China, Índia, Sri Lanka, Madagascar, África do Sul, Israel e alguns países do Mediterrâneo [19]. É utilizada na medicina popular como um diurético, anti-reumático, anti-hipertensivo, anti-febril, anti inflamatório, eupéptica, carminativa e como um agente terapêutico para as doenças do estômago [20-25].
Em uma triagem fitoquímica do pó das folhas de Eugenia uniflora L. [21], observou-se a presença de antraquinonas, esteróides, triterpenos, heterosídeos flavonóides, heterosídeos saponínicos e taninos. Não foram detectados alcalóides, amido, cumarinas e heterosídeos digitálicos. O teor de fenóis totais da amostra do pó das folhas de E. uniflora foi de 9,22 %, o teor de taninos de 5,08 % e a percentagem de flavonóides totais de 0,53 %.
O gênero Eugenia é bastante rico em compostos fenólicos, como taninos e flavonóides. Os flavonóides são fitoquímicos que apresentam uma grande variedade de efeitos biológicos como atividade antitumoral e prevenção contra doenças cardiovasculares [26, 27]. Devido ao alto teor de compostos fenólicos, as espécies deste gênero, apresentam atividade antioxidante, relacionada a estes compostos [19, 28]. Os taninos identificados na investigação de constituintes fenólicos de folhas de E. uniflora, foram as eugeniflorinas D1 (C75H52O48) e D2 (C68H48O45), dois taninos macrocíclicos hidrolisáveis, obtidos do extrato metanólico das folhas [20]. Outros compostos com ação antioxidante identificados na espécie são as antocianinas cianidina-3-O-β-glucopiranosídeo e delfinidina-3-O-β-glucopiranosídeo, importantes na pigmentação de flores e frutos [23]. Os antioxidantes são compostos que atrasam a oxidação de óleos e gordura, prevenindo doenças por evitar que sejam gerados oxigênios reativos [19, 29].
Assim, visto a variedade de compostos que indicam atividade antioxidante, presentes na pitangueira e sua possibilidade de aplicações de interesse farmacológicos, o objetivo deste estudo foi o de avaliar o potencial mutagênico e antimutagênico do extrato etanólico de folhas de Eugenia uniflora L. através do teste de micronúcleo em células eritrocitárias policromáticas de camundongos Swiss. Este estudo se mostra promissor visto que em um estudo in vitro, o extrato aquoso obteve, em concentração média mais elevada, uma atividade antimutagênica [30].
1. MATERIAIS E MÉTODOS
1.1 Local
Os experimentos de característica experimental e do tipo bloco casualizado, foram realizados no laboratório 102 da Universidade José do Rosário Vellano.
1.2 Extração da planta
As folhas de Pitanga (Eugenia uniflora L.) foram coletadas de árvores localizadas na cidade de Divinópolis (MG) no mês de Agosto de 2015. Após a coleta, as amostras foram encaminhadas ao laboratório 102, para serem submetidas ao processo de extração. Para obtenção do extrato etanólico, a metodologia utilizada foi baseada nos estudos de FIUZA (2008). As folhas de Eugenia uniflora L., foram lavadas com água destilada e selecionadas, sendo descartadas as partes atacadas por pragas, partes doentes e as folhas mortas. Logo seguiu-se o processo de secagem das folhas, onde foram dessecadas em estufa (Logen Scientific® /1.3) a 40ºC (± 5ºC) por um período de 36 a 48 horas. As folhas secas foram moídas utilizando um moinho de facas (Logen Scientific® /WLS-3004) e o pó seco das folhas (597,73g) foi macerado em etanol a 95% na proporção de 1:3 à temperatura ambiente, em frascos âmbar, com agitação ocasional pelo período de Agosto de 2015 à Fevereiro de 2016. Após a maceração, o concentrado foi filtrado 3 vezes em papel filtro 0.03mm, sendo 900 mls do extrato liofilizados no laboratório de Patologia Experimental da UFSJ, rendendo 25,13g, cuja concentração foi de 820,3 g/L.
1.3 Animais
Foram utilizados camundongos machos da espécie Swiss albino cujo peso corpóreo médio era de 44,32g (±10,72g), sendo provenientes do Biotério Central da Universidade José do Rosário Vellano (câmpus Alfenas). Os animais foram mantidos em caixas plásticas com tampa-grade durante o período de tratamento, com água e ração ad.libidum, em ciclo claro/escuro de 12 horas e temperatura climatizada (25 ±2 ºC). O número total de animais utilizados neste estudo foram 56, sendo distribuídos em 8 grupos, totalizando 7 animais por grupo para cada tratamento. O projeto foi aprovado pela Comissão de Ética no Uso de Animais (CEUA) da Universidade José do Rosário Vellano sob parecer Nº 11 A/2015, na cidade de Alfenas, em 18 de agosto de 2015.
1.4 Tratamento
Para o tratamento dos grupos controles e testes foi aplicada uma metodologia com base nos estudos de QUEIROGA (2012) e GONÇALVES (2012) e seguindo as recomendações de dosagens descritas na OECD 474. Os animais foram divididos em 6 grupos experimentais e 2 grupos controles. Os grupos testes e controle negativo, receberam seu tratamento em dose única de 0,5 mL por gavagem. O grupo controle negativo recebeu 0,5 ml de dimetilsulfóxido (DMSO), solvente utilizado para diluição do extrato. Os grupos 1 e 4 receberam tratamento de extrato diluído em DMSO, concentrado a 500 mg/Kg/peso corpóreo (p.c.); Os grupos 2 e 5 receberam tratamento de extrato diluído em DMSO, concentrado a 1000 mg/Kg/p.c.; Os grupos 3 e 6 receberam tratamento de extrato diluído em DMSO, concentrado a 2000 mg/Kg/p.c. Uma hora após a administração dos tratamentos dos extratos, os grupos 1, 2 e 3 receberam 0,5ml/p.c. de DXR, via intraperitoneal, juntamente com os animais do grupo controle positivo.
Após 24 horas, da aplicação dos tratamentos, os camundongos de todos os grupos submetidos à eutanásia por inalação de dióxido de carbono (CO2) em câmara de acrílico adaptadas. As fezes dos camundongos e maravalhas utilizadas durante este projeto, foram incineradas a fim de evitar contaminação de água, terra ou esgoto.
1.5 Preparo de lâminas e análise hematológica
Para o preparo das lâminas e a análise histológica, a metodologia foi baseada nos estudos de VALE (2012), SILVA (2013) e TAVARES (2014). As epífises do fêmur foram cortadas e a medula óssea lavada com 2,5 ml de soro fetal bovino. Após homogeneização da medula no soro, centrifugou-se a 3600 rpm durante 5 minutos e o sobrenadante foi parcialmente descartado. O precipitado de células foi homogeneizado com pipeta Pasteur. Uma gota de suspensão celular foi então transferida para a lâmina histológica, para realização do esfregaço celular. Após secagem das lâminas em temperatura ambiente, estas foram fixadas em metanol absoluto durante 5 minutos, coradas em solução de Giemsa tamponada com pH 6,8 por um período de 20 minutos, lavadas em água corrente e secas em temperatura ambiente.
Para a análise dos micronúcleos, dois mil eritrócitos policromáticos (EPC) por animal foram contabilizados para determinar a propriedade clastogênica do extrato. Para detectar possíveis efeitos citotóxicos, foi calculada a razão de 400 eritrócitos EPC/ ENC (eritrócitos normocromáticos) por animal. As células foram registradas cegamente, em triplicata, com um microscópio de luz (OLYMPUS) em ampliação 1000x. O número médio de eritrócitos policromáticos micronucleados (EPCMN) em camundongos individuais foi utilizado como a unidade experimental, com variabilidade (desvio padrão) com base nas diferenças entre os animais do mesmo grupo.
1.6 Análise Estatística
A análise estatística foi realizada pelo teste One-way ANOVA, seguido pelo teste de comparação múltipla (teste de Dunnett) para todas as avaliações. Para avaliação de antigenotoxicidade foi realizada por meio da comparação das frequências de EPCMN dos grupos tratados com extrato e DXR, em relação ao grupo positivo. Já os grupos tratados apenas com extrato tiveram a frequência de EPCMN comparadas com o grupo negativo. Para a avaliação de citotoxidade as frequências de EPC/ENC dos grupos tratados apenas com extrato foram comparados com as frequencias de EPC/ENC do grupo negativo e os dos grupos de extratos e DXR comparados com o grupo positivo. Foram levados em consideração apenas resultados que apresentaram diferença significativa onde p < 0,05.
2. RESULTADOS
Os efeitos da administração do extrato etanólico das folhas de Eugenia uniflora L. (eefEU), em diferentes concentrações, acompanhadas ou não da aplicação de DXR nas células medulares de camundongos Swiss, estão apresentados na Tabela 1.
Tabela 1 – Média da frequência de EPCMNs e EPC/ENC nas células medulares de camundongos Swiss tratados com diferentes concentrações do extrato etanólico de E. uniflora L., com ou sem administração concomitante de DXR e os respectivos controles
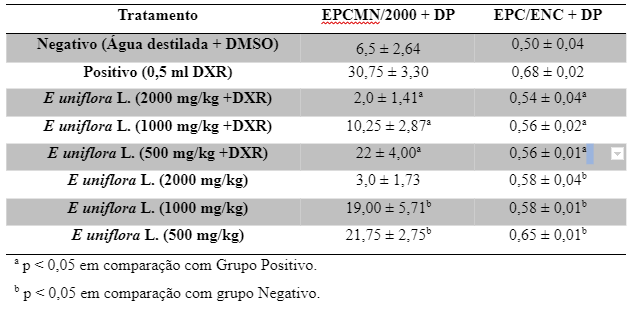
Na avaliação do potencial antimutagênico do extrato etanólico de folhas de E. uniflora L. (eefEU), expressa pela média das frequências de EPCMN (Tabela 1), observou-se que os camundongos apresentaram uma média de 2, 10,25 e 22 EPCMN/2000 EPC nas concentrações de 2000, 1000 e 500 mg/Kg de eefEU com tratamento concomitante de DXR respectivamente, enquanto o controle positivo apresentou uma média de 30,75 EPCMN/2000 EPC (Figura 1). O resultado demonstra que a administração do extrato com DXR provocou uma redução significativa de EPCMN em relação ao grupo positivo em todas as doses aplicadas (p < 0,05).
Já na avaliação do potencial mutagênico os animais tratados com o extrato, as concentrações de 2000, 1000 e 500 mg/Kg, apresentaram uma média de 3, 19 e 21,75 EPCMN/ 2000 EPC respectivamente, enquanto o controle negativo apresentou uma média de 6,5 EPCMN/ 2000 EPC (Figura 2). O resultado demonstra que a administração do extrato possui atividade mutagênica nas doses de 1000 e 500 mg/Kg, já que, nessas concentrações, obteve diferença significativa em relação ao controle negativo (p > 0,05).
Para avaliação da citotoxicidade foram analisados 400 eritrócitos e realizada a razão de EPC/ENC dos animais tratados com as diferentes doses do extrato e comparado com a razão do grupo negativo. Todas as doses testadas apresentaram diferenças significativas em relação ao grupo negativo indicando a presença de possível citotoxicidade. Além disso, foi observado que dois animais do grupo 6, com administração de 2000 mg/Kg do eefEU, vieram a óbito antes do fim das 24 horas do teste. Também foi observado que os outros animais do grupo, apresentavam ofegação e tinham comportamento mais quieto do que aqueles em que a dose aplicada do extrato foi menor ou até mesmo do que naqueles grupos onde foi administrado extrato e DXR.
A razão de EPC/ENC dos animais tratados com extrato e DXR em comparação com o grupo controle positivo, avaliou a anticitotoxicidade. Todas as doses testadas apresentam diferenças significativas, indicando uma possível anticitotoxicidade quando é administrado o extrato etanólico de folhas de Eugenia uniflora L. e a doxorrubicina.
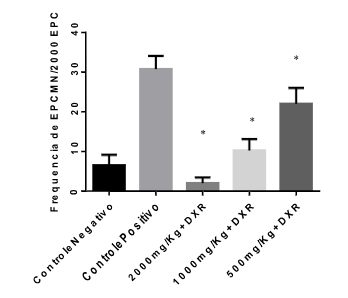
Figura 1 – Frequência de eritrócitos policromáticos micronucleados (EPCMN) após 24 horas de tratamento extrato etanólico de Eugenia uniflora L. concomitantemente com DXR e controles.
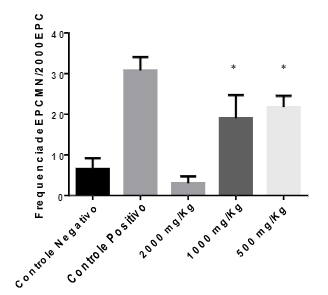
Figura 2 – Frequência de eritrócitos policromáticos micronucleados (EPCMN) após 24 horas de tratamento extrato etanólico de Eugenia uniflora L. e controles.
3. DISCUSSÃO
Esta pesquisa avaliou os potenciais mutagênico e antimutagênico do extrato etanólico das folhas de Eugenia uniflora em três diferentes concentrações (2000, 1000 e 500 mg/Kg) quando comparadas aos controles negativo e positivo (doxorrubicina), em células medulares de camundongos Swiss. A análise dos resultados estatísticos, indica que o extrato das folhas de pitanga apresentou uma atividade antimutagênica em todas as doses testadas, atividade mutagênica nas doses de 1000 e 500 mg/Kg e ainda apresentou citotoxicidade quando administrada sozinha e anticitotoxicidade quando administrada juntamente com a doxorrubicina.
Os compostos secundários encontrados em plantas, são responsáveis por suas atividades farmacológicas, sendo de grande importância como fonte de estudos a fim de descobrir extratos que podem ser utilizados em prevenção e tratamento de doenças [27]. Compostos metabólicos como taninos e flavonóides possuem atividade antioxidante, que tem sido alvo de estudos quanto a sua atividade anitmutagênica quando administrados frente um agente indutor de mutações no material genético ou até mesmo em redução de tumores já existentes [14, 31].
A literatura descreve alguns compostos encontrados em extratos realizados com as folhas de pitanga, sendo relatados entre eles, compostos que apresentam atividade antioxidante como antraquinonas, flavonóides e taninos [19-21, 23, 28, 32]. Embora muitos ensaios farmacológicos tenham sido realizados com extratos de folhas de E. Uniflora L., são escassos os estudos toxicogenéticos e/ou genoprotetores desse extrato, sendo encontrado apenas um estudo, in vitro, onde foi reportado ambos potenciais de atividade mutagênica em baixas concentrações do extrato e atividade antimutagênica em altas concentrações, realizadas através do teste Allium cepa [30]. Os resultados obtidos no estudo in vitro foram compatíveis com aqueles encontrados no modelo in vivo demonstrado neste estudo.
Antioxidantes são geralmente relacionados com potenciais genoprotetores e atividade anti carcinogênica, mas em algumas situações, sua interação com Espécies Reativas de Oxigênio (ROS), podem converter esses compostos em prooxidantes, que tem o potencial de oxidar lipideos, proteínas e até mesmo o DNA [33]. A quercetina, por exemplo, pertencente à classe de flavonóides, em altas doses pode induzir o aumento de peroxidação lipídica, obtendo efeito prooxidante, ao invés de sua atividade antioxidante [34].
Embora não seja muito comum, um extrato pode apresentar atividades mutagênicas e anti mutagênicas, como pode ser observado num estudo onde a quercetina presente em Heterotheca inuloides apresentou efeito duplo, agindo como anti e prooxidante. Os mecanismos de ação de compostos presentes em plantas nem sempre são facilmente elucidados, principalmente quando várias moléculas podem interagir e gerar vários mecanismos de ação que podem estar envolvidos no sistema de reparo do DNA [35].
A quercetina tem apresentado atividade mutagenica através de substituições de pares de base e mutações de frameshift quando aplicadas no teste de Ames e indução de aberrações cromossomais em linhagens celulares CHO. Já os testes de micronúcleos aplicados em células medulares de camundongos apresentam convergências de dados, nem sempre apresentando mutagenicidade [36]. Além da quercetina, o flavonóide chrysin, encontrado no mel e no própolis, apresentou citotoxicidade em culturas de células HepG2 induzindo apoptose, produzindo quebras no DNA e/ou mutações pontuais [37].
Assim os flavonóides presentes nas folhas de Eugenia uniflora L podem estar agindo como antimutagenicos e mutagenicos visto que esses compostos estão ligados à vários mecanismos de ação quando se trata de interação com o DNA [38].
Alguns flavonóides conseguem atuar na captura e eliminação de radicais livres induzidos por agente quimioterápicos, além de aumentar a ação citotóxica desses agentes sem causar danos às células saudáveis [13, 39]. Esta ação citotóxica de agentes quimioterápicos pode ser a resposta de porque o mesmo extrato, aplicado nas mesmas concentrações, cuja a única diferença é a presença de um antineolpásico alquilante em determinados grupos testes, apresenta ambas citoproteção e citotoxicidade.
Além da presença de agentes alquilantes ou células tumorais, outro fator que parece influenciar a presença de citotoxicidade ou não, são os solventes utilizados para extração dos componentes, presentes nas folhas, e até mesmo nos frutos da pitangueira. Em um estudo que avaliou a citotoxicidade de extratos de folhas e sementes de Eugenia uniflora e malaccensis L, verificou que frações do extrato, realizadas com etil acetato e butanol, apresentaram níveis de toxicidade em concentrações diferentes, mas que o extrato aquoso das folhas e sementes não apresentaram toxicidade quando avaliadas em teste de cultura celular de baços de camundongos de linhagem BALB/c. Quando as mesmas frações foram avaliadas com um teste de toxicidade hemolítica, apenas as frações extraídas com etil acetato apresentaram toxicidade [40].
Em um estudo realizado com extrato de pitangas roxas, demonstraram efeito antiproliferativo e citotóxico em sistema in vitro. Os estudos sugerem que a citotoxicidade pode ser causada por apoptose induzida via redução da membrana de mitocôndrias, sendo verificado através de ativação do caminho da caspase 3 [41].
Num estudo de toxicidade das folhas de pitanga em Drosophila melanogaster, o óleo essencial demonstrou atividade tóxica, com rápida indução de mortalidade e déficit de locomoção. As moscas demonstraram sinais de estresse oxidativo por formação de ROS, principalmente entre os tempos de 3 horas até 12 horas após administração do óleo essencial do extrato, além do aumento de atividade de peroxidação lipídica entre 6 e 12 horas após administração [42].
Já o extrato etanólico realizado em outro estudo, realizado pelo mesmo grupo de pesquisadores, utilizando Drosophila melanogaster, mas utilizando concentrações maiores do extrato, não foi observado toxicidade significativa, assim como em outros testes de citotoxicidade realizados em culturas de sementes de alface e bactéria quando expostas à metais pesados [43].
Assim, os compostos deste extrato parecem ter um tropismo por outros compostos, podendo apresentar atividade anticitotoxica em células saudáveis quando há presença de compostos de origem tóxica.
4. CONCLUSÃO
A administração do extrato etanólico de folhas de Eugenia uniflora L com a doxorrubicina resultou na presença de atividade antimutagenica, podendo esta ser correlacionada à grande presença de compostos flavonóides, e atividade anticitotóxica, que parece estar ligada à presença de metais pesados ou de agentes alquilantes. Quando administrado somente o extrato, houve atividade mutagenica que pode estar relacionada também com a presença de flavonóides que agem como prooxidantes, e atividade citotóxica, atividade esta que parece estar intimamente ligada à concentração e forma de extração.
Assim, são necessário outros estudos para elucidar os mecanismos de interação dos compostos presentes nas folhas da pitangueira, a fim identificar quais compostos e quando interagem com as células e o material genético e em quais situações não apresenta toxicidade ou uma dose segura para consumo, visto que as folhas são amplamente utilizadas na medicina popular.
REFERÊNCIAS BIBLIOGRÁFICAS
- Melo, J.G.d., et al., Phytochemical and pharmacological notes of plants indicated to treat tumors in Brazil. Revista Brasileira de Farmacognosia, 2011. 21: p. 744-753.
- Zhang, X., et al., Plant natural compounds: targeting pathways of autophagy as anti- cancer therapeutic agents. Cell Proliferation, 2012. 45(5): p. 466-476.
- Shanmugam, M.K., et al., Targeted inhibition of tumor proliferation, survival, and metastasis by pentacyclic triterpenoids: Potential role in prevention and therapy of cancer. Cancer Letters, 2012. 320(2): p. 158-170.
- Lee, S., et al., Cyto-/genotoxic effects of the ethanol extract of Chan Su, a traditional Chinese medicine, in human cancer cell lines. Journal of ethnopharmacology, 2014. 152(2): p. 372-376.
- Araujo, E.C., et al., Uso De Plantas Medicinais Pelos Pacientes Com Câncer De Hospitais Da Rede Pública De Saúde Em João Pessoa (Pb). Revista Espaço para a Saúde, 2007. 8(2): p. 44-52.
- Oliveira, L.A.R., R.D. Machado, and A.J.L. Rodrigues, Levantamento sobre o uso de plantas medicinais com a terapêutica anticâncer por pacientes da Unidade Oncológica de Anápolis. Revista Brasileira de Plantas Medicinais, 2014. 16: p. 32-40.
- Alonso- Castro, A.J., et al., Mexican medicinal plants used for cancer treatment: Pharmacological, phytochemical and ethnobotanical studies. Journal of Ethnopharmacology, 2011. 133(3): p. 945-972.
- Alves, A.B.C.R., et al., Genotoxic assessment of Rubus imperialis (Rosaceae) extract in vivo and its potential chemoprevention against cyclophosphamide-induced DNA damage. Journal of ethnopharmacology, 2014. 153(3): p. 694-700.
- Tolentino, F., et al., In vivo evaluation of the genetic toxicity of Rubus niveus Thunb.(Rosaceae) extract and initial screening of its potential chemoprevention against doxorubicin-induced DNA damage. Journal of ethnopharmacology, 2015. 164: p. 89-95.
- Njoya, E.M., P.F. Moundipa, and H. Stopper, in vitro genotoxic and mutagenic evaluation of the aqueous extract of Codiaeum variegatum and its amoebicidal sub-fraction. Journal of ethnopharmacology, 2014. 155(1): p. 823-829.
- Queiroga, A.S., Avaliação do potencial antimutagênico do leite humano em interação com a Alfa Cipermetrina pelo Teste do Micronúcleo em camundongos. 2012, Universidade Estadual da Paraíba: Campina Grande. p. 49.
- Silva, M.B.d., Avaliação in vivo do potencial mutagênico e antimutagênico do extrato obtido das folhas de Schinopsis Brasiliensis Engl. através do teste de micronúcleo em camundongos. 2013, Universidade Estadual da Paraíba: Campo Grande. p. 25.
- Vale, C.R.d., Avaliação da atividade tóxica, genotóxica e antigenotóxica de hymenaea courbaril l. em camundongos e drosophila melanogaster. 2012, Universidade federal de Goias: Goiania. p. 126.
- Sturbelle, R.T., et al., Avaliação da atividade mutagênica e antimutagênica da Aloe vera em teste de Allium cepa e teste de micronúcleo em linfócitos humanos binucleados. Revista Brasileira de Farmacognosia, 2010. 20: p. 409-415.
- Tavares, A.V., Avaliação in vivo do potencial mutagênico e antimutagênico do extrato etanólico da entrecasca do caule de Maytenus rigida Mart. pelo teste de micronúcleo em sangue periférico de camundongos. 2014, Universidade Estadual da Paraíba: Campo Grande. p. 21.
- Rebouças, S.d.O., et al., The antigenotoxic activity of latex from Himatanthus articulatus. Revista Brasileira de Farmacognosia, 2012. 22: p. 389-396.
- Silva, V.A., et al., Assessment of mutagenic, antimutagenic and genotoxicity effects of Mimosa tenuiflora. Revista Brasileira de Farmacognosia, 2013. 23: p. 329-334.
- Boriollo, M.F.G., et al., Evaluation of the mutagenicity and antimutagenicity of Ziziphus joazeiro Mart. bark in the micronucleus assay. Genetics and molecular biology, 2014. 37(2): p. 428-438.
- Martinez-Correa, H.A., et al., Extracts from pitanga (Eugenia uniflora L.) leaves: Influence of extraction process on antioxidant properties and yield of phenolic compounds. The Journal of Supercritical Fluids, 2011. 55(3): p. 998-1006.
- Viana, F.C., A.C.M. Santana, and R.M.X. Moura, Identificação Fitoquímica De Flavonóides E Taninos Em Folhas De Pitanga (Eugenia Uniflora L.) Utilizadas Tradicionalmente Na Região Sul Da Bahia. InterPHacis – Informação farmaceutica: Interfaces entre a Pharmacia e as Ciências da Saúde, 2012. 1: p. 9.
- Fiuza, T.S., et al., Caracterização Farmacognóstica Das Folhas De Eugenia Uniflora L. (Myrtaceae). Revista Eletrônica de Farmácia, 2008. 5(2).
- Victoria, F.N., et al., Essential oil of the leaves of Eugenia uniflora L.: Antioxidant and antimicrobial properties. Food and Chemical Toxicology, 2012. 50(8): p. 2668-2674.
- Magina, M.D.A., Estudo fitoquímico e biológico de espécies do gênero Eugenia, in Centro de Ciências Físicas e Matemáticas. Programa de Pós-Graduação em Química. 2008, Universidade Federal de Santa Catarina: Santa Catarina. p. 277.
- Lee, M.-H., et al., EBV DNA polymerase inhibition of tannins from Eugenia uniflora. Cancer Letters, 2000. 154(2): p. 131-136.
- Amorim, A.C.L., et al., Antinociceptive and hypothermic evaluation of the leaf essential oil and isolated terpenoids from Eugenia uniflora L. (Brazilian Pitanga). Phytomedicine, 2009. 16(10): p. 923-928.
- Biso, F.I., et al., Assessment of DNA damage induced by extracts, fractions and isolated compounds of Davilla nitida and Davilla elliptica (Dilleniaceae). Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2010. 702(1): p. 92-99.
- Serpeloni, J.M., et al., Antimutagenicity and induction of antioxidant defense by flavonoid rich extract of Myrcia bella Cambess. in normal and tumor gastric cells. Journal of ethnopharmacology, 2015. 176: p. 345-355.
- Lima, V.L.A.G.d., E.d.A. Mélo, and D.E.d.S. Lima, Fenólicos e carotenóides totais em pitanga. Scientia Agricola, 2002. 59: p. 447-450.
- Brewer, M., Natural antioxidants: sources, compounds, mechanisms of action, and potential applications. Comprehensive Reviews in Food Science and Food Safety, 2011. 10(4): p. 221-247.
- Kuhn, A.W., et al., Mutagenic and antimutagenic effects of Eugenia uniflora L. by the Allium cepa L. test. Caryologia, 2015. 68(1): p. 25-30.
- Weng, C.-J. and G.-C. YEN, Chemopreventive effects of dietary phytochemicals against cancer invasion and metastasis: Phenolic acids, monophenol, polyphenol, and their derivatives. Cancer Treatment Reviews, 2012. 38(1): p. 76-87.
- Massarioli, A.P., et al., Antioxidant activity of different pitanga (Eugenia uniflora L.) fruit fractions. Int J Food Agric Environ, 2013. 11: p. 288-293.
- Mellado-García, P., et al., Genotoxicity of a thiosulfonate compound derived from Allium sp. intended to be used in active food packaging: In vivo comet assay and micronucleus test. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2016. 800: p. 1-11.
- Martins, R.d.P., et al., Synergistic neurotoxicity induced by methylmercury and quercetin in mice. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 2009. 47(3): p. 645-649.
- Ruiz-Pérez, N.J., et al., Mutagenic and antimutagenic effects of Heterotheca inuloides. Scientific reports, 2014. 4.
- Resende, F.A., et al., Mutagenicity of flavonoids assayed by bacterial reverse mutation (Ames) test. Molecules, 2012. 17(5): p. 5255-5268.
- Oliveira, G., et al., Evaluation of the mutagenic activity of chrysin, a flavonoid inhibitor of the aromatization process. Journal of Toxicology and Environmental Health, Part A, 2012. 75(16-17): p. 1000-1011.
- Resende, F.A., et al., Differences in the hydroxylation pattern of flavonoids alter their chemoprotective effect against direct- and indirect-acting mutagens. Food Chemistry, 2014. 155: p. 251-255.
- Şekeroğlu, Z.A. and V. Şekeroğlu, Effects of Viscum album L. extract and quercetin on methotrexate-induced cyto-genotoxicity in mouse bone-marrow cells. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2012. 746(1): p. 56-59.
- Figueiroa, E.d.O., et al., Evaluation of Antioxidant, Immunomodulatory, and Cytotoxic Action of Fractions from Eugenia uniflora L. and Eugenia malaccensis L.: Correlation with Polyphenol and Flavanoid Content. The Scientific World Journal, 2013. 2013: p. 7.
- Denardin, C.C., et al., Antiproliferative and cytotoxic effects of purple pitanga (Eugenia uniflora L.) extract on activated hepatic stellate cells. Cell biochemistry and function, 2014. 32(1): p. 16-23.
- da Cunha, F.A.B., et al., Eugenia uniflora leaves essential oil induces toxicity in Drosophila melanogaster: involvement of oxidative stress mechanisms. Toxicology Research, 2015. 4(3): p. 634-644.
- Cunha, F.A., et al., Cytoprotective effect of Eugenia uniflora L. against the waste contaminant mercury chloride. Arabian Journal of Chemistry, 2016.
1Universidade José do Rosário Vellano-UNIFENAS;
2Universidade José do Rosário Vellano-UNIFENAS;
3Faculdade Anhaguera Divinópolis;
4Faculdade Anhaguera Divinópolis;
5Faculdade Santa Casa de Belo Horizonte;
6Centro Universitario UNA Divinópolis;
7Faculdade Estácio de Sá;
8Faculdade Anhanguera de Divinópolis;
9Faculdade Anhanguera de Divinópolis.
