EVALUATION OF THE DEGRADATION PROFILE OF CEFADROXIL AND AZITHROMYCIN ANTIBIOTICS
REGISTRO DOI: 10.5281/zenodo.7926208
Carolina Aparecida Moreno Lopes
Rodrigo de Oliveira Marcon
Carenina Vidotte Plaza
RESUMO
Objetivo: Obtenção do perfil de degradação qualitativo do fármaco ou medicamento perante o método proposto. Comprovação de que um método proposto é indicativo de estabilidade. Detecção de condições de estresse as quais o medicamento é particularmente sensível.
Revisão Bibliográfica: O estudo de degradação forçada tem como objetivo avaliar a especificidade e seletividade do método analítico frente a possíveis produtos de degradação formados devido a exposição em algumas condições mais severas que as habituais em que o medicamento é normalmente exposto, conhecidas como condições de estresse, como por exemplo, umidade, luz, temperatura, calor, hidrólise básica/ ácida e oxidação, entre outras. Sendo assim, o estudo de degradação forçada nos permite descobrir quais os grupos funcionais susceptíveis e as vias de degradação mais propícias para os fármacos em estudo, e quando aliado a uma busca em literatura sobre a existência de impurezas oriundas do processo de degradação já conhecidas, fornecerá um conhecimento robusto sobre a estabilidade do fármaco. Conhecendo a formulação dos medicamentos estudados, é possível presumir se essas impurezas são possíveis de formar ao longo do tempo de vida útil e, dessa maneira, identificá-las e quantificá-las. O perfil de degradação de fármacos, assim como estudos de degradação forçada, vem sendo exigidos pela ANVISA em forma de legislação (RDC 53/2015) desde 2015, com isso se faz necessário entender os mecanismos de degradação do insumo farmacêutico ativo isolado e em combinação com os excipientes presentes no medicamento, para então entender o universo das impurezas potenciais e relacioná-lo ao universo real, resultante do estudo de estabilidade do medicamento, promovendo uma especificação aceitável de possíveis impurezas que possam vir a serem formadas durante seu período de vida útil, com limite seguro à ingestão pelo paciente.
Considerações finais: As condições suscetíveis à degradação do IFA isolado e no produto acabado de ambos antibióticos estudados são as condições de hidrólise alcalina e ácida, oxidativa via peróxido, temperatura e umidade. O principal produto de degradação formado durante o estudo [ou por essas vias] foram as impurezas conhecidas F e J da azitromicina e a impureza B da cefadroxila, sendo estes os principais marcadores da degradação desses fármacos, portanto, tornando-se necessário o seu monitoramento no estudo de estabilidade do medicamento. Deste modo conclui-se que a Azitromicina obteve um resultado mais expressivo que a cefadroxila pois o seu perfil de degradação apresentou mais impurezas já conhecidas, uma vez que a cefadroxila apresentou muitas impurezas desconhecidas, além da cefadroxila necessitar de condições mais brandas para obter quedas de teores semelhantes à azitromicina.
Palavras-chave: Perfil de degradação. Estabilidade de medicamento. Azitromicina. Cefadroxila. Antibióticos.
ABSTRACT
Objective: Obtaining the qualitative degradation profile of the drug or medication using the proposed method. Proof that a proposed method is indicative of stability. Detection of stress conditions to which the drug is particularly sensitive.
Bibliographic Review: The forced degradation study aims to evaluate the specificity and selectivity of the analytical method against possible degradation products formed due to exposure to some more severe conditions than the usual ones in which the drug is normally exposed, known as stress conditions, such as example, humidity, light, temperature, heat, basic/acid hydrolysis and oxidation, among others. Thus, the study of forced degradation allows us to discover which functional groups are susceptible and which are the most favorable degradation pathways for the drugs under study, and when combined with a search in the literature on the existence of already known impurities arising from the degradation process, will provide robust knowledge about drug stability. Knowing the formulation of the drugs studied, it is possible to presume whether these impurities are possible to form over the shelf life and, in this way, identify and quantify them. The drug degradation profile, as well as forced degradation studies, have been required by ANVISA in the form of legislation (RDC 53/2015) since 2015, with this it is necessary to understand the degradation mechanisms of the active pharmaceutical ingredient alone and in combination with the excipients present in the drug, in order to then understand the universe of potential impurities and relate it to the real universe, resulting from the stability study of the drug, promoting an acceptable specification of possible impurities that may be formed during its useful life , with a safe limit for intake by the patient.
Final considerations: The conditions susceptible to the degradation of the isolated API (Active Pharmaceutical Ingredient) and in the finished product of both antibiotics studied are the conditions of alkaline and acid hydrolysis, oxidative via peroxide, temperature and humidity. The main degradation product formed during the study [or through these routes] were the known impurities F and J of azithromycin and the impurity B of cefadroxil, these being the main markers of the degradation of these drugs, therefore, making their monitoring necessary in the drug stability study. Thus, it is concluded that Azithromycin obtained a more expressive result than cefadroxil because its degradation profile presented more known impurities, since cefadroxil presented many unknown impurities, in addition to cefadroxil needing milder conditions to obtain decreases in levels similar to azithromycin.
Keywords: Degradation profile. Drug stability. Azithromycin. Cefadroxil. Antibiotics.
1. INTRODUÇÃO
A estabilidade química das moléculas farmacêuticas é uma questão de grande preocupação, uma vez que afeta a segurança e eficácia do medicamento. As orientações da FDA (Food and Drug Administration) e ICH (The International Council for Harmonisation) declaram a exigência de dados de teste de estabilidade para entender como a qualidade de uma substância e produto farmacêutico muda com o tempo sob a influência de vários fatores ambientais. O conhecimento da susceptibilidade da molécula ajuda na escolha ideal da formulação e embalagem, bem como fornecer condições de armazenamento adequadas e prazo de validade, que é essencial para a documentação regulamentar.
O estudo de perfil de degradação é um processo que envolve a degradação do produto terminado (PT) e insumo farmacêutico ativo (IFA) em condições mais estressantes do que as condições de um estudo de estabilidade acelerada e, assim, gera produtos de degradação que podem ser estudados para determinar a estabilidade da molécula.
Nesse sentido, temos como hipótese, ou melhor, partimos do pressuposto de que tanto a cefadroxila quanto a azitromicina são susceptíveis às principais vias de degradação, avaliados pela estrutura molecular. A predição orgânica teórica tem como intuito auxiliar a discussão dos dados gerados em um estudo de degradação forçada de moléculas sintéticas, como requisito para cumprimento da RDC 53/2015 (ANVISA). Para tal, é feita uma análise da estrutura molecular desse alvo, com informações sobre as funções químicas nela contida e sua vulnerabilidade frente a alguns agentes estressantes vistos anteriormente. Junto a essa avaliação são propostas as estruturas para potenciais produtos de degradação e sua via de formação, assim como se há compêndios oficiais que monitoram impurezas. Este conhecimento é útil para a verificação do método quantitativo proposto, ou seja, se é indicativo de estabilidade, como seletividade/especificidade suficientes para sua finalidade, bem como predizer a vida útil do medicamento, com possíveis fontes de degradação intra (compatibilidade com excipientes) e/ou extra medicamentosa que o produto possa sofrer durante sua vida útil.
As principais funções orgânicas presentes para a predição de degradação da molécula de azitromicina são: amina terciária, lactona/éster, éter e álcool. O insumo farmacêutico ativo azitromicina, possui alta suscetibilidade frente os principais agentes degradantes, principalmente a reações de hidrólise em toda a faixa de pH. (Zhang, et al., 2009)
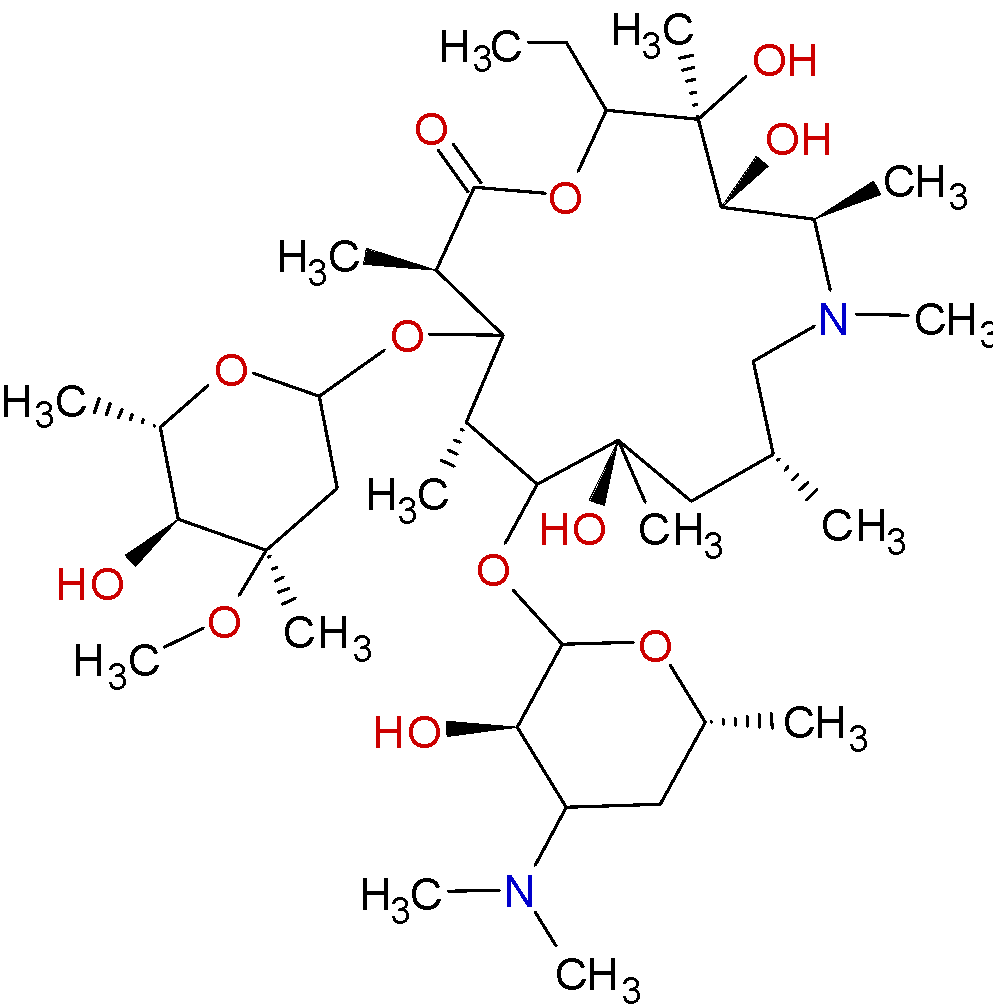
Figura 1. Estrutura química da azitromicina. (Farmacopeia Europeia)
As principais funções orgânicas presentes para a predição de degradação da molécula de cefadroxila são: Ácido carboxílico, amidas, lactamas, fenóis, tioéter. As literaturas estudadas relatam a susceptibilidade da cefadroxila a degradação sob condições ácidas, alcalinas e oxidativas, já nas condições térmica e fotolítica mostrou ser relativamente estável. (DEY, et al., 2010)
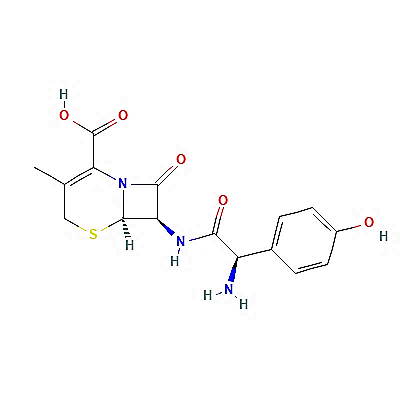
Figura 2. Estrutura química da cefadroxila. (PUBCHEM, 2023)
2. REVISÃO BIBLIOGRÁFICA
Os estudos de degradação forçada devem ser projetados para fornecer informações adequadas para desenvolver e validar métodos indicativos de estabilidade. Esses métodos indicativos de estabilidade devem ser capazes de detectar de maneira seletiva o ativo e seus possíveis degradantes, é importante ressaltar, que os possíveis produtos formados são gerados a partir de uma condição forçada, não sendo, necessariamente, parte do perfil real de produtos de degradação.
2.1 TEMPERATURA
O estresse por altas temperaturas é talvez a condição de estresse que se assemelha mais diretamente a interpretação preditiva. Isso pressupõe, é claro, que a cinética de Arrhenius é observada dentro da faixa de temperatura de armazenamento de longo prazo para o fármaco estressado nessa condição. Assumindo a cinética de Arrhenius e as energias de ativação, é possível traçar um paralelo entre tempo e temperatura para prever a quantidade de degradação formada durante o armazenamento a longo prazo.
Hickey e colaboradores (2007) estudaram a estabilidade térmica em relação a cristalinidade e hidratação de antibióticos. Quando a molécula de água presente na estrutura está distante do anel β-lactâmico, estruturas como da cefadroxila são relativamente estáveis, visto que a condição para que a reação ocorra – ataque nucleofílico pela molécula de água – é menos favorável e mais lenta. (HICKEY, et al., 2007)
Seguindo este racional, é esperado que os produtos formados após aquecimento da cefadroxila sejam derivados da abertura do anel β-lactâmico, como indicado no trabalho de Rourick e colaboradores (1996). (Rourick, et al., 1996)
A influência da temperatura em degradações da azitromicina em solução foi amplamente estudada e comprovada que influencia no aumento da velocidade das reações (Saita, et al., 2018) (Tong, Eichhorn, Pérez, Wang, & Barceló, 2011) (Zhang, et al., 2009). Em calor seco, é esperado que moléculas contendo açúcares em sua composição degradem de maneira significativa em pouco tempo de exposição.
Moreno e colaboradores (2009) obtiveram uma de degradação de 40% quando expuseram a azitromicina a uma temperatura de 50ºC por 20 dias e, nesse mesmo período, ocorreu a degradação total da substância exposta a 100ºC.
2.2 Umidade
O estresse por umidade elevada fornece informações relacionadas com a necessidade de proteção contra a exposição à alta ou baixa umidade.Tal informação é geralmente considerada apenas semiquantitativa em sua essência, ou seja, se a estabilidade do composto é ou não melhor em altas ou baixas umidades. Esta via de degradação está relacionada com mecanismos de hidrólise neutra.
A cefadroxila é conhecida como uma molécula que degrada rápido na presença de umidade, por causa da hidrólise do anel β-lactâmico. Estudos de degradação conduzidos em meio com pH neutro ou conduzido com água mostram os mesmos produtos observados nas hidrólises catalisadas por ácido e base, segundo discutido nos itens anteriores. (DEY, et al., 2010) (HELALEH & ABU-NAMEH, 1998) (Li, 2012) (TSUJI, et al., 1981) (HICKEY, et al., 2007)
Em adição, a formação de mais um composto em meio aquoso foi relatado por Tsuji e colaboradores (1981) e trata-se do composto 3-hydroxy-4-methylthiophen-2(5H)-one.
2.3 Fotólise
Estresse de exposição à luz (ou seja, radiação ultravioleta e visível) é guiado pela diretriz ICH sobre fotoestabilidade. A diretriz guiada pelo ICH é direcionada principalmente para testes confirmatórios de fotoestabilidade, que descreve os níveis de fotoexposição com a finalidade de identificar potenciais problemas de fotoestabilidade que podem ser encontrados durante o armazenamento e distribuição do produto comercializado. A maioria desses tipos de problemas podem ser abordados por modificações de embalagem, rotulagem e/ou formulação. Pouca orientação é dada à interpretação de estudos de fotoestresse (aos quais a diretriz se refere como “teste forçado de degradação”) em relação ao processo de desenvolvimento. Assim, os estudos de fotoestresse são principalmente úteis para o desenvolvimento de uma compreensão da fotoquímica do fármaco e para o desenvolvimento aprotópico. Um possível uso de estudos de fotoestabilidade/fotoestresse é a avaliação de possíveis problemas na fabricação e/ou manuseio analítico. É recomendado pela EFPIA que 100.000 lux-h é um valor razoável de quantidade de exposição à luz, para determinar se precauções especiais devem ser consideradas durante a fabricação. Este nível de exposição à luz também deve fornecer uma estimativa razoável dos problemas que podem ser encontrados durante o desenvolvimento analítico e de formulação. Claro, o potencial de exposição à luz ultravioleta também pode precisar ser avaliado dependendo sobre as condições de iluminação dos laboratórios analíticos e da instalação da fábrica. A melhor maneira de avaliar o potencial de exposição à luz seria fazer medições reais nos laboratórios e instalações de fabricação. (Reed, et al., 2003)
Não foram encontrados estudos na literatura de formação de produtos de fotodegradação de cefadroxila, porém, conforme estudos gerais de antibióticos cefalosporínicos, é esperado que, após exposição a irradiação, a molécula seja oxidada através da formação de espécies reativas de oxigênio. (Li, 2012) (Baertschi, Alsante, & Reed, 2011) (Reynoso, Nesci, Allegretti, Criado, & Biasutti, 2012)
A azitromicina em meio aquoso degrada totalmente num período de 30 minutos, quando exposta à irradiação UV-D (254/185 nm), enquanto na luz UV-A (365 nm) não ocorre degradação. Neste mesmo estudo, cinco produtos de degradação foram identificados, conforme mostrados na (Cizmic, et al., 2019)
2.4 Hidrólise Ácido/Base
Os resultados da degradação por hidrólises indicarão se a molécula do fármaco tem ou não uma determinada instabilidade em condições aquosas em função do pH. Este estudo é bastante útil para compostos que estarão em formulação líquida (solução ou suspensão), pois será preciso informações sobre a cinética na faixa de pH especificada do produto, para então se ter dados de estabilidade desejada, assim, os solventes, a força iônica, o tipo e concentração de tampão concentração serem utilizados são cuidadosamente controlados. (Waterman, et al., 2002)
Em estudo da dependência da taxa de degradação hidrolítica da cefadroxila em relação ao pH mostra que a hidrólise aumenta significativamente ao aumentar o valor de pH do meio reacional, sendo a clivagem da β-lactama a principal característica dos produtos formados. (TSUJI, et al., 1981)
A literatura relata a alta susceptibilidade da cefadroxila a sofrer todo tipo de hidrólise. (DEY, et al., 2010) relatam degradação quase que completa quando submetido a NaOH 0,01M e a HCl 0,3M por apenas 90 minutos. Helaleh & Abu-Nameh (1998) propuseram uma reação de hidrólise catalisada por NaOH com a formação de dois produtos resultantes da clivagem das ligações β-lactâmica e tioéter, consequente oxidação.
A azitromicina possui, como sua principal via de degradação em meio ácido, a hidrólise da ligação éter do açúcar cladinose. (Li, 2012) Em um estudo sobre a cinética de degradação da azitromicina, os autores avaliaram a influência do pH na velocidade de degradação e, concluíram que nos pHs extremos, a taxa de degradação é alta e diminui em valores próximos a 6 e aumenta novamente com o incremento de valores no pH. (Zhang, et al., 2009)
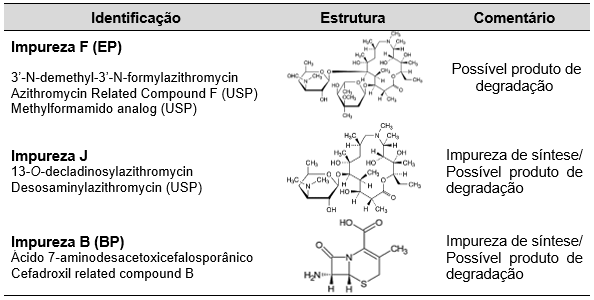
Neste intervalo de variação de pH, estudado por Zhang e colaboradores (2009) foram identificados cinco degradantes desconhecidos, sendo que o majoritário foi identificado como desosaminylazithromycin (descladinose azitromicina, impureza J – EP), resultado da quebra da ligação α-glicosídica da azitromicina, esta impureza é controlada no medicamento Azithromycin for Injection pela monografia da Farmacopeia Americana (USP).
A estabilidade da azitromicina em função do pH (6,0 – 7,2) foi também estudada por Saita e colaboradores (2018), que identificaram como produtos de degradação duas outras substâncias decorrentes da hidrólise da azitromicina, nomeadas como impurezas X e Y, além da descladinose azitromicina (impureza J). Conforme os autores, as impurezas X e Y são produtos da hidrólise do grupo éster (lactona) presente na estrutura da azitromicina. (Saita, et al., 2018)
Ao ser exposta a HCl 0,1 M e NaOH 0,1 M, em ambas as condições sob temperatura de 70ºC por seis horas, foi observada degradação total da azitromicina, comprovando sua alta susceptibilidade à hidrólise em pHs extremos. (Moreno, da Silva, & Salgado, 2009)
2.5 Oxidação / Íons metálicos
Pode ser difícil traduzir os resultados do teste de estresse oxidativo em previsões da suscetibilidade de um composto à oxidação, pois os mecanismos oxidativos podem ser bastante diversos e complexos e, degradação oxidativa muitas vezes não segue a cinética típica de Arrhenius. O uso de peróxido de hidrogênio diluído é indicado para testar a suscetibilidade à oxidação por peróxidos, isso é útil, uma vez que muitos excipientes possuem traços de peróxidos residuais. (Johnson, Gu, 1988)
A oxidação da cefadroxila já é esperada, DEY e seus colaboradores (2010) relatam degradação quase que completa quando submetido a H2O2 3% por apenas 15 minutos. A oxidação da cefadroxila por permanganato, proposta por Bhamare e Kulkarni (2019) resultou na formação de cinco produtos, a cinética de degradação da cefadroxila com permanganato e sua dependência dos meios em que ocorre, foram estudadas e concluído que a taxa de degradação diminui com o aumento da polaridade do meio e também, em relação ao pH, a taxa é mais alta em pHs baixos, além de ser diretamente proporcional ao aumento da temperatura.
Moléculas contendo aminas terciárias, como no caso da azitromicina, são susceptíveis a oxidação, com a formação de N-óxidos. Quando exposta a H2O2 0,3% a 70ºC por um período de 6 horas, a azitromicina se degradou em torno de aproximadamente 90%, sofrendo uma degradação muito expressiva nessa condição de exposição. (Moreno, da Silva, & Salgado, 2009)
3. MATERIAIS E MÉTODOS
Estudo de revisão da literatura com análise experimental que visa identificar as possíveis rotas de degradação, aplicando uma metodologia para quantificação do ativo de cefadroxila e azitromicina; seus principais produtos de degradação, estabelecer um paralelo entre o estudo experimental e teórico, detectando condições as quais o medicamento é particularmente sensível. Os agentes estressantes serão utilizados conforme preconizado no guia ICH Q3B e a RDC 53/2015 as quais as amostras serão aplicadas, já as concentrações e o tempo de exposição, chamado end point, serão baseados segundo descritos no livro do Bartschi et al.(2011)
4. TESTE DE DEGRADAÇÃO DA CEFADROXILA E AZITROMICINA
4.1 Equipamentos e reagentes – cefadroxila
Equipamentos necessários para o preparo das amostras de cefadroxila: Banho ultrassônico, balança analítica, cromatógrafo líquido de alta eficiência com detector UV/PDA, colunas cromatográficas (Lichrosorb RP-18 (250 x 4,0 mm x 5µm) F1986719 e Lichrosorb RP-18 (250 x 4,0 mm x 10µm) L55017620), estufa, câmara climática e micropipeta. Reagentes: acetonitrila, ácido clorídrico, ácido fosfórico, fosfato de potássio monobásico, hidróxido de potássio, hidróxido de sódio, peróxido de hidrogênio, sulfato de cobre pentahidratado e água ultrapurificada.
4.2 Equipamentos e reagentes – azitromicina
Equipamentos necessários para o preparo das amostras de azitromicina: Banho ultrassônico, balança analítica, cromatógrafo líquido de alta eficiência com detector UV/PDA, colunas cromatográficas (Gemini C18 250 x 4,6mm – 5μm (L1) H20-191426 e XBridge C18 (150 x 4,6mm; 3,5μm) 02053008413869),estufa, câmara climática, micropipeta. Reagentes: fosfato de potássio bibásico, água ultrapurificada, hidróxido de potássio, acetonitrila, hidróxido de amônio, metanol, fosfato de amônio monobásico.
Tabela 1. Preparo de soluções
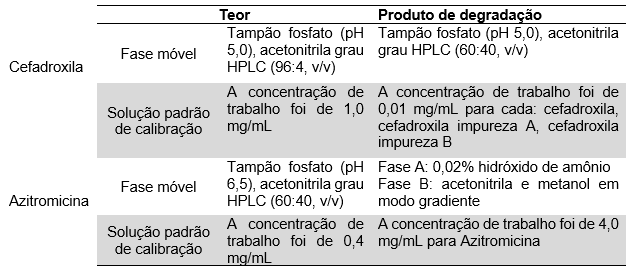
Tabela 2. Preparo de amostras

5. CONCLUSÃO
O estudo demonstra que o ativos azitromicina e cefadroxila se mantiveram estáveis em algumas das condições realizadas, nas quais foram submetidos, apresentando níveis de degradação pouco significativos nas condições de degradação fotolítica e oxidação de íons metálicos, na qual o insumo farmacêutico ativo e o produto terminado de ambos os ativos se mostraram pouco sensíveis e apresentaram níveis de degradação quase irrelevante (de até 4,4%), mesmo após o período máximo de exposição estipulado (end points) no preparo de amostra, conforme a tabela 2. O IFA e o PT apresentaram degradação considerável nas condições de hidrólises ácida e alcalina, temperatura, umidade e oxidação via peróxido de hidrogênio.
Na condição ácida, o IFA da azitromicina apresentou formação de 20,96% de impurezas e queda de 25,4% do teor, o produto terminado apresentou formação de 40,7% de impurezas e queda de teor de 44,3%. Já o IFA da cefadroxila apresentou formação de 18,4% de impurezas e queda de 21,6% do seu produto terminado apresentou formação de 27,6% de impurezas, queda de teor de 44,3%.
Na condição de hidrólise ácida, o produto majoritário de degradação encontrado no IFA e PT da azitromicina é a Impureza J (descladinose azitromicina, impureza J – EP; tabela 3). Tal condição é propícia para a formação deste produto de degradação pois o mesmo é formado a partir da hidrólise catalisada por ácido, figura 3. O IFA e PT da cefadroxila obtiveram formação de impurezas desconhecidas, vários estudos na literatura relatam a alta susceptibilidade da cefadroxila a sofrer todo tipo de hidrólise conforme (DEY, et al., 2010).
Figura 3. Principal degradante via hidrólise da azitromicina. (Zhang, et al., 2009)
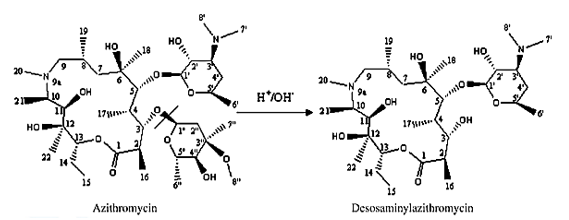
Figura 3. Principal degradante via hidrólise da azitromicina. (Zhang, et al., 2009)
Na condição de hidrólise alcalina, o IFA da azitromicina apresentou nível de degradação pouco significativo (de até 1,4%), o produto terminado apresentou formação de 25,2% de impurezas e queda de teor de 26,3%. Já o IFA da cefadroxila apresentou formação de 1,2% de impurezas e queda de 12,3% do teor, o produto terminado apresentou formação de 3,5% de impurezas e queda de teor de 23,2%.
Na condição de hidrólise alcalina, os produtos majoritários de degradação encontrados no IFA e PT da azitromicina são N-Óxido, Impureza F e Impureza J (3′-N-Demethyl-3′-N-formylazithromycin – Impureza F; descladinose azitromicina, impureza J – EP; tabela 3). O IFA e PT da cefadroxila obtiveram formação majoritária da impureza B (7-aminodesacetoxicefalosporânico, Composto relacionado B – impureza B) conforme figura 4, formada a partir da hidrólise da amida, com formação da amina primária correspondente.
Figura 4. Produtos de degradação formados via hidrólise (II, IV e V). (TSUJI, et al., 1981)
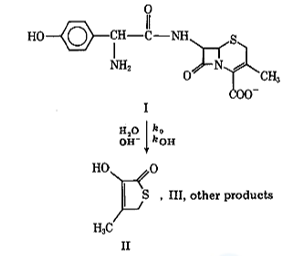
Figura 4. Produtos de degradação formados via hidrólise (II, IV e V). (TSUJI, et al., 1981)
Diante a exposição no estudo de perfil de degradação do PT e IFA isolado de ambos os ativos, houve necessidade de exposições reduzidas nas condições como alcalina, ácida, oxidativa via peróxido, temperatura e umidade. Nestas condições foram observadas degradações significativas (superiores a 10%). Este comportamento era esperado, uma vez que, os principais produtos de degradação da azitromicina e da cefadroxila são formados por hidrólise em meio ácido e alcalino, oxidativo via peróxido, temperatura e umidade.
Na condição de oxidação via peróxido de hidrogênio, o IFA da azitromicina apresentou formação de 66,8%, queda de teor de 62,8%, o produto terminado apresentou formação de 25,9% de impurezas, queda de teor de 21,1%. Já o IFA da cefadroxila apresentou formação de 19,2% de impurezas e queda de 8,9% do teor , o produto terminado apresentou formação de 40,6% de impurezas e queda de teor de 14,2%. De acordo com esta condição o produto majoritário de degradação encontrado no IFA e PT da azitromicina é o N-Óxido, pois sofre uma degradação muito expressiva segundo (Moreno, da Silva, & Salgado, 2009). O IFA e o PT da cefadroxila obtiveram formação majoritária de impurezas desconhecidas.
Na condição de temperatura, o IFA da azitromicina não apresentou degradação, o produto terminado apresentou formação de 1,0% de impurezas e queda de teor de 1,7%. Já o IFA da cefadroxila não apresentou degradação e seu produto terminado apresentou formação de 6,4% de impurezas com queda de teor de 25,6%. Nesta condição os produtos majoritários de degradação encontrados no IFA e PT da azitromicina são N-Óxido, Impureza F e Impureza J (3′-N-Demethyl-3′-N-formylazithromycin – Impureza F; descladinose azitromicina, impureza J – EP; tabela 3). O IFA e PT da cefadroxila obtiveram formação majoritária da impureza B (7-aminodesacetoxicefalosporânico, composto relacionado B – impureza B).
Na condição de umidade, o IFA da azitromicina não apresentou degradação, o produto terminado apresentou formação de 23,5% de impurezas e queda de teor de 24,5%. Já o IFA da cefadroxila não apresentou degradação, o produto terminado apresentou formação de 0,3% de impurezas e queda de teor de 5,2%. Nesta condição o produto majoritário de degradação encontrado no IFA e PT da azitromicina é a Impureza J (descladinose azitromicina, impureza J – EP; tabela 3). O IFA e PT da cefadroxila obtiveram formação majoritária da impureza B (7-aminodesacetoxicefalosporânico, composto relacionado B – impureza B; tabela 3).
Tabela 3. Impurezas majoritariamente formadas na degradação da azitromicina e cefadroxila.
Em vista dos resultados obtidos é possível estimar que a azitromicina se mostrou menos suscetível a maioria das condições de degradação quando comparada a cefadroxila, visto que os tempos e concentração dos agentes estressantes foram mais brandos para a cefadroxila. Outro ponto observado foi que a azitromicina apresentou mais impurezas conhecidas formadas maioritariamente do que a cefadroxila, durante o estudo de degradação forçada.
REFERÊNCIAS
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. GUIA N° 4: Guia para obtenção do perfil de degradação, e identificação e qualificação de produtos de degradação em medicamentos. Versão 1 Brasília: Anvisa, 2015.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. RESOLUÇÃO DA DIRETORIA COLEGIADA – RDC Nº 53, DE 4 DE DEZEMBRO DE 2015: Estabelece parâmetros para a notificação, identificação e qualificação de produtos de degradação em medicamentos com substâncias ativas sintéticas e semissintéticas, classificados como novos, genéricos e similares, e dá outras providências. Brasília: Anvisa, 2015.
BAERTSCHI, S. W.; ALSANTE, K. M.; REED, R. Pharmaceutical stress testing – Predicting drug degradation. Taylor & Francis Inc. 2º Ed Vol. 210, 2011.
BHAMARE, V. S., & KULKARNI, R. M. (2019). Uncatalysed oxidative degradation of cefadroxil by heptavalent manganese during water treatment: reaction kinetics and pathways. AIP Conference Proceedings, 2142, pp. 210004.1-5. doi:10.1063/1.5122651
Boccardi G. Autoxidation of drugs: prediction of degradation impurities from results of reaction with radical chain initiators. Il Farmaco 1994; 49(16): 431–435.Cizmic, M., Ljubas, D., Rožman, M., Ašperger, D., Curkovic, L., & Babic, S. (2019).
Photocatalytic Degradation of Azithromycin by Nanostructured TiO2 Film: kinetics, degradation products, and toxicity. Materials, 12(813), 1-16. doi:10.3390/ma12060873
DEY, S., KALYANI, K., SAMYUKTHA, B., SAHOO, S. K., MOHAPATRA, S., MURTHY, P. N., & KUMAR, D. (2010). Development and validation of a uvvis spectrophotometric method for the estimation and degradation monitoring of cefadroxil in bulk and pharmaceutical dosage forms. International Journal of Chemistry Research, 1(1), p. 6p.
HELALEH, M. I., & ABU-NAMEH, E. S. (1998). A Kinetic Approach for Determination of Cefadroxil in Pharmaceuticals by Alkaline Hydrolysis. Journal of AOAC International, 81(3), pp. 528-533.
HICKEY, M. B., PETERSON, M. L., MANAS, E. S., ALVAREZ, J., HAEFFNER, F., & ALMARSSON, Ö. (2007). Hydrates and solid-state reactivity: a survey of b-lactam antibiotics. TransForm Pharmaceuticals, 96(5), pp. 1090-1099. doi:10.1002/jps.20919
Johnson DM, Gu LC. Autoxidation and antioxidants. In: Swarbrick J, Boylan JC, eds. Encyclopedia of Pharmaceutical Technology. Vol. 1. New York: Marcel Dekker, 1988:425–429.
Li, M. (2012). Organic chemistry of drug degradation (Vol. 29). Croydon, United Kingdom: CPI Group.
Moreno, A. H., da Silva, M. F., & Salgado, H. R. (2009). Stability study of azithromycin in ophthalmic preparations. Brazilian Journal of Pharmaceutical Sciences, 45(2), 219-226.
Reed RA, Harmon P, Manas D, Wasylaschuk W, Galli C, Biddell R, Bergquist PA, Hunke W, Templeton AC, Ip D. The role of excipients and package components in the photostability of liquid formulations. J Pharm Sci Technol 2003; 57(5):351–368.
ROURICK, R. A., VOLK, K. J., KLOHR, S. E., SPEARS, T., KERNS, E. H., & LEE, M. S. (1996). Predictive strategy for the rapid structure elucidation of drug degradants. Journal of Pharmaceutical and Biomedical Analysis, 14, pp. 1743-1752.
Saita, M. G., Aleo, D., Melilli, B., Mangiafico, S., Cro, M., Sanfilippo, C., & Patti, A. (2018).
pH-Dependent stability of azithromycin in aqueous solution and structure identification of two new degradation products. Journal of Pharmaceutical and Biomedical Analysis, 158,47-53. doi:10.1016/j.jpba.2018.05.042
Solomons, T. W., & Fryhle, C. B. (2001). Química Orgânica (7 ed.). Rio de Janeiro:LTC.
Stewart PJ, Tucker IG. Prediction of drug stability. Part 2. Hydrolysis. Aust J Hosp Pharm 1985; 15(1):11–16.
Tong, L., Eichhorn, P., Pérez, S., Wang, Y., & Barceló, D. (2011). Photodegradation of azithromycin in various aqueous systems under simulated and natural solar radiation:
Kinetics and identification of photoproducts. Chemosphere, 83, 340–348.doi:10.1016/j.chemosphere.2010.12.025
TSUJI, A., NAKASHIMA, E., DEGUCHI, Y., NISHIDE, K., SHIMIZU, T., HORIUCHI, S., YAMANA, T. (1981). Degradation Kinetics and Mechanism of Aminocephalosporins in Aqueous Solution: Cefadroxil. Journal of pharmaceutical Sciences, 70(10), pp. 1120-1128. doi:10.1002/jps.2600701008
Waterman KC, Adami RC, Antipas AS, Arenson DR, Carrier R, Hong J, Landis MS, Lombardo F, Shah JC, Shalaev E, Smith SW, Wang H. Hydrolysis in pharmaceutical formulations. Pharm Dev Tech 2002; 7(2):113–146.
Zhang, Y., Liu, X., Cui, Y., Huang, H., Chi, N., & Tang, X. (2009). Aspects of Degradation Kinetics of Azithromycin in Aqueous Solution. Chromatographia(70), 67–73. doi:10.1365/s10337-009-1116-x <https://pubchem.ncbi.nlm.nih.gov/compound/47965> Acesso em 25 de abril de 2023
