EVALUATION OF POSTURAL BALANCE CONTROL IN WOMEN SURVIVING BREAST CANCER: COMPARISON WITH SEROMA AND GHOST BREAST DEVELOPED AFTER THE DISEASE TREATMENT
REGISTRO DOI:10.5281/zenodo.12803273
Régis Inocêncio Valerio da Luz1;
Erika Carvalho Rodrigues2.
Resumo: Os tratamentos para câncer de mama, ainda benéficos, podem gerar complicações, como instalação de Seromas, Mama Fantasma e alterações no controle postural. Entretanto, não sabemos a influência dessas complicações sobre o controle postural. O objetivo foi investigar a influência da presença de seroma e mama fantasma no controle postural de pacientes pós-mastectomia e tratamento adjuvantes. Estudo transversal com mulheres em pós-operatório mínimo de um ano, que compareceram ao ambulatório de fisioterapia de um Hospital de Referência para tratamento do câncer. Coletadas variáveis sócio-demográficas, patológicas, clínicas e registro sobre presença de seroma e mama fantasma. Realizaram teste posturográfico, se posicionando sobre uma plataforma de força com pés afastados, olhos abertos e fechados. Computados desvio padrão e velocidade média do deslocamento postural para anterior-posterior e médiolateral. ANOVA de duas vias aplicada, assumindo alfa de 5%. 35 pacientes participaram. As pacientes foram alocadas de acordo com a presença de seroma (N=18) ou não (N=17); e as mesmas foram divididas com (N=20) ou sem (N=15) mama fantasma. Observamos diferenças estatísticas entre os grupos seroma positivo versus negativo para velocidade média na direção anterior-posterior (P=0,031), indicando menor velocidade de deslocamento postural no grupo seroma. Houve diferenças significativas entre condições visuais, para todas as variáveis e grupos, refletindo a redução no deslocamento postural para olhos fechados. A presença de seroma, está associada à alteração do controle postural em pacientes submetidas à tratamento para câncer de mama. A resposta das pacientes à condição de olhos fechados pode indicar uma alteração na integração sensorial subjacente ao controle postural nessa população.
Palavras-chave: Câncer de Mama; Quimioterapia; Equilíbrio Postural; Mastectomia.
Abstract: The treatments for breast cancer, which are still beneficial, can generate complications, such as the installation of Seromas, Phantom Breast and alterations in postural control. However, we do not know the influence of these complications on postural control. The objective was to investigate the influence of the presence of seroma and phantom breast on the postural control of post-mastectomy patients and adjuvant treatment. Cross-sectional study with women in the postoperative period of at least one year, who attended the physiotherapy clinic of a Reference Hospital for the treatment of cancer. Socio-demographic, pathological, clinical variables were collected, as well as records on the presence of seroma and phantom breast. They performed a posturographic test, positioning themselves on a force platform with feet apart, eyes open and closed. Standard deviation and mean velocity of postural displacement for anterior-posterior and mediolateral were computed. Two-way ANOVA applied, assuming 5% alpha. 35 patients participated. Patients were allocated according to the presence of seroma (N=18) or not (N=17); and they were divided with (N=20) or without (N=15) phantom breast. We observed statistical differences between seroma positive versus negative groups for mean velocity in the anterior-posterior direction (P=0.031), indicating lower postural displacement velocity in the seroma group. There were significant differences between visual conditions, for all variables and groups, reflecting the reduction in postural displacement for eyes closed. The presence of seroma is associated with changes in postural control in patients undergoing treatment for breast cancer. The response of patients to the condition with eyes closed may indicate a change in sensory integration underlying postural control in this population.
Keywords: Breast Cancer; Chemotherapy; Postural Balance; Mastectomy.
INTRODUÇÃO
O câncer de mama é aquele que mais frequentemente acomete pessoas do sexo feminino (Bray et al., 2018). De acordo com dados do Instituto Nacional de Câncer (INCA), para cada ano do triênio 2020-2022, no Brasil, a estimativa é de cerca de 66.280 novos casos de câncer de mama ao ano, ou 61,61 novos casos para cada 100 mil mulheres (INCA, 2019). O tratamento do câncer de mama depende do quadro clínico e histológico da doença, sendo ele realizado por via cirúrgica como a mastectomia, mastectomia com reconstrução mamária imediata, quadrantectomia e tumorectomia, acompanhadas ou não do tratamento adjuvante de quimioterapia, radioterapia e hormonioterapia (Barbosa et al., 2013). Além da própria doença, que acarreta uma série de comprometimentos físicomotores, sensoriais, entre outros, os tratamentos adjuvantes podem trazer, junto com a melhora do quadro clínico, complicações de ordem cognitivo e físico-motora (Bijker et al., 2018).
Subsequente ao tratamento cirúrgico para remoção do tumor, são frequentes, por exemplo, o aparecimento de condições clínicas tais como a sensação de mama fantasma (sensação do tecido ou seio que não está mais presente; Rothemund et al., 2004), e surgimento de seromas (quadros de inflamação e acúmulo de líquido do local da cirurgia e em regiões adjacentes; Pan et al., 2015). O quadro de sensação fantasma pósmastectomia geralmente cursa com alterações álgicas, sendo ainda pouco compreendido. Estudos relatam uma prevalência que varia entre 15-51%, dependendo das características da população (Rothemund et al., 2004; Hamood et al., 2018). No estudo de Rothemund e colaboradores, por exemplo, metade das participantes mastectomizadas apresentaram sensação fantasma, com 15% de relatos de dor fantasma. O seroma, por sua vez, ocorre em decorrência da remoção do tecido mamário, quando também se instalam quadros de redução da mobilidade dos tecidos moles, perda de massa muscular, neuropatias, entre outros (Zabit & Iyigun, 2019). O seroma pode se instalar em aproximadamente 23% das pacientes submetidas à cirurgia, dependendo parcialmente do tempo de cirurgia e dos procedimentos de anestesia (Pan et al., 2015).
Do ponto de vista funcional, é comum o relato de prejuízos no controle postural em pessoas submetidas à cirurgia para remoção de tumor mamário. Por exemplo, através da posturografia por plataforma de força, foram observadas uma maior área de deslocamento postural em participantes pós-mastectomia ou submetidas a outra forma e tratamento (Mangone et al., 2019; Glowacka-Mrotek et al., 2020) quando comparadas com um grupo controle. As alterações posturais se refletem também na distribuição de peso corporal entre os membros inferiores, com pacientes submetidas à mastectomia distribuindo uma maior carga no membro contralateral ao segmento afetado (Glowacka-Mrotek, et al., 2017). Alterações também são obtidas durante a avaliação da estabilidade postural em apoio unipodal, na qual participantes submetidas à quimioterapia apresentam deslocamentos mais amplos que o grupo controle (Sarah et al., 2016).
Contudo, esses estudos não investigaram especificamente como determinadas complicações que se seguem comumente ao tratamento cirúrgico do câncer de mama afetam o controle postural de pessoas no pós-tratamento do câncer de mama. Face ao exposto, o objetivo do estudo foi comparar o controle postural na posição ortostática em uma amostra de participantes com câncer de mama tratados com cirurgia de remoção de tumor, sendo de acordo com suas características clínicas divididas em um grupo com ou sem presença de seroma (S+ ou S-, respectivamente) ou com ou sem sensação fantasma da mama (MF+ e MF-, respectivamente).
MÉTODOS
Participantes e questões éticas
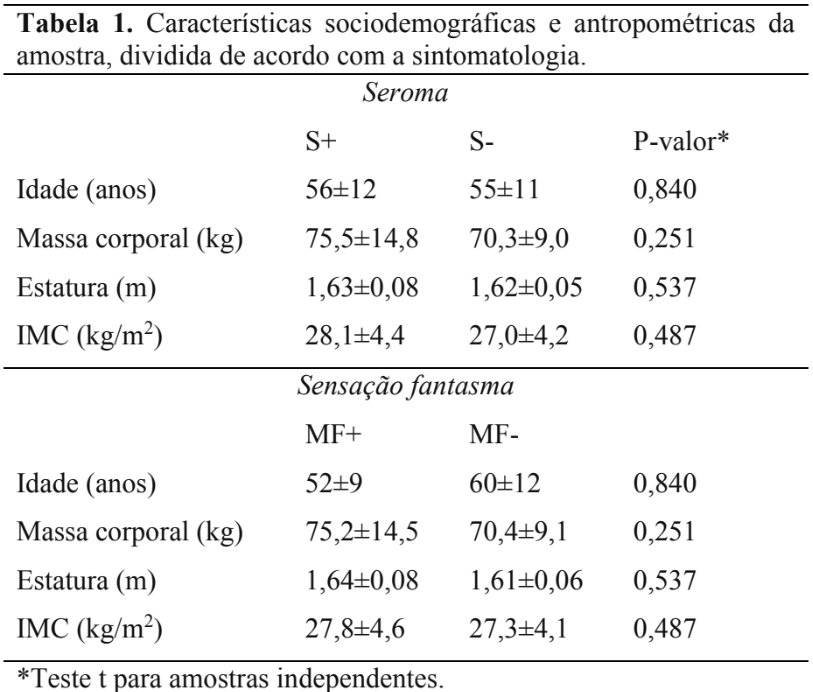
Nesse estudo transversal observacional, participantes foram avaliadas quanto à sintomatologia posterior à cirurgia e tratamento de câncer de mama, e ao controle do equilíbrio postural, através de avaliação posturográfica (descrito abaixo). As participantes eram todas provenientes de um serviço público de referência de atendimento oncológico, constituindo uma amostra por conveniência. Os critérios de inclusão para participação no estudo foram ter idade acima de 18 anos, terem sido submetidas ao tratamento cirúrgico e apresentarem seguimento mínimo de 1 ano pós-operatório. Aquelas em curso de tratamento adjuvante com quimioterapia ou radioterapia, com câncer de mama bilateral, evolução de doença local ou à distância, déficit cognitivo aferido durante a entrevista, relato de alteração funcional em membro superior prévia ao diagnóstico de câncer de mama, consumo regular de álcool e/ou medicamento psicoativo e relato de doença neurológica prévia ao câncer de mama não foram incluídas no estudo. As características da amostra são apresentadas na Tabela 1. As participantes assinaram um termo de consentimento livre e esclarecido, após explicação dos procedimentos a serem realizados. Todos os procedimentos foram aprovados pelo comitê de ética local, sob processo número 84/11.
Um total de 35 voluntárias participaram do estudo. Suas características demográficas e antropométricas eram (média ±DP ou frequência absoluta): 56±11 anos de idade; 73,1±12,5 kg de massa corporal; 1,63±0,07 metros de estatura; IMC de 27,6±4,3 kg/m2. O perfil clínico do grupo foi o seguinte: o tempo de revisão após cirurgia foi de 1,9±0,7 anos; 6 participantes apresentaram estadiamento 1, 13 apresentaram estadiamento 2, enquanto 14 apresentaram estadiamento 3; o lado direito foi o afetado para 13 participantes, e o esquerdo para 21 participantes, sendo a maioria delas destras (N=30); a maior parte das voluntárias realizaram cirurgia do tipo Madden (N=23), seguido do tipo simples (N=5) e conservadora (N=3), não havendo tal informação para 3 participantes; do total de voluntárias, apenas 1 foi submetida à cirurgia de reconstrução, não havendo informações sobre 1 voluntária. 34 voluntárias foram submetidas à tratamento adjuvante, havendo informação disponível de apenas 32 delas: o tratamento mais frequente foi a radioterapia (N=18), seguida de quimioterapia isolada ou em combinação com outra terapia (N=12), sendo 2 voluntárias submetidas apenas ao tratamento com inibidores da histona metiltransferase.
As voluntárias foram alocadas nos seguintes grupos, de acordo com a sintomatologia obtida através de prontuário médico: aquelas que apresentaram seroma (S+, N=18) ou não (S-, N=17) após a cirurgia; ou aqueles que reportaram sensação de membro fantasma (MF+, N=20) ou não (MF-, N=15). As características demográficas e antropométricas dos grupos são apresentadas na Tabela 1.
Procedimentos
As participantes foram instruídas a permanecer de pé, descalças, sobre uma plataforma de força. Os pés deveriam estar posicionados de forma confortável, afastados na distância aproximada dos quadris, os membros superiores deveriam ser posicionados ao longo do corpo, não devendo as participantes mover os braços, cabeça ou pés durante o teste posturográfico. As participantes deveriam permanecer com os olhos abertos (OA), fixos em um ponto na parede à frente, ou com os olhos fechados (OF). As condições visuais foram realizadas de modo aleatório. A duração do teste foi de 60 segundos, para cada condição visual.
Posturografia – aquisição e análise.
As coordenadas do centro de pressão dos pés (CP) foram adquiridas através de uma plataforma de força (AccuSwayPLUS, AMTI, EUA). O sinal foi adquirido a uma taxa de 50Hz, sendo registrado para posterior análise.
Para análise do sinal posturográfico, os primeiros 10s foram descartados e os 50s subsequentes foram utilizados. Após remoção da média e uso de filtro passa-baixa (Butterworth de 2ª ordem, direto e reverso, ponto de corte em 5Hz), foram computados o desvio-padrão (DP), medida de amplitude e variabilidade do deslocamento do CP, e a velocidade média (VM; Prieto et al., 1996). Ambas as medidas foram calculadas para o deslocamento nas direções medial-lateral (ML) e anterior-posterior (AP).
Análise estatística
Foi aplicada uma ANOVA de modelo misto (grupo vs. condições visual), separadamente para cada grupo (seroma ou membro fantasma). A ANOVA foi seguida do pós-teste de Tukey, quando necessário. O tamanho do efeito foi computado através do quadrado do eta (η2). O limiar estatístico assumido foi de 5%. As análises foram realizadas no programa JASP versão 0.13.1 (The JASP Team 2020, Holanda).
RESULTADOS
Efeito da presença ou ausência de seroma
Houve efeito principal de condição visual para as seguintes variáveis: VMML (P<0.001, η2=0,259); VMAP (P<0.001, η2=0,023) e DPML (P<0.001, η2=0,269). Não houve efeito principal de condição visual para a variável DPAP (P=0,125, η2=0,019). Na Figura 1 é possível observar que a condição olhos fechados (OF; barras cinzas) provoca uma significativa redução nos descritores do deslocamento postural.
Um efeito principal de grupo foi observado para VMAP (P=0,031, η2=0,123), mas não para os outros descritores (todos os P-valores >0,225). A presença de seroma (S+) nas voluntárias promoveram uma redução na velocidade de deslocamento postural na direção anterior-posterior (Fig. 1B). Não houve interação entre grupos e condição visual para nenhuma variável (todos os P-valores >0,138).
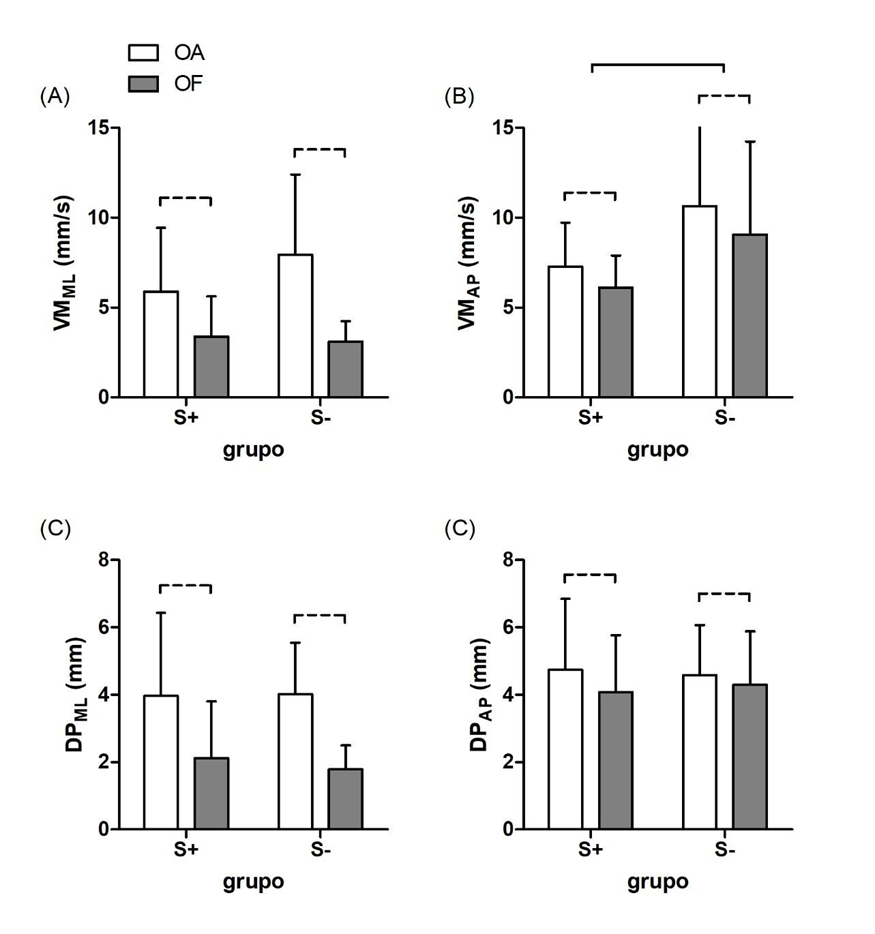
Figura 1. Resultado de grupo (média ±DP) para aquelas com (S+) ou sem seroma (S-) pós-mastectomia, nas condições olhos abertos (OA, barras brancas) e olhos fechados (OF, barras cinzas). (A) e (B), velocidade média nas direções ML e AP, respectivamente. (C) e (D), desvio-padrão nas direções ML e AP, respectivamente. Linhas horizontais pontilhadas correspondem ao efeito principal de condição visual. Linha horizontal contínua em (B) corresponde ao efeito principal de grupo.
Efeito da sensação de membro fantasma
Um efeito significativo de condição visual foi identificado nas seguintes variáveis: VMML (P<0,001, η2=0,250); VMAP (P<0,001, η2=0,024); DPML (P<0,001, η2=0,264) mas não para DPAP (P=0,107, η2=0,022). A condição olhos fechados (OF; barras cinzas na Figura 2) provoca uma significativa redução nos descritores do deslocamento postural nos participantes. Não houve efeito principal de grupo (todos os P-valores >0,580) ou interação entre grupo e condição visual (todos os P-valores >0,420) para nenhuma das variáveis (Fig. 2).
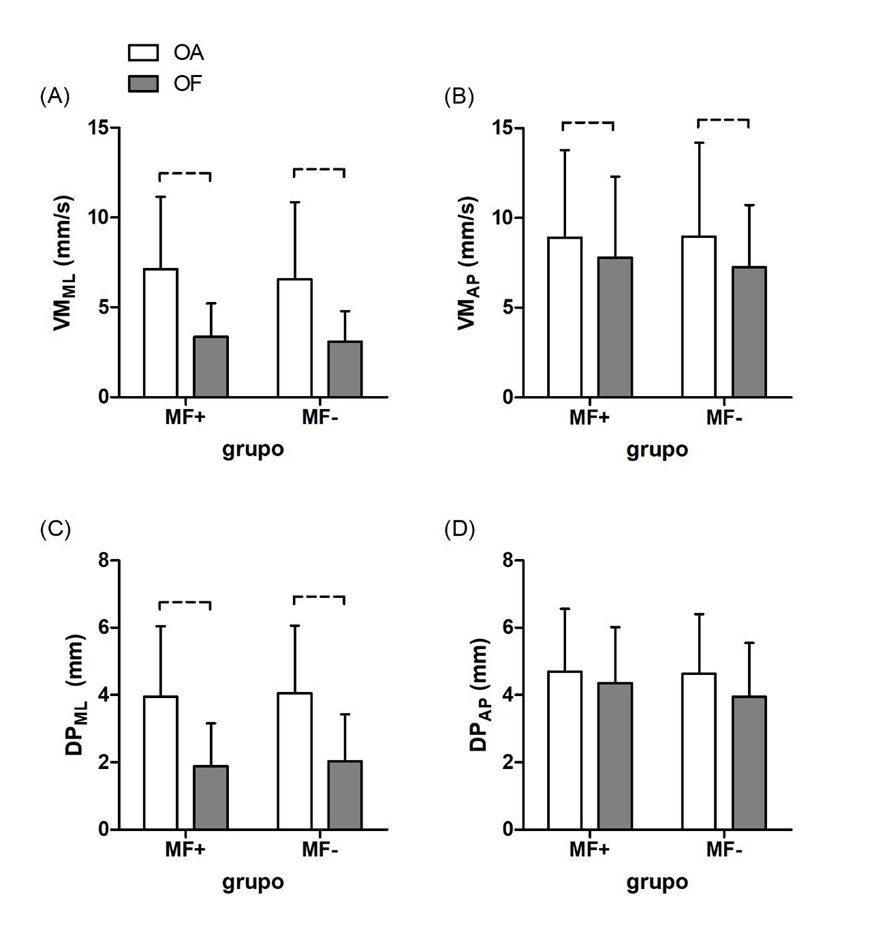
Figura 2. Resultado de grupo (média ±DP) para aquelas com (MF+) ou sem (MF-) sensação de membro fantasma pós-mastectomia, nas condições olhos abertos (OA, barras brancas) e olhos fechados (OF, barras cinzas). (A) e (B), velocidade média nas direções ML e AP, respectivamente. (C) e (D), desvio-padrão nas direções ML e AP, respectivamente. Linhas horizontais pontilhadas correspondem ao efeito principal de condição visual.
DISCUSSÃO
No presente estudo, investigamos o controle postural em uma amostra de participantes com sintomatologias particulares pós-cirurgia e tratamento do câncer de mama. Particularmente, investigamos os efeitos da presença de seroma e de sensação de mama fantasma nos deslocamentos posturais como olhos abertos ou fechados. Como resultado principal, observamos um efeito específico da presença de seroma na velocidade de deslocamento na direção anterior-posterior, fazendo com que esta variável apresentasse menores valores nas participantes seroma-positivo. Outro achado interessante é que, independentemente da sintomatologia atribuída, as participantes apresentaram redução significativa na amplitude e velocidade de deslocamento quando de olhos fechados, indicando uma mudança importante na contribuição dos sistemas sensoriais no controle postural dessa população.
As participantes que apresentaram seroma apresentaram velocidade média de deslocamento postural na direção anterior-posterior menor que as do grupo seromanegativo, independente da condição visual (Fig. 1B). Um tamanho de efeito forte (η2=0,123; Lakens, 2013) reforça nossa interpretação de tal diferença em função do sintoma apresentado. Entre as explicações possíveis, podemos destacar as mudanças na orientação postural que geralmente acometem essa população, se manifestando principalmente no plano sagital. Por exemplo, a anteriorização da cabeça, junto com a inclinação pélvica, é uma das características posturais adaptativas comuns dessa população (Beleza et al., 2016; Mangone et al., 2019), tais adaptações observadas nessas pacientes, isso infere na menor velocidade de deslocamento apresentados nos resultados quando na presença de Seroma. Além disso, o alinhamento do ombro e a curvatura torácica também é alterado naquelas com câncer de mama submetidas à cirurgia, quando comparado com um grupo de controle, e mesmo entre aquelas participantes submetidas à tratamento conservador, não-cirúrgico (Barbosa et al., 2013; Glowacka et al., 2016; Glowacka et al., 2017). Alterações na distribuição da massa corporal decorrente da perda muscular, assim como o padrão de torque articular nessa região, refletindo as propriedades inerciais da cintura escapular, podem ambos ter influência significativa no controle postural; tais fatores são considerados, por exemplo, para interpretação das alterações posturais em pessoas com lesão de plexo braquial (Souza et al., 2016). Embora as posições e movimentos articulares ao longo do eixo corporal compensem uns aos outros (Hsu et al.,2007), podemos sugerir que, nessa população, tais compensações não são suficientes para minimizar as alterações posturais.
Investigações anteriores observaram os efeitos gerais da intervenção em pacientes com câncer de mama no controle postural. Já foi observado que a velocidade média na direção AP, mas não ML, e a área de deslocamento postural é maior em participantes pósmastectomia quando comparadas com um grupo de controle, sendo as diferenças significativa para a condição olhos abertos (Glowacka-Mrotek et al., 2020). Uma maior área de deslocamento postural comparada à um grupo controle também é observada naquelas com câncer de mama submetidas a outros tratamentos (Mangone et al., 2019). Nesse contexto, o presente estudo contribui para especificação dos processos fisiopatológicos adjacentes às mudanças no controle postural, identificando que não somente a intervenção no câncer de mama é relevante para adaptações do controle postural, mas também que as consequências clínicas e funcionais (no caso, a presença de seroma) participam desse processo.
Além disso, sabemos que o tratamento quimioterápico promove outras mudanças funcionais importantes: a força máxima isométrica de quadríceps, por exemplo, assim como a velocidade da marcha estão reduzidos nessa população (Niederer et al., 2014). Além disso, as pacientes submetidas à quimioterapia apresentam maior medo de queda e maior deslocamento postural comparados com controles pareados em idade (Niederer et al., 2014) – nesse estudo, em termos de medidas de estabilidade postural e queda, tais pacientes, com média de idade de 51 anos, se equiparam ao grupo de idosos com idade média de 70 anos. Complicações relativas à quimioterapia também afetam o controle postural: pacientes com neuropatia relacionada à quimioterapia apresentam deslocamento postural na base unipodal maior que indivíduos saudáveis, o que pode ser resultado das mudanças observadas na excitabilidade espinhal e nos níveis de co-contração dos músculos dorsiflexores e flexores plantar do tornozelo (Sarah et al., 2016). Além disso, modificações na distribuição de peso corporal entre os membros inferiores, com sobrecarga do lado contralateral ao lado mastectomizado (Glowacka-Mrotek, et al., 2017), podem causar modificações adaptativas deletérias no controle postural. Dessa forma, aspectos neuromusculares e psicológicos podem se somar à presença de seroma pós-intervenção nessas pacientes, agravando o quadro clínico e modificando, direta ou indiretamente, o controle postural dessa população.
Um resultado interessante observado foi a resposta postural das participantes à condição de olhos fechados, na qual supõem-se que o sistema nervoso altera a forma de integração sensório-motora, “recalibrando” os sistemas sensoriais para a nova condição ambiente (Assländer & Peterka, 2014). Sistematicamente, os resultados de grupos mostraram redução significativa da amplitude e velocidade de deslocamento postural na condição olhos fechados, comparado com a condição olhos abertos (ver Figura 1 e 2). Esse resultado se deu independente da condição sintomatológica da participante. Apesar da grande variabilidade na resposta à condição visual (ex., Lacour et al.,1997), usualmente se espera um certo equilíbrio postural quando com olhos abertos devido ao sentido visual.
Considerando os dados agrupados da amostra, sem divisão em função da condição clínica, observamos que a maioria das participantes apresenta uma razão olhos fechados dividido por olhos abertos menor que o valor 1, correspondente à redução das variáveis de deslocamento postural quando de olhos fechados. De fato, a proporção de participantes com razão <1 foi de 85% (percentual do total) para DPML, 66% para DPAP, 74% para VMML e 80% para VMAP, caracterizando nossa população como majoritariamente “nãovisual”, ou que não modifica de modo significativo o controle postural em visão da alteração da condição visual (Lacour et al.,1997; Chiari et al., 2000). As estimativas disponíveis para jovens saudáveis apresentam uma proporção de 54% de visuais contra 46% de não-visuais (Lacour et al.,1997). As razões para essa desproporção na classificação de não-visuais na população de participantes submetidas a cirurgia de câncer de mama podem estar relacionadas às possíveis alterações sensoriais periféricas e centrais. Da perda da sensibilidade local (Andersen et al., 2017; Bijkerk et al., 2019) a instalação de neuropatias (ex., Siqueira et al., 2021) e ocorrência de dor (Andersen et al., 2017; Villa et al., 2021), o tratamento para câncer de mama cursa com diversas alterações sensoriais que potencialmente afetam o processo de integração sensório-motora em diferentes níveis do SN. Sendo sensíveis à modificações no estado geral do organismo (Woollacott & Shumway-Cook, 1990), um processo de recalibração sensorial “maladaptativa” nessa população pode ser uma das causas subjacentes das alterações observadas controle postural.
Limitações do estudo
Dentre as limitações do estudo, podemos citar o tamanho amostral. Possivelmente, um número maior de participantes produziria resultados estatísticos mais consistentes. De qualquer modo, diferenças significativas foram observadas, com tamanhos de efeitos moderados. Outra limitação, foi que, entre as participantes, algumas apresentavam mama fantasma e seroma, o que nos limitou na eficácia da homogeneidade da amostra durante a distribuição dos grupos. Além disso, não foi possível a realização de testes de função do membro superior acometido, tornando as referências entre prejuízo motor na cintura escapular e suas possíveis repercussões no controle postural matéria de especulação. Entretanto, outros estudos, em que diferentes condições funcionais do membro superior se mostraram relacionados ao controle postural (ex., Coleman & Clifft, 2010; Souza et al., 2016), corroboram nossa discussão. Ainda assim, outros estudos acrescidos de testes funcionais e um maior tamanho amostral podem lançar luz sobre questões não resolvidas no presente trabalho.
Conclusão
As adaptações posturais observadas em participantes submetidas ao tratamento cirúrgico para câncer de mama dependem, parcialmente, da sintomatologia que a acompanha, sendo observadas mudanças na estratégia de controle postural na direção anterior-posterior naquelas que apresentam seroma, e alteração generalizada na participação dos sistemas sensoriais, evidente pelos resultados posturográficos obtidos com os olhos fechados, independente dos sintomas associados ao período pós-cirúrgico. Os achados podem contribuir para um melhoramento no âmbito de tratamento para essas pacientes, desenvolvendo novas estratégias na reabilitação. Se tais alterações citadas refletem a funcionalidade dessas participantes, e se a remição desses sintomas é capaz de restabelecer os padrões pré-cirúrgicos de deslocamento postural, são ambas questões a serem abordadas em trabalhos futuros.
Referências
ANDERSEN, K.G., DURIAUD, H.M., KEHLET, H., AASVANG, E.K. The relationship between sensory loss and persistent pain 1 year after breast cancer surgery. J. Pain. 2017; 18:1129-1138.
ASSLÄNDER, L., PETERKA, R.J. Sensory reweighting dynamics in human postural control. J. Neurophysiol. 2014; 111:1852-1864.
BARBOSA, J.A.N., AMORIN, M.H.C., ZANDONADE, E., DELAPRANE, M.L. Avaliação da postura corporal em mulheres com câncer de mama. Rev. Bras. Ginecol. Obstet. 2013; 35:215-220.
BELEZA, A.C.S., PINTO, L.O., LOUREIRO, A.F., DE SÁ, C.S.C. Alterações posturais em mulheres submetidas à cirurgia para retirada do câncer de mama. ABCS Health Sci. 2016; 41:15-19.
BIJKER, R., DUIJTS, S.F.A., SMITH, S.N., WILDT-LIESVELD, R., ANEMA, J.R., REGEER, B.J. Functional impairments and work-related outcomes in breast cancer survivors: a systematic review. J. Occup. Rehab. 2018; 28:429-451.
BIJKERK, E., VAN KUJIK, S.M.J., BEUGELS, J., CORNELISSEN, A.J.M., HEUTS, E.M., VAN DER HULST, R.R.W.J., TUINDER, S.M.H. Breast sensibility after mastectomy and implant-based breast reconstruction. Breast Cancer Res. Treat. 2019; 175:369-378.
BRAY, F., FERLAY, J., SOERJOMATARAM, I., SIEGEL, R.L., TORRE, L.A., JEMAL, A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018; 68:394-424.
CHIARI, L., BERTANI, A., CAPPELLO, A. Classification of visual strategies in human postural control by stochastic parameters. Hum. Mov. Sci. 2000; 19:817-842.
COLEMAN, A., CLIFFT, J. The effect of shoulder immobilization on balance in community-dwelling older adults. J. Geriatr. Phys. Ther. 2010; 33:118-121.
GLOWACKA, I., NOWIKIEWICZ, T., HAGNER, W., NOWACKA, K., SOWA, M., ZEGARSKI, W. Sagittal plane postural changes in female patients with breast cancer after different surgical techniques. Breast J. 2017; 23:109-111.
GLOWACKA, I., NOWIKIEWICZ, T., SIEDLECKI, Z., HAGNER, W., NOWACKA, K., ZEGARSKI, W. The assessment of the magnitude of frontal plane postural changes in breast cancer patients after breast-conserving therapy or mastectomy: follow-up results 1 year after the surgical procedure. Pathol. Oncol. Res. 2016; 22:203-208.
GLOWACKA-MROTEK, I., SOWA, M., SIEDLECKI, Z., NOWIKIEWICZ, T., HAGNER, W., ZEGARSKI, W. Evaluation of changes to foot shape in females 5 years after mastectomy: a case–control study. Breast Cancer Res. Treat. 2017; 163:287294.
GLOWACKA-MROTEK, I., TARKOWSKA, M., NOWIKIEWICZ, T., HAGNER- DERENGOWSKA, M., GOCH, A. Assessment of postural balance in women treated for breast cancer. Medicina. 2020; 56:505. doi:10.3390/medicina56100505.
HAMOOD, R., HAMOOD, H., MERHASIN, I., KEINAN-BOKER, L. Chronic pain and other symptoms among breast cancer survivors: prevalence, predictors, and effects on quality of life. Breast Cancer Res. Treat. 2018; 167:157-169.
HSU, W-L., SCHOLZ, J.P., SCHÖNER, G. JEKA, J.J., KIEMEL, T. Control and estimation of posture during quiet stance depends on multijoint coordination. J. Neurophysiol. 2007; 9:3014-3035.
Instituto Nacional de Câncer José Alancar Gomes da Silva – INCA. Estimativa 2020: incidência de câncer no Brasil. Rio de Janeiro, INCA. 2019. p. 34.
LACOUR, M., BARTHELEMY, J., BOREL, L., MAGNAN, J., XERRI, C., CHAYS, A., OUAKNINE, M. Sensory strategies in human postural control before and after unilateral vestibular neurotomy. Exp. Brain Res. 1997; 115:300-310.
LAKENS, D. Calculating and reporting effects sizes to facilitate cumulative science: a practical primer for t-test and ANOVAs. Front. Psychol. 2013; 4:863. doi:10.3389/fpsyg.2013.00863.
MANGONE, M., BERNETTI, A., AGOSTINI, F., PAOLINI, M., DE CICCO, F.A., CAPOBIANCO, S.V., BAI, A.V., BONIFACINO, A., SANTILLI, V., PAOLUCCI, T. Changes in spine alignment and postural balance after breast cancer surgery: a rehabilitative point of view. Biores. Open Access. 2019; 8:121-128.
NIEDERER, D., SCHMIDT, K., VOGT, L., EGEN, J. KLINGLER, J., HUBSCHER, M., THIEL, C., BERNHORSTER, M., BANZER, W. Functional capacity and fear of falling in cancer patients undergoing chemotherapy. Gait & Posture. 2014; 39:865869.
PAN, X-F., HUAN, J-L., QIN, X-J. Potential risk factor for the development of seroma following mastectomy with axillary dissection. Mol. Clin. Oncol. 2015; 3:222-226.
PRIETO, T.E., MYKLEBUST, J.B., HOFFMANN, R.G., LOVETT, E.G., MYKLEBUST, B.M. Measures of postural steadiness: differences between healthy young and elderly adults. IEEE Trans. Biomed. Eng. 1996; 43:956-966.
ROTHEMUND, Y., GRUSSER, S.M., LIEBESKIND, U., SCHIAG, P.M., FLOR, H. Phantom phenomena in mastectomized patients and their relation to chronic and acute pre-mastectomy pain. Pain. 2004; 107:140-146.
SARAH, K., ANJA, W., KATHRIN, F., KATRIN, L., BRITTA, R., BERND, H., HELGE, B.H., HARTMUT, B., ALBERT, G., RAMONA, R. Balance impairment and neuromuscular changes in breast cancer patients with chemotherapy-induced peripheral neuropathy. Clin. Neurophysiol. 2016; 127:1481-1490.
SIQUEIRA, T.C., FRÁGOAS, S.P., PELEGRINI, A., OLIVEIRA, A.R., LUZ, C.M. Factors associated with upper limb dysfunction in breast cancer survivors. Support Care Cancer. 2021; 29:1933-1940.
SOUZA, L., LEMOS, T., SILVA, D.C., de OLIVEIRA, J.M. GUEDES CORRÊA, J.F., TAVARES, P.L., OLIVEIRA, L.A. RODRIGUES, E.C., VARGAS, C.D. Balance impairment after brachial plexus injury as assessed through clinical and posturographic evaluation. Front. Hum. Neurosci. 2016; 9:715, doi:10.3389/fnhum.2015.00715.
VILLA, G., MANDARANO, R., SCIRÈ-CALABRISOTTO, C., RIZZELLI, V., DEL DUCA, M., MONTIN, D.P., PAPARELLA, L., DE GAUDIO, A.R., ROMAGNOLI, S. Chronic pain after breast surgery: incidence, associated factors, and impact on quality of life, an observation prospective study. Perioper. Med. 2021; 10:6. doi:10.1186/s13741-021-00176-6.
WOOLLACOTT, M.H., SHUMWAY-COOK, A. Changes in posture control across the life span – a systems approach. Phys. Ther. 1990; 70:799-807.
1Programa de Pós-Graduação em Ciências da Reabilitação, Centro Universitário Augusto Motta – UNISUAM, Rio de Janeiro, Brasil. regis_luz_@hotmail.com https://orcid.org/0000-0001-8685-1639
2Professora Dra. no Programa de Pós-Graduação em Ciências da Reabilitação, Centro Universitário Augusto Motta – UNISUAM, Rio de Janeiro, Brasil. erikacrodrigues@gmail.com https://orcid.org/0000-0001-5464-2963
