REGISTRO DOI: 10.69849/revistaft/th102412030867
Alana Daylin Pulgatti
Prof. Orientador: Dra. Thaís Duarte Bifano
Prof. Coorientador: Dra. Suzana Bender
Resumo
O estudo analisou compostos bioativos e a eficiência antioxidante de cremes cosméticos que contêm própolis e pólen, destacando uma abordagem comparativa de suas propriedades. A própolis, amplamente reconhecida por suas características antimicrobianas e antioxidantes, é uma substância resinosa elaborada por abelhas a partir de resinas vegetais. Por outro lado, o pólen, coletado diretamente das flores, é uma fonte rica em proteínas, vitaminas, minerais e compostos fenólicos. A pesquisa comparou o teor de compostos fenólicos e flavonoides em diferentes formulações comerciais e preparações manipuladas, correlacionando esses compostos bioativos com a capacidade antioxidante avaliada pelo método do radical DPPH. Os resultados revelaram que os cremes contendo pólen apresentaram maior concentração de compostos fenólicos e flavonoides, o que se refletiu em uma atividade antioxidante superior em comparação aos cremes com própolis. O estudo destacou o grande potencial do pólen como ingrediente em formulações cosméticas devido à sua composição bioativa rica e diversificada. A metodologia adotada incluiu análises espectrofotométricas detalhadas e rigorosas avaliações estatísticas, gerando dados que reforçam a importância de ingredientes naturais na indústria cosmética. Esse trabalho contribui significativamente para o desenvolvimento de produtos mais eficazes e alinhados à crescente demanda por cosméticos sustentáveis.
Palavras–chave: polifenóis; flavonoides; antioxidante; cremes comerciais.
1 INTRODUÇÃO
A própolis, também conhecida como “cola de abelha”, é uma substância resinosa de tonalidade escura que as abelhas obtêm de vegetais em crescimento. Elas a combinam com cera e a empregam na edificação e modificação de suas colmeias (BANKOVA; DE CASTRO; MARCUCCI, 2000).
A origem do termo “própolis” vem do grego antigo, onde “pro” se refere a “à frente de” ou “na entrada para”, enquanto “polis” refere-se à “comunidade” ou “cidade”, expressando uma substância que protege a colmeia (CASTALDO; CAPASSO, 2002).
Sua composição é altamente complexa, com mais de 300 componentes identificados até o momento. Essa composição varia conforme a estação do ano e a vegetação presente nas áreas onde é coletada. Entre os constituintes estão presentes ceras, resinas, bálsamos, óleos essenciais, aminoácidos e açúcares, com uma predominância de flavonoides e derivados do ácido cinâmico (CASTRO, 2001).
Outro produto que as abelhas aproveitam das plantas é o pólen. O pólen é o gameta masculino das flores, utilizado na reprodução das plantas com flores. É uma estrutura microscópica essencial para o processo de polinização. Possui importância na reprodução das plantas, mas além disso, o pólen é coletado por abelhas para alimentar suas larvas. Ele é compactado em pequenas pelotas nas pernas traseiras das abelhas e é conhecido como “pólen de abelha”. Este pólen de abelha é uma mistura de diferentes tipos de pólen de flores e é considerado um alimento nutritivo, rico em proteínas, vitaminas e minerais (CAMPOS et al., 2008).
Considerado uma substância complexa e altamente nutritiva, o pólen é composto por uma variedade de substâncias, incluindo: proteínas, carboidratos, lipídios e ácidos graxos, compostos fenólicos, vitaminas e minerais, além de compostos bioativos como enzimas, fitoesteróis e pigmentos (XI et al., 2018).
A própolis e o pólen são fontes naturais de polifenóis, compostos importantes para a saúde e bem-estar, devido às suas características antioxidantes e potenciais benefícios à saúde. Os polifenóis possuem estrutura complexa e variada, possuindo anéis fenólicos ligados a várias outras moléculas, como açúcares e ácidos orgânicos. Devido à diversidade de estruturas e subclasses, apresentam uma ampla gama de propriedades biológicas, incluindo atividades anti-inflamatórias, antimicrobianas e anticancerígenas (SCALBERT; WILLIAMSON, 2000).
Os flavonoides constituem um amplo grupo de polifenóis naturalmente presentes em frutas, vegetais, grãos, cascas, raízes, caules, flores, chá e vinho (MIDDLETON, 1998). Surgem biogeneticamente da combinação de uma unidade de carbono derivada do malonato com uma parte do fenilpropanoide proveniente do ácido chiquímico, originando primeiramente as chalconas (MABRY; ULUBELEN, 1980).
A variada estrutura dos compostos fenólicos, entre eles os flavonoides, aliada às suas propriedades antioxidantes, anti-inflamatórias e antimicrobianas, tem atraído crescente atenção para o uso desses compostos em diferentes setores, especialmente na cosmética. Ingredientes naturais ricos em compostos fenólicos, como pólen e própolis, têm se destacado por oferecer benefícios funcionais às formulações cosméticas, alinhando-se à demanda por produtos mais sustentáveis e eficazes. Contudo, apesar do amplo potencial de aplicação, ainda há uma escassez de estudos na literatura que explorem de maneira detalhada a composição química e a eficácia antioxidante de cosméticos formulados com esses ingredientes. Essa lacuna limita a capacidade de consumidores e profissionais de tomarem decisões bem-informadas.
O objetivo deste estudo avaliou e comparou o conteúdo de compostos fenólicos e em especial os flavonoides em cremes comerciais contendo pólen e própolis, visando determinar quais produtos apresentam maior quantidade desses bioativos e atividade antioxidante. Para isso, foram identificados e selecionados produtos disponíveis no mercado que incluíam esses ingredientes em suas formulações, e nas amostras selecionadas foram quantificados os compostos fenólicos totais e flavonoides totais. Além disso, foi determinada a capacidade antioxidante de cada amostra, correlacionando-a às concentrações de polifenóis e flavonoides, com o intuito de compreender a relação entre esses compostos bioativos e a atividade antioxidante observada.
2 Desenvolvimento
2.1 Metodologia
2.1.1 Amostras
Foram adquiridos cremes comerciais contendo pólen e própolis em sua composição, selecionados de forma aleatória. Com o objetivo de avaliar a concentração de compostos bioativos e inibição do radical DPPH, foram desenvolvidas formulações manipuladas semelhantes às dos cosméticos analisados, mas isentas de pólen e própolis. Para facilitar a identificação, as amostras foram designadas como A1, correspondente ao creme comercial contendo pólen; A2, referente ao creme comercial contendo própolis; M1, representando a base de creme manipulada sem pólen; e M2, indicando o creme manipulado sem própolis.
2.1.2 Pesquisa de compostos fenólicos totais
A determinação dos compostos fenólicos totais foi realizada conforme Singleton et al. (1999), com algumas adaptações. Foi pesado 1,0 grama do creme, o qual foi diluído na proporção 1:100 (p/v) em etanol p.a. e adicionado a um balão volumétrico para dissolver em banho ultrassônico. Para a reação, foi adicionado 1,0 mL do creme diluído, acrescentados 1,0 mL de Folin Ciocalteau (1:4), 2 mL de água destilada e, após vinte minutos, 2 mL de solução de carbonato de sódio a 20%. Após 60 minutos no escuro, a leitura foi realizada no comprimento de onda de 760 nm em espectrofotômetro. O branco foi preparado sem a adição do creme, e o ensaio foi conduzido nas mesmas condições. O ácido gálico foi utilizado para construir uma curva de calibração, e os resultados foram expressos em miligrama equivalente de ácido gálico/g de amostra. A curva de calibração para a determinação dos compostos fenólicos totais foi construída utilizando o padrão ácido gálico nas concentrações de 10, 20, 30, 40 e 50 ![]() g/mL, seguindo os mesmos procedimentos descritos anteriormente, em relação à proporção da mistura reacional utilizada para as amostras. A leitura da absorbância foi realizada em triplicata a 760 nm com uma repetição.
g/mL, seguindo os mesmos procedimentos descritos anteriormente, em relação à proporção da mistura reacional utilizada para as amostras. A leitura da absorbância foi realizada em triplicata a 760 nm com uma repetição.
2.1.3 Pesquisa de flavonoides totais
A concentração de flavonoides totais foi determinada pelo método descrito por Carpes et al. (2008), com algumas modificações. Uma alíquota de 1,0 mL da diluição do creme 1:100 em etanol p.a. foi transferida para um tubo de ensaio e adicionada a 4,3 mL de etanol a 80% e 1 mL de cloreto de alumínio a 10%. O branco foi preparado sem a adição do creme, e o ensaio foi conduzido nas mesmas condições. O complexo reacional e o branco foram cuidadosamente agitados e mantidos por 30 minutos ao abrigo da luz, e as absorbâncias foram medidas a 420 nm em espectrofotômetro. A curva de calibração para a determinação de flavonoides totais foi construída utilizando o padrão quercetina. A quercetina foi preparada em solução etanólica utilizando 0,5 mg/mL. Desta solução-mãe, foram retiradas alíquotas para a construção de uma curva de calibração nas concentrações de 10, 20, 40, 60, 80 e 100 ![]() g/mL, seguindo os mesmos procedimentos descritos anteriormente em relação à proporção da mistura reacional realizada para as amostras. A análise foi realizada em triplicata com uma repetição. O teor de flavonoides totais foi determinado por interpolação das absorbâncias das amostras (descontando a absorbância do branco) contra uma curva de calibração construída com as diferentes concentrações do padrão quercetina, e os resultados foram expressos como miligramas equivalentes de quercetina por grama de extrato liofilizado (mg equivalente de quercetina/g de creme).
g/mL, seguindo os mesmos procedimentos descritos anteriormente em relação à proporção da mistura reacional realizada para as amostras. A análise foi realizada em triplicata com uma repetição. O teor de flavonoides totais foi determinado por interpolação das absorbâncias das amostras (descontando a absorbância do branco) contra uma curva de calibração construída com as diferentes concentrações do padrão quercetina, e os resultados foram expressos como miligramas equivalentes de quercetina por grama de extrato liofilizado (mg equivalente de quercetina/g de creme).
2.1.4 Determinação da inibição do radical DPPH
A metodologia foi realizada conforme Fries e Frasson (2010) com algumas adaptações para a análise de inibição do radical DPPH dos cremes. Inicialmente, foi preparado 1 g de cada creme, que foi diluído em etanol p.a. até um volume final de 100 mL (1:100 p/v). Em seguida, foram transferidos 2 mL dessa diluição para um tubo de ensaio, ao qual foram adicionados 1 mL de uma solução de DPPH 2 mM em etanol. Após agitação, as amostras foram mantidas por 30 minutos à temperatura ambiente e ao abrigo da luz. A leitura da absorbância foi realizada no espectrofotômetro, no comprimento de onda de 515 nm, utilizando etanol como branco. Apenas essa diluição foi utilizada para a análise, e os experimentos foram realizados em triplicata com uma repetição. Entretando foi calculada a porcentagem de inibição do radical DPPH pela seguinte equação conforme Oliveira (2015):
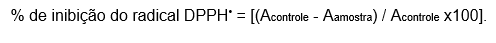
Onde:

2.1.5 Análise estatística
Inicialmente, foi realizada a análise de variância (ANOVA) unidirecional, para verificar se havia diferenças estatisticamente significativas entre as médias dos grupos analisados.
Para identificar quais pares de grupos apresentavam diferenças significativas, foi aplicado o teste de comparações múltiplas de Tukey (HSD – Honest Significant Difference). Este teste calculou as diferenças médias, intervalos de confiança e determinou quais comparações possuíam significância estatística. As análises foram realizadas utilizando O software SPSS®, versão 22.0, e o nível de significância empregado foi de 5% (p≤0,05).
Os resultados foram apresentados com base no valor-p (p-value), considerando um nível de significância de 5%, com tabelas geradas para ilustrar os dados e facilitar a interpretação.
2.2 Resultados e discussão
2.2.1 Compostos fenólicos totais
Os teores de compostos fenólicos totais das amostras foram determinados utilizando a equação da reta obtida através da curva de calibração do ácido gálico:
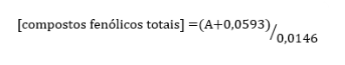
Os resultados foram obtidos substituindo-se Y pela média das absorbâncias encontradas para cada amostra e X por concentração de compostos fenólicos. Os valores foram expressos como miligrama equivalente de ácido gálico por grama de creme (mg EAG/g). Os resultados foram apresentados na Tabela 1.
Tabela 1. Compostos fenólicos totais nos cremes cosméticos analisados.
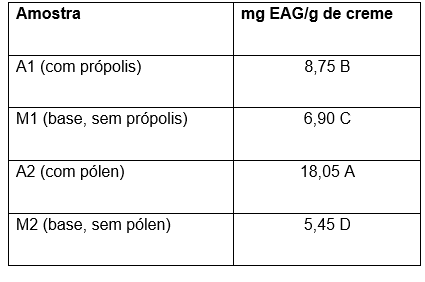
Diferença estatística entre as amostras, onde p<0,05, representada por letras maiúsculas.
Conforme observado na Tabela 1, existe uma diferença estatística significativa entre as concentrações médias de A1 e A2. Isso indicou que as amostras apresentaram concentrações substancialmente diferentes, sendo A2 maior que A1.
A variação na quantidade de compostos fenólicos entre a própolis (A1) e o pólen (A2), decorre de suas origens botânicas distintas e dos métodos de coleta e produção utilizados pelas abelhas. O pólen é obtido diretamente das flores e apresenta uma grande diversidade de compostos fenólicos, incluindo flavonoides e ácidos fenólicos. Esses compostos são metabólitos secundários que as plantas geram para se defender contra a radiação ultravioleta, infecções por patógenos e ataques de herbívoros (MITHÖFER; BOLAND, 2012). A ampla gama de fontes vegetais contribui para a elevada concentração e diversidade de compostos bioativos encontrados no pólen (ARES et al., 2018).
Já a própolis, é uma substância resinosa que as abelhas elaboram utilizando resinas de plantas, combinadas com sua saliva e cera. Apesar de incluir compostos fenólicos, a variedade de seus componentes é relativamente restrita, dependendo das fontes vegetais acessíveis nas proximidades da colmeia. Ademais, o processamento que as abelhas fazem pode diminuir a quantidade de fenóis, uma vez que o material é diluído durante o processo de produção (SANTOS-BUELGA; GONZÁLEZ-PARAMÁS, 2017).
Um estudo publicado por Berretta et al., (2020) investigou a composição química e a atividade antioxidante de diferentes extratos de própolis verde, destacando a presença de compostos fenólicos e flavonoides em concentrações inferiores às encontradas em outras fontes apícolas. Mohdaly et al. (2015) ressaltaram que, embora tanto a própolis quanto o pólen apresentem alto teor de compostos fenólicos, o pólen se destaca por sua composição rica em 3,4-dimetoxicinamato, identificado como o principal componente fenólico. Essa característica contribui para suas expressivas capacidades antioxidantes, especialmente na neutralização de radicais livres.
As variações químicas entre o pólen e a própolis elucidam o motivo pelo qual o pólen possui uma concentração superior de compostos fenólicos em suas formulações (BARBOSA, 2021). Dessa forma, em cremes contendo pólen ou própolis, é provável que o creme com pólen apresente uma maior concentração de compostos fenólicos totais em comparação ao creme com própolis, devido ao teor naturalmente mais elevado desses compostos no pólen.
Com relação às bases, as amostras contendo própolis (A1) e pólen (A2) apresentaram concentrações de compostos fenólicos totais significativamente superiores às das respectivas bases controle, M1 e M2. As análises estatísticas confirmaram que A1 diferiu significativamente de M1, assim como A2 diferiu de M2. Esses aumentos podem ser atribuídos à alta concentração de compostos fenólicos totais presentes no pólen e na própolis (ALMEIDA-MURADIAN et al., 2005; ALVES DE KUBOTA, 2013).
Quando as bases foram comparadas observou-se que ambas foram estatisticamente diferentes, sendo a diferença percentual entre M1 (base, sem própolis) e M2 (base, sem pólen) de aproximadamente 26,61%. A diferença percentual observada entre as bases M1 e M2 é resultado das variações na composição, especialmente no tipo e concentração dos agentes emulsionantes e espessantes, bem como na presença de ativos adicionais na base M2. (Rowe et al., 2021).
Embora não haja compostos fenólicos na base, outras matérias-primas com estruturas fenólicas podem ter interferido nos resultados. Conservantes como Nipagim (metilparabeno) e Nipasol (propilparabeno), presentes em ambas as bases, são ésteres do ácido p-hidroxibenzóico, que possuem estrutura fenólica. Esses compostos são amplamente utilizados na indústria cosmética devido às suas propriedades antimicrobianas, ajudando a prevenir o crescimento de bactérias e fungos nas formulações (Andersen, 2008).
2.2.2 Flavonoides totais
Os teores de flavonoides totais foram calculados com base na equação da reta obtida através da curva de calibração da quercetina:
Flavonoides totais = (A + 0,0016) / 0,0055
Com base nas absorbâncias medidas a 420 nm, foram determinados os valores de concentração ( ![]() g/mL,), posteriormente corrigidos pela diluição 1:100 e expressos como mg equivalente de quercetina por grama de creme (mg EQ/g).
g/mL,), posteriormente corrigidos pela diluição 1:100 e expressos como mg equivalente de quercetina por grama de creme (mg EQ/g).
Os resultados foram apresentados na Tabela 2.
Tabela 2 – Concentração de flavonoides totais nos cremes cosméticos analisados.
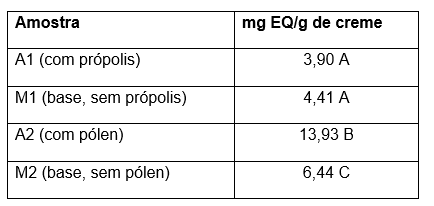
Diferença estatística entre as amostras, onde p<0,05, representada por letras maiúsculas.
A diferença na concentração de flavonoides entre A1 (3,90 mg EQ/g) e A2 (13,93 mg EQ/g) foi 257,18% maior e pode ser explicada pela diversidade de fontes vegetais que contribuem para a composição do pólen, tornando-o significativamente mais rico em flavonoides. O pólen, coletado diretamente das flores pelas abelhas, possui alta diversidade de flavonoides, os quais estão relacionados à fotoproteção e ao combate a agentes patogênicos nas plantas (Bogdanov, 2011). Em contrapartida, a própolis é composta por resinas vegetais misturadas com cera e saliva das abelhas, resultando em um espectro químico mais limitado, fortemente dependente das espécies vegetais disponíveis ao redor da colmeia (Viuda-Martos et al., 2008).
A amostra contendo pólen (A2) apresentou um aumento de 53,77% no teor de flavonoides em relação à base sem pólen (M2). Essa diferença destacou a contribuição direta do pólen na formulação, corroborando sua composição rica em quercetina, kaempferol e outros flavonoides bioativos (Pascoal et al., 2014). Essas substâncias não apenas conferem propriedades antioxidantes, mas também podem atuar como aditivos naturais que aumentam a estabilidade das formulações cosméticas (VALE et al., 2021). Embora a base sem pólen contenha conservantes como metilparabeno e propilparabeno, que possuem estruturas fenólicas como citado anteriormente, sua contribuição para o teor total de flavonoides é insignificante em comparação aos compostos provenientes do pólen (BEREKETOGLU; PRADHAN, 2019). Estudos de Gutiérrez-Del-Río et al. (2021) apontam que o pólen é uma das fontes mais concentradas em flavonoides e outros metabólitos secundários, destacando seu papel em formulações com propriedades bioativas.
Surpreendentemente, a base sem própolis (M1) apresentou um teor de flavonoides total 13,8% maior do que a amostra contendo própolis (A1). Esse resultado pode ser atribuído a dois fatores principais como: a composição química das bases e o potencial interferente dos excipientes presentes na formulação. Conservantes como parabenos e outros agentes estabilizantes presentes na base podem apresentar resposta espectrofotométrica, elevando o valor detectado como flavonoides (Rowe et al., 2009). Além disso, a própolis, ao ser processado pelas abelhas, passa por transformações químicas que podem reduzir a quantidade de flavonoides livres disponíveis, já que esses compostos muitas vezes se ligam a matrizes resinoides e cerosas, diminuindo sua solubilidade e disponibilidade (Miguel e Antunes, 2011). A ausência desses fatores na base pode explicar o resultado superior observado.
A diferença de 46,03% no teor de flavonoides entre as bases sem própolis (M1) e sem pólen (M2) reflete as variações em suas formulações. Embora nenhuma das bases contenha flavonoides adicionados, a presença de conservantes com estruturas fenólicas, como os parabenos, pode contribuir para os resultados observados (RIBEIRO et al., 2020). Além disso, outros componentes das bases, como estabilizantes e emulsionantes, podem apresentar reações químicas que interferem na detecção espectrofotométrica de flavonoides (LAVILLA et al., 2023). Diferenças nos agentes emulsionantes e na composição dos estabilizantes são conhecidas por influenciar a detecção de compostos fenólicos em análises espectrofotométricas. Segundo Chang et al. (2002), mesmo pequenas variações na formulação podem impactar os resultados de compostos bioativos, sugerindo que as diferenças entre M1 e M2 podem ser atribuídas à presença de outros aditivos não identificados como principais fontes de flavonoides.
2.2.3 Determinação da inibição do radical DPPH:
A porcentagem da inibição do radical DPPH foi calculado conforme a equação apropriada para descoloração do DPPH:
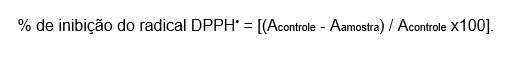
Os resultados estão apresentados na Tabela 3.
Tabela 3 – Porcentagem de inibição do radical DPPH calculada para os cremes cosméticos analisados.
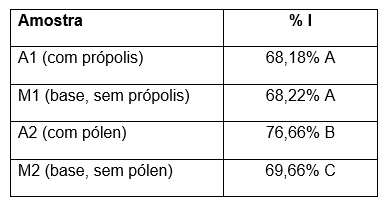
Diferença estatística entre as amostras, onde p<0,05, representada por letras maiúsculas.
A análise comparativa das amostras A1 e A2 revelou diferenças significativas na porcentagem de inibição do radical DPPH, com A2 apresentando um percentual de 76,66%, enquanto A1 registrou 68,18%. Essa variação pode ser atribuída às distintas composições químicas de cada formulação, especialmente no que tange à concentração de compostos fenólicos (DE-MELO et al., 2014).
Estudos indicam que o pólen possui uma elevada concentração de compostos fenólicos, como flavonoides e ácidos fenólicos, que conferem uma potente capacidade antioxidante (NEVES et al., 2009). Por outro lado, a própolis, embora também rica em compostos fenólicos, apresentou uma concentração inferior desses compostos em comparação ao pólen, o que pode justificar a menor atividade antioxidante observada na amostra A1 (YESILTAS et al., 2014).
Portanto, a maior atividade antioxidante observada na amostra A2 pode ser atribuída à presença mais abundante de compostos fenólicos derivados do pólen, em contraste com a amostra A1, que contém própolis como principal fonte de antioxidantes (NEVES et al., 2009).
A comparação entre a amostra A1 e o manipulado M1, que contém Polawax (8%), glicerina (2%), óleo mineral (2%), DC 245 Fluid (2%), EDTA (0,2%), Nipagim (0,1%), Nipasol (0,08%) e água, revela atividades antioxidantes semelhantes, com percentuais de 68,18% e 68,22%, respectivamente, o que refletiu em amostras sem diferença estatisticamente significativas. Essa equivalência pode ser atribuída à presença de excipientes que não interferem negativamente na atividade antioxidante dos compostos fenólicos presentes na própolis (CABRAL et al., 2009).
A glicerina, por exemplo, é um umectante que pode auxiliar na estabilidade dos compostos ativos, enquanto o Polawax atua como emulsificante, garantindo a homogeneidade da formulação sem comprometer a eficácia dos antioxidantes (TASIC-KOSTOV et al., 2012).
Além disso, o EDTA, utilizado como quelante, pode prevenir a degradação oxidativa dos componentes da formulação, contribuindo para a manutenção da atividade antioxidante (BUGNOTTO et al., 2006). Portanto, a composição do manipulado M1 resultou em desempenho comparável ao da amostra A1.
A comparação entre a amostra A2 e o manipulado M2, que contém Carbopol 940 (1%), Nipagin (0,1%), Nipasol (0,08%), DC 9040 (2%), glicerina (2%), vitamina E (0,5%), Zincidone (0,5%), peptídeo de cobre (0,5%) e água, revela atividades antioxidantes de 76,66% e 69,66%, respectivamente. Essa diferença pode ser atribuída à presença de vitamina E na formulação M2, um antioxidante lipossolúvel conhecido por sua capacidade de neutralizar radicais livres e proteger as células contra o estresse oxidativo (TRABER; ATKINSON, 2007).
A comparação entre as formulações manipuladas M1 e M2 demonstrou diferenças significativas em sua composição e potencial antioxidante. A formulação M1 contém Polawax (8%), glicerina (2%), óleo mineral (2%), DC 245 Fluid (2%), EDTA (0,2%), Nipagim (0,1%), Nipasol (0,08%) e água. Já a formulação M2 é composta por Carbopol 940 (1%), Nipagin (0,1%), Nipasol (0,08%), DC 9040 (2%), glicerina (2%), vitamina E (0,5%), Zincidone (0,5%), peptídeo de cobre (0,5%) e água.
A presença de vitamina E na formulação M2 é um fator determinante para sua atividade antioxidante em inibir o radical DPPH. A vitamina E é reconhecida por sua capacidade de neutralizar radicais livres e proteger as células contra o estresse oxidativo. Estudos demonstram que a incorporação de vitamina E em formulações cosméticas pode aumentar significativamente a capacidade antioxidante do produto, contribuindo para a prevenção do envelhecimento cutâneo (SAEZ; SOUZA; MANSUR, 2018).
Além disso, a glicerina presente em ambas as formulações atua como um umectante, auxiliando na hidratação da pele e na estabilidade dos compostos ativos. No entanto, a ausência de antioxidantes específicos na formulação M1 pode resultar em uma menor inibição do radical DPPH em comparação com M2 (CARVALHO, 2021).
A inclusão de ativos como Zincidone e peptídeo de cobre em M2 também pode contribuir para a eficácia antioxidante, uma vez que esses componentes possuem propriedades que auxiliam na manutenção da integridade celular e na proteção contra danos oxidativos (BIGHETTI; SAMPAIO; GUSMÃO, 2018).
Portanto, a formulação M2, devido à presença de vitamina E e outros ativos com propriedades antioxidantes, apresenta um potencial antioxidante superior ao da formulação M1, que não contém tais componentes específicos. Essa diferença na composição justifica a variação na atividade antioxidante observada entre as duas formulações.
Conclusão
Os resultados obtidos evidenciam que tanto a própolis quanto o pólen contribuem significativamente para o aumento da atividade antioxidante em cremes cosméticos, com destaque para o pólen, que apresentou maior porcentagem de inibição do radical DPPH na análise realizada.
A pesquisa confirmou que tanto o pólen quanto a própolis são fontes valiosas de compostos bioativos, como fenólicos e flavonoides, que conferem propriedades importantes às formulações em que são utilizados. Contudo, as análises realizadas evidenciaram a superioridade do pólen em relação à própolis em termos de concentração de compostos fenólicos totais, flavonoides e capacidade antioxidante.
As amostras contendo pólen apresentaram concentrações significativamente mais altas de compostos bioativos e maior capacidade antioxidante em comparação às formulações com própolis. Especificamente, a concentração de compostos fenólicos totais foi 106,3% superior nos cremes com pólen em relação aos com própolis, enquanto o teor de flavonoides foi 257,18% maior nas formulações contendo pólen.
Esses resultados corroboram a literatura científica, que destaca o pólen como uma fonte mais rica e diversificada de metabólitos secundários devido à sua origem diretamente botânica e à ausência de processamento significativo pelas abelhas. Já a própolis, embora possua propriedades biológicas importantes, demonstrou limitações em relação à concentração de compostos fenólicos e flavonoides, o que pode ser atribuído ao seu processo de produção, que dilui e modifica os componentes originais.
Já as diferenças identificadas entre as formulações manipuladas e as comerciais reforçam a influência dos excipientes e do processo de fabricação nas propriedades finais dos cosméticos. Elementos como estabilizantes e conservantes podem impactar as análises espectrofotométricas, ao mesmo tempo que contribuem para a estabilidade e funcionalidade das formulações. Esses achados indicam que o desenvolvimento de cosméticos com ingredientes naturais exige uma seleção adequada dos ativos, além de uma avaliação detalhada da composição completa da formulação.
Esta pesquisa proporciona relevância à ciência cosmética ao comparar os potenciais bioativos de dois ingredientes naturais amplamente utilizados. Os resultados obtidos podem direcionar futuras pesquisas no desenvolvimento de cosméticos mais eficazes e sustentáveis, explorando os benefícios do pólen e da própolis em combinação com tecnologias avançadas de formulação.
REFERÊNCIAS
ALMEIDA-MURADIAN, L. B.; PAMPLONA, L. C.; COIMBRA, S.; BARTH, O. M. Chemical composition and botanical evaluation of dried bee pollen pellets. Journal of Food Composition and Analysis, v. 18, n. 1, p. 105-111, 2005.
ANDERSEN, F. A. Final report on the safety assessment of methylparaben, ethylparaben, propylparaben, and butylparaben as used in cosmetic products. International Journal of Toxicology, v. 27, n. 4, p. 1-82, 2008. DOI: 10.1080/10915810802548359.
ARES, A.; VALVERDE, S.; BERNAL, J.; NOZAL, M. J.; BERNAL, J. Extraction and determination of bioactive compounds from bee pollen. Journal of Pharmaceutical and Biomedical Analysis, v. 147, p. 110-124, 2018.
BANKOVA, V. S.; DE CASTRO, S. L.; MARCUCCI, M. C. Propolis: Recent advances in chemistry and plant origin. Apidologie, v. 31, n. 1, p. 3-15, 2000.
BARBOSA, Valquiria Sehnem. Avaliação da atividade antioxidante de mel, própolis e pólen de abelhas Jataí. 2021. Trabalho de Conclusão de Curso – Curso Superior de Tecnologia em Processos Químicos, Universidade Tecnológica Federal do Paraná, Toledo, 2021.
BEREKETOGLU, Ceyhun; PRADHAN, Ajay. Comparative transcriptional analysis of methylparaben and propylparaben in zebrafish. Science of The Total Environment, v. 671, p. 129-139, 2019. DOI: 10.1016/j.scitotenv.2019.03.358.
BERRETTA, A. A.; NASCIMENTO, A. P.; BUENO, P. C.; DE OLIVEIRA LIMA LEITE VAZ, M. M.; MARCHETTI, J. M. Propolis standardized extract (EPP-AF®), an innovative chemically and biologically reproducible pharmaceutical compound for treating wounds. International Journal of Biological Sciences, v. 16, n. 1, p. 99-107, 2020. DOI: 10.7150/ijbs.35900.
BIGHETTI, A. E.; SAMPAIO, P. G.; GUSMÃO, C. P. Estudo da atividade antioxidante de uma formulação cosmética. Revista Uningá, v. 55, n. 3, p. 1-13, 2018.
BOGDANOV, Stefan. Bee pollen: Nutrition, functional properties, health: A review. Bee Product Science, v. 1, n. 1, p. 1-28, 2011.
BUGNOTTO, Camila; SOARES, Gláucia; LAPORTA, Luciane Varini; ALVES, Marta Palma; SCHMIDT, Cleber Alberto; LIMBERGER, Jane Beatriz. Estudo de estabilidade de formulação tópica contendo própolis. Disc. Scientia. Série: Ciências da Saúde, Santa Maria, v. 7, n. 1, p. 1-12, 2006.
CABRAL, Ingridy Simone Ribeiro; OLDONI, Tatiane Luiza Cadorin; PRADO, Adna; BEZERRA, Rosângela Maria Neves; ALENCAR, Severino Matias de; IKEGAKI, Masaharu; ROSALEN, Pedro Luiz. Composição fenólica, atividade antibacteriana e antioxidante da própolis vermelha brasileira. Química Nova, São Paulo, v. 32, n. 6, p. 1523-1527, 2009.
CAMPOS, M. et al. Pollen composition and standardisation of analytical methods. Journal of Apicultural Research and Bee World, v. 47, p. 156-163, 1 jun. 2008.
CARPES, S. T. et al. Avaliação do potencial antioxidante do pólen apícola produzido na região sul do Brasil. Química Nova, v. 31, n. 7, p. 1660-1664, 2008.
CARVALHO, J. G. S. Estudo sobre formulações cosméticas naturais e princípios ativos de origem natural encontrados no Brasil. 2021. Trabalho de Conclusão de Curso – Bacharelado em Química, Universidade Tecnológica Federal do Paraná, Pato Branco, 2021.
CASTALDO, S.; CAPASSO, F. Propolis, an old remedy used in modern medicine. Fitoterapia, v. 73, p. S1-S6, 1 nov. 2002. CASTRO, S. L. Propolis: Biological and Pharmacological Activities. Annual Review of Biomedical Sciences, v. 3, n. 0, p. 49-83, 2001.
CHANG, Chia-Chi; YANG, Ming-Hung; WEN, Hsiu-Ming; CHERN, Janey Chun-Jung. Estimation of total flavonoid content in propolis by two complementary colorimetric methods. Journal of Food and Drug Analysis, v. 10, n. 3, p. 178-182, 2002.
ERKAN, N.; AYRANCI, G.; AYRANCI, E. Antioxidant activities of rosemary (Rosmarinus Officinalis L.) extract, blackseed (Nigella sativa L.) essential oil, carnosic acid, rosmarinic acid and sesamol. Food Chemistry, v. 110, n. 1, p. 76-82, 1 set. 2008.
FERNANDES, N. A. F. Avaliação da atividade biológica de compostos naturais de plantas medicinais de Angola e de compostos de síntese. 2013. 146 p. Tese (Doutorado em Bioquímica), Universidade da Beira Interior, Covilhã, Portugal, 2013.
FRIES, Aline Taís; FRASSON, Ana Paula Zanini. Avaliação da atividade antioxidante de cosméticos anti-idade. Revista Contexto & Saúde, v. 10, n. 19, p. 17-23, jul./dez. 2010.
GUTIÉRREZ-DEL-RÍO, I. et al. Terpenoids and polyphenols as natural antioxidant agents in food preservation. Antioxidants (Basel), v. 10, n. 8, p. 1264, 2021. DOI: 10.3390/antiox10081264.
HARTMAN, P. E.; SHANKEL, D. M. Antimutagens and anticarcinogens: A survey of putative interceptor molecules. Environmental and Molecular Mutagenesis, v. 15, n. 3, p. 145-182, 1990.
LAVILLA, Isela; ROMERO, Vanesa; COSTAS, Paula; BENDICHO, Carlos. Kinetic spectrophotometric assay for the determination of vitamin C in cosmetics following ultrasound-assisted emulsification. Analytical Methods, v. 15, p. 951-958, 2023. DOI: 10.1039/D2AY00291H.
LIMA, A. F.; SANTANA, E. C. DE J.; MOREIRA, J. A. R. Atuação da vinhoterapia no retardo do envelhecimento cutâneo: revisão de literatura. Revista Científica da FHO|Uniararas, v. 6, n. 2, p. 1-8, 30 dez. 2018.
MABRY, T. J.; ULUBELEN, A. Chemistry and utilization of phenylpropanoids including flavonoids, coumarins, and lignans. Journal of Agricultural and Food Chemistry, v. 28, n. 2, p. 188-195, 1980.
MIDDLETON, E. Jr. Effect of plant flavonoids on immune and inflammatory cell function. In: MANTHEY, J. A.; BUSLIG, B. S. (eds.). Flavonoids in the Living System. Springer, 1998. p. 175-182.
MIGUEL, Maria da Graça; ANTUNES, Maria Dulce. Is propolis safe as an alternative medicine? Journal of Pharmacy and Bioallied Sciences, v. 3, n. 4, p. 479-495, 2011.
MITHÖFER, A.; BOLAND, W. Plant defense against herbivores: chemical aspects. Annual Review of Plant Biology, v. 63, p. 431-450, 2012.
MOHDALY, A.; MAHMOUD, A.; ROBY, M.; SMETANSKA, I.; RAMADAN, M. Phenolic extract from propolis and bee pollen: Composition, antioxidant and antibacterial activities. Journal of Food Biochemistry, v. 39, p. 538-547, 2015.
NEVES, Letícia Corassa; ALENCAR, Severino Matias de; CARPES, Solange Terezinha. Determinação da atividade antioxidante e do teor de compostos fenólicos e flavonoides totais em amostras de pólen apícola de Apis mellifera. Braz. J. Food Technol., v. VII BMCFB, junho 2009.
OLIVEIRA, G. L. S. Determinação da capacidade antioxidante de produtos naturais in vitro pelo método do DPPH•: estudo de revisão. Revista Brasileira de Plantas Medicinais, v. 17, n. 1, p. 1-10, jan./mar. 2015. Disponível em: https://doi.org/10.1590/1983-084X/12_165.
PASCOAL, A.; RODRIGUES, S.; TEIXEIRA, A. et al. Biological activities of commercial bee pollens: Antimicrobial, antimutagenic, antioxidant and anti-inflammatory. Food and Chemical Toxicology, v. 63, p. 233-239, 2014.
RIBEIRO, Daiany Alves; CAMILO, Cicera Janaine; NONATO, Carla de Fátima Alves; et al. Influence of seasonal variation on phenolic content and in vitro antioxidant activity of Secondatia floribunda A. DC. (Apocynaceae). Food Chemistry, v. 315, p. 1-8, 2020. DOI: 10.1016/j.foodchem.2020.126277.
ROWE, R. C.; SHESKEY, P. J.; OWEN, M. S. Handbook of Pharmaceutical Excipients. 6th ed. London: Pharmaceutical Press, 2009.
SAEZ, V.; SOUZA, I. D. L.; MANSUR, C. R. E. Lipid nanoparticles (SLN & NLC) for delivery of vitamin E: a comprehensive review. International Journal of Cosmetic Science, v. 40, p. 103-116, 2018. DOI: 10.1111/ics.12452.
SCALBERT, A.; WILLIAMSON, G. Dietary Intake and Bioavailability of Polyphenols. The Journal of Nutrition, v. 130, n. 8, p. 2073S-2085S, 1 ago. 2000.
SINGLETON, V. L.; ORTHOFER, R.; LAMUELA-RAVENTÓS, R. M. [14] Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. In: Methods in Enzymology: Oxidants and Antioxidants Part A. Academic Press, 1999. v. 299, p. 152-178.
TASIC-KOSTOV, M.; PAVLOVIC, D.; LUKIC, M.; JAKSIC, I.; ARSIC, I.; SAVIC, S. Lactobionic acid as antioxidant and moisturizing active in alkylpolyglucoside-based topical emulsions: the colloidal structure, stability and efficacy evaluation. International Journal of Cosmetic Science, v. 34, p. 424-434, 2012. DOI: 10.1111/j.1468-2494.2012.00732.x.
TRABER, M. G.; ATKINSON, J. Vitamin E, antioxidant and nothing more. Free Radical Biology & Medicine, v. 43, n. 1, p. 4-15, 2007.
VALE, David L. et al. A topical formulation containing quercetin-loaded microcapsules protects against oxidative and inflammatory skin alterations triggered by UVB irradiation: enhancement of activity by microencapsulation. Journal of Drug Targeting, v. 29, n. 9, p. 983-997, 2021. DOI: 10.1080/1061186X.2021.1898621.
VIUDA-MARTOS, M.; RUIZ-NAVAJAS, Y.; FERNÁNDEZ-LÓPEZ, J.; PÉREZ-ÁLVAREZ, J. A. Functional properties of honey, propolis, and royal jelly. Journal of Food Science, v. 73, n. 9, p. 117-124, 2008.
XI, X. et al. The Potential of Using Bee Pollen in Cosmetics: a Review. Journal of Oleo Science, v. 67, n. 9, p. 1071-1082, 1 set. 2018.
YESILTAS, Betul; CAPANOGLU, Esra; FIRATLIGIL-DURMUS, Ebru; SUNAY, Asli E.; SAMANCI, Taylan; BOYACIOGLU, Dilek. Investigating the in-vitro bioaccessibility of propolis and pollen using a simulated gastrointestinal digestion system. Journal of Apicultural Research, v. 53, n. 1, p. 101-108, 2014. DOI: 10.3896/IBRA.1.53.1.10.
