EVALUATION OF THE ACUTE TOXICITY OF DIPYRONE ON THE BIOINDICATOR DAPHNIA MAGNA
REGISTRO DOI: 10.5281/zenodo.8435754
Flávia Caroline Haluch1
Janine de Lima da Penha2
Júlia Adriane Carlos3
João Fernandes Dreher4
Silvia Mara Haluch5
RESUMO
A ocorrência de fármacos no meio ambiente aquático é um assunto importante e de interesse para a comunidade científica. Diversos compostos de origem farmacológica têm sido descartados em grande escala na Natureza. A dipirona é um fármaco derivado pirazolônico não narcótico com efeito analgésico, antipirético e espasmolítico. O paracetamol é um analgésico-antitérmico derivado do p-aminofenol possui ação antipirética e analgésica, porém sua ação anti-inflamatória é baixa, seu mecanismo de ação ainda hoje não é completamente conhecido, no entanto sabe-se que atua preferencialmente no sistema nervoso central inibindo a ciclo-3 oxigenase. O presente estudo avaliou os efeitos tóxicos do paracetamol e dipirona frente ao bioindicador Daphnia magna, largamente utilizado em testes laboratoriais. Dos dados obtiveram o valor aproximado de CE50 de 10 mg.L-1 para ambos os fármacos porém, quando ambos foram expostos em conjunto, a mistura não induziu toxicidade para o bioindicador testado. Dessa forma, é possível observar que o risco toxicológico em que organismos aquáticos estão submetidos pelas concentrações ambientais de fármacos, possuem dinâmicas diferenciadas e que em misturas, o entendimento é mais complexo, devido ao sinergismo e antagonismo. E por esse fato, o impacto nos compartimentos ambientais necessita de novo marco regulatório.
Palavras chaves: Daphnia magna; Dipirona; Paracetamol; Analgésico; Toxicidade.
ABSTRACT
The occurrence of drugs in the aquatic environment is an important issue of interest to the scientific community. Several compounds of pharmacological origin have been discarded on a large scale in Nature. Dipyrone is a non-narcotic pyrazolonic derivative drug with analgesic, antipyretic and spasmolytic effect. Paracetamol is an analgesic-antipyretic derivative of p-aminophenol, it has antipyretic and analgesic action, but its anti-inflammatory action is low, its mechanism of action is still not fully known, however it is known that it acts preferentially in the central nervous system inhibiting cyclo-3 oxygenase. The present study evaluated the toxic effects of paracetamol and dipyrone against the bioindicator Daphnia magna, widely used in laboratory tests. From the data, the approximate EC50 value of 10 mg.L-1 was obtained for both drugs, however, when both were exposed together, the mixture did not induce toxicity for the tested bioindicator. Thus, it is possible to observe that the toxicological risk to which aquatic organisms are submitted by the environmental concentrations of drugs, have different dynamics and that in mixtures, the understanding is more complex, due to the synergism and antagonism. And for this reason, the impact on environmental compartments requires a new regulatory framework.
Keywords: Daphnia magna; Dipyrone; Paracetamol; Analgesic; Toxicity.
1.INTRODUÇÃO
Desde a Revolução Industrial, os avanços tecnológicos alavancaram a economia mundial, porém, o meio ambiente foi largamente impactado com lançamentos de substâncias químicas diversas. (Ferguson, 2017).
Dentre todos os compartimentos ambientais mais impactados com a poluição decorrente do crescimento econômico, destaca-se principalmente a água, devido ser o destino final dos rejeitos produzidos pelas atividades humanas, e onde se encontra o ecossistema aquático que ainda abriga uma grande quantidade de espécies (Kennon, 2017).
Ao chegar aos compartimentos ambientais, os poluentes, na sua grande maioria, os fármacos, constituem os grandes desafios atuais devido ao seu poder de persistência, biodisponibilidade e bioacumulação (Sim et al., 2010; Piedade et al, 2020).
As contaminações químicas de fármacos incluem desde o solo, águas subterrâneas e superficiais, ecossistemas diversos, quando introduzidos, e suas características traduzem em dinâmicas diferenciadas, e afetando diversos organismos de forma um tanto desconhecida (Corcoran, 2010).
O perfil de bioacumulação no ecossistema dos fármacos está sendo discutidas pela Comunidade Científica nesses últimos anos e pouco se sabe acerca da associação dessas duas drogas, assim como seu impacto direto ao meio ambiente e em especial a organismos aquáticos como a Daphnia magna e por isso se justifica para levantamento de dados de práticas laboratoriais a fim de alimentar resultados sobre essas substâncias químicas persistentes no Meio Ambiente. Testes de toxicidade com invertebrados aquáticos fornecem importante suporte na determinação de impactos químicos ao meio ambiente (Gherardi-Goldstein et al., 1990).
Estudos de fármacos e seu impacto na Natureza, além de trazer respostas sobre o comportamento desses poluentes persistentes, traz alinhamento nos primórdios de proteção ambiental e sustentabilidade, segundo às metas dos Objetivos de Desenvolvimento Sustentável – ODS, bem como, modelar o sinergismo ou antagonismos dos mesmos para projetar futuros estudos sobre os mecanismos de adaptação de microrganismos altamente resistentes.
1.1 Os fármacos
A Metamizol, mais conhecida como dipirona (figura 1), é um derivado das pirazolonas, sua síntese veio da necessidade de um derivado com maior capacidade terapêutica e de solubilidade. É utilizado pela sua atividade antitérmica e analgésica (Diogo, 2003).
Figura 1. Ilustração da estrutura molecular da Dipirona. Fonte: Merck (2019).
Segundo alguns levantamentos, a Dipirona pode induzir graves reações como anemias aplásticas, necroses tóxicas e epidérmicas, agranulocitose e síndrome de Stevens-Johnson (SJ) É uma pró-droga cuja metabolização gera a formação de vários metabólitos, dentre eles, dois possuem efeitos analgésicos: 4-metil-aminoantipirina (4-MAA) e 4-amino-antipirina (4-AA). Além da inibição da ciclo-oxigenase, outros mecanismos explicam o efeito antinoceptico, como, a inibição da síntese de prostaglandinas e a dessensibilização dos nociceptores periféricos. Sabe-se que, quando administrada pela via intravenosa, é excretada cerca de 96% e 6% na urina e nas fezes, respectivamente, da dose do fármaco. (ANVISA, 2001).
O acetaminofeno, mais conhecido como paracetamol (figura 2), é um fármaco que pertence à classe dos antinflamatórios não esteroidais (AINEs), apesar de sua classificação, não possui efeito aintinflamatório, apenas analgésico com a inibição da síntese de prostaglandinas e nos reguladores térmicos do sistema nervoso central, ação antipirética. Tem metabolismo hepático e conta com três mecanismos, a conjugação com ácido glicurônico, sulfatação e oxidação (Ernst et al., 2019).
Figura 2. Ilustração da estrutura molecular da Paracetamol. Fonte: Merck (2019).
O paracetamol é metabólito da acetanilida, que produz baixas quantidades de meta-hemoglobina, e fenacetina tendo, assim, atividades analgésicas e antipiréticas similares e, além disso, pode substituir em diversas formulações farmacêuticas pelo fato de ser menos tóxico que fenacetina (Castro, 2013).
De acordo com o Índice Nacional Terapêutico, tanto a dipirona quanto paracetamol, são fármacos indicado para o tratamento sintomático de gripes, constipações ou outras hipertemias infecciosas, cefaleias ligeiras e moderadas, odontalgias, otalgias, dores menstruais (dismenorreia primária), dores pós-traumáticas, reações hiperérgicas da vacinação, dores musculares e articulares (ligeiras e moderadas), e como analgésicos antes e após intervenções cirúrgicas (BRASIL, 2010).
Em adultos a dose terapêutica do Paracetamol varia de 325 a 1000 mg por dia, não podendo exceder 4000 mg. Em crianças a dose deve ser de até 10 mg.kg-1, não podendo ultrapassar o limite de 5 doses por dia. (Goodman et al., 2010).
Sobre a dose da Dipirona, em crianças o recomendado é de 15mg/kg/dose. (Filho, 2003). E em adultos a dose varia entre 10mg/kg (antipirética); 30 mg/kg (analgésica); 50mg/kg (antiinflamatória) (Vale, 2006).
Quanto à hepatotoxicidade do paracetamol, o fármaco é considerado seguro em doses terapêuticas, em casos de superdosagem apresenta variação individual dependendo de metabólitos ativos e outros fatores (foi vista com dose única de 10 a 15 gramas). Em alguns casos, pode apresentar riscos se associados a outros medicamentos (Ataee et al., 2020).
Esses fármacos são lançados ao meio ambiente diariamente em largas escalas, causando impactos ambientais gravíssimos em toda teia alimentar dos ecossistemas, principalmente os organismos aquáticos como fitoplâncton, zooplâncton e Bentos, como exemplo de zooplâncton, a Daphnia magna.
Atualmente existem diversos sistemas de tratamento de esgotos e resíduos, no entanto a maioria apresenta falha ou não realiza o tratamento adequado para substâncias potencialmente consideradas químicas ou tóxicas. A dipirona, assim como o Paracetamol, pode ser maléfica para o ser humano e ao meio ambiente quando utilizados em excesso (Hernando, 2006).
Ecotoxicologia
A Ecotoxicologia pode ser entendida como a junção de ecologia e toxicidade, pois a ecologia é o estudo da interação dos seres vivos entre si e com o meio ambiente em que vivem; e a toxicologia é uma ciência que procura entender os tipos de efeitos causados por substâncias químicas, bioquímicas e os processos biológicos (Ratte, 2003).
Uma alteração que cause um efeito deletério, pode ser responsável por um efeito em um nível trófico, sendo repassado para próximos níveis da cadeia alimentar. O objetivo da ecotoxicologia seria então entender e prever efeitos de substâncias químicas em seres vivos e comunidades naturais (Rogowska, 2020).
Bioindicador Daphnia magna
A Daphnia magna (figura 3) é vulgarmente conhecida como pulga d’água, classificada como no fio Artropoda, subfilo Crustacea, classe Branchiopoda, ordem Diplostraca, subordem Clarocera.
Essa espécie é largamente utilizada em testes ecotoxicológicos, pois esse organismo, apresenta características favoráveis, como o ciclo de vida curto, a alta taxa de fecundidade, reprodução partenogenética, capaz de produzir indivíduos geneticamente idênticos, evitando que as variáveis genéticas interfiram no ensaio, e seu tamanho reduzido (Knie e Lopes, 2004).
Todos estes aspectos tornam a Daphnia magna um excelente bioindicador ecotoxicológico (Koivisto, 1995).
.
Figura 3. Ilustração de espécime de Daphnia magna de 30 dias, microscópio 40x. Fonte: Autores.
A Daphnia magna atua na atua como consumidor primário na cadeia alimentar aquática entre os metazoários, suas pernas torácicas agem como peneiras que retêm partículas, bactérias e pequenas partículas de material orgânico da água. Apresentam tamanho médio de 5 a 6 mm e uma carapaça bivalve transparente que envolve todo o corpo, exceto cabeça e antenas (Knie e Lopes, 2004).
Portanto, o impacto de fármacos nesse organismo, pode trazer respostas acerca do perfil de bioacumulação, biomagnificação, bem como avaliar extinção de espécies, ou modelar sobre interações medicamentosas para prever equações matemáticas, que possam contribuir para estudos de resistência microbiana.
Expressão dos resultados de toxicidade
Os testes de toxicidade permitem determinar valores de Dose Letal (DL) Concentração Letal (CL), Concentração Efetiva (CE), Concentração Inibitória (CI) e Concentração Inibitória Percentual (CIP) (Costa et al., 2008).
Para o presente estudo foi utilizado o programa TKS (Trimmed Spearman-Karber) esse é um método que alinha o cálculo para 95% de confiança para calcular o CE50, que é a concentração efetiva em 50% dos organismos testados (US EPA, 2002).
MATERIAL E MÉTODOS
Obtenção das amostras de fármacos
As amostras de paracetamol e dipirona foram conseguidas na rede pública de saúde para fins de estudos da forma comercialmente utilizada.
Testes de ecotoxicidade
Os testes foram realizados seguindo as condições da Norma ABNT NBR 12713:2016 – Ecotoxicologia aquática – Toxicidade aguda, método de ensaio com Daphina spp (Crustacea, Cladocera), que revela os procedimentos a serem realizados nos testes ecotoxicológicos de biomarcadores aquáticos (ABNT, 2016).
O método se baseia na exposição de neonatos de Daphnia magna às várias diluições de Dipirona e Paracetamol por um período de 48 horas ao escuro.
Após esse intervalo de tempo, observa-se a incapacidade natatória em relação ao branco. Foram realizados alguns testes preliminares e definitivos utilizando béqueres contendo as amostras testes, e posteriormente foram adicionados 10 neonatos de Daphnia magna.
Teste preliminar e definitivo
Para determinar as concentrações de dipirona necessárias para que seja possível observar a inibição do movimento natatório nos bioindicadores foram realizados testes preliminares. O ensaio foi realizado com as seguintes concentrações de dipirona, 1,0 mg.mL-1, 10,0 mg.mL-1, 25,0 mg.mL-1 e 50,0 mg.mL-1.
No segundo teste, foram utilizadas as concentrações, 0,005 mg.mL-1; 0,0025 mg.mL-1; 0,005 mg.mL-1, 0,010 mg.mL-1, 0,020 mg.mL-1, 0,050 mg.mL-1, 0,10 mg.mL-1 e 0,50 mg.mL-1.
No terceiro teste foram realizadas as misturas nas concentrações de 0,005, 0,010 e 0,020 mg.mL-1.
Em cada béquer com volume de 50mL de solução teste e no branco, foram colocados 10 organismos. Os béqueres foram isolados com plástico filme e protegidos da luz através de uma cobertura com folha de alumínio e deixados em uma estufa com temperatura controlada (18-22ºC) no laboratório do minhocário da Universidade Positivo.
Cada concentração foi testada em duplicata e após 48h de exposição, observou-se a presença ou não de movimentos natatórios.
Cultivo e Conservação da Daphnia magna
A Daphnia magna foi cultivada em uma solução de água composta pelo meio básico chamado de M4, ou seja, consta sais essenciais característicos da água natural como cálcio, magnésio, potássio, sódio, acrescentados de traços de vitaminas.
A água utilizada não deve apresentar compostos tóxicos como pesticidas e metais, de forma a não induzir resistência da mesma, e os valores sejam comparados com outros estudos já realizados.
Os testes foram realizados nos laboratórios de química e microbiologia e o minhocário da Universidade Positivo.
Teste de Sensibilidade para Daphnia magna
Os testes de sensibilidade aferem a sensibilidade dos organismos utilizados em testes de toxicidade. De acordo com as normas ABNT NBR 12713 e ISO 6341:2012 substâncias químicas são utilizadas para garantir a validade dos resultados analíticos e a garantia da qualidade (USEPA , 2002).
Nos testes de sensibilidade foi utilizado como substância de referência o reagente comercial dicromato de potássio, com pureza de 99,9%. Para a realização de cada controle foram utilizados testes com concentrações variando de 0,1; 0,2; 0,3; 0,4; 0,5; 0,6 e 0,7 mg.L-1 de dicromato de potássio a fim de obter o valor de CE50 e compor a carta de sensibilidade.
RESULTADOS E DISCUSSÃO
Carta controle
Os valores obtidos de testes com os organismos testes foram avaliados com dicromato de potássio com grau de pureza de 99% e de grau PA (Para Análise). Os valores obtidos podem ser observados na figura 4.
Figura 4. Carta controle com dicromato de potássio como referência. Fonte: Autores (2019).
Pelos dados observados da carta controle, os aspectos se apresentaram válidos, pois não ocorreu tendência da dispersão dos dados e não houve sete dados consecutivos tendenciosos.
Ensaios de Toxicidade de Soluções Aquosas de Dipirona e Paracetamol
O primeiro teste foi observado que em todas as concentrações os bioindicadores foram afetados, incluindo o controle. Isso ocorreu, pois a preparação das soluções testes, foram realizadas no laboratório de química, onde ocorreu muitas práticas laboratoriais, e dessa forma, ocorreu contaminação do local, fazendo a repetição do procedimento.
Em uma segunda etapa, os testes foram de 0,005; 0,010; 0,020; 0,050; 0,1 e 1,0 mg.mL-1. Ao final das 48 horas, os valores de concentrações que induzem algum efeito deletério acima de 10% da população foi acima de 0,010 mg.mL-1 e para tanto, esta foi usada como base para o estudo.
Ensaio definitivo
No segundo teste, primeiramente foram testados separadamente o Paracetamol e a Dipirona com concentrações de 0,005 mg.mL-1 ,0,010 mg.mL-1 e 0,020 mg.mL-1. Em ambos os fármacos foi observado toxicidade a partir da segunda concentração. Em seguida houve a associação com diferentes concentrações, foi possível observar a incapacidade natatória em concentrações de 0,010 mg.mL-1 de ambos os e concentrações alternadas de 0,010 mg.mL-1, 0,005 mg.mL-1 e 0,020 mg.mL-1 de cada uma das substâncias. A tabela 1 representa esquematicamente os dados brutos dos ensaios realizados em duplicata (A e B).
Tabela 01: Resultados dos testes definitivos.
Testes MORTES -A MORTES -B MEDIA Branco 0 0 0 Paracetamol – P Paracetamol0,005 mg.mL-1 0 0 0 Paracetamol0,010 mg.ml-1 3 3 3 Paracetamol0,020 mg.mL-1 10 10 10 Dipirona- D Dipirona0,005 mg.mL-1 0 0 0 Dipirona0,010 mg.mL-1 5 4 4,5 Dipirona0,020 mg.mL-1 10 10 10 Misturas Dipirona (0,010) + Paracetamol (0,005)mg.mL-1 1 0 1 Dipirona (0,005) + Paracetamol (0,005)mg.mL-1 0 0 0 Dipirona (0,010) + Paracetamol (0,010)mg.mL-1 2 2 2 Dipirona (0,005) + Paracetamol (0,010)mg.mL-1 0 0 0 Dipirona (0,010) + Paracetamol (0,020)mg.mL-1 2 1 1,5 Dipirona (0,020) + Paracetamol (0,005)mg.mL-1 2 2 1,5
Fonte: Autores
Estatísticas dos dados obtidos.
Pelos dados dos testes da tabela 01 e usando o programa TSK, os valores da concentração efetiva em 50% para o paracetamol é de CE50 = 0,010 ± 0,01 mg.mL-1 (10 ± 1 mg.L-1) e para a dipirona CE 50 = 0,010 ±0,02 mg.mL-1 (10 ± 2 mg.L-1).
Plotando os dados do teste agudo contendo paracetamol, é possível observar que o resultado demonstra uma curvatura de resposta aguda pelo bioindicador, conforme figura 5A e do fármaco dipirona figura 5B.
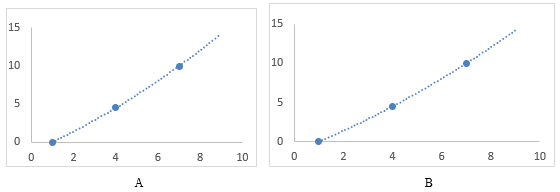
Figura 5. A: Gráfico dose x resposta de Paracetamol. B: Fonte: Gráfico dose x resposta de Dipirona
Fonte: Autores (2019).
Utilizando o programa Statistic para verificar a ocorrência de dados significativos e garantir que os valores de confronto com outros autores, tanto dos fármacos testados em separados, quanto em misturas. A seguir, a tabela 02 de dados obtidos das médias e sua significância.
Tabela 02: Resultados obtidos pelo teste estatístico.
Teste Valores obtidos – estatística Branco – B 0 a Paracetamol (P)- 0,005 mg.ml-1 0 a Paracetamol (P)- 0,010 mg.ml-1 3b Paracetamol(P) – 0,020 mg.ml-1 10d Dipirona (D) – 0,005 mg.mL-1 0 a Dipirona (D) – 0,010 mg.mL-1 5c Dipirona (D) – 0,020 mg.mL-1 10d Dipirona (0,010) + Paracetamol (0,005) mg.mL-1 1b Dipirona (0,005) + Paracetamol (0,005) mg.mL-1 0a Dipirona (0,010) + Paracetamol (0,010) mg.mL-1 2b Dipirona (0,005) + Paracetamol (0,010) mg.mL-1 0a Dipirona (0,010) + Paracetamol (0,020) mg.mL-1 2b Dipirona (0,020) + Paracetamol (0,005) mg.mL-1 2b
Fonte: Autores
Pelos dados estatísticos, o grupo de dados do branco, Paracetamol 0,005 mg.mL-1, Dipirona 0,005 mg.mL-1, Dipirona (0,005) + Paracetamol (0,005) mg.mL-1, Dipirona (0,005) + Paracetamol (0,010) mg.mL-1 não apresentaram diferenças significativas, com médias 0. Porém, esse grupo apresentou diferenças significativas com o grupo das médias entre 2 e 3 temos o Paracetamol 0,010 mg.mL-1, Dipirona (0,010) + Paracetamol (0,005) mg.mL-1, Dipirona (0,010) + Paracetamol (0,010) mg.mL-1 e Dipirona (0,010) + Paracetamol (0,020) mg.mL-1.
A dipirona 0,010 mg.mL-1, apresentou diferenças significativas dos demais com média de 5 organismos, enquanto Paracetamol 0,020 mg.mL-1 e Dipirona 0,020 mg.mL-1, apresentaram médias de 10 organismos testes e diferem significativamente de todos os demais.
Com esses resultados, é possível mensurar, que os fármacos misturados ficam inibidos, ou seja, ocorre antagonismo químicos entre as duas substâncias, portanto, quando ambos os fármacos estão juntos, é inibido o efeito deletério aos organismos aquáticos.
Figura 6. Gráfico de similaridade dos testes realizados. Fonte: Autores (2019)
Através da figura 6, que representa um teste estatístico de similaridade entre os grupos, podemos observar que a Dipirona e Paracetamol, ambos de concentrações de 0,020 mg.mL-1, formam um grupo que diferem dos demais.
Dessa forma, também podemos observar que os compostos ao serem misturados possuem uma ação antagonista, ou seja, por algum fenômeno, ocorreu uma ação inibitória da toxicidade.
Resultados Obtidos e comparação com estudos já realizados
Os dados obtidos neste estudo constatam que as doses farmacológicas utilizadas por humanos são consideravelmente maiores em comparação ao valor CE50 encontrado em testes laboratoriais. Deve-se considerar que organismos humanos possuem enzimas responsáveis por degradar os fármacos estudados, ao contrário dos indivíduos utilizados nos ensaios.
A tabela 03 exibe dados de trabalhos relacionados ao presente estudo, possibilitando a comparação dos resultados e enfatizando a necessidade de uma postura mais vigorosa a respeito da utilização indiscriminada dos fármacos estudados.
Tabela 03: Estudos de Paracetamol e Dipirona encontrados por alguns autores
Autores Bioindicador Reporte de resultado Valor encontrado Machado et al., (2017) C. silvestrii CL50 (48h)Agudo Paracetamol: 25 μg.mL-1
Diclofenaco de sódio: 41,88 μg.mL-1.Kim et al., (2012) Daphnia magna CE50 (48h)Agudo Paracetamol: 11,85 mg.L-1 Kühn et al.,(1989) Daphnia magna CE50 (48h)Agudo Paracetamol: 9,2 mg.L-1 Almeida (2015) Molusco bivalve (mexilhão) Perna perna. CL50 (48h)Crônico Paracetamol: 20,58 mg.L-1 Kim et al., (2007)
Daphnia magnaCE50 (48h)Agudo Paracetamol: 39,9 mg.L-1 Santos et al., (2010) Daphnia magna CE50 (48h) Paracetamol: 30,1 mg.L-1 Pino et al., (2015) Eisenia foetida LC50 Paracetamol: 693,5 mg.kg-1 Mortalidade. Carballeira et al., (2012) Diatomácea marinha Phaeodactylum tricornutum. CL50(48h) Paracetamol: 265,8 mg.L-1 Garcez et al., (2018) Artemia salina CL50(24h) Dipirona: 1000 µg.mL-1
Fonte: Autores (2019)
Segundo Santos et al. (2010), os medicamentos são excretados por mecanismos antropogênicos, principalmente pela urina e fezes. Durante o processo de metabolização dos fármacos podem ocorrer modificações nas moléculas originais como, por exemplo, oxidação, redução, hidrólise ou conjugação. Uma vez metabolizados e excretados, os compostos podem ser transportados do esgoto até o tratamento de água que será consumida pela população. Além desse fator, há também, a possibilidade do alcance desses compostos por meio da utilização de estrumes e fertilizantes, estes contendo fezes de animais previamente medicados. Ademais a contaminação direta do solo, deve-se considerar a possibilidade do escoamento pelas chuvas contaminando as águas da superfície e subterrâneas.
A maior parte da população faz o descarte dos medicamentos no lixo doméstico, isto porque não existe conscientização sobre a forma correta de se desfazer dos fármacos. (Alavarenga, 2010).
Estes fatos justificam a preocupação com a crescente pesquisa direcionada à presença desses compostos no meio ambiente e ao impacto que esse fenômeno pode acarretar a saúde.
Levando em consideração todos esses fatores apontados por vários autores com relação à contaminação do ecossistema, fica evidente a necessidade de uma legislação mais rígida para que não ocorra a ingestão indireta de fármacos pela população.
De acordo com Kim et al. (2007), o valor obtido no estudo foi de CE50 (48h) de 39,9 mg.L-1. Kim et al (2012) aponta que valores acima de 9 mg.L-1 de paracetamol apresentam toxicidade aguda para Daphnia magna e Kühn et al. (1989), na execução do estudo não foi notado efeito deletério significativo até a concentração e 10 mg.L-1 .
Segundo Santos et al. (2010), a concentração de Paracetamol encontrada nos lençóis freáticos dos Estados Unidos foi de 30,1 mg.L-1 em sua concentração mais alta. Além disso, também foi apontando que em Taiwan a concentração em efluentes hospitalares e de instalações farmacêuticas foi de 26,6 mg.L-1, no mesmo bioindicador, este resultado foi reportado com 96 horas.
Garcez et al. (2018), encontrou o valor de CL50(24h) ≤ 1000 µg.mL-1 para a Dipirona genérica no mesmo bioindicador. Carballeira et al. (2012), avaliou através de bioensaios de toxicidade a malformação de larvas de ouriço do mar em águas e sedimentos possivelmente contaminadas com diferentes substâncias. Dentre as classes de ouriço do mar avaliadas, foi possível observar que determinadas substâncias como pesticidas, alguns fármacos, anti-incrustante e desinfetantes são capazes de causar malformações no esqueleto durante o desenvolvimento embrionário destes organismos.
Pino et al. (2015), testou 18 fármacos (4 antinflamatórios não esteroidais, 6 betabloqueadores, 3 antibióticos,5 hipolipemiantes), sendo que todos os AINES causaram toxicidade no bioindicador Eisenia fetida com valores de CL50 de 693,50 à 64,80 mg.kg-1. Os compostos mais tóxicos para essa espécie de minhoca foram: ibuprofeno em primeiro lugar, diclofenaco, ácido salicílico e paracetamol. De acordo com esse estudo foi possível observar que o Paracetamol exibiu toxicidade aguda no organismo estudado, porém esta é inferior à apresentada com diclofenaco e ibuprofeno.
Apesar da eficácia da Dipirona como analgésico e antipirético, países como, por exemplo, os Estados Unidos e Reino unido baniram seu uso devido ao risco do desenvolvimento de doenças hematológicas como, a mais frequente, agranulocitose (Magni, 2007).
É preciso levar em consideração, que o uso contínuo e a ausência de legislação própria, podem levar a um processo de poluição e bioacumulação, podendo gerar impacto ambiental na cadeia alimentar por conta do demasiado processo de poluição.
Estudos ecotoxicológicos devem ser realizados para apurar efeitos ambientais causados em médio e longo prazo, investigando, assim, o risco ambiental causado pelo uso intensivo de fármacos. Entretanto, essas pesquisas ainda são de baixa ocorrência (Kennon, 2017).
Considerando que os fármacos são micropoluentes resistentes, é preciso que ocorra a discussão abordando a reutilização de águas tratadas levando em consideração a prática sustentável e necessária. (Moreira et al., 2013).
No Brasil, ainda há muitas limitações quando o assunto é a quantificação de micropoluentes nas águas (Raimundo, 2011).
Tendo em vista tudo que foi evidenciado no presente estudo, deve-se dar continuidade às pesquisas sobre a ecotoxicidade causada por fármacos e outros fatores que podem causar sinergismo e antagonismo.
AGRADECIMENTOS
Agradecemos a Navelab Comércio de Produtos para laboratórios pelo financiamento da publicação desse artigo.
CONCLUSÃO
Com o presente estudo, foi possível demonstrar que nem sempre os fármacos resultam em aumento de efeitos deletérios nos ecossistemas aquáticos, podendo agir de forma antagonista.
As dinâmicas que ocorrem em relação ao antagonismo entre os dois fármacos estudados, ou seja, os efeitos tóxicos dos mesmos foram inibidos. Porém, ocorrem muitas evidências de que substâncias químicas ao interagirem, são potencializadas e pouco se sabe sobre esses fatores nos diversos compartimentos ambientais.
O resultado obtido também enfatiza o fato de que é necessário novo marco regulatório das legislações vigentes, visando à introdução de novas substâncias químicas, largamente disseminada como os fármacos e outros poluentes persistentes nas tabelas de valores máximos permitidos.
É prudente, portanto, uma continuidade das pesquisas nos modelos de ecotoxicidade, ou seja, uso de bioindicadores ambientais para observação e efeitos de bioacumulação e de outros impactos de fármacos, para a averiguação da dinâmica acerca de resistência microbiana e mecanismos de adaptação nos meios aquáticos.
REFERÊNCIAS
ABNT. NBR 12713. Aquatic ecotoxicology-Acute toxicity-Test with Daphnia spp (Cladocera, Crustacea) Ecotoxicologia aquática-Toxicidade aguda-Método de ensaio com Daphnia spp (Crustacea, Cladocera). p. 27, 2016.
ALVARENGA, L.S.V.; NICOLETTI, M.A. Descarte Doméstico de Medicamentos e Algumas Considerações Sobre o Impacto Ambiental Decorrente. Revista Saúde, 4(3) 2010.
ANVISA. Painel Internacional de Avaliação da Segurança da Dipirona, Brasília, 24 jul. Ministério da Saúde. 2001. Acesso em: 25/04/2019. 2001.
ATAEE,P.; KARIMI, A.; EFFEKHARI, K. Hepatic Failure following Metronidazole in Children with Cockayne Syndrome. Case Reports in Pediatrics, 2020, ISSN: 2090-6803 ; E-ISSN: 2090-6811 ; DOI: 10.1155/2020/9634196 ; PMCID: 7008298
BRASIL. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Assistência Farmacêutica e Insumos Estratégicos. Relação Nacional de Medicamentos Essenciais: RENAME. 7. ed. Brasília: Ministério da Saúde, 2010
CASTRO, G. L. G. et al. Uso de benzodiazepínicos como automedicação: consequências do uso abusivo, dependência, farmacovigilância e Farmacoepidemiologia. Revista Interdisciplinar, v. 6, n. 1, p. 112-123, 2013.
CAVALCANTE, Ana Amélia et al. Avaliação da toxicidade, citotoxicidade, mutagenicidade e genotoxicidade da dipirona sódica e do paracetamol em células meristemáticas de raízes de Allium cepa. Boletim Informativo Geum, v. 6, n. 4, p. 7-15, 2015.
CARBALLEIRA, C.; RAMOS –GÓMEZ, J.; MARTIN-DIAZ, L. DELVALLS, T. Identification of specific malformations of sea urchin larvae for toxicity assessment: Application to marine psiculture effluents. Marine Environmental Research. 2012 Archives of Environmental Contamination and Toxicology 63(2):249-61 · May 2012 Reads DOI: 10.1007/s00244-012-9769-0
CORCORAN, J., Winter, M. J & Tyler, C. R. (2010). Pharmaceuticals in the aquatic environment: A critical review of the evidence for health effects in fish. Crit. Rev. Toxicol. 40, 287-304
DIOGO, A. Dipirona: Segurança do Uso e Monitoramento da Qualidade de Comprimidos Orais. Dissertação (Mestrado em Vigilância Sanitária: Ensino Superior). 89p. Rio de Janeiro. INCQS/FIOCRUZ, 2003.
ERNST, A.; BRIX, N.; LAURIDSEN, L.L.B.; OLSEN, J.; PARNER, E.T.; LIEW, Z.; OLSEN, L.H.; RAMLAU, C.H.H. Acetaminophen (Paracetamol) Exposure During Pregnancy and Pubertal Development in Boys and Girls From a Nationwide Puberty Cohort. American Journal of Epidemiology, 2019, Vol. 188(1), pp.34-46 . 2019.
FERGUSON, D. C. Principles of Pharmacodynamics and Toxicodynamics. [s.l.] Elsevier Inc., 2017.
FILHO, Luciano A. P. Dipirona em Crianças Dose Antitérmica Utilizada pelas Mãe. Rev Med Minas Gerais; 13(2):97-9. 2003
GARCEZ, B. B. D. et al. Toxicidade Aguda da Dipirona Sódica in vitro Utilizando o Bioindicador de Toxicidade Artemia salina Leach. Revinter, v. 11, n. 02, p. 114-119, jun. 2018
Gherardi-Goldstein. Testes de Toxicidade com Daphnia magna: Uma Ferramenta para a Avaliação de um Reator Experimental UASB (1990).
GOODMAN, L.S.G. Risco de hepatotoxicidade do Paracetamol. Revista Brasileira de Farmácia 93 (4) 411-414, agos.2012
HERNANDO, M. D.; MALATO, O.; FARRÉ, M.; FERNANDEZ-ALBA, M.; BARCELÓ, D. Application of ring study: Water toxicity determinations by bioluminescence assay with Vibrio fischeri, Talanta. v. 69, p.370-376, 2006
ISO. ISO 6341. Water quality — Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) — Acute toxicity test. 2012.
KENNON_MCGILL, S.; MCGILL, M. Extrahepatic toxicity of acetaminophen: critical evaluation of the evidence and proposed mechanisms. Journal of Clinical and Translational Research, v. 3, n. 3, p. 501–526, 2017.
KNIE, J., L., W.; LOPES, E., W.,B. Testes ecotoxicológicos: métodos, técnicas e aplicações. Florianópolis: FATMA/GTZ, 2004
KOIVISTO, S. ‘Is Daphnia magna an ecologically representative zooplankton species in toxicity tests’, Environmental Pollution. Elsevier, pp. 263–267. doi: 10.1016/0269-7491(95)00029-Q. 1995.
MAGNI, A. M. et al. Efeito Antipirético e Tolerabilidade do Ibuprofeno versus a Dipirona, em Dose Oral Única, em Pacientes Pediátricos Estudo Aberto, Randomizado, Multicêntrico Brasileiro. Pediatria Moderna, 2007.
MERCK. Catálogo oficial de substâncias químicas – reagentes químicos, 2019.
MOREIRA, J. C; GONÇALVES, E.S. Contaminantes Emergentes. Revista de Química Industrial. 738: 6-13. 2013
PIEDADE, F.; BIO, S.; NUNES, B. Effects of common pharmaceutical drugs (paracetamol and acetylsalicylic acid) short term exposure on biomarkers of the mussel Mytilus spp. Environmental Toxicology and Pharmacology, January 2020, Vol.73 ISSN: 1382-6689 ; E-ISSN: 1872-7077 ; DOI: 10.1016/j.etap.2019.103276
PINO, M. R., Val, J., Mainar, A. M., Zuriaga, E., Español, C & Langa, E. Acute toxicological effects on earthworm Eisenia foetida of 18 common pharmaceuticals in artificial soil. Sci. Total Environ. 518-519, 225-337. 2015.
RAIMUNDO, C., M. Contaminantes emergentes em água tratada e seus mananciais: sazonalidade, remoção e atividade estrogênica. Universidade Estadual de Campinas, Instituto de Química, p.203, 2011. Revista USP. São Paulo, n 70, p 24-35, agosto 2005.
ROGOWSKA, J. Micropollutants in treated wastewater. Ambio, Feb 2020, Vol.49(2), pp.487-503 ISSN: 00447447 ; E-ISSN: 16547209 ; DOI: 10.1007/s13280-019-01219-5
RUPPERT, E.E.; BARNES, R.D. Zoologia dos invertebrados. 6.ed. São Paulo: Roca, 1996. 1029p.
SANTOS, L. H. et al. Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment. Journal of Hazardous Materials, v. 175,n. 1-3, p.45-95, 2010.
RATTE, H., T.; HAMMERS-WIRTZ, M.; CLEUVER, M. Bioindicators and Biomonitors. Elsevier Science Ltd, v. 6, p. 305–307, 2003.
SIM, W., J.; LEE, J.,W.; OH, J.,E. Occurrence and fate of pharmaceuticals in wastewater treatment plants and rivers in Korea. Environmental Pollution, 2010.
VALE, Nilton. Desmistificando o Uso da Dipirona. Medicina perioperatoria, p. 1107-1123, 2006.
US EPA – Environmental Protection Agency. EPA-821-R-02-012. Short-term methods for estimating the acute toxicity of effluents and receiving waters to freshwater and marine organisms. 5 th Ed. U.S. Environmental Protection Agency. Office of Water, Washington, DC. 2002.
1Estudante de Biomedicina da UPP – Universidade Pequeno Príncipe. Microbiologista, toxicologista e Gerente da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
2,3 Biomédicas formadas pela Universidade Positivo.
4Químico e estudante de Engenharia ambiental. Sócio-gerente da Navelab Produtos para Laboratórios. joaodreher@gmail.com
5Mestre em Ciências, Biomédica, Química e Biotecnologista. Pesquisadora e Consultora da Goldlab Ciência e Tecnologia Ltda. Goldlablaboratorios@gmail.com
