Evaluation of Immunomodulatory Activity of Ganoderma lucidum in Elderly
REGISTRO DOI: 10.69849/revistaft/th10249242013
Patricia Nancy Iser Bem
Orientadora: Prof. Dra. Renata Gorjão
RESUMO
O envelhecimento promove alterações do equilibrio imunológico levando à imunosenescência. O Ganoderma lucidum pode amenizar algumas alterações fisiológicas decorrentes da idade, promovendo um reestabelecimento da resposta imunológica. Muitos estudos têm investigado os componentes isolados de Ganoderma tais comopolissacarídeos, tripterpenos e proteínas. No entanto, poucos estudos têm demonstrado o efeito sinérgico deste cogumelo como um todo. Desta forma, o objetivo deste trabalho foi investigar os efeitos da suplementação com Ganoderma lucidum na função de linfócitos de idosas. O trabalho foi dividido em duas etapas: 1) suplementação de 25 idosas com 1500 mg por dia de Ganoderma contendo 58,40% de β-glucanos totais e 25 com 1500 mg de amido (placebo) (Grupo 1= projeto piloto); 2) suplementação de 30 idosas com 2000 mg por dia de Ganoderma contendo 52,83% de β-glucanos totais e 30 com placebo(Grupo 2). O estudo foi realizado na forma de duplo-cego. No Grupo 1, finalizaram o estudo 11 idosas em cada grupo e no Grupo 2 finalizaram o estudo 23 idosas no grupo Ganoderma e 16 no Placebo. Foi realizada a avaliação das medidas antropométricas e de composição corporal e coleta de sangue venoso antes e após 8 semanas de suplementação. Foram avaliados marcadores de toxicidade hepática e renal, concentração plasmática de lipídios, e glicemia em jejum. Também foi realizada a análise do hemograma. Os linfócitos totais foram isolados e posteriormente avaliados a expressão de CD28+; o perfil de citocinas (TNF-α, IL-2, INFɣ, IL-6, IL-17, IL-10 e IL-4) no sobrenadante em cultura na presença de PHA por citometria de fluxo. No estudo do Grupo 1, não observamos alteração de lipídios plasmáticos em nenhuma das condições experimentais. Observamos redução de transaminase glutâmico-oxalacética (TGO) e creatinina no grupo Ganoderma e um aumento em transaminase glutâmico-pirúvica (TGP). Na avaliação da capacidade proliferativa e expressão de CD28+ não observamos diferenças significativas. Para a análise de secreção de citocinas observamos redução de IL-10 no grupo Ganoderma e aumento de IL-17 em ambos os grupos, mas sem diferenças entre Placebo e Ganoderma no período pós. No estudo do Grupo 2, não observamos diferenças nas análises referentes ao hemograma, parâmetros bioquímicos e expressão de CD28+ na presença de ConA, mas observamos aumento da proliferação na presença de ConA para o grupo Ganoderma. Na avaliação de expressão gênica dos linfócitos, observamos aumento para FoxP3, TGFβ, IL-10, IL-6, RORɣ, GATA-3 e INFɣ no grupo Ganoderma. O resultados sugerem efeito positivo na função de linfócitos Treg de idosos com redução da secreção de citocinas de perfil Th1, Th2 e Th17 na presença de ConA. Na presença de ionomicina e PMA Ganoderma promoveu redução da porcentagem de células Th17+, aumento da porcentagem de Th2+ e redução na média de fluorescência para expressão de INFɣ (Th1) e IL4 (Th2), o que sugere um perfil anti-inflamatório para o composto.
Palavra-chave: Lingzhi, linfócitos T, imunomoduladoção, idosos.BEM, P.N.I.
ABSTRACT
Aging promotes immune balance changes leading to immunosenescence. Ganoderma lucidum may attenuate some physiological changes promoted by aging, leading to a reestablishment of the immune response. Many studies have demonstrated the effects of isolated components of Ganoderma such as polysaccharides, triterpenes and proteins. However, few studies have shown the synergistic effect of this mushroom as a whole. Thus, the objective of this work was to investigate the effects of Ganoderma lucidum supplementation on the function of lymphocytes in elderly woman. The study was divided into two stages: 1) supplementation of 25 elderly with 1500 mg per day of Ganoderma containing 58.40% of total β-glucans and 25 with 1500 mg of starch (placebo) (Group 1 = pilot project); 2) supplementation of 30 elderly with 2000 mg per day of Ganoderma containing 52.83% of total β-glucans and 30 with placebo (Group 2). The study was performed as double blind protocol. In Group 1, finalizing the study 11 elderly women in each group and in Group 2 finalize the study 23 elderly in the Ganoderma group and 16 in the Placebo. Anthropometric and body composition measurements and venous blood collection were performed before and after 8 weeks of supplementation. Liver and renal toxicity markers, lipase, plasma lipid concentration, and fasting glucose were evaluated. Blood count analysis was also performed. Total lymphocytes were isolated and subsequently CD28+ expression and cytokine profile (TNF-α, IL-2, IFNɣ, IL-6, IL-17, IL-10 and IL-4) in culture supernatant were analyzed in the presence of PHA by flow cytometry. In Group 1, we did not observe changes in plasma lipids in any of the experimental conditions. We observed a reduction in TGO and creatinine in the Ganoderma group and an increase in TGP. In the evaluation of proliferative capacity and CD28+ expression we did not observe significant differences. For cytokine secretion analysis we observed a reduction in IL-10 in the Ganoderma group and an increase in IL-17 in both groups, but without differences between Placebo and Ganoderma in the post period. In the Group 2 study, we did not observe differences in the analysis of blood count, biochemical parameters and CD28+ expression in the presence of ConA but we observed increased proliferation in the presence of ConA for the Ganoderma group. In the evaluation of lymphocyte gene expression, we observed increase for FoxP3, TGFβ, IL-10, IL-6, RORɣ, GATA-3 and IFNɣ in the Ganoderma group. The results suggest a positive effect on Treg lymphocyte function in elderly with reduced secretion of Th1, Th2 and Th17 profile cytokines in the presence of ConA. In the presence of ionomycin and PMA Ganoderma promoted a reduction in the percentage of Th17+ cells, an increase in the percentage of Th2+ and a reduction in fluorescence average of IFNɣ (Th1) and IL4 (Th2) suggesting an anti-inflammatory profile for the compound.
Keyword: Lingzhi, T lymphocytes, immunomodulation, elderly.
1.0 INTRODUÇÃO
1.1 Epidemiologia do envelhecimento
O envelhecimento é entendido como um processo inerente ao organismo de um indivíduo. Esse processo é progressivo, acumulativo, não reversível e não patológico. Neste processo, o indivíduo torna-se frágil e, perde a capacidade de responder aos estímulos de estresse (Saúde et al., 2006; Saúde, 2018).
O envelhecimento natural no contexto da saúde pública é definido como senescência. Possui como característica alterações orgânicas tais como morfológicas e funcionais. No processo do envelhecer não patológico, ocorre o aumento da fragilidade e vulnerabilidade do indivíduo. Já a senilidade é conhecida como um envelhecimento patológico, cujas modificações são caracterizadas por afecções que com frequência acometem indivíduos idosos, ou seja, envolve processos degenerativos associados a doenças crônicas (Papaléo Netto et al., 2005).
De acordo com o levantamento da Organização das Nações Unidas O.N.U, 2018 (Nações Unidas no Brasil), o número de pessoas idosas no mundo é crescente.
Estima-se que em 2050, indivíduos com idade superior a 60 anos chegarão a 2 bilhões (22% da população global), número muito superior aos 900 milhões já registrados no ano de 2015. Isto significa que, em 2050, uma em cada cinco pessoas no mundo será idosa (W.H.O., 2017).
Baseado neste novo cenário, que mostra aumento da expectativa de vida também em países menos favorecidos economicamente, a Organização Mundial da Saúde (W.H.O., 2017) tem direcionado suas recomendações e novas diretrizes pautadas em modelos que possam atender essa nova realidade. Em 2017, a Organização Mundial de Saúde (W.H.O., 2017) publicou um documento intitulado como Guidelines on Integrated Care for Older People, que traz novas recomendações sobre o cuidado integral à pessoa idosa.
De acordo com a Organização mundial de Saúde, 80 % dos idosos viverão em países de baixa ou média renda. No Brasil, de acordo com dados do Instituto Brasileiro de Geografia e Estatística (IBGE), (Estatística, 2018), o número de pessoas idosas passou de 12,8% para 14,4% entre os anos de 2012 e 2016. Considerando que em 2016 existia uma população residente de 205,5 milhões de pessoas, estes dados revelam crescimento na população idosa de 16%, o que representa um salto no número de 25,5 milhões em 2012 para 29,6 milhões em 2016 desta faixa etária. O IBGE também apontou redução de 4,7% na população residente na faixa etária entre 0 a 9 anos (14,1% para 12,9%). Estes dados apresentam similaridade com as observações apontadas pela OMS em 2017 (W.H.O., 2017).
O envelhecimento populacional no Brasil tem ocorrido em virtude de dois fatores importantes, a transição demográfica e epidemiológica. A transição demográfica é decorrente da redução na taxa de fecundidade e mortalidade com consequente aumento da expectativa de vida. Em consequência disto, ocorre o fenômeno de transição epidemiológica, caracterizada pela redução de mortalidade por doenças infecto-parasitárias (como tuberculose, por exemplo), aumento das doenças crônico-degenerativas e maior acesso à medicamentos pela população. De modo geral, tanto a transição demográfica quanto a epidemiológica são justificadas pelo processo de urbanização, industrialização, maior renda, educação e maior acesso à tecnologias em saúde (medicamentos) (Papaléo Netto et al., 2005).
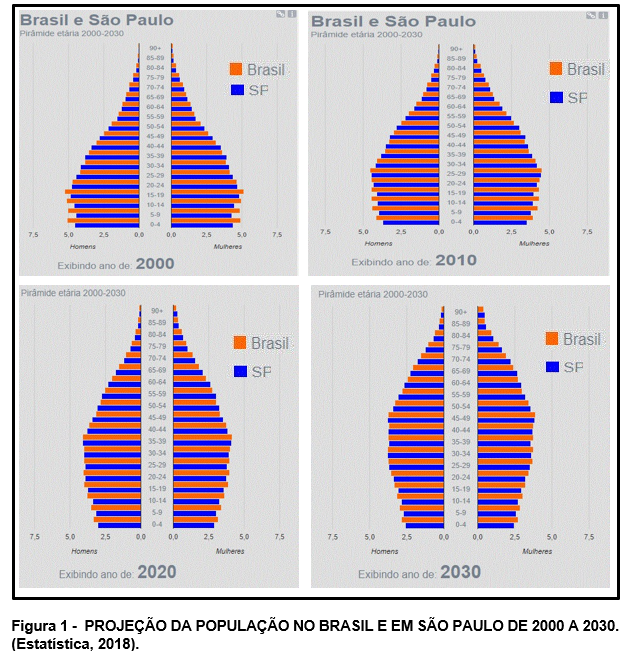
A alteração do perfil populacional no Brasil pode ser observada na Figura 1 da pirâmide etária da população no Brasil e em São Paulo, além da Figura 2, apresentadas a seguir, disponíveis no site de projeção de população do IBGE (Estatística, 2018). Considerando que a população idosa no mundo para 2025 irá crescer em proporção, dezesseis vezes mais em comparação ao crescimento populacional total que será de cinco vezes, é natural a crescente preocupação e destaque sobre esse tema (Papaléo Netto et al., 2005).
A Figura 1, mostra o envelhecimento da população no Brasil e em São Paulo. A cada década (2000-2030), observa-se estreitamento na base ao passo de discreta expansão no pico dessa pirâmide (população idosa), chamada de inversão da pirâmide etária. Este fenômeno tem ocorrido não somente no Brasil, mas no mundo também. Essa alteração do perfil populacional pode ser justificada por maior expectativa de vida em função do maior acesso a tecnologias em saúde (medicamentos), educação, maior renda, industrialização e urbanização.
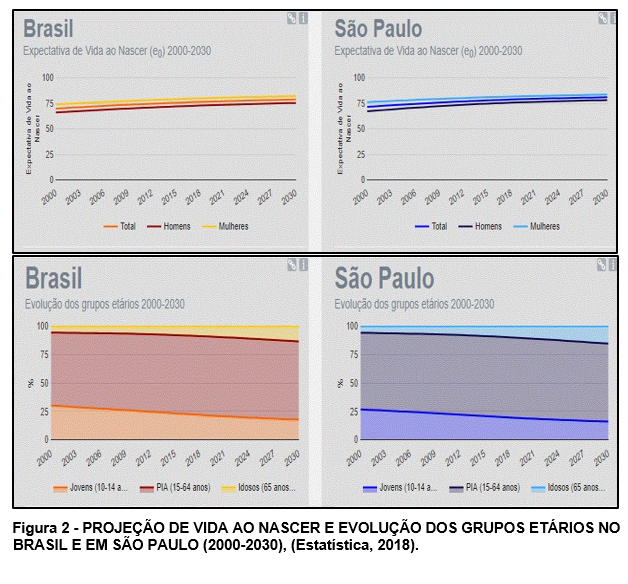
Deste modo, parte destas mudanças podem ser observadas na Figura 2 onde visualizamos a projeção do envelhecimento no Brasil e em São Paulo a evolução de grupos etários de 2000 a 2030. O gráfico de projeção de expectativa de vida ao nascer (2000-2030) mostra discreto aumento da expectativa de vida da população do sexo feminino para o Brasil (82 anos), enquanto que para o estado de São Paulo, a expectativa é de 83,54 anos. Na projeção da evolução dos grupos etários do Brasil e São Paulo (2030), observa-se evidente aumento da população com idade superior a 65 anos. O aumento dessa faixa etária da população no Brasil é semelhante ao último relatório sobre o idoso apontado pela OMS, em 2017. Isto mostra que a inversão da pirâmide etária acontece não só no Brasil, mas em outros países em desenvolvimento
Como descrito anteriormente, o fenômeno de transição epidemiológica é caracterizado pelo aumento das doenças crônico-degenerativas, muitas das quais também podem estar associadas a fatores genéticos, modificações epigenéticas, alimentação inadequada, bem como ao sedentarismo, levando à obesidade, diabetes mellitus, dislipidemias dentre outras. Muitas destas alterações podem levar a mudanças no processo de controle do sistema imune, favorecendo a ocorrência de algumas patologias.
1.1 Envelhecimento e resposta imune
Com o envelhecimento, ocorre uma diminuição do equilíbrio imunológico e este processo está relacionado com importantes alterações corporais, pois observase aumento de gordura abdominal, com característica de inflamação local, decorrente da liberação de algumas adipocinas (Hughes et al., 2002). Boa parte dos estudos demonstra maior produção de citocinas pró-inflamatórias em idosos (Kritchevsky et al., 2005; Larbi et al., 2011; Lim et al., 2014). Isso ocorre em virtude de uma resposta exagerada a estímulos. Desta forma, faz-se imprescindível compreender o processo de ativação e diferenciação celular envolvidos com a resposta imune.
Nesta fase, encontramos aumento da expressão de citocinas próinflamatórias, processo também conhecido recentemente como inflammaging. O processo de inflammaging é uma condição característica da imunossenescência. Com a perda da capacidade de equilíbrio no sistema imune (imunossenescência), ocorre o desequilíbrio entre mediadores pró e anti-inflamatórios, com consequente aumento de citocinas pró-inflamatórias (inflammaging). Esta alteração fisiológica, é decorrente da resposta exagerada a estímulos ao mesmo tempo em que acontece falha na produção de mediadores anti-inflamatórios por diminuição da função do sistema imune com comprometimento das células T reguladoras (linfócitos T Reg) (Fulop et al., 2016).
No processo fisiológico normal, na presença de microrganismos é fundamental a proliferação dos linfócitos. Porém, o desequilíbrio neste processo pode levar ao desenvolvimento de doenças inflamatórias (Bachelez, 2005). O sistema imunológico é classificado em inespecífico (inato ou natural) e específico (adquirido). O sistema inespecífico atua como primeira forma de contato (microrganismos), e neste caso, espera-se a resposta inflamatória aguda. Esta fase é caracterizada pela ação de citocinas e ativação do sistema complemento. Já a resposta adquirida é controlada por linfócitos (Clever e Parslow, 1997).
Os linfócitos podem ser divididos por sua função em linfócitos B (LyB) e T (LyT). Os LyB participam da resposta humoral e se ativados, são diferenciados em plasmócitos, sendo estes, capazes de secretar anticorpos. Os linfócitos T, são responsáveis pela imunidade celular, modulam a resposta imunológica na presença de mediadores químicos e participam também na ativação de outras células do sistema imune (Pillon et al., 2013; Abbas et al., 2015).
Os LyT auxiliam na ativação de outros grupos celulares, principalmente via secreção de citocinas (LT CD4+) ou pela ação direta sobre células alvo, como no caso dos LT CD8+ (citotóxicos). Ambos os grupos celulares secretam citocinas (Rosenberg, 1993; Mcneela e Mills, 2001).
Os linfócitos CD4+ podem diferenciar-se em Th1 e Th2 nos tecidos ou na circulação. Para que ocorra esta diferenciação, faz-se necessária a presença de citocinas no meio. Os Ly Th1 secretam TNFα, INFɣ, IL-2 e IL-12 que atuam estimulando processos inflamatórios através da ativação de macrófagos e outras células T (Martin e Leibovich, 2005). No processo de diferenciação para Th2, ocorre a produção de citocinas IL-4, IL-5, IL-10 e IL-13 que ativam linfócitos B, atuam na reposta contra bactérias, além das reações de hipersensibilidade (IgE) e reações imunes mediadas por eosinófilos e mastócitos (Abbas et al., 2015). A diferenciação em Th17 envolve a produção de IL-6, IL-17A, IL-17F, IL-21, IL-22 e IL-26 que estão relacionadas às respostas de inflamação características das doenças autoimunes (Tuomela et al., 2012; Pillon et al., 2013; Abbas et al., 2015).
O aumento de INFɣ limita a resposta em Th2 e o aumento de IL-4 e IL-10, em Th1. Isso permite equilíbrio na resposta imune. A IL-12 tem papel fundamental na diferenciação da célula Th0 em Th-1 (Dumitru et al., 2018).
Larbi et al. (2011) observaram uma redução na produção de IL-2 por linfócitos T durante o envelhecimento devido alterações dos mecanismos de sinalização intracelular. A diminuição da citocina IL-2 está associada a maior ativação de células Th17 (Lim et al., 2014), favorecendo a ocorrência de doenças autoimunes.
Os linfócitos T reguladores (L Treg) são responsáveis pelo controle da resposta imunológica, sendo eles caracterizados pela expressão de CD4 e CD25 na superfície da membrana e pela expressão do fator de transcrição Foxp3. Atuam sobre outros subtipos celulares da imunidade inata e adaptativa, promovendo efeito supressor. Estas células podem diferenciar-se no timo ou nos tecidos periféricos, dependendo dos estímulos aos quais os linfócitos Th0 são expostos (Field et al., 2007). Estas células liberam grandes quantidades de IL-10, IL-35 e TGFβ e podem controlar a ativação celular (Nagler-Anderson et al., 2004). De fato, a redução da IL10 circulante e elevados níveis de IL-6 e TNFα já foram observados em idosos com complicações cardiovasculares (Kritchevsky et al., 2005). Esta relação de citocinas também é observada em pacientes com diabetes mellitus tipo 2. Assim, as células Treg parecem exercer influência importante no controle imunológico nestas patologias.
A Figura 3, resume as subpopulações de linfócitos após a ativação, na presença de alguns fatores determinantes.
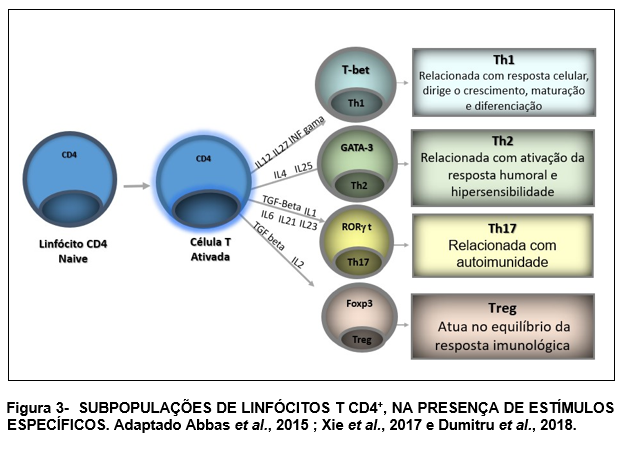
Além da diferenciação celular, os linfócitos são modulados pela expressão de receptores de superfície. A expressão da proteína de membrana CD28+ está associada à uma ativação das células auxiliares CD4+ e indução da expressão de inúmeras citocinas importantes para a regulação da função celular. Em idosos, há decréscimo da expressão de CD28+. Este fato está associado à diminuição da função celular que leva ao aumento da incidência de doenças autoimunes (Vallejo, 2005). Portanto, o aumento da expressão de CD28+ pode ser importante para a regulação da função imunológica, uma vez que ele atua como um “coestimulador ” em linfócito T. Sua ligação ao correceptor B7 é determinante para que ocorra a expressão de CD25+ e IL-2 (Van Parijs e Abbas, 1998; Chen, 2004; Abbas et al., 2015).
Alguns compostos naturais com capacidade imunomoduladora têm sido estudados. Destacam-se, dentre eles, substâncias extraídas do Ganoderma lucidum, um cogumelo popular da Medicina Chinesa.
1.1.2 Ganoderma lucidum
O cogumelo Ganoderma lucidum é um produto natural, original da China, utilizado como suplemento alimentar há milênios para tratamento de diversas enfermidades humanas (Wasser, 2005; Wasser, 2010). Este cogumelo também é conhecido na literatura por outros dois nomes, Reishi (japonês) ou Lingzhi (chinês) cujo significado quer dizer saúde, vitalidade e longevidade. O cogumelo é natural da China, porém no Brasil, é conhecido pelo nome popular de cogumelo rei ou cogumelo brilhante (Urben et al., 2004).
A Resolução de Diretoria Colegiada 152/17 e 280/19, estabelecida no Brasil, determina que produtos da medicina tradicional chinesa estão isentos de registro, porém, a prescrição, manipulação e dispensação, somente pode ser realizada por profissional especializado na área de saúde. Para a prescrição, estão autorizados os farmacêuticos, biomédicos, veterinários e médicos, para a manipulação, somente os farmacêuticos. Reações adversas identificadas pelos prescritores, de acordo com esta resolução, são classificadas como notificação compulsória, (Saúde, 2017; Saúde, 2019) .
A suplementação com Ganoderma lucidum contendo moléculas bioativas, pode contribuir tanto como um agente quimioterapêutico em processos patológicos ou até como alimento funcional. Estudos mostraram que este cogumelo tem propriedades antioxidantes, quelantes (principalmente do Fe+2) e genoprotetora (Shiao, 2003;
Saltarelli et al., 2019).
Chen et al. (2011), além de Zhao et al. (2012), demonstraram que Lingzhi possui diversos princípios ativos importantes, entre eles os polissacarídeos bioativos que podem modular a resposta imune tanto “in vivo” como “in vitro” (Gao et al., 2002; Gao, Yihuai et al., 2003; Gao, Y. et al., 2003; Gao et al., 2005; Zhang et al., 2016).
Wachtel-Galor et al. (2011) já afirmaram que, entre os benefícios do Ganoderma lucidum na saúde, destacam-se principalmente o controle dos níveis de glicose, melhora da memória, qualidade do sono, efeito antioxidante e imunomodulação.
Na prática da medicina chinesa, este cogumelo é utilizado principalmente como suplemento alimentar. As doses seguras recomendadas na farmacopeia chinesa estão entre 6 a 12 g ao dia. Para Zhao et al. (2012) doses superiores a 5 g estão indicadas para tratamento de doenças crônicas, como diabetes e câncer, por exemplo.
Pesquisadores descrevem que este cogumelo tem sido consumido principalmente por povos chineses, coreanos e japoneses, sendo incluído em suas dietas como alimento há milênios (Yang et al., 2000; Sliva, 2004; Wasser, 2005). Autores já mostraram que Ganoderma lucidum não induz alterações no DNA (Kim e Kim, 1999), assim como efeitos de toxicidade aguda e crônica também não foram observados em estudos em modelo animal (Chiu et al., 2000; Chen et al., 2011; Zhao et al., 2012; Zhang et al., 2016).
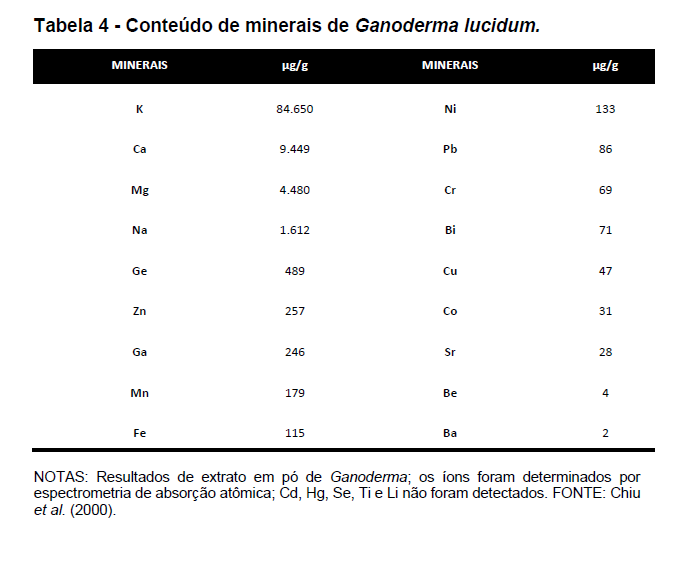
Borchers et al. (2009), constataram em seus estudos que o cogumelo apresenta os seguintes componentes: 90% de seu peso em água e os 10% restantes de: 10-40% de proteína, 2-8% de gordura, 3-28% de carboidrato, 3-32% de fibra, 810% teor de cinzas, além de vitaminas e sais minerais como cálcio, fosforo, magnésio, selênio, ferro, zinco e cobre. Cabe ressaltar que estes componentes são variáveis em função de sua forma de cultivo.
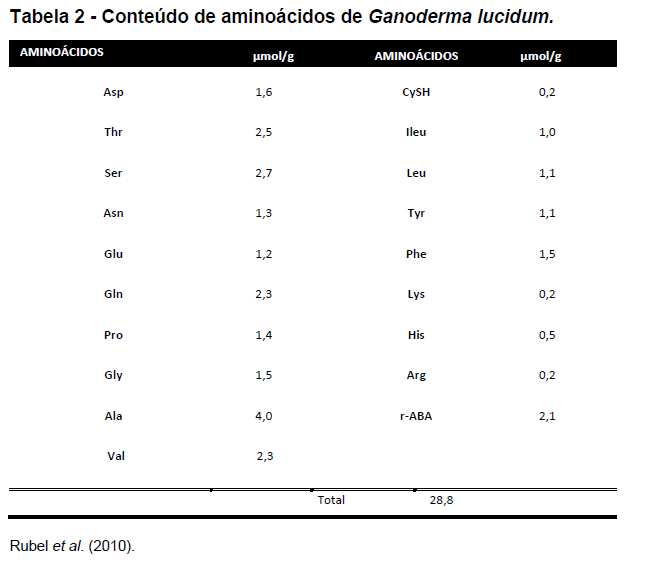
Chiu et al. (2000) encontraram em seus estudos também o germânio. Este pode encontrar-se com teor mais elevado em função de técnicas de cultivo especiais do cogumelo. Para Sanodiya et al. (2009), as proteínas de cogumelos são ricas em aminoácidos essenciais. Para Borchers et al. (2009), o baixo teor de ácidos graxos saturados associado à elevada proporção de ácidos graxos poli-insaturados pode ser encontrado neste cogumelo. Ácidos graxos totais podem chegar até 6,5% se cultivados por técnicas especiais como, por exemplo, a submersa (Rubel, 2006). Segundo Zhou et al. (2007), o Ganoderma lucidum ainda é constituído de diferentes tipos de polissacarídeos bioativos (peso molecular, tipo de cadeia e solubilidade) e ainda triterpenos, vitaminas, enzimas e minerais.
Wasser (2005) relatou que quantidades superiores a 100 tipos de polissacarídeos e triterpenos (Rubel, 2006; Yue et al., 2010) já foram isolados e identificados da espécie deste cogumelo, sendo os mais abundantes, os ácidos ganodéricos (triterpenos). Kubota et al. (1982) identificaram os primeiros e mais abundantes triterpenos (ácidos ganodéricos). Faz-se necessário salientar que em todas as partes do cogumelo pode-se encontrar polissacarídeos bioativos, com destaque imunomodulador aos polissacarídeos bioativos β1-3 e β1-6 (Lei e Lin, 1992; Rubel, 2006; Rubel et al., 2010 ; Henao et al., 2018).
A porcentagem e constituição de suas substâncias ativas podem alterar-se em função de características de cultivo, temperatura, umidade, fermentação e região. Em estudos de verificação de triterpenos e polissacarídeos bioativos, observaram-se diferentes concentrações destes dois princípios ativos. Em algumas amostras, o teor de triterpenos chegou a ser indetectável (Wachtel-Galor et al., 2011). Este fato sugere que os diferentes resultados encontrados em algumas pesquisas podem ser justificados pela diferença de percentual de triterpenos e polissacarídeos bioativos encontrados nos cogumelos que, por sua vez, estão relacionados às características e cuidados no cultivo do Ganoderma lucidum.
Os polissacarídeos bioativos de alto peso molecular encontrados em Ganoderma lucidum possuem diferentes efeitos na potência de resposta imune (Chan et al., 2007; Habijanic et al., 2015; Chang et al., 2015). Para Wachtel-Galor et al. (2011), eles podem ser encontrados em partes diferentes do cogumelo (corpo e micélio), além dos esporos. Estudos demonstram que polissacarídeos bioativos possuem ação anti-inflamatória, antitumoral, imunoestimulante e hipoglicemiante (Miyazaki e Nishijima, 1981; Tomoda et al., 1986; Rubel, 2006; Yue et al., 2010; Rubel et al., 2010; Yang, Chen, et al., 2018; Yang, Wu, et al., 2018).
Também têm sido isolados, a partir de Ganoderma lucidum outros componentes ativos, tais como proteínas capazes de alterar o tempo de coagulação de eritrócitos em modelo animal (LZ8), (Jeurink et al., 2008), as lacases, vitaminas (provitamina D2) e nucleotídeos, além de ácidos ganodéricos (Wasser, 2005; Wang e Ng, 2006; Paterson, 2006; Wang et al., 2007; Wasser, 2010; Saltarelli et al., 2019).
A seguir, são apresentadas as tabelas de composição do Ganoderma lucidum (Rubel et al., 2010):


1.1.3 Polissacarídeos de Ganoderma e o sistema imune
A modulação da resposta imune promovida por Ganoderma lucidum é muito variada. Polissacarídeos bioativos deste cogumelo promovem a ativação de células apresentadoras de antígeno (APC), aumentam a capacidade fagocítica de monócitos, assim como a imunidade humoral e celular (Gao et al., 2002; Gao et al., 2005; Chen et al., 2004; Rubel, 2006; Ma et al., 2008; Rubel et al., 2010; Habijanic et al., 2015). Acredita-se que estas alterações são responsáveis pelos efeitos antitumorais deste composto.
Pesquisadores já demonstraram que Ganoderma lucidum promove aumento
do número de linfócitos T, B, células “natural killer” e células dentríticas em estudo com modelo animal (Chen et al., 2004; Li et al., 2007; Ma et al., 2008). Estes dados mostram que Ganoderma lucidum pode exercer funções antibacterianas, antivirais e antitumorais através da modulação da resposta imune (Chung et al., 2001, Gao, Y. et al., 2003, Rubel et al., 2010; Pan et al., 2013).
Chung et al. (2001) compararam dois tipos de polissacarídeos bioativos obtidos por técnicas específicas de isolamento. Após isolarem os polissacarídeos bioativos, compararam suas ações farmacológicas (solúvel e insolúvel). Eles observaram que polissacarídeos bioativos insolúveis isolados de Ganoderma lucidum, podem exercer o controle celular através de mecanismos reguladores da apoptose, resultando na regulação negativa da célula tumoral. Foi observado, o controle exercido pelo polissacarídeo de Ganoderma no crescimento em linhagem de células humanas tumorais do fígado (Hep3B), estômago (AGS) e pulmão (A549) em uma faixa de inibição exercida por este polissacarídeo, entre 85-93%. Houve também aumento na expressão de IL-6 e TNFα em linhagem de linfócitos T, na presença destes polissacarídeos bioativos.
Outros pesquisadores do Ganoderma lucidum também observaram melhora na atividade e imunidade celular (Gao et al., 2002; Gao, Yihuai et al., 2003; Gao, Y. et al., 2003; Gao et al., 2005). Estes pesquisadores observaram, em seus resultados, o aumento de IL-2, IL-6, INFɣ e do número de células natural killer em doses de 5,4 g/dia (forma farmacêutica de extrato seco) em indivíduos suplementados durante doze semanas, enquanto níveis de IL-1β e TNFα foram reduzidos.
Em camundongos Balb tratados com extrato rico em polissacarídeos bioativos de Ganoderma lucidum, observou-se aumento da proliferação de esplenócitos e das atividades de macrófagos e células natural killer, o que, como consequência promoveu elevação dos níveis de IL-6 e INFɣ (Chang et al., 2009). Em outro estudo, o polissacarídeo (F3) foi capaz de aumentar as citocinas IL-1, IL-6, IL-12 e INFɣ secretadas a partir de esplenócitos de ratos (Chen, 2004).
Outros autores evidenciaram que células tratadas com polissacarídeos bioativos de Ganoderma lucidum na presença de LPS, foram capazes de exercer aumento na produção de TNFα, IL-10 e IL-12, indicando ativação de linfócitos e monócitos (Jeurink et al., 2008).
Pan et al. (2013) observaram aumento dos níveis séricos de IL-2, IL-4 e IL-10 induzidos por polissacarídeos bioativos isolados de Ganoderma lucidum (GLP) em modelo animal. Os autores também observaram melhora no nível plasmático e do tecido gástrico das enzimas catalase, superóxido desmutase e glutationa peroxidase (resultado dose-dependente). Estas enzimas são responsáveis por exercer o controle negativo (funcionando como defesa antioxidante), sobre a produção excessiva de espécies reativas de oxigênio, elevada em processos inflamatórios. Espécies reativas de oxigênio, são moléculas instáveis e reativas, podendo modificar por exemplo, lipídeos, proteínas e carboidratos. Isto reforça a hipótese da contribuição destes polissacarídeos bioativos (GLP) na redução de radicais livres e no dano oxidativo, causado pelo acúmulo de espécies reativas de oxigênio no estresse oxidativo,
(observado em câncer gástrico), presente no modelo animal, proposto neste estudo. Reforçando a hipótese de contribuição de Ganoderma lucidum como anti-inflamatório e imunomodulador.
Pesquisadores já mostraram resultados promissores sobre a imunomodulação promovida por componentes oriundos do Ganoderma lucidum. Hong et al. (2004) descreveram que polissacarídeos bioativos de Ganoderma lucidum administrados por via oral são captados por macrófagos e depois pela medula óssea. Na medula, por ação dos macrófagos, são degradados em compostos menores e solúveis, que possuem afinidade e ligam-se a receptores específicos. A afinidade de alguns substratos de Ganoderma lucidum à receptores de macrófagos pode justificar a ativação de mecanismos envolvidos com a modificação do perfil de linfócitos em idosos.
Pesquisas indicam ainda que os polissacarídeos bioativos de Ganoderma lucidum ligam-se a receptores do sistema imune, tais como TLR4, TLR2 e 6 em superfície de macrófagos induzindo a expressão de algumas citocinas como TNFα, IL-2, IL-10 e IL-12 (Shao et al., 2004; Chen et al., 2004; Hsu et al., 2004; Chan et al., 2009). Além disso, outros receptores também podem ser ativados por polissacarídeos bioativos como é o caso da dectina-1 (proteína expressa em macrófagos, neutrófilos e células dentríticas), sendo também ligante do receptor do complemento 3 (CR3), presentes em macrófagos e células “natural killer” (Chan et al., 2009). Portanto, a ativação da dectina-1, CR-3 e receptores de TLR4, TLR2 e 6 concomitantemente por polissacarídeos bioativos ampliam a resposta imune inata através da ativação da via de sinalização de NFkB. Esta, por sua vez, promove a ativação e amplificação da resposta em macrófagos, células dentríticas, neutrófilos, “natural killer”, linfócitos B e T. Já Chang et al. (2015) concluíram que polissacarídeos de alto peso molecular possuem propriedade anti-inflamatória, além de prebiótica. Habijanic et al. (2015) concluíram que polissacarídeos bioativos extraídos de diferentes partes do cogumelo, exercem ações diferentes na resposta imune inata e adaptativa.
Neste sentido, Wan et al. (2012) sugerem que a supressão da IL-17, que é
uma citocina de perfil de linfócitos Th17, inibe a progressão do diabetes tipo II. Gao et al. (2004) demonstraram o efeito hipoglicêmico de polissacarídeos de Ganoderma lucidum em 71 pacientes portadores de diabetes mellitus tipo 2. Tomoda et al. (1986) demonstraram a atividade hipoglicêmica de dois polissacarídeos bioativos extraídos do corpo de frutificação do Ganoderma lucidum. Talvez estes efeitos tenham relação com a modulação da resposta imune. Em resumo, há evidências científicas de que o extrato seco de Ganoderma lucidum possa “modular” os níveis de glicose por três mecanismos distintos; pela ação direta em enzimas hepáticas que metabolizam a glicose, pela modulação das vias de sinalização em subgrupos de linfócitos CD4+ (alterando o perfil de algumas citocinas inflamatórias), como por exemplo a IL-17, e pelo aumento dos níveis de insulina. Porém, a maioria desses resultados foram obtidos somente em modelo animal (Seto et al., 2009).
Em outro estudo realizado em modelo animal (Rubel et al., 2010), observouse que o Ganoderma lucidum promoveu a imunoestimulação com aumento de INFɣ produzido por macrófagos e também aumento dos níveis de IL-10 no sobrenadante de cultura destas células, além da redução de TNFα. Pan et al. (2013) observaram que o polissacarídeo bioativo GLP, extraído de Ganoderma lucidum, é capaz de promover o aumento sérico de IL-2, IL-4 e IL-10, concomitantemente à redução de TNFα e IL-6 em modelo animal.
1.1.4 Proteínas do Ganoderma e sistema imune
Alguns pesquisadores que isolaram proteínas de Ganoderma, também observaram sua influência no sistema imune em modelo de células mononucleares, observando inclusive, a atividade imunomoduladora de Ganoderma lucidum sem a presença de qualquer mitógeno (Jeurink et al., 2008) “in vitro”. Mitógenos são substâncias com a propriedade de promover a proliferação celular, estimulando a mitose. Neste modelo, houve indução da secreção de IL-12 por células periféricas mononucleares (PBMC) pelos extratos de proteínas isolados de Ganoderma lucidum, sugerindo efeito direto destas proteínas em monócitos que, dessa forma, modulam a atividade de linfócitos e outras citocinas de forma indireta.
As proteínas fúngicas imunomoduladoras (FIPs), isoladas por pesquisadores em estudos com Ganoderma lucidum, formam um grupo de proteínas classificadas por uma sequência de aminoácidos semelhantes e por suas ações na resposta imunológica. A proteína LZ-8 (proteína fúngica com bioatividade) foi isolada e mostrou afinidade de ligação a carboidratos (na avaliação de hemaglutinação de eritrócitos de coelhos). Esta mesma proteína foi capaz de estimular a proliferação de linfócitos (Hsu et al., 1997; Jeurink et al., 2008).
A avaliação da atividade dos extratos de proteínas na produção de citocinas por células mononucleares periféricas humanas (hPBMC) não estimuladas, mostrou que as proteínas de Ganoderma lucidum induziram resposta maior que as proteínas de outros cogumelos (V. volvacea), com baixa, mas significativa indução de IL-4, IL10 e IL-12, assim como níveis fortemente elevados de INFɣ e TNFα, comparadas ao controle (Jeurink et al., 2008). Isto sugere uma capacidade mitogênica autóloga do Ganoderma lucidum.
Quando houve a incubação das hPBMC com extratos de proteínas na presença de Concanavalina A (ConA), ocorreu redução na produção de INFɣ (Jeurink et al., 2008). Quando avaliada a concentração de IL-12 nas mesmas condições, a produção desta citocina foi elevada na presença da proteína fúngica de Ganoderma lucidum. Não houve aumento de IL-10 nas células tratadas com ConA e proteínas de Ganoderma lucidum. Nas células PBMC tratadas com Ganoderma lucidum em presença de PMA/Ionomicina, houve aumento das citocinas IL-10 e INFɣ. Em resumo, o Ganoderma lucidum em combinação com ConA, mimetiza o estímulo em receptor de célula T (TCR) e promove a redução de perfil Th1 (Jeurink et al., 2008), esse efeito foi justificado pelos autores deste estudo considerando duas hipóteses, a primeira, que proteínas de Ganoderma lucidum exercem antagonismo competitivo em receptor de TCR por se ligar diretamente com a ConA, impedindo que a ConA ligue-se diretamente ao receptor; ou então, é possível que as próprias proteínas de Ganoderma liguem-se diretamente ao receptor de TCR, impedindo também, a ligação de ConA ao receptor de TCR. Já quando há estímulo intracelular (PMA), ocorre maior produção de INFɣ e IL-10, mostrando uma potente imunomodulação por vias específicas, o mitógeno PMA mimetiza a ação do diacilglecerol (DAG).
Vale salientar que Haak-Frendscho et al. (1993) observaram aumento da expressão de IL-2 em células mononucleares humanas na presença de LZ-8 de Ganoderma lucidum, indicando possível papel deste composto no bloqueio da resposta Th17. Este efeito é muito interessante, pois, como descrito anteriormente, ocorre redução da produção de IL-2 por linfócitos de idosos, característico do processo de imunossenescência. Assim, o Ganoderma pode ter importante papel na imunossenescência, amenizando este processo.
Yang, Chen, et al. (2018) e Yang, Wu, et al. (2018) mostraram recentemente o potencial hipoglicemiante de um proteoglicano extraído de Ganoderma lucidum “in vitro” e “in vivo”, o Fudan-Yueyang (FYGL). Este bioativo mostrou atividade inibitória competitiva na expressão da proteína tirosina fosfatase (PTP1B). O FYGL foi capaz ainda de reduzir o peso, diminuir a resistência à insulina e os níveis de glicose no sangue em modelo animal (ratos), além de inibir a expressão de PTP1B. Este bioativo de Ganoderma também mostrou regular positivamente a expressão do transportador de glicose (GLUT 4). A regulação positiva do GLUT 4 foi atribuída ao bioativo que mostrou atividade no aumento da fosforilação em tirosina do substrato 1 do receptor de insulina (IRS-1). Os autores deste estudo sugerem a ativação destes mecanismos como sendo favorecidos pela alta permeabilidade celular do proteoglicano de Ganoderma.
1.1.5 Triterpenoides de Ganoderma e sistema imune
Triterpenoides são compostos bioativos de Ganoderma lucidum. Estes ácidos são componentes principais desse cogumelo e vários estudos tem demostrado suas propriedades medicinais. Dentre os triterpenoides, estão as diversas classes de ácidos ganodéricos que possuem afinidade com as tirosina quinases, atuando em vias de sinalização como o NFkB, Akt, RAS, MAPK, PI3K, mTOR, dentre outras vias. Assim, ativam mecanismos que estão relacionados com a parada do ciclo celular e indução da apoptose (Wu et al., 2013 ; Jiang et al., 2017; Cor et al., 2018).
Dentre as propriedades farmacológicas dos triterpenoides encontram-se a atividade antitumoral, antiviral, atividade imunomoduladora com efeitos antiproliferativo em células tumorais, antioxidante e anti-HIV1 (Zhang e Liu, 2019). Pesquisadores afirmam que o ácido ganodérico é bem absorvido pelo trato gastrintestinal e seu processo de distribuição é rápido, sendo sua principal via de excreção, a bile após a absorção. Pesquisadores recentemente apontaram sete das oitenta e três classes de triterpenoides com ação farmacológica para aplicação clínica, sendo eles os ácidos ganodéricos A, C2, D, F, DM, X e Y (Liang et al., 2019). Neste estudo, os autores apontaram que o ácido ganodérico DM, desempenha importante papel na autofagia e apoptose, além de promover a ativação de células “natural killer” e melhorar o desempenho de atividade destas células.
Os mecanismos moleculares ativados pelos ácidos ganodéricos podem variar em função das células e método de tratamento e, atualmente, é um dos maiores desafios para sua aplicação clínica. Autores sugerem atividade promissora dos ácidos ganodéricos para manter o equilíbrio do sistema imune na fase do inflammaging (estado pró-inflamatório de baixo grau, porém, persistente, característico do processo do envelhecimento). Além disso, pesquisadores sugerem também a regulação da hiperatividade do sistema imune (Liang et al., 2019).
O ácido ganodérico A, por exemplo, promove a inibição da via de sinalização STAT3, interferindo na produção de várias citocinas (Ren et al., 2008). Sua ação inclui ainda, inibição de histamina, indução de apoptose, controle das funções hepáticas e controle da dislipidemia (Sanodiya et al., 2009; Chen et al., 2017; Wang et al., 2017).
O ácido ganodérico C2 é um marcador para as espécies de Ganoderma lucidum (metabólito secundário). Tem sido atribuídas a este triterpeno, propriedades antienvelhecimento, antitumorais, anti-histamínica e propriedade citotóxica.
O ácido ganodérico C2, na atualidade, passa por etapas de estudos préclínicos para o tratamento de complicações diabéticas na Universidade de Pequim, China. Pesquisadores recentemente mostraram que o ácido ganodérico C2 exerce potente ação inibitória sobre a aldose redutase recombinante humana e também sobre a enzima α-glucosidade; essa ação é superior à ação exercida por outros doze ácidos ganodéricos. A enzima aldose redutase é responsável por catalisar a conversão de glicose em sorbitol; já a enzima α-glucosidade, é responsável por promover a captação da glicose pelo intestino (Fatmawati et al., 2013; Liang et al., 2019).
O ácido ganodérico D tem propriedades anti-inflamatórias (por reduzir a proliferação de macrófagos e proteger osteoblastos humanos) (Liu et al., 2010; Chen et al., 2014), possui atividade imunomoduladora, ação antiproliferativa em células tumorais em especial, apresenta efeito citotóxico em carcinoma cervical humano, com parada do ciclo celular e indução da apoptose (Liang et al., 2019).
Por outro lado, pesquisadores, recentemente, também mostram o potencial inibitório do ácido ganodérico F sobre a enzima conversora de angiotensina (ECA), sendo este ácido promissor para o tratamento de hipertensão (Daskaya-Dikmen et al., 2017), mostrando também, resultados efetivos na supressão da carcinogênese (Liang et al., 2019).
Estudos recentes apontam que o ácido ganodérico DM é um candidato promissor para o tratamento avançado de câncer de próstata. Resultados recentes sugerem que sua estrutura é análoga ao androgênio e estrogênio, atuando como antagonista nestes dois receptores, exercendo assim, atividade antiproliferativa no tumor de próstata (inclusive andrógeno independente), (Johnson et al., 2010) e tumor de mama. No câncer de mama, pesquisadores recentemente mostraram que o ácido ganodérico induz a parada do ciclo celular (fase G1), ao dano no DNA e induz a apoptose, além da autofagia (Miyamoto et al., 2009; Wu et al., 2012; Liang et al., 2019). Além disso, mostra potente efeito antiproliferativo e antimetastático em vários tipos de câncer. Dessa forma, pesquisadores têm sugerido o ácido ganodérico DM como opção complementar aos tratamentos convencionais para câncer. Atualmente , o ácido ganodérico DM passa por ensaios pré-clínicos para o tratamento de linfoma (Liang et al., 2019).
Já o ácido ganodérico Y foi desenvolvido pela empresa Nestlé para distúrbio de lipoproteínas (inibidor da biossíntese do colesterol), exercendo influência sobre a enzima HMG-CoA redutase (1.4 µM) exerce inibição de 50% da biossíntese do colesterol (Hajjaj et al., 2005; Wang et al., 2015; Meneses et al., 2016). O ácido ganodérico Y mostra ser um composto bioativo de Ganoderma lucidum com atividade promissora para a inibição da enzima acetilcolinesterase (AchE) (Lee et al., 2011; Wei et al., 2018), além de promover a inibição da mitogênese (Wang et al., 2015) .
Li et al. (2005) mostraram que o ácido ganodérico X exerceu atividade inibitória nas enzimas topoisomerase I e IIa. Estas enzimas possuem papel fundamental na estrutura e função do DNA. Baixos níveis de BclxL também foram identificados na presença do ácido ganodérico X com consequente indução da apoptose por ativação da via de sinalização da caspase III, o que promoveu a inibição da mitogênese em célula tumoral (Li et al., 2005).
Dessa forma, compostos isolados ou na forma de extrato bruto de Ganoderma, têm despertado o interesse de pesquisadores na investigação da atividade imunomoduladora de Ganoderma lucidum. Acreditamos, a partir desta revisão, que Ganoderma lucidum possa exercer a regulação positiva no sistema imune de idosos, uma vez que este sistema se encontra limitado no processo de envelhecimento não patológico.
2 JUSTIFICATIVA DO PRESENTE ESTUDO
Durante o envelhecimento natural ocorre a imunosenescência, ou seja, perda da capacidade de controle da resposta imunológica. A utilização de Ganoderma lucidum pode exercer papel importante no restabelecimento deste equilíbrio. Conforme revisão apresentada, diversos estudos têm mostrado que a exposição a diferentes componentes isolados de Ganoderma lucidum estimulam diversas funções de leucócitos, como a produção de citocinas. No entanto, não existem estudos mostrando a influência do Ganoderma lucidum na formade extrato bruto em linfócitos isolados, em especial, na população de idosos. Idosos com níveis elevados de IL-10 e baixos de IL-6, garantem maior longevidade (Caruso et al., 2004 ; Capri et al., 2006). Essa população apresenta comprometimento na função, diferenciação e ativação de linfócitos T, responsáveis por orquestrar os mecanismos de equilíbrio imunológico. Estudos desta revisão são sugestivos da hipótese de Ganoderma lucidum em promover a regulação positiva no sistema imune de idosos.
3 OBJETIVO
O objetivo deste trabalho é investigar os efeitos da suplementação com Ganoderma lucidum no processo de diferenciação e função de linfócitos circulantes em idosas suplementadas.
Estratégia experimental:
O presente projeto foi realizado em duas etapas: 1) avaliação da suplementação com 1.500 mg por dia de Ganoderma lucidum, contendo 10,05% de polissacarídeos especificado pelo fabricante, (projeto piloto); 2) suplementação com 2000 mg por dia de Ganoderma lucidum, contendo 47,92% de polissacarídeos, de acordo com a especificação do fornecedor. As análises foram realizadas antes eapós 8 semanas de suplementação conforme listadas a seguir:
- avaliação de medidas antropométricas e de composição corporal (IMC, porcentagem de gordura corporal, circunferências de quadril e cintura, peso e estatura);
- avaliação de parâmetros plasmáticos:
- metabólicos (concentração plasmática de colesterol total e frações, triglicérides e glicose);marcadores hepáticos: concentração plasmática das enzimas gamaglutamiltransferase (GGT), transaminase glutâmica oxaloacética (TGO), transaminase glutâmica pirúvica (TGP) e lipase;avaliação dos marcadores de função renal: concentração plasmática de creatinina;avaliação de urina tipo I (avaliação de bilirrubina e proteína na urina);avaliação da porcentagem de linfócitos Th1, Th2, Th17 e Treg na cultura de células (linfócitos);determinação da proliferação e produção de citocinas no sobrenadante de células (linfócitos) estimulados com o mitógeno concanavalina (ConA) ou fitohemaglutinina (PHA);
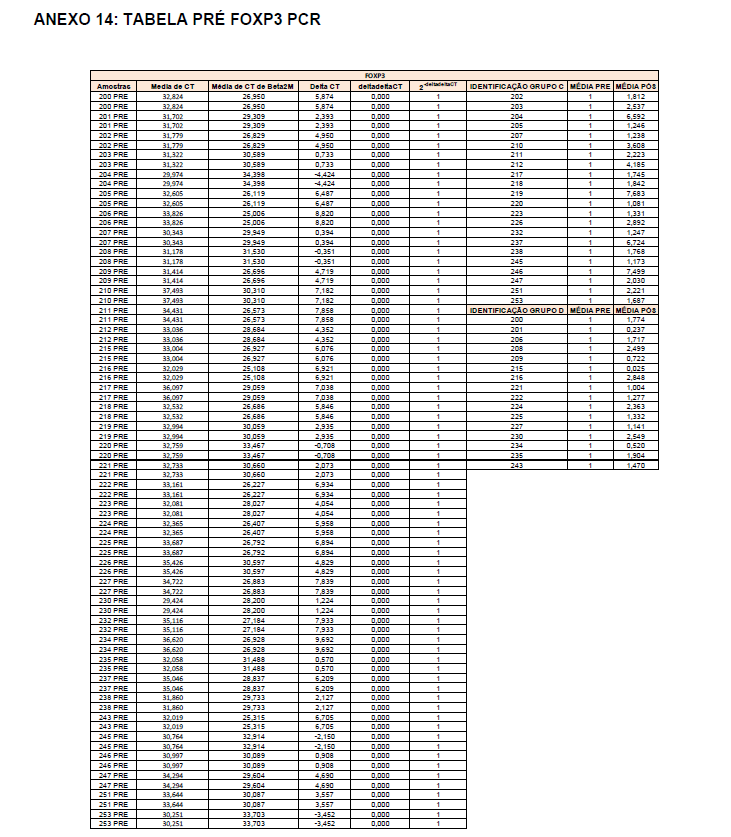
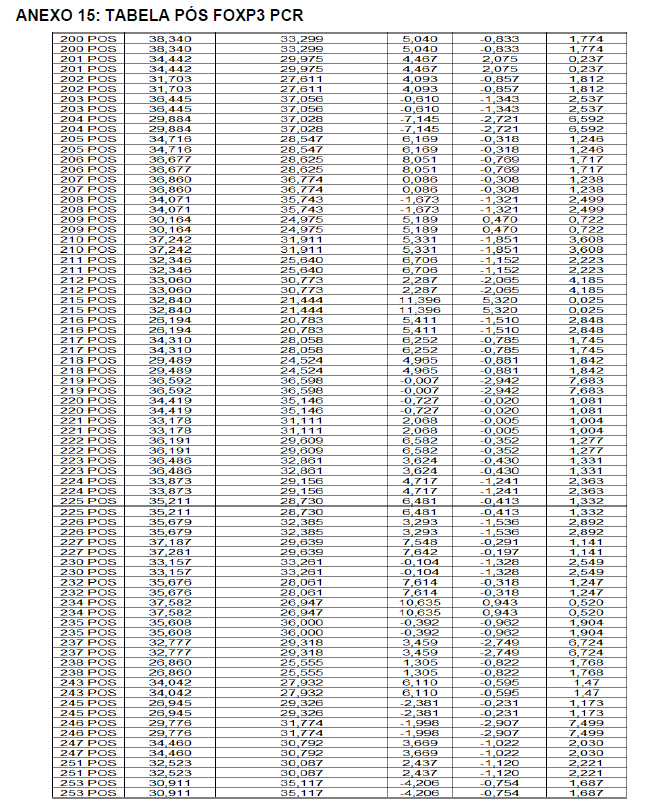
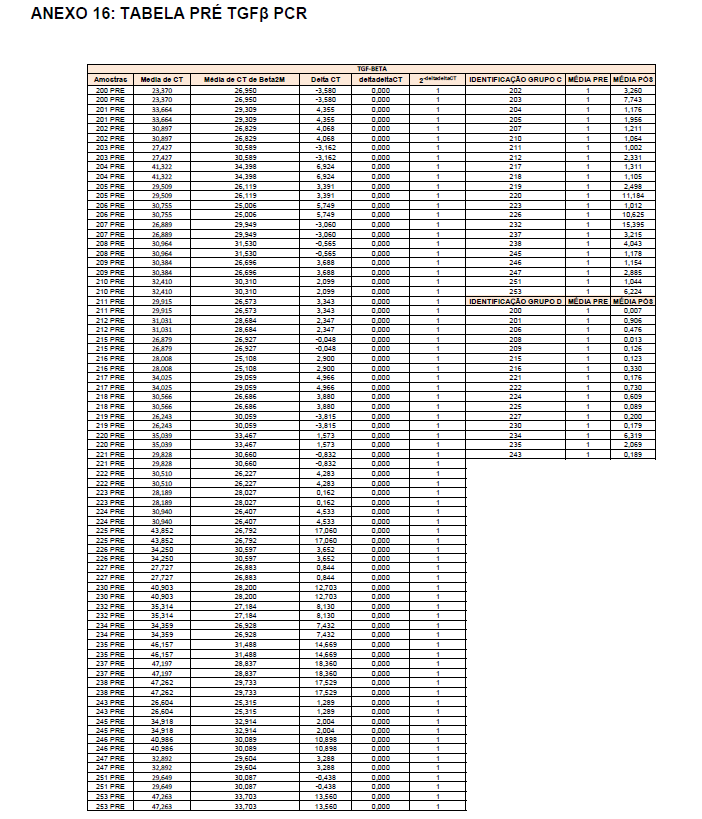
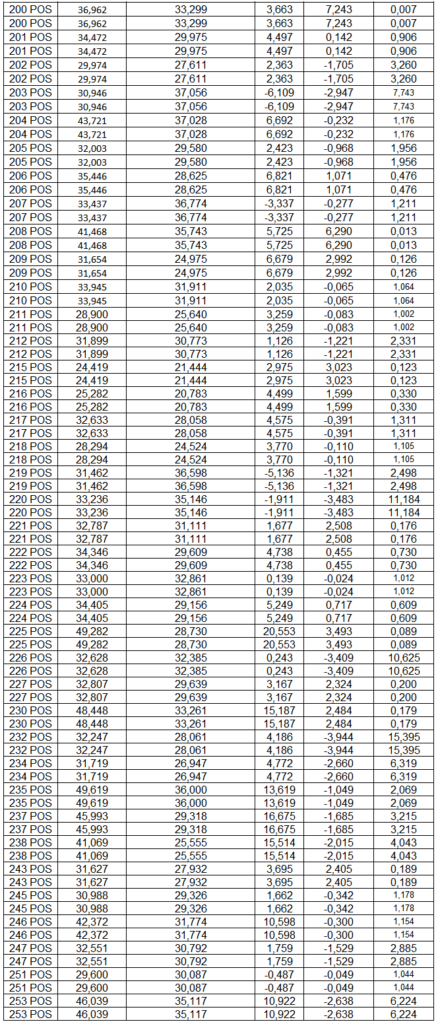
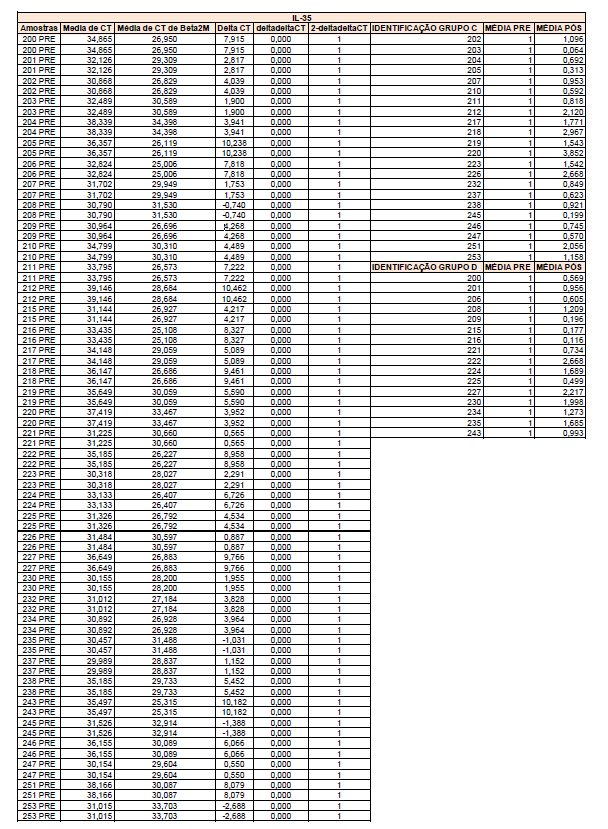
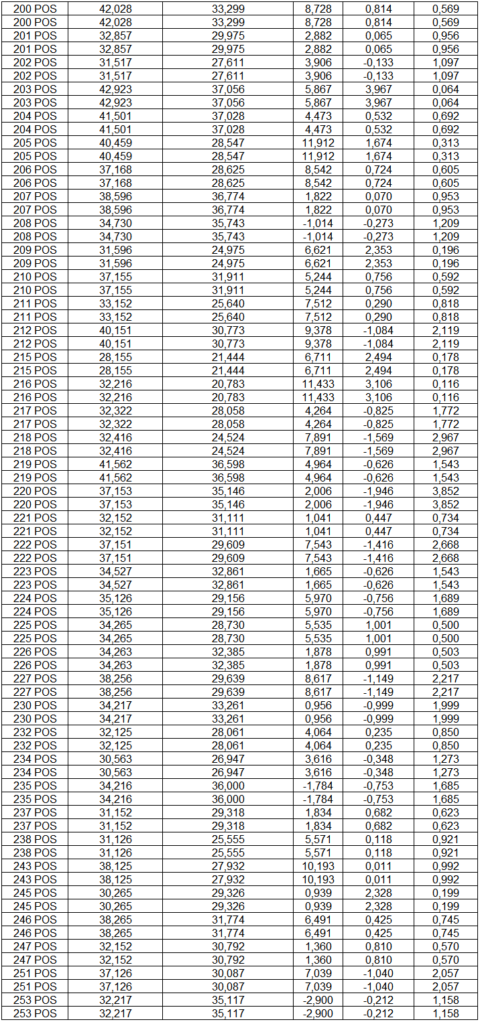
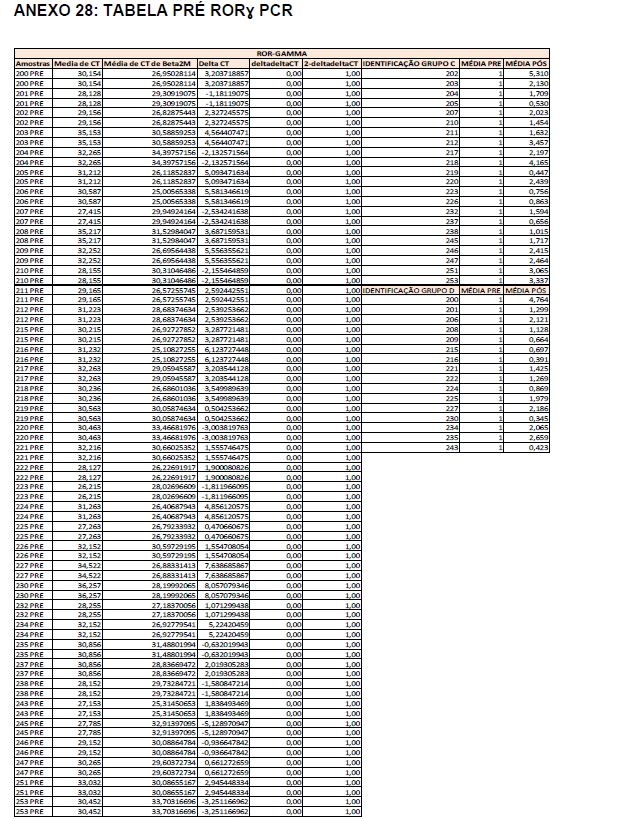
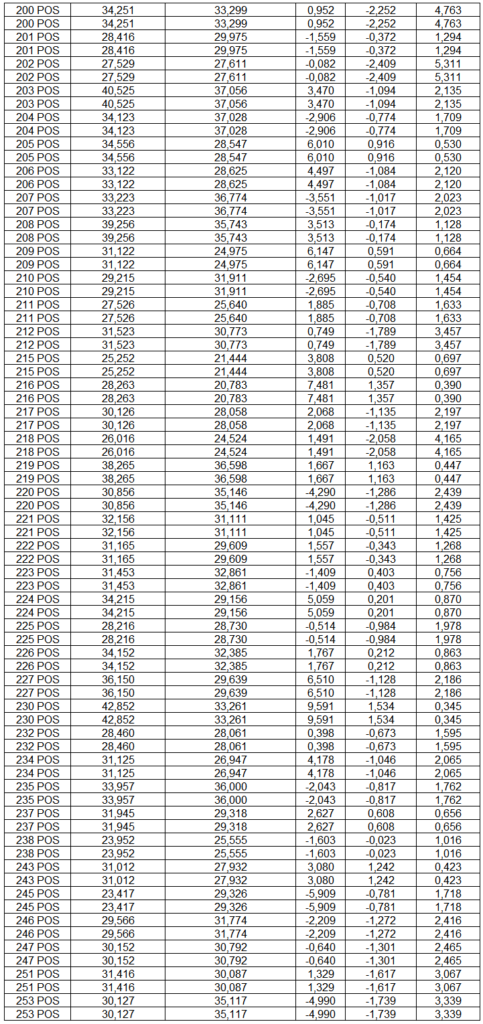
- avaliação da expressão do mRNA de IL-35, IL-10, IL-2, IL-17, IL-6, TGFβ, GATA-3, T-bet, RORɣ e FoxP3 nos linfócitos totais (isolados);
- avaliação da expressão da proteína CD28+ na superfície de linfócitos CD4+ por citometria de fluxo.
4. MATERIAL E MÉTODOS
4.1 Casuística
A amostra deste estudo foi constituída de idosas na faixa etária de 60 a 80 anos de idade de ambos os sexos. Na primeira fase do projeto (Estudo I), foram recrutadas 50 idosas, sendo que 22 completaram o estudo. As idosas foram suplementadas com 1500 mg de Ganoderma contendo 10,05% (especificação do fabricante) de polissacarídeos. Dentre os motivos de desistências estão: doenças adquiridas ao longo do estudo de familiares dos idosos e viagens no período da coleta. A suplementação foi realizada seguindo o modelo duplo cego, onde foram analisadas 11 idosas suplementados com Ganoderma lucidum e 11 suplementadas com placebo (amido) perfazendo um total de 22 voluntárias. A distribuição das voluntárias foi realizada de forma pareada para idade, medicamentos e nível de atividade física.
Na segunda fase desse estudo (Estudo II), as idosas foram suplementadas com 2000 mg/dia de Ganoderma contendo 47,92 % de polissacarídeos (especificação do fabricante) ou placebo (amido). Nesta etapa, 60 idosas foram recrutadas, sendo que finalizaram 23 no grupo Ganoderma e 16 no grupo placebo, perfazendo, o total de 39 voluntárias. A distribuição das voluntárias nesta etapa, foi realizada de forma pareada para idade, IMC, medicamentos e nível de atividade física.
Inicialmente foi realizado um encontro com as voluntárias, no qual ministramos uma palestra para a apresentação do projeto seguida da realização de anamnese para verificação dos critérios de inclusão e exclusão (Anexo 2). Posteriormente, aplicamos o questionário IPAQ para avaliação do nível de atividade física (Anexo 32).
Após as análises iniciais, realizamos o pareamento dos grupos como descrito abaixo.
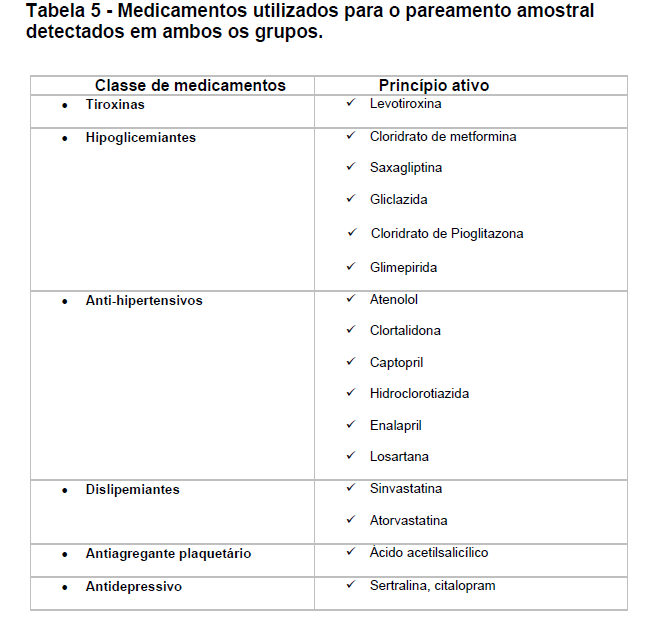
a) Quanto ao pareamento por uso de medicamentos em ambos os grupos: os grupos foram pareados por uso de medicamentos das classes dos antihipertensivos, diuréticos, hipoglicemiantes, antidepressivos, hipocolesterolêmicos e antiagregantes plaquetários (Tabela 5).
b) Quanto ao pareamento por atividade física: utilizou-se o questionário IPAQ (Anexo 32),validado por Matsudo; et al. (2001). A classificação do indivíduo foi: sedentário, pouco ativo, ativo e muito ativo. O critério aplicado baseia-se no levantamento de atividades diárias dos idosos calculados em METs (minutos de atividades por frequência na semana). O resumo do critério utilizado é representado na FIGURA 4
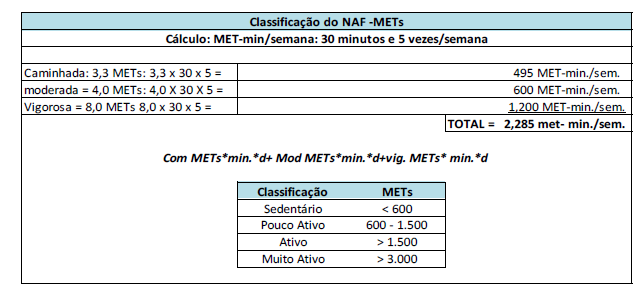
Figura 4 – CLASSIFICAÇÃO DO NÍVEL DE ATIVIDADE FÍSICA BASEADO EM ATIVIDADES DIÁRIAS CALCULADAS EM METS: minutos de atividades por frequência na semana) segundo o Questionário Internacional de Atividade Física (IPAQ).
https://celafiscs.org.br/article/questionario-internacional-de-atividade-fisica-ipaq-estudo-devalidade-e-reprodutibilidade-no-brasil
- Quanto ao pareamento por sexo: participaram deste estudo (primeiro grupo), dois indivíduos do sexo masculino, sendo distribuído um idoso para cada grupo. Participaram do segundo grupo somente voluntárias do sexo feminino.
- Quanto ao pareamento por idade: participaram deste estudo (primeiro grupo), cinco mulheres com idade inferior a 60 anos (53, 54, 57(2) e 59), sendo então distribuídas nos dois grupos. No segundo grupo, participaram somente mulheres com idade superior a 60 anos.
Os idosos foram recrutados através da distribuição de folhetos de divulgação do projeto no bairro da Liberdade, veículos e internet. Todos os participantes foram entrevistados com anamnese, destinada à identificação de possíveis problemas de saúde. Este estudo foi submetido e aprovado pelo Comitê de Ética da Universidade Cruzeiro do Sul (CEP 010_2016) (Anexo 7) e as participantes assinaram o Termo de Consentimento Livre e Esclarecido (Anexo 1), atendendo às normas da Comissão de Ética em pesquisa da Universidade Cruzeiro do Sul.
4.2 Critérios de inclusão e exclusão
Foram incluídos neste estudo pacientes idosas com idade superior a 60 anos. Nos dois grupos, as idosas podiam fazer tratamento com medicamentos para hipertensão e dislipidemias.
Não participaram do projeto pessoas que apresentavam diagnóstico prévio de doenças que pudessem interferir nos resultados da pesquisa como:
- Doença cardiológica grave;
- Doença autoimune;
- Uso de medicamentos anti-inflamatórios cronicamente e imunossupressores;
4.3 Administração de Ganoderma lucidum
O estudo foi duplo cego, sendo que no Estudo I, 11 idosos foram suplementados com dose de 1.500 mg/dia de extrato seco do cogumelo antes do almoço durante 8 semanas (equivalente a 3 cápsulas diárias). Os outros 11 idosos foram suplementados com 1500 mg de veículo inerte (amido) (equivalente a 3 cápsulas diárias em dose única), o qual não possui propriedade farmacológica. Neste estudo, foi utilizado o extrato de Ganoderma contendo 10,05% de polissacarídeos (de acordo com a especificação do fabricante).
Realizou-se o cálculo amostral utilizando o programa estatístico Epi Info 6.0.
Considerou-se para o cálculo, intervalo de confiança de 95% e α de 5%. Determinouse que a amostra deveria ser composta por 15 indivíduos em cada grupo referente às análises de perfil linfocitário.
No segundo grupo, 23 idosas foram suplementadas com 2000 mg/dia de Ganoderma e 16 foram suplementadas com placebo (amido). Ambos os grupos receberam prescrição farmacêutica com orientação sobre a suplementação. Neste estudo, foi utilizado o extrato de Ganoderma contendo maior teor de polissacarídeos 47,92% (de acordo com especificação do fabricante).
No Brasil, o Ganoderma lucidum segue a RDC 280/19 (Saúde, 2019) e atualmente é classificado como produto isento de Registro.
A separação da amostra foi pareada, sendo que a mesma programação de administração das cápsulas foi dada aos dois grupos. Os frascos foram identificados como A ou B na primeira fase do estudo e C e D na segunda fase. A descrição do conteúdo de cada conjunto de frascos foi realizada em formulário, o qual foi armazenado em envelope lacrado e são apresentados no início da tese..
Nas doses preconizada de 1500 mg/dia e 2000 mg/dia, não foram relatadas na literatura reações adversas, efeitos colaterais ou reações de toxicidade. As doses recentemente utilizadas por Zhang et al. (2016) foram descritas em outros estudos por Chen et al. (2011), além de Gao et al. (2005). Nestes estudos foram utilizadas doses entre 20 mg/Kg/dia até 8g/kg/dia. Estudos científicos com o extrato de Ganoderma lucidum administrados em humanos, assim como compostos isolados de Ganoderma lucidum utilizados em modelos animais, mostram doses de acordo com a recomendação da farmacopeia chinesa (2000). A farmacopeia chinesa (2000) recomenda doses de 6-12 gr /dia. Portanto, as doses utilizadas em nosso estudo são seguras de acordo com a revisão apresentada por Li et al. (2007). Gao et al. (2005) recrutaram 36 pacientes com câncer de pulmão e os mesmos foram tratados com doses de 5,4 g /dia de polissacarídeos de Ganoderma, sem efeitos colaterais.
Não foram relatadas suspeitas de reações adversas em nosso estudo.
4.4 Características das cápulas Ganoderma lucidum
Para garantir a estabilidade e melhor aproveitamento do extrato de Ganoderma lucidum, alguns testes foram realizados em meio ambiente e sob refrigeração (2-8 Cº) para evitar alterações durante o armazenamento (autogerenciamento) pelas idosas. As pacientes foram orientadas a armazenar o extrato seco na forma de cápsulas sob refrigeração.
Foi utilizado no estudo I a cápsula gastrorresistente que tem como característica, a dissolução no intestino delgado. No estudo II, utilizamos cápsula gelatinosa que tem como característica a dissolução no estômago. Foram utilizados no preparo das cápsulas (para placebo e Ganoderma), os seguintes adjuvantes farmacotécnicos: manitol (diluente para fármacos higroscópicos), laurilsulfato de sódio (agente molhante, emulsificante), aerosil (absorvente), carbonato de magnésio (diluente) e corante de caramelo. As imagens a seguir representam alguns testes de estabilidade do extrato, (Figura 5). Não observamos alterações na estabilidade de ambas as cápsulas em temperatura ambiente e sobre refrigeração.

4.5 Determinação de β-glucanos no Ganoderma
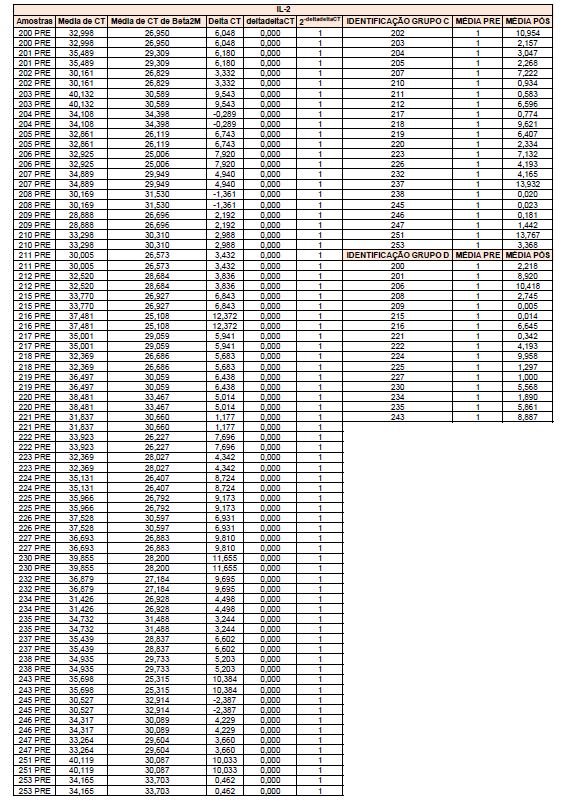
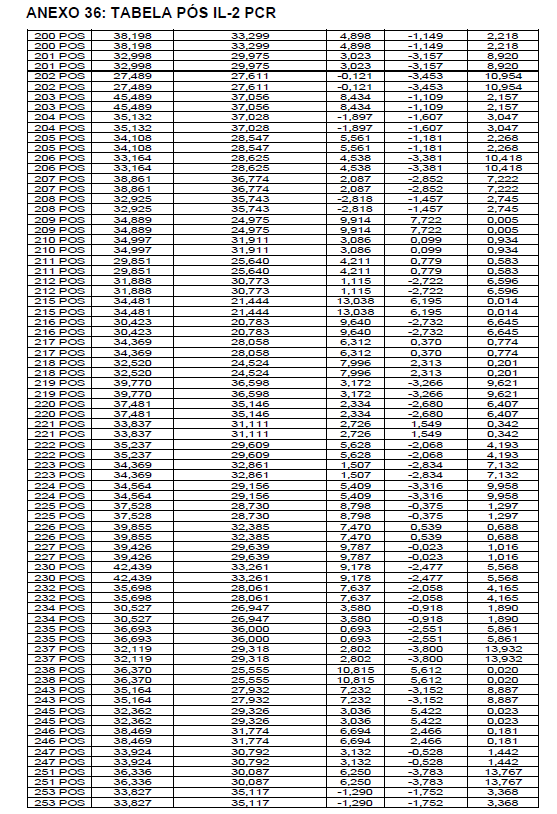
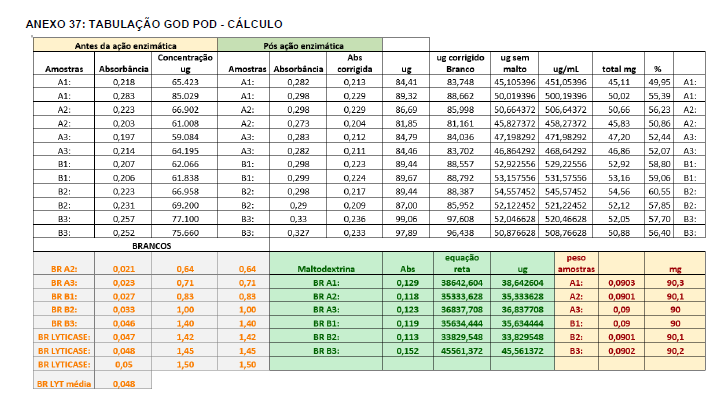
Para a análise de β-glucanos totais utilizamos o protocolo adaptado de Mushroom and yeast beta-glucan –assay procedure – KYBGL08/18, Megazyme. Utilizamos a Liticase bruta obtida de Arthrobacter luteus (Sigma Aldrich, lote: 019M4125V). As amostras de Ganoderma foram separadas em A (Ganoderma lucidum lote: 2018) e B (Ganoderma lucidum lote: 2016).
O princípio do ensaio de β-glucanos de cogumelos e leveduras (Mushroom and yeast beta-glucan –assay procedure) consiste em solubilizar 1,3:1,6-βD-glucanos, 1,3-βD-glucanos e α-glucanos em H2SO4 12 M gelado. Após isso, é realizada a hidrólise em H2SO4 2M. Os fragmentos de glucano restantes são então hidrolisados quantitativamente em glicose usando a mistura de exo-1,3-β-glucanase e βglucosidase, fornecendo então, a medida de glucanos totais. Os α-glucanos e sacarose são hidrolisadas (D-glicose, D-frutose e glicose), sendo mensuradas com amiloglucosidase e invertase, usando reagente GOPOD. β-glucanos são, então, determinados pela diferença.
Resumidamente, as análises foram realizadas em triplicatas para os lotes de Ganoderma de 2016 e Ganoderma 2018 com a pesagem inicial de 90 mg das amostras de ambos os lotes.
Inicialmente, foi utilizada a enzima Liticase bruta que foi preparada pesandose1 mg da enzima e, posteriormente diluída em 1mL de tampão fosfato 20 mM, pH 6,5. A Liticase tem a especificidade de separar os β-glucanos que são polímeros constituídos de unidade β -1-3-D glicopiranosil com ramificação nas unidades β-1-6D glicopiranosil. Posteriormente, foi realizada a leitura das absorbâncias antes e após a ação enzimática da Liticase bruta.
Após essa avaliação foi necessário proceder com a digestão das amostras pela presença da maltodextrina, um carboidrato que não é característico do extrato de Ganoderma, presente em ambos os lotes. Normalmente, a maltodextrina é adicionada aos lotes como veículo inerte para facilitar o manejo do Ganoderma lucidum. A digestão foi realizada com as enzimas amiloglicosidase e α-amilase para a quebra das ligações glicosídicas (α-1,6 e α-1,4) e suas absorbâncias foram lidas. Após esse procedimento, foi realizado o cálculo do teste enzimático colorimétrico GOD-POD, (glicose oxidase e peroxidase). As leituras e o cálculo para a determinação de βglucanos totais estão apresentados no ANEXO 37 desta tese.
4.5.1 Análise de cromatografia por exclusão molecular
Para a análise de cromatografia por exclusão molecular, seguimos o protocolo de Do Prado et al. (2016). A cromatografia de exclusão molecular consiste na preparação do soluto em reagente apropriado. O reagente utilizado na preparação do soluto é o mesmo utilizado na fase móvel que é injetado em uma coluna contendo partículas porosas de tamanho definido. Neste método, os solutos são eluidos da fase estacionária em ordem decrescente de tamanho molecular baseados na diferença de tamanho das moléculas presentes na amostra. Moléculas com tamanho superior ou igual aos poros serão eluidas primeiro formando o volume de vazio da coluna. Já as moléculas menores sofrerão a influência dos poros presentes nessa coluna e eluirão posteriormente da coluna com volume maior conhecido como volume de permeação ou volume total.
Resumidamente, foi realizada a diluição da amostra para a análise de βglucanos solúveis de 10 mg/mL, realizada pelo método cromatografia de exclusão molecular de alto desempenho – detecção de índice de refração (HPSEC-RID). A amostra permaneceu a 80ºC, em tampão de corrida, durante 1 h, sob agitação constante (200 rpm). Após esse período, a amostra foi centrifugada (10,000 g) por 10 min, o sobrenadante foi filtrado em 0,45 µm e seguido com a análise pelo HPSEC, de acordo com Do Prado et al. (2016).
4.6 Questionários utilizados no estudo
4.6.1 Qualidade de vida
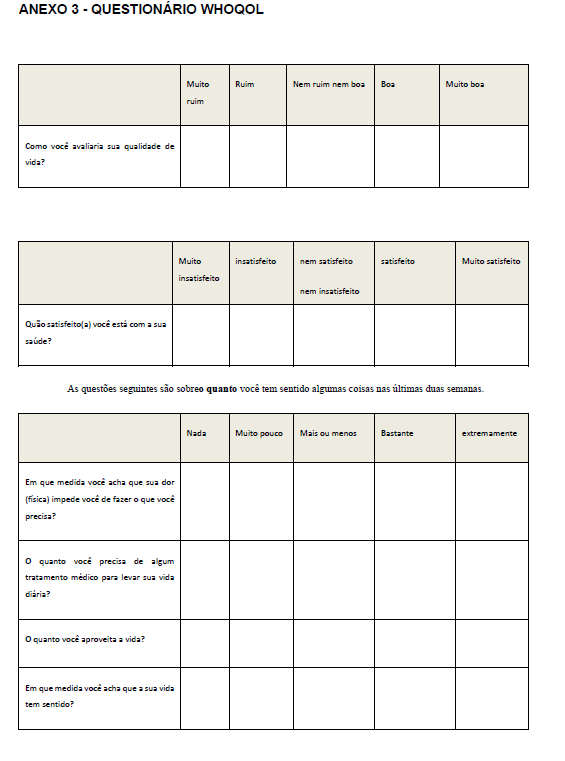
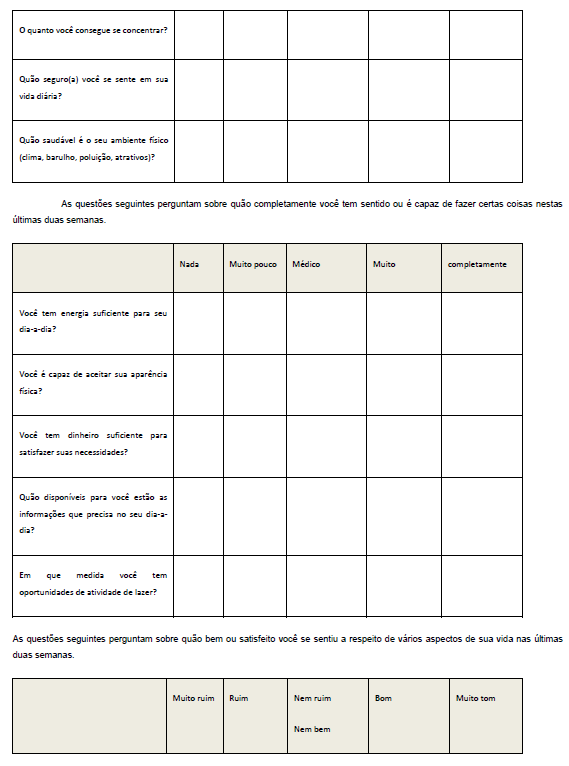
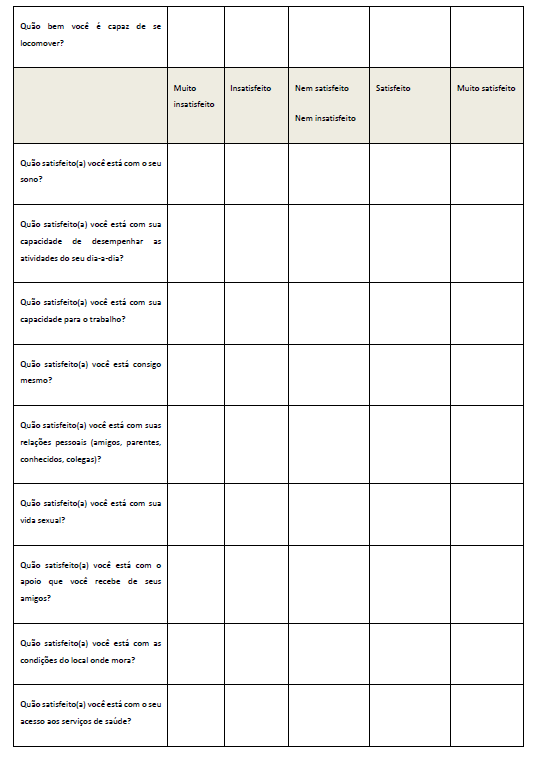
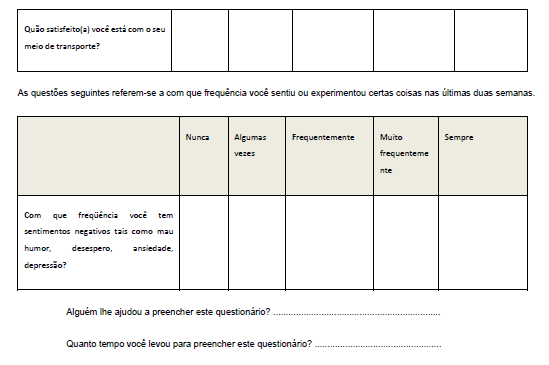
Foi aplicado o questionário para avaliação da Qualidade de Vida (WHOQOLAnexo 3), antes e após a suplementação dos grupos I e II. O questionário WHOQOL, em versão para a língua portuguesa, foi preenchido no início e fim do projeto, conforme procedimento adotado por Pedroso et al., (2009). Esse questionário é dividido em quatro partes para avaliação dos seguintes domínios: A (físico), B (psicológico) C (relações sociais) e D (meio ambiente). Este instrumento requer que o indivíduo assinale múltiplas questões para cada domínio e suas facetas, com variáveis de um a cinco. Ao final desse processo, quanto mais próximo de 100 a pontuação, melhor é a qualidade de vida do indivíduo.
4.6.2 Adesão terapêutica
Para a avaliação de adesão medicamentosa aplicaram-se dois instrumentos após a suplementação nos grupos I e II:
- O questionário MORISKY-GREEN (Anexo 5). Vários métodos atualmente são utilizados para avaliação da baixa ou não adesão terapêutica, dentre eles, métodos direto e indireto. MORISK- GREEN (1986) é muito utilizado nos EUA e é um exemplo de método indireto. Sua validação na literatura e tradução foi descrita por Aguiar (2010). Este instrumento tem sido utilizado em conjunto com outros questionários para a identificação mais apurada do regime, recordação e crença da terapia. Trata-se de um instrumento de verificação terapêutica de adesão, através de um questionário que contém poucas perguntas (Anexo 5).
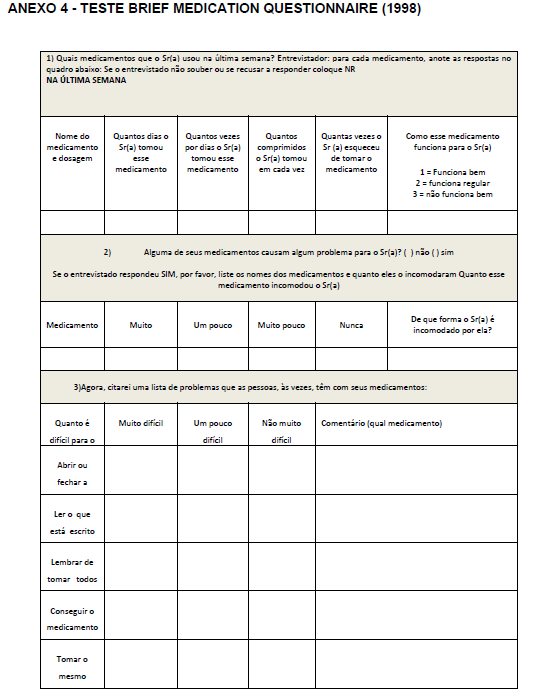
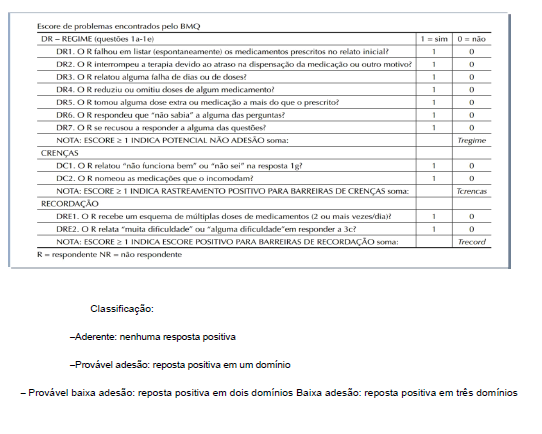
- O questionário BRIEF (Anexo 4) . Este questionário foi validado em inglês em 1998 (Anexo 4). Trata-se de um questionário dividido em três domínios capazes de identificar obstáculos à adesão, ao regime, à crença e à recordação em relação à terapia medicamentosa. O mesmo apresentou sensibilidade de 80% e especificidade de 100% no domínio regime. Sua tradução e validação em português ocorreu em 2012 por Ben et al. (2012). Este instrumento permite um rastreamento mais apurado da conduta do paciente diante do tratamento (Ben et al., 2012).
A Figura 6, a seguir, resume o desenho experimental do nosso estudo.
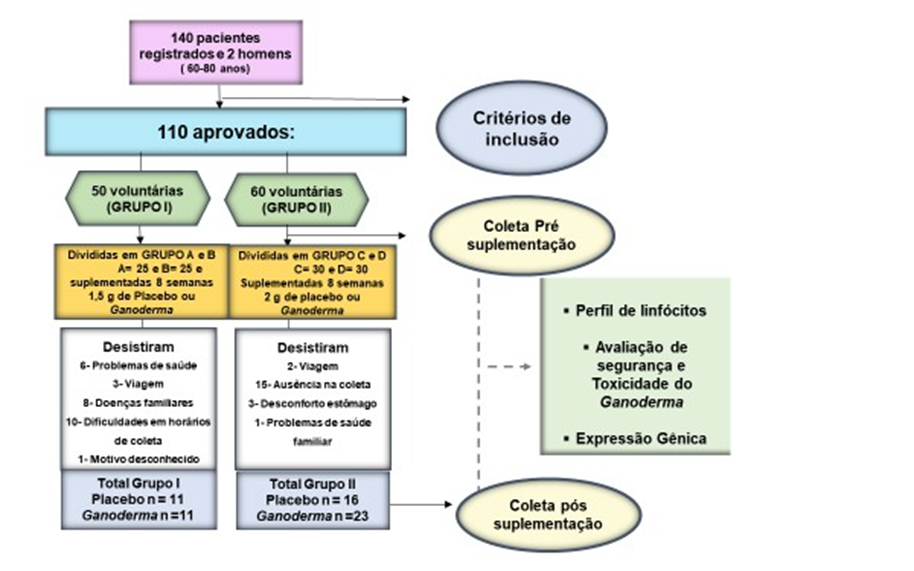
Figura 6- DESENHO EXPERIMENTAL DO ESTUDO. Em 2016, foram aprovados para o Estudo I, 50 indivíduos e concluíram o estudo, 22 indivíduos. Em 2018, foram aprovados para o Estudo II, 60 indivíduos e concluíram esta etapa 39 pacientes.
4.7 Avaliação da composição corporal por bioimpedância
A medida da composição corporal (porcentagem de gordura, massa corporal gorda e massa corporal magra) foi estimada pelo método de bioimpedância, onde a massa magra, por possuir maior quantidade de água e eletrólitos, conduz melhor a corrente elétrica do que a massa gorda. Com este método,a corrente elétrica de baixo nível é passada através do corpo do indivíduo e a impedância (z), ou oposição ao fluxo a corrente, é medida com o analisador de BIA (Biodynamics Corporation, EUA- A310). A medida de bioimpedância foi executada do lado direito do corpo, com o indivíduo deitado em decúbito dorsal em superfície não condutora, em sala com temperatura ambiente normal (~22 ºC). Com algodão embebido em álcool foi realizada previa limpeza da pele nos pontos dos eletrodos. Após, foi realizada a colocação dos eletrodos-sensores (proximais) na superfície dorsal da articulação do punho de forma que a borda superior do eletrodo se alinhasse à cabeça da ulna. Na superfície dorsal do tornozelo foram colocados outros eletrodos de modo que a borda superior do eletrodo se alinhasse aos maléolos medial e lateral. A colocação dos eletrodos-fonte (distais) deu-se na base da segunda ou terceira articulação metarcarpo-falângica da mão e metatarso-falângica do pé. Os braços e as pernas do indivíduo estavam afastados em aproximadamente 45 ºC um do outro (Lohman e Ratcliffe, 1988). O paciente esvaziou a bexiga (30 min antes) e estava em jejum de pelo menos 4 horas antes da avaliação.
4.8 Estatura
A estatura (cm) foi mensurada utilizando o estadiômetro fixado na parede da marca Sanny . O indivíduo permaneceu em de pé, ereto, braços estendidos ao longo do corpo, pés unidos e ligeiramente afastados, procurando pôr em contato com o instrumento de medida as superfícies posteriores do calcanhar, cintura pélvica, cintura escapular e região occipital. A medida foi realizada com o indivíduo em apneia inspiratória, de modo a minimizar possíveis variações sobre esta variável antropométrica. A cabeça foi orientada segundo o plano de Frankfurt, paralela ao solo. A medida foi executada com o cursor em ângulo de 90º em relação à escala. Os indivíduos estavam descalços durante a medida (Lohman e Ratcliffe, 1988).
4.9 Massa corporal
A massa corporal (kg) foi mensurada utilizando-se balança mecânica da marca Welmy modelo R-104 com capacidade para 150 Kg. O voluntário se posicionou em pé, com o olhar num ponto fixo à sua frente, utilizando roupas leves e descalças (Lohman e Ratcliffe, 1988).
4.10 Pressão arterial (PA)
Durante toda a pesquisa, foi aferida a PA de cada idoso mediante o uso de um esfignomanômetro aneróide, devidamente calibrado pelo IPEM/ Inmetro no dia da coleta. Antes de cada aferição, os idosos estavam com a bexiga vazia; sem ingerir bebida alcoólica, alimento ou café; sem praticarem atividade física e na ausência do consumo tabaco pelo menos 30 minutos antes (Sociedade Brasileira de Hipertensão, 2010).
Em cada consulta, foi realizada a aferição de PA, após 10 minutos de descanso, Cardiologia (2016). Cada aferição foi documentada e os resultados comparados antes e depois de oito semanas da administração das cápsulas aos pacientes.
4.11 Coleta de sangue
O sangue foi coletado por enfermeiro (a), com conhecimento teórico e prático das técnicas de coleta de sangue, dentro das normas de biossegurança e em ambiente apropriado. Foram utilizados para coleta os seguintes materiais: luvas, álcool gel, algodão, torniquete, agulhas, adaptador e tubos. A coleta foi realizada por punção venosa, na altura da dobra do braço e antebraço, em tubos a vácuo contendo anticoagulante heparina.
A coleta de sangue das idosas foi realizada no Instituto de Ciências da
Atividade Física e Esporte (ICAFE) da Universidade Cruzeiro do Sul. Foram coletados 20 mL de sangue por indivíduo participante do estudo. Após a coleta, os tubos foram mantidos em gelo e em seguida foi realizada a separação celular.
A coleta de sangue ocorreu em 2 etapas: a primeira antes do período de suplementação e a segunda, após 8 semanas da suplementação. Os voluntários foram orientados a não praticarem nenhum exercício físico nas 48 horas anteriores à coleta e permanecerem 12 horas em jejum antes da coleta.
4.11.1 Obtenção do plasma
A obtenção do plasma foi realizada através da centrifugação do sangue total a 400 g por 10 minutos. A fase superior foi coletada e o precipitado celular diluído em tampão salina fosfato (PBS – NaCl 136,8 mM, KCL 2,7 mM, NaH2PO4 0,9 mM, pH 7.4) na proporção de 1:2. O plasma foi congelado a -80 oC para a realização das análises.
4.11.2 Avaliação dos parâmetros plasmáticos
4.11.3 Ácidos graxos livres não esterificados
A concentração de ácidos graxos livres no plasma foi determinada através do ensaio colorimétrico utilizando-se o kit HR Series NEFA-HR, Wako Diagnostics. Após a reação do ácido graxo com os reagentes fornecidos pelo kit, forma-se o produto de coloração avermelhada (Quinoneimina). Inicialmente, o ácido graxo reage com CoA na presença da acil-CoA sintase, formando acil-CoA. Posteriormente, a reação deste com O2 levam à formação de 2,3- trans-Enoil-CoA e H2O2. Este último em reação com 4-Aminofenazona e MEHA, forma a Quinoneimina e H2O. Consequentemente, a intensidade do pigmento vermelho é proporcional à concentração de ácidos graxos livres da amostra. O produto foi determinado a 550 nm e 660 nm. A leitura foi realizada em espectrofotômetro Spectra MAX plus (Molecular Devices, CA, EUA).
4.11.4 Lipoproteína de baixa densidade (LDL)
A determinação do LDL colesterol foi realizada pelo emprego de anti-soro policlonal enzimático em partículas de látex, removendo assim as partículas de HDL e VLDL da amostra. Esta determinação foi realizada com o Kit Labtest Diagnóstica,
(LDL Colesterol Liquiform), em duas etapas, sendo a primeira, acrescentado um tensoativo reagente que solubiliza as partículas lipoproteicas não-LDL. O colesterol liberado é consumido pela enzima colesterol esterase, enquanto a enzima colesterol oxidase, oxida as lipoproteínas de não-LDL na reação sem desenvolvimento de cor. Outro tensoativo solubiliza as partículas de LDL formando cor proporcional à quantidade de LDL colesterol presente na amostra. O produto foi analisado por espectrofotometria a 660 nm e 546 nm.
4.11.5 Lipoproteína de alta densidade (HDL)
Este método foi realizado com o Kit Labtest Diagnóstica, (HDL Colesterol-LE) em duas etapas, sendo que na primeira, o colesterol livre é solubilizado e consumido na reação sem presença de cor. Na segunda etapa as HDL são solubilizadas por um detergente. O HDL-colesterol liberado reage com o colesterol esterase, colesterol oxidase e toluidina dissódica, formando o produto. O produto foi analisado por espectrofotometria a 600 nm e 700 nm.
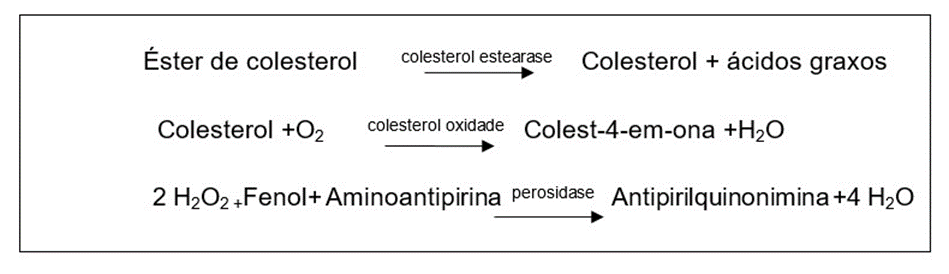
4.11.6 Colesterol total (CT)
Este método foi realizado com o kit Labtest Diagnóstica, por reação de ponto final (método colorimétrico enzimático). O éster de colesterol presente no plasma da amostra é clivado, liberando então colesterol e ácidos graxos (por ação da estearase), o colesterol liberado reage com oxigênio e a enzima oxidase, formando peróxido de hidrogênio, que, ao reagir com fenol e aminoantipirina (por ação da peroxidade), produz a cor cereja, cuja intensidade é proporcional à concentração de colesterol da amostra e lida em espectrofotômetro (comprimento de 500 nm). Esta reação foi analisada pelo aparelho Fluostar da empresa Ômega.
O princípio desta análise é representado a seguir:
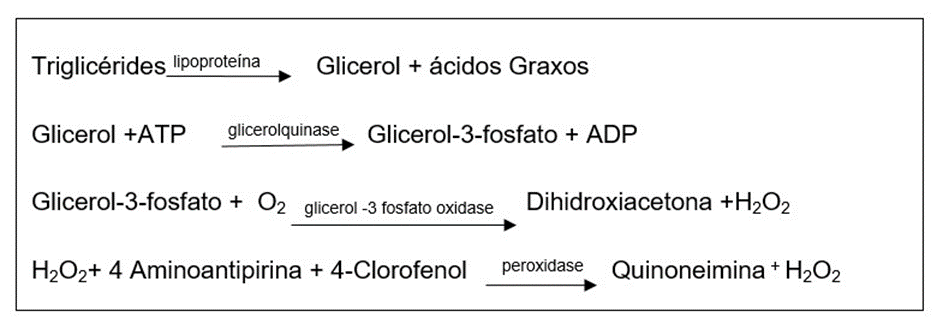
4.11.7 Triglicerídeos (TG)
Este método foi realizado com o Kit Labtest Diagnóstica por reação de ponto final, (método colorimétrico enzimático). Os triglicerídeos presentes no plasma da amostra são clivados, liberando então glicerol e ácidos graxos, o glicerol liberado reage com adenosina trifosfato, formando Glicerol-3-fosfato, que, ao reagir com oxigênio, forma peróxido de hidrogênio, que por sua vez reage com 4-aminoantipirina e 4-clorofenol, produzindo a coloração vermelha, cuja intensidade é proporcional à concentração de colesterol da amostra. O produto foi analisado por espectrofotometria a 505 nm pelo aparelho Fluostar Ômega, BMG LABTECH.
O princípio desta análise é representado a seguir:
4.11.8 Análise de GGT, TGO, TGP, lipase e creatinina
As concentrações plasmáticas de GGT, TGO, TGP e lipase foram determinadas utilizando-se os kits da Roche Brasil, segundo informações do fabricante. As análises foram realizadas no plasma que, após a coleta, permaneceram congelados por 30 dias no freezer (- 80 Cº).
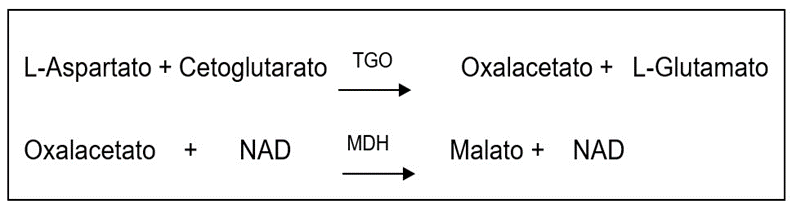
Para a análise de TGO por método cinético, basicamente, a enzima aspartato amino transferase, catalisa a transferência do grupo amina do ácido aspártico para o cetoglutarato, formando glutamato e oxalacetato. O oxalacetato é reduzido a malato por ação da malato desidrogenase (MDH), enquanto que a coenzima NADH é oxidada à NAD. Ocorre redução da absorbância em 340 nm com consequente oxidação da coenzima NADH, que é monitorada fotometricamente, sendo diretamente proporcional à atividade da enzima TGO no plasma. Esta reação pode ser observada a seguir:
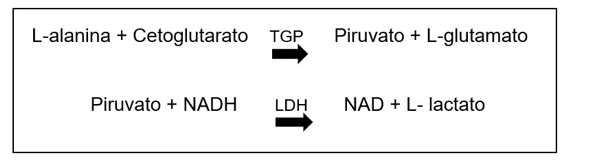
Para a análise de TGP, o princípio baseia-se na ação da enzima TGP presente no plasma que catalisa a transferência do grupo amina da alanina para o cetoglutarato, formando assim, o glutamato e piruvato. Desta forma, o piruvato é reduzido a lactato por ação da enzima lactato desidrogenase (LDH), enquanto a coenzima NADH é oxidada a NAD. A redução da absorbância ocorre em 340 nm devido à oxidação da coenzima NADH, essa reação é monitorada fotometricamente, sendo então proporcional a atividade da enzima TGP no plasma. A reação descrita anteriormente é resumida logo abaixo:
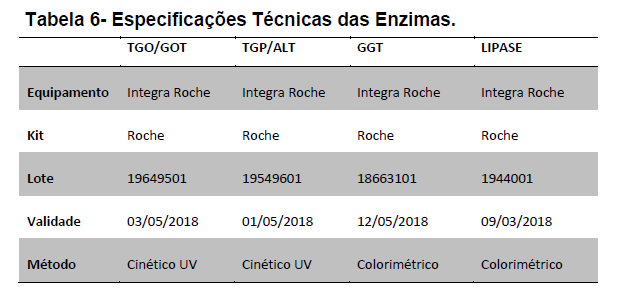
As especificações dos Kits da Roche Brasil são mostradas logo a seguir na tabela 6.
A determinação da enzima GGT foi realizada por método colorimétrico enzimático, através da presença do resíduo gama-glutamil transferido do substrato gama-glutamil-3-carboxi-4-nitroanilida. Este radical é transferido na reação para a glicilglicina. A absorbância do produto resultante da hidrólise (ácido 2-nitro-5aminobenzóico) da reação é medida em 409 nm, conforme especificações do fabricante.
Para a determinação de lipase presente no plasma, foi realizado o teste colorimétrico, onde a lipase hidrolisa o tioéster, liberando o tioálcool e ácido butírico. O tioálcool reage com ácido 5,5-ditio-bis-2-nitrobenzóico e, em consequência disso, ocorre à formação de um ânion com coloração amarela. Sua intensidade de cor é proporcional à presença da enzima e sua absorbância é lida em 412 nm.
Para a dosagem de creatinina, utilizou-se o soro como amostra e as análises foram realizadas no mesmo dia das coletas, conforme recomendação do fabricante. Para esta análise, utilizou-se o aparelho Fluostar Ômega da empresa BMG LABTECH e o kit da empresa Labtest Diagnóstica. A amostra contendo creatinina reage com o ácido pícrico em meio alcalino, isso produz o picrato de creatinina, de cor vermelha que é proporcional à concentração de creatinina presente na amostra. A leitura da absorbância é realizada em 510nm. A adição do ácido pícrico abaixa o pH para 5,0 e isso promove a decomposição do picrato de creatinina, permanecendo inalterada a cor derivada dos cromogênios, que também é medida por fotometria. A diferença entre as duas leituras fornece o valor da creatinina não corrigida.
4.11.9 Dosagem de glicose plasmática
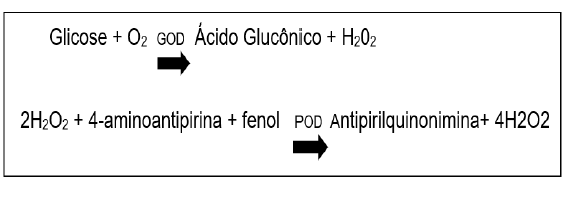
Esta análise foi determinada pelo método enzimático de acordo com as recomendações do Kit Labtest Diagnóstica. Nesta reação, a enzima glicose oxidase catalisa a reação de oxidação da glicose formando o ácido glucônico e o peróxido de hidrogênio. O peróxido de hidrogênio formado reage com a 4-aminoantipirina e fenol, sob a ação da enzima peroxidase, através da reação oxidativa de acoplamento, formando a antipirilquinonimina (cor vermelha). A intensidade da cor produzida é então proporcional à concentração de glicose na amostra.
A reação descrita acima é representada abaixo:
4.12 Parâmetros urinários
4.12.1 Análise de bilirrubina e proteína na urina
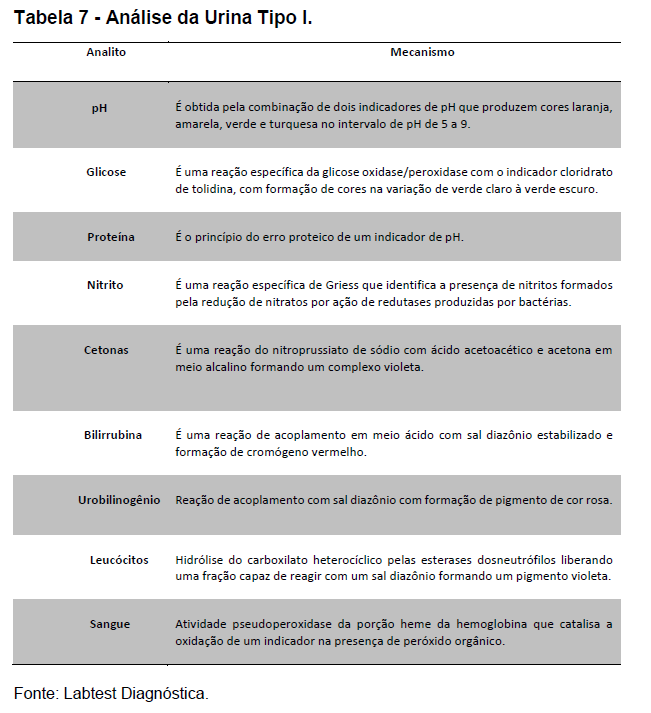
A coleta de urina foi realizada em local reservado utilizando-se coletor universal. As voluntárias foram orientadas sobre os cuidados com a coleta (jato médio e assepsia), sendo desprezado o primeiro jato de urina. A presença de bilirrubina e proteínas totais na urina foi realizada utilizando-se kit Labtest Diagnóstica (URIQUEST PLUS I). Este kit apresenta capacidade para os seguintes analitos (bilirrubina, cetonas, densidade, glicose, leucócitos, nitrito, pH, proteína, sangue, urobilinogênio). A análise foi realizada entre 1 a duas horas, com amostras mantidas sob refrigeração (2-8 Cº) até o início da análise, conforme recomendação do fabricante.
De acordo com o fabricante, a tira de urina apresenta vários reagentes químicos secos, formando a reação colorimétrica quando em contato com a amostra. Os princípios das reações químicas são demonstrados na tabela a seguir.
4. 13 Avaliação dos linfócitos
4.13.1 Separação dos linfócitos
Para a separação de linfócitos foi utilizado o reagente Histopaque®1077 (Sigma Chemical Co, St. Louis, MO, EUA). Em um tubo de 15 mL , foram adicionados 3 mL de Histopaque e, em seguida, vagarosamente, 6 mL de sangue diluído na proporção de 1:2 em PBS. Após, realizada a centrifugação a 400 g por 30 minutos à temperatura ambiente. Esta centrifugação possibilita a separação dos componentes celulares, onde na parte superior permanece o plasma, na interface as células mononucleares seguida do Histopaque e, por fim, os eritrócitos e granulócitos sedimentam no fundo do tubo.
Com uma pipeta Pasteur foram coletadas as células mononucleares contidas na interface e transferidas para um tubo de 50 mL. Posteriormente, as células foram diluídas em PBS. Após a diluição, a suspensão foi centrifugada a 400 g por 10 minutos, a 4ºC. O sedimento final foi ressuspenso em 1 mL de PBS.
Para obtenção dos linfócitos, as células mononucleares foram incubadas em ambiente estéril em garrafa de cultura com área de 75 cm² contendo meio de cultura RPMI-1640, enriquecido com glutamina a 2 mM, tamponado com bicarbonato de sódio a 24 mM, HEPES a 20 mM, 10% de soro fetal bovino (SFB) e antibiótico (1000 U/ml de penicilina e 1000 g/ml de estreptomicina). As células mononucleares foram incubadas em cultura por 1 hora, a 37oC / 95% ar atmosférico / 5% CO2. Os monócitos aderiram à garrafa e os linfócitos permaneceram no sobrenadante. Os linfócitos foram mantidos em meio RPMI a 4ºC.
Os linfócitos obtidos como descrito acima, foram centrifugados a 400 g por 10 minutos e após, desprezado o sobrenadante. As células foram ressuspensas em PBS. Após, realizada diluição de 50 vezes para contagem de células em câmara de Neubauer.
Os linfócitos foram congelados em DMSO com soro fetal a bovino a 10% no freezer a –80 oC até a realização de todas as análises de ensaio celular.
4.13.2 Cultura primária de linfócitos humanos
Os linfócitos foram mantidos em meio RPMI-1640, enriquecido com glutamina a 2 mM, tamponado com bicarbonato de sódio a 24mM, HEPES a 20mM, 10% de soro fetal bovino (SFB), e antibióticos (10000 U/mL de penicilina e 10000 g/ml de estreptomicina). A cultura foi mantida a 37oC com 5% de CO2 e 95% de ar atmosférico, por 48-60 horas para os ensaios de proliferação celular e produção de citocinas.
A concentração de manutenção dos linfócitos foi sempre de 1×106 células por mL em todos os ensaios.
4.13.3 Capacidade proliferativa
A capacidade proliferativa foi avaliada através da incorporação de BrdU no
DNA das células in vitro utilizando-se o kit APC BrdU Flow Kit (BD Biosciences). Resumidamente, os linfócitos foram ressuspensos em 1 mL de meio RPMI-1640 suplementado com 10% de soro fetal bovino contendo antibióticos (penicilina 10.000 U e estreptomicina 10 mg/L de meio). Após a centrifugação, os linfócitos foram cultivados em placas de 96 poços, contendo 2,5 x 105 (Estudo I) e 1,0x 106 (Estudo II) células por escavação e incubados a 37oC e atmosfera de 95 % ar e 5 % CO2. No início da cultura, os linfócitos foram estimulados com PHA (5 μg/mL) e incubados com 10 μM de BrdU por 48 horas, estudo I. No estudo II, foram estimulados com concanavalina (5 μg/mL) por 60 horas. Após este período, foi feita a permeabilização (saponina) e fixação das células com BD Cytofix/ Buffer Cytoperm (100 μL para 1×106 células, a temperatura ambiente por 30 minutos). Posteriormente as células foram lavadas com 500 μL da solução BD Perm/Wash Buffer e incubadas com 100 μL de DNase (300 μg/mL em DPBS) por 1 hora, a 37 oC. A seguir, as células foram lavadas com 500 μL da solução BD Perm/Wash Buffer e incubadas com 50 μL de solução BD Perm/Wash Buffer contendo o anticorpo anti-BrdU conjugado à APC (1:50) por 20 minutos a temperatura ambiente. As células foram lavadas novamente conforme descrito anteriormente e ressuspensas em 200 μL de PBS. Por fim, as células foram analisadas por citometria de fluxo no BD-Accuri (Becton Dickinson). Dez mil eventos foram adquiridos por amostra em histogramas. Os histogramas foram analisados através do BD Accuri C6 Software (Becton Dickinson).
4.13.4 Determinação da produção de citocinas de resposta Th1/Th2/Th17 no
sobrenadante de cultura de linfócitos
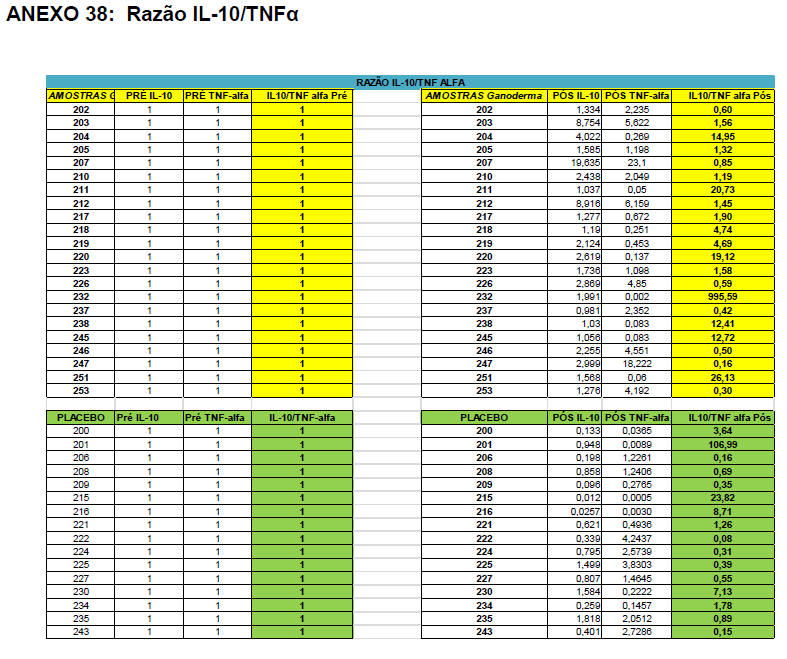
Após o tratamento das células em cultura com 5 μg/mL de fitohemaglutinina (Estudo I) e 5 μg/mL de concanavalina (Estudo II) por 48 horas e 24 horas, foram realizadas as medidas da concentração de TNF-α, IL-6, IL-4, IL-2, IL-10, INF- e IL17A no sobrenadante da cultura de linfócitos através do kit BD™ CBA Human Cytokine Kit (BD Biosciences), conforme instruções do fabricante. Estas citocinas são amplamente produzidas por linfócitos Th1 (IL-2, INF- e TNFα), Th2 (IL-4 e IL-10) e Th17 (IL-17A e IL-6).
O método CBA (Cytometric Bead Array) consiste em esferas de poliestireno contendo diferentes intensidades de fluorescência (em APC), conjugadas com anticorpos de captura específicos e são detectadas no canal FL-4 no citômetro BDAccuri. Os anticorpos de detecção foram marcados com o fluorocromo PE, detectado no filtro FL-2. Essa metodologia permite a avaliação simultânea de diversas citocinas no mesmo ensaio.
Em resumo, 25 µL das partículas contendo diferentes intensidades de fluorescência e cobertas com os anticorpos específicos para as citocinas foram adicionados a 25 µL do sobrenadante de cultura e incubados por uma hora, à temperatura ambiente, ao abrigo da luz. Nas amostras estimuladas com PHA e ConA, foi realizada a diluição de quatro vezes. A seguir, 25 µL do anticorpo secundário conjugado ao fluorocromo foi adicionado à mistura e incubado por duas horas a temperatura ambiente. Paralelamente, os padrões para cada citocinas foram utilizados da mesma forma no lugar da amostra. As partículas foram lavadas para remoção dos anticorpos não ligados, ressuspensas em tampão de lavagem e analisadas, utilizando o BD Accuri (BD Biosciences). A aquisição foi realizada no BDAccuri C6 Software e as concentrações determinadas utilizando-se o FCAP software v.3.0 (BD, Biosciences).
4.13.5 Análise da expressão de CD28, porcentagem de células Treg, Th1, Th2 e Th17
Após a separação dos linfócitos, foi realizada a determinação da expressão de CD28+ na superfície de linfócitos por citometria de fluxo. A suspensão de células (1,0 x106 células) foi centrifugada a 400 g por 15 minutos, seguida de lavagem por duas vezes com PBS contendo 1% de albumina e as células ressuspensas em 100 μL deste tampão. O anticorpo específico conjugado a PERCP-Cy5 (CD28+) foi adicionado a esta suspensão (1:20) e as células foram incubadas a temperatura ambiente, por 30 minutos e protegidas da luz. As células do controle negativo foram incubadas com o anticorpo marcado não reativo IgG.
Inicialmente, para a determinação das células Th17, Th1 e Th2, os linfócitos
(1×106) foram incubados com PMA (5 μg/mL) e ionomicina (1 µg/mL) em meio RPMI 1640 suplementado com soro fetal bovino (10%), por 12 horas. Posteriormente, as células foram lavadas com PBS (1% de BSA) e marcadas com anti-CD4 PERCPCY5.5, incubado por 30 min, à temperatura ambiente. Após, realizamos a fixação das células (formaldeído 1%) e seguimos para a permeabilização. As células foram incubadas com tampão contendo agente permeabilizante (Becton Dickinson) por 15 min, seguida de incubação com os anticorpos anti IL-17A PE, anti-INFɣ FITC, antiCD4 PERCP-CY5.5, por 30 min. Após, foi realizada a leitura no citômetro de fluxo. Foram adquiridos vinte mil eventos positivos para CD4+ em histogramas. Os histogramas foram analisados através do “BD-Accuri software” (Becton Dickinson).
4.13.6 Avaliação da expressão do mRNA das citocinas produzidas por PCR em tempo-real
A expressão do mRNA das citocinas IL-2, IL-17, IL-35, TGF- e dos fatores de transcrição RORɣ, FOXP3, T-bet e GATA-3 foram determinados na população de linfócitos totais. Determinamos também a expressão gênica de IL-10, IL-6, TNFα e INFɣ. O YWHAZ e β2M foram utilizados como genes constitutivos para a normalização dos dados. Nosso grupo de estudo utilizou o programa G-Norm e foram avaliados os genes constitutivos, HDHA, β-Actina e GAPDH e, dentre estes constitutivos os que apresentaram menor variação foram os genes YWHAZ e β2M.
4.13.7 Extração de RNA total
O RNA total foi extraído de 1×107 células utilizando o reagente TRIZOL (Thermo Fisher, Carlbad, CA, USA). As células foram centrifugadas, homogeneizadas com 1 mL do reagente de extração e incubadas à temperatura ambiente por 5 minutos. Após adição de 0,2 mL de clorofórmio, os tubos com as células foram agitados vigorosamente por 15 segundos e incubados à temperatura ambiente, por 3 minutos. A separação das fases foi feita por centrifugação a 12.000 g por 15, minutos a 4°C. O RNA presente na fase aquosa (superior) foi transferido para outro tubo, precipitado pela adição de 0,5 mL de isopropanol e incubado por 10 min, à temperatura ambiente. Posteriormente, a amostra foi centrifugada a 12.000 g por 10 min, a 4°C. O sedimento foi lavado com 1 mL de etanol a 75 %, agitado em com o uso de vórtex, centrifugado a 7000 g por 5 minutos, seco à temperatura ambiente e ressuspenso em água contendo DEPC (dietilpirocarbonato).
A concentração do RNA foi determinada por espectrofotometria (Pharmacia Biotech, Cambrigde, UK) nos comprimentos de onda de 260 nm (correspondente ao pico de absorção de RNA) e 280 nm (correspondente ao pico de absorção de proteínas).
4.13.8 Síntese do cDNA
A síntese do DNA complementar (cDNA) foi realizada a partir de 1 µg de RNA total extraído e tratado conforme descrito anteriormente. A síntese do cDNA foi realizada utilizando a seguinte mistura de reagentes (High Capacity cDNA Reverse Transcription Kit, ThermoFisher): 0,8 µL de “Random primers” e 1,0 µL da enzima transcriptase reversa (High Capacity cDNA Reverse Transcription Kit, ThermoFisher), 2 µL do tampão da enzima (10X), 2,0 µL de dNTP (100 mM), em um volume final de reação de 20 μL. Esta mistura final foi incubada por 10 min a 25°C para permitir a hibridização dos oligonucleotídeos randômicos ao RNA, seguida de aquecimento a 37°C por 120 min e 85 °C por 5 minutos. O cDNA assim obtido foi armazenado a 20°C até a realização da PCR em tempo real.
4.13.9 Reação de amplificação
As sequências dos primers específicos para a análise da expressão gênica foram designadas através do uso do banco de dados público Gene Bank da National Center for Biotechnology Information (NCBI), acessado via internet (http/www.ncbi.nlm.nih.gov/genbank). O desenho de primers foi realizado utilizando a ferramenta Pick primer (NCBI) (Tabela 8).
A temperatura de hibridação dos primers foi padronizada para compor o modelo de ensaio da PCR em tempo real. Os parâmetros utilizados para a realização das análises por PCR foram padronizados. As sequências dos estão apresentadas na Tabela 8.
A quantificação do mRNA foi determinada utilizando-se o kit Platinum SYBR Green Qpcr Super Mix-UDG (ThermoFisher, USA) através do equipamento Quant Studio 3 (ThermoFisher, USA). Inicialmente foram adicionados 5 µl da amostra de cDNA, 0,5 µL do primer sense e do anti-sense (concentração final de 200 nM) em 12,5 µL do reagente Platinum SYBR Green qPCRSuperMix-UDG. O volume final foi completado com água livre de RNase para 20 µL.
Durante a padronização para cada primer utilizado, foram realizadas curvas de eficiência que apresentaram: porcentagem de eficiência entre 90 e 110%, slope próximo de -3,33 e R2 maior que 0,99.
O valor da quantificação relativa de cada gene alvo foi expresso através do método comparativo de CT (Ct = threshold cycle; número de ciclo no qual o produto do PCR atinge um limiar de detecção). A seguinte fórmula foi utilizada para calcular a relação entre o transcrito e o gene de referência (YWhaz), (Estudo I), e β2M (Estudo II) : 2-DDCT, onde DCT é a diferença entre o CT do gene de interesse e o de referência, e DDCT é igual a média do DCT da amostra no período pós – a média do DCT da amostra no período pré (Livak e Schmittgen, 2001; Pfaffl, 2001).
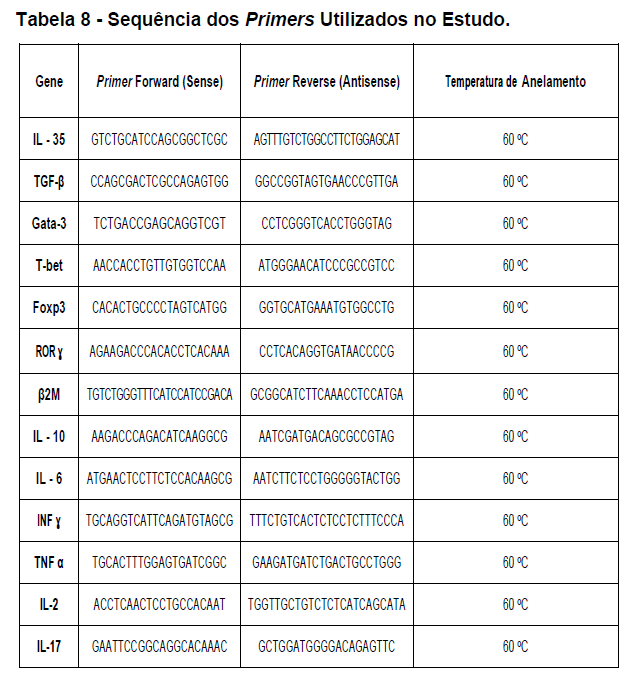
5. ANÁLISE ESTATÍSTICA
Foi realizada a estatística descritiva, com média e desvio padrão e teste de normalidade dos dados D’Agostino Pearson. A distribuição dos dados foi normal para todas as análises. Foram realizados o ANOVA TWO-WAY de medidas repetidas, seguido do pós-teste Sidak. Foi adotado como critério de significância o valor de p< 0,05, que foi determinado pelo programa Graph Pad Prism 6.
6. RESULTADOS DO ESTUDO I
6.1 Caracterização da amostra
A Tabela 9 mostra os resultados referentes às medidas antropométricas e de composição corporal das idosas do estudo I. Nas análises de circunferência da cintura, IMC, peso, relação cintura/quadril e altura, não houve diferença estatística significativa após a suplementação entre os grupos Ganoderma e placebo para os parâmetros avaliados.
Na análise de porcentagem de gordura e circunferência de quadril, houve diferença significativa (P < 0,05) na comparação entre Grupo Ganoderma e Grupo placebo no período PRÉ. Houve também redução na circunferência de quadril e aumento de massa magra no Grupo Ganoderma (PRÉ e PÓS).
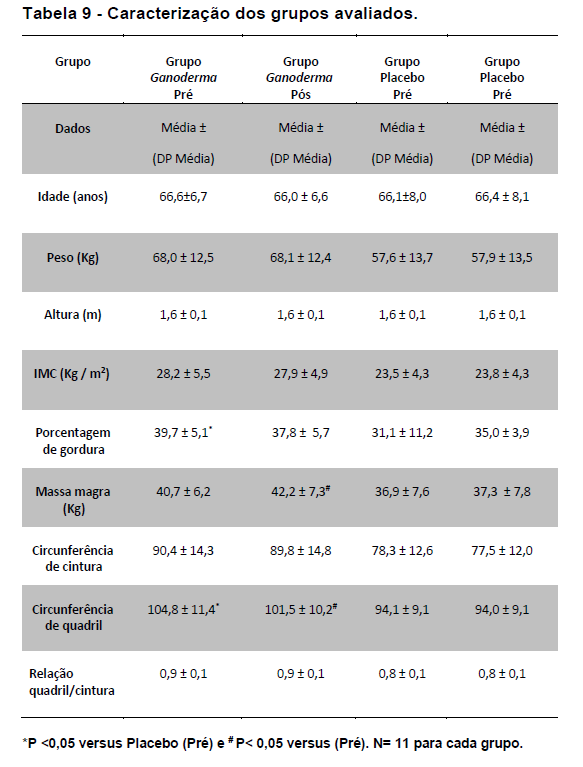
6.2 Avaliação de parâmetros plasmáticos
Em relação aos níveis plasmáticos de glicose (Figura 7) não se observou diferença antes (Pré) e após (Pós) oito semanas de suplementação para os dois grupos (A= Ganoderma e B= placebo). Também não foram encontradas diferenças intergrupos.
Figura 7- CONCENTRAÇÃO PLASMÁTICA DE GLICOSE. A concentração de glicose foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo e Ganoderma (Pós). Os valores estão apresentados como média ± EPM. N=11 para cada grupo.
Na análise do colesterol total antes e após oito semanas de suplementação com placebo e Ganoderma (Figura 8), não houve diferença significativa entre os grupos. Para as análises de HDL e LDL, também não encontramos diferenças significativas para ambos os grupos (Pré e Pós) suplementados. Embora alguns pacientes apresentem antes da suplementação valores de referência do colesterol total superior a 200 mg/dL e LDL superior a 100 mg/dL, estes valores se mantém após a suplementação, sem diferenças significativas. A maioria dos pacientes apresentam índice de HDL superior a 50mg/dL.
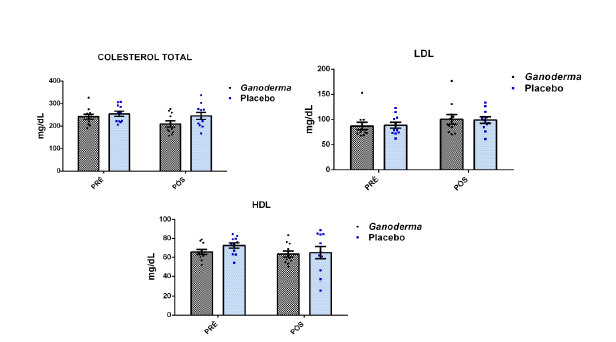
Figura 8- CONCENTRAÇÃO DE COLESTEROL TOTAL NO PLASMA, LDL e HDL. A concentração de colesterol total e frações foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=11 para cada grupo.
Na avaliação de triglicerídeos não houve diferença significativa em ambos os grupos (Ganoderma e Placebo). O mesmo observou-se para a comparação intergrupos (Figura 9). Embora alguns pacientes apresentem antes da suplementação valores de referência do triglicerídeos superior ao desejável (150 mg/dL), estes valores mantém-se após a suplementação, sem diferenças significativas.
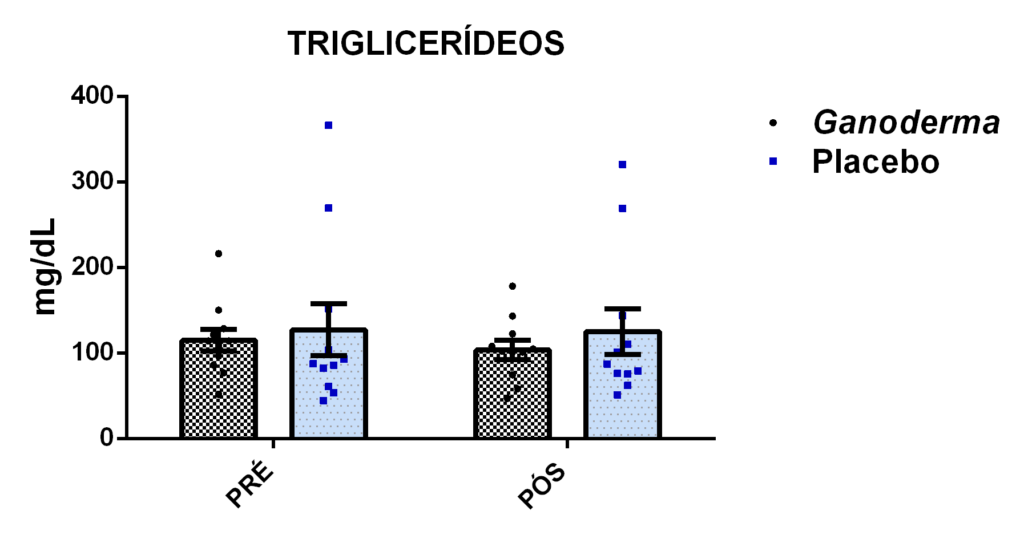
Figura 9- CONCENTRAÇÃO DE TRIGLICERÍDEOS NO PLASMA. A concentração de triglicerídeos foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo.
6.3 Avaliação do perfil de ácidos graxos livres
A Figura 10 representa a análise plasmática de ácidos graxos livres. No período PRÉ, o grupo placebo apresentou maiores níveis em relação à Ganoderma.
No entanto, após a suplementação esta diferença deixou de existir.
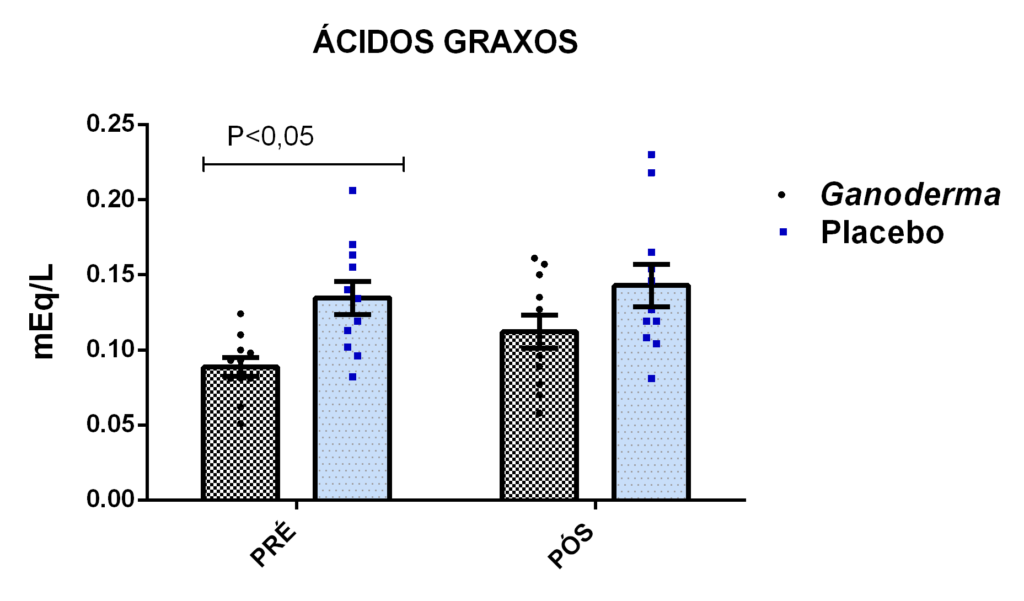
Figura 10 – ANÁLISE DE ÁCIDOS GRAXOS LIVRES NO PLASMA. A concentração de ácidos graxos no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com Placebo e Ganoderma foi determinada. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo.
6.4 Avaliação de marcadores hepáticos e pancreáticos
Foram analisados os marcadores hepáticos (TGO, TGP, GGT) e o marcador pancreático lipase. Na análise de TGO (Figura 11), não houve diferença significativa entre os dois grupos no período pós-suplementação. No entanto, observamos maiores níveis de TGO no grupo Placebo, no período Pré. Após a suplementação, os níveis de TGO neste grupo diminuíram. Vale salientar que em ambos os grupos todos os valores estão dentro da faixa de referência (até 50 U/L).
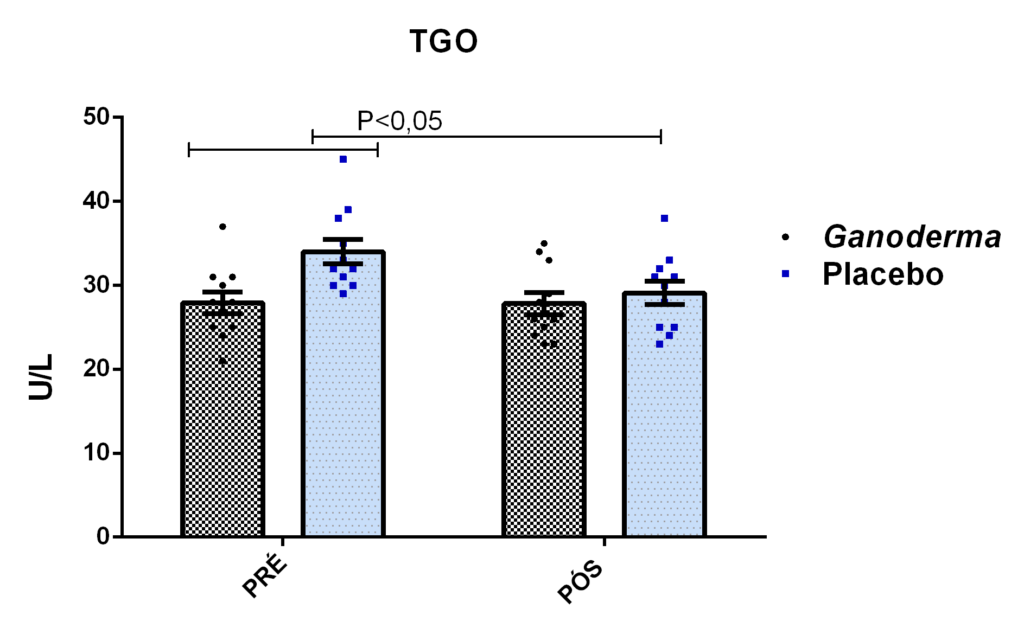
Figura 11- CONCENTRAÇÃO DE TGO NO PLASMA. A concentração da enzima TGO foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo. TGO, transaminase glutâmica oxaloacética.
Na análise de TGP (Figura 12), não houve diferença significativa entre os dois grupos pós-suplementação. Porém, observamos aumento no grupo Ganoderma após oito semanas de suplementação. No entanto, os valores encontram-se abaixo de 50 U/L (valor de referência para TGP).
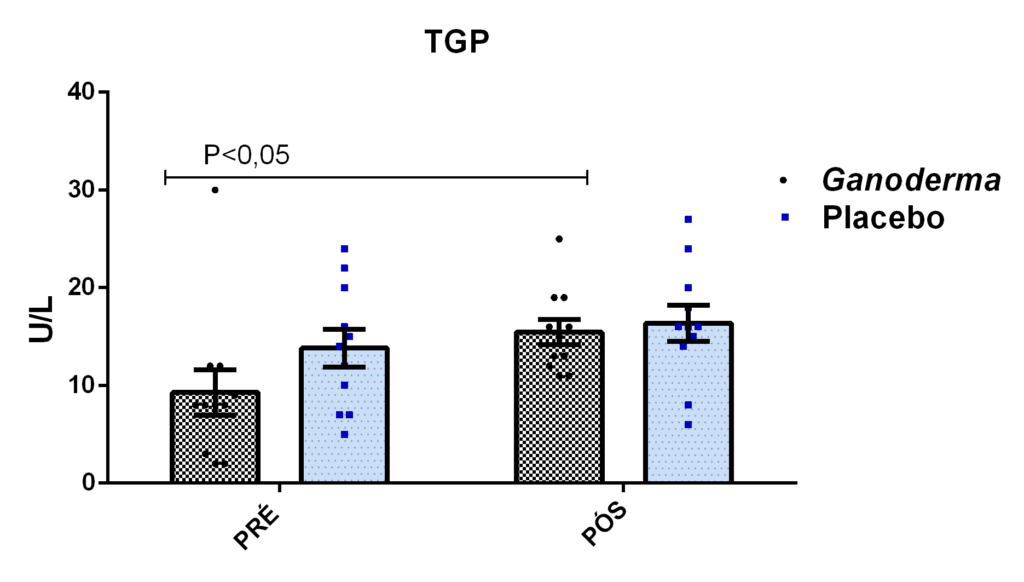
Figura 12 – CONCENTRAÇÃO DE TGP NO PLASMA. A concentração da enzima TGP foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo. TGP, transaminase glutâmica pirúrvica.
Em relação aos níveis plasmáticos de GGT (Figura 13), não se observou diferença significativa em ambos os grupos e na comparação entre eles. Alguns indivíduos na fase pré suplementação apresentam valores acima da faixa de normalidade, 50U/L, no entanto, essa diferença permanece após a suplementação, sem aumento significativo.
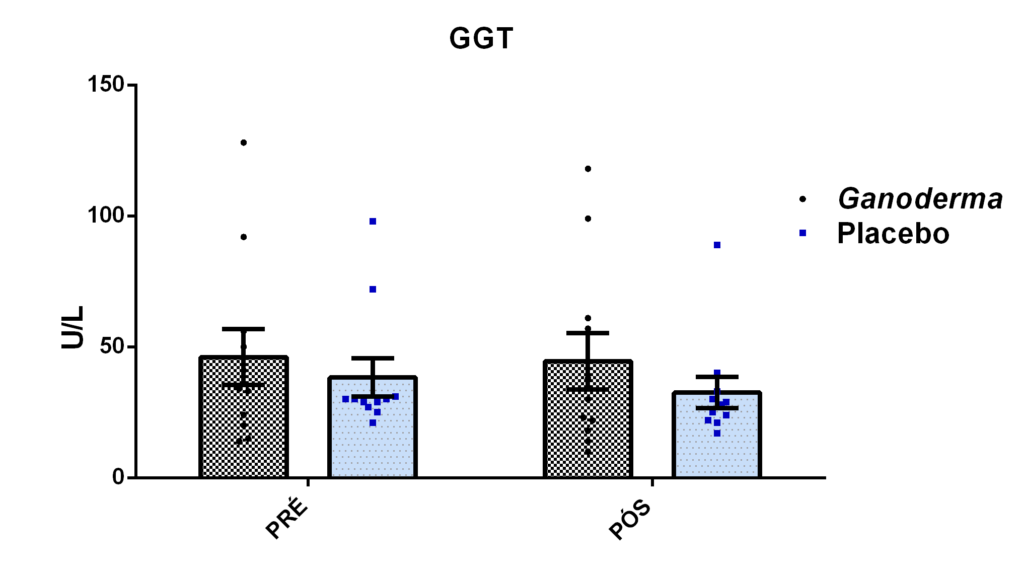
Figura 13– CONCENTRAÇÃO DE GGT NO PLASMA. A concentração da enzima GGT foi determinada (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo. GGT, gamaglutamiltransferase.
Em relação aos níveis plasmáticos da enzima lipase (Figura 14), não se observou diferença significativa na comparação intergrupos e intragrupos. Alguns indivíduos na fase pré-suplementação apresentam valores acima da faixa de normalidade, 50U/L, no entanto, essa diferença permanece após a suplementação, sem aumento significativo.
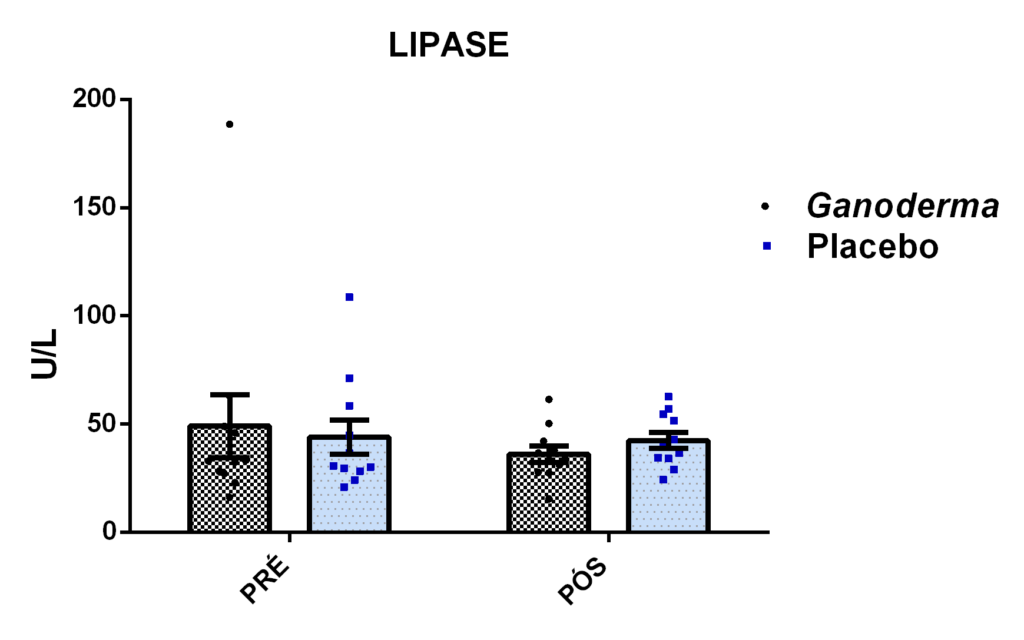
Figura 14 – CONCENTRAÇÃO DE LIPASE NO PLASMA. A concentração da enzima lipase foi determinada (Pré) e após oito semanas de suplementação com placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N =11 mulheres para cada grupo.
6.5 Avaliação de marcadores renais
Para a avaliação de possíveis alterações renais foi realizado o teste de urina I. Foram avaliados os principais analitos presentes na urina para a prova de função renal (proteína e bilirrubina) e não houve alteração no teste qualitativo e quantitativo de analitos para os dois grupos, antes e após suplementação (Tabela 10 e 11).
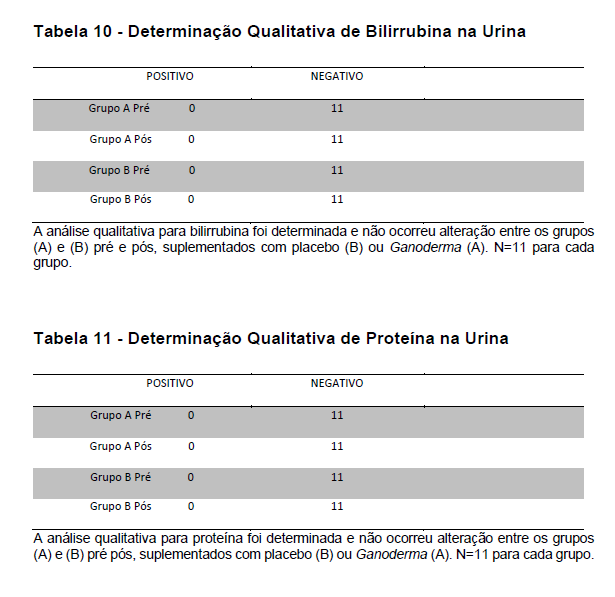
Para a prova de função renal, também foi realizada a análise de creatinina no soro. Não houve diferença significativa na comparação entre os grupos Ganoderma e placebo após a suplementação. No entanto, observou-se redução de creatinina no grupo Placebo após 8 semanas de suplementação (Figura 15).
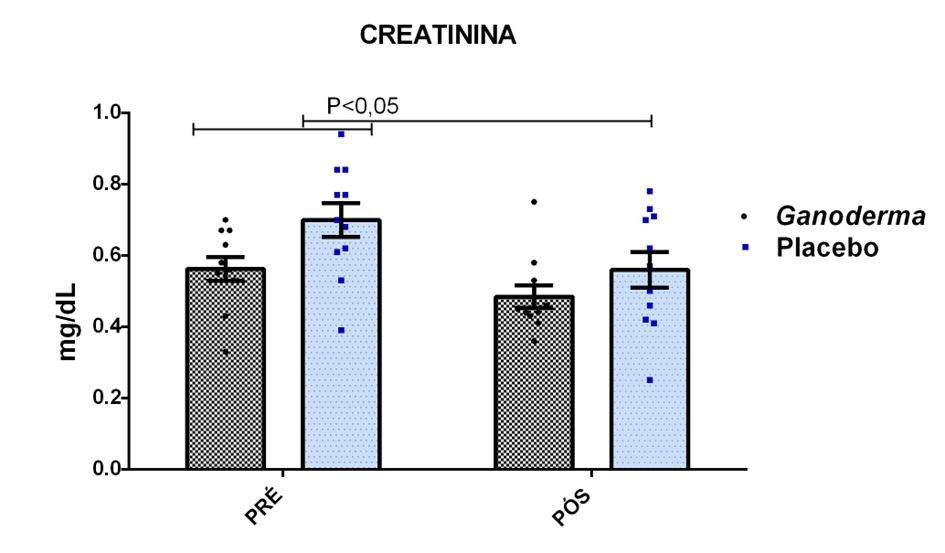
Figura 15 – CONCENTRAÇÃO DE CREATININA NO SORO. A concentração de creatinina foi determinada no soro antes (Pré) e após a suplementação com placebo ou Ganoderma. Os valores estão apresentados como média ± EPM. N=11 mulheres para cada grupo.
6.6 Avaliação do perfil de linfócitos
6.6.1 Avaliação da expressão de CD28+ e proliferação
Para a análise da expressão de CD28+, não observamos diferenças entre os grupos Ganoderma e Placebo (Pré e Pós). A Figura 16 representa a análise quantitativa da média de fluorescência para células CD28+.
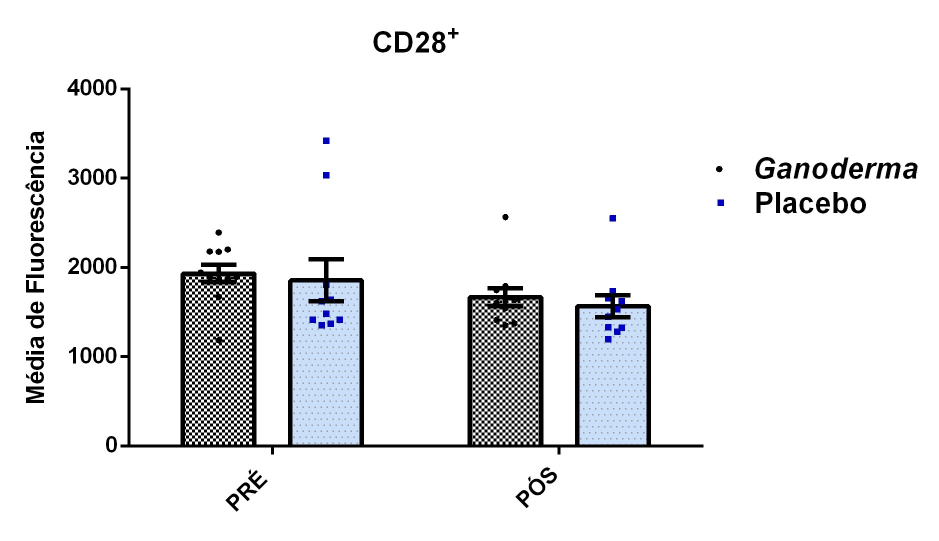
Figura 16 – EXPRESSÃO DE CD28+ NA SUPERFÍCIE DE LINFÓCITOS HUMANOS. A média de fluorescência para células CD28+ foi avaliada antes (Pré) e após dois meses de suplementação com Ganoderma ou Placebo. Os linfócitos foram incubados com anticorpo anti-human CD28-PercP-Cy5 (1:20). A análise foi realizada pela porcentagem de células CD4+, positivas para CD28+ através do “BD C-Sampler Software”. Os valores estão apresentados como média ± EPM. N=11 para Ganoderma e N=10 para grupo placebo.
Na análise de proliferação dos linfócitos “in vitro” (Figura 17) na presença de PHA, não encontramos diferenças significativas entre os grupos Ganoderma e Placebo (Pré e Pós).
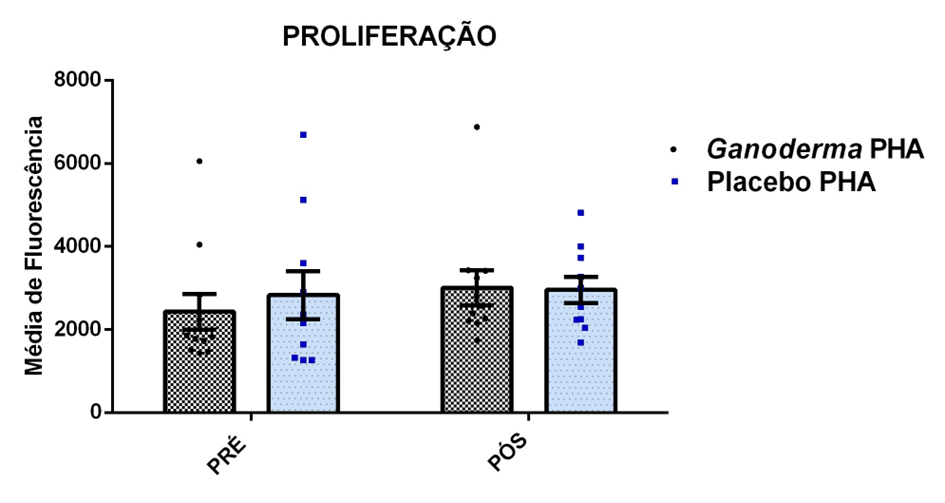
Figura 17- CAPACIDADE PROLIFERATIVA DE LINFÓCITOS ESTIMULADOS “ IN VITRO” COM PHA. Foi realizada a análise da proliferação de linfócitos antes (Pré) e após a suplementação com placebo ou Ganoderma. Os linfócitos foram incubados com BRDU por 48 horas na presença de PHA. Posteriormente foi realizada a marcação com anticorpo antiBRDU marcado com APC. A análise foi avaliada pela média de fluorescência através do “BD Accuri C6 Sampler Software”. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
6.6.2 Avaliação do sobrenadante da cultura de linfócitos
A Figura 18 representa a análise da citocina IL-2 no sobrenadante da cultura de linfócitos na presença de PHA. Observamos redução da produção de IL-2 no grupo Placebo após a suplementação. Porém, não encontramos estas mesmas diferenças no grupo Ganoderma (Pré e Pós). O grupo Ganoderma mostra tendência à redução da IL-2.
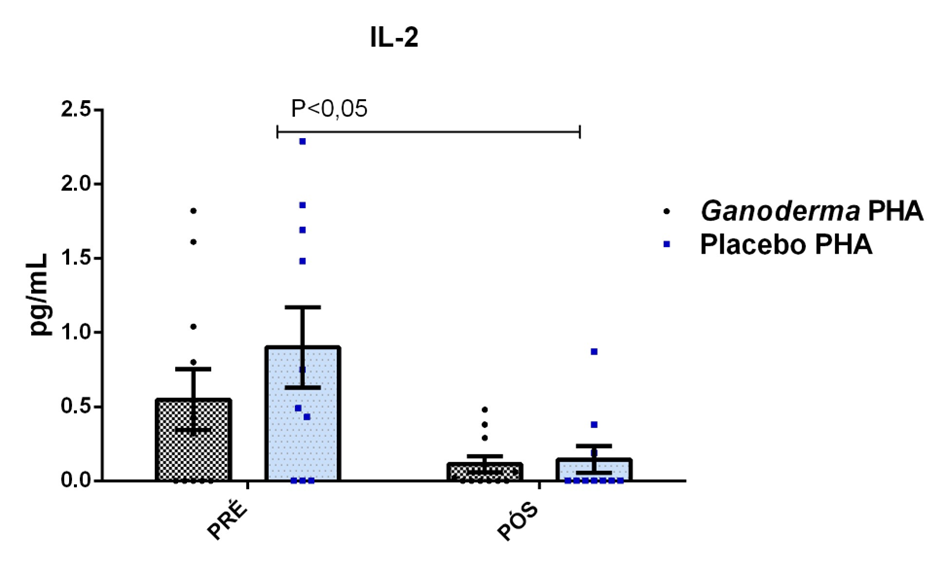
Figura 18 – CONCENTRAÇÃO DA CITOCINA IL-2 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 10 5 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 19 representa a análise da citocina IL-4 na presença de PHA no sobrenadante de cultura de linfócitos. Não foi possível observar diferença significativa entre os grupos Placebo (Pré e Pós) e Ganoderma (Pré e Pós).
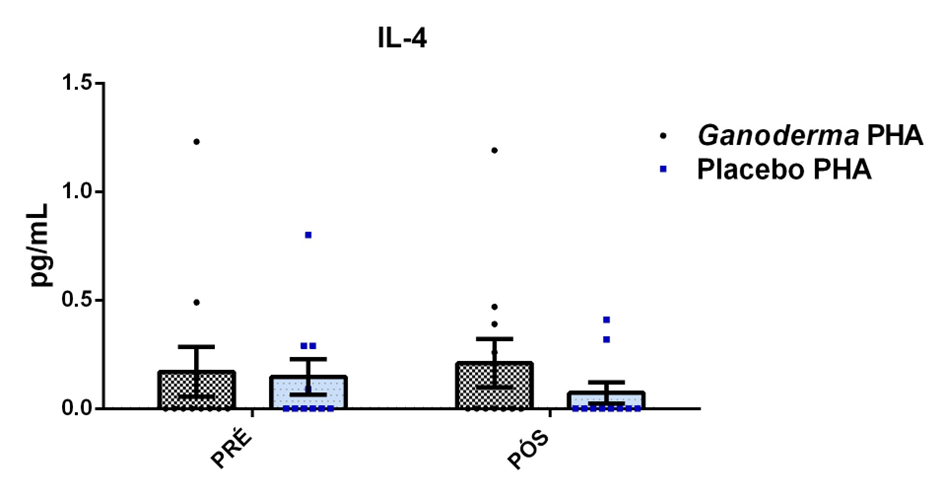
Figura 19 – CONCENTRAÇÃO DA CITOCINA IL-4 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 10 5 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 20 representa a análise da citocina IL-5 na presença de PHA no sobrenadante de cultura de linfócitos. Não foi possível observar significância entre os grupos.
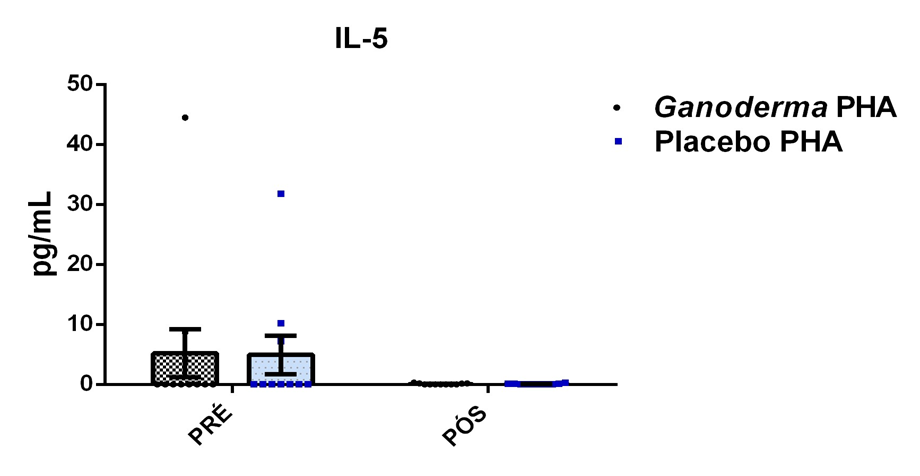
Figura 20- CONCENTRAÇÃO DA CITOCINA IL-5 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 10 5 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 21 representa a análise da citocina IL-10 na presença de PHA no sobrenadante de cultura de linfócitos. Foi possível observar redução significativa para esta citocina no grupo Ganoderma (Pré e Pós). Não observamos diferenças entre os grupos Placebo e Ganoderma.
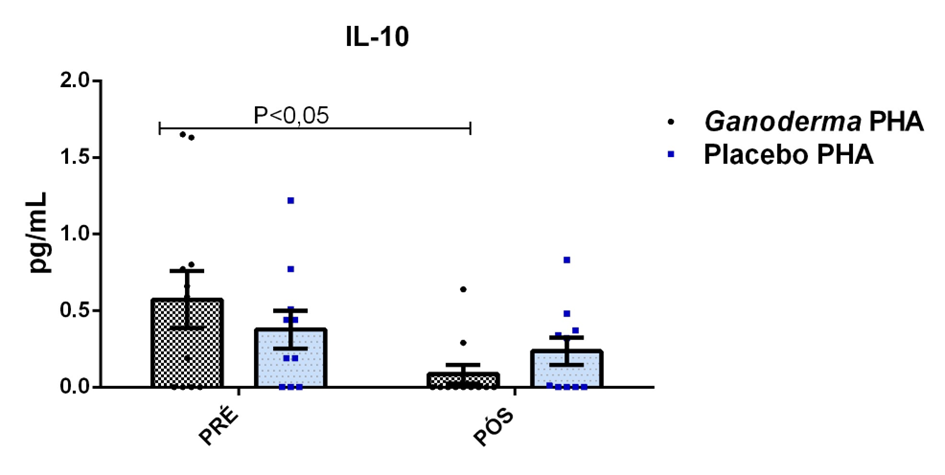
Figura 21 – CONCENTRAÇÃO DA CITOCINA IL-10 NO SOBRENADANTE DE CULTURA LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 10 5 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 22 representa a análise da citocina IL-17 na presença de PHA no sobrenadante de cultura de linfócitos. Foi possível observar aumento significativo para esta citocina no grupo Ganoderma (Pré e Pós) e Placebo (Pré e Pós). Para esta mesma análise, não observamos diferença entre os grupos.
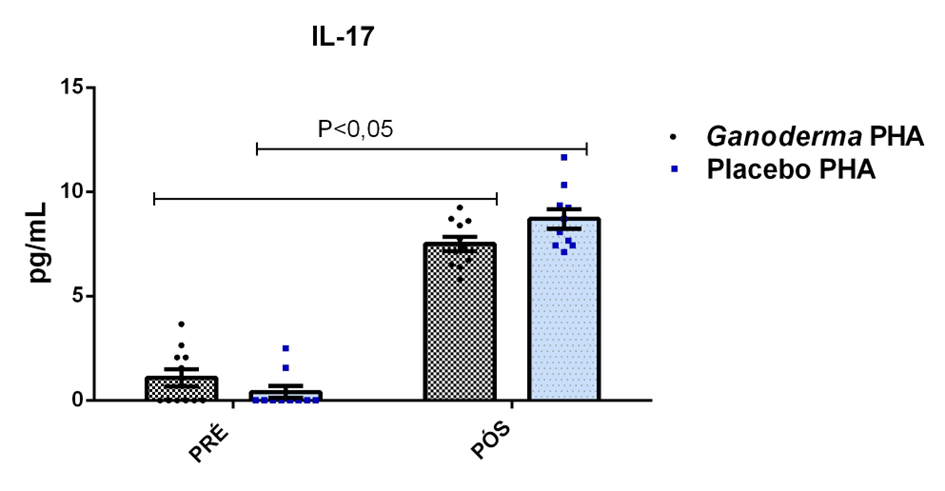
Figura 22 – CONCENTRAÇÃO DA CITOCINA IL-17 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 10 5 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 23 representa a análise da citocina INFɣ na presença de PHA. Não ocorreram diferenças entre os grupos em ambos os períodos.
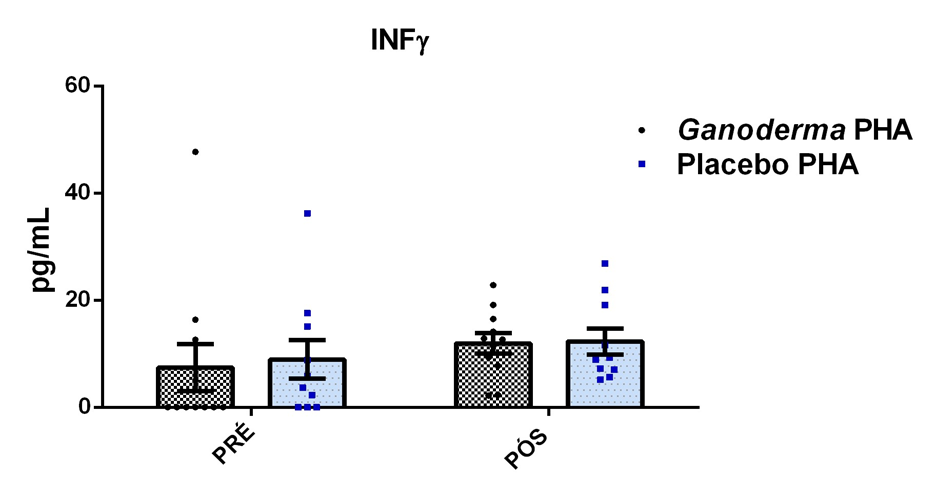
Figura 23 – CONCENTRAÇÃO DA CITOCINA INFɣ NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 105 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
A Figura 24 representa a análise da citocina TNFα na presença de PHA no sobrenadante de cultura de linfócitos. Em relação a esta citocina, não observamos diferenças em ambos os grupos para os dois tempos avaliados.
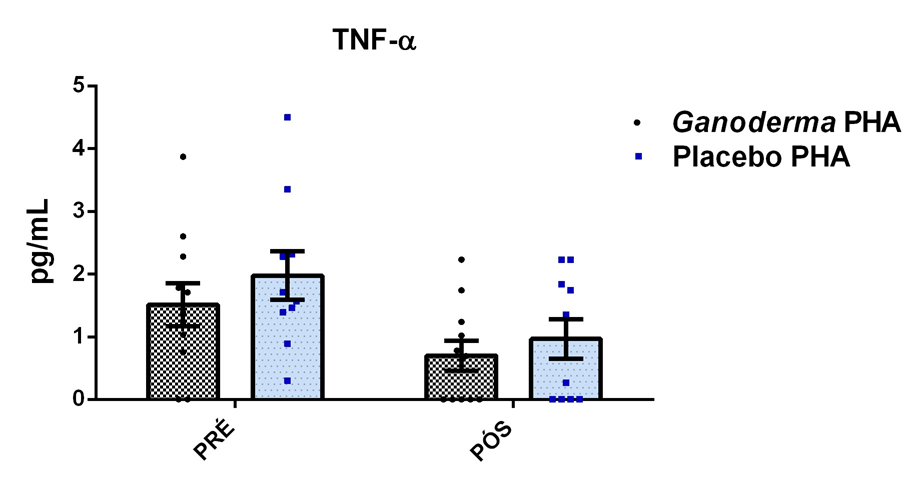
Figura 24 – CONCENTRAÇÃO DA CITOCINA TNF-α NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS ESTIMULADOS COM PHA. Os linfócitos (2,5 x 105 células) foram incubados com PHA por 48 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. N=11 para o grupo Ganoderma e N=10 para o grupo placebo.
6.7 Avaliação de adesão terapêutica
A Figura abaixo (25) apresenta a avaliação por método indireto de adesão terapêutica através do questionário MORISKY-GREEN.
Vários métodos atualmente são utilizados para avaliação da baixa ou não adesão terapêutica, dentre eles, métodos direto e indireto. Este instrumento tem sido utilizado em conjunto com outros questionários para a identificação mais apurada do regime, recordação e crença da terapia. Trata-se de um instrumento de verificação terapêutica de adesão, através de um questionário que contém poucas perguntas. Quanto mais próximo do total de 100%, maior a adesão do grupo suplementado.
Nesta análise, observamos que 54,54% dos pacientes do grupo Ganoderma se enquadram como aderente, ou seja, não apresentaram nenhuma falha na posologia durante a última semana de suplementação no estudo. Entretanto, 45,46% das voluntárias do grupo Ganoderma apresentaram alguma falha na adesão terapêutica. Já para o grupo placebo, houve adesão terapêutica de 63,63%, ou seja, 63,63% dos voluntários não apresentaram nenhuma falha na posologia na última semana de suplementação.
A classificação de fragilidade na adesão foi realizada identificando nas demais facetas, falhas em algumas das perguntas. Quando a falha foi identificada em 1 pergunta, o paciente foi classificado em (moderada adesão 1), falhas em duas perguntas (moderada adesão 2), falhas em três perguntas (baixa adesão 3), falhas em quatro perguntas (baixa adesão 4). Estas análises foram aplicadas seguindo o estudo de Hayward et al. (2017).
Na Figura 25, podemos observar entre os grupos Ganoderma e placebo, adesão para a suplementação proposta. Para o grupo Ganoderma, houve fragilidades de adesão de 36,36 % representada pela somatória entre as facetas moderada adesão 1 e moderada adesão 2. Na análise realizada, este grupo apresentou 9,10% de baixa adesão 3 e 0% de baixa adesão 4.
Para o grupo Placebo pós-suplementado, também houve fragilidades na adesão de 27,27% representada pela somatória entre as facetas, moderada adesão 1 e moderada adesão 2. Na análise realizada, o grupo placebo apresentou 9,10% de baixa adesão 3 e 0% de baixa adesão 4 (Figura 25).
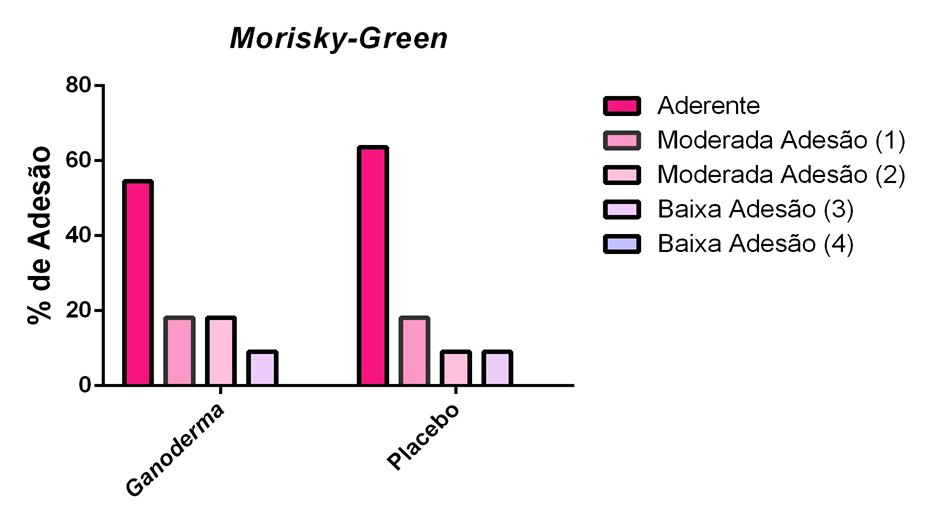
Figura 25 – AVALIAÇÃO DO QUESTIONÁRIO MORISKY-GREEN SOBRE ADESÃO TERAPÊUTICA. O questionário foi aplicado após dois meses de suplementação com Ganoderma (grupo A) e placebo (grupo B). Após a suplementação foi realizada a somatória da pontuação total. Grupo Ganoderma = 10 e Placebo =11.
A Figura 26, apresenta a avaliação realizada pelo teste indireto de adesão terapêutica através do questionário Brief Medication Questionnare (BMQ), sendo considerado teste padrão-ouro.
Nesta análise, foi observado que 27,27% dos pacientes do grupo Ganoderma se enquadram como aderente , ou seja, não apresentaram nenhuma falha quanto às modalidades de regime, recordação e crença durante a última semana de suplementação no estudo. Entretanto, 72,73 % apresentaram alguma falha na adesão terapêutica. Já para o grupo placebo, houve adesão terapêutica de 63,63% das voluntárias, ou seja, 63,63% das voluntárias não apresentaram nenhuma falha na posologia na última semana.
A classificação de fragilidade na adesão foi realizada identificando nos demais regimes, falhas em algumas das perguntas. Quando não houve falha, classificamos como aderente, e quando a falha foi identificada em uma pergunta, o paciente foi classificado em provável adesão, falhas em duas perguntas (provável baixa adesão) e falhas em três perguntas ou mais (baixa adesão). Estas análises foram aplicadas seguindo o estudo de Ben et al. (2012) e Hayward et al. (2017).
Na Figura 26, podemos observar fragilidades na adesão entre os grupos Ganoderma e placebo para a suplementação proposta. Para o grupo Ganoderma, houve adesão de 27,27% representada pela faceta de adesão, provável adesão representada por 45,45% das voluntárias,18,18 % das voluntárias foram classificadas na faceta provável baixa adesão, enquanto 9,10% delas foram classificadas na faceta baixa adesão. A faceta baixa adesão foi identificada somente no grupo Ganoderma.
Para o grupo placebo, houve adesão de 63,63% representada pela faceta de adesão, provável adesão representada por 9,10% das voluntárias, 27,27 % das voluntárias foram classificadas na faceta provável baixa adesão, enquanto 0% delas foram classificadas na faceta baixa adesão.
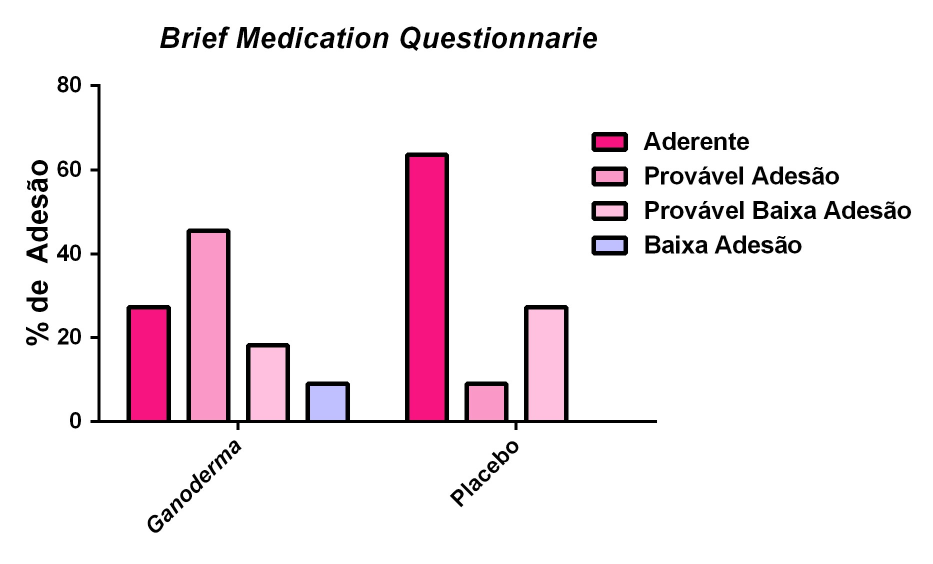
Figura 26 – AVALIAÇÃO DO QUESTIONÁRIO SOBRE ADESÃO TERAPÊUTICA BRIEF MEDICATION QUESTIONNARIE. O questionário foi aplicado após dois meses de suplementação com Ganoderma (grupo A) e placebo (grupo B). Após a suplementação foi realizada a somatória da pontuação total. Grupo Ganoderma = 10 e Placebo =11.
6.8 Avaliação do questionário de qualidade de vida
O questionário para avaliação da Qualidade de Vida (WHOQOL) foi aplicado em dois períodos, antes e após a suplementação dos grupos (Ganoderma) A e (Placebo) B. O questionário WHOQOL, em versão para a língua portuguesa foi preenchido no início e fim do projeto e foi analisado conforme procedimento adotado por Pedroso et al. (2009). Esse questionário é dividido em quatro partes, sendo que permite a avaliação dos seguintes domínios A (físico), B (psicológico) C (relações sociais) e D (meio ambiente). Este instrumento requer que o indivíduo assinale múltiplas questões para cada domínio e suas facetas, com variáveis de um a cinco. Ao final desse processo, quanto mais próximo de 100 a pontuação, melhor é a qualidade de vida do indivíduo. Nesta análise, não houve diferenças significativas para nenhum dos domínios, em nenhum dos períodos e para ambos os grupos.
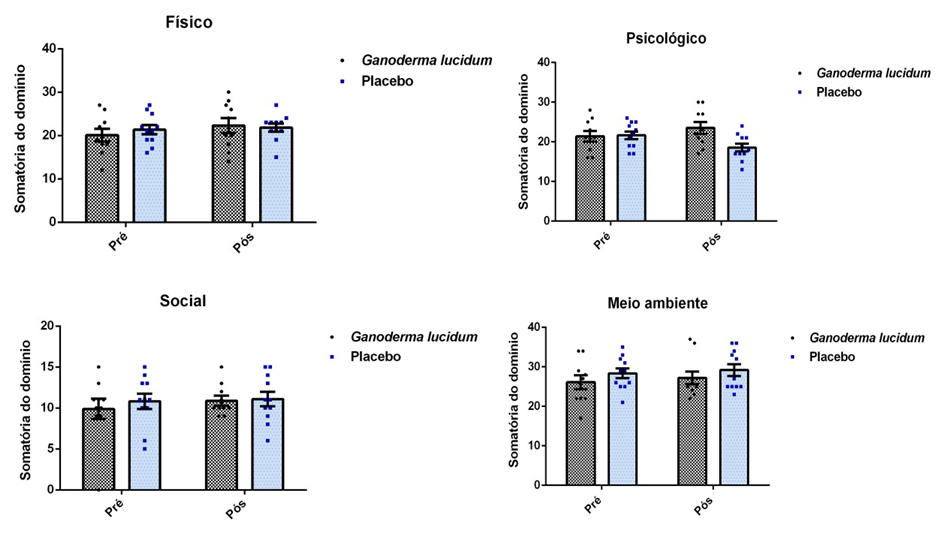
Figura 27 – AVALIAÇÃO DO QUESTIONÁRIO QUALIDADE DE VIDA. O questionário foi aplicado no momento Pré e Pós suplementação com Ganoderma (grupo A) e placebo (grupo B). Após a suplementação foi realizada a somatória da pontuação total. Os valores estão apresentados como média ± EPM. N=10 para o grupo Ganoderma e N= 11 para o grupo Placebo.
Na Tabela 12, estão apresentados, de forma resumida os resultados do grupo suplementado com 1500 mg/dia de extrato seco de Ganoderma ou placebo.
Tabela 12 – Resultados Parciais do Estudo I (Suplementação com 1500 mg de Ganoderma lucidum)
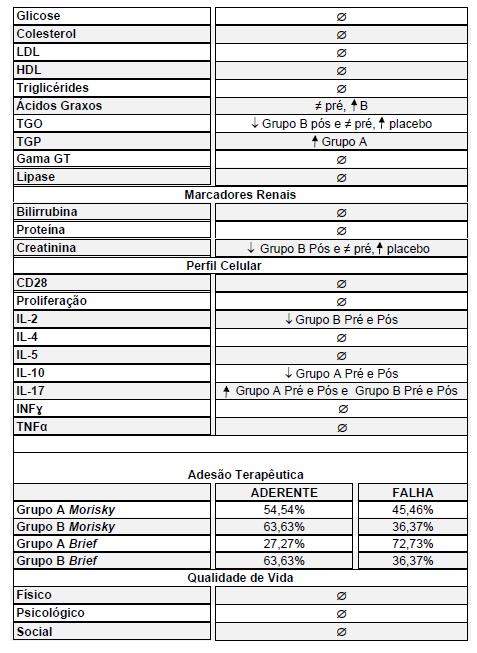
7.0 RESULTADOS DO ESTUDO II
7.1 Caracterização da amostra
A Tabela 13 mostra os resultados referentes à composição corporal das idosas antes e após a suplementação com 2000 mg/dia de Ganoderma ou Placebo. Nas análises de circunferência da cintura e quadril, IMC, peso, porcentagem de gordura e massa magra não houve diferença após a suplementação entre os grupos Ganoderma e placebo para os parâmetros avaliados.
Tabela 13 – Caracterização da amostra do segundo grupo.
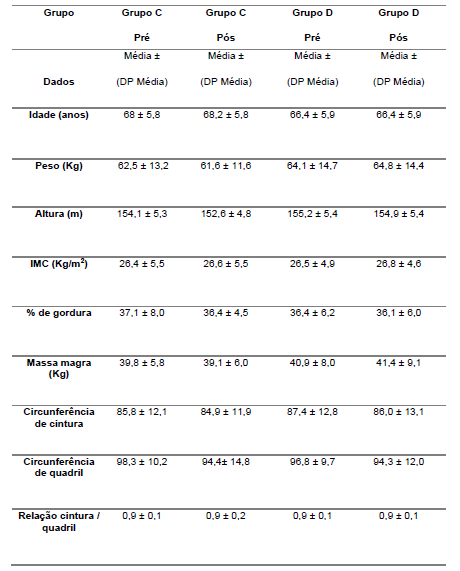
7.1.1 Caracterização de β-glucanos
7.1.2 Determinação de β-glucanos totais
Os cálculos referentes à determinação de β-glucanos dos lotes de Ganoderma lucidum utilizados no estudo I (lote 2016) e II (lote 2018), são mostrados no ANEXO 37 desta tese. A tabela à seguir (14), mostra o teor de βglucanos. Podemos observar que o lote de Ganoderma utilizado no primeiro estudo, apresentava 58,40% de β-glucanos e no segundo estudo 52,83% de β-glucanos.
Tabela 14 – Teor de β-glucanos no suplemento de Ganoderma lucidum.
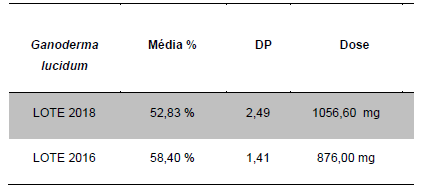
7.1.3 Determinação de β-glucanos solúveis (HPSEC-RID)
A análise por cromatografia de exclusão molecular (HPSEC-RID) foi realizada em água, fazendo com que as análises ficassem restritas à porção mais solúvel em fase aquosa. A Figura 28 representa a análise de cromatografia de exclusão molecular.
Para esta análise, observamos que as amostras de Ganoderma dos dois lotes formam um pico em 44 minutos indicando peso molecular de 12 KDa, depois observamos pico adicional de 4,6 KDa, somente para o lote de 2018 (Ganoderma
S) e no final, um último pico de 1,4 KDa para a amostra de Ganoderma lote 2016 (Ganoderma P) e de 1,3 KDa, para amostra de Ganoderma lote 2018 (Ganoderma S). Para ambas amostras, 1,3 KDa e 1,4 KDa (em último pico), observamos que a eluição ocorreu entre 50 minutos sendo finalizada em aproximadamente 52 minutos. Esta análise, mostra características semelhantes para ambos os lotes de Ganoderma realizadas por este método.
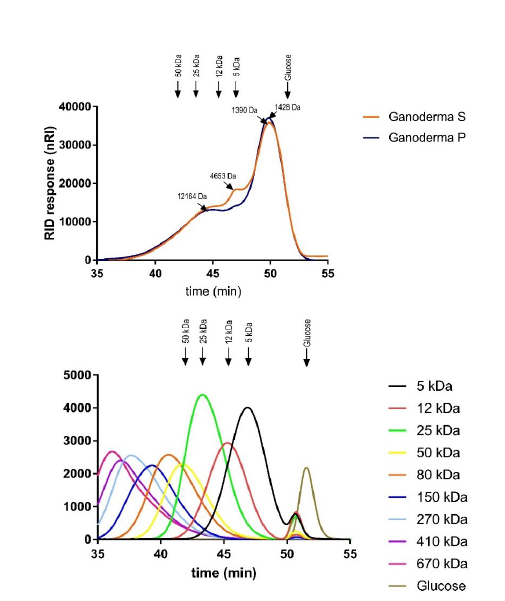
Figura 28 – ANÁLISE DE β-GLUCANOS SOLÚVEIS EM ÁGUA (HPSEC-RID), CROMATOGRAFIA DE EXCLUSÃO MOLECULAR POR TAMANHO DE ALTO DESEMPENHO ACOPLADO A UM DETECTOR DE ÍNDICE DE REFRAÇÃO. PERFIL DE DISTRIBUIÇÃO DE PESO MOLECULAR DE PADRÕES UTILIZADOS. Ganoderma S= lote 2018 e Ganoderma P= lote 2016 .
7.2 Avaliação de parâmetros plasmáticos
Em relação aos níveis plasmáticos de glicose (Figura 29), não se observou diferença antes (Pré) e após (Pós) oito semanas de suplementação para os dois grupos (C= Ganoderma e D= placebo). Também não foram encontradas diferenças intergrupos.
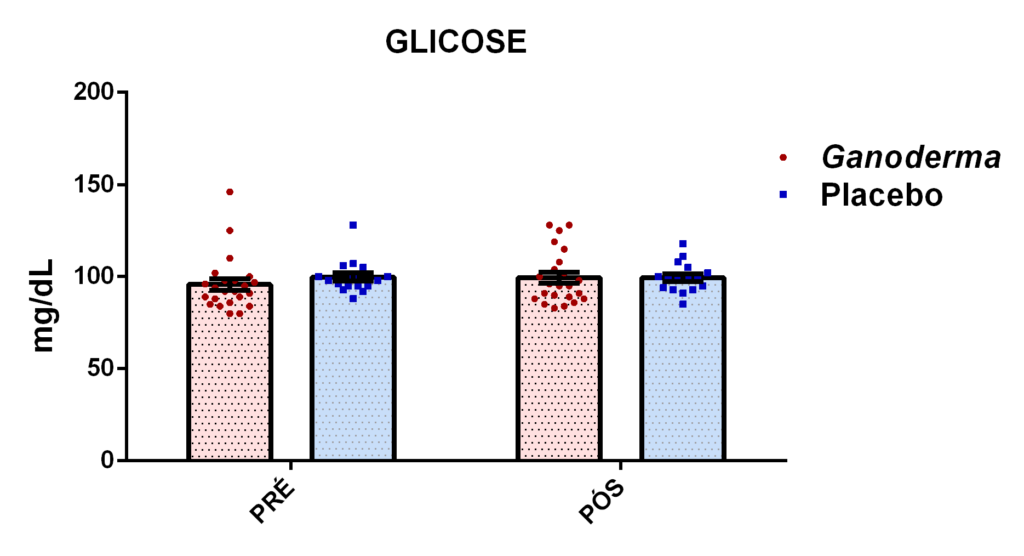
Figura 29 – CONCENTRAÇÃO DE GLICOSE NO SANGUE. A concentração de glicose foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na análise do colesterol total antes e após oito semanas de suplementação com placebo (D) e Ganoderma (C) (Figura 30), não houve diferença significativa entre os grupos C e D. Para as análises de HDL e LDL, também não encontramos diferenças significativas para ambos os grupos (Pré e Pós) suplementados. Embora alguns pacientes apresentem, antes da suplementação valores de referência do colesterol total superior a 200mg/dL e LDL superior a 100mg/dL, estes valores mantém-se após a suplementação, sem diferenças significativas. Todos os pacientes apresentam índice de HDL superior a 40mg/dL.
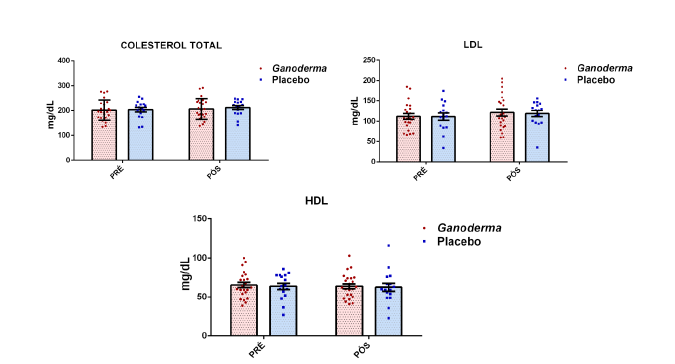
Figura 30- CONCENTRAÇÃO DE COLESTEROL TOTAL, HDL e LDL NO PLASMA. A concentração de colesterol total e frações foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo (GRUPO D) e Ganoderma (GRUPO C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na análise de triglicérides, antes e após oito semanas de suplementação com placebo (D) e Ganoderma (C) (Figura 31), não houve diferença significativa entre os grupos. Embora alguns pacientes apresentem antes da suplementação valores de referência do triglicerídeos superior ao desejável (150mg/dL), estes valores mantém-se após a suplementação, sem diferenças significativas.
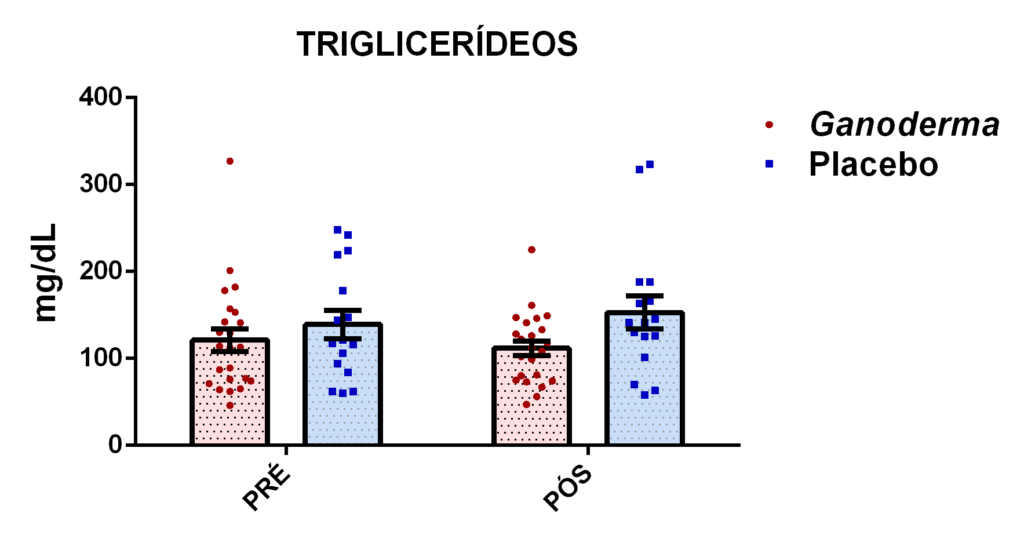
Figura 31- CONCENTRAÇÃO DE TRIGLICERÍDEOS NO PLASMA. A concentração de triglicerídeos foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
7.3 Avaliação de marcadores hepáticos e pancreáticos
A Figura 32, representa a análise de TGO. Também não observamos diferenças significativas para ambos os grupos avaliados. Observamos que um indivíduo do grupo Ganoderma na fase pré, apresenta o valor de TGO acima do valor de referência (50 U/l); porém, após a suplementação todos os valores individuais encaixam-se dentro da faixa de normalidade.
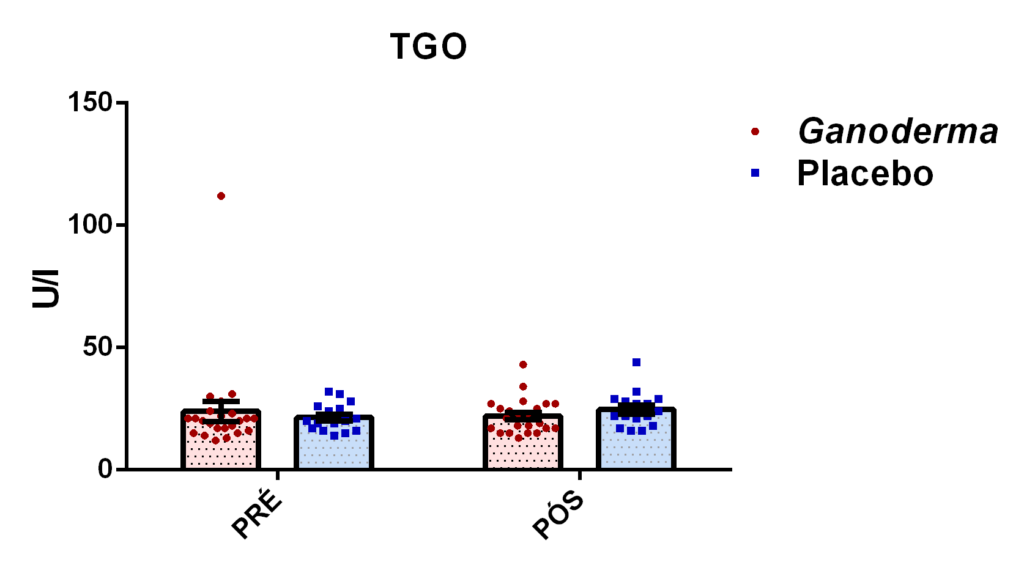
Figura 32 – CONCENTRAÇÃO DE TGO NO PLASMA. A concentração da enzima TGO foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo. TGO, transaminase glutâmica oxaloacética.
A Figura a seguir (33), representa a análise de TGP. Também não observamos diferenças significativas para ambos os grupos avaliados. Observamos que alguns indivíduos na fase pré-suplementação apresentam níveis de TGP acima dos valores de referência (50 U/L); no entanto, essa diferença se mantém após a suplementação para ambos os grupos.
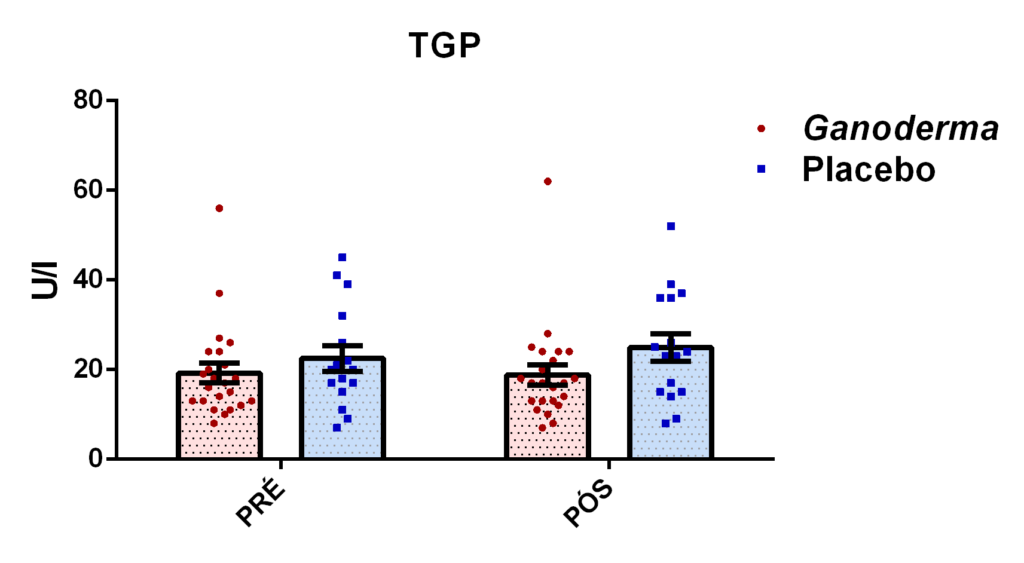
Figura 33- CONCENTRAÇÃO DE TGP NO PLASMA. A concentração da enzima TGP foi determinada no plasma sanguíneo antes (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo. TGP, transaminase glutâmica pirúrvica.
A Figura a seguir (34) representa a análise de GGT. Também não observamos diferenças significativas para ambos os grupos avaliados. Alguns indivíduos na fase de pré suplementação apresentam valores acima da faixa de normalidade (50 U/L); no entanto, essa diferença permanece após a suplementação, sem aumento significativo.
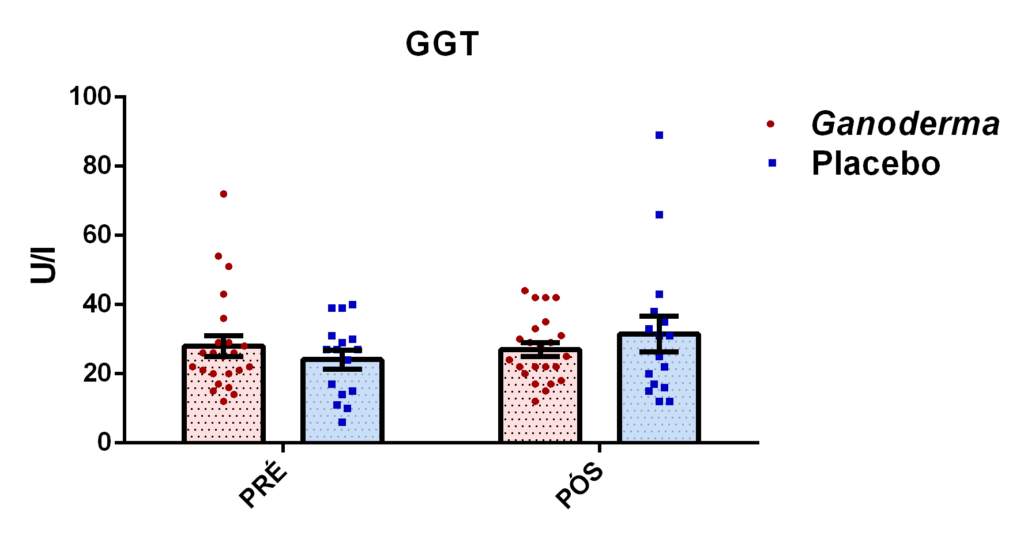
Figura 34- CONCENTRAÇÃO DE GGT NO PLASMA. A concentração da enzima GGT foi determinada (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo. GGT, gamaglutamiltransferase.
A Figura a seguir (35) representa a análise de lipase. Também não observamos diferenças significativas para ambos os grupos avaliados. Alguns indivíduos na fase de pré-suplementação apresentam valores acima da faixa de normalidade, 50 U/L; no entanto, essa diferença permanece após a suplementação, sem aumento significativo.
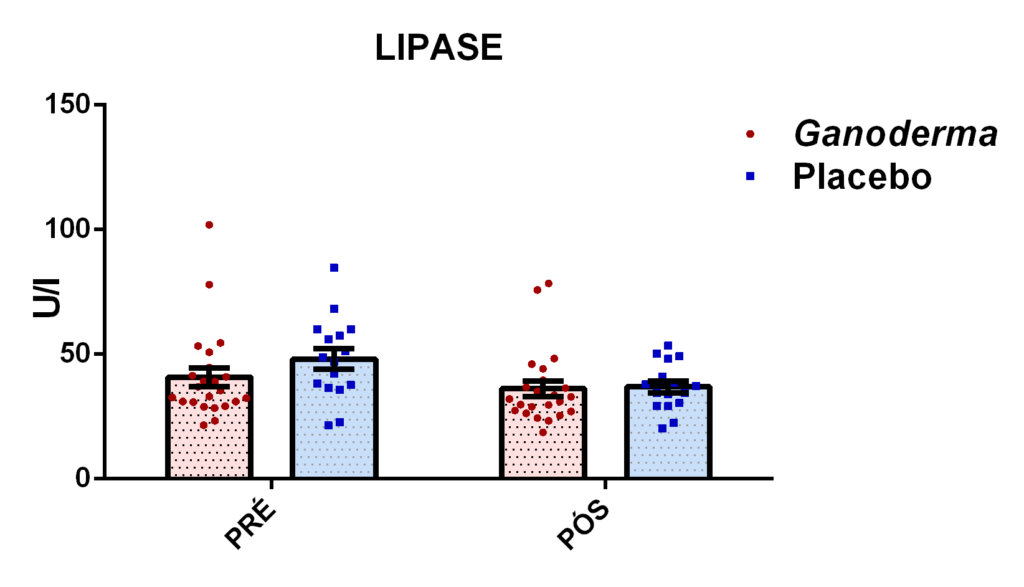
Figura 35- CONCENTRAÇÃO DE LIPASE NO PLASMA. A concentração da enzima lipase foi determinada (Pré) e após oito semanas de suplementação com placebo (D) e Ganoderma(C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
7.4 Avaliação de marcadores renais
Para a avaliação de possíveis alterações renais foi realizado o teste de urina I. Não observamos alteração no teste qualitativo e quantitativo de analitos para os dois grupos antes e após a suplementação (Tabela 15 e 16).
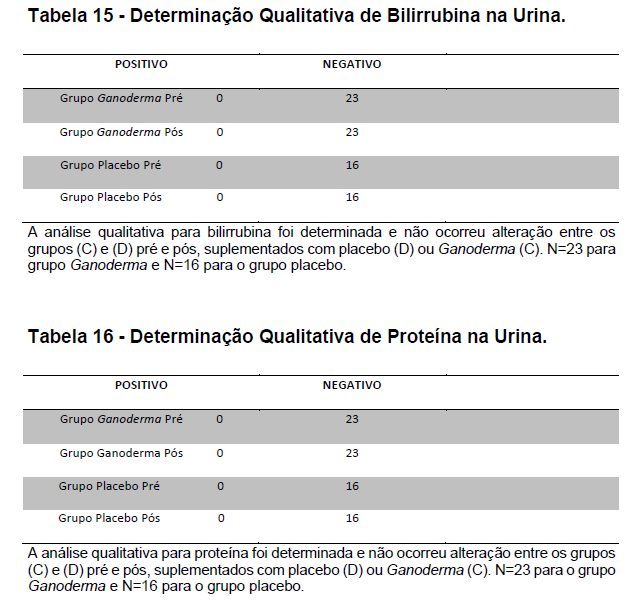
Para a prova de função renal, também foi realizada a análise de creatinina no soro. Não houve diferença significativa na comparação entre os grupos Ganoderma e placebo após a suplementação (Figura 36).
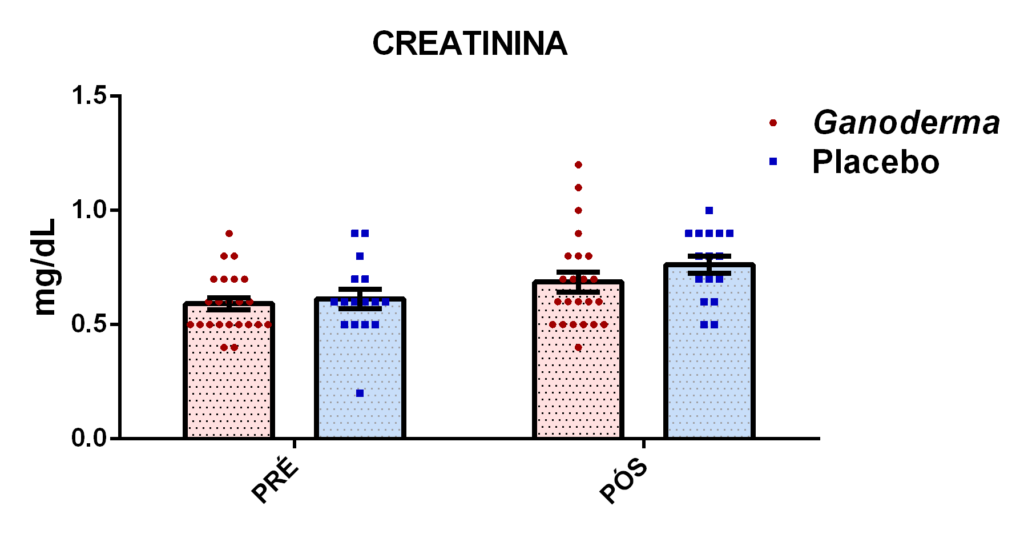
Figura 36- CONCENTRAÇÃO DE CREATININA NO SORO. A concentração de creatinina foi determinada no soro antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
7.5. Avaliação de leucócitos totais
Na contagem de leucócitos e linfócitos totais, eritrócitos, determinação do hematócrito e hemoglobina, não encontramos diferenças para ambos os grupos Placebo e Ganoderma em nenhum dos períodos avaliados(Figuras 37 a 41).
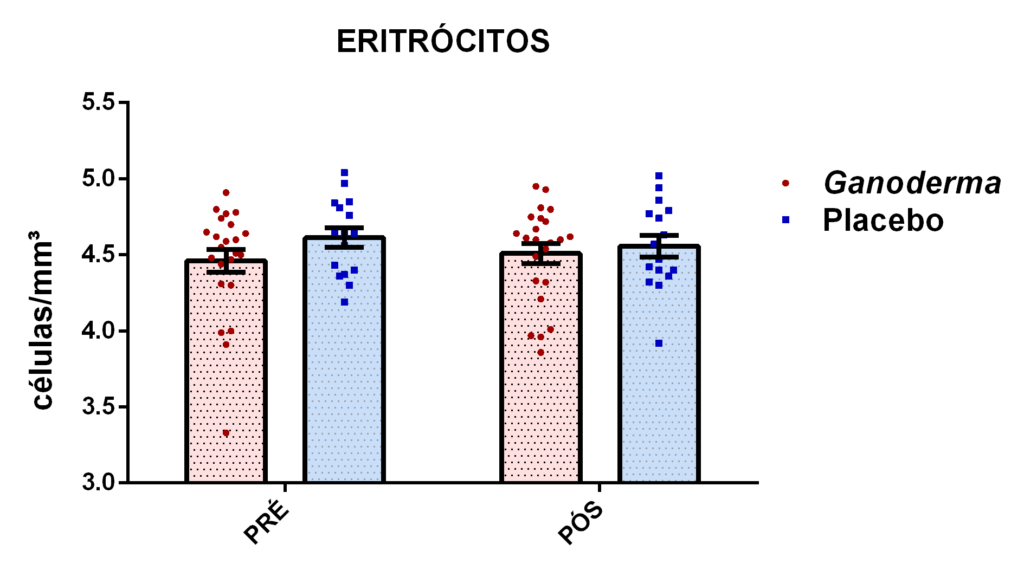
Figura 37- CONTAGEM DE ERITRÓCITOS NO SANGUE TOTAL. A contagem de eritrócitos foi determinada no sangue antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). As análises foram realizadas por citometria de fluxo (Sysmex XT 2000I). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
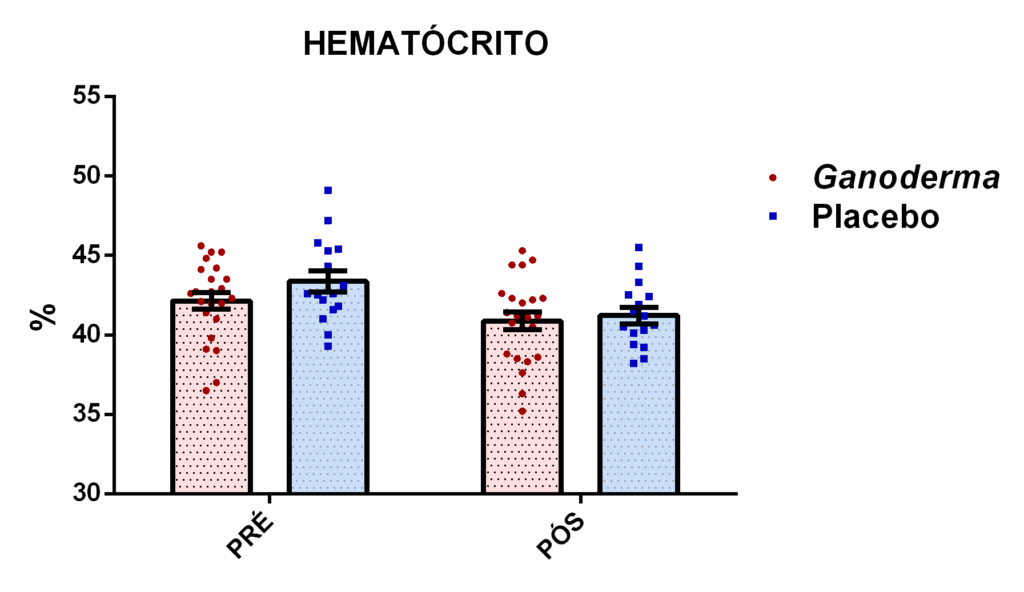
Figura 38- PORCENTAGEM DO HEMATÓCRITO NO SANGUE TOTAL. A porcentagem do hematócrito foi determinada no sangue antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). As análises foram realizadas por citometria de fluxo (Sysmex XT 2000I). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
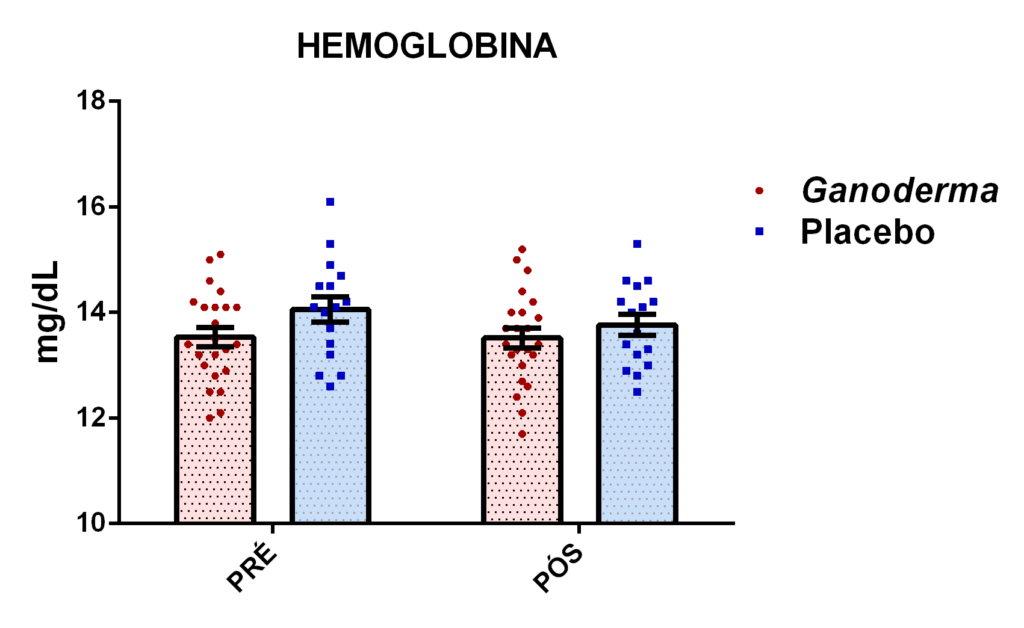
Figura 39- CONCENTRAÇÃO DE HEMOGLOBINA NO SANGUE TOTAL. A contagem de hemoglobina foi determinada no sangue antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). As análises foram realizadas por citometria de fluxo (Sysmex XT 2000I). Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
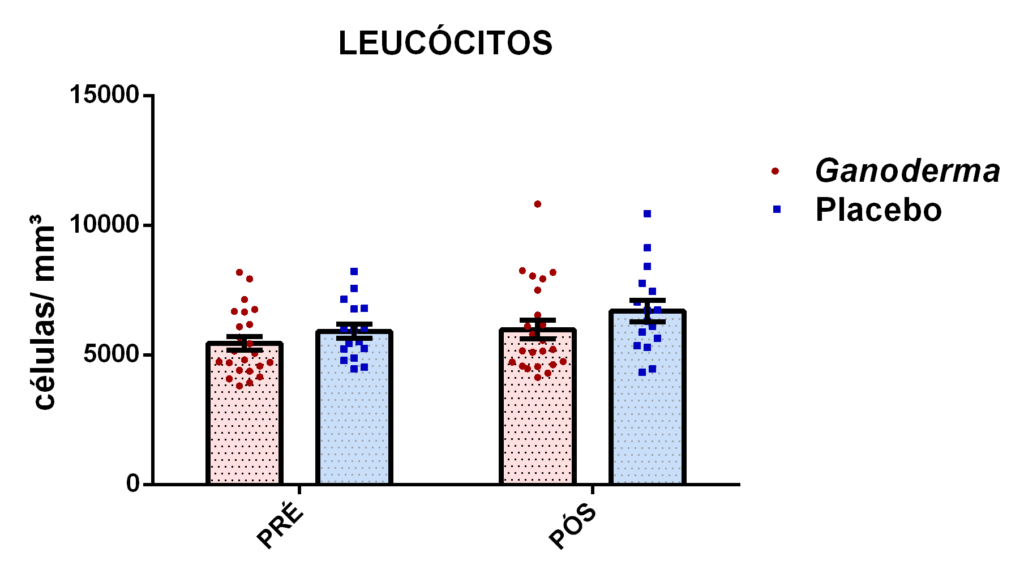
Figura 40- CONTAGEM DE LEUCÓCITOS NO SANGUE TOTAL. A contagem de leucócitos foi determinada no sangue antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). As análises foram realizadas por citometria de fluxo (Sysmex XT 2000I) . Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
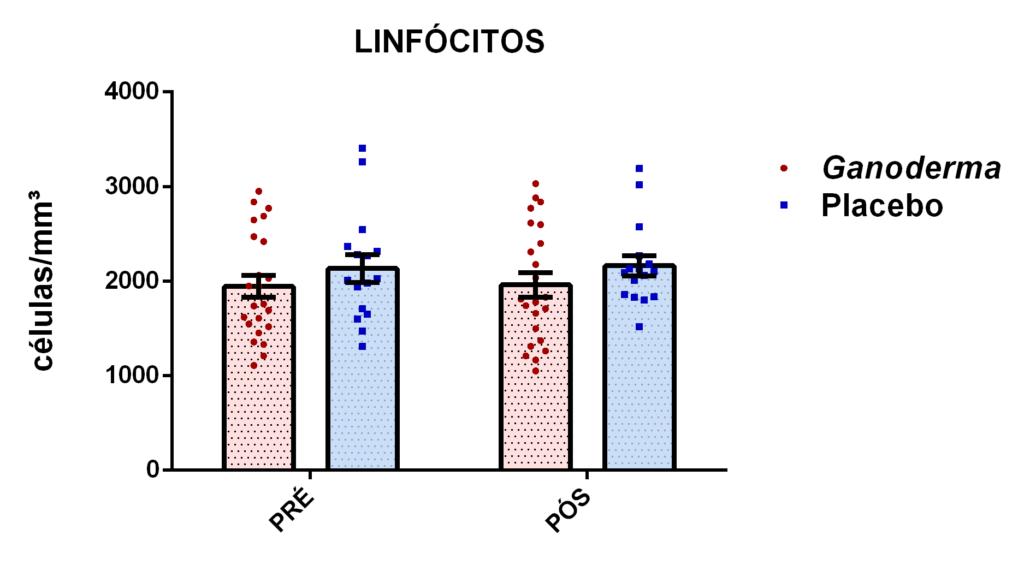
Figura 41- CONTAGEM DE LINFÓCITOS NO SANGUE TOTAL. A contagem de linfócitos foi determinada no sangue antes (Pré) e após a suplementação com placebo (D) ou Ganoderma (C). As análises foram realizadas por citometria de fluxo (Sysmex XT 2000I) . Os valores estão apresentados como média ± EPM. N=23 para o grupo Ganoderma e N= 16 para o grupo placebo.
7.6 Avaliação do perfil de linfócitos
7.6.1 Avaliação da expressão de CD28+ e proliferação
A Figura a seguir (42), mostra o resultado da expressão da proteína CD28+ na ausência de concanavalina (ConA); esta proteína é expressa em linfócitos quando este é estimulado por mitógenos ou microrganismos. Para esta análise, observamos apenas diferenças significativas entre grupos pré-suplementados, Ganoderma e Placebo.
Já a Figura 43, mostra a expressão de CD28+ na presença de concanavalina (ConA). Para esta análise, não observamos diferenças significativas para ambos os grupos, pré e pós suplementados.
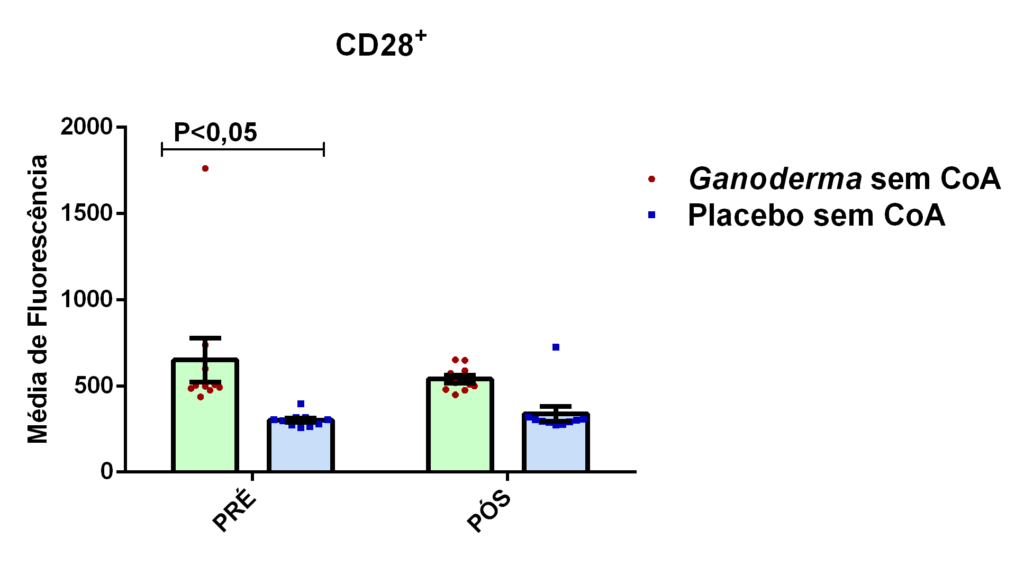
Figura 42- EXPRESSÃO DE CD28+ NA SUPERFÍCIE DE LINFÓCITOS HUMANOS SEM ConA. A porcentagem de células CD28+ foi avaliada antes (Pré) e após dois meses de suplementação com Ganoderma ou Placebo. Os linfócitos foram incubados com anticorpo anti-human CD28-PercP-Cy5 (1:20). A análise foi realizada pela porcentagem de células CD4+, positivas para CD28+ através do “BD C-Sampler Software”. Os valores estão apresentados como média ± EPM. N=10 para Ganoderma e N=10 para grupo placebo.
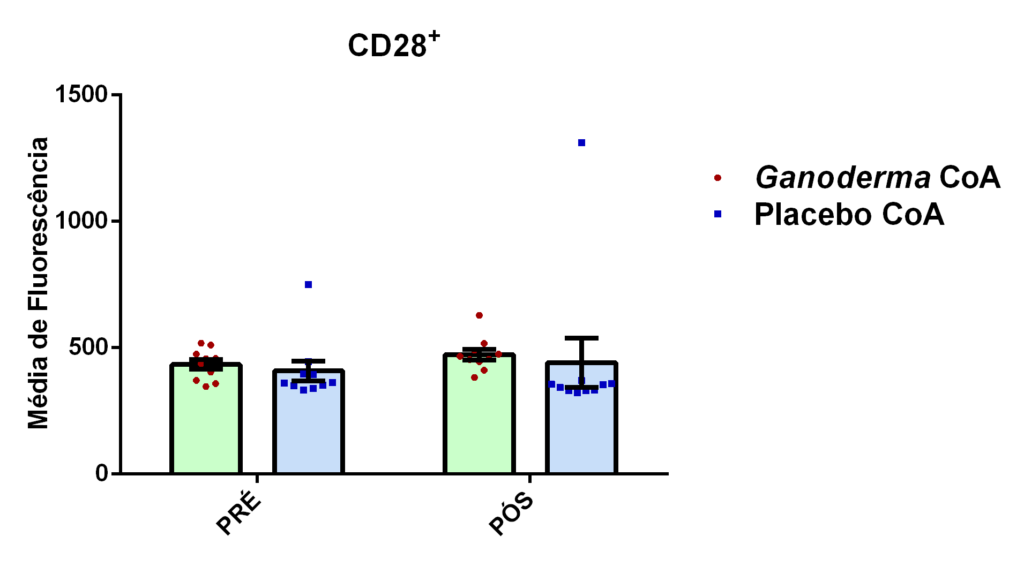
Figura 43- EXPRESSÃO DE CD28+ NA SUPERFÍCIE DE LINFÓCITOS HUMANOS ESTIMULADOS COM ConA. A porcentagem de células CD28+ foi avaliada antes (Pré) e após dois meses de suplementação com Ganoderma ou Placebo. Os linfócitos foram incubados com anticorpo anti-human CD28-PercP-Cy5 (1:20). A análise foi realizada pela porcentagem de células CD4+, positivas para CD28+ através do “BD C-Sampler Software”. Os valores estão apresentados como média ± EPM. N=10 para Ganoderma e N=10 para grupo placebo.
Na análise seguinte, Figura 44, observamos a capacidade proliferativa de Ganoderma na presença de ConA. Observamos maior capacidade proliferativa para o grupo Ganoderma em relação ao Placebo após a suplementação
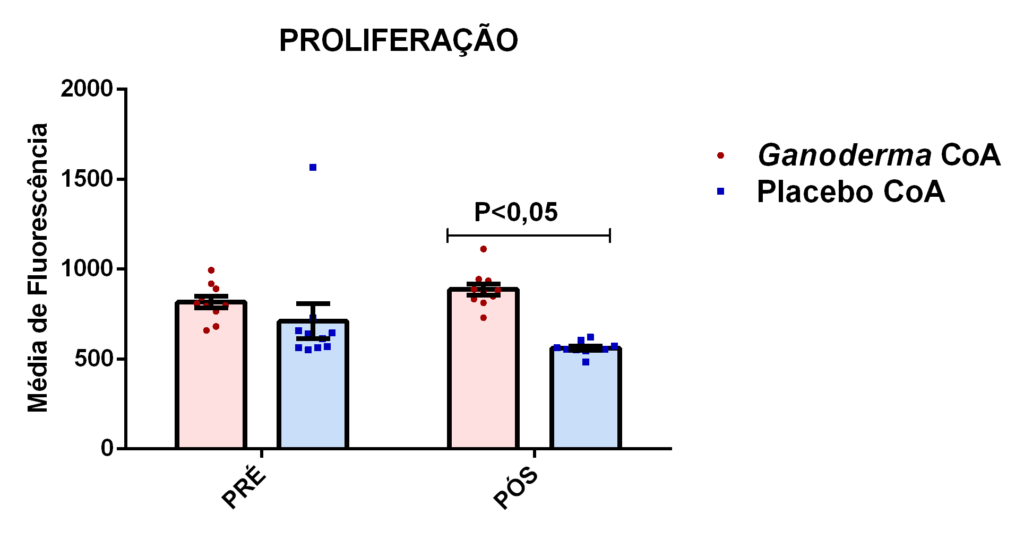
Figura 44 – CAPACIDADE PROLIFERATIVA DE LINFÓCITOS ESTIMULADOS “IN VITRO” COM ConA. Foi realizada a análise da proliferação de linfócitos antes (Pré) e após a suplementação com placebo ou Ganoderma. Os linfócitos foram incubados com BRDU por 60 horas na presença de PHA. Posteriormente foi realizada a marcação com anticorpo anti-BRDU marcado com APC. A análise foi avaliada pela média de fluorescência através do “BD Accuri C6 Sampler Software”. Os valores estão apresentados como média ± EPM. N=10 para o grupo Ganoderma e N=10 para o grupo placebo.
7.6.2 Avaliação da expressão gênica
Antes de iniciar os experimentos para a avaliação da expressão de genes, ensaios para a padronização da quantidade de amostra e primers foram realizados. Também foi realizada a curva de eficiência para cada um dos primers utilizados.As Figuras a seguir demostram as curvas de eficiência para cada gene investigado.
Figura 45 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO β2M. Realizamos a padronização da curva padrão do gene alvo Beta 2M para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência (109.41%), Slope (-3.225) e R2 (0.996).
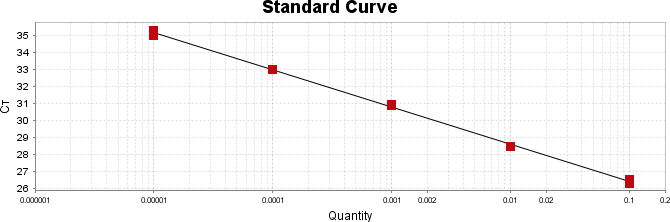
Figura 46 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO GATA-3.Realizamos a padronização da curva padrão do gene alvo Gata-3 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência (108.53%), Slope (-3.195) e R2 (0.998).
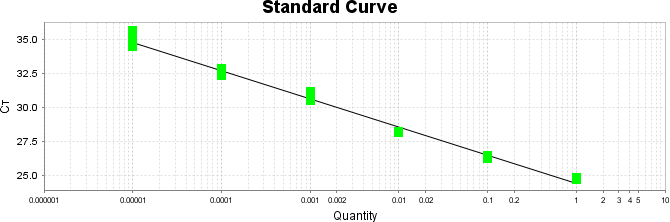
Figura 47 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO TGFβ. Realizamos a padronização da curva padrão do gene alvo TGF-β para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência entre (102.00%), Slope (-3.083) e R2 (0.996).
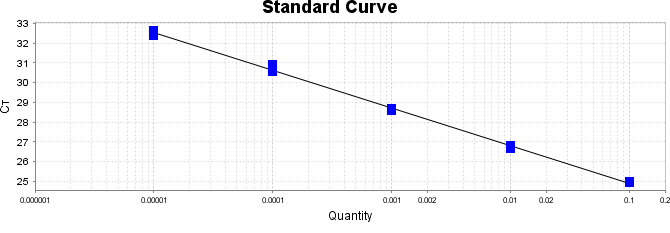
Figura 48 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO T-BET. Realizamos a padronização da curva padrão do gene alvo T-bet para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (104.19%), Slope (-3.208) e R2 (0.998).
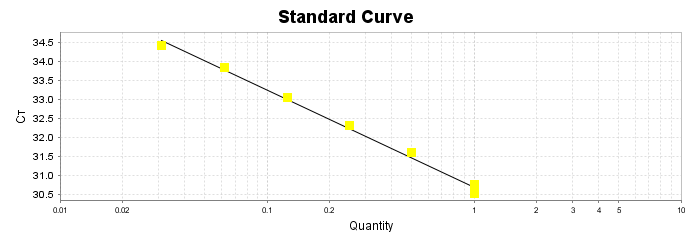
Figura 49 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO RORɣ. Realizamos a padronização da curva padrão do gene alvo RORɣ para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (102.20 %), Slope (-3.270) e R2 (0.997).
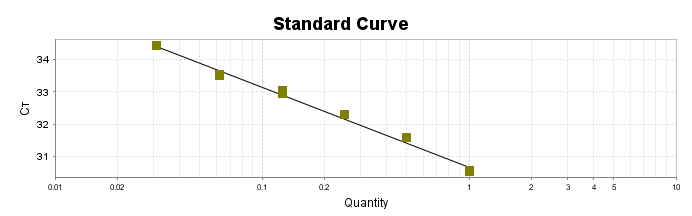
Figura 50 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO FOXP3. Realizamos a padronização da curva padrão do gene alvo FoxP3 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (110.69 %), Slope (-3.024) e R2 (0.994).
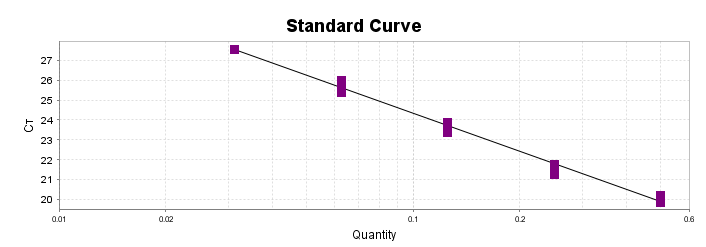
Figura 51 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO INFɣ. Realizamos a padronização da curva padrão do gene alvo INFɣ para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (110.69 %), Slope (-3.009) e R2 (0.995).
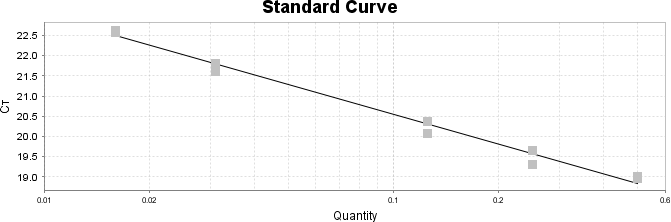
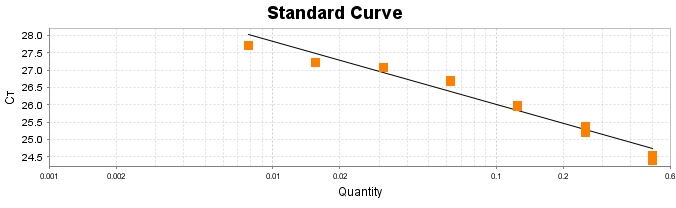
Figura 52 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO IL-6. Realizamos a padronização da curva padrão do gene alvo IL6 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (108.76 %), Slope (-2.442) e R2 (0.990).
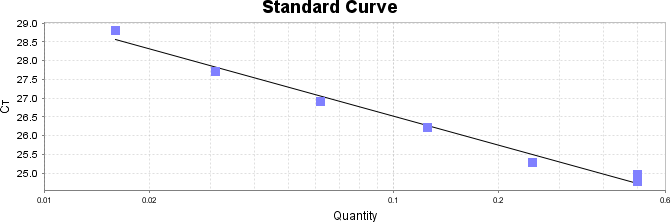
Figura 53 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO IL-10. Realizamos a padronização da curva padrão do gene alvo IL-10 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (101.38 %), Slope (-2.542) e R2 (0.996).
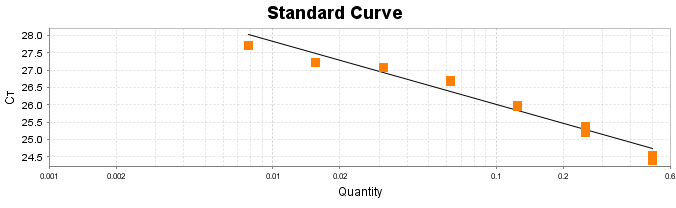
Figura 54- ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO IL-17. Realizamos a padronização da curva padrão do gene alvo IL-17 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (102,557%), Slope (-3.091) e R2 (0.993).
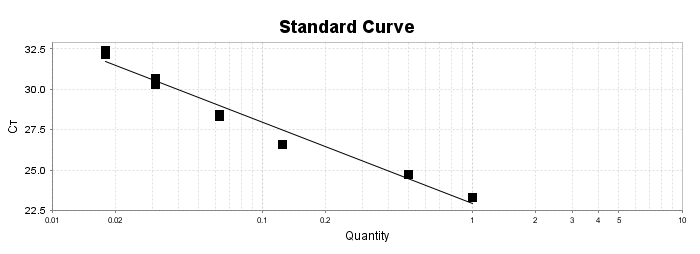
Figura 55 – ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO IL-35. Realizamos a padronização da curva padrão do gene alvo IL-35 para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (102.93 %), Slope (-3.226) e R2 (0.991).
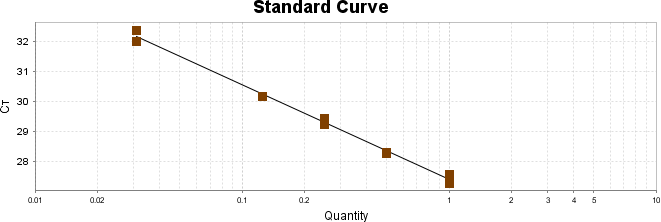
Figura 56- ANÁLISE DA CURVA DE PADRONIZAÇÃO E EFICIÊNCIA REALIZADA PARA O GENE ALVO TNFα. Realizamos a padronização da curva padrão do gene alvo TNFα para amplificação de cDNA a partir do RNA, para diluições em série. Utilizamos o fator de diluição 10. Os valores estão apresentados como porcentagem de eficiência de (106.91 %), Slope (-3.671) e R2 (0.994).
Com relação à expressão gênica de IL-2, observamos diferenças significativas com aumento da expressão entre os grupos Ganoderma e Placebo pré e pós-suplementados (Figura 57).
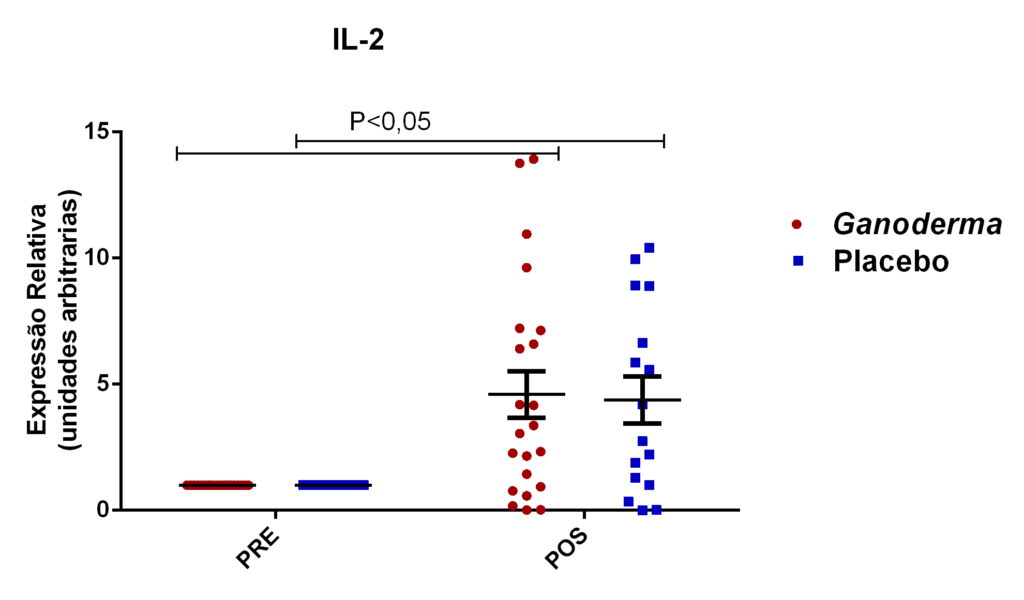
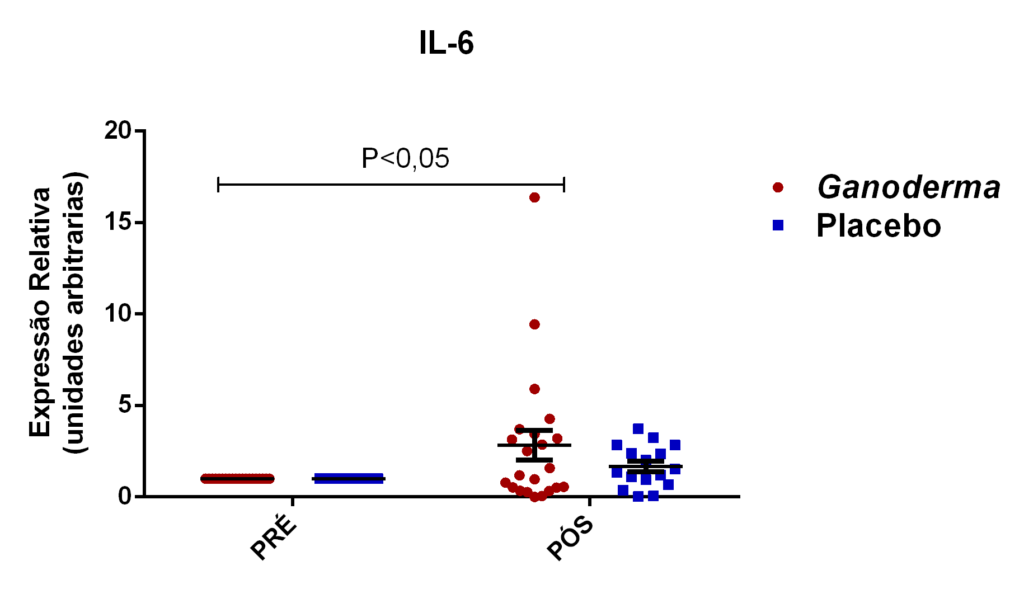
Figura 57- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA IL-2 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de IL-2 foi realizada por PCR em tempo real (método 2-CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
A Figura 58 representa a análise de expressão de mRNA da citocina IL-6. Para esta análise, encontramos maior expressão desta citocina para o grupo Ganoderma pós suplementação comparado ao grupo pré Ganoderma.
Figura 58- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA IL-6 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de IL-6 foi realizada por PCR em tempo real (método 2-CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
A Figura 59 mostra a análise de expressão do mRNA da citocina IL-10. Para esta análise, observamos maior expressão de IL-10 no grupo Ganoderma em relação ao Placebo no período pós-suplementação.
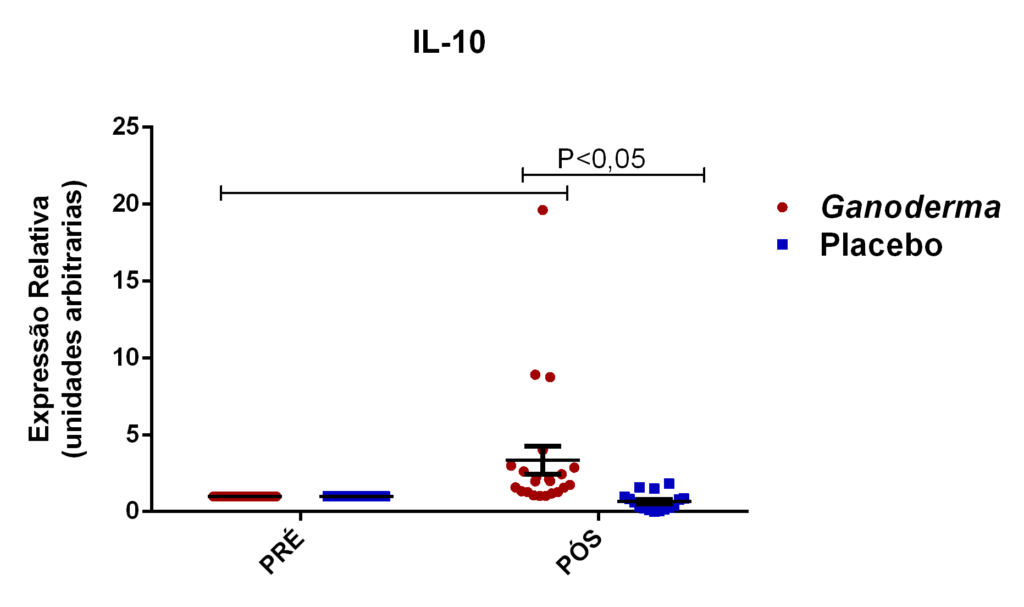
Figura 59- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA IL-10 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de IL-10 foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
Com relação à expressão gênica de IL-17, observamos aumento da expressão nos grupos Ganoderma e Placebo após suplementação, sem diferença entre eles (Figura 60).
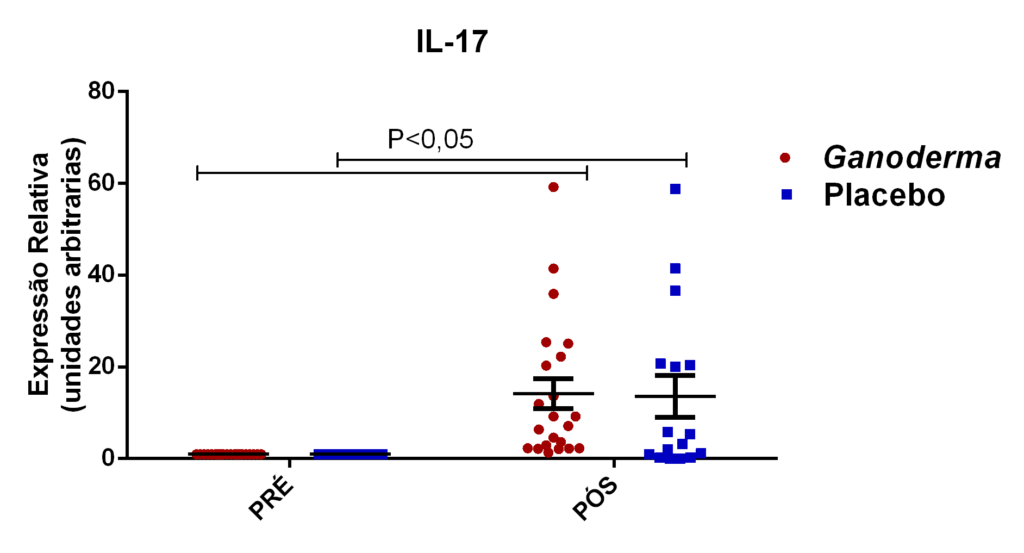
Figura 60 – AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA IL-17 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de IL-17 foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
A expressão de TGFβ está relacionada com a inibição da proliferação de células T efetoras e com a formação de células T reguladoras maduras. Para esta análise, observamos maior expressão do TGFβ no período pós-suplementação no grupo Ganoderma em relação ao Placebo (Figura 61).
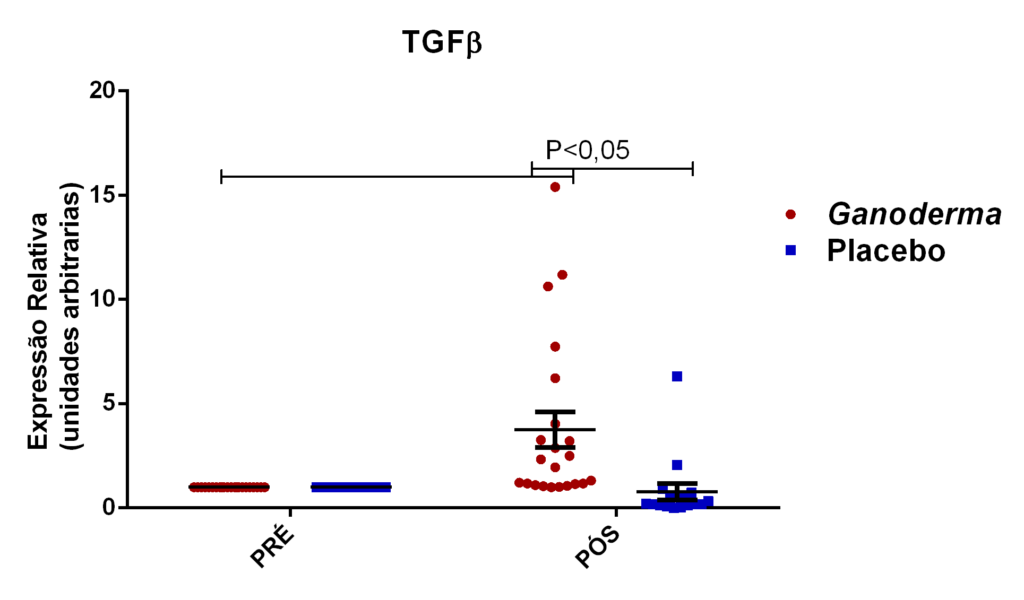
Figura 61- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA TGFβ EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de TGFβ foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como méia ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
Para a análise do GATA-3, observamos o aumento da expressão gênica no grupo Ganoderma (Figura 62).
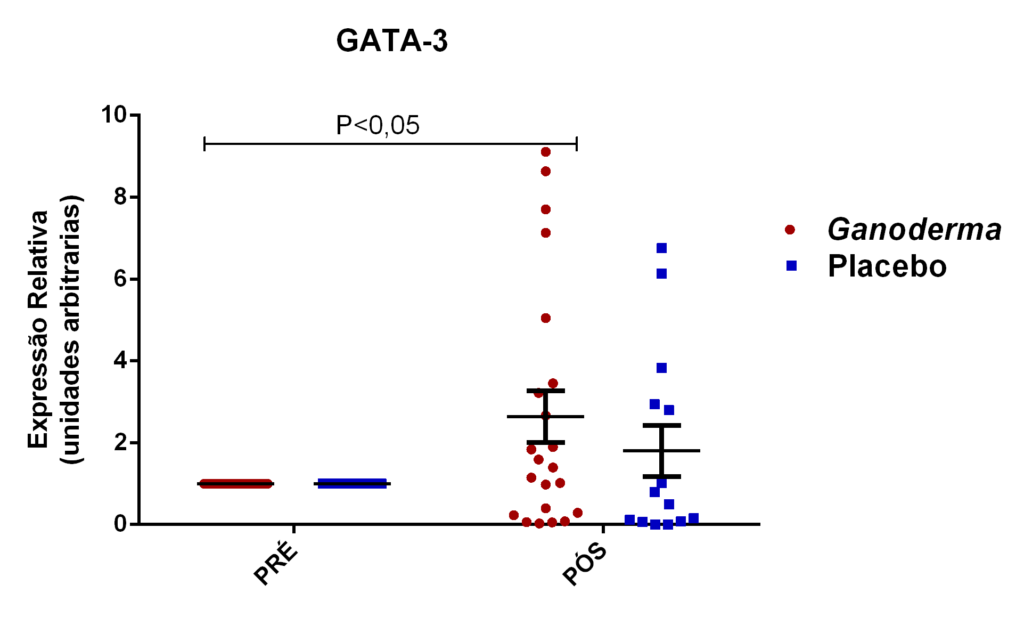
Figura 62- AVALIAÇÃO DA EXPRESSÃO do mRNA DE GATA-3 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de GATA-3 foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3 (Austrália). As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 14 para o grupo placebo.
A Figura 63 mostra a análise de expressão do fator de transcrição Foxp3. Esse fator é ativado durante o processo de diferenciação de células Treg. Para esta análise, observamos maior expressão desse fator no grupo Ganoderma em relação ao Placebo no período pós-suplementação.
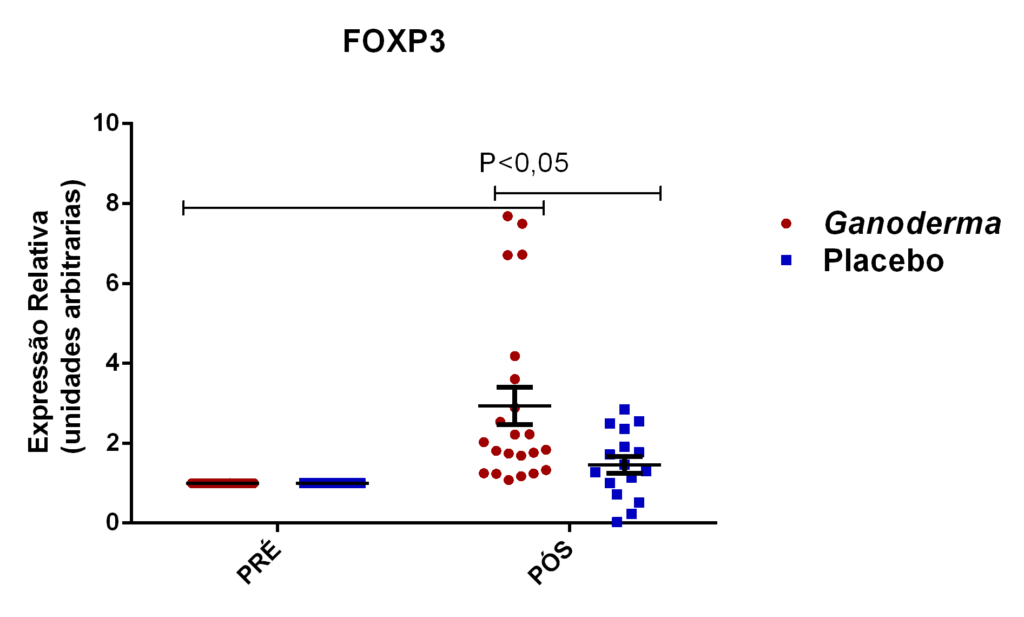
Figura 63- AVALIAÇÃO DA EXPRESSÃO do mRNA DE FOXP3 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de Foxp3 foi realizada por PCR em tempo real (método 2-CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
A Figura 64 representa a avaliação da expressão do mRNA da citocina IL-35. Podemos observar que não houve diferença significativa entre os grupos Ganoderma e Placebo pós-suplementados.
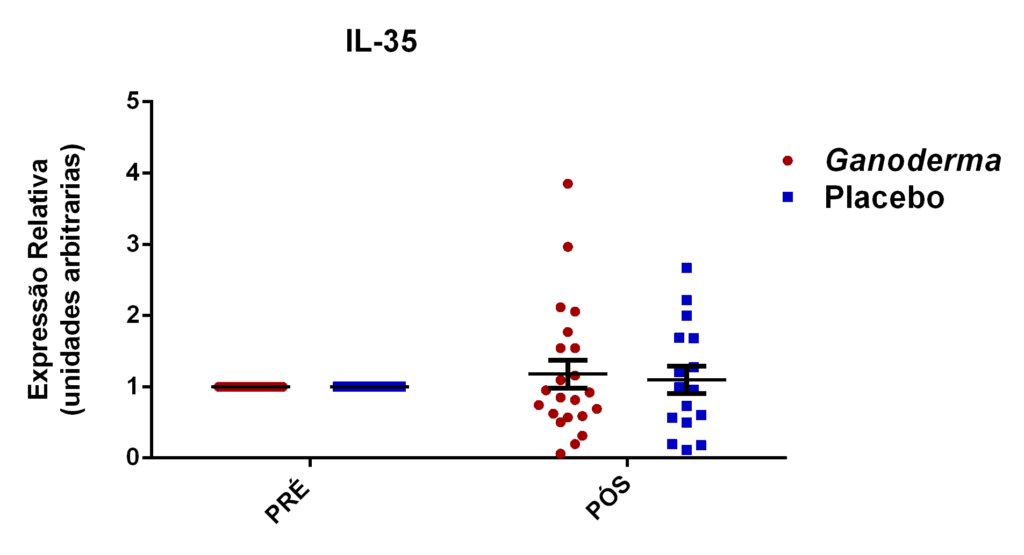
Figura 64- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA IL-35 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de IL-35 foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
Com relação à expressão do fator de transcrição T-bet, observamos aumento da expressão nos grupos Ganoderma e Placebo após a suplementação.
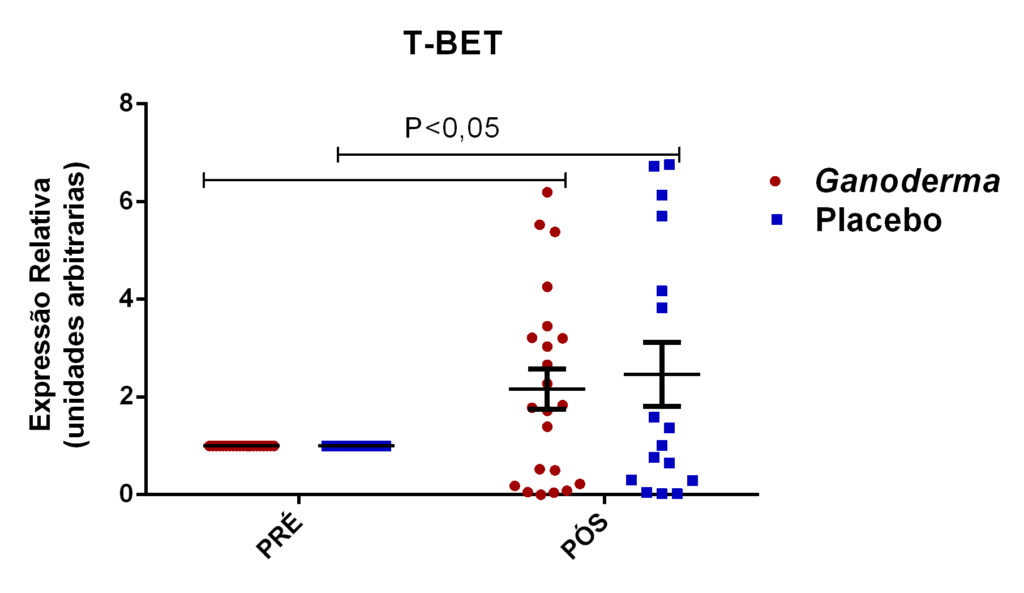
Figura 65- AVALIAÇÃO DA EXPRESSÃO do mRNA DE T-bet EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de T-bet foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
O fator de transcrição RORɣ é ativado durante o processo de diferenciação de linfócitos Th17. Em nosso estudo, observamos aumento na expressão apenas no grupo Ganoderma (Figura 66).
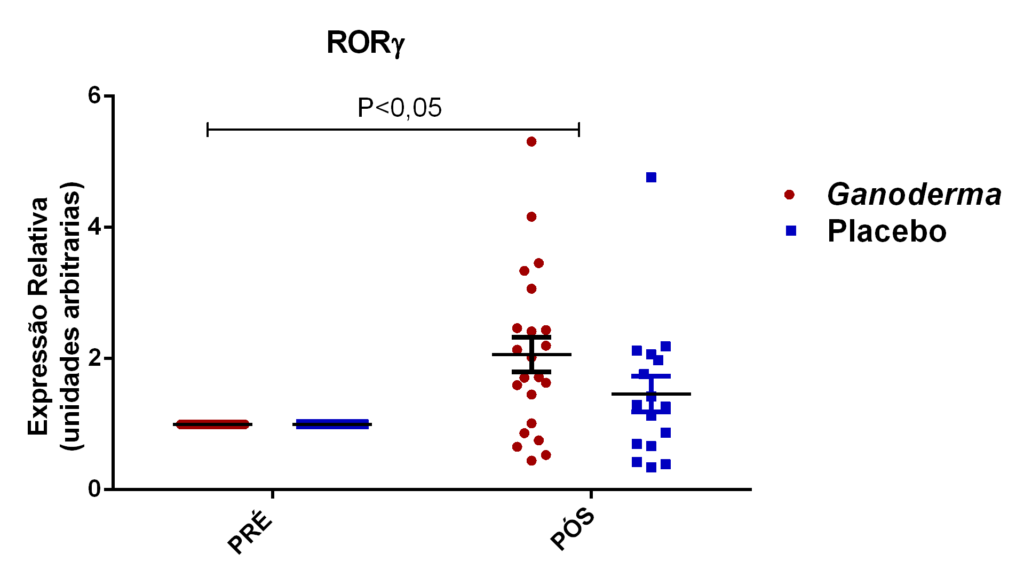
Figura 66- AVALIAÇÃO DA EXPRESSÃO do mRNA DE RORɣ EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de RORɣ foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
Com relação à análise da expressão de mRNA da citocina INFɣ, observamos aumento da expressão gênica desta citocina nos grupos Ganoderma e Placebo após a suplementação (Figura 67).
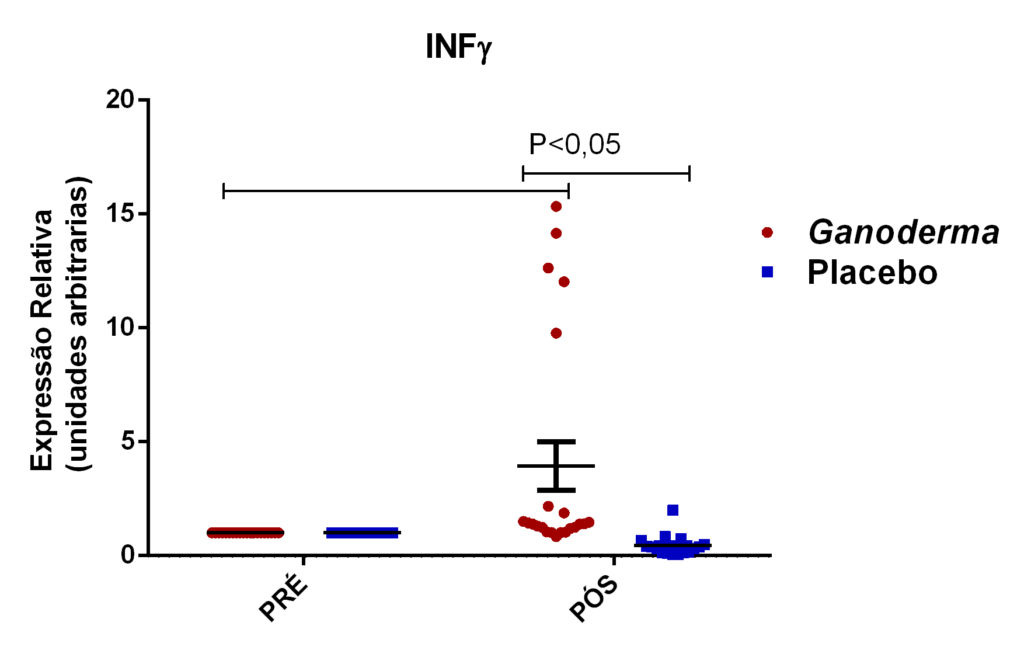
Figura 67- AVALIAÇÃO DA EXPRESSÃO do mRNA de INFɣ EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de INF foi realizada por PCR em tempo real (método 2–CT ). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na análise de expressão de TNF-α (Figura 68), observamos aumento da expressão no grupo Ganoderma após a suplementação.
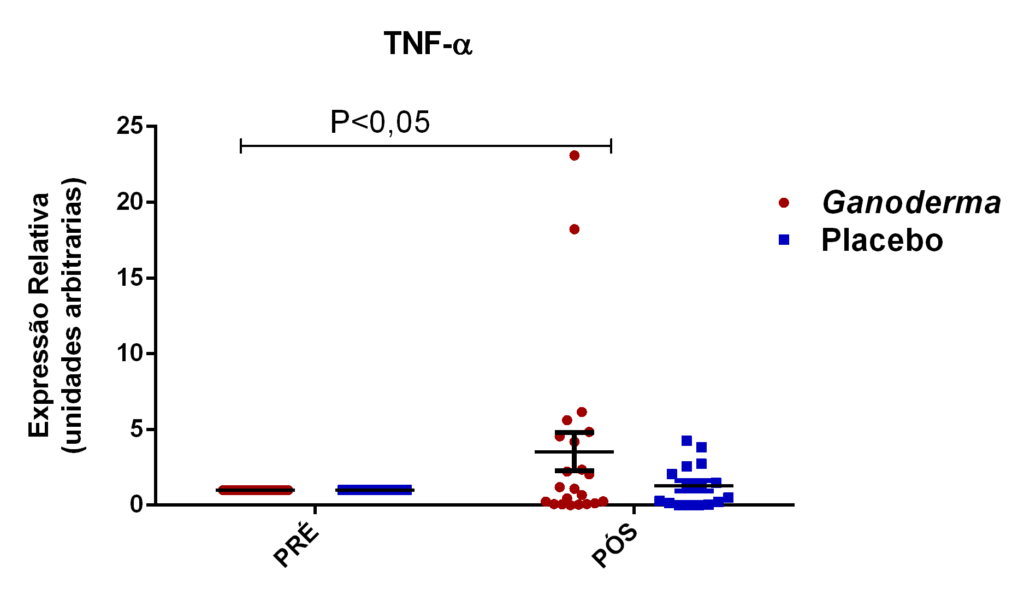
Figura 68- AVALIAÇÃO DA EXPRESSÃO do mRNA DA CITOCINA TNF-α EM LINFÓCITOS POR PCR EM TEMPO-REAL. A análise da expressão de TNF-α foi realizada por PCR em tempo real (método 2-CT). Os resultados foram obtidos pelo equipamento QuantStudio Real Time PCR System 3, Astrália. As unidades arbitrárias foram expressas antes (Pré) e após oito semanas de suplementação para o grupo D (placebo) e grupo C (Ganoderma). O gene constitutivo β2M foi usado como controle interno para normalizar os dados. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma e N= 16 para o grupo placebo.
7.6.3 Avaliação da razão da expressão de genes pró e anti-inflamatórios
Para a análise da razão entre IL-10/TNFα, encontramos significância entre grupos pós suplementados Ganoderma e Placebo e encontramos também entre grupo Ganoderma pré e pós-suplementados (Figura 69).
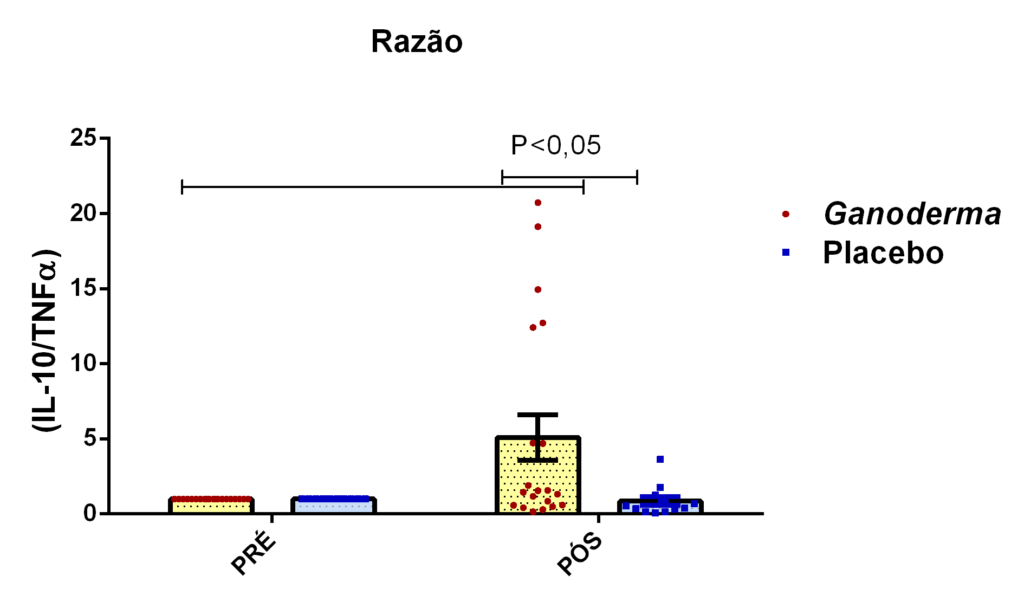
Figura 69- AVALIAÇÃO DA RAZÃO DO mRNA DA CITOCINA IL-10/TNFα EM LINFÓCITOS POR PCR EM TEMPO-REAL. A razão foi obtida pela divisão das concentrações de IL-10 e TNFα. Os resultados foram obtidos antes (Pré) e após oito semanas de suplementação para o grupo placebo e grupo Ganoderma. Os valores estão apresentados como média ± EPM. N=20 para o grupo Ganoderma e N= 12 para o grupo placebo.
Para a análise da razão de IL-10/INFɣ representada pela Figura 70, não observamos diferenças significativas entre Ganoderma e Placebo.
Figura 70- AVALIAÇÃO DA RAZÃO do mRNA DA CITOCINA IL-10/INFɣ EM LINFÓCITOS POR PCR EM TEMPO-REAL. A razão foi obtida pela divisão das concentrações de IL-10 e INF. Os resultados foram obtidos antes (Pré) e após oito semanas de suplementação para o grupo placebo e grupo Ganoderma. Os valores estão apresentados como média ± EPM. N=21 para o grupo Ganoderma e N= 14 para o grupo placebo.
Para a análise da razão de IL-10/IL-17 representada pela Figura 71, observamos redução após a suplementação em ambos os grupos, Ganoderma e Placebo.
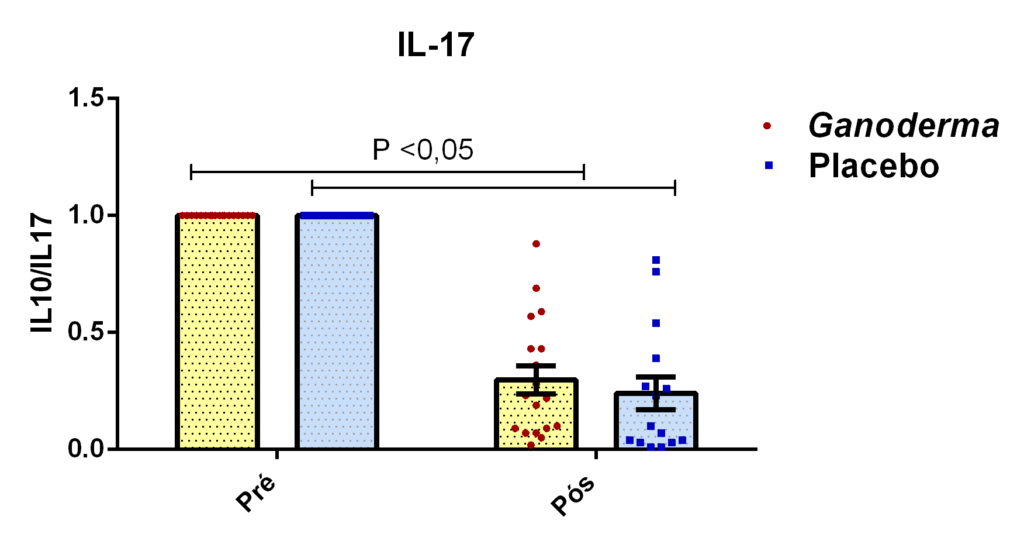
Figura 71- AVALIAÇÃO DA RAZÃO do mRNA DA CITOCINA IL-10/IL-17 EM LINFÓCITOS POR PCR EM TEMPO-REAL. A razão foi obtida pela divisão das concentrações de IL-10 e IL17. Os resultados foram obtidos antes (Pré) e após oito semanas de suplementação para o grupo placebo e grupo Ganoderma. Os valores estão apresentados como média ± EPM. N=18 para o grupo Ganoderma e N= 15 para o grupo placebo.
7.6.4 Avaliação de citocinas no sobrenadante da cultura de linfócitos
A Figura 72 representa a análise da citocina IL-2 no sobrenadante da cultura de linfócitos na presença e ausência de ConA (esquerda e direita, respectivamente). Na figura 72 à esquerda, observamos na presença de ConA, redução da produção de IL-2 no grupo Ganoderma após a suplementação.
Já para a análise de IL-2 na ausência de concanavalina, Figura 72 à direita, não observamos diferenças em ambos os grupos.
Figura 72- CONCENTRAÇÃO DA CITOCINA IL-2 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (ConA) por 24 horas. Posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA). Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
A Figura 73 representa a análise da citocina IL-4 no sobrenadante da cultura de linfócitos na presença e ausência de concanavalina A (esquerda e direita, respectivamente). Na figura 73 à esquerda, observamos, na presença de ConA, redução da produção de IL-4 no grupo Ganoderma após a suplementação. Porém, não encontramos estas mesmas diferenças no grupo Placebo (Pré e Pós). Já para a análise de IL-4 na ausência de ConA, Figura 73 à direita, não observamos diferenças em ambos os grupos.
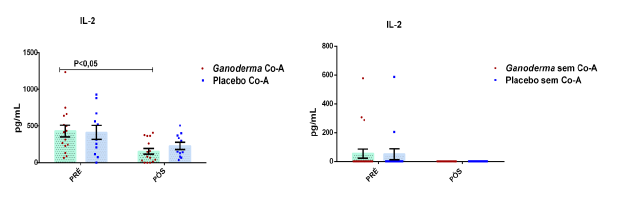
Figura 73- CONCENTRAÇÃO DA CITOCINA IL-4 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (ConA) por 24 horas. Posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA) . Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
A Figura 74 representa a análise da citocina IL-6 no sobrenadante da cultura de linfócitos na presença e ausência de ConA (a esquerda e a direita, respectivamente. Na presença de concanavalina, não observamos diferenças para a análise de IL-6. Já para a análise na ausência do estímulo, observamos redução para os grupos Ganoderma e Placebo no período pós-suplementação.
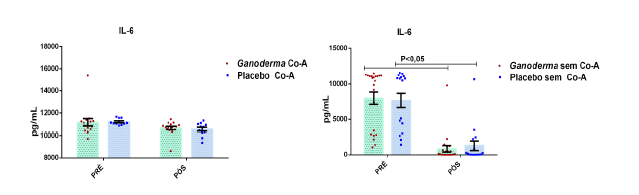
Figura 74- CONCENTRAÇÃO DA CITOCINA IL-6 NO SOBRENADANTE DE CULTURA DE LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (ConA) por 24 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA). Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
A Figura 75 representa a análise da citocina IL-10 no sobrenadante da cultura de linfócitos na presença e ausência de ConA (esquerda e direita, respectivamente). Observamos na presença de Concanavalina A, redução da produção de IL-10 no grupo Ganoderma e Placebo após a suplementação. Estas mesmas diferenças foram observamos para a IL-10 na ausência de Concanavalina A.
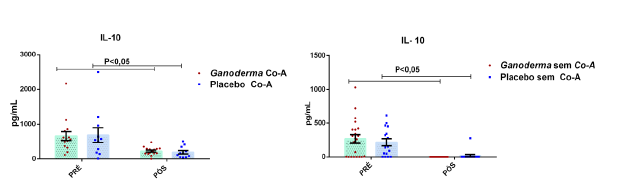
Figura 75- CONCENTRAÇÃO DA CITOCINA IL-10 NO SOBRENADANTE DE CULTURA LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (ConA) por 24 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA). Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
A Figura 76 representa a análise da citocina IL-17 no sobrenadante da cultura de linfócitos na presença e ausência de ConA (esquerda e direita, respectivamente). Observamos na presença de concanavalina, redução da produção de IL-17 no grupo Ganoderma e Placebo após a suplementação. Estas mesmas diferenças foram observamos para a IL-17 no grupo placebo na ausência de concanavalina.
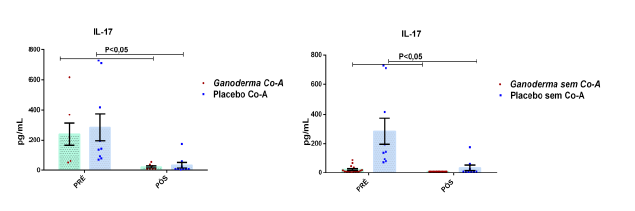
Figura 76- CONCENTRAÇÃO DA CITOCINA IL-17 NO SOBRENADANTE DE CULTURA LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (ConA) por 24 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 7, Grupo Placebo N= 9 (com CoA). Grupo Ganoderma N=16 e Placebo =9 (sem CoA).
Na figura 77 à esquerda, observamos, na presença de ConA, redução da produção de INFɣ no grupo Ganoderma e Placebo após a suplementação. Estas mesmas diferenças foram observamos para a produção de INFɣ em ambos os grupos na ausência de concanavalina (Figura 77, à direita).
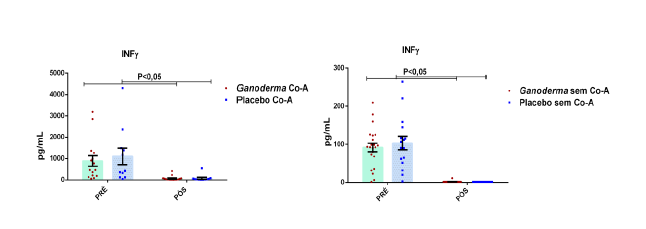
Figura 77- CONCENTRAÇÃO DA CITOCINA INFɣ NO SOBRENADANTE DE CULTURA LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (CoA) por 24 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA). Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
A Figura 78 representa a análise da citocina TNF-α no sobrenadante da cultura de linfócitos na presença e ausência de ConA. Observamos, na presença de ConA (à esquerda), redução da produção de TNF-α no grupo Placebo após a suplementação. Não observamos diferenças significativas para a produção de TNFα em ambos os grupos na ausência de ConA (Figura 78, à direita).
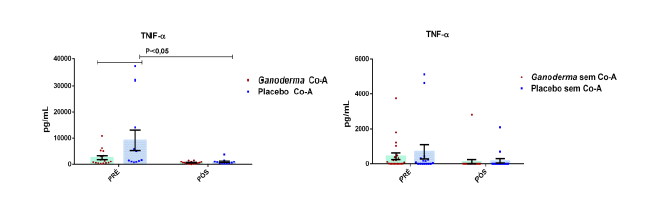
Figura 78- CONCENTRAÇÃO DA CITOCINA TNF-α NO SOBRENADANTE DE CULTURA LINFÓCITOS HUMANOS. Os linfócitos (1,0 x 106 células) foram cultivados na presença (à esquerda) e ausência (à direita) de concanavalina A (CoA) por 24 horas, posteriormente, o sobrenadante foi coletado e a determinação da citocina realizada por Cytometric Bead Array (CBA). A avaliação qualitativa foi realizada em filtro FL4 e a análise quantitativa em FL2. Os resultados foram adquiridos através do “BD C-Sampler Software” e analisados pelo FCAP software. Os valores estão apresentados como média ± EPM. Grupo Ganoderma N= 15, Grupo Placebo N= 11 (com CoA). Grupo Ganoderma N=22 e Placebo =16 (sem CoA).
7.6.5 Avaliação de subpopulações de linfócitos T
A Figura 79 representa a análise da porcentagem de linfócitos T de perfil Th1, na presença de dois desafios PMA e Ionomicina. Em relação a este parâmetro, não observamos diferenças entre os grupos Ganoderma pré e pós-suplementados e entre grupos pós-suplementados, Ganoderma e Placebo.
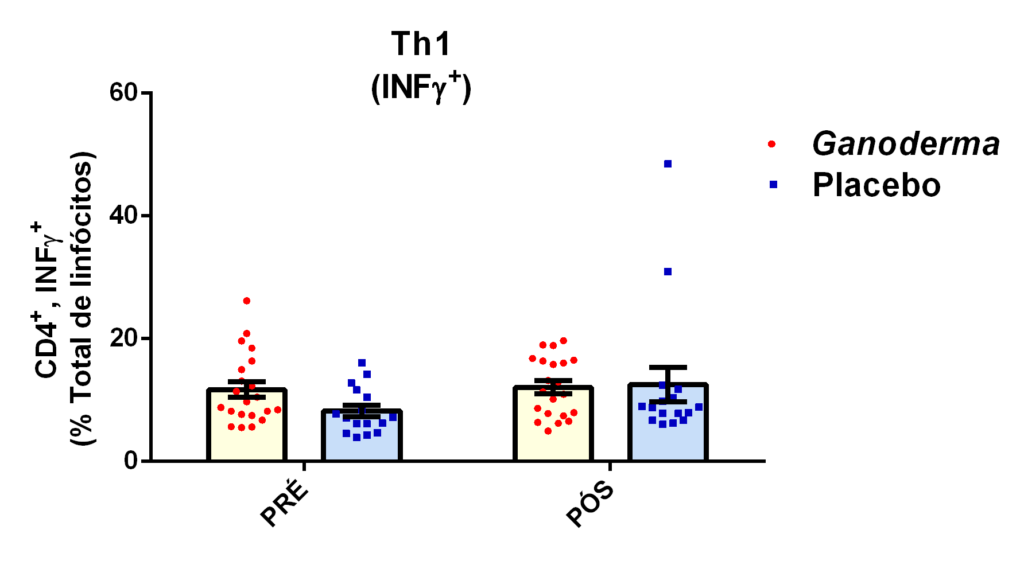
Figura 79- PORCENTAGEM DE CÉLULAS TH1 (CD4+, INFƔ+) EM LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO COM GANODERMA E PLACEBO. A porcentagem de linfócitos Th1 a partir do estímulo PMA (5 μg/mL) e Ionomicina (1 μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação com Ganoderma e Placebo. Os valores estão apresentados como média ± EPM. N=21 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na Figura 80, podemos visualizar a média de fluorescência para INF em linfócitos Th1 na presença de Ionomicina e PMA. O grupo Ganoderma apresentou redução significativa da média de fluorescência referente a INF, em comparação ao grupo Placebo, na presença de Ionomicina e PMA. Isto é, sugestivo de que, na presença destes dois estímulos, Ganoderma promove menor atividade de células de perfil Th1.
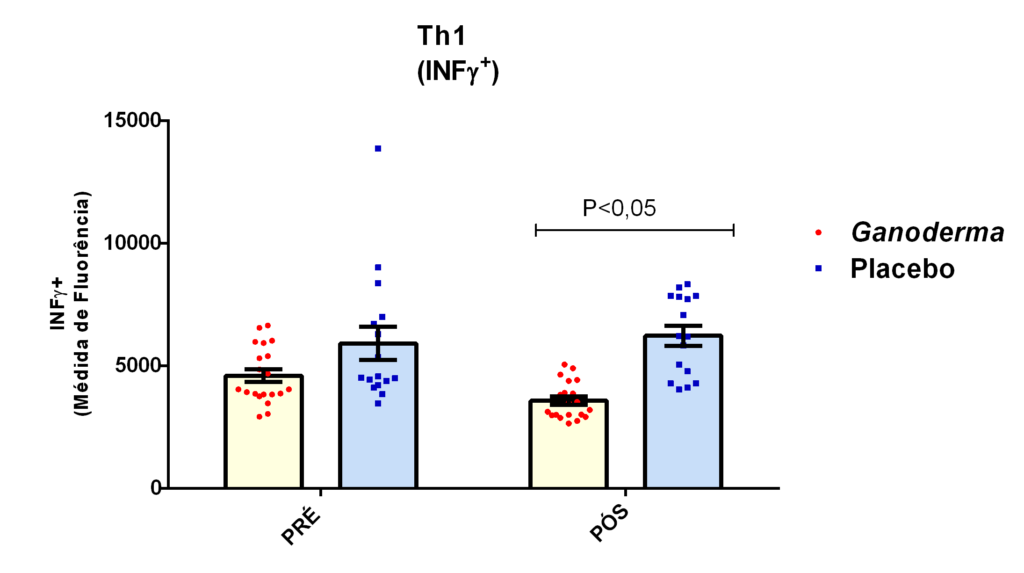
Figura 80– MÉDIA DE FLUORESCÊNCIA DE INF EM CÉLULAS TH1 (CD4+, INFƔ+) DE LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO DE GANODERMA E PLACEBO. A média de fluorescência para a marcação de INF em linfócitos Th1 estimulados com PMA (PMA 5 μg/mL) e Ionomicina (1μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação para placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=20 para o grupo Ganoderma e N= 16 para o grupo placebo.
A análise a seguir, representada pela Figura 81, mostra a porcentagem de células de perfil Th2. Em relação a esta análise, observamos maior porcentagem de células com perfil Th2 para o grupo Ganoderma em relação ao Placebo.
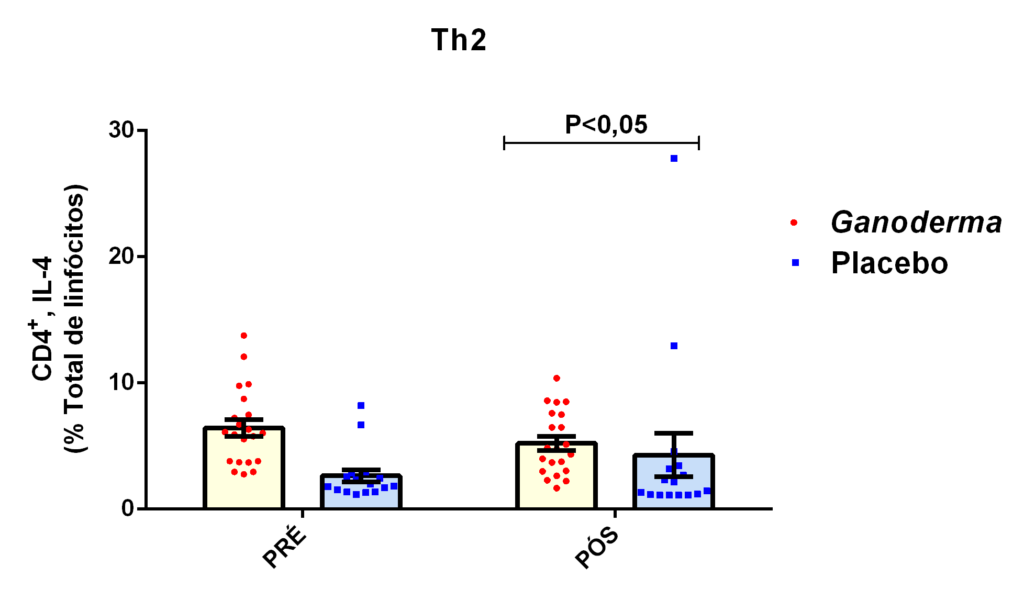
Figura 81- PORCENTAGEM DE CÉLULAS TH2 (CD4+, IL-4+) EM LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO DE GANODERMA E PLACEBO. A porcentagem de linfócitos Th2 a partir do estímulo PMA (5 μg/mL) e Ionomicina (1 μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação com Ganoderma e Placebo. Os valores estão apresentados como média ± EPM. N=21 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na Figura 82, podemos observar a média de fluorescência de células de perfil Th2. Em relação a esta análise, observamos que Ganoderma em comparação ao grupo Placebo, apresenta menor média de fluorescência desde o período pré. Não observamos diferenças significativas pela suplementação.
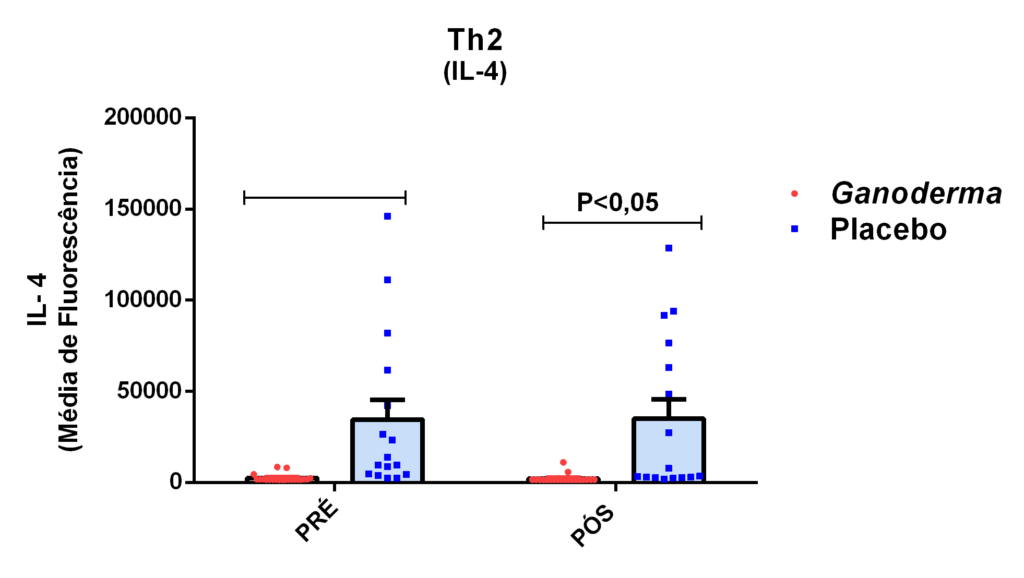
Figura 82– MÉDIA DE FLUORESCÊNCIA DE IL-4 EM CÉLULAS TH2 (CD4+, IL-4) DE LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO DE GANODERMA E PLACEBO. A média de fluorescência para a marcação de IL-4 em linfócitos Th2 estimulados com PMA (5 μg/mL) e Ionomicina (1 μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação para placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=20 para o grupo Ganoderma e N= 16 para o grupo placebo.
A porcentagem de linfócitos de perfil Th17 está apresentada na Figura 83. O grupo Ganoderma apresentamenor porcentagem de linfócitos de perfil Th17 (IL17-A) em comparação ao grupo Placebo pós-suplementado, na presença da Ionomicina e PMA.
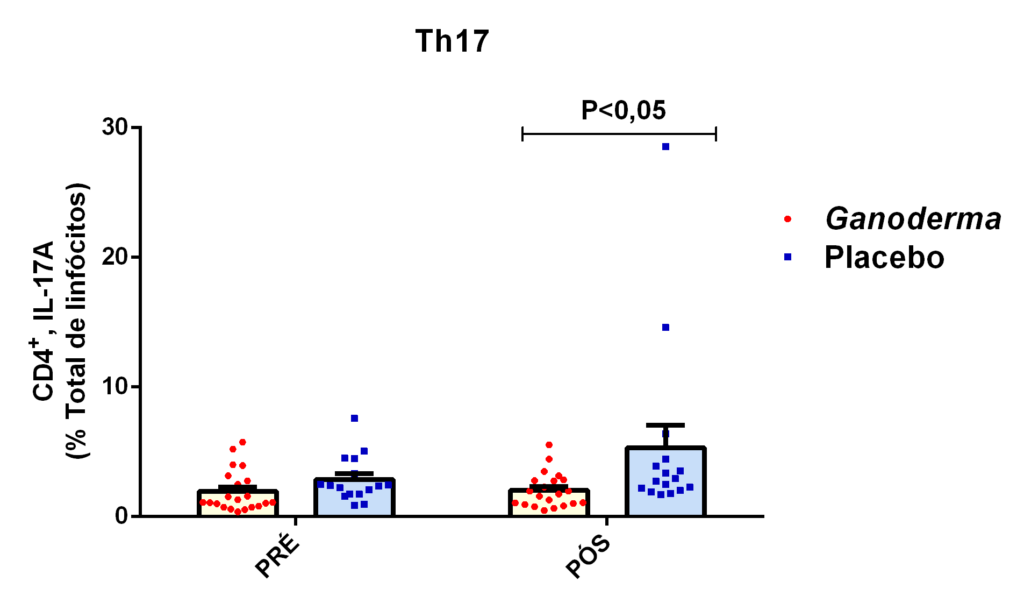
Figura 83- PORCENTAGEM DE CÉLULAS TH17 (CD4+, IL-17+) EM LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO DE
GANODERMA E PLACEBO. A porcentagem de linfócitos Th17 a partir do estímulo PMA(5 μg/mL)e Ionomicina (1 μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação com Ganoderma e Placebo. Os valores estão apresentados como média ± EPM. N=21 para o grupo Ganoderma e N= 16 para o grupo placebo.
Na Figura 84, podemos observar a expressão média de IL-17 em células Th17+. Não observamos diferenças significativas entre Ganoderma e Placebo em relação aos grupos pré e pós-suplementados.
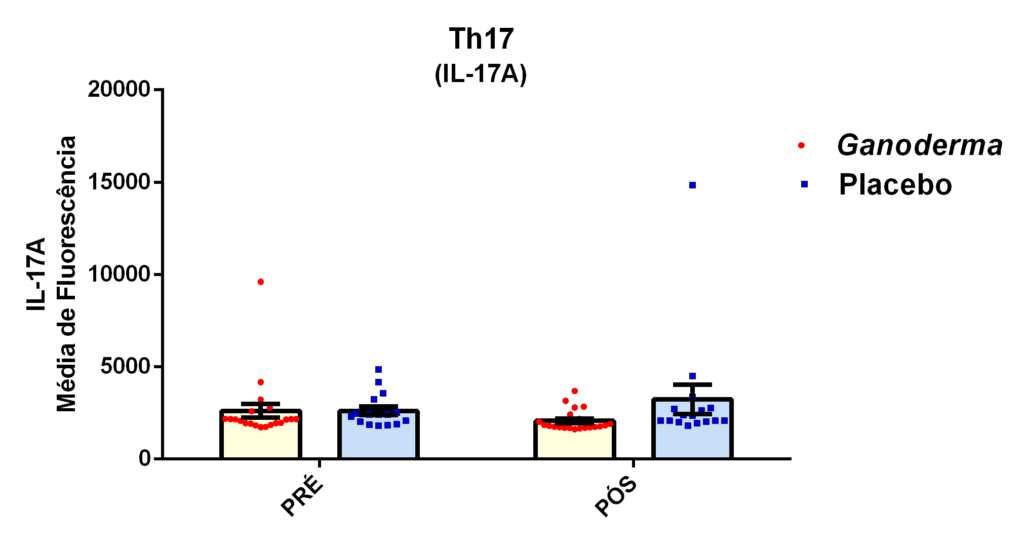
Figura 84 – MÉDIA DE FLUORESCÊNCIA DE IL-17A EM CÉLULAS TH17 (CD4+, IL-17+) DE LINFÓCITOS ESTIMULADOS COM PMA E IONOMICINA ANTES E APÓS A SUPLEMENTAÇÃO DE GANODERMA E PLACEBO. A média de fluorescência para a marcação de IL-17A em linfócitos Th17 estimulados com PMA (5 μg/mL) e Ionomicina (1 μg/mL) foi avaliada antes (Pré) e depois (Pós) de oito semanas de suplementação para placebo e Ganoderma. Os valores estão apresentados como média ± EPM. N=20 para o grupo Ganoderma e N= 16 para o grupo placebo
7.7 Questionário de adesão terapêutica
A Figura abaixo (85) apresenta a avaliação por método indireto de adesão terapêutica através do questionário MORISKY-GREEN.
Nesta análise, observamos que 25 % dos pacientes do grupo Ganoderma enquadram-se como aderente, ou seja, não apresentaram nenhuma falha naposologia durante a última semana de suplementação no estudo e 75% das voluntáriasapresentaram alguma falha na adesão terapêutica. Já para o grupo placebo, 27,03% das voluntárias deste grupo não apresentaram nenhuma falha na posologia na última semana enquanto 72,97% das voluntárias, apresentaram alguma falha na adesão terapêutica (moderada adesão 1 e 2) .
A classificação de fragilidade na adesão foi realizada identificando nas demais facetas, falhas em algumas das perguntas. Quando a falha foi identificada em 1 pergunta, o paciente foi classificado em (moderada adesão 1), falhas em duas perguntas (moderada adesão 2), falhas em três perguntas (baixa adesão 3), falhas em quatro perguntas (baixa adesão 4), quando todas as perguntas foram respondidas pelas voluntárias corretamente, estas foram classificadas como aderente. Estas análises foram aplicadas seguindo o estudo de Hayward et al. (2017). Apenas o grupo Ganoderma mostrou fragilidade nas facetas baixa adesão (3 e 4).
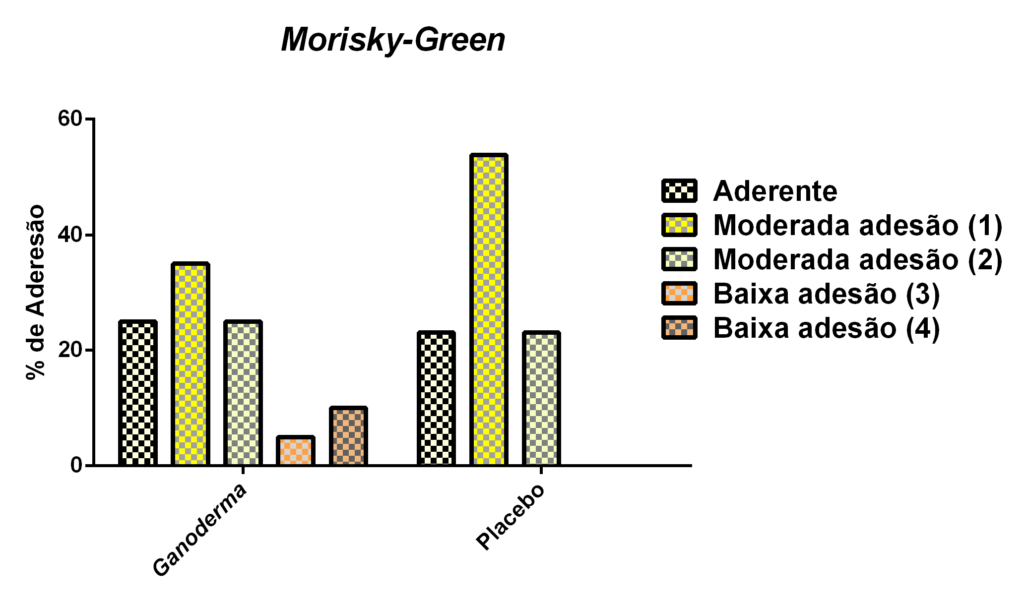
Figura 85- AVALIAÇÃO DO QUESTIONÁRIO MORISKY-GREEN SOBRE ADESÃO TERAPÊUTICA. O questionário foi aplicado após dois meses de suplementação com Ganoderma (grupo C) e placebo ( grupo D). Após a suplementação, foi realizada a somatória da pontuação total. Grupo Ganoderma = 22 e Placebo =16.
No grupo placebo, 27,03% das voluntárias foram aderentes e nas demais facetas de falhas na terapia, identificamos 72,97%.
A Figura 86 apresenta a avaliação realizada pelo teste indireto de adesão terapêutica através do questionário Brief Medication Questionnare (BMQ), sendo considerado teste padrão-ouro.
Nesta análise, foi observado que 45% dos pacientes do grupo Ganoderma enquadram-se como aderentes, ou seja, não apresentaram nenhuma falha quanto às modalidades de regime, recordação e crença durante a última semana de suplementação no estudo. Entretanto, 55% das voluntárias apresentaram alguma falha na adesão terapêutica (facetas provável adesão e provável baixa adesão). Já para o grupo placebo, identificamos que 38,46% dos voluntários deste grupo não apresentaram nenhuma falha na posologia e, neste caso, foram classificadas como aderentes. Já 61,54% das voluntárias do mesmo grupo apresentaram alguma falha na terapia sendo classificadas como provável adesão e provável baixa adesão.
A classificação de fragilidade na adesão foi realizada identificando nos demais regimes, falhas em algumas das perguntas. Quando não houve falha, classificamos como aderente, e quando a falha foi identificada em uma das perguntas, o paciente foi classificado na faceta provável adesão; falhas em duas perguntas (provável baixa adesão) e falhas em três perguntas ou mais (baixa adesão). Estas análises foram aplicadas seguindo o estudo de Ben et al. (2012) e Hayward et al. (2017).
Na figura 86, podemos observar fragilidades de adesão para os grupos Ganoderma e placebo pois os dois grupos mostraram falhas para a suplementação proposta. Para o grupo Ganoderma , houve adesão de 55% representada pela somatória entre as facetas provável adesão e provável baixa adesão enquanto para o grupo placebo, houve 61,54% (nas facetas provável adesão e provável baixa adesão). Nas análises realizadas, os grupos Ganoderma e placebo, apresentaram respectivamente 0% na faceta baixa adesão. Estes últimos dados indicam que houve maior fragilidade terapêutica no grupo Placebo comparado ao grupo Ganoderma.
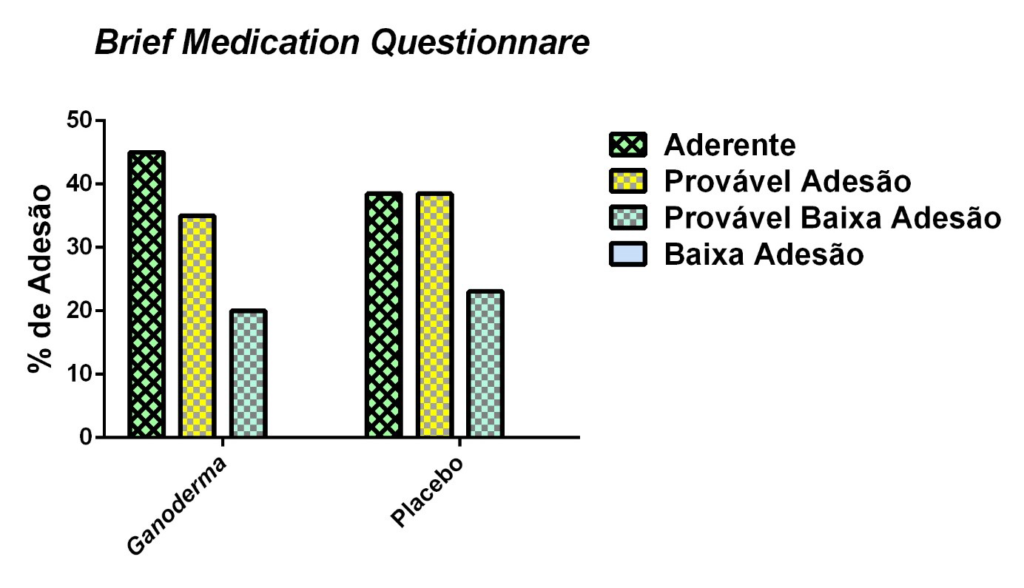
Figura 86- AVALIAÇÃO DO QUESTIONÁRIO SOBRE ADESÃO TERAPÊUTICA BRIEF MEDICATION QUESTIONNARIE. O questionário foi aplicado após dois meses de suplementação com Ganoderma (grupo C) e placebo (grupo D). Após a suplementação foi realizada a somatória da pontuação total. Grupo Ganoderma = 22 e Placebo =16.
7.8 Avaliação do questionário de qualidade de vida
A Figura 87 mostra a avaliação de qualidade de vida. Os domínios avaliados foram o físico, social, psicológico e meio ambiente para o grupo II. Para esta análise encontramos apenas diferença significativa no domínio psicológico, com redução da somatória geral desse domínio para o grupo Placebo em comparação com o grupo Ganoderma pós-suplementados. Encontramos também redução significativa na comparação no grupo Placebo (pré e pós).
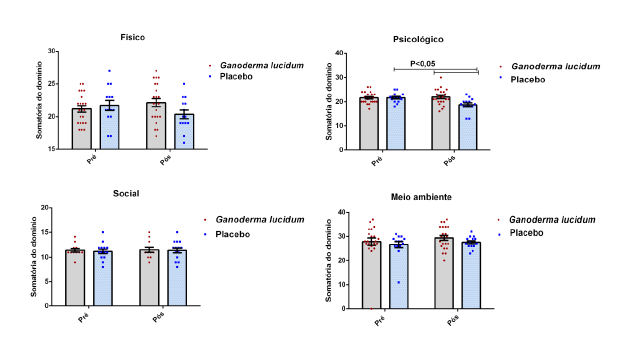
Figura 87- AVALIAÇÃO DO QUESTIONÁRIO QUALIDADE DE VIDA. O questionário foi aplicado no momento Pré e Pós suplementação com Ganoderma (grupo C) e placebo (grupo D). Após a suplementação foi realizada a somatória da pontuação total. Os valores estão apresentados como média ± EPM. N=22 para o grupo Ganoderma no domínio físico, psicológico e meio ambientee N= 14 para o grupo Placebo. N= 10 para o grupo Ganoderma e N= 14 para o Placebo no domínio social.
A tabela a seguir (Tabela 17) resume os resultados das análises da segunda fase do estudo.
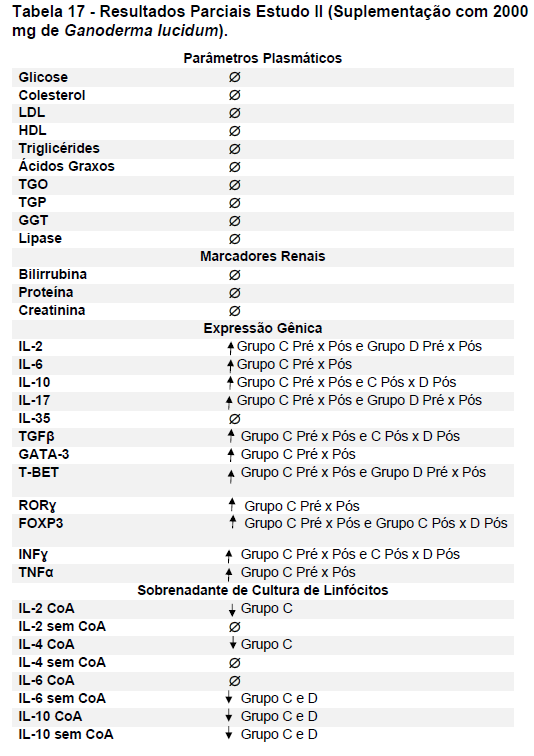
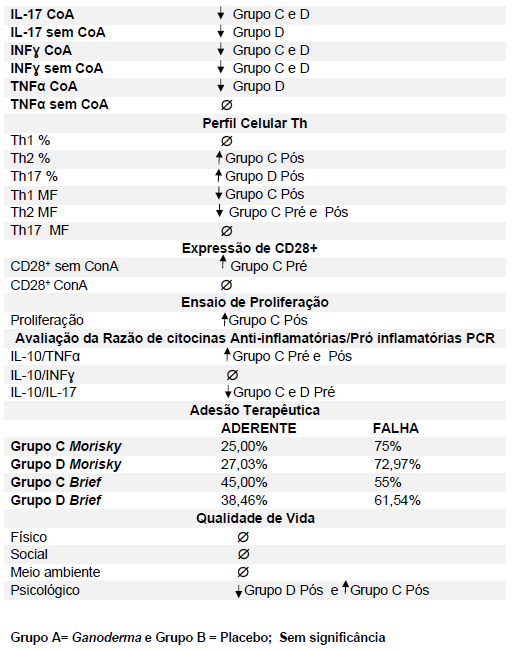
8.0 DISCUSSÃO
Os estudos apresentados anteriormente mostram resultados promissores sobre a imunomodulação promovida por componentes oriundos do Ganoderma lucidum. No entanto, para a avaliação de qualquer efeito no sistema imunológico, temos que acompanhar possíveis alterações hepáticas e renais que possam ser moduladas pelo composto. Em uma primeira fase do estudo, avaliamos o efeitos da suplementação com 1500 mg por dia de extrato de Ganoderma com 10,05% de polissacarídeos (especificação do fabricante). Baseado nos dados encontrados, onde poucos efeitos foram observados e levando-se em consideração o número amostral, realizamos a suplementação em um segundo grupo de voluntárias. Neste segundo estudo, as idosas foram suplementadas com 2000 mg por dia de extrato contendo 47,92% de polissacarídeos (especificação do fabricante), com a finalidade de observar maior atividade imunomoduladora. Assim, a discussão dos dados será realizada sempre explorando os resultados encontrados nestes dois momentos.
a. Análise de função renal
Na análise de função renal, foi possível observar que a suplementação com Ganoderma não promoveu comprometimento renal (tanto 1500 como 2000 mg/dia). Curiosamente para o grupo Placebo pós-suplementação, observamos redução significativa nos níveis de creatinina no soro no Estudo I, com 1500 mg de Ganoderma. Ainda para a prova de função renal, na análise de urina, não observamos alteração qualitativa para a presença de proteína e bilirrubina em ambos os grupos. É possível afirmar, então, que entre os dois grupos suplementados, não se observa alteração que possa indicar risco renal para a saúde do idoso em nenhuma das concentrações avaliadas. Estudos anteriores já indicaram que Ganoderma não produziu efeitos de toxicidade aguda e crônica em modelo animal (Chiu et al., 2000; Chen et al., 2011; Zhao et al., 2012; Zhang et al., 2016).
b. Análise de função hepática
Para a análise de função hepática, investigamos os marcadores TGO, TGP,
GGT. Na presença de substâncias com potencial de induzir toxicidade ao fígado, estas enzimas elevam-se no plasma, sendo então, utilizadas como indicadores para função hepática. Na análise de TGO, observamos que houve redução no grupo placebo após a suplementação. Já para a análise de TGP, observamos um aumento dos níveis plasmáticos para o grupo Ganoderma (Pré e Pós) e não observamos esse mesmo comportamento para o grupo Placebo. No entanto, no grupo suplementado com 2000 mg de Ganoderma contendo maior porcentagem de polissacarídeos (47,92% de polissacarídeos em cápsulas gelatinosas determinada pelo fabricante), não observamos alterações significativas para estas enzimas.
Sudheesh et al. (2012), em um estudo em modelo anima,l sugeriram que Ganoderma foi capaz de proteger a mitocôndria do fígado de ratos e reverter o estresse oxidativo gerado pelo tetracloreto de carbono (CCL4). Neste estudo, foi observado que o Ganoderma foi capaz de reverter o comprometimento do transporte de elétrons na mitocôndria ocasionado pelo CCL4 que é um modelo clássico de intoxicação animal. O CCL4 é capaz de aumentar as espécies reativas de oxigênio porque compromete o transporte de elétrons nos complexos I, II, III e IV. Neste mesmo estudo, Ganoderma foi capaz de reverter os altos níveis de TGO, TGP e fosfatase alcalina gerados pela intoxicação do (CCl4) em níveis significativamente mais baixos. Sudheesh et al. (2012) atribuíram ao composto Ganoderma os benefícios de elevação das enzimas glutationa peroxidase, superóxido desmutase e manutenção dos níveis do substrato glutationa que estão envolvidos no controle das espécies reativas de oxigênio e que, se esgotadas neste sistema, podem comprometer a cadeia respiratória. Quando estas enzimas diminuem e há comprometimento ou esgotamento da glutationa, ocorre a citotoxicidade hepática com a indução da peroxidação lipídica. Em estudo anterior de Chiu et al. (2017), observou-se que o Ganoderma foi capaz de promover o efeito protetor no fígado de pacientes com disfunção hepática com níveis elevados de TGO e TGP. Porém, em nosso estudo, nossos voluntários não apresentam disfunção hepática o que sugere que este composto pode modular a disfunção hepática, mas não altera níveis de TGO e TGP em pacientes que apresentam valores dentro da faixa de normalidade. Neste mesmo estudo, os pesquisadores utilizaram doses de Ganoderma de 225 mg, por um período de seis meses, em extrato contendo uma associação na proporção de 7% de triterpenos (ácidos ganodéricos, A, B, C, C5, C6, D, E e G) e 6 % de polissacarídeos.
Vale salientar que, apesar de nosso grupo de voluntárias serem polimedicamentosas, as mesmas não apresentam qualquer disfunção hepática. A capacidade de modular estes biomarcadores hepáticosestá associada à estruturação química do Ganoderma, como a característica dos polissacarídeos e triterpenoides nele contidos, assim como sugerido anteriormente por Chiu et al. (2017) e Henao et al. (2018). Desta forma, nossas observações sobre segurança e toxicidade de Ganoderma demonstradas pelas análises corroboram com dados recentes encontrados sobre a segurança de 1,3-β glucanos isolados de Ganoderma em humanos (Henao et al., 2018). Este estudo também demonstrou que não ocorre alteração dos níveis de marcadores hepáticos e renais em indivíduos suplementados.
c. Análise glicêmica
Na análise da glicemia plasmática, não observamos diferenças significativas em nenhuma das doses e compostos utilizados. Porém, vale salientar que embora em nosso grupo de voluntárias, algumas apresentem Diabetes mellitus tipo 2, foi realizado um pareamento para ambos os grupos (placebo e Ganoderma) e portanto, não temos um grupo exclusivamente diabético. Assim, possíveis efeitos da suplementação na glicemia, podem ficar mascarados. Gao et al. (2004) observaram atividade hipoglicemiante em pacientes com diabetes tipo 2, suplementados com o produto patenteado GANOPOLY R (contendo 25% de polissacarídeos). No entanto, a suplementação neste estudo foi realizada por um período de doze semanas, em doses de 5,4 g/dia, divididas em três tomadas. Tomoda et al. (1986) observaram atividade hipoglicemiante em modelo animal de ganoderans B e C (peptidoglicano), princípios ativos extraídos de Ganoderma. O estudo foi realizado em animais com glicemia normal e hiperglicemia induzida, porém, na dosagem equivalente a 10 g/Kg de extrato bruto. Neste estudo, também foram avaliados os constituintes isolados descritos acima, nas concentrações de 10, 30 e 100 mg/Kg. Os ganoderans B e C, mostraram ação hipoglicemiante de forma dose-dependente.
Estudos recentes mostraram o potencial hipoglicemiante de um proteoglicano extraído de Ganoderma lucidum “in vitro” e “in vivo”, o Fudan-Yueyang (FYGL). Este bioativo mostrou atividade inibitória competitiva na expressão da proteína tirosina fosfatase (PTP1B). O FYGL foi capaz ainda de reduzir o peso, diminuir a resistência à insulina e os níveis de glicose no sangue em modelo animal (ratos), além de inibir a expressão de PTP1B. Este bioativo de Ganoderma também mostrou regular de maneira positiva a expressão do transportador de glicose (GLUT 4). A regulação positiva do GLUT 4 foi atribuída ao bioativo que mostrou atividade no aumento da fosforilação em tirosina do substrato 1 do receptor de insulina (IRS-1). Os autores deste estudo, sugerem a ativação destes mecanismos como sendo favorecidos pela alta permeabilidade celular do proteoglicano de Ganoderma. Nossos resultados para a análise de glicose utilizando o extrato bruto de Ganoderma lucidum na dose de 1500 mg por dia e na dose de 2000 mg/dia em cápsulas gelatinosas e teor de polissacarídeos de 47,92% (especificação do fabricante), não corroboram com os resultados atribuídos à esta glicoproteína recentemente descoberta por Yang, Chen, et al. (2018) e Yang, Wu, et al. (2018). Vale salientar que a maior parte das voluntárias de nosso estudo com média de idade de 67,3 anos, possui níveis de glicose dentro da faixa de normalidade, não sendo então, classificadas como diabéticas.
d. Análise de lipídios plasmáticos
Para a análise de triglicérides e colesterol não foram observadas diferenças significativas entre os grupos Ganoderma e placebo pré e pós-suplementados. Nossos achados corroboram com os achados de Klupp et al. (2015), Klupp et al. (2016) que também não encontraram diferenças significativas no perfil lipídico de pacientes com síndrome metabólica. No estudo de 2016, os pesquisadores compararam a suplementação de extrato seco de Ganoderma com ou sem Cardyceps sinenses ou placebo, por 16 semanas, em dose de 3000 mg/dia e também não encontraram diferenças significativas nesses pacientes.
Meneses et al. (2016) já relataram a atividade hipocolesterolêmica de Ganoderma em modelo animal. Neste estudo, um mecanismo proposto para esta atividade foi sugerido a partir da modulação por α-glucanos e β-glucanos presentes neste composto, que promovem redução da absorção do colesterol pelo intestino, além do aumento da excreção de sais biliares pelas fezes. Os pesquisadores atribuíram ao Ganoderma, atividade prebiótica, sendo este capaz de modificar a microbiota dos animais com o aumento inclusive de lactobacillus. Chang et al. (2015) observaram que polissacarídeos de Ganoderma (peso superior a 300 KDa), de maneira dose-dependente (modelo animal), também foram capazes de alterar a microbiota, diminuir a obesidade em ratos e alterar o tamanho de adipócitos no fígado mostrando também atividade protetora. Em nosso estudo, o Ganoderma e placebo não alteram a concentração de colesterol total, HDL e LDL. Vale salientar que em nosso grupo de voluntários, embora existam alguns pacientes com dislipidemia, os mesmos fazem uso de medicamentos hipolipemiantes. Possivelmente, o controle da dislipidemia exercido por fármacos específicos pode influenciar a modulação exercida por Ganoderma o que justificaria o fato de não visualizarmos de maneira significativa a modulação exercida pelo composto Ganoderma. Nesse sentido, não encontramos diferenças significativas entre o grupo placebo e Ganoderma pós-suplementação, embora o grupo tratado com Ganoderma mostre uma tendência a redução do colesterol.
e. Análise antropométrica e de composição corporal
Embora não tenhamos utilizado o IMC e parâmetros de composição corporal para o pareamento dos grupos no Estudo 1, o grupo tratado com Ganoderma, mostrou redução para a circunferência de quadril e aumento da massa magra. Estes achados corroboram com as observações apontadas por Chang et al. (2015) em modelo animal. Os pesquisadores observaram redução do tecido adiposo em ratos obesos. No entanto, os valores de IMC e de circunferências no tempo pré foi maior no grupo Ganoderma em relação ao Placebo. Baseado nestes dados, no Estudo 2 (2000 mg de Ganoderma), realizamos o pareamento da amostra através dos parâmetros antropométricos e de composição corporal, além dos medicamentos.
f. Expressão de CD28+ e proliferação de linfócitos
Uma vez que não ocorreram alterações importantes nos parâmetros antropométricos e bioquímicos, iniciamos a avaliação do perfil de linfócitos. No estudo I, com relação ao ensaio de proliferação celular, não ocorreram diferenças entre os grupos. Gao et al. (2005), observaram em pacientes com câncer, que na presença de PHA, o Ganoderma com 25% de polissacarídeos, reduziu a atividade mitogênica em (29,30%) para 12 pacientes e aumentou em (53,30%) para 12 pacientes. Neste mesmo estudo, na contagem total de linfócitos no sangue, Ganoderma exerceu pouca ou nenhuma influência. Nossos achados para esta análise, sugerem que o lote utilizado contendo 10,05% de polissacarídeos (especificação do fabricante) não foi capaz de exercer atividade sobre a proliferação de linfócitos. No Estudo II para a análise de proliferação na presença do mitógeno concanavalina A (cultura de linfócitos de 60 horas), não observamos diferenças significativas entre os grupos Ganoderma lucidum pré e pós-suplementados, mas encontramos aumento da proliferação após a suplementação com Ganoderma. O mitógenos PHA e ConA estimulam a via de sinalização em TCR, com consequente ativação da proteína RAS, MAPK e NFAT1 e consequente aumento da produção de IL-2.
Para a análise da expressão de CD28+ no Estudo II, na presença e
ausência do mitógeno concanavalina A, não observamos diferenças significativas após suplementação. Para esta análise, encontramos diferenças significativas apenas para o grupo pré-suplementação para a avaliação da expressão de CD28+ na ausência de concanavalina. O aumento da expressão de CD28+ está relacionado com a ampliação da via de ativação em NFkB. Essa rota ativada, regula a sobrevivência celular (aumento da produção de BclXL e Bcl2), a ativação de mecanismos de proliferação celular e a ativação de mecanismos múltiplos de diferenciação em células efetores e células de memória (Chen e Flies, 2013; Vanhove et al., 2017). Vanhove et al. (2017) já afirmaram que três os mecanismos estão envolvidos na ativação de linfócitos T, sendo o primeiro exercido pela ação da célula apresentadora de antígeno em receptor de TCR, o segundo mecanismo por moléculas coestimulatórias, como por exemplo (CD28+) ou molécula coinibitória (CTL4) e o terceiro mecanismo pela produção de citocinas que regulam a diferenciação de células T em células T efetoras ou de memória. De acordo com estes estudos, a expressão de CD28+ exerce papel muito importante na estimulação dos linfócitos, sobretudo na proliferação dos linfócitos. Desta forma, em doenças autoimunes, observa-se a falta de regulação na molécula coestimulatória (CD28+) e/ou inibitória (CTL4). Embora não tenhamos observado modulação exercida por Ganoderma na expressão de CD28+ mesmo na presença de um desafio (agonista em TCR), observamos maior capacidade proliferativa para o grupo Ganoderma em relação ao Placebo pós-suplementados. Estes dados são sugestivos de que Ganoderma talvez exerça alguma regulação em outra molécula coestimulatória. Chan et al. (2005) também observaram o aumento sutil na proliferação de células mononucleares humanas exercido pelo extrato do micélio de Ganoderma lucidum, ao passo que observaram sutil supressão na proliferação pelo extrato de esporos de Ganoderma (Yang et al., 2015; Vanhove et al., 2017; Shi et al., 2017).
g. Análise de citocinas no sobrenadante de cultura de linfócitos na presença de PHA
Com relação à análise da citocina IL-2 no sobrenadante de cultura de linfócitos, observamos redução apenas para o grupo placebo. Nossos achados para esta citocina não corroboram com os resultados de Haak-Frendscho et al. (1993) e Cai et al. (2016). No estudo Haak-Frendscho et al. (1993), observou-se que a proteína isolada de Ganoderma (LZ-8), aumenta a secreção de IL-2, TNFα e INFɣ por linfócitos, além do aumento da expressão de CD25,que é a subunidade do receptor de IL-2. Nossos achados também não corroboram com o estudo de Habijanic et al. (2015). Os pesquisadores observaram, em cultura de células mononucleares, a influência de polissacarídeos extraídos da parede extracelular do caldo do cogumelo Ganoderma no aumento da secreção de IL2, INFɣ e IL-10. Nossos achados para este grupo piloto suplementado com o extrato seco de Ganoderma contendo 10,05% de polissacarídeos (especificação do fabricante), são sugestivos de que a influência do extrato seco de Ganoderma em citocinas pode ser diferente dos resultados encontrados a partir de proteínas, polissacarídeos e triterpenos isolados deste cogumelo. Com base na ausência de resultados com esta concentração, resolvemos, no estudo 2, utilizar o extrato com maior teor de polissacarídeos (dados apresentados posteriormente).
Para a avaliação das citocinas IL-4 e IL-5 no sobrenadante de cultura de linfócitos, não observamos diferenças para ambos os grupos estudados. Para a citocina IL-4, nossos achados corroboram com os encontrados no estudo de Habijanic et al. (2015), no qual os pesquisadores observaram que polissacarídeos de parede extracelular presentes no caldo deste cogumelo não foram capazes de influenciar a IL-4, permanecendo esta inalterada.
Na avaliação da secreção da citocina IL-10 em sobrenadante de cultura de linfócitos, observamos em nosso estudo, significativa redução na concentração em comparação ao grupo placebo. Isto pode indicar influência deste extrato na resposta inflamatória. Nesse sentido, nossos resultados para esta citocina avaliada, não corroboram com os estudos de Jeurink et al. (2008) e Habijanic et al. (2015). Em ambos os estudos, observou-se aumento na concentração de IL-10 para extrato de proteínas de Ganoderma e frações de polissacarídeos, porém, ambos estudos foram com bioativos isolados deste cogumelo.
Cai et al. (2016) também encontraram, em modelo animal de lupus eritematoso, o aumento da secreção da citocina IL-10 em células Breg (CD19+, CD5+, CDd1+) que são linfócitos B reguladores. Este aumento foi observado em comparação aos ratos não tratados pelo extrato complexo de Ganoderma (35.7%) e San Miao (associação de 3 produtos chineses contendo Cangzhu, 21.4%, Huangbai 21.4% e Niux 21.4%). No estudo I, nossos resultados não foram os mesmos encontrados por este grupo. De fato, nós avaliamos a secreção de IL-10 por linfócitos totais, sendo que a alteração observada pode estar associada a outros tipos de linfócitos presentes na cultura. Desta forma, no estudo II avaliamos além da secreção da citocina a expressão do mRNA da mesma, associado a outros genes específicos de células reguladoras, como discutido abaixo.
Com relação às análises de TNFα e INFɣ, não encontramos diferenças significativas e sim, apenas tendência ao aumento da secreção para INFɣ e tendência à redução para TNFα. Nossos achados não corroboram com a revisão apresentada até o momento. Vale salientar que nosso extrato possui teor de polissacarídeo diferente dos demais estudos, a maioria dos estudos realizados, utilizaram frações isoladas de triterpenos, proteínas ou polissacarídeos. Em alguns outros estudos, ocorre a associação de mais de uma substância em concentrações conhecidas(Habijanic et al., 2015, Chiu et al., 2017).
h. Análise de citocinas no soro
Gao, Y. et al. (2003), em estudo em humanos que utilizou Ganoderma contendo 25% de polissacarídeos, observaram que o extrato em doses de 5,4 g por dia, exerceu atividade imunomuduladora, aumentando a concentração de IL-2, IL-6 e INFɣ, e reduzindo de TNFα no plasma. Nós também avaliamos estas citocinas no soro, porém os níveis encontrados não foram detectados pelo método CBA nos indivíduos avaliados. Altos níveis no plasma de citocinas pró-inflamatórias podem ser justificados em decorrência da presença de doenças crônicas, como o diabetes e obesidade por exemplo. Já estímulos artificiais ou naturais em tecidos são eventos apenas locais e não elevam citocinas no plasma até porque sofrem ação das proteases teciduais, possuindo tempo de vida muito curto. Estas evidências podem explicar o fato de não encontrarmos, em nosso estudo, níveis detectáveis de citocinas no plasma.
i. Análise de expressão gênica
Para a avaliação de IL-17, no estudo I, observamos aumento desta citocina para ambos os grupos suplementados. Habijanic et al. (2015) encontraram em frações isoladas de polissacarídeos, grande atividade estimulatória. Isto pode sugerir que nosso extrato exerce efeito estimulador, mesmo na presença de um desafio para os linfócitos, ou seja, na presença de um mitógeno (PHA). Nossos resultados no estudo I não são os mesmos encontrados por Xie et al. (2017). Nesse estudo, doses de extrato de micélio foram administradas por gavagem (ratos) em doses de 100, 200 e 300 mg/dia, durante 20 dias, e os pesquisadores observaram que altas doses de extrato de Ganoderma promoveram a regulação negativa na secreção de IL-6 e IL-17 e regulação positiva na expressão do fator TGF-β1, que é determinante para a diferenciação em perfil celular Th17. Baixos níveis de TGF-β1 concomitante a altos níveis de citocina IL-6 favoreceram a diferenciação para perfil celular de linfócitos Th17 (efeito dose-dependente), enquanto que altos níveis de TGF-β1 e baixos de IL-6 favoreceram a diferenciação para T reg. Por outro lado, TGF- β, na presença de altos níveis de IL-6, favorece a expressão de RORα ou RORɣ, o que, por sua vez, leva à diferenciação para linfócitos Th-17. TGF- β1, na ausência de citocinas próinflamatórias, por sua vez, favorece a expressão do fator de transcrição Foxp3. A expressão deste fator de transcrição é responsável pela ativação de linfócitos Treg induzidos (Lee et al., 2009; Xie et al., 2017). Estudos de Yang et al. (2008) mostraram também que tanto RORɣ e RORα (super-expresso) na presença de IL-6 e TGF-β foi capaz de promover a ativação de perfil Th-17. Além disso, a deficiência de RORα foi capaz de reduzir a expressão de IL-17 in vitro e in vivo. De acordo com os autores deste estudo, a coexpressão de RORɣ e α, de maneira sinérgica, aumenta a diferenciação para o perfil Th-17.
Baseado nestes resultados de secreção de citocinas no estudo realizado com 1500 mg de Ganoderma (10,05% de polissacarídeos pela especificação do fabricante), partimos para a análise do composto com maior teor de polissacarídeos (47,92% pela especificação do fabricante) administrado em maior dose (2000 mg).
Para a análise de expressão do fator de transcrição RORɣ no estudo II, encontramos aumento para o grupo Ganoderma. Este fator de transcrição quando ativado, favorece a diferenciação de linfócitos para o perfil Th17. No entanto, a secreção de IL-17 pelos linfócitos, foi reduzida. Nossos resultados parciais são sugestivos de que somente o aumento da expressão de RORɣ (grupo Ganoderma) não é o suficiente para a regulação positiva na secreção de IL-17 no sobrenadante da cultura de linfócitos, pois esta citocina é secretada na presença de altos níveis de expressão de TGF-β e IL-6, concomitantemente. Desta forma, quando ocorre esse sinergismo, o resultado é a diferenciação para o perfil Th17. Em nosso estudo, encontramos aumento na expressão gênica de IL-6 e TGF-β e do fator de transcrição RORɣ, que, juntos, podem levar à maior secreção de IL-17 (Hsu et al., 2013; Cai et al., 2016 e Xie et al., 2017). Nossos achados para esta citocina, sugerem então, regulação negativa no perfil de linfócitos Th17 exercida pelo aumento da expressão do gene de IL-10, mesmo na presença de significativo aumento dos genes TGF-β, IL6 e RORɣ, principais marcadores para a secreção de citocinas IL-17.
Em nossos resultados para o segundo grupo de voluntárias (suplementadas com 2000 mg/dia em cápsulas gelatinosas), encontramos aumento da expressão de GATA-3. O fator de transcrição GATA-3 está relacionado ao perfil celular de linfócitos Th2 (IL-4, IL-5, IL-10 e IL-13) (Srivastava et al., 2004; De Grove et al., 2017). Nossos achados são sugestivos de regulação negativa exercida pela expressão gênica de IL10 (T reg) na diferenciação de linfócitos de perfil Th2, mesmo na presença do aumento da expressão do gene GATA-3, pois não observamos o aumento na secreção da citocina IL-4, no sobrenadante,k que é de característica em perfil celular Th2.
Em nosso estudo, encontramos valores relativos aumentados na expressão de mRNA para FoxP3, TGF-β, IL-10 para o grupo Ganoderma em relação ao Placebo no período pós-suplementação. Já para a expressão de T-bet, observamos aumento em ambos os grupos. Este último fator de transcrição tem um importante papel na diferenciação para perfil celular Th1, pois ele é capaz de amplificar a resposta de INFɣ e, neste caso, na avaliação da expressão gênica de INFɣ em nosso estudo, encontramos aumento. Vale salientar que não observamos o mesmo para o INFɣ no sobrenadante em cultura de linfócitos para o grupo Ganoderma, isto é sugestivo de que o aumento encontrado na expressão de IL-10 pode exercer efeito de regulação negativa na secreção da citocina INFɣ. Nossos resultados foram os mesmos encontrados nos estudos de Cai et al. (2016) e Xie et al. (2017) para outros tipos celulares. Já é sabido que o aumento na expressão de TGF-β, associado a baixos níveis de expressão de IL-6, favorece a diferenciação dos linfócitos para perfil de Treg, aumentando a expressão do fator de transcrição FoxP3 (Lee et al., 2009; Cai et al., 2016 e Xie et al., 2017). A expressão de TGF-β está relacionada à inibição da proliferação de células T efetoras e com a formação de células T reguladoras maduras. Além disso, para exercer sua função reguladora, os linfócitos Treg atuamatravés da secreção de citocinas IL-10, TGF-β e IL-35.
A IL-35 é uma citocina com característica inibitória e em nosso estudo para o segundo grupo de voluntárias, não encontramos diferenças significativas para a expressão de IL-35, apenas uma tendência ao aumento da mesma. Desta forma, nossos dados são sugestivos de que o Ganoderma está exercendo ação reguladora diante de TGF-β e a expressão gênica de IL-10. Até o momento, não encontramos estudos em humanos que explorassem e correlacionassem a ação de Ganoderma sobre os linfócitos T reguladores e seus fatores de transcrição. Hsu et al. (2013)demostraram a capacidade da proteína isolada de Ganoderma, a LZ-8 (grau de pureza superior a 98%), na expansão de linfócitos Treg em modelo animal (BALB) e em células Jurkat. Estes últimos resultados são sugestivos de que, possivelmente, o nosso segundo lote de Ganoderma (2000mg/dia e teor de 47,92 % de polissacarídeos) induz ao perfil da diferenciação para linfócitos Treg, cuja função é coordenar o sistema imune. Estes dados não são os mesmos encontrados no nosso primeiro lote de Ganoderma (10,05% de polissacarídeos).
O aumento da expressão de TNFα, INFɣ e T-bet, encontrado em nosso segundo lote, é sugestivo da correlação positiva do estímulo de Ganoderma para perfil celular Th1. Porém, o aumento também da expressão gênica de IL-10 e TGF-β em nosso estudo,indica regulação negativa exercida por esses genes (IL-10 e TGF-β) sobre a secreção de citocinas de perfil Th1, pois não visualizamos esse mesmo aumento na secreção de citocinas em sobrenadante de cultura para TNFα, INFɣ e IL-2.
j. Modulação da citocina IL-10 sobre outras citocinas
A regulação negativa exercida por IL-10 na secreção de citocinas (INFɣ e TNF-α) no sobrenadante de cultura de linfócitos, pode ser regulada através da inibição da STAT1 e NFkB, de acordo com Fioranelli e Roccia (2014). Os autores sugerem que a nomenclatura correta para a IL-10 não é de citocina supressora, mas citocina reguladora devido a sua propriedade pleiotrópica. Ela possui inúmeras funções e a principal delas é o equilíbrio, ou seja, a regulação entre Th1 e Th2.
A IL-10 induz a expressão de SOCS, cuja função é suprimir outras citocinas pró-inflamatórias, como é o caso da SOCS3. A SOCS3 tem a função de inibir a fosforilação do receptor de IL-6 através da inibição da fosforilação de Jak3 (Mosser e Zhang, 2008; Shouval et al., 2014; Soendergaard et al., 2017). Já foram relatadas para a IL-10 suas propriedades em suprimir TNFα, IL-6 e IL-1β, assim como sua capacidade de regular genes anti-apoptóticos, como BclxL e Bcl2. Entre outras propriedades, foram descritas sua atividade em regular genes do ciclo celular e, ainda, sua capacidade em regular outras STATs. A STAT 1, por exemplo, regula INFɣ, a STAT 4 regula a IL-12 em macrófagos e a STAT 5 regula a IL-2. A IL-10 pode ainda inibir NFkB e estimular a produção de anticorpos (Yoshimura et al., 2005; Fioranelli e Roccia, 2014; Lee e Park, 2015). A partir disso, acreditamos que a IL-10 exerceu influência no sobrenadante da cultura de linfócitos (INFɣ). Com relação à citocina TNFα no sobrenadante de cultura, não encontramos diferenças significativas na ausência de ConA e encontramos apenas tendência à redução para o grupo Ganoderma na cultura com estímulo.
Ao analisarmos a expressão gênica de Foxp3, encontramos aumento da expressão no tratamento com Ganoderma. Sabe-se que o aumento da expressão gênica de Foxp3 suprime a secreção de TNFα e de seu receptor, o que pode ser observado na avaliação desta citocina no sobrenadante da cultura de linfócitos. Nossos achados também são sugestivos da modulação do gene Foxp3 e sua relação com a supressão de TNFα, uma vez que não observamos o aumento de TNFα no sobrenadante da cultura de linfócitos (células com e sem estímulo). Estudos são sugestivos de que a citocina IL-10 também pode promover a regulação negativa de TNFα (Fioranelli e Roccia, 2014). Uma possível rota para essa regulação negativa exercida por IL-10 sobre TNFα poderia ser a inibição da ativação de NFkB. Esta é uma importante via de sobrevivência, diferenciação e proliferação de linfócitos que é regulada negativamente por STAT3 de IL-10 (Lee e Park, 2015).
Com relação à citocina IL-17 no sobrenadante de linfócitos, observamos que houve redução para ambos os grupos pós-suplementação, mas houve diferença estatística entre Ganoderma e placebo no período pré. A expressão de três genes pode influenciar de maneira direta o aumento da secreção da citocina IL-17, a expressão de IL-6 e TGF-β, além da expressão do fator de transcrição RORɣ, cuja principal função é a de amplificar a resposta para perfil Th-17, através do aumento da secreção de IL-17. Para estes três genes, observamos aumento da expressão, efeito oposto ao observado para a concentração da citocina IL-17. Estes resultados são sugestivos de regulação negativa exercida por IL-10 sobre a secreção de IL-17 (a IL10 aumentou significativamente para o grupo Ganoderma em comparação ao placebo pós suplementado). Possivelmente, a expressão elevada do gene de IL-10 em nossos achados está regulando negativamente a secreção de IL-6. Como mencionado anteriormente, a IL-10 possui atividade em regular a transcrição de vários genes (pró e anti-inflamatórios). A ativação do receptor de IL-10 leva à fosforilação de JAK1 na cauda citoplasmática do receptor de IL-10, ativando o STAT3 em seu domínio ligante.
O STAT3 fosforilado transloca-se para o núcleo e ativa a transcrição de vários genes, em especial, a ativação da transcrição de SOCS3 (Figura 88), cuja função é regular negativamente a IL-6 (Yoshimura et al., 2005; Mosser e Zhang, 2008; Shouval et al., 2014; Soendergaard et al., 2017). A família de SOCS é composta por proteínas com ação reguladora em várias citocinas. Curiosamente, ambos os receptores de IL-10 e IL-6 são ativados através da fosforilação da STAT3. Porém, através de mediadores diferentes, como JAK1 e JAK 3, respectivamente (Figura 88). Desta forma, estes resultados indicam que a supressão de IL-17 pode ser regulada via expressão de IL10. Xie et al. (2017) fizeram as mesmas observações na diferenciação de linfócitos de perfil Th-17 em modelo animal.
Com relação a avaliação da razão da expressão gênica IL-10/TNFα nossos resultados indicam controle exercido pela aumento da expressão de IL-10 sobre a expressão de perfil Th1.
l. Análise de citocinas no sobrenadante na presença e ausência de ConA
Com relação à citocina IL-10 no sobrenadante de linfócitos, observamos redução para ambos os grupos na presença e ausência de ConA. Embora tenhamos observado aumento significativo da expressão gênica de IL-10 não observamos esse mesmo aumento para a proteína no sobrenadante. Nossos resultados indicam que o tempo de cultura de 24 horas para a análise desta citocina no sobrenadante não foi suficiente para que pudéssemos evidenciar o aumento de IL-10 no sobrenadante de cultura de linfócitos. Desta forma, observamos uma condição para a expressão gênica oposta a secreção em cultura desta citocina. Em 2015,Habijanic et al. (2015)investigaram o perfil de citocinas em células mononuclerares sob a influência de proteínas isoladas de Ganoderma (subgrupos de linfócitos) e fizeram a mesma observação para algumas citocinas anti-inflamatórias. Esse estudo mostrou a capacidade de polissacarídeos de parede em estimular a resposta inata (inalterada para a IL-10) enquanto polissacarídeos de parede extra celular, solúvel em água quente, mostrou modulação positiva em resposta imune adaptativa com aumento de INFɣ, IL-2 e inclusive IL-10 (inalterada para IL-4). Fioranelli e Roccia (2014) também sugeriram a observação da secreção de IL-10 após 72 horas de cultura.
Para a análise da citocina IL-4 no sobrenadante de linfócitos na ausência de ConA, também não observamos diferenças. Mas, na presença de estímulo, observamos redução da IL-4 para o grupo Ganoderma. Porém, ao avaliarmos a expressão gênica de GATA-3, um fator de transcrição cuja função é de amplificar a diferenciação de linfócitos para perfil Th-2, observamos aumento para o Ganoderma após a suplementação. A citocina IL-4, que é estimulada na diferenciação de linfócitos de perfil Th-2, pode ser produzida em pequenas quantidades pelos próprios linfócitos ou também por mastócitos e eosinófilos na presença de helmintos. Outra possibilidade é a ativação do receptor de TCR. GATA-3 amplifica a secreção de IL-4, que, por sua vez, é capaz de atuar de maneira autócrina em seu próprio receptor (IL-4). Outros estudos avaliaram a produção de IL-4 por polissacarídeos de Ganoderma e observaram pouca ou nenhuma influência de Ganoderma na secreção de IL-4 (Jeurink et al., 2008; Habijanic et al., 2015; Xie et al., 2017). Uma hipótese para nossos resultados, seria a regulação negativa exercida por IL-10 em STAT6, a qual é ativada pelo receptor de IL-4 (Figura 88). Possivelmente a fosforilação de STAT-3 regulada por IL-10 pode promover regulação negativa no receptor de IL-4.
Nosso estudo mostra a influência do extrato seco bruto de Ganoderma na modulação de linfócitos Treg em humanos, cuja função está relacionada em coordenar o sistema imune inato e adaptativo, algo que não foi observado anteriormente. Nossos resultados indicam que o extrato seco de Ganoderma exerce influência em perfil de linfócitos Th1, Th17 e pouco em perfil Th2.
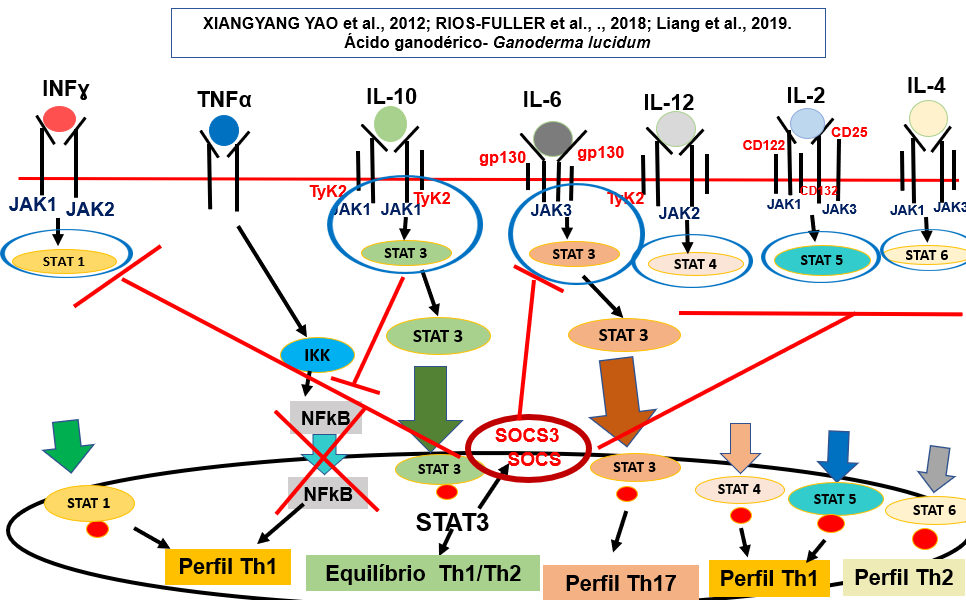
Figura 88- ESQUEMA DOS RECEPTORES DE CITOCINAS – A STAT3 fosforilada a partir da JAK1 e TyK2 (receptor de IL-10) é translocada para o núcleo e se liga a vários elementos STATs, possuindo regulação pleiotrópica. Pode exercer, então, por exemplo, regulação negativa via STAT3 direta ou via ativação da família de SOCs que pode regular negativamente várias outras citocinas pró-inflamatórias, incluindo a inibição da via NFkB ativada pelo receptor de TNFα.
m. Perfil celular
Com relação à porcentagem de linfócitos T de perfil Th1, na presença de dois desafios, PMA e Ionomicina, não observamos diferenças entre os grupos Ganoderma pré e pós-suplementados e entre grupos pós suplementados, Ganoderma e Placebo. Com relação à média de fluorescência para INF em linfócitos Th1 na presença de Ionomicina e PMA, o grupo Ganoderma pós-suplementadoapresentou redução significativa da média de fluorescência referente a INF, em comparação ao grupo Placebo, na presença de Ionomicina e PMA. Isto indica que, na presença destes dois estímulos, Ganoderma promove menor atividade de células de perfil Th1, pois observamos redução da média de fluorescência referente à expressão de INF.Isto mostra que na presença dos mitógenos PMA e ionomicina, Ganoderma exerce predomínio na modulação da atividade das células de perfil Th1. Ganoderma parece promover alguma supressão na capacidade de atividade das células de perfil Th1 (INF) sem promover redução na porcentagem destas células Th1 quando na presença de PMA e Ionomicina.
Com relação à porcentagem de células de perfil Th2 na presença do estímulo Ionomicina e PMA, observamos maior porcentagem para o grupo Ganoderma em relação ao Placebo. Em relação à análise de média de fluorescência, observamos que Ganoderma em comparação ao grupo Placebo, apresenta menor média de fluorescência desde o período pré referente à marcação de IL-4. Neste caso, Ganoderma tambémparece promover alguma supressão na capacidade de atividade das células de perfil Th2 na presença dos mitógenos, deixando as células menos ativas. De acordo com outros estudos, Ganoderma parece exercer pouca ou nenhuma influência sobre a IL-4 (Jeurink et al., 2008; Habijanic et al., 2015; Xie et al., 2017).
Sobre a análise do perfil celular Th17 (IL-17A), na presença de Ionomicina e PMA, o grupo Ganoderma apresentamenor porcentagem de linfócitos de perfil Th17 (IL17-A) em comparação ao grupo Placebo pós-suplementado, na presença da Ionomicina e PMA.Com relação à expressão da média de fluorescência de IL-17A em células Th17+ , não observamos diferenças significativas entre Ganoderma e Placebo em relação aos grupos pré e pós-suplementados. Observamos redução de IL-17A para o grupo Ganoderma pós-suplementado comparado ao grupo Placebo. Nós também avaliamos a citocina no sobrenadante da cultura de linfócitos na presença de concanavalina e encontramos redução para a citocina IL-17A e nenhuma influência do Ganoderma sobre a IL-6. Isso reforça a hipótese de que linfócitos T reg exercem supressão sobre a diferenciação desse perfil celular mesmo na presença do desafio ConA. É possível que o aumento da expressão gênica de IL-10 encontrado em nosso estudo possa indicar controle sobre o perfil de diferenciação celular Th17+. Desta forma, estes resultados indicam que a supressão de IL-17 pode ser regulada via expressão de IL-10. Xie et al. (2017) fizeram as mesmas observações na diferenciação de linfócitos de perfil Th-17 em modelo animal.
n. Adesão terapêutica
Com relação às análises de adesão ao tratamento, os dois grupos mostraram fragilidades na suplementação proposta. As análises foram aplicadas seguindo o estudo clínico de Hayward et al. (2017) .
Com relação à investigação na adesão terapêutica no estudo I, utilizamos para esta análise, o método indireto Morisky-Green e Brief que consiste na aplicação de poucas perguntas para verificar falhas na terapia. Na análise de Morisky, observamos que 54,54% dos pacientes do grupo Ganoderma se enquadram como aderente 1, ou seja, não apresentaram nenhuma falha na posologia durante a última semana de suplementação no estudo; 45,46% apresentaram alguma falha na adesão terapêutica. Já para o grupo placebo a adesão terapêutica foi 63,63%, ou seja, não apresentaram nenhuma falha na posologia na última semana. Não encontramos até o presente, outros estudos que tivessem aplicado esse mesmo questionário (MoriskyGreen) para que pudéssemos comparar nossos resultados.
A classificação de fragilidade na adesão foi realizada identificando nas demais facetas, falhas em algumas das perguntas. Quando a falha foi identificada em uma pergunta, o paciente foi classificado em moderada adesão 1, falhas em duas perguntas (moderada adesão 2), falhas em três perguntas (baixa adesão 3) e falhas em quatro perguntas (baixa adesão 4). Podemos observar nestes resultados, que ouve falha na adesão para ambos os grupos pós suplementados.
Na avaliação realizada pelo teste indireto de adesão terapêutica através do questionário Brief Medication Questionnare (BMQ), sendo considerado um teste padrão-ouro, foi observado que 27,27% dos pacientes do grupo Ganoderma enquadram-se como aderente 1, ou seja, não apresentaram nenhuma falha quanto às modalidades de regime, recordação e crença durante a última semana de suplementação no estudo; 72,73% apresentaram alguma falha na adesão terapêutica. Já para o grupo placebo, a adesão terapêutica foi 63,63%, ou seja, não apresentaram nenhuma falha na posologia na última semana.
A classificação de fragilidade na adesão foi realizada identificando nos demais regimes, falhas em algumas das perguntas. Quando não houve falha, classificamos como aderente, e quando a falha foi identificada em uma pergunta, o paciente foi classificado em provável adesão, falhas em duas perguntas (provável baixa adesão 2) e falhas em três perguntas (baixa adesão 3). Estas análises foram aplicadas seguindo o estudo de Ben et al. (2012). Para o grupo Ganoderma (A), houve adesão de 27,27% representada pela faceta de adesão. Já nas demais facetas somam um total de 72,73% e são representadas por provável adesão 1, provável baixa adesão 2 e baixa adesão 3. Nas análises realizadas, os grupos Ganoderma e placebo (A e B) apresentaram, respectivamente, 9,10% e 0,00% de baixa adesão. Estes últimos dados indicam que houve maior fragilidade no grupo Ganoderma em relação ao grupo placebo.
Na avaliação das voluntárias no estudo II, aplicamos também o teste indireto de adesão terapêutica Morisky e Brief. No primeiro teste, identificamos adesão de 25% para o grupo Ganoderma e 27,03 % do grupo placebo e no questionário Brief, identificamos adesão de 45% no grupo Ganoderma e 38,46% de adesão no grupo placebo.
Falhas de 75% apontadas no primeiro questionário (Morisky) e de 55% apontadas no segundo questionário (Brief), podem justificar as diferenças encontradas em nosso estudo comparado a outros estudos nos mesmos parâmetros. Não identificamos nos estudos acima, avaliação de dados detalhados de adesão terapêutica que pudessem subsidiar e comparar nossos testes de adesão terapêutica. Um único estudo em modelo humano (crianças 3-5 anos) é mencionado na literatura por Henao et al. (2018). No entanto, o grupo de pesquisadores não deixa explícito a maneira pelo qual a investigação sobre a adesão terapêutica foi realizada, a fragilidade de adesão relatada neste estudo foi de apenas 10% enquanto em nosso estudo, identificamos 75% de fragilidades na adesão terapêutica.
o. Qualidade de Vida
Para o questionário de qualidade de vida WHOQOL (Estudo I), não observamos diferenças significativas para nenhuma das facetas analisadas (físico, psicológico, social e meio ambiente). A suplementação com Ganoderma não exerceu nenhuma influência entre os parâmetros avaliados. O questionário WHOQOL, em versão para a língua portuguesa foi preenchido no início e fim do projeto e foi analisado conforme procedimento adotado por Pedroso et al. (2009). Nesse sentido, nossos dados para esta análise foram os mesmos encontrados por Wang, Wang, et al. (2018); eles investigaram a eficácia do extrato de Ganoderma na dose de 1000 mg/ dia (fracionado em 4 doses de 250 mg), durante seis semanas para o tratamento de Alzheimer. Os pesquisadores neste estudo, aplicaram o mesmo questionário para a avaliação das mesmas facetas e também não encontraram diferenças significativas.
Outro estudo para avaliar o potencial de 1000 mg/dia de Ganoderma (fracionado em 3 doses dia) durante oito semanas em pacientes com epilepsia foi realizado por Wang, Li, et al. (2018); eles também não encontraram diferenças significativas para a avaliação das facetas mencionadas no mesmo questionário aplicado.
Para o questionário de qualidade de vida WHOQOL (Estudo II) encontramos diferenças significativas para a faceta psicológica com redução da somatória geral para o grupo Placebo pré-suplementado comparado ao grupo pós-suplementado e redução dessa mesma faceta no grupo pós-suplementado Placebo em comparação ao grupo Ganoderma pós.
p. Polissacarídeos
Com relação a presença de polissacarídeos referente ao lote utilizado em nosso Estudo I, a empresa Florien atestou o total de polissacarídeos na amostra de 10,05%; no entanto, nossas análises para a determinação de β-glucanos totais realizadas no Departamento de Alimentos e Nutrição Experimental da Universidade de São Paulo (USP) revelaram a presença de 58,40% de β-glucanos totais. Já para a presença polissacarídeos referente ao lote utilizado em nosso Estudo II, a empresa Vitajoy atestou a presença de 47,92% de polissacarídeos, teor bem próximo ao teor encontrado nas nossas análises (52,83% de β-glucanos totais). Nossas análises mostram divergência com relação ao laudo apresentado pela empresa Florien (lote de 2016).
9.0 CONCLUSÃO
Ganoderma lucidum nas doses utilizadas mostrou segurança e não induziu danos hepáticos nem renais. Na dose de 2000 mg/dia no Estudo II, após a avaliação do perfil de polissacarídeos totais, constatamos a presença de um teor de 52,83% de polissacarídeos totais (equivalente a dose diária ingerida de 791,14 mg).
Após a suplementação com Ganoderma na população de idosos polimedicamentosos, podemos concluir:
- Ganoderma regulou positivamente a expressão de genes envolvidos na ativação de perfil celular Th1 (T-bet, INFɣ e TNFα), Th2 (GATA-3) e Th17 (RORɣ,IL-6, IL-17A e TGFβ). No entanto, promoveu também a redução de cada uma das citocinas de perfil Th1 (IL-2 e INFɣ), Th2 (IL-4 e IL-10) e Th17 (IL-17A) na presença de ConA. Isso provavelmente ocorreu através do aumento da expressão de genes de linfócitos T reguladores, como Foxp3, IL-10 e TGFβ;
- O cálculo da razão IL-10/TNFα nas análises de expressão gênica evidenciam que a suplementação com Ganoderma estimula a expressão gênica mas promove também o controle imunológico através da expressão da citocina IL-10, provavelmente expressa por linfócitos T reguladores;
- Ganoderma não ativou a proliferação de linfócitos através da via de expressão de CD28+ na presença de concanavalina A, provavelmente por exercer a modulação em outra molécula coestimulatória;
- Ganoderma mostrou induzir sutilmente o aumento da porcentagem de células de perfil celular Th2 (IL-4+) na presença de PMA + ionomicina, mas reduziu a média de fluorescência referente à marcação de IL-4;
- Ganoderma, na presença de PMA e ionomicina não alterou a porcentagem de células de perfil Th1, mas reduziu a média de fluorescência, deixando estas células menos ativas;
- Ganoderma, na presença de PMA e Ionomicina, reduziu a porcentagem de células de perfil Th17 (IL-17A), mas não alterou a média de fluorescência referente à IL-4;
- O Ganoderma utilizado no segundo estudo indica perfil imunomodulador em Th1, Th2 e Th17, mas mostra predomínio em perfil Th2 (anti-inflamatório) resultado evidenciado com o aumento da porcentagem celular de células IL4+ na presença de Ionomicina e PMA.
A Figura seguinte (89) resume os resultados das análises realizadas.
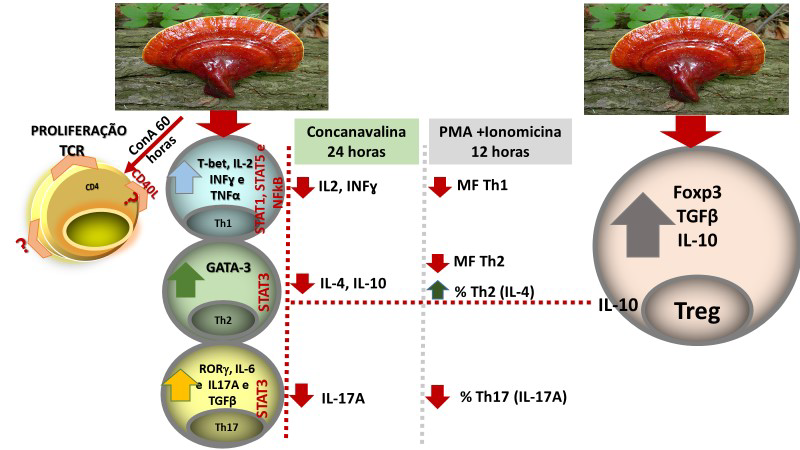
Figura 89- RESUMO DAS VIAS DE MODULAÇÃO DE GANODERMA LUCIDUM.
Ganoderma lucidum pode regular STAT1, 3, 5 e NFkB, levando ao aumento da expressão de linfócitos Treg (IL-10, FoxP3 e TGFβ). Ganoderma promoveu redução da secreção de citocinas de perfil Th1,Th2 e Th17 na presença de ConA (cultura de 24 horas). Na presença de ionomicina e PMA (cultura de 12 horas), promoveu redução da porcentagem de Th17+ e aumento de Th2+ com redução de média de fluorescência para INFɣ e IL-4. Ganoderma promoveu o estímulo da capacidade proliferativa na presença de ConA (cultura de 60 horas).
REFERÊNCIAS BIBLIOGRÁFICAS
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. Imunologia celular e molecular. 8ª edição. 2015.
AGUIAR, P. M. Impacto de um Programa de Atenção Farmacêutica nos Resultados Clínicos de um Grupo de Pacientes Idosos com Hipertensão não
Controlada. 2010. 141f Mestrado em Ciências Farmacêuticas, Universidade Federal de Sergipe
BACHELEZ, H. Immunopathogenesis of psoriasis: recent insights on the role of adaptive and innate immunity. J Autoimmun, v. 25 Suppl, p. 69-73, 2005. ISSN
0896-8411 (Print)0896-8411 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16263244 >.
BEN, A. J.; NEUMANN, C. R.; MENGUE, S. S. The Brief Medication Questionnaire and Morisky-Green test to evaluate medication adherence. Rev Saude Publica, v.
46, n. 2, p. 279-89, Apr 2012. ISSN 1518-8787 (Electronic)0034-8910 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/22331180 >.
BORCHERS, A. T. et al. Probiotics and immunity. J Gastroenterol, v. 44, n. 1, p. 26-46, 2009. ISSN 0944-1174 (Print)0944-1174 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19159071 >.
CAI, Z. et al. Anti-inflammatory activities of Ganoderma lucidum (Lingzhi) and SanMiao-San supplements in MRL/lpr mice for the treatment of systemic lupus erythematosus. Chin Med, v. 11, p. 23, 2016. ISSN 1749-8546 (Print)1749-8546 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/27134645 >.
CAPRI, M. et al. The genetics of human longevity. Ann N Y Acad Sci, v. 1067, p. 252-63, May 2006. ISSN 0077-8923 (Print)0077-8923 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16803995 >.
CARDIOLOGIA, S. B. D. Arquivos Brasileiros de Cardiologia. 7ª DIRETRIZBRASILEIRA DE HIPERTENSÃO ARTERIAL,http://publicacoes.cardiol.br/2014/diretrizes/2016/05_HIPERTENSAO_ARTERIAL.pdf , 2016. ISSN ISSN-0066-782X. Acesso em: 10/10/2016.
CARUSO, C. et al. Aging, longevity, inflammation, and cancer. Ann N Y Acad Sci, v. 1028, p. 1-13, Dec 2004. ISSN 0077-8923 (Print)0077-8923 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15915584 >.
CHAN, G. C.; CHAN, W. K.; SZE, D. M. The effects of beta-glucan on human immune and cancer cells. J Hematol Oncol, v. 2, p. 25, Jun 10 2009. ISSN 1756-8722 (Electronic)1756-8722 (Linking). Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/19515245 >.
CHAN, W. K. et al. Ganoderma lucidum mycelium and spore extracts as natural adjuvants for immunotherapy. J Altern Complement Med, v. 11, n. 6, p. 1047-57, Dec 2005. ISSN 1075-5535 (Print)1075-5535.
CHAN, W. K. et al. Response of human dendritic cells to different immunomodulatory polysaccharides derived from mushroom and barley. IntImmunol, v. 19, n. 7, p. 891-9, Jul 2007. ISSN 0953-8178 (Print)0953-8178 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/17606977 >.
CHANG, C. J. et al. Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota. Nat Commun, v. 6, p. 7489, Jun 23 2015. ISSN2041-1723 (Electronic)2041-1723 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/26102296 >.
CHANG, Y. H. et al. Gandoderma lucidum extract promotes immune responses in normal BALB/c mice In vivo. In Vivo, v. 23, n. 5, p. 755-9, Sep-Oct 2009. ISSN 0258-851X (Print)0258-851X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19779111 >.
CHEN, B. et al. Triterpenes and meroterpenes from Ganoderma lucidum with inhibitory activity against HMGs reductase, aldose reductase and alpha-glucosidase. Fitoterapia, v. 120, p. 6-16, Jul 2017. ISSN 0367-326x.
CHEN, H. S. et al. Studies on the immuno-modulating and anti-tumor activities of Ganoderma lucidum (Reishi) polysaccharides. Bioorg Med Chem, v. 12, n. 21, p. 5595-601, Nov 1 2004. ISSN 0968-0896 (Print)0968-0896 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15465337 >.
CHEN, L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity. Nat Rev Immunol, v. 4, n. 5, p. 336-47, May 2004. ISSN 1474-1733(Print)1474-1733 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15122199 >.
CHEN, L. et al. Prediction of anti-tumor chemical probes of a traditional Chinese medicine formula by HPLC fingerprinting combined with molecular docking. Eur J Med Chem, v. 83, p. 294-306, Aug 18 2014. ISSN 0223-5234.
CHEN, L.; FLIES, D. B. Molecular mechanisms of T cell co-stimulation and coinhibition. Nat Rev Immunol, v. 13, n. 4, p. 227-42, Apr 2013. ISSN 1474-1733.
CHEN, S. N. et al. Safety assessment of mushroom beta-glucan: subchronic toxicity in rodents and mutagenicity studies. Food Chem Toxicol, v. 49, n. 11, p. 2890-8, Nov 2011. ISSN 1873-6351 (Electronic)0278-6915 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/21856366 >.
CHIU, H. F. et al. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: a randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. Pharm Biol, v. 55, n. 1, p. 1041-1046, Dec 2017. ISSN 1744-5116 (Electronic)1388-0209 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/28183232 >.
CHIU, S. W. et al. Nutritional value of ganoderma extract and assessment of its genotoxicity and antigenotoxicity using comet assays of mouse lymphocytes. Food Chem Toxicol, v. 38, n. 2-3, p. 173-8, Feb-Mar 2000. ISSN 0278-6915 (Print)02786915 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/10717357 >.
CHUNG, W. T. et al. Effect of mycelial culture broth of Ganoderma lucidum on the growth characteristics of human cell lines. J Biosci Bioeng, v. 92, n. 6, p. 550-5,
2001. ISSN 1389-1723 (Print)1347-4421 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16233144 >.
CLEVER, J. L.; PARSLOW, T. G. Mutant human immunodeficiency virus type 1 genomes with defects in RNA dimerization or encapsidation. J Virol, v. 71, n. 5, p. 3407-14, May 1997. ISSN 0022-538X (Print)0022-538X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/9094610 >.
COR, D.; KNEZ, Z.; KNEZ HRNCIC, M. Antitumour, Antimicrobial, Antioxidant andAntiacetylcholinesterase Effect of Ganoderma Lucidum Terpenoids andPolysaccharides: A Review. Molecules, v. 23, n. 3, Mar 13 2018. ISSN 1420-3049.
DASKAYA-DIKMEN, C. et al. Angiotensin-I-Converting Enzyme (ACE)-Inhibitory Peptides from Plants. Nutrients, v. 9, n. 4, Mar 23 2017. ISSN 2072-6643.
DE GROVE, K. C. et al. Dysregulation of type 2 innate lymphoid cells and TH2 cells impairs pollutant-induced allergic airway responses. J Allergy Clin Immunol, v. 139, n. 1, p. 246-257 e4, Jan 2017. ISSN 1097-6825 (Electronic)0091-6749 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/27315767 >.
DO PRADO, S. B. et al. Physiological Degradation of Pectin in Papaya Cell Walls:Release of Long Chains Galacturonans Derived from Insoluble Fractions during Postharvest Fruit Ripening. Front Plant Sci, v. 7, p. 1120, 2016. ISSN 1664-462X (Print)1664-462x.
DUMITRU, C.; KABAT, A. M.; MALOY, K. J. Metabolic Adaptations of CD4(+) T Cells in Inflammatory Disease. Front Immunol, v. 9, p. 540, 2018. ISSN 1664-3224 (Print) 1664-3224 (Linking). Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/29599783 >.
ESTATÍSTICA, I. B. D. G. E. Projeção da população do Brasil e das Unidades da Federação. 2018. Disponível em: < https://www.ibge.gov.br/apps/populacao/projecao/ >.
FATMAWATI, S.; KONDO, R.; SHIMIZU, K. Structure-activity relationships of lanostane-type triterpenoids from Ganoderma lingzhi as alpha-glucosidase inhibitors. Bioorg Med Chem Lett, v. 23, n. 21, p. 5900-3, Nov 1 2013. ISSN 0960-894x.
FIELD, E. H.; KULHANKOVA, K.; NASR, M. E. Natural Tregs, CD4+CD25+ inhibitory hybridomas, and their cell contact dependent suppression. Immunol Res, v. 39, n. 13, p. 62-78, 2007. ISSN 0257-277X (Print)0257-277X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/17917056 >.
FIORANELLI, M.; ROCCIA, M. G. Twenty-five years of studies and trials for the therapeutic application of IL-10 immunomodulating properties. From high doses administration to low dose medicine new paradigm. J Integr Cardiol, v. 1, n. 1, p. 26, 2014.
FULOP, T. et al. From inflamm-aging to immune-paralysis: a slippery slope during aging for immune-adaptation. Biogerontology, v. 17, n. 1, p. 147-57, Feb 2016. ISSN 1573-6768 (Electronic)1389-5729 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/26472173 >.
GAO, Y. et al. A randomized, placebo-controlled, multicenter study of Ganoderma lucidum (W. Curt.: Fr.) Lloyd (Aphyllophoromycetideae) polysaccharides (Ganopoly®) in patients with advanced lung cancer. International Journal of Medicinal Mushrooms, v. 5, n. 4, 2003. ISSN 1521-9437.
GAO, Y. et al. A phase I/II study of Ling Zhi mushroom Ganoderma lucidum (W. Curt.: Fr.) Lloyd (Aphyllophoromycetideae) extract in patients with type II diabetes mellitus. International Journal of Medicinal Mushrooms, v. 6, n. 1, 2004. ISSN 1521-9437.
GAO, Y. et al. Effects of water-soluble Ganoderma lucidum polysaccharides on the immune functions of patients with advanced lung cancer. J Med Food, v. 8, n. 2, p.159-68, Summer 2005. ISSN 1096-620X (Print)1096-620X (Linking). Disponível em:< http://www.ncbi.nlm.nih.gov/pubmed/16117607 >.
GAO, Y. et al. A phase I/II study of a Ganoderma lucidum (Curt.: Fr.) P. Karst. Extract (Ganopofy) in patients with advanced cancer. International Journal of Medicinal Mushrooms, v. 4, n. 3, 2002. ISSN 1521-9437.
GAO, Y. et al. Effects of ganopoly (a Ganoderma lucidum polysaccharide extract) on the immune functions in advanced-stage cancer patients. Immunol Invest, v. 32, n.
3, p. 201-15, Aug 2003. ISSN 0882-0139 (Print)0882-0139 (Linking). Disponível em:< http://www.ncbi.nlm.nih.gov/pubmed/12916709 >.
HAAK-FRENDSCHO, M. et al. Ling Zhi-8: a novel T cell mitogen induces cytokine production and upregulation of ICAM-1 expression. Cell Immunol, v. 150, n. 1, p. 101-13, Aug 1993. ISSN 0008-8749 (Print)0008-8749 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/8102083 >.
HABIJANIC, J. et al. Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-alpha, IL-12, IFNgamma, IL-2, IL-4, IL-10 and IL-17. N Biotechnol, v. 32, n. 1, p. 85-95, Jan 25 2015. ISSN 1876-4347 (Electronic)1871-6784 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/25078944 >.
HAJJAJ, H. et al. Effect of 26-oxygenosterols from Ganoderma lucidum and their activity as cholesterol synthesis inhibitors. Appl Environ Microbiol, v. 71, n. 7, p.3653-8, Jul 2005. ISSN 0099-2240 (Print)0099-2240.
HAYWARD, K. L. et al. Medication beliefs predict medication adherence in ambulatory patients with decompensated cirrhosis. World J Gastroenterol, v. 23, n.
40, p. 7321-7331, Oct 28 2017. ISSN 2219-2840 (Electronic)1007-9327 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29142479 >.
HENAO, S. L. D. et al. Randomized Clinical Trial for the Evaluation of ImmuneModulation by Yogurt Enriched with beta-Glucans from Lingzhi or Reishi MedicinalMushroom, Ganoderma lucidum (Agaricomycetes), in Children from Medellin,Colombia. Int J Med Mushrooms, v. 20, n. 8, p. 705-716, 2018. ISSN 1940-4344(Electronic)1940-4344 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/30317947 >.
HONG, F. et al. Mechanism by which orally administered beta-1,3-glucans enhance the tumoricidal activity of antitumor monoclonal antibodies in murine tumor models. J Immunol, v. 173, n. 2, p. 797-806, Jul 15 2004. ISSN 0022-1767 (Print)0022-1767 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15240666 >.
HSU, H. C. et al. Fip-vvo, a new fungal immunomodulatory protein isolated fromVolvarilla volvacea. Biochem J, v. 323 ( Pt 2), p. 557-65, Apr 15 1997. ISSN 0264-6021 (Print)0264-6021 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/9163352 >.
HSU, H. Y. et al. Extract of Reishi polysaccharides induces cytokine expression via TLR4-modulated protein kinase signaling pathways. J Immunol, v. 173, n. 10, p. 5989-99, Nov 15 2004. ISSN 0022-1767 (Print)0022-1767 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15528333 >.
HSU, H. Y. et al. Reishi Protein LZ-8 Induces FOXP3(+) Treg Expansion via a CD45-Dependent Signaling Pathway and Alleviates Acute Intestinal Inflammation in Mice. Evid Based Complement Alternat Med, v. 2013, p. 513542, 2013. ISSN1741-427X (Print)1741-427X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/23864893 >.
HUGHES, V. A. et al. Longitudinal changes in body composition in older men and women: role of body weight change and physical activity. Am J Clin Nutr, v. 76, n. 2, p. 473-81, Aug 2002. ISSN 0002-9165 (Print)0002-9165 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/12145025 >.
JEURINK, P. V. et al. Immunomodulatory capacity of fungal proteins on the cytokine production of human peripheral blood mononuclear cells. Int Immunopharmacol, v.8, n. 8, p. 1124-33, Aug 2008. ISSN 1567-5769 (Print)1567-5769 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/18550017 >.
JIANG, Y. et al. Overview of Ganoderma sinense polysaccharide-an adjunctive drug used during concurrent Chemo/Radiation therapy for cancer treatment in China. Biomed Pharmacother, v. 96, p. 865-870, Dec 2017. ISSN 0753-3322.
JOHNSON, B. M. et al. Ganoderic Acid DM: An Alternative Agent for the Treatment of Advanced Prostate Cancer. Open Prost Cancer J, v. 3, p. 78-85, Jan 1 2010. ISSN 1876-8229 (Print).
KIM, K. C.; KIM, I. G. Ganoderma lucidum extract protects DNA from strand breakage caused by hydroxyl radical and UV irradiation. Int J Mol Med, v. 4, n. 3, p. 273-7, Sep 1999. ISSN 1107-3756 (Print)1107-3756 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/10425278 >.
KLUPP, N. L. et al. Ganoderma lucidum mushroom for the treatment of
cardiovascular risk factors. Cochrane Database Syst Rev, n. 2, p. CD007259, Feb 17 2015. ISSN 1469-493X (Electronic)1361-6137 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/25686270 >.
KLUPP, N. L. et al. A double-blind, randomised, placebo-controlled trial of Ganoderma lucidum for the treatment of cardiovascular risk factors of metabolic syndrome. Sci Rep, v. 6, p. 29540, Aug 11 2016. ISSN 2045-2322 (Electronic)20452322 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/27511742 >.
KRITCHEVSKY, S. B.; CESARI, M.; PAHOR, M. Inflammatory markers and cardiovascular health in older adults. Cardiovasc Res, v. 66, n. 2, p. 265-75, May 12005. ISSN 0008-6363 (Print)0008-6363 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15820195 >.
KUBOTA, T. et al. Structures of Ganoderic Acid A and B, Two New Lanostane Type Bitter Triterpenes from Ganoderma lucidum (FR.) KARST. Helvetica Chimica Acta, v. 65, n. 2, p. 611-619, 1982. ISSN 0018-019X.
LARBI, A. et al. Impact of age on T cell signaling: a general defect or specific alterations? Ageing Res Rev, v. 10, n. 3, p. 370-8, Jul 2011. ISSN 1872-9649(Electronic)1568-1637 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/20933612 >.
LEE, I. et al. Selective cholinesterase inhibition by lanostane triterpenes from fruiting bodies of Ganoderma lucidum. Bioorg Med Chem Lett, v. 21, n. 21, p. 6603-7, Nov 1 2011. ISSN 0960-894x.
LEE, S. H.; PARK, S. W. Inflammation and cancer development in pancreatic and biliary tract cancer. The Korean Journal of Gastroenterology, v. 66, n. 6, p. 325339, 2015. ISSN 1598-9992.
LEE, Y. K. et al. Developmental plasticity of Th17 and Treg cells. Curr OpinImmunol, v. 21, n. 3, p. 274-80, Jun 2009. ISSN 1879-0372 (Electronic)0952-7915 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19524429 >.
LEI, L. S.; LIN, Z. B. Effect of Ganoderma polysaccharides on T cell subpopulations and production of interleukin 2 in mixed lymphocyte response. Yao Xue Xue Bao, v.27, n. 5, p. 331-5, 1992. ISSN 0513-4870 (Print)0513-4870 (Linking). Disponível em:< http://www.ncbi.nlm.nih.gov/pubmed/1442052 >.
LI, C. H. et al. Ganoderic acid X, a lanostanoid triterpene, inhibits topoisomerases and induces apoptosis of cancer cells. Life Sci, v. 77, n. 3, p. 252-65, Jun 3 2005.ISSN 0024-3205 (Print)0024-3205.
LI, E. K. et al. Safety and efficacy of Ganoderma lucidum (lingzhi) and San Miao San supplementation in patients with rheumatoid arthritis: a double-blind, randomized, placebo-controlled pilot trial. Arthritis Rheum, v. 57, n. 7, p. 1143-50, Oct 15 2007. ISSN 0004-3591 (Print)0004-3591 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/17907228 >.
LIANG, C. et al. Review of the molecular mechanisms of Ganoderma lucidum triterpenoids: Ganoderic acids A, C2, D, F, DM, X and Y. Eur J Med Chem, v. 174, p. 130-141, Jul 15 2019. ISSN 1768-3254 (Electronic)0223-5234 (Linking). Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/31035236 >.
LIM, M. A. et al. Increased Th17 differentiation in aged mice is significantly associated with high IL-1beta level and low IL-2 expression. Exp Gerontol, v. 49, p. 55-62, Jan 2014. ISSN 1873-6815 (Electronic)0531-5565 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/24140620 >.
LIU, J. et al. Ganoderic acids from Ganoderma lucidum: inhibitory activity of osteoclastic differentiation and structural criteria. Planta Med, v. 76, n. 2, p. 137-9, Feb 2010. ISSN 0032-0943.
LIVAK, K. J.; SCHMITTGEN, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods, v. 25, n. 4, p. 402-8, Dec 2001. ISSN 1046-2023 (Print)1046-2023 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/11846609 >.
LOHMAN, J. A.; RATCLIFFE, R. G. Prospects for NMR imaging in the study of biological morphogenesis. Experientia, v. 44, n. 8, p. 666-72, Aug 15 1988. ISSN
0014-4754 (Print)0014-4754 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/3409998 >.
MA, C. et al. Differential protein expression in mouse splenic mononuclear cells treated with polysaccharides from spores of Ganoderma lucidum. Phytomedicine, v.15, n. 4, p. 268-76, Apr 2008. ISSN 1618-095X (Electronic)0944-7113 (Linking).Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/18222673 >.
MARTIN, P.; LEIBOVICH, S. J. Inflammatory cells during wound repair: the good, the bad and the ugly. Trends Cell Biol, v. 15, n. 11, p. 599-607, Nov 2005. ISSN 0962-8924 (Print)0962-8924 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16202600 >.
MATSUDO;, S. et al. QUESTIONARIO INTERNACIONAL DE ATIVIDADE FISICA (I PAQ): ESTUDO DE VAllDADE E REPRODUTIBILIDADE NO BRASIL. Atividade física & saúde, p. 1-14p, 2001. Disponível em: < https://celafiscs.org.br/article/questionario-internacional-de-atividade-fisica-ipaqestudo-de-validade-e-reprodutibilidade-no-brasil/ >.
MCNEELA, E. A.; MILLS, K. H. Manipulating the immune system: humoral versus cell-mediated immunity. Adv Drug Deliv Rev, v. 51, n. 1-3, p. 43-54, Sep 23 2001. ISSN 0169-409X (Print)0169-409X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/11516778 >.
MENESES, M. E. et al. Hypocholesterolemic Properties and Prebiotic Effects ofMexican Ganoderma lucidum in C57BL/6 Mice. PLoS One, v. 11, n. 7, p. e0159631, 2016. ISSN 1932-6203 (Electronic)1932-6203 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/27438015 >.
MIYAMOTO, I. et al. Regulation of osteoclastogenesis by ganoderic acid DM isolated from Ganoderma lucidum. Eur J Pharmacol, v. 602, n. 1, p. 1-7, Jan 5 2009. ISSN 0014-2999.
MIYAZAKI, T.; NISHIJIMA, M. Studies on fungal polysaccharides. XXVII. Structural examination of a water-soluble, antitumor polysaccharide of Ganoderma lucidum.Chem Pharm Bull (Tokyo), v. 29, n. 12, p. 3611-6, Dec 1981. ISSN 0009-2363(Print)0009-2363 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/7340947 >.
MOSSER, D. M.; ZHANG, X. Interleukin-10: new perspectives on an old cytokine. Immunol Rev, v. 226, p. 205-18, Dec 2008. ISSN 1600-065X (Electronic)0105-2896 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19161426 >.
NAGLER-ANDERSON, C. et al. Control freaks: immune regulatory cells. Nat Immunol, v. 5, n. 2, p. 119-22, Feb 2004. ISSN 1529-2908 (Print)1529-2908 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/14749778 >.
O.N.U. Organização das Nações Unidas 2018. Disponível em: < https://nacoesunidas.org/brasil–adota–recomendacoes–da–oms–e–lanca–estrategiapara–melhorar–vida–de–idosos/ >.
PAN, K. et al. Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities. Int J Biol Macromol, v. 55, p. 301-6, Apr 2013. ISSN 1879-0003 (Electronic)0141-8130 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/23370161 >.
PAPALÉO NETTO, M.; CARVALHO FILHO, E. T.; SALLES, R. F. N. Fisiologia do envelhecimento. 2005.
PATERSON, R. R. Ganoderma – a therapeutic fungal biofactory. Phytochemistry, v.67, n. 18, p. 1985-2001, Sep 2006. ISSN 0031-9422 (Print)0031-9422 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16905165 >.
PEDROSO, B.; PILATTI, L. A.; REIS, D. R. Cálculo dos escores e estatística descritiva do WHOQOL-100 utilizando o Microsoft Excel. Revista Brasileira de Qualidade de Vida: Ponta Grossa. 1, n. 1: 23-32 p. 2009.
PFAFFL, M. W. A new mathematical model for relative quantification in real-time RTPCR. Nucleic Acids Res, v. 29, n. 9, p. e45, May 1 2001. ISSN 1362-4962(Electronic)0305-1048 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/11328886 >.
PILLON, N. J. et al. Cross-talk between skeletal muscle and immune cells: musclederived mediators and metabolic implications. Am J Physiol Endocrinol Metab, v.304, n. 5, p. E453-65, Mar 1 2013. ISSN 1522-1555 (Electronic)0193-1849 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/23277185 >.
REN, Z. et al. Crystal structure of unphosphorylated STAT3 core fragment. Biochem Biophys Res Commun, v. 374, n. 1, p. 1-5, Sep 12 2008. ISSN 0006-291x.
ROSENBERG, S. A. Principles and applications of biologic therapy. 4. ed. 1993.
RUBEL, R. Produção de compostos bioativos do Ganoderma lucidum: avaliação da ação antitumoral, imunomoduladora e hipolipidêmica. 2006. 172 Doutorado em Processos Biotecnológicos, Universidade Federal do Paraná
RUBEL, R. et al. Medicinal mushroom Ganoderma lucidum (Leyss: Fr) Karst. triggers immunomodulatory effects and reduces nitric oxide synthesis in mice. J Med Food, v. 13, n. 1, p. 142-8, Feb 2010. ISSN 1557-7600 (Electronic)1096-620X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/20136448 >.
SALTARELLI, R. et al. Phytochemical composition, antioxidant and antiproliferative activities and effects on nuclear DNA of ethanolic extract from an Italian mycelial isolate of Ganoderma lucidum. J Ethnopharmacol, v. 231, p. 464-473, Mar 1 2019. ISSN 1872-7573 (Electronic)0378-8741 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/30513345 >.
SANODIYA, B. S. et al. Ganoderma lucidum: a potent pharmacologicalmacrofungus. Curr Pharm Biotechnol, v. 10, n. 8, p. 717-42, Dec 2009. ISSN 1873-4316 (Electronic)1389-2010 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19939212 >.
SAÚDE, B. M. D.; SAÚDE, S. D. A. A.; BÁSICA, D. D. A. CADERNOS DE ATENÇÃO BÁSICA. 2006. Disponível em: < https://www.nescon.medicina.ufmg.br/biblioteca/registro/Envelhecimento_e_saude_d a_pessoa_idosa/614 >.
SAÚDE, M. D. RESOLUÇÃO DE DIRETORIA COLEGIADA 152. 152, DIÁRIO OFICIAL DA UNIÃO, p. página 67, 25 DE abril de 2017 2017. Disponível em: < http://pesquisa.in.gov.br/imprensa/jsp/visualiza/index.jsp?jornal=1&data=27/04/2017 &pagina=67 >. Acesso em: 22 DE nOVEMBRO DE 2019.______. RESOLUÇÃO DE DIRETORIA COLEGIADA 280.v. 74, n. 1, p. 202, 31.01.2020 2019.
SAÚDE, O. O. P. D. Folha informativa – Envelhecimento e saúde. 2018. Disponível em: < https://www.paho.org/bra/index.php?option=com_content&view=article&id=5661:folh a-informativa-envelhecimento-e-saude&Itemid=820 >. Acesso em: 26/04.
SETO, S. W. et al. Novel hypoglycemic effects of Ganoderma lucidum water-extract in obese/diabetic (+db/+db) mice. Phytomedicine, v. 16, n. 5, p. 426-36, May 2009. ISSN 1618-095X (Electronic)0944-7113 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/19109000 >.
SHAO, B. M. et al. Immune receptors for polysaccharides from Ganoderma lucidum.Biochem Biophys Res Commun, v. 323, n. 1, p. 133-41, Oct 8 2004. ISSN 0006-291X (Print)0006-291X (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15351712 >.
SHI, R. et al. Pharmacokinetic, Pharmacodynamic, and Safety Profile of a Novel Anti-CD28 Domain Antibody Antagonist in Healthy Subjects. J Clin Pharmacol, v. 57, n. 2, p. 161-172, Feb 2017. ISSN 0091-2700.
SHIAO, M. S. Natural products of the medicinal fungus Ganoderma lucidum:occurrence, biological activities, and pharmacological functions. Chem Rec, v. 3, n. 3, p. 172-80, 2003. ISSN 1527-8999 (Print)1528-0691 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/12900937 >.
SHOUVAL, D. S. et al. Interleukin 10 receptor signaling: master regulator of intestinal mucosal homeostasis in mice and humans. In: (Ed.). Advances in immunology: Elsevier, v.122, 2014. p.177-210. ISBN 0065-2776.
SLIVA, D. Cellular and physiological effects of Ganoderma lucidum (Reishi). Mini Rev Med Chem, v. 4, n. 8, p. 873-9, Oct 2004. ISSN 1389-5575 (Print)1389-5575 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15544548 >.
SOENDERGAARD, C.; YOUNG, J. A.; KOPCHICK, J. J. Growth HormoneResistance-Special Focus on Inflammatory Bowel Disease. Int J Mol Sci, v. 18, n. 5, May 9 2017. ISSN 1422-0067 (Electronic)1422-0067 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/28486400 >.
SRIVASTAVA, K. et al. Immunomodulatory effect of the antiasthma Chinese herbal formula MSSM-002 on TH2 cells. J Allergy Clin Immunol, v. 113, n. 2, p. 268-76, Feb 2004. ISSN 0091-6749 (Print)0091-6749 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/14767441 >.
SUDHEESH, N. P. et al. Ganoderma lucidum protects liver mitochondrial oxidative stress and improves the activity of electron transport chain in carbon tetrachloride intoxicated rats. Hepatol Res, v. 42, n. 2, p. 181-91, Feb 2012. ISSN 1872-034X
(Electronic)1386-6346 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/22050471 >.
TOMODA, M. et al. Glycan structures of ganoderans B and C, hypoglycemic glycans of Ganoderma lucidum fruit bodies. Phytochemistry, v. 25, n. 12, p. 2817-2820, 1986. ISSN 0031-9422.
TUOMELA, S. et al. Identification of early gene expression changes during humanTh17 cell differentiation. Blood, v. 119, n. 23, p. e151-60, Jun 7 2012. ISSN 1528-0020 (Electronic)0006-4971 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/22544700 >.
URBEN, A. F. et al. Produção de cogumelos por meio de tecnologia chinesa modificada. 2 Ed. 2004.
VALLEJO, A. N. CD28 extinction in human T cells: altered functions and the program of T-cell senescence. Immunol Rev, v. 205, p. 158-69, Jun 2005. ISSN 0105-2896(Print)0105-2896 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15882352 >.
VAN PARIJS, L.; ABBAS, A. K. Homeostasis and self-tolerance in the immune system: turning lymphocytes off. Science, v. 280, n. 5361, p. 243-8, Apr 10 1998. ISSN 0036-8075 (Print)0036-8075 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/9535647 >.
VANHOVE, B. et al. Antagonist Anti-CD28 Therapeutics for the Treatment of Autoimmune Disorders. Antibodies (Basel), v. 6, n. 4, Nov 21 2017. ISSN 20734468.
W.H.O. Integrated care for older people Guidelines on community-level interventions to manage declines in intrinsic Capacity. 2017. Disponível em: < https://www.who.int/ageing/publications/guidelines–icope/en/ >.
WACHTEL-GALOR, S. et al. Ganoderma lucidum (Lingzhi or Reishi): A Medicinal Mushroom. In: ND;BENZIE, I. F. F., et al (Ed.). Herbal Medicine: Biomolecular and Clinical Aspects. Boca Raton (FL), 2011. ISBN 9781439807132.
WAN, X. et al. Mechanisms underlying antigen-specific tolerance of stable and convertible Th17 cells during suppression of autoimmune diabetes. Diabetes, v. 61, n. 8, p. 2054-65, Aug 2012. ISSN 1939-327X (Electronic)0012-1797 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/22751698 >.
WANG, G. et al. Enhancement of IL-2 and IFN-gamma expression and NK cells activity involved in the anti-tumor effect of ganoderic acid Me in vivo. Int Immunopharmacol, v. 7, n. 6, p. 864-70, Jun 2007. ISSN 1567-5769 (Print)15675769 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/17466920 >.
WANG, G. H. et al. A retrospective study of Ganoderma Lucidum Spore Powder for patients with epilepsy. Medicine (Baltimore), v. 97, n. 23, p. e10941, Jun 2018. ISSN 1536-5964 (Electronic)0025-7974 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29879039 >.
WANG, G. H. et al. Spore powder of Ganoderma lucidum for the treatment ofAlzheimer disease: A pilot study. Medicine (Baltimore), v. 97, n. 19, p. e0636, May 2018. ISSN 1536-5964 (Electronic)0025-7974 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29742702 >.
WANG, H. X.; NG, T. B. A laccase from the medicinal mushroom Ganoderma lucidum. Appl Microbiol Biotechnol, v. 72, n. 3, p. 508-13, Sep 2006. ISSN 0175-7598 (Print)0175-7598 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/16636832 >.
WANG, K. et al. Lanostane Triterpenes from the Tibetan Medicinal Mushroom Ganoderma leucocontextum and Their Inhibitory Effects on HMG-CoA Reductase and alpha-Glucosidase. J Nat Prod, v. 78, n. 8, p. 1977-89, Aug 28 2015. ISSN 0163-3864.
WANG, X. et al. Ganoderic acid A inhibits proliferation and invasion, and promotes apoptosis in human hepatocellular carcinoma cells. Mol Med Rep, v. 16, n. 4, p.3894-3900, Oct 2017. ISSN 1791-2997.
WANG, Y. Y. et al. Studies on the immuno-modulating and antitumor activities of Ganoderma lucidum (Reishi) polysaccharides: functional and proteomic analyses of a fucose-containing glycoprotein fraction responsible for the activities. Bioorg Med Chem, v. 10, n. 4, p. 1057-62, Apr 2002. ISSN 0968-0896 (Print)0968-0896 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/11836115 >.
WASSER, S. P. Reishi. Encyclopedia of Dietary Supplements. DEKKER, M. 1 ed.:603-622p p. 2005.______. Reishi. Encyclopedia of Dietary Supplements.
HEALTHCARE, I. 2 Ed: 680-690p p. 2010.
WEI, J. C. et al. Chemical characteristics of the fungus Ganoderma lucidum and their inhibitory effects on acetylcholinesterase. J Asian Nat Prod Res, v. 20, n. 10, p.992-1001, Oct 2018. ISSN 1028-6020.
WU, G. S. et al. Anti-cancer properties of triterpenoids isolated from Ganoderma lucidum – a review. Expert Opin Investig Drugs, v. 22, n. 8, p. 981-92, Aug 2013. ISSN 1354-3784.
WU, G. S. et al. Ganoderic acid DM, a natural triterpenoid, induces DNA damage, G1 cell cycle arrest and apoptosis in human breast cancer cells. Fitoterapia, v. 83, n. 2, p. 408-14, Mar 2012. ISSN 0367-326x.
XIE, L. et al. The effects of freeze-dried Ganoderma lucidum mycelia on a recurrent oral ulceration rat model. BMC Complement Altern Med, v. 17, n. 1, p. 511, Dec 1 2017. ISSN 1472-6882 (Electronic)1472-6882 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29191190 >.
YANG, F.; KE, Y.; KUO, S. Effect of fatty acids on the mycelial growth and polysaccharide formation by Ganoderma lucidum in shake flask cultures. EnzymeMicrob Technol, v. 27, n. 3-5, p. 295-301, Aug 1 2000. ISSN 1879-0909
(Electronic)0141-0229 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/10899556 >.
YANG, X. O. et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity, v. 28, n. 1, p. 29-39, Jan2008. ISSN 1074-7613 (Print)1074-7613 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/18164222 >.
YANG, Z. et al. Hypoglycemic mechanism of a novel proteoglycan, extracted fromGanoderma lucidum, in hepatocytes. Eur J Pharmacol, v. 820, p. 77-85, Feb 5 2018. ISSN 1879-0712 (Electronic)0014-2999 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29233661 >.
YANG, Z. et al. Integrated Pharmacokinetic/Pharmacodynamic Analysis forDetermining the Minimal Anticipated Biological Effect Level of a Novel Anti-CD28 Receptor Antagonist BMS-931699. J Pharmacol Exp Ther, v. 355, n. 3, p. 506-15, Dec 2015. ISSN 0022-3565.
YANG, Z. et al. A novel PTP1B inhibitor extracted from Ganoderma lucidum ameliorates insulin resistance by regulating IRS1-GLUT4 cascades in the insulin signaling pathway. Food Funct, v. 9, n. 1, p. 397-406, Jan 24 2018. ISSN 2042-650X (Electronic)2042-6496 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/29215104 >.
YOSHIMURA, A. et al. Negative regulation of cytokine signaling and immune responses by SOCS proteins. Arthritis Res Ther, v. 7, n. 3, p. 100-10, 2005. ISSN
1478-6362 (Electronic)1478-6354 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/15899058 >.
YUE, Q. X. et al. Effects of triterpenes from Ganoderma lucidum on protein expression profile of HeLa cells. Phytomedicine, v. 17, n. 8-9, p. 606-13, Jul 2010. ISSN 1618-095X (Electronic)0944-7113 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/20092987 >.
ZHANG, F. F.; LIU, R. M. [Pharmacokinetics of ganoderic acids]. Zhongguo Zhong Yao Za Zhi, v. 44, n. 5, p. 905-911, Mar 2019. ISSN 1001-5302 (Print)1001-5302 (Linking). Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/30989848 >.
ZHANG, J. et al. Toxicology and immunology of Ganoderma lucidum polysaccharides in Kunming mice and Wistar rats. Int J Biol Macromol, v. 85, p.302-10, Apr 2016. ISSN 1879-0003 (Electronic)0141-8130 (Linking). Disponível em:< http://www.ncbi.nlm.nih.gov/pubmed/26763176 >.
ZHAO, W. et al. Antioxidant activities of Ganoderma lucidum polysaccharides and their role on DNA damage in mice induced by cobalt-60 gamma-irradiation. Food Chem Toxicol, v. 50, n. 2, p. 303-9, Feb 2012. ISSN 1873-6351 (Electronic)02786915 (Linking). Disponível em: < http://www.ncbi.nlm.nih.gov/pubmed/22079311 >.
ZHOU, X. et al. Ganodermataceae: natural products and their related pharmacological functions. Am J Chin Med, v. 35, n. 4, p. 559-74, 2007. ISSN0192-415X (Print)0192-415X (Linking). Disponível em: < http://www.ncb6.5 Avaliação de marcadores renais