PRELIMINARY ANTIMYCOTIC EVALUATION OF FLUCONAZOLE INCORPORATED IN MESOPOROUS SILICA MCM-41
REGISTRO DOI: 10.5281/zenodo.7847515
Wilson Rodrigues Braz1
Ralisson José Ferreira1
João Pedro de Sousa Oliveira1
Maria Gabriela Martins de Souza2
Michelle Saltarelli2
Eduardo José Nassar2
Lucas Alonso Rocha2
Emerson Henrique de Faria2
Melissa Grazielle Morais3
Joice de Freiras Fonseca1
Camila Gontijo Morais1
Resumo
Introdução: Com o avanço da tecnologia e das pesquisas sobre materiais mesoporosos, pesquisas acerca do uso destes, como nanocarreadores de fármacos, ganha-se destaque. Dentre os diversos tipos de sílicas mesoporosas, a MCM-41 recebe destaque por ter uma rota de síntese alcalina, baixo custo e por não apresentar citotoxicidade ao organismo humano permitindo obter um material com alta área específica e adsorção com vários fármacos. Metodologia: Realizou-se a síntese “template” utilizando brometo de cetiltrimetilamônio (CTAB) como molde de poros e tetraetilortosilicato (TEOS) como precursor de sílica. Os materiais foram caracterizados por difratometria de Raios X, espectroscopia de absorção na região do infravermelho, termogravimetria e sua derivada. A incorporação do fluconazol à matriz ocorreu com um tempo de 48h. A avaliação antimicótica qualitativa foi realizada por ensaio de difusão (método do poço) em ágar Sabouraud dextrose (SBA). Resultados: O DRX reportou um perfil preliminar da formação da MCM-41. A incorporação do fluconazol foi evidenciada através do espectro de absorção na região do infravermelho (FTIR) com bandas características do fármaco na matriz e através do perfil termogravimétrico e sua derivada quantificou-se a incorporação de 17,5% (m/m) do fármaco. Conclusão: O fármaco incorporado apresentou atividade antimicótica promissora contra C. albicans, porém a exemplo do fluconazol puro, não teve ação antimicótica sobre C. krusey.
Palavras-chave: Nanotecnologia, MCM-41, Incorporação de fármacos, Reposicionamento de fármacos.
Abstract
Introduction: With the advancement of technology and research on mesoporous materials, research on their use as drug nanocarriers has gained prominence. Among the various types of mesoporous silicas, MCM-41 stands out for having an alkaline synthesis route, low cost and for not presenting cytotoxicity to the human body, allowing to obtain a material with high specific area and adsorption with several drugs. Methodology: A “template” synthesis was performed using cetyltrimethylammonium bromide (CTAB) as a pore template and tetraethylorthosilicate (TEOS) as a silica precursor. The materials were characterized by X-ray diffraction, infrared absorption spectroscopy, thermogravimetry and its derivative. The incorporation of fluconazole to the matrix occurred after 48 hours. Qualitative antimycotic evaluation was performed by diffusion assay (well method) on Sabouraud dextrose agar (SBA). Results: DRX reported a preliminary profile of the MCM-41 formation. The incorporation of fluconazole was evidenced through the absorption spectrum in the infrared region (FTIR) with characteristic bands of the drug in the matrix and through the thermogravimetric profile and its derivative, the incorporation of 17.5% (m/m) of the drug was quantified . Conclusion: The incorporated drug showed promising antimycotic activity against C. albicans, however, like pure fluconazole, it had no antimycotic action against C. krusey.
Keywords: Nanotechnology, MCM-41, Drug incorporation, Repositioning of drugs.
INTRODUÇÃO
A nanotecnologia é uma ciência que estuda materiais que apresentam em alguma de suas dimensões escala nanométrica e que são um bilhão de vezes menor que o metro. O seu advento ocorreu em dois momentos descritos pela literatura: publicação do livro “Engenhos da Criação: o advento da era da nanotecnologia” pelo Engenheiro Erick Drexler em 1986, e um pouco antes pelo físico Richard Feynman em 1959 em palestras1-2.
Atualmente, a nanotecnologia abrange inúmeras aplicações no cotidiano das pessoas como na indústria têxtil, na tecnologia da informação, indústria de alimentos, indústria farmacêutica e automobilística. Na área farmacêutica as mais promissoras atribuições relacionadas ao uso da nanotecnologia são a pesquisa de maior eficácia terapêutica e menor toxicidade para mecanismos clássicos com o fármaco na nanoestrutura em relação ao fármaco molecular ou buscar carreadores nanométricos de fármacos a fim de alcançar novos mecanismos para fármacos clássicos e assim, atuar no tratamento de doenças, diminuindo os efeitos adversos, aumentando a especificidade e modulando a atividade farmacológica nos sítios de ação3.
Um material bastante interessante no desenvolvimento de sistemas carreadores de fármacos é a sílica mesoporosa MCM-41 (Mobil Composition of Matter Nº 41). Esse material possui importantes características como estrutura hexagonal organizada e poros nanométricos com volumes padronizados na faixa de 2 a 30 nm, permitindo assim, grande área superficial, resistência mecânica, permeabilidade e estabilidade termoquímica, que garantem a integridade quando submetido a grandes variações de temperatura e compatibilidade além de, grupos silanóis residuais que permitem a interação química com os fármacos a serem incorporados nas matrizes ou sua funcionalização com outros grupos como amino ou cloro4-6 .
Assim, o uso farmacêutico da sílica mesoporosa como carreadoras de fármacos tem como primeira justificativa a compatibilidade a diversos componentes químicos, tanto dos fármacos, quanto do organismo humano e se mostraram materiais hipoalergênicos e atóxicos5. Outras prerrogativas relevantes são: alta superfície de contato, que por sua vez aumenta a concentração de fármaco no sítio alvo; a proteção do fármaco contra possíveis instabilidades no organismo; a regularidade deste em níveis plasmáticos; a melhoria dos resultados terapêuticos e o controle da liberação do ativo no sítio alvo sensíveis. Por fim, a diminuição da dose e do número de administrações do medicamento e aumento da aceitação da terapia pelo paciente7.
A utilização desses carreadores no tratamento de infecções causadas por fungos se mostra promissora buscando a sensibilidade para fármacos resistentes na fórmula molecular ou reduzir a toxicidade para fármacos antimicóticos, conseguindo assim, reduzir a dosagem posológica habitual. Os antifúngicos são fármacos que por diversos mecanismos impedem a reprodução (fungistáticos) ou causam a morte desses microrganismos (fungicidas). Assim como ocorre com as bactérias, os fungos também têm desenvolvido resistência aos antimicrobianos, dificultando o seu tratamento8.
Dentre os vários tipos de antifúngicos existentes, o fluconazol tem sido o medicamento de primeira escolha. Ele apresenta alta biodisponibilidade, tendo cerca de 80% de concentração plasmática logo nas primeiras horas após sua administração. Tem um amplo espectro de ação contra fungos das espécies Candida e Cryptococcus, incluindo linhagens de Candida albicans. Entretanto, possui pouca efetividade contra linhagens de Candida krusey e Cândida glabrata9.
O mecanismo de ação desses fármacos, da classe dos triazólicos, consiste em impedir a síntese do ergosterol fúngico pela inibição da enzima 14α-esterol desmetilase do P450 microssomal. Essa inibição causa um acúmulo de lanosterol no fungo e desestabiliza sua membrana causando instabilidade na cadeia de transporte de elétrons, o que resulta em morte celular10.
O maior problema farmacocinético do fluconazol está relacionado à falta de especificidade ao complexo P450 fúngico, o que faz com que ele também inibe enzimas hepáticas do organismo humano tornando-se a nanotecnologia interessante na busca da diminuição desses efeitos tóxicos9.
Tendo em vista os conceitos e vantagens do uso da nanotecnologia em sistemas carreadores de fármacos e a praticidade do uso da sílica mesoporosa MCM-41 como precursor desses sistemas, aliado à necessidade de reverter os impactos da resistência fúngica ao fluconazol bem como, em reduzir a toxicidade ao antimicótico, este trabalho propôs incorporar o fármaco fluconazol a matriz MCM-41 e avaliar a sua ação antimicótica qualitativa contra Candida krusey (ATCC 20298) e Candida albicans (ATCC 18804).
METODOLOGIA
Síntese e ativação da sílica mesoporosa
A síntese da sílica mesoporosa tipo MCM-41 foi realizada conforme descrito por Kamarudin et al.11, utilizando como direcionador de poros o brometo de cetiltrimetilamônio (CTAB), o precursor de sílica tetraortosilicato (TEOS) e o catalisador alcalino hidróxido de amônio (NH4OH).
Foi disperso 250mg do CTAB em 34 mL de água purificada obtida por osmolarização. Em seguida, adicionou 25,0 mL de NH4OH e lentamente 1,25 mL de TEOS. Posteriormente, a solução ficou sob agitação magnética por 24 horas. O material obtido foi centrifugado a 4.000 RPM por 30 minutos e posteriormente, lavado 3 vezes por centrifugação nas mesmas condições de rotação e tempo com água purificada para que o catalisador fosse retirado. O sólido obtido foi seco em estufa a 60 ºC por 24 horas. O material seco foi submetido ao tratamento térmico em mufla a 620 ºC por 5 horas, eliminando os resíduos orgânicos do direcionador de poros CTAB.
O processo de tratamento térmico gerou a desidroxilação dos grupos silanóis residuais e os mesmos foram reconstituídos através da ativação da sílica com solução de ácido clorídrico (HCl) 1,0 mol.L-1. Utilizou-se a razão 300 mg de sílica:30 mL de HCl sob refluxo e agitação magnética a 100 ºC por 1 hora. O excesso do ácido foi retirado por lavagem de 3 vezes por centrifugação à 4.000 RPM por 30 minutos. O material foi seco em estufa de secagem a 60 ºC por 24 horas, obtendo assim a sílica mesoporosa ativada tipo MCM-41 (MCM-41 ativada).
Incorporação do fluconazol à matriz de sílica mesoporosa
Para incorporação do fluconazol na sílica mesoporosa ativada foi utilizada a proporção 1:1 (m/m) de sílica mesoporosa:fármaco, utilizando o método descrito por Braz et al.12 com adequações. Em seguida foram acrescentados 50,0 mL de etanol absoluto P.A. para a solubilização do fármaco. Essa mistura foi mantida sob agitação, utilizando o agitador magnético, por 48 horas.
Após o tempo de incorporação foi realizada a centrifugação do material a 4.000 RPM por 20 minutos. Descartou-se o sobrenadante e a secagem material ocorreu em estufa a 60ºC por 24 horas, obtendo assim amostras de sílica mesoporosa incorporada ao fluconazol no tempo de 48 horas (MCM-41 fluconazol 48h).
Caracterização dos materiais puros e incorporados
As amostras de MCM-41-Fluconazol 48h, fluconazol puro e MCM-41 puro, foram caracterizadas por difratometria de Raios X (DRX), espectroscopia de absorção na região do infravermelho (FTIR) e termogravimetria (TGA) e sua derivada (DTG).
As caracterizações ocorreram em parceria com a Unifran, Fapesp e Capes – realizadas na central analítica da Universidade de Franca.
Difratometria de raios X
Para realizar o teste de Difração de raios X (DRX) para as amostras de MCM-41-Fluconazol 48h e MCM-41 puro, foi utilizada a metodologia descrita por Santos Filho et al.13, utilizando o método do pó em temperatura ambiente no intervalo de 2θ entre 1,2 a 10º (0,05º/10s). Utilizou-se o difratômetro Miniflex RIGAKU II® com radiação Kα do cobre (λ = 1,5418 Å). Os valores base para cálculo do espaçamento interplanar (d100) e parâmetro de células unitárias hexagonais (a0) seguiram o processo descrito por Rocha14, conforme equações:

Legenda: d100 – espaçamento interplanar; a0 – parâmetros de célula unitária.
Espectroscopia na região do infravermelho por transformada de Fourier
Os espectros infravermelhos (FTIR) para a análise de MCM-41-fluconazol 48h, fluconazol puro e MCM-41 puro foram obtidos em espectrofotômetro Perkin Elmer modelo Frontier 93430®, seguindo a metodologia descrita por Silva et al.15, utilizando janela de operação entre 4000-400 cm-1 junto ao o método por reflectância difusa partindo de uma mistura de cada uma das amostras com brometo de potássio (KBr).
Termogravimetria e termogravimetria derivada
A termogravimetria e sua derivada (TGA/DTG) foi obtida para as amostras MCM-41-Fluconazol 48h, fluconazol puro e MCM-41 puro no equipamento TA Instruments-SDT Q600-Simultaneous DTA-TGA® seguindo a metodologia descrita por Araújo et al.16. Utilizou-se uma variação de temperatura de 25ºC, aproximadamente, até 1000ºC, com variação de 20 °C a cada minuto, sob fluxo de nitrogênio de 100 mL/min e massa de amostra de aproximadamente 10 mg.
Avaliação da atividade antimicótica
Para avaliar a atividade qualitativa antimicótica, para as amostras MCM-41-fluconazol 48h, fluconazol puro e MCM-41 puro, foi utilizada a metodologia descrita por Zanoni et al.17. Os ensaios biológicos ocorreram em triplicata no laboratório de microbiologia da Una Bom Despacho.
Padronizou-se suspensões salinas com as leveduras Candida albicans (ATCC 18804) e Candida krusey (ATCC 20298) com a escala McFarland padrão 0,5 UT, obtendo uma densidade fúngica equivalente a 108 UFC/mL.
Realizou-se a semeadura por toda a superfície de ágar Sabouraud dextrose (SBA) com auxílio de swab estéril para cada linhagem de fungo para placas identificadas para amostras MCM-41-fluconazol 48h, fluconazol puro e MCM-41 puro das suspensões padronizadas.
Após a inoculação, perfurou-se um poço com as costas de uma ponteira estéril no centro da placa, e esta foi levada à estufa a 37ºC por 5 minutos. Passado esse tempo, foi adicionado ao poço de cada placa 200 mg do material MCM-41 puro, 35 mg de fluconazol puro e por fim, 200 mg de MCM-41-fluconazol 48h. Para facilitar a difusão, foi adicionado 20 ųL de água estéril para injetáveis e novamente levado à estufa a 37ºC para incubação por 18-24 horas.
Ressaltando-se que o fármaco incorporado se encontrava na proporção em massa determinada no TGA/DTG na matriz, ou seja, quando se aplicou 35 mg de fluconazol puro para a difusão em ágar foi baseado na correção em massa da matriz incorporada.
RESULTADOS E DISCUSSÕES
Caracterização das amostras puras e incorporadas
Difratometria de Raios X
A FIGURA 1 demonstra o padrão de difratometria de Raios X (DRX) obtido para MCM-41 pura.
FIGURA 1: Perfil de difratometria de Raios X (DRX) obtido para a sílica mesoporosa do tipo MCM-41.
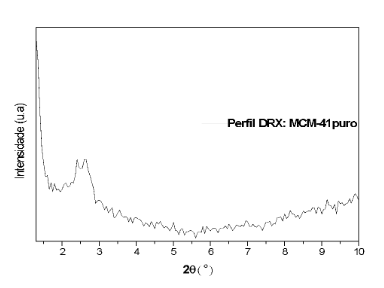
Observou-se o pico principal em cerca de 2,76º (2θ). Com o dado do pico principal foi obtido a distância interplanar d100 (índice de Miller) de 3,20 nm e parâmetros de células unitárias hexagonais a0 de 3,69. Os resultados sugerem a formação de rede hexagonal organizada prevista para a sílica mesoporosa, conforme literatura11,14,18.
Espectroscopia na região do infravermelho por transformada de Fourier
Os perfis de absorção obtidos por espectroscopia de absorção na região do infravermelho por transformada de Fourier (FTIR) para as amostras de MCM-41 pura, fluconazol puro e MCM-41-fluconazol 48h são apresentados na FIGURA 2.
FIGURA 2: Espectro FTIR para as amostras de fluconazol puro (vermelho); MCM-41 pura (azul) e fluconazol incorporado (verde).
Ao se comparar os perfis de absorção na região das três amostras nota-se um pico largo na região de 3500 cm-1 e absorções na região de 1500 cm-1 a 1000 cm-1 para a sílica mesoporosa MCM-41 pura e MCM-41 incorporada com o fluconazol, que indicam a presença do grupo hidroxila, conforme descrito por Dai et al.19.
Observou-se para MCM-41 pura a ausência de bandas de absorção características de compostos orgânicos, caracterizando a eficiência do processo de calcinação com a eliminação do direcionador de poros CTAB, corroborando com os estudos de Kamarudin et al.11.
Ao observar o perfil de absorção do fluconazol puro observou-se, conforme Silveira et al.20, bandas características em 3030 cm-1 C-H de carbono do tipo sp2 de anel aromático, outra banda larga em aproximadamente 3200 cm-1 referente ao estiramento da ligação OH, duas bandas de absorções em aproximadamente 1600 cm-1 e 1500 cm-1 referentes a presença de C=C de aromático, banda de absorção em 1000 cm-1 devido à presença da ligação C-F e por último em 2500 cm-1 banda característica de estiramento de C=N de anéis heterocíclicos.
Por fim, ao comparar o perfil da MCM-41 pura, fluconazol puro e MCM-41 incorporada observa-se a presença do fluconazol incorporado na sílica mesoporosa MCM-41. Foi observado a expressão de novas bandas características de materiais orgânicos não evidenciados na sílica pura, o que sugere a ocorrência da adsorção de matéria orgânica. Pode-se notar também que na região de 1500 cm-1 a 1250 cm-1 existem dois picos bem destacados que estavam presentes na curva descrita pelo fluconazol, representando presença de C=C de aromático, como descrito por Silveira et. al.20 e ainda, bandas na região de 2000 cm-1 presentes também na curva do fluconazol puro.
Termogravimetria e termogravimetria derivada
A FIGURA 3 apresenta através da análise termogravimétrica (TGA) e sua derivada (DTG) as perdas de massa em função da variação de temperatura para a amostra de MCM-41 pura.
FIGURA 3: Curva termogravimétrica e sua derivada (TGA/DTG) para sílica mesoporosa MCM-41 pura.
Observou-se uma perda de massa de 32,5% na região de 100 ºC que representa a perda de água e a ausência de picos de perda de massa orgânica no intervalo de 100 ºC a 600 ºC e o intervalo de 600ºC a 700ºC representou as desidroxilações dos grupos silanóis conforme descrito por Vallet-Regi et al.21. Esses resultados complementam os dados da espectroscopia FTIR com a ausência de matéria orgânica para a MCM-41 com a eliminação do CTAB no tratamento térmico (calcinação).
A FIGURA 4 apresenta o perfil TGA/DTG obtido para o fármaco fluconazol puro.
FIGURA 4: Curva termogravimétrica e sua derivada (TGA/DTG) para o fluconazol.
Observou-se a perda de massa equivalente a 1% na região de 100 ºC, equivalente a umidade, uma perda de 1,5% na região de 100 a 150 ºC com posterior grande perda de massa de 97,5% que representam a perda de matéria orgânica referente ao fluconazol, dados que corroboram com os estudos realizados por Moura22.
Por fim, a FIGURA 5 apresenta a análise TGA/DTG para o fluconazol incorporado à sílica mesoporosa MCM-41 em 48h (MCM41-fluconazol 48h).
FIGURA 5: Curva termogravimétrica e sua derivada (TGA/DTG) para o fluconazol incorporado na sílica mesoporosa MCM-41.
Pode-se observar uma perda de massa de 10% relacionada a água em 100 ºC e no intervalo de temperatura de 100 ºC a 250 ºC, aproximadamente, tivemos uma queda de massa de 5% e posterior perda entre 250 ºC e 450 ºC de 12,5%, correspondentes a adsorção de 17,5% em massa de fluconazol no material mesoporoso, descrito pelas interações hidrofóbicas e de hidrogênio conforme França et al.23.
Avaliação da atividade antimicótica
Os testes de difusão em ágar SBA pelo método do poço para a avaliação antimicótica qualitativa frente a possível sensibilidade C. krusey ATCC 20298 ao fluconazol incorporado à sílica mesoporosa é representado na FIGURA 6.
FIGURA 6: Atividade antimicótica do fluconazol puro (a), MCM-41 pura (b) e fluconazol incorporado em 48h (c) para fungo C. krusey ATCC 20298 pelo método de difusão em ágar.
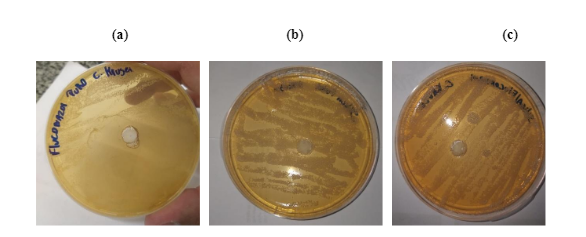
Nos testes para atividade antimicótica para a levedura C. krusey ATCC 20298, buscou-se trabalhar com o objetivo da nanotecnologia em buscar a sensibilidade ao fluconazol para esta espécie pois, segundo a literatura tais fungos, são resistentes ao fluconazol9,24.
Observa-se na FIGURA 6 (a) a ausência de halo inibitório para o fluconazol puro confirmando, de acordo com a literatura, a resistência desses fungos ao antimicótico. O mesmo ocorre quando se observa na FIGURA 6(b) a ausência de halo inibitório quanto em questão foi a sílica MCM-41 pura. Porém, ao observar a FIGURA 6(c), observa-se que o objetivo em reduzir a resistência fúngica através de um reposicionamento do fármaco incorporado ao sistema nanoestruturado não foi alcançado pois, a levedura C. krusey ATCC 20298 continuou resistente ao fármaco, com ausência de halo inibitório nas triplicatas testadas.
A avaliação da atividade antimicótica contra o fungo C. albicans ATCC 18804 é representada na FIGURA 7.
FIGURA 7: Atividade antimicótica do fluconazol puro (a), sílica do tipo MCM-41 (b) e fluconazol incorporado em 48h (c) para fungo C. albicans ATCC 18804 pelo método de difusão em ágar.
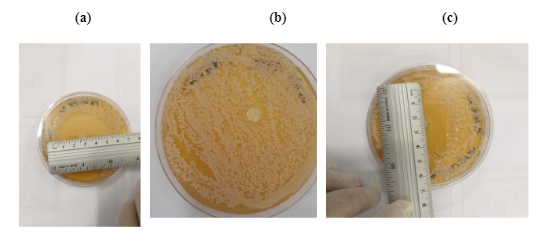
Observou-se que a sílica mesoporosa pura (FIGURA 7(a)) não apresentou ação antimicótica contra a cepa de C. albicans, não influenciando na atividade. Porém, observou-se na FIGURA 7(b) a cepa C. albicans ATCC 18804 foi sensível ao fluconazol puro apresentando uma halo inibitório médio da triplicata de 5,6 cm de diâmetro para a dosagem 20 mg do fármaco puro. Obteve-se um halo inibitório médio da triplicada referente a 4 cm de diâmetro quando avaliado a amostra incorporada com o antimicótico (MCM-41 fluconazol 48h), confirmando a ação antimicótica do fluconazol incorporado e liberado da matriz mesoporosa, representado pela FIGURA 7(c).
Os resultados contra a C. albicans são satisfatórios pois, halos de inibição superiores a 19 mm confirmam efeito inibitório em avaliações antifúngicas25-26. Pode-se inferir que quando incorporado, o fluconazol obteve uma ação antimicótica equivalente ao fluconazol puro e que estudos futuros são necessários para avaliar a redução do pico plasmático e assim, os dados corroboraram para a redução da toxicidade do fármaco.
CONCLUSÃO
Os testes para a avaliação antimicótica do fluconazol reposicionado a uma matriz nanocarreadora reafirmaram a resistência da cepa C. krusey ATCC 20298 ao fármaco. Já contra C. albicans ATCC 18804, o fluconazol demonstrou uma possível eficácia terapêutica semelhante ao fármaco puro, onde há a possibilidade em apresentar uma liberação lenta e assim, reduzir os efeitos adversos oriundos da terapêutica convencional.
AGRADECIMENTOS
Agradecemos à UNIFRAN, FAPESP e CAPES pela parceria analítica e Magisfarma Bom Despacho por gentilmente colaborar com a disponibilidade do fármaco fluconazol.
REFERÊNCIAS
1. Martins P. Nanotecnologia e meio ambiente para uma sociedade sustentável. Estudios Sociales. 2009;17(34):291-309.
2. Schulz PA. Nanomateriais e a interface entre nanotecnologia e ambiente. Visa em debate. 2013;1(4):53-58.
3. Sousa A. Materiais mesoporosos ordenados aplicados como sistemas para liberação controlada de drogas. [Dissertação]. Belo Horizonte: Centro de Desenvolvimento da Tecnologia Nuclear:2006.
4. Martinho MP, Soares V. Determinação do índice de refração dos materiais pelo método de Ptolomeu. Rev. Bras. Ensino Fís. 2017;39(3):1806-1117.
5. Gomes LS, Furtado ACR, Souza MC. A Sílica e Suas Particularidades. Revista Virtual de Quimica. 2018;10(8):1-22.
6. Oye G, Sjöblom J, Stocker M. Synthesis, characterization and potential applications of new materials in the mesoporous range. Advances in Colloid and Interface Science. 2001;89(90):439-466.
7.Pimentel, LF, Jácome Júnior AT, Mosqueira VCF, Santos-Magalhães, NS. Nanotecnologia farmacêutica aplicada ao tratamento da malária. Revista Brasileira de Ciências Farmacêuticas. 2007;43(4):503-514.
8. Fica CA. Tratamento de infecciones fúngicas sistêmicas primeira parte: fluconazol, itraconazol y voriconazol. Rev Chil Infectol. 2004;21(1):26-38.
9. Golan DE. Princípios de farmacologia: a base fisiopatológica da farmacoterapia. Guanabara Koogan. 3. ed. Rio de Janeiro; 2009.
10. Rang HP, Ritter, JM, Flower, RJ, Henderson, G. Farmacologia: Rang e Dale. Elsevier. 8. ed. 2019.
11. Kamarudin NHN, Jalil AA, Triwahyono S, Salleh NFM, Karim AH, Mukti RR, et al. Role of 3-aminopropyltriethoxysilane in the preparation of mesoporous silica nanoparticles for ibuprofen delivery: Effect on physicochemical properties. Microporous and Mesoporous Materials. 2013;180:235-241.
12. Braz WR, Rocha NL, Faria EH, Andrade ML, Ciuffi KJ, Rocha LA, et al. Incorporation of Anti-Inflammatory Agent into Mesoporous Silica. Nanotechnology. 2016;385103: (9p.).
13. Santos Filho LP, Nascimento MPFP, Marçal L, Ciuffi KJ, Silva MLA, Nassar EJ.; Rocha, LA. (−)-Hinokinin antimicrobial agents into functionalized mesoporous silica. Journal of Sol-Gel Science and Technology. 2021; 98:342-350.
14. Rocha LA. Materiais meso-estruturados luminescentes. [Tese]. Araraquara-SP:Universidade Estadual Paulista:2010.
15. Silva ACP, Cordeiro PY, Estevão BM, Caetano W, Eckert H, Santin SMO, et al. Synthesis of Highly Ordered Mesoporous MCM-41: Selective External Functionalization by Time Control. J. Braz. Chem. Soc. 2019;30 (8):1599-1607.
16. Araújo AS, Jaroniec M. Thermogravimetric monitoring of MCM-41 synthesis. Thermochimica Acta. 2000;363(1-2): 175-180.
17. Zanoni ET, Cardoso WA, Baesso AS, Savi GD, Folgueras MV, Mendes E, et al. Avaliação da atividade antimicrobiana e absortividade de nanopartículas de sílica dopadas com CuO. Matéria (Rio de Janeiro). 2019;24(1):1-11.
18. Nascimento GE, Duarte MB, Schuler ARP, Barbosa CMBM. Synthesis, characterization, and application of the mesoporous molecular sieve Sr-MCM-41 in the removal of naphthenic acids from a model mixture of aviation kerosene by adsorption. Brazilian Journal of Petroleum and Gas. 2014;8(1):001-013.
19. Dai X, Qiu F, Zhou X, Long Y, Li W, Tu Y. Amino-functionalized MCM-41 for the simultaneous electrochemical determination of trace lead and cádmium. Electrochimica Acta. 2014;144:161-167.
20. Silveira BM, Santos VMR, Npack KM, Lopes SA. Incorporação de Fluconazol em Inéditos Derivados do Copolímero PMMA-g-PEG. 21º Cbecimat – Congresso Brasileiro de Engenharia e Ciência dos Materiais. 2014;6863-6870. Disponível em: <http://www.metallum.com.br/21cbecimat/CD/PDF/404-019.pdf>. Consultado em: Novembro de 2019.
21. Vallet-Regí, M, Rámila A, Del Real RP, Pérez-Pariente J. A new property of MCM-41: Drug delivery system. Chemistry of Materials. 2001;13 (2):308-311.
22. MOURA EA. Estudo de correlação de parâmetros térmicos e de dissolução do fluconazol na caracterização tecnológica de desintegrantes. [Dissertação]. Recife: Universidade Federal de Pernambuco:2018.
23. França RRF, Carvalho AS, Branco FSC, Pinto AC, Boechat N. Inibidores potentes da enzima esterol 14α-desmetilase contra Trypanosoma cruzi. Rev. Virtual Quim. 2014;6 (5):1483-1516.
24. Purisco SU. Prevalência e sensibilidade a antifúngicos de espécies de Candida pouco frequentes como agentes de candidemia. [Monografia]. São Paulo:Secretaria de Estado da Saúde de São Paulo:2010.
25. Azevedo AC, Bizerra FC, Matta DA, Almeida, LP, Rosas R., Colombo AL. In vitro susceptibility of a large collection of Candida strains against fluconazole and voriconazole by using the CLSI disk diffusion assay. Mycopathologia. 2011;171(6):411-416.
26. Pedroso RS, Menezes RP, Ferreira JC, Penatti MPA, Sá WM, Malvino LDS, et al. Sensibilidade de isolados de Cândida ssp. a antifúngicos por disco-difusão em ágar e microdiluição em caldo. Biosci. J. 2014; 30 (1);304-311.
1Centro Universitário Una Bom Despacho – Curso de Farmácia. Bom Despacho – Minas Gerais, Brasil.
2Universidade de Franca – Pós-graduação em Ciências. Franca – São Paulo, Brasil.
3Universidade do Estado de Minas Gerais – Curso de Biomedicina. Passos – Minas Gerais, Brasil.
