REGISTRO DOI: 10.69849/revistaft/cs10202411141346
Beatriz Serdeira Silvestre
Maria Luiza Ferreira Santos
Qendra Gabriele dos Santos Ribeiro
Thayna Lima Fernandes
Orientador (a): Professor Mestre Leandro Teodoro da Silva
Resumo
A Distrofia Muscular de Duchenne (DMD) foi inicialmente descrita pelo Dr. Charles Bell em 1830 e mais detalhadamente por Dr. Meryon em 1851. A condição, nomeada a partir do termo grego “dys-trophen” (má nutrição), foi caracterizada como uma doença genética hereditária que afeta predominantemente homens, levando a fraqueza muscular progressiva e eventual morte. Dr. Guillaume Duchenne, em 1868, ampliou a descrição da doença, destacando a perda progressiva de movimentos e a hipertrofia muscular falsa. No Brasil, os estudos avançaram a partir de 1989 com a pesquisa de Maria Rita Passos Bueno sobre a distrofina.
A DMD é uma das maiores patologias genéticas humanas, causada por mutações no gene da distrofina localizado no cromossomo X. A falta dessa proteína essencial resulta em deterioração progressiva das fibras musculares devido ao aumento do cálcio intracelular e à degradação das proteínas musculares. A condição é diagnosticada através de biópsia muscular, eletromiografia, e testes de creatinofosfoquinase (CPK).
Clinicamente, a DMD se manifesta com atraso motor, fraqueza muscular, e pode levar a deformidades como o pé equino, caracterizado por flexão plantar e elevação do calcanhar, o que deixa o pé semelhante ao de um cavalo. O controle da DMD inclui tratamento farmacológico e tratamentos fisioterapêuticos, como cinesioterapia e fisioterapia aquática. A utilização de órteses é fundamental para prevenir deformidades e melhorar a funcionalidade. Além disso, a reabilitação contínua e o acompanhamento de uma equipe multidisciplinar são essenciais para manter a qualidade de vida e retardar a progressão da doença.
Palavras Chaves: Distrofia Muscular de Duchenne, Pé equino, Deformidade, Cromossomo X, Fisioterapia, Avaliação neurológica, Dr. Guillaume Duchenne.
Abstract
Duchenne Muscular Dystrophy (DMD) was first described by Dr. Charles Bell in 1830 and in more detail by Dr. Meryon in 1851. The condition, named after the Greek term “dys-trophen” (malnutrition), was characterized as an inherited genetic disease that predominantly affects men, leading to progressive muscle weakness and eventual death. In 1868, Dr. Guillaume Duchenne expanded the description of the disease, highlighting the progressive loss of movement and false muscle hypertrophy. In Brazil, studies advanced in 1989 with Maria Rita Passos Bueno’s research on dystrophin.
DMD is one of the most serious human genetic pathologies, caused by mutations in the dystrophin gene located on the X chromosome. The lack of this essential protein results in progressive deterioration of muscle fibers due to increased intracellular calcium and degradation of muscle proteins. The condition is diagnosed through muscle biopsy, electromyography, and creatine phosphokinase (CPK) tests.
Clinically, DMD manifests itself with motor delay, muscle weakness, and can lead to deformities such as equinus foot, characterized by plantar flexion and elevation of the heel, which makes the foot like that of a horse. Control of DMD includes pharmacological treatment and physiotherapeutic treatments, such as kinesiotherapy and aquatic physiotherapy. The use of orthoses is essential to prevent deformities and improve functionality. In addition, continuous rehabilitation and monitoring by a multidisciplinary team are essential to maintain quality of life and slow the progression of the disease.
Keywords: Duchenne Muscular Dystrophy, Equinus foot, Deformity, X chromosome, Physiotherapy, Neurological evaluation, Dr. Guillaume Duchenne.
1. Introdução
1.1 Histórico da Distrofia muscular de Duchenne.
A Distrofia Muscular de Duchenne (DMD) foi descrita pela primeira vez pelo Dr. Charles Bell em 1830, em seu livro “Case of Partial Paralysis of the Lower Extremities”, o nome veio de dys-trophen, que em grego significa “má nutrição”. Já a descrição mais completa foi feita pela primeira vez pelo Dr. Meryon (1807- 1880) como uma doença que causa fraqueza muscular levando a morte na maioridade (MERYON et al., 1851). Foi observado que a DMD era de caráter hereditário, onde pessoas da mesma família eram afetadas, em sua maioria dos indivíduos do sexo masculino, com essas observações ele concluiu que era uma doença do tecido muscular. Em 1868 outro estudioso do assunto trouxe novas ideias sobre essa patologia, seu nome é Dr. Guillaume Benjamin Amand Duchenne, neurologista francês que nasceu no dia 17 de setembro de 1806, onde descreve a DMD como sendo perda progressiva dos movimentos, afetando inicialmente nos membros inferiores e posteriormente nos superiores com pseudo hipertrofia progressiva dos músculos afetados e aumento significativo do tecido conjuntivo e do tecido adiposo. (Moraes et al, 2011)
No Brasil os estudos referentes a DMD teve início por volta dos anos 1989, onde as investigações sobre o DNA, especificamente sobre a distrofina foram realizadas por Maria Rita Passos Bueno, que na época estava fazendo o seu pós-doutorado em Oxford. Ela trouxe de volta o conhecimento para trabalhar com o genoma humano, tornando-se a pioneira nesse tipo de análise no país. (Chinelli, 2015).
1.2 Fisiopatologia
A DMD é a maior patologia genética descrito em humanos, com aproximadamente 2,4 milhões de pares de bases, o que corresponde a aproximadamente 0,1% do genoma humano ou 1,5% do total do cromossomo X, gene que se localiza no braço curto do cromossomo X, na região Xp21. Trata-se de uma doença vertical, e a sua incidência é de 1 em 3.500 nascidos vivos, os indivíduos do sexo masculino são os mais acometidos que do sexo feminino que geralmente não desenvolvem quadro clínico. A miopatia se caracteriza por ser um grupo de patologias de origem muscular que atinge os músculos. Entre diversas miopatias, a de Duchenne se define por ser uma distrofia muscular, hereditária e progressiva. (Worton et.al, 2001).
Essa anomalia ocorre por meio genético quando há alterações no cromossomo X que sofre com a mutação por meio do DNA, o sexo feminino possui dois cromossomos sendo XX, enquanto o masculino possui apenas um cromossomo sendo XY, isso faz com que a incidência de homens atingidos pela condição seja unanime já que para uma mulher ter a síndrome seria necessário que os dois cromossomos X tivessem a mutação.
O gene atípico pode ser encontrado no braço curto do cromossomo X, lócus Xp21, sub banda Xp 212. Ele é o encarregado por fazer a produção da proteína cito esquelética distrofina, que pode ser encontrada no sarcolema das fibras musculares I-IIB, a distrofina é responsável por revestir o músculo durante a contração das fibras musculares, fazendo a conexão entre a actina do aparelho contrátil com a camada do tecido conjuntivo que envolve as fibras musculares, estabilizando assim as mesmas enquanto ocorrem as contrações, a ausência dessa proteína ou alteração da mesma ocasiona mutações impedindo a execução correta de suas funções, pois as fibras musculares são facilmente deterioradas enquanto ocorre a contração, causando perda de função e lesões que ocorrem de forma gradativa, e embora o músculo possa ser funcional sem a proteína, ele não pode suportar a contração por um longo período de tempo; Entretanto, a homeostase do cálcio nas células musculares é essencial para a regulação de sinalização fisiológicas. Organelas, proteínas transportadoras, canais iônicos e substâncias no citosol controlam o cálcio, regulando seu influxo, armazenando e liberando-o na célula. Isso é crucial para a função muscular normal e evita distúrbios musculares, é possível verificar em alguns exames as fibras musculares e detectar que são facilmente deterioradas enquanto ocorre a contração. (N.6 Aartsma-rus; Ginjaar; Bushby 2016, p 145).
Com o avanço nos estudos sobre essa alteração genética sabe-se atualmente que a falta da proteína distrofina leva a necrose da fibra muscular em músculos lisos, esqueléticos, cardíacos e em alguns neurônios. (Monteiro et al.,2013).
Nesses pacientes com a distrofia muscular, é possível observar um aumento na concentração de cálcio no interior da célula, o que representa uma das possíveis causas do extenso dano muscular associado a essa condição. A ausência da proteína distrofina compromete a permeabilidade da membrana celular e afeta a atividade de alguns canais de membrana, incluindo os canais de cálcio. A elevada concentração de cálcio intracelular favorece a atividade de proteases, enzimas que degradam proteínas, levando a um comprometimento ainda maior da integridade da membrana celular. Esse desequilíbrio de cálcio desempenha um papel importante na progressão da distrofia muscular e na degeneração do tecido muscular. (Horita; Cruz, 2015, p. 35)
1.3 Quadro Clínico
Durante a atividade de esforço ocorre outros tipos de modificações fisiológicas, como alteração da frequência cardíaca, alteração de pressão arterial, frequência respiratória, são algumas variáveis que ocorrem para suprir a necessidade de nutrientes e oxigênio, algumas medidas metabólicas como concentração de lactato, e glicose também podem ser alteradas, algumas alterações das fibras tipo I e II também podem ocorrer, no tipo I, atrofia e em Tipo II hipertrofia. Através da biópsia muscular é possível detectar essa patologia, ela é solicitada após a coleta da história médica e clínica do paciente, também tem a possibilidade da realização da eletromiografia EMG e exames complementares como a dosagem do CPK (creatinofosfoquinase) que pode ser usada como triagem em meninos com atraso de desenvolvimento e em recém-nascidos com histórico familiar positivo, também pode ser detectado na sexagem fetal.
A criança com DMD nasce visivelmente saudável, sendo que sua primeira alteração é o atraso motor onde o portador só desenvolve a marcha aos 18 meses de vida, cerca de 30% dos pacientes apresentam dificuldade de aprendizagem e comportamento. (Junior, 2020).
1.4 Deformidades no pé equino.
O pé equino é uma condição ortopédica que afeta a posição normal do pé, caracterizada pela flexão plantar do tornozelo e elevação do calcanhar associada à hipertonia do gastrocnêmio-sóleo sendo similar à de uma posição da pata de um cavalo. Esta condição pode ser congênita ou adquirida, resultando em dificuldades significativas tanto na marcha quanto no equilíbrio.
Essa deformidade pode ocorrer por diversos motivos, como malformações congênitas nos músculos, articulações ou tendões do tornozelo e pé; Anomalias genéticas como a DMD, ou fatores ambientais durante o desenvolvimento fetal. Algumas lesões neurológicas também podem contribuir para adquirir essa condição, como: paralisia cerebral ou lesões medulares que podem afetar os nervos que inervam os músculos do pé, levando ao desenvolvimento do pé equino.
Na DMD há muitos movimentos compensatórios, inclusive em flexão plantar de tornozelo, aumento da base de apoio e anteriorização da cabeça e tronco. Deformidades ortopédicas também são bem comuns, como as das vértebras, articulações, tornozelo, hiperlordose e escápulas aladas. Essas alterações ortopédicas resultam na necessidade da prescrição de órteses e dispositivos auxiliares que ajudam a retardar as deformidades associadas à marcha, (Souza et al., 2024 p. 155. A marcha consiste em fase e ciclos, na qual aproximadamente 60% do pé está em contato com o solo, e a fase de balanço, na qual cerca de 40% do pé não está em contato com a superfície. (Lessa; Gouvêa, 2018, p. 22).
O diagnóstico do pé equino é realizado por meio de exames de imagem como: Raio-x, Ressonância Magnética ou Ultrassom para avaliar estrutura óssea, bem como tecidos moles, também é composto por um exame clínico minucioso para analisar a posição do pé e a amplitude de movimento junto a avaliação neurológica.
Os tratamentos para correção desta condição pode ser diverso e depende da gravidade da condição bem como do estado do portador dela. Podemos citar: Tratamento cirúrgico, fisioterapia e exercícios, acompanhamento e reabilitação, órteses e talas, além da aplicação da toxina botulínica.
Com o avanço da DMD ocorre a diminuição da mobilidade e a perda da deambulação, desta forma o indivíduo com DMD pode desenvolver obesidade. Essa doença traz consequências diretas na biomecânica do paciente. É necessário que o fisioterapeuta atue na adequação postural do paciente na cadeira de rodas quando chegar nessa fase da doença, para evitar a piora do paciente. (Caromano et al., 2010, P 221).
1.5 Tratamento farmacológico.
Alguns tratamentos medicamentosos também são recomendados, como o uso de esteroides, que segundo estudos, contribuem para uma melhora da força muscular, entre eles destaca-se o uso dos corticosteroides que auxiliam na função e força, também contribuem para conservação pulmonar diminuindo o risco de escoliose. (MINISTÉRIO DA SAÚDE, 2022).
1.6 Tratamento fisioterapêutico.
A fisioterapia se torna fundamental no tratamento desses indivíduos, embora a DMD não tenha cura, a terapia possui considerável contribuição na melhora das atividades de vida diária (AVDS) agregando maior independência funcional ao paciente. Destaca-se que para cada portador a abordagem é única e o seu prognóstico deve ser realizado após a anamnese, levando em consideração a redução em relação à exaustão muscular, contraturas e dor: Fazendo a manutenção da força muscular evitando possíveis atrofias, mantendo habilidades funcionais e a função respiratória. (Bonifácio; Matos; Silva, 2024)
Um dos recursos mais utilizados na fisioterapia é a cinesioterapia, que consiste em tratar por meio do movimento, abrangendo tanto a função motora quanto para a respiratória. Ressaltamos também a fisioterapia aquática, onde o aquecimento da água oferece alívio de dores, facilita a mobilidade e torna a terapia agradável especialmente para as crianças, permitindo-lhes realizar atividades que não seriam possíveis em solo firme. (Filho et al.,2010, p23)
As órteses são equipamentos que se definem por ser dispositivo auxiliar na prevenção de deformidades, elas proporcionam alinhamento, suporte e correção postural, o uso da órtese se torna imprescindível para um paciente que é portador de DMD, visto que através dela o paciente pode ter maior independência estendendo a utilidade dos membros inferiores, que são os mais atingidos, corrigindo o encurtamento que advém da patologia. (Zacharia Isaac, 2023).
Alguns estudos científicos vêm mostrando a importância da utilização das órteses para os membros inferiores, são evidenciados o uso da órtese Knee Ankle Foot Orthosis (KAFO) que são utilizadas para joelho, tornozelo e pé e LBB sendo a KAFO a mais aceitável, aparentemente, quando é utilizada o paciente tem contraturas e deformidades menos aparentes. Outra órtese em destaque é a cadeira de rodas visto que por volta dos 10 anos de idade, o portador tenha que fazer o uso devido ao aumento progressivo da fraqueza muscular, inclinação pélvica e escoliose. (Rev. Neurociência, 2012.p 2).
OBJETIVO
Examinar as manobras e/ou protocolos fisioterapêuticos utilizados na prevenção e das deformidades em pé equino.
METODOLOGIA
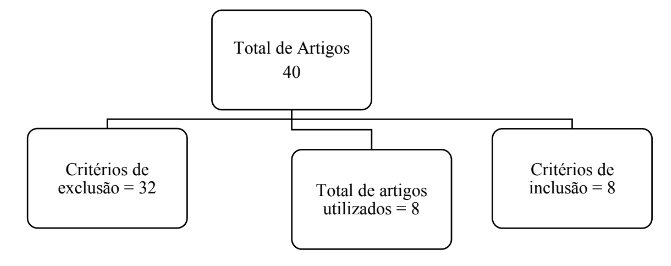
Este estudo trata-se de uma revisão bibliográfica utilizando as bases de dados Scielo, PubMed, Pedro e Ministério da Saúde. Nos idiomas em português, inglês e Espanhol.
Critérios de inclusão.
Os critérios de inclusão foram artigos que apresentam relevância com o tema, que estejam disponíveis nas bases de dados acima citadas e que estejam disponíveis de forma gratuita. Os artigos devem ter no máximo 10 anos de publicação.
Critérios de exclusão.
Os critérios de exclusão foram artigos que não atendiam aos critérios de inclusão, que não estão nas bases de dados Scielo, PubMed, PeDro e Ministério da Saúde e que foram pagos.
A tabela abaixo expressa a análise descritiva dos resultados obtidos nos artigos selecionados:
Autor e Ano Título Método Intervenções Resultado Ana Paula Fraga
Melo, Fabiane Alves de Carvalho, 2011.Efeitos da fisioterapia respiratória na Distrofia Muscular de Duchenne- Relato de Caso. Relato de caso Realização de espirometria, exercícios para fortalecimento da musculatura respiratório e aplicação de
questionário sobre
qualidade de vida.Melhora na
qualidade de vida dos indivíduos e
ganho de força de musculatura respiratória.Samuel Iwao Maia Horita, Felipe Mactavisch da Cruz, 2015. Distrofia muscular de Duchenne: Eventos celulares, teciduais e
tratamento.Apresenta os principais acometimentos celulares e teciduais, tratamentos disponíveis e seus pontos
positivos e
negativos.Fernanda Mendonça Moraes, Regina Célia de Souza Campos Fernandes, Enrique Medina Acosta, 2011. Distrofia muscular de Duchenne: Relato de caso. Relato de caso Análise de exames
laboratoriais,
discussão da clínica do paciente, exame físico.Mostrar a
importância da família no
diagnóstico de DMD, impactos de um diagnóstico tardio.Bruno Mezêncio, Jacielle Carolina Ferreira, Alberto Carlos Amândio, 2021. Biomecânica do movimento
humano.Revisão integrativa. Apresenta a
importância da biomecânica para o movimento
humano, elucida
metodologias e
apresentando seus conceitos.Ana Lúcia Yaeko da Silva Santos, Flaviana Kelly de Lima Maciel,
Francis Meire Fávero,
Luís Fernando Grossklauss,
Cristina dos Santos Cardoso de Sá, 2020.Funcionalidade de membro superior em pacientes
deambuladores e não deambuladores com distrofia
muscular de
Duchenne.Relatório de pesquisa. atividades funcionais com membros superiores,
aplicação de
escalas: função cognitiva miniexame do estado mental (MEEM), funcionalidade dos membros inferiores (escala Vignos)Indivíduos não deambuladores tem piora na
funcionalidade dos membros superiores.Francisca Naiana Amorim Barbosa, Jordano Leite Cavalcante de Macêdo, Maria Karolanede Oliveira Gonçalves, 2021. Relação entre o controle de tronco e a funcionalidade de membro superior em pacientes com disfunções neurológicas: uma revisão sistemática. Revisão sistemática. Aplicação da escala MEEM, avaliação do controle de
tronco com a SATCo-Br (Avaliação Segmentar do Controle de Tronco), escala de Vignos, função dos membros superiores foi testada pelo teste Jebsen Taylor (TJT).Quanto maior o estadiamento da doença pior o controle de tronco, com relação aos
membros
superiores não foi possível
analisar correlação, os indivíduos
conseguiram
escrever e pegar objetos.Bruna Bento dos Santos, Emilly Kelly Silva Monteiro, Tatiane Bonfim Ribeiro, Daniela Oliveira de Melo, 2022. Medicamentos para o tratamento da distrofia muscular de Duchenne. Revisão sistemática. Fátima Aparecida Caromano, Clarice Tanaka, Sílvia Maria Amado João, Ana Patrícia Kamisaki, Kelly Cristina Yano, Maiza Ritomy Ide, 2010. Correlação da
massa e
porcentagem de gordura com a idade na distrofia muscular de Duchenne.Relatório de pesquisa. Medição de peso e de altura, teste de bioimpedância , realização do índice de massa corpórea
(imc).Mostrou que os portadores de DMD apresentam perda de massa magra,
aumento da massa de gordura já está
presente em
indivíduos na faixa etária 09- 11 anos (G2).
Discussão
Tendo em vista os dados expostos, esta pesquisa propõe uma análise referente a atuação do fisioterapeuta em indivíduos acometidos pela DMD, especificamente na prevenção e tratamento da deformidade musculoesquelética de pé equino varo. abordando a história da patologia e as características observadas e quais os recursos utilizados para seu diagnóstico junto aos sinais e sintomas apresentados pelos indivíduos.
A atuação da fisioterapia para esses indivíduos é parte essencial para regressão dos sinais deletérios da patologia trazendo maior qualidade de vida para o paciente, bem como uma equipe multidisciplinar. A partir do diagnóstico a intervenção do fisioterapeuta é fundamental para auxiliar nas atividades de vida diárias e nos movimentos compensatórios desenvolvidos durante o progresso da DMD.
A deformidade pé equino varo é tratada como forma secundária em todos os artigos analisados neste trabalho, sendo o principal foco na maioria dos artigos revisados a perda progressiva da função respiratória. É relatado que o pé equino é desenvolvido ainda na infância pois é mais fácil se estabilizar verticalmente deambulando com as pontas dos pés, porém geralmente essa função pode ser perdida por volta dos 10 anos de idade.
A pesquisa teve enfoque na deformidade do pé equino varo, e em como o tratamento realizado na fisioterapia pode beneficiar esse indivíduo, seja na prevenção ou no tratamento. O pé equino varo é a condição em que o indivíduo realiza uma flexão plantar, mas não consegue realizar a dorsiflexão. Isto ocorre por alterações nos músculos responsáveis pelo movimento de dorsiflexão, sendo o músculo tibial anterior o principal responsável, pé equino varo pode causar problemas na marcha, tornando difícil para o indivíduo andar de maneira eficiente. A postura anormal pode levar a um padrão de marcha compensatório que pode ser menos eficiente e mais cansativo, o que pode causar dores nas articulações e músculos.
A literatura não traz pesquisas com a finalidade de prevenção desta deformidade, seu tratamento vem agregado a terapias que buscam melhora global do membro inferior, mesmo com esta alteração o portador de DMD consegue realizar a marcha, que consiste em fase e ciclos, na qual aproximadamente 60% do pé está em contato com o solo, e a fase de balanço, na qual cerca de 40% do pé não está em contato com a superfície.
Evidências mostram melhora das deformidades em MMII com o uso de órteses, das quais são prescritas por fisioterapeutas, em alguns casos sendo necessário a realização de cirurgias. Com o avanço da doença ocorre a diminuição da mobilidade e a perda da deambulação, desta forma o indivíduo com DMD pode desenvolver obesidade. Essa doença traz consequências diretas na biomecânica do paciente sendo necessário que o fisioterapeuta fique atento nas progressões musculoesquelética que o indivíduo com DMD irá apresentar.
Conclusão
No presente estudo conclui se que não existem estudos voltados para prevenção do pé equino no paciente com DMD, existindo assim a necessidade de novas pesquisas voltadas para o tema proposto nesta pesquisa. Vale ressaltar a importância da fisioterapia no tratamento da DMD de uma forma integrada, onde não observasse somente a parte musculoesquelética, mas respiratória e cardíaca.
Referências
Efeitos da fisioterapia respiratória na Distrofia Muscular de Duchenne – Relato de Caso. Efeitos da fisioterapia respiratória na Distrofia Muscular de Duchenne – Relato de Caso, [s. l.], p. 693, 19 jan. 2010.
HORITA, Samuel Iwao Maia; CRUZ, Felipe Mactavisch da. DISTROFIA MUSCULAR DE DUCHENNE: Eventos Celulares, Teciduais e Tratamentos. Episteme Transversalis, [S.l.], v. 6, n. 2, ago. 2017. ISSN 2236-2649. Disponível em: <http://revista.ugb.edu.br/ojs302/index.php/episteme/article/view/157>. .Acesso em: 25 out. 2023.
MORAES, Fernanda M. et al. Distrofia Muscular de Duchenne: Relato De Caso. Revista Científica da FMC., Brasil, v. 6, n. 2, p. 1-5, 1 jan. 2011. Disponível em: https://revista.fmc.br/ojs/index.php/RCFMC/article/view/100/80. Acesso em: 23 out. 2023.
MEZÊNCIO, Bruno; FERREIRA, Jacielle Carolina; AMADIO, Alberto Carlos. Biomecânica do movimento humano Corpo consciência, v. 25, n. 2, p.87-109, mai./ ago., 2021. Disponível em: https://periodicoscientificos.ufmt.br/ojs/index.php/corpoconsciencia/article/view/12682/ 8324. Acesso em: 02 dez 2023.
SANTOS, Ana L. Y. da S. et al. Funcionalidade de membro superior em pacientes deambuladores e não deambuladores com distrofia muscular de Duchenne. Scielo, Brasil, p. 1-1, 31 jul. 2020. DOI https://doi.org/10.1590/1809-2950/19017427022020. Disponível em: https://www.scielo.br/j/fp/a/zrSR5KDMQw9W3XCBXfvTVhc/#. Acesso em: 25 nov. 2023.
BARBOSA, Francisca N. A. et al. Relação entre o controle de tronco e a funcionalidade de membro superior em pacientes com disfunções neurológicas: Uma Revisão Sistemática. Brazilian Journal of Development, Curitiba – PR, v. 7, ed. 11, p. 109610- 109622, 29 Nov. 2021. DOI 10.34117/bjdv7n11-539. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/40339/pdf. Acesso em: 11 nov. 2023.
PARREIRA, Samara L. S. Qualificação da força muscular e habilidades motoras de pacientes com Distrofia Muscular de Duchenne, em tratamento com corticoterapia. Biblioteca Digital de Teses e Dissertações da USP, São Paulo, sp, p.1-167 ,2005. Disponível em: https://www.teses.usp.br/teses/disponiveis/5/5138/tde-04042006153416/publico/SamaraLamounierSantanaParreira.pdf. Acesso em: 11 nov. 2023
Ministério da saúde. Medicamentos para o tratamento da distrofia muscular de Duchenne. Brasília: Ministério da Saúde, 2022. Cartilha. Disponível em: https://www.gov.br/conitec/ptbr/midias/radar/2022/informemht_distrofiamuscularduche ne.pdf. Acesso em: 30 de janeiro 2024.
CAROMANO, Fátima A. et al. Correlação da massa e porcentagem de gordura com a idade na distrofia muscular de Duchenne. Scielo, Brasil, jun. 2010. DOI https://doi.org/10.1590/S0103-51502010000200006. Disponível em: https://www.scielo.br/j/fm/a/3xSWbTQ5gWfx59mjCQN4hRr/#. Acesso em: 19 nov. 2023.
