REGISTRO DOI: 10.5281/zenodo.6611593
Autores:
Natália Trindade Caires1
Daniele Gonçalves Castilho2
1 Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
2 Docente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
RESUMO
A doença de Alzheimer (DA) é a forma mais comum de demência. É uma doença neurodegenerativa progressiva, que afeta memória, pensamento, cognição e habilidades de linguagem, caracterizada pelo aparecimento de emaranhados neurofibrilares de proteína tau hiperfosforilada e placas neurolíticas, resultado do acúmulo do peptídeo β-amiloide (KARAMAN e BREIJYEH, 2020). A Apolipoproteína E (ApoE) é uma proteína plasmática envolvida no transporte de colesterol e outras moléculas hidrofóbicas. Os alelos polimórficos da Apolipoproteína E são os principais determinantes genéticos do risco da doença de Alzheimer: indivíduos que possuem o alelo ε4 apresentam maior risco de desenvolver a doença, enquanto indivíduos com o alelo ε2 possuem risco reduzido quando comparados com portadores do alelo ε3, o mais comum. (HAMMER et al., 2015; BU et al., 2019). As isoformas ApoE regulam a agregação e depuração de β-amiloide no cérebro, provocando toxidade que pode levar à disfunção sináptica e a neurodegerenação na doença de Alzheimer. Diversos estudos mostram que a ApoE também tem se mostrado patogênica em diversas vias homeostáticas do cérebro, incluindo a neurodegerenação mediada por tau, o transporte de lipídios, integridade e plasticidade sináptica, metabolismo de glicose e função cerebrovascular. (BU et al., 2013; KANDEL et al., 2014)
Palavras-chave: Doença de Alzheimer, Apolipoproteínas, Apolipoproteína E, beta-amiloide.
ABSTRACT
Alzheimer’s disease (AD) is the main form of dementia. It is a progressive neurodegenerative disease that affects memory, thinking, cognition, and language skills, characterized by the appearance of neurofibrillary tangles of hyperphosphorylated tau protein and neurolytic plaques, resulting from the accumulation of the β-amyloid peptide (KARAMAN e BREIJYEH, 2020). Apolipoprotein E (ApoE) is a plasma protein involved in the transport of cholesterol and other hydrophobic molecules. The polymorphic alleles of Apolipoprotein E are the main genetic determinants of the risk of Alzheimer’s disease: individuals who have the ε4 alleles are at higher risk of developing the disease, while individuals with the ε2 allele have a reduced risk when compared to carriers of the ε3 allele, the most common. (HAMMER et al., 2015; BU et al., 2019). ApoE isoforms regulate the aggregation and clearance of β-amyloid in the brain, causing toxicity that can lead to synaptic dysfunction and neurodegeneration in Alzheimer’s disease. Studies show that ApoE has also been shown to be pathogenic in several homeostatic pathways of the brain, including tau-mediated neurodegeneration, lipid transport, synaptic integrity and plasticity, glucose metabolism, and cerebrovascular function. (BU et al., 2013; KANDEL et al., 2014)
Keywords: Alzheimer’s disease, Apolipoproteins, Apolipoprotein E, β-amyloid.
1. INTRODUÇÃO
A doença de Alzheimer é uma doença neurodegenerativa de progressão lenta e fatal, que afeta memória e cognição e causa comprometimento de linguagem, raciocínio e percepção. É o tipo mais comum de demência, responsável por cerca de 70% dos casos em idosos. Atualmente, há cerca de 35 milhões de pessoas diagnosticadas com a doença de Alzheimer, e devido ao aumento da população idosa estima-se que até o ano de 2050 o número de pessoas afetadas pela doença triplique. (VERAS, 2007; BU et al., 2013; MINISTÉRIO DA SAÚDE; OMS)
O diagnóstico da Doença de Alzheimer é baseado no histórico pessoal e familiar do paciente, em testes psicológicos e por exclusão de outros tipos de doenças. Alguns dos critérios diagnósticos são: início gradual com piora progressiva, após os 40 anos de idade e ausência de distúrbios ou lesões cerebrais. Considera-se também alguns biomarcadores, como por exemplo: baixo nível de beta-amiloide no líquido cerebrospinal, depósitos beta-amiloides e/ou proteína tau detectados por imagens PET e atrofia nos lobos temporais mediais, basais e laterais, detectada por ressonância magnética. A sobrevida média oscila entre 8 e 10 anos e o quadro clínico costuma ser dividido em quatro estágios (Tabela 1). (BU et al., 2013; MINISTÉRIO DA SAÚDE)
TABELA 1 – ESTÁGIOS DA DOENÇA DE ALZHEIMER
ESTÁGIO SINTOMAS Estágio 1 (inicial) Alterações de memória, personalidade e habilidades espaciais e visuais Estágio 2 (moderado) Dificuldade para falar, realizar tarefas simples e coordenar movimentos Estágio 3 (grave) Resistência à execução de tarefas diárias e deficiência motora progressiva Estágio 4 (terminal) Infecções intercorrentes e restrição ao leito
A doença de Alzheimer é caracterizada pela presença de emaranhados neurofibrilares de proteína tau hiperfosforilada e por placas neurolíticas, resultado de acúmulo do peptídeo β-amiloide (βA) em estruturas cerebrais, como as neocorticais e o lobo temporal medial. A demência na doença de Alzheimer está associada à neurodegerenação, inicialmente caracterizada por lesão sináptica, seguida de perda neuronal. Na doença de Alzheimer o encéfalo apresenta-se atrofiado, com peso reduzido, giros estreitos e sulcos alargados. (STAVLJENIC–RUKAVINA, 2004; KANDEL et al., 2014; KARAMAN e BREIJYEH, 2020)
O córtex cerebral e as paredes dos vasos meníngeos e cerebrais apresentam placas neurolíticas de material amiloide cercadas por axônios e dendritos inchados, decorrente de inflamação por astrócitos reativos e micróglia. Também são formados emaranhados neurofibrilares, que são inclusões filamentosas nos corpos celulares e dendritos que contém filamentos helicoidais pareados e retos. A perda neuronal e sináptica, astrocitose reativa e proliferação da micróglia são outras alterações estruturais presentes. (STAVLJENIC–RUKAVINA, 2007; KARAMAN e BREIJYEH, 2020)
Uma das principais características da doença de Alzheimer é a formação de placas senis, devido ao acúmulo de peptídeos beta-amilóide, que se agrupam nos vasos sanguíneos e na superfície externa dos neurônios, ocasionando morte neuronal. O peptídeo β-amilóide é criado pelo corte enzimático da proteína percursora amilóide (APP), uma proteína de membrana do neurônio. As enzimas podem cortar a APP de modo que não acarrete a formação de βA. (STAVLJENIC–RUKAVINA, 2004; KANDEL et al., 2014; KARAMAN e BREIJYEH, 2020)
Na doença de Alzheimer, entretanto, o corte enzimático não apenas resulta na formação de βA, como pode resultar em duas formas diferentes de peptídeos β-amilóide, uma com 40 e outra com 42 aminoácidos. A formação de βA é regulada pelas enzimas secretases, que competem para clivar a APP e causar a formação de placas amilóides. A α-secretase cliva a APP de uma maneira que o βA42 não é formado. A β-secretase, no entanto, cliva a APP, podendo formar o peptídeo βA de 40 aminoácidos ou o peptídeo β-amilóide de 42 aminoácidos, que se aglomera formando placas amilóides insolúveis. Estudos mostraram que o βA42 é mais tóxico, forma núcleos de fibrilas amilóides mais rápido e a deposição amilóide se inicia antes que o βA40. (STAVLJENIC–RUKAVINA, 2004; KANDEL et al., 2014; HAMMER, 2015; KARAMAN e BREIJYEH, 2020)
Após a formação da placa amilóide, ocorrem dois processos importantes na morte neuronal: a inflamação e a formação de emaranhados neurofibrilares. As principais células cerebrais que participam do processo inflamatório, os astrócitos e a micróglia, estão presentes em grande quantidade. Na doença de Alzheimer, o número de astrócitos está aumentado e ativado para produzir prostaglandina, levando à inflamação mediada pelo ácido araquidônico. (STAVLJENIC–RUKAVINA, 2004; KANDEL et al., 2014; HAMMER, 2015; KARAMAN e BREIJYEH, 2020)
Os nutrientes e os componentes de regulação celular são transportados ao longo dos microtúbulos, que possuem sua integridade celular estabilizada pela proteína tau. A presença de β-amilóide na doença de Alzheimer leva os neurônios a hiperfosforilar a proteína Tau, que perde sua capacidade de se ligar aos microtúbulos, ligando-se entre si e formando filamentos helicoidais emparelhados, os emaranhados neurofibrilares. Com a dinâmica microtubular comprometida, o transporte intraneural é afetado, ocasionando efeitos deletérios nos processos celulares. (STAVLJENIC–RUKAVINA, 2004; KANDEL et al., 2014; BU et al., 2014; HAMMER, 2015; KARAMAN e BREIJYEH, 2020)
Estudos recentes mostraram que mutações nos genes APP (proteína percursora amilóide), ApoE (Apolipoproteína E), PS-1 (presenilina 1) e PS-2 (presenilina 2) foram encontradas na doença de Alzheimer, resultando em níveis elevados de β-amilóide. O polimorfismo do gene da Apolipoproteína E (ApoE) é o principal fator de suscetibilidade para a doença de Alzheimer. A Apolipoproteína E é uma glicoproteína envolvida no transporte de colesterol e no metabolismo de partículas de lipoproteínas, no cérebro é responsável por regular a agregação e depuração de β-amiloide. Existem três alelos principais do gene ApoE: ε3, presente em aproximadamente 77,9% da população, ε4, em 13,7% da população e o alelo ε2, com frequência mundial de cerca de 8,4%. A isoforma ApoE ε4 é o fator de risco genético mais forte para a doença de Alzheimer: indivíduos que possuem um alelo ε4 possuem duas a três vezes mais chances de desenvolver a doença, e em indivíduos com os dois alelos ε4, o risco aumenta para 12 vezes. Além disso, a ApoE ε4 provoca toxidade, neurodegerenação mediada por TAU, além de interferir no metabolismo de glicose e na função cerebrovascular. (KANDEL et al., 2014; BU et al., 2013; BU et al., 2019 KARAMAN e BREIJYEH, 2020).
Atualmente, existem apenas duas classes de medicamentos aprovados para o tratamento da doença de Alzheimer, eficazes apenas no tratamento dos sintomas da doença de Alzheimer, mas não curam ou previnem a doença. O conhecimento sobre as vias relacionadas à ApoE na fisiopatologia do Alzheimer nos apresenta novas oportunidades para a terapia da doença de Alzheimer (CREWS, 2010; KARAMAN, BREIJYEH, 2020)
2. OBJETIVOS
2.1 Objetivo Geral
Compreender através de uma revisão de literatura a associação entre a Apolipoproteína E e o risco de declínio cognitivo na doença de Alzheimer.
2.2 Objetivos Específicos
◉ Entender os mecanismos moleculares da Doença de Alzheimer;
◉ Descrever as funções e isoformas da Apolipoproteína E;
Analisar a isoforma ApoE ε4 como fator de risco para a doença de Alzheimer;
◉ Apurar a relação entre a ApoE ε4 e o aumento na deposição de β-amilóide;
◉ Explorar possíveis terapias.
3. METODOLOGIA
Trata-se de uma pesquisa bibliográfica sistemática, com finalidade básica estratégica. Revisão bibliográfica sistemática é considerada por Levy e Ellis (2006) o processo de coletar, conhecer, compreender, analisar, sintetizar e avaliar um conjunto de artigos científicos com o propósito de criar um embasamento teórico-científico sobre um determinado tópico ou assunto pesquisado.
O método de pesquisa utilizado foi o qualitativo. Para que o estudo fosse possível, houve um levantamento bibliográfico sobre os mecanismos patológicos da doença de Alzheimer, o papel da Apolipoproteína E (ApoE) na doença de Alzheimer, o alelo E4 da Apolipoproteína E como fator de risco para a doença de Alzheimer, imunoterapia e regulação da Apolipoproteína E. As bases de dados utilizadas foram: PubMed, Scielo, Science Direct, Biblioteca Virtual em Saúde, Periódicos Capes, Minha Biblioteca, Medline e Google Acadêmico. Os seguintes termos foram utilizados para pesquisa: Alzheimer, Apolipoproteína E, ApoE ε4, β-amiloide, Regulação da ApoE. Os principais autores que contribuíram para o trabalho foram Guojun Bu, David Holtzman, Eric Kandel, Na Zhao, Chia-Chen Liu, Rafik Karaman e Ana Stavljenic–Rukavina.
4. DESENVOLVIMENTO
4.1 Apolipoproteína E
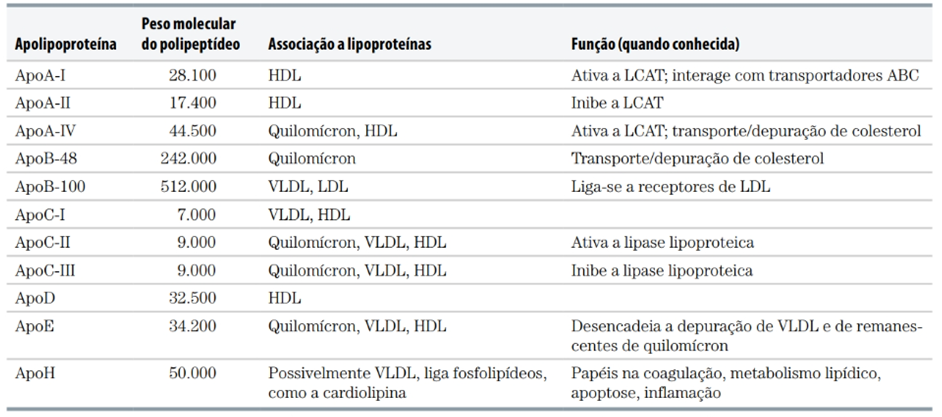
No plasma sanguíneo, o colesterol é transportado como lipoproteína plasmática – um complexo de proteínas transportadoras específicas, as apolipoproteínas, que quando combinadas com lipídios, formam diversas classes de partículas lipoproteicas. As apolipoproteínas atuam como sinalizadores, ativando enzimas que agem nas lipoproteínas. Pelo menos dez apolipoproteínas são encontradas nas lipoproteínas do plasma humano (Tabela 2), se diferenciando por tamanho, reações com anticorpos e distribuição nas classes de lipoproteínas. (MAHLEY, 2000; KANEKIYO et al., 2014, NELSON et al., 2019; BU et al., 2019)
TABELA 2 – APOLIPOPROTEÍNAS DAS LIPOPROTEÍNAS PLASMÁTICAS HUMANAS
A Apolipoproteína E é uma glicoproteína de 299 aminoácidos que possui ligação com as lipoproteínas de alta densidade (HDLs), de muita baixa densidade (VLDLs), quilomícrons remanescentes e atua principalmente no transporte reverso do colesterol, agindo na remoção dos resíduos dos quilomícrons e VLDs circulantes. A ApoE secretada é lipidada pelos transportadores ABCA1 e ABCG1, que transportam o colesterol celular e os fosfolipídios para a ApoE, formando partículas de lipoproteínas. A síntese de ApoE ocorre principalmente no fígado, seguido do cérebro, baço, rins e glândulas suprarrenais. No cérebro é expressa principalmente pelos astrócitos e micróglia e é a principal apolipoproteína de HDL no Sistema Nervoso Central (SNC). (BU et al., 2009; MAHLEY et al.,2000; CHRISTENSEN et al., 2010; BU et al., 2013; NELSON et al., 2019)
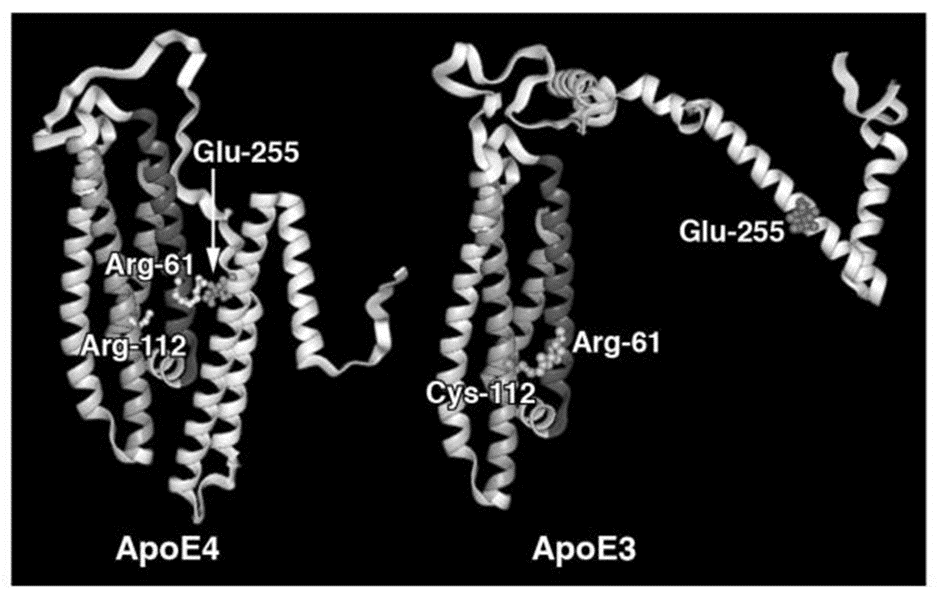
A ApoE possui três isoformas que diferem umas das outras nas posições 112 e 158, são elas: ApoE ε2 (112: cisteína, 158: cisteína), ApoE ε3 (112: cisteína, 158: arginina) ApoE ε4 (112: arginina, 158: arginina). Na apoE ε4, a arginina 112 orienta a cadeia lateral da arginina 61 para o meio aquoso, podendo interagir com o ácido glutâmico 255, resultando na interação entre os domínios N-terminal e C-terminal. Na apoE ε3, a arginina 61 não está disponível para interagir com os resíduos no domínio C-terminal, resultando em uma conformação geral diferente (Figura 1). Esses polimorfismos são capazes de alterar a estrutura e a função da APOE, modulando suas propriedades de ligação em relação a lipídios e receptores. O alelo ε4 aumenta em 2 a 3 vezes o risco de Doença de Alzheimer, e em indivíduos que possuem dois alelos ε4, o risco aumenta para 12 vezes. (BU et al., 2009; RANNIKMAE et al., 2014; HUANG et al., 2014; SHINOHARA et al., 2016; LIM et al., 2017; NELSON et al., 2019)
FIGURA 1 – DIFERENÇAS ENTRE APOE Ε4 E APOE Ε3
4.2 Patologia amilóide
Na doença de Alzheimer, peptídeos beta-amilóide se agrupam nos vasos sanguíneos e superfície externa dos neurônios, formando placas amilóides e ocasionando morte neuronal. Pesquisas realizadas em tecidos cerebrais post-mortem de pacientes com Doença de Alzheimer descobriram que a ApoE ε4 acentua o acúmulo intraneural de β-amiloide, a deposição de placas no parênquima cerebral e a formação de oligômeros neurotóxicos de β-amiloide. Também foi descoberto que a ApoE ε4 está associada a uma maior deposição de β-amiloide no cérebro de idosos cognitivamente saudáveis e com comprometimento cognitivo leve, no entanto não foram observadas diferenças entre os genótipos ApoE na deposição de β-amiloide em indivíduos com a patologia amilóide. Esses resultados sugerem que o efeito da ApoE ε4 no metabolismo e agregação de β-amiloide é mais pronunciado durante a fase inicial de acúmulo β-amiloide. (BU et al., 2009; KOFFIE et al., 2012; RANNIKMAE et al., 2014; SHINOHARA et al., 2016; LIM et al., 2017; BU et al., 2019)
Por outro lado, a ApoE ε2 foi associada à redução da deposição cerebral de β-amiloide em idosos cognitivamente saudáveis e com comprometimento cognitivo leve. A ApoE ε2 também mostrou efeito protetor contra o acúmulo longitudinal de β-amiloide, principalmente entre indivíduos sem deposição amilóide. (RANNIKMAE et al., 2014; SHINOHARA et al., 2016; LIM et al., 2017; BU et al., 2019)
Evidências indicam que o efeito patológico da ApoE ε4 supere o efeito protetor da ApoE ε2. Em indivíduos cognitivamente saudáveis e com comprometimento cognitivo leve, a prevalência de patologia amilóide foi maior em indivíduos com ApoE ε2/ ε4 do que os que possuem ApoE ε3/ ε3, mostrando que ApoE ε4 impulsiona a deposição de β-amiloide independente da presença de ApoE ε2 ou ApoE ε3. (SHINOHARA et al., 2016; LIM et al., 2017; BU et al., 2019)
A captação celular e a degradação de β-amiloide pela micróglia também são influenciadas diferencialmente pelas várias isoformas de ApoE. A degradação de peptídeos β-amiloide pela neprilisina dentro da micróglia é marcadamente facilitada na presença de ApoE, sendo ApoE ε4 menos eficiente em promover a degradação de β-amiloide solúvel do que ApoE ε2 e APOE ε3. Além disso, o efluxo de colesterol mediado por ApoE facilita a entrega de β-amiloide aos lisossomos e aumenta a eficiência da degradação de β-amiloide intracelular na micróglia. (RANNIKMAE et al., 2014; SHINOHARA et al., 2016; LIM et al., 2017; BU et al., 2019)
4.3 Agregação TAU
Nutrientes e componentes de regulação celular são transportados ao longo dos microtúbulos, que possuem sua integridade celular estabilizada pela proteína tau. Na Doença de Alzheimer os neurônios hiperfosforilam a proteína Tau, que perde sua capacidade de se ligar aos microtúbulos, ligando-se entre si e formando filamentos helicoidais emparelhados, os emaranhados neurofibrilares (NFTs). (CRARY et al., 2014; FARFEL et al., 2016; LEYNS et al., 2017)
Estudos mostraram que indivíduos com patologia amilóide portadores de dois alelos APOE ε4 têm mais agregados tau do que aqueles que carregam um ou nenhum alelo ε4. Além disso, a superexpressão de ApoE ε4 aumenta a fosforilação tau em camundongos, que desenvolveram mais atrofia cerebral e neuroinflamação que camundongos com ApoE ε2 ou ApoE ε3. Esses resultados sugerem que a ApoE influencia a patologia tau e toxidade neuronal mediada por tau de maneira dependente da isoforma. (CRARY et al., 2014; FARFEL et al., 2016; LEYNS et al., 2017)
4.4 Neuroinflamação
A neurodegerenação na Doença de Alzheimer é caracterizada inicialmente por lesão sináptica seguida de perda neuronal. Os astrócitos e micróglia estão presentes em grande quantidade e ativados para produzir prostaglandina, levando à inflamação mediada pelo ácido araquidônico. (KEENE et al., 2011; KANDEL et al., 2014; BU et al., 2019; KARAMAN e BREIJYEH, 2020)
Estudos sugerem que a ApoE seja capaz de modular as funções microgliais de maneira diferente na Doença de Alzheimer, tendo sido relatado morfologia alterada da micróglia e níveis reduzidos de fagocitose de β-amiloide em ApoE ε4 quando comparada com APOE ε3. A Apolipoproteína E4 também aumentou a ativação pró-inflamatória microglial e neurodegerenação em camundongos com patologia tau 12. É possível que a composição da ApoE ε4 afete as estruturas lipídicas nas membranas das células microgliais, induzindo um fenótipo DAM mais forte, e exacerbando a patogênese e neurodegerenação de β-amiloide ou tau. (KEENE et al., 2011; ULRICH et al., 2018; RANGARAJU et al., 2018)
4.5 Metabolismo da glicose
O hipometabolismo da glicose cerebral é um biomarcador precoce da Doença de Alzheimer, existente muito antes do início clínico da doença. Em comparação com indivíduos clinicamente saudáveis, pacientes com Alzheimer apresentam níveis alterados de insulina, assim como de seus receptores. Nas áreas do cérebro frequentemente afetadas na Doença de Alzheimer, os portadores de ApoE ε4 apresentam menor metabolismo cerebral de glicose que os não portadores. Estudos epidemiológicos também confirmaram que resistência à insulina e diabetes são fatores de risco para a doença. (Morris et al., 2017; Geijselaers et al., 2018; BU et al., 2019)
A ApoE ε4 interage com os receptores de insulina e os prende nos endossomos, prejudicando o tráfego do receptor de insulina e provocando reduções no metabolismo cerebral da glicose e na sinalização da insulina. Estudos associaram níveis aumentados de insulina com níveis aumentados de TAU total e TAU fosforilada no Líquido Cefalorraquidiano (LCR) de portadores de ApoE ε4. Estudos pré-clínicos com camundongos revelaram que as isoformas ApoE influenciam o metabolismo de glicose cerebral e a sinalização de insulina de maneira diferente. Em comparação com camundongos APOE ε3, camundongos ApoE ε4 apresentaram sinalização de insulina cerebral prejudicada e resistência à insulina, além de baixa regulação da sinalização do receptor γ ativado pelo proliferador de peroxissoma cerebral e do coativador PPARγ 1, envolvidos na regulação da captação e metabolismo de glicose. (Morris et al., 2017; Geijselaers et al., 2018; BU et al., 2019)
4.6 Função cerebrovascular
A ApoE ε4 pode modular a função cerebrovascular exercendo ações diretamente nas células endoteliais que formam a barreira hematoencefálica. Estudos mostraram que camundongos ApoE ε4 possuem fluxo sanguíneo cerebral reduzido, menor densidade vascular e acoplamento neurovascular em comparação com camundongos ApoE ε2 ou ApoE ε3. Outro estudo mostrou que camundongos ApoE ε4 também são mais propensos à hipoperfusão cerebral, lesão da substância branca e comprometimento cognitivo induzido por estenose bilateral da artéria carótida, quando comparados a camundongos ApoE ε3. Esses achados sugerem que a ApoE ε4 é menos eficiente que a ApoE ε2 ou ApoE ε3 na manutenção da homeostase cerebrovascular. (BELL et al., 2012; ALATA et al., 2015; KOIZUMI et al., 2018; BU et al., 2019)
4.7 Genótipo APOE para medicina de precisão
A medicina de precisão tem como objetivo adaptar as intervenções terapêuticas à predisposição de um indivíduo à doença, progressão e resposta à terapia. Estratégias de intervenção médica guiadas pelo polimorfismo da ApoE podem ser promissoras no tratamento da Doença de Alzheimer. (CASELLI et al., 2009; CASELLI et al., 2011; HEAD et al., 2012; BONHAM et al., 2016; STOCKER et al., 2018)
Mesmo em indivíduos cognitivamente saudáveis, a presença de ApoE ε4 é relacionada com maior declínio de memória. No entanto, educação avançada e atividades de lazer constantes são capazes de reduzir o risco de declínio cognitivo mediado pela ApoE. Já um estilo de vida sedentário está associado a uma maior deposição de beta amiloide. (REGER et al., 2008; BUGG, 2012; SALLOWAY et al., 2014; MONTINE et al., 2015; ESCOTT et al., 2017; STOCKER et al., 2018; BU et al., 2019)
A genotipagem ApoE pode ser útil na avaliação do risco de Alzheimer. Se o início da patologia β-amiloide for detectado precocemente, diferentes tipos de intervenções podem ser considerados a partir do genótipo ApoE do paciente. (REGER et al., 2008; SALLOWAY et al., 2014; MONTINE et al., 2015; ESCOTT et al., 2017; STOCKER et al., 2018; BU et al., 2019)
Em vários estudos clínicos, portadores e não portadores de ApoE ε4 responderam de forma diferente ao tratamento para Doença de Alzheimer. Em ensaios de fase III de bapineuzumab, um anticorpo monoclonal anti-βA humano, em indivíduos com Alzheimer leve a moderada, a ApoE ε4 foi associada a diferenças nos resultados de biomarcadores, como metabolismo de β-amiloide e patologia tau. Em portadores de ApoE ε4, a deposição de β-amiloide detectada por PET permaneceu inalterada em indivíduos tratados com bapineuzumab (0,5 mg kg –1), enquanto os indivíduos que receberam placebo apresentaram aumento na deposição de β-amiloide ao longo de 71 semanas. Por outro lado, em indivíduos não portadores de ApoE ε4, nenhum aumento na deposição de β-amiloide foi observado nos grupos placebo e não houve diferença entre o grupo placebo e os indivíduos que receberam 0,5 mg/kg ou 1,0 mg/kg de bapineuzumab. (REGER et al., 2008; SALLOWAY et al., 2014; MONTINE et al., 2015; MISHRA et al., 2018; BU et al., 2019)
5. CONCLUSÃO
O trabalho resumido nessa revisão destaca evidências clínicas para a associação entre a Apolipoproteína E e a Doença de Alzheimer. A ApoE ε2 e a ApoE ε4 diferem da ApoE ε3 por uma única substituição de aminoácidos, o que resulta em impactos extremamente diferentes no risco e nos resultados da doença. Os portadores de ApoE ε4 tem declínio cognitivo acelerado e patologia aumentada na Doença de Alzheimer superior aos não portadores. (BU et al., 2019)
Alterações na interação da ApoE com seus receptores ou com proteínas envolvidas na patogênese da doença estão correlacionadas com a desaceleração ou aceleração da progressão da doença de Alzheimer. Além disso, a ApoE interage diretamente com o peptídeo beta-amiloide, a proteína Tau, e alfa-sinucleína, contribuindo para a formação de agregados de proteínas. O direcionamento da ApoE e suas interações patogênicas nos proporciona uma via para prevenção e/ou tratamento da Doença de Alzheimer. (CHRISTENSEN, 2010; Kandel et al., 2014)
REFERÊNCIAS BIBLIOGRÁFICAS
ALATA, Wael et al. Human Apolipoprotein E ε4 Expression Impairs Cerebral Vascularization and Blood—Brain Barrier Function in Mice. Journal of Cerebral Blood Flow & Metabolism, v. 35, n. 1, p. 86-94, 22 out. 2014. Disponível em: https://doi.org/10.1038/jcbfm.2014.172. Acesso em: 12 maio 2022.
BELL, Robert D. et al. Apolipoprotein E controls cerebrovascular integrity via cyclophilin A. Nature, v. 485, n. 7399, p. 512-516, maio 2012. Disponível em: https://doi.org/10.1038/nature11087. Acesso em: 12 maio 2022.
BONHAM, Luke W. et al. Age‐dependent effects of APOE ε4 in preclinical Alzheimer’s disease. Annals of Clinical and Translational Neurology, v. 3, n. 9, p. 668-677, 26 ago. 2016. Disponível em: https://doi.org/10.1002/acn3.333. Acesso em: 12 maio 2022.
BREIJYEH; KARAMAN. Comprehensive Review on Alzheimer’s Disease: Causes and Treatment. National Library of Medicine, Jerusalém, v. 25, n. 24, p. 1-28, dez./2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7764106/pdf/molecules-25-05789.pdf. Acesso em: 4 set. 2021.
BU, G. et al. Apolipoprotein E and Alzheimer disease: pathobiology and targeting strategies. Nature, Jacksonville, v. 15, n. 15, p. 501-589, jul./2019. Disponível em: https://www.nature.com/articles/s41582-019-0228-7. Acesso em: 2 set. 2021.
BU, G. et al. Apolipoprotein E and Alzheimer disease: Risk, mechanisms and therapy. Nature, Jacksonville, v. 9, n. 1, p. 106-118, jan./2013. Disponível em: https://www.nature.com/articles/nrneurol.2012.263. Acesso em: 7 set. 2021.
BU, Guojun. Apolipoprotein E and its receptors in Alzheimer’s disease: pathways, pathogenesis and therapy. Nature Reviews Neuroscience, v. 10, n. 5, p. 333-344, 2 abr. 2009. Disponível em: https://doi.org/10.1038/nrn2620. Acesso em: 12 maio 2022.
BUGG, Julie M. Exercise Engagement as a Moderator of the Effects of APOE Genotype on Amyloid Deposition. Archives of Neurology, v. 69, n. 5, p. 636, 1 maio 2012. Disponível em: https://doi.org/10.1001/archneurol.2011.845. Acesso em: 12 maio 2022.
CASELLI, R. J. et al. Longitudinal modeling of frontal cognition in APOE 4 homozygotes, heterozygotes, and noncarriers. Neurology, v. 76, n. 16, p. 1383-1388, 18 abr. 2011. Disponível em: https://doi.org/10.1212/wnl.0b013e3182167147. Acesso em: 12 maio 2022.
CASELLI, Richard J. et al. Longitudinal Modeling of Age-Related Memory Decline and theAPOEε4 Effect. New England Journal of Medicine, v. 361, n. 3, p. 255-263, 16 jul. 2009. Disponível em: https://doi.org/10.1056/nejmoa0809437. Acesso em: 12 maio 2022.
CHRISTENSEN, Ditte Z. et al. Accumulation of intraneuronal Aβ correlates with ApoE4 genotype. Acta Neuropathological, v. 119, n. 5, p. 555-566, 10 mar. 2010. Disponível em: https://doi.org/10.1007/s00401-010-0666-1. Acesso em: 12 maio 2022.
CRARY, John F. et al. Primary age-related tauopathy (PART): a common pathology associated with human aging. Acta Neuropathologica, v. 128, n. 6, p. 755-766, 28 out. 2014. Disponível em: https://doi.org/10.1007/s00401-014-1349-0. Acesso em: 10 março 2022.
CREWS, Leslie; MASLIAH, Eliezer. Molecular mechanisms of neurodegeneration in Alzheimer’s disease. Oxford University Press, Oxford, v. 19, n. 1, p. 12-20, abr./2010.
ESCOTT-PRICE, Valentina et al. Polygenic risk score analysis of pathologically confirmed Alzheimer disease. Annals of Neurology, v. 82, n. 2, p. 311-314, ago. 2017. Disponível em: https://doi.org/10.1002/ana.24999. Acesso em: 12 maio 2022.
FARFEL, Jose M. et al. Association of APOE with tau-tangle pathology with and without β-amyloid. Neurobiology of Aging, v. 37, p. 19-25, jan. 2016. Disponível em: https://doi.org/10.1016/j.neurobiolaging.2015.09.011. Acesso em: 30 março 2022.
GEIJSELAERS, Stefan L. C. et al. Association of Cerebrospinal Fluid (CSF) Insulin with Cognitive Performance and CSF Biomarkers of Alzheimer’s Disease. Journal of Alzheimer’s Disease, v. 61, n. 1, p. 309-320, 28 nov. 2017. Disponível em: https://doi.org/10.3233/jad-170522. Acesso em: 12 maio 2022.
HAMMER, Gary D; MCPHEE, Stephen J. Fisiopatologia da Doença: Uma introdução à medicina clínica. 7. ed. Porto Alegre: Artmed, 2015. p. 177-179
HUANG, Yadong; MAHLEY, Robert W. Apolipoprotein E: Structure and function in lipid metabolism, neurobiology, and Alzheimer’s diseases. Neurobiology of Disease, v. 72, p. 3-12, dez. 2014. Disponível em: https://doi.org/10.1016/j.nbd.2014.08.025. Acesso em: 30 maio 2022
KANDEL, Eric; SCHWARTZ, James; JESSELL, Thomas. Princípios de Neurociências. 5. ed. Porto Alegre: AMGH, 2014. p. 1163-1172.
KANEKIYO, Takahisa; XU, Huaxi; BU, Guojun. ApoE and Aβ in Alzheimer’s Disease: Accidental Encounters or Partners? Neuron, v. 81, n. 4, p. 740-754, fev. 2014. Disponível em: https://doi.org/10.1016/j.neuron.2014.01.045. Acesso em: 12 maio 2022.
KEENE, C. Dirk et al. Apolipoprotein E isoforms and regulation of the innate immune response in brain of patients with Alzheimer’s disease. Current Opinion in Neurobiology, v. 21, n. 6, p. 920-928, dez. 2011. Disponível em: https://doi.org/10.1016/j.conb.2011.08.002. Acesso em: 30 março 2022.
KOFFIE, Robert M. et al. Apolipoprotein E4 effects in Alzheimer’s disease are mediated by synaptotoxic oligomeric amyloid-β. Brain, v. 135, n. 7, p. 2155-2168, 25 maio 2012. Disponível em: https://doi.org/10.1093/brain/aws127. Acesso em: 12 maio 2022.
KOIZUMI, Kenzo et al. Apoε4 disrupts neurovascular regulation and undermines white matter integrity and cognitive function. Nature Communications, v. 9, n. 1, 19 set. 2018. Disponível em: https://doi.org/10.1038/s41467-018-06301-2. Acesso em: 12 maio 2022.
LEVY, Y.; ELLIS, T.J. A system approach to conduct an effective literature review in support of information systems research. Informing Science Journal, v.9, p.181-212, 2006. Disponível em: http://www.inform.nu/Articles/Vol9/V9p181-212Levy99.pdf. Acesso em: 6 set. 2021.
LEYNS, Cheryl E. G.; HOLTZMAN, David M. Glial contributions to neurodegeneration in tauopathies. Molecular Neurodegeneration, v. 12, n. 1, 29 jun. 2017. Disponível em: https://doi.org/10.1186/s13024-017-0192-x. Acesso em: 10 março 2022.
LIM, Yen Ying; MORMINO, Elizabeth C. APOE genotype and early β-amyloid accumulation in older adults without dementia. Neurology, v. 89, n. 10, p. 1028-1034, 9 ago. 2017. Disponível em: https://doi.org/10.1212/wnl.0000000000004336. Acesso em: 12 maio 2022.
MAHLEY, Robert W.; RALL, Stanley C. APOLIPOPROTEINE: Far More Than a Lipid Transport Protein. Annual Review of Genomics and Human Genetics, v. 1, n. 1, p. 507-537, set. 2000. Disponível em: https://doi.org/10.1146/annurev.genom.1.1.507. Acesso em: 12 maio 2022.
MINISTÉRIO DA SAÚDE. Doença de Alzheimer. Disponível em: https://portalarquivos2.saude.gov.br/images/pdf/2014/abril/02/pcdt-doenca-de-alzheimer-livro-2013.pdf. Acesso em: 31 ago. 2021.
MISHRA, Shruti et al. Longitudinal brain imaging in preclinical Alzheimer disease: impact of APOE ε4 genotype. Brain, v. 141, n. 6, p. 1828-1839, 17 abr. 2018. Disponível em: https://doi.org/10.1093/brain/awy103. Acesso em: 12 maio 2022.
MONTINE, Thomas J.; MONTINE, Kathleen S. Precision medicine: Clarity for the clinical and biological complexity of Alzheimer’s and Parkinson’s diseases. Journal of Experimental Medicine, v. 212, n. 5, p. 601-605, 4 maio 2015. Disponível em: https://doi.org/10.1084/jem.20150656. Acesso em: 12 maio 2022.
MORRIS, Jill K. et al. Effect of APOE ε4 Genotype on Metabolic Biomarkers in Aging and Alzheimer’s Disease. Journal of Alzheimer’s Disease, v. 58, n. 4, p. 1129-1135, 23 jun. 2017. Disponível em: https://doi.org/10.3233/jad-170148. Acesso em: 12 maio 2022.
NELSON, David L. Princípios de Bioquímica de Lehninger. 7.ed. ed. Porto Alegre: Artmed/Panamericana Editora Ltda, 2019.
RANGARAJU, Srikant et al. Identification and therapeutic modulation of a pro-inflammatory subset of disease-associated-microglia in Alzheimer’s disease. Molecular Neurodegeneration, v. 13, n. 1, 21 maio 2018. Disponível em: https://doi.org/10.1186/s13024-018-0254-8. Acesso em: 10 março 2022.
RANNIKMAE, K. et al. APOE associations with severe CAA-associated vasculopathic changes: collaborative meta-analysis. Journal of Neurology, Neurosurgery & Psychiatry, v. 85, n. 3, p. 300-305, 25 out. 2013. Disponível em: https://doi.org/10.1136/jnnp-2013-306485. Acesso em: 12 maio 2022.
REGER, Mark A. et al. Intranasal Insulin Administration Dose-Dependently Modulates Verbal Memory and Plasma Amyloid-β in Memory-Impaired Older Adults. Journal of Alzheimer’s Disease, v. 13, n. 3, p. 323-331, 14 abr. 2008. Disponível em: https://doi.org/10.3233/jad-2008-13309. Acesso em: 12 maio 2022.
SALLOWAY, Stephen et al. Two Phase 3 Trials of Bapineuzumab in Mild-to-Moderate Alzheimer’s Disease. New England Journal of Medicine, v. 370, n. 4, p. 322-333, 23 jan. 2014. Disponível em: https://doi.org/10.1056/nejmoa1304839. Acesso em: 12 maio 2022.
SHINOHARA, Mitsuru et al. Impact of sex and APOE4 on cerebral amyloid angiopathy in Alzheimer’s disease. Acta Neuropathologica, v. 132, n. 2, p. 225-234, 14 maio 2016. Disponível em: https://doi.org/10.1007/s00401-016-1580-y. Acesso em: 12 maio 2022.
STAVLJENIC–RUKAVINA, Ana. Molecular Mechanisms in Alzheimer’s Disease. The Journal of the International Federation of Clinical Chemistry, Croatia, v. 15, n. 3, p. 100-103, ago. 2004.
STOCKER, Hannah et al. The genetic risk of Alzheimer’s disease beyond APOE ε4: systematic review of Alzheimer’s genetic risk scores. Translational Psychiatry, v. 8, n. 1, 24 ago. 2018. Disponível em: https://doi.org/10.1038/s41398-018-0221-8. Acesso em: 12 maio 2022.
ULRICH, Jason D. et al. ApoE facilitates the microglial response to amyloid plaque pathology. Journal of Experimental Medicine, v. 215, n. 4, p. 1047-1058, 26 fev. 2018. Disponível em: https://doi.org/10.1084/jem.20171265. Acesso em: 10 março 2022.
VERAS, R. P. et al. Avaliação dos gastos com o cuidado do idoso com demência. Revista de Psiquiatria Clínica, São Paulo, v. 34, n. 1, p. 5-12, mai./2007. Disponível em: https://www.scielo.br/j/rpc/a/XLBMGpTHGSkNsqRpnbWpbdv/?format=pdf&lang=pt. Acesso em: 20 out. 2021.
