TRASTUZUMAB MONOCLONAL ANTIBODY AS A BIOSIMILAR DRUG IN THE TREATMENT OF METASTATIC BREAST CANCER
REGISTRO DOI: 10.69849/revistaft/cs10202512282340
Nicolle D’Ajuda de Souza1
Mariana Moreira Andrade2
RESUMO: Este Trabalho de Conclusão de Curso teve como objetivo analisar a funcionalidade e qualidade do medicamento Trastuzumabe, um anticorpo monoclonal desenvolvido como um medicamento biossimilar como alternativa para alguns tratamentos oncológicos como o câncer de mama em estágio metastático. Os biossimilares são medicamentos originários de proteínas terapêuticas ou biológicas, cujas patentes estão expiradas ou em processo de expiração. O medicamento Trastuzumabe, é designado como um antineoplásico anticorpo monoclonal humanizado recombinante, o qual atinge de forma seletiva as proteínas extracelulares do receptor-2 do fator de crescimento epidérmico humano (HER2) no carcinoma de mama. Os medicamentos biossimilares possuem uma série de particularidades referentes principalmente a questões regulatórias, tais como imunogenicidade, intercambialidade, substituição automática e farmacovigilância, as quais demandam grande esforço por parte das entidades regulatórias, bem como conhecimento por parte dos prescritores, farmacêuticos e pacientes. Neste trabalho, foi realizada uma análise de estudos e pesquisas que certificam o fator farmacológico aplicado a esse medicamento, as eventualidades quanto ao seu mecanismo de ação e estruturação comparada ao medicamento de referência.
Palavras-chave: Biossimilar, Anticorpo monoclonal, Trastuzumabe, Câncer de mama, Metástase.
ABSTRACT: This Course Completion Work aimed to analyze the functionality and quality of the drug Trastuzumab, a monoclonal antibody developed as a biosimilar drug as an alternative to some oncological treatments such as metastatic breast cancer. Biosimilars are medicines originating from therapeutic or biological proteins, whose patents are expired or in the process of expiring. Trastuzumab is designated as a recombinant humanized monoclonal antibody that selectively targets the extracellular proteins of human epidermal growth factor receptor-2 (HER2) in breast carcinoma. Biosimilar medicines have a series of particularities related mainly to regulatory issues, such as immunogenicity, interchangeability, automatic substitution and pharmacovigilance, which require great effort on the part of regulatory entities, as well as knowledge on the part of prescribers, pharmacists and patients. In this study, an analysis of studies and research was carried out that certifies the pharmacological factor applied to this drug, the eventualities regarding its mechanism of action and structuring compared to the reference drug.
Keywords: Biosimilar, Monoclonal antibody, Trastuzumab, Breast cancer, Metastasis.
1. INTRODUÇÃO
Os medicamentos biológicos foram desenvolvidos para transformar o tratamento de diversas doenças, tais como neoplasias, diabetes mellitus e condições autoimunes. Com o término de suas patentes, torna-se possível o registro de medicamentos conhecidos como “biossimilares”, que seriam suas “cópias legais” (Chun, 2017).
A produção de medicamentos biossimilares são baseadas em organismos vivos, os quais possuem uma molécula quase idêntica relacionada ao produto biológico original. Esses medicamentos apresentam uma redução de custo relativo ao medicamento de referência, por isso apresentam benefícios relevantes de doenças crônicas, como a oportunidade de abranger pacientes debilitantes em situações paliativas quanto ao custo do tratamento em setor público, a fim de garantir uma qualidade na terapia de modo apropriado (Guerra, et al. 2023).
É praticamente inviável produzir um medicamento biossimilar idêntico ao seu original, uma vez que são biofármacos de estruturas complexas e de difícil caracterização e qualquer modificação no processo de fabricação pode resultar em variações nos perfis de segurança e eficácia do produto (Chun, 2017). No entanto, os medicamentos biossimilares podem ser uma opção acerca do tratamento de pacientes oncológicos, devido à efetividade clínica dos anticorpos monoclonais aprovados pela Agência Nacional de Vigilância Sanitária (ANVISA) (Brandão Dias et al., 2020).
O uso de biossimilares, quando combinados à quimioterapia adjuvante e neoadjuvante, aprimora de maneira significativa a sobrevivência do paciente. Ademais, o tratamento do câncer de mama metastático positivo para receptor-2 do fator de crescimento epidérmico humano o (HER2) foi desenvolvido com anticorpos monoclonais humanizados, que aumentam substancialmente a eficácia e os resultados da terapia (Brandão Dias et al., 2020). Um ponto central dessa discussão é a necessidade de eliminar ou minimizar o fator imunogênico, garantindo que o biossimilar, como o Trastuzumabe, não cause reações imunológicas indesejadas. Essa precaução é essencial para que o medicamento biossimilar possa ser considerado seguro e confiável para os pacientes, especialmente em tratamentos delicados como o do câncer de mama metastático. De modo atual, a falta de legislação e guias específicas de farmacovigilância no Brasil para os biossimilares resulta em um monitoramento inadequado desses medicamentos que exigem atenção especial para garantir seu perfil de segurança (Chun, 2017).
O Trastuzumabe, um anticorpo monoclonal utilizado no tratamento oncológico, faz parte da primeira linha do arsenal terapêutico para o câncer de mama HER2 positivo (Dallemole, 2023). Este medicamento, desenvolvido a partir de moléculas quase idênticas ao biológico original cuja patente expirou, permite a fabricação de versões biossimilares. No entanto, é importante destacar que, apesar da semelhança, os biossimilares não são considerados genéricos. Medicamentos genéricos são cópias idênticas de moléculas sintetizadas quimicamente, enquanto os biossimilares replicam com alta similaridade, mas com pequenas variações devido à complexidade de sua estrutura (Sobrafo, 2021).
Embora os biossimilares não sejam réplicas exatas, continuamente têm demonstrado que eles mantêm perfis de eficácia, qualidade e segurança semelhantes aos medicamentos biológicos de referência. No caso do Trastuzumabe biossimilar, essas características são fundamentais para garantir que os pacientes oncológicos recebam o mesmo nível de cuidado proporcionado pelo medicamento original, sem comprometer a qualidade do tratamento (Kurki et al., 2021).
Este estudo tem como objetivo realizar uma revisão narrativa com enfoque de analisar a eficácia, segurança e regulamentação do Trastuzumabe biossimilar no tratamento do câncer de mama HER2 positivo, destacando seu impacto na prática oncológica. O estudo abordará a definição e o mecanismo de ação do Trastuzumabe biossimilar, com ênfase em sua farmacologia e aplicação clínica, revisará os possíveis efeitos adversos relacionados à imunogenicidade dos biossimilares no contexto oncológico e compilará as legislações e normas regulatórias disponíveis no Brasil para o uso de medicamentos biossimilares. Por fim, a revisão demonstrará os benefícios clínicos e a eficácia do Trastuzumabe biossimilar no tratamento do câncer de mama em estágios iniciais e metastáticos.
Dessa forma, foi conduzida uma revisão narrativa de literatura a fim de demonstrar a eficácia e as vantagens do Trastuzumabe biossimilar na oncologia, focando em sua definição, possíveis efeitos adversos relacionados à imunogenicidade, farmacologia e registros clínicos aprovados. Além disso, será abordado o conceito desse anticorpo monoclonal, detalhando seu mecanismo de ação. Por fim, foi realizado um compilado das legislações e normas disponíveis que regulam o uso de biossimilares, especialmente no que diz respeito à eficácia, segurança e fatores de imunogenicidade. Esses aspectos são fundamentais para garantir que o Trastuzumabe biossimilar continue sendo uma opção segura e eficaz no tratamento do câncer de mama inicial ou em metástase.
2. METODOLOGIA
Este estudo foi desenvolvido seguindo as etapas que caracterizam uma revisão narrativa de literatura. Os dados foram escolhidos, coletados, analisados e interpretados com base em informações secundárias provenientes de artigos, livros, sites oficiais, manuais, monografias, dissertações e teses. Segundo Sukhera (2022), os artigos de revisão narrativa de literatura, são publicações amplas e qualitativas, apropriadas para descrever e discutir o desenvolvimento de um determinado assunto, sob o ponto de vista teórico e contextual. Essa categoria de artigo possui um papel fundamental de educação continuada, pois permite ao leitor adquirir e atualizar o conhecimento sobre a temática específica.
Para a realização do estudo, foi elaborado um levantamento de pesquisas em artigos científicos obtidos nas bases de dados SciELO (Scientific Electronic Library Online), National Library of Medicine (PUBMED), MEDLINE (Medical Literature Analysis and Retrievel System Online). Além disso, com critérios de marco temporal entre os anos de 2010 a 2024, e buscas por livros, sites de revistas online e sites governamentais. Para busca, as seguintes palavras-chave foram utilizadas: anticorpos monoclonais, medicamentos biológicos, biossimilares, Trastuzumabe, biossimilares no Brasil, intercambialidade, câncer de mama e metástase.
3. REFERENCIAL TEÓRICO
3.1 Anticorpo Monoclonal
Anticorpos monoclonais (mAbs) são moléculas de anticorpos idênticas produzidas por clones individuais de células B específicas para um determinado epítopo de um antígeno (Lu et al., 2020).
Os anticorpos monoclonais possuem uma vantagem de se direcionarem para um antígeno específico, por meio de interações específicas entre o sítio de ligação do anticorpo para com o epítopo do antígeno, o qual são reconhecidos pelo anticorpo, por esse motivo, a maioria é empregada no tratamento de câncer e doenças autoimunes. No contexto atual, cerca de 80 anticorpos monoclonais estão no mercado americano aprovados pelo FDA – Food and Drug Administration (Conceição, 2021, apud Lu et al., 2020).
Os anticorpos monoclonais possuem um potencial terapêutico elevado, por exemplo, sua projeção em se ligar a um antígeno específico. Devido a isso, existem investimentos contínuos para o desenvolvimento de novas técnicas e novas moléculas para o diagnóstico e tratamento de determinadas doenças. Em 2018, destacaram-se mAbs antineoplásicos e imunossupressores (Lu et al., 2020).
O mecanismo de ação dos mAbs na eliminação de células tumorais envolve a citotoxicidade celular mediada por anticorpos devido à interação da região Fc. A região Fc, ou fragmento cristalizado, consiste na interação com receptores ou outras moléculas do sistema imunológico. Essa região não se liga de forma direta ao antígeno, porém auxilia na ativação do sistema complemento, se liga às células NK e macrófagos com o objetivo de destruir a célula infectada (Delves et al., 2018). Após a ligação do mAb aos receptores celulares, ocorre a interação do domínio Fc com células natural killers, monócitos e macrófagos, resultando na eliminação das células malignas (Bruggemann et al., 2015).
Na terapia oncológica, por exemplo, os anticorpos também podem ser empregados conjugados a medicamentos citotóxicos ou conjugados de anticorpo-fármaco (ADCs, do inglês Antibody-Drug Conjugates), sendo direcionados a uma molécula até o antígeno específico no tumor. Esses anticorpos conjugados reduzem a toxicidade não específica, elevando a dose máxima tolerada do medicamento (Schumacher et al., 2016; Bayer et al., 2019).
Os mAbs podem ser categorizados como não-conjugados e conjugados. Os anticorpos não-conjugados, que são amplamente utilizados, funcionam aderindo-se às células cancerosas, estimulando a resposta imunológica, reconhecendo checkpoints e aumentando a sinalização intracelular a fim de ativar as vias de apoptose, como o antineoplásico trastuzumabe. Já os conjugados auxiliam na entrega de quimioterápicos ou materiais radioativos, tendo mais efeitos colaterais em comparação aos não-conjugados (Behl et al., 2023).
Referente aos bi-específicos, os quais combinam dois mAbs que então atuam em dois antígenos ao mesmo tempo: um nas células cancerígenas, e outro nas células do sistema imunológico (como as células natural killer). Os tri-específicos, definidos como uma evolução dos bis- específicos, interagem com três antígenos distintos (Behl et al., 2023).
3.2 Câncer de mama
O câncer de mama é uma das neoplasias malignas que mais afeta as mulheres ao redor do mundo. Durante o triênio de 2023 a 2025, prevê-se o surgimento de 73.610 novos casos a cada ano, correspondendo a uma taxa de incidência ajustada de 41,89 casos para cada 100.000 mulheres. (INCA, 2022).
A enfermidade ocorre devido ao crescimento desordenado de células mamárias, as quais adquirem características anômalas. Essas anomalias são produzidas através de mutações no material genético das células, o que vai comprometer sua capacidade de divisão e replicação, alcançando um resultado de uma proliferação excessiva de células e, consequentemente, no desenvolvimento do tumor (Sun et al., 2017; Urban et al., 2017). O câncer de mama pode ser originado em diversas regiões da mama, mas a maior parte dos casos surge nas células epiteliais que revestem os ductos mamários, chamadas de carcinoma ductal invasivo. A estrutura da mama é formada por tecido glandular, ductos, lóbulos, tecido adiposo e vasos sanguíneos (Nascimento et al, 2023).
No câncer de mama, podem ocorrer mutações em genes que regulam o ciclo celular e a reparação do DNA, como os genes BRCA1 e BRCA2, que desempenham papéis no reparo de danos ao DNA e na preservação da estabilidade genética. A ativação de oncogenes, como o HER2 (receptor 2 do fator de crescimento epidérmico humano), ou a desativação de genes supressores tumorais, como o p53, pode promover a proliferação desordenada das células da mama (Freitas et al., 2024).
Relacionada à morfologia, o tumor pode apresentar variações, com alguns tipos mostrando um crescimento mais agressivo e outros, um ritmo mais lento. Além disso, o câncer de mama pode ser categorizado em subtipos moleculares de acordo com sua expressão gênica, como os subtipos luminal A, luminal B, HER2 positivo e triplo negativo, que apresentam distintas características clínicas, prognósticos e respostas ao tratamento (Cirqueira et al., 2011).
A neoplasia maligna da mama acomete mais o público feminino, embora homens também podem desenvolver esse tipo de câncer. Acredita-se que os fatores socioeconômicos e culturais os quais correspondem em questão do acesso à saúde, informação e histórico sendo como um componente genético ou sem histórico familiar significativo, podem influenciar diretamente na questão patológica (Bravo, et al., 2021).
Diante do perfil epidemiológico nacional, o câncer de mama representa como uma das três classes de em uma ocorrência maior entre as mulheres. Os dados de mortalidade conforme a Figura 1, indica o câncer de mama no Brasil entre os anos de 1980 e 2020 onde, evidenciam um aumento significativo distribuído nas regiões brasileiras (Luz et al., 2021).
Figura 1: Taxa de mortalidade por câncer de mama no Brasil e em suas regiões, entre os anos de 1980 e 2020.
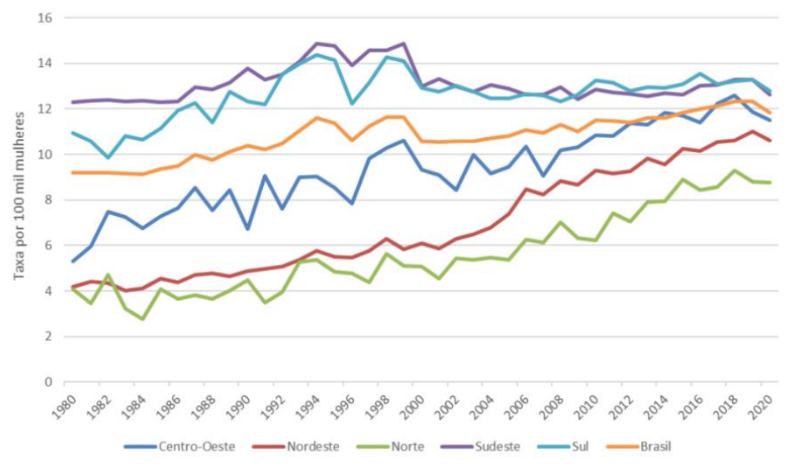
Para a detecção da doença, são realizados alguns exames e procedimentos. Um desses exames avaliam o tecido mamário, dispondo como instrumento anamnese, inspeção e palpação das mamas, denominado exame físico das mamas ou também exame clínico das mamas (ECM), mamografia e ultrassonografia (Nascimento et al., 2022).
Outrossim, destaca-se a importância do autoexame das mamas como uma forma inicial e complementar, o qual antecede aos demais exames realizados. Essa técnica auxilia na detecção precoce de uma possível alteração das mamas, incluindo a possibilidade de câncer. No entanto, cabe destacar que há limitações negativas quanto a esta técnica, pela insuficiência de uma informação na busca de um médico, o que leva a um incidente de um diagnóstico falso- positivo ou possibilidade de não identificar um tumor não-palpável (Bravo et al., 2021).
No tratamento do câncer de mama, há o procedimento quimioterápico neoadjuvante e adjuvante. No neoadjuvante, a quimioterapia antecede a um procedimento cirúrgico, já no adjuvante ela é administrada durante o pós-cirúrgico. Existem outras formas de tratamentos, como a hormonioterapia, terapia-alvo que compreende a utilização de medicamentos que agem de forma direta nas proteínas específicas do tumor, como o medicamento trastuzumabe. A mastectomia é a remoção total ou parcial de uma das mamas ou ambas, como prevenção de um desenvolvimento carcinogênico. Esses métodos proporcionam uma qualidade de vida melhor ao paciente e evitam o ressurgimento tumoral (Reis; Gradim, 2018).
3.3 Câncer de mama metastático
A fase de metástase do câncer de mama é identificada como uma ação das células cancerígenas a partir do sítio primário, as quais se estendem para outros órgãos, formando os sítios metastáticos (Nascimento et al., 2022).
A metástase óssea é considerada comum no câncer de mama, apesar de causar de forma significativa a morbidade e o impacto na qualidade de vida do paciente, a qual de forma geral está associada a uma longa sobrevida. Outrossim, há casos de sítios primários metastáticos que se disseminam nos pulmões, fígado e sistema nervoso central (SNC), caracterizado como metástase extra óssea, o qual pode indicar a um estágio mais avançado da doença (Brum et al., 2017).
Apesar dos avanços recentes na medicina, a metástase no câncer de mama continua sendo a principal causa de óbito. Há vários fatores e mecanismos os quais induzem a metástase, uma vez que a indução de EMT (do inglês – Epithelial-mesenchymal transition) conferido como um processo pelo qual as células epiteliais perdem suas características ordenadas, favorecendo a migração e invasão, típica de propriedades de células mesenquimatosas o que resulta na progressão tumoral, é um fator direcionado a metástase (Park et al., 2022).
No entanto, a causa da metástase deste tipo de tumor é abrangente, o que significa que ainda não pode ser evitada. O tratamento paliativo é uma indicação terapêutica a partir do momento que melhora a qualidade de saúde do paciente, o que ocasiona no aumento de sobrevida global, sendo um indicador do tempo de tratamento desde o diagnóstico até a progressão do câncer e a sobrevida livre (Gonçalves et al., 2023).
3.4 Trastuzumabe
O trastuzumabe é um anticorpo monoclonal contra o receptor 2 do fator de crescimento epidérmico humano (HER2), o qual se liga a um domínio extracelular desse receptor e bloqueia sua homodimerização, prevenindo a sinalização mediada por HER2 (Hong et al., 2024).
Acredita-se também que o trastuzumabe favorece a citotoxicidade celular dependente de anticorpos, induzindo a morte de células que expressam HER2. Os conjugados anticorpo droga são agentes terapêuticos que entregam cargas citotóxicas às células que expressam uma proteína-alvo (Greenblatt et al., 2024).
O antineoplásico biológico Trastuzumabe é um anticorpo monoclonal humanizado anti-HER2 no tratamento de carcinoma de mama inicial HER2 positivo ou em estágio avançado. Este medicamento foi introduzido em 1998 como primeira terapia direcionada ao HER2 (Maadi et al., 2021). A produção foi realizada através de uma técnica de DNA recombinante, sendo a primeira terapia direcionada aos receptores HER2 e aprovada pela FDA em 25 de setembro de 1998 (FDA, 1998).
Sua criação foi designada a partir do enxerto da região determinante de complementaridade (CDRs) do camundongo nas regiões variáveis do anticorpo humano. As áreas hipervariáveis tornam-se constituídas pelo anticorpo murino, enquanto o restante da estrutura é formado pelo anticorpo humano. Como consequência, ocorre um aumento na especificidade e uma melhoria na atividade biológica desejada (Cordeiro Mls et al., 2014).
Relacionada a sua disponibilidade, o trastuzumabe aumentou de forma significativa a sobrevida associada ao câncer de mama HER2 positivo. Notavelmente, também carrega considerável importância histórica como um dos primeiros agentes quimioterápicos “direcionados” desenvolvidos. Dessa forma, este medicamento é tipicamente administrado em combinação com um ou mais agentes citotóxicos, mais comumente antraciclinas (p.ex., doxorrubicina) e taxanos (p. ex., paclitaxel) (Greenblatt et al., 2024).
Os receptores do HER2 são receptores de tirosina quinase que atravessam a membrana celular e, em condições normais, regulam o crescimento, a sobrevivência e a proliferação das células. Cada receptor HER2 possui um sítio extracelular, um segmento transmembrana lipofílico e um sítio tirosina quinase intracelular, que é ativado na presença de um ligante, por meio da homodimerização ou heterodimerização (Silva, 2016).
Esse mecanismo promove sinais relacionados à proliferação e imortalização celular. Quando ocorre superexpressão do HER2, há um aumento na quantidade de proteínas atuando como receptores do fator de crescimento, o que resulta em multiplicação celular acelerada e desorganizada, além de inibir a morte celular, levando ao desenvolvimento cancerígeno (Silva, 2016).
3.4.1 Mecanismo de ação
Os efeitos terapêuticos do anticorpo monoclonal trastuzumabe se destacam na inibição da proliferação celular, após o trastuzumabe se ligar a proteína HER2, haverá o bloqueio através das vias de sinalização intracelulares, como a via MAPK (do inglês Mitogen-Activated Protein Kinase), que envolve processos celulares como diferenciação, apoptose e respostas ao estresse. Com a ativação do medicamento, ocasiona na inibição da ativação da via a qual promove mais crescimento de células cancerígenas (Maadi et al., 2021).
Ademais, a indução a citotoxicidade mediada por células dependentes de anticorpos, ADCC (do inglês Cytotoxicity Mediated by Antibody-Dependent Cell Cytotoxicity) é um dos principais mecanismos funcionais antitumorais do trastuzumabe, isso porque o anticorpo monoclonal potencializa a resposta imunológica contra o tumor (Hong et al., 2024).
As células dependentes de anticorpos, são mediadas por células NK (Natural Killer) a fim de destruir as células-alvo por meio de uma marcação, a qual o receptor HER2 marca as células tumorais, e por meio do reconhecimento do anticorpo pelas células imunes realizam a ativação da célula imune que libera substâncias citotóxicas induzindo a apoptose (Hong et al., 2024).
Na endocitose e degradação do HER2, os efeitos do trastuzumabe nessa indução são controversos. O efeito do trastuzumabe na endocitose do HER2 foi lançado de forma reciclável para membrana plasmática. Esse processo basicamente é a internalização em vesículas do complexo anticorpo-receptor, ou seja, o trastuzumabe ligado ao receptor HER. Na degradação desse receptor, haverá fragmentação de HER2, devido ao processo de endocitose, que libera em sua vesícula de degradação enzimas proteases localizadas nos lisossomos (Maadi et al., 2021).
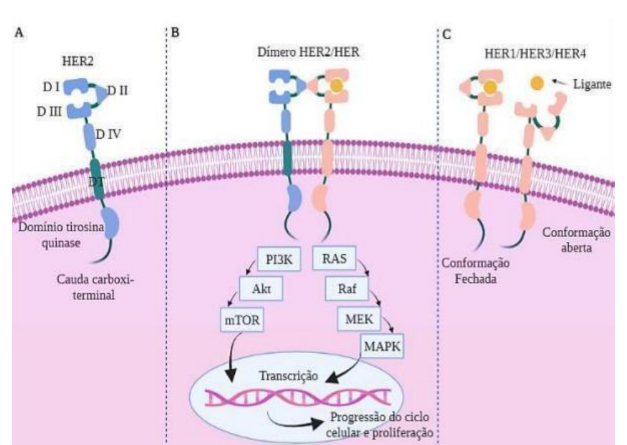
A Figura 2 representa o diagrama esquemático das vias de sinalização HER2 relacionadas ao mecanismo de ação do trastuzumabe quanto a inibição da atividade desta proteína.
Figura 2: Esquema das vias de sinalização HER2. (A) Organização estrutural dos receptores HER2. (B) Vias de sinalização ativadas por dímeros HER; (C) Modificação na conformação do receptor mediada por ligante.
3.5 Biossimilares
Medicamentos biossimilares são versões análogas desenvolvidas após o término da patente dos produtos biotecnológicos originais (formulação). Esses medicamentos são comparáveis, mas não exatamente idênticos, sendo equivalentes aos medicamentos originais no que se refere aos fármacos biológicos (Sobrafo, 2021).
Assim como o produto de referência, os biossimilares também são produtos biotecnológicos obtidos a partir de organismos vivos. Sua estrutura molecular é igualmente extensa e de natureza complexa (Sobrafo, 2021).
O desenvolvimento de biossimilares representa um avanço significativo na indústria farmacêutica, oferecendo alternativas terapêuticas que se assemelham aos medicamentos biológicos de referência. Esses produtos, embora se esforcem para alcançar uma semelhança substancial com seus produtos de referência, reconhecem-se como distintos devido à complexidade inerente à sua produção (Iskit, 2022).
O que difere de forma fundamental os medicamentos biológicos dos medicamentos biossimilares, é justamente que os medicamentos biológicos são produzidos de organismos vivos ou então de suas proteínas, além disso, com a inclusão de terapias como anticorpos monoclonais, citocinas e vacinas. Enquanto os biossimilares são produzidos a partir de moléculas quase idênticas do produto biológico original, sendo considerados biotecnológicos também (Costa et al., 2023).
O desenvolvimento desses biofármacos possuem a finalidade de serem semelhantes aos biológicos, os quais constam como medicamento de referência. Com isso, a semelhança desses medicamentos deve ser comprovada a partir da eficácia medicamentosa, segurança e qualidade perante o biológico (Costa et al., 2023).
Um medicamento é liberado para comercialização após ser definido, analisado e aprovado pela agência reguladora. No Brasil, a ANVISA (Agência Nacional de Vigilância Sanitária) é a responsável por essa regulamentação e classifica o biossimilar como um fármaco desenvolvido a partir da biossíntese em células vivas (in vivo) que foram geneticamente modificadas (Brandão Dias et al., 2020).
Esses medicamentos são compostos por moléculas complexas, sensíveis a variações de temperatura e condições de armazenamento. O investimento necessário é elevado devido ao processo biotecnológico, e a replicação não é feita de maneira idêntica, portanto, as moléculas biológicas nunca serão completamente iguais (Brandão Dias et al., 2020).
Relacionada a elaboração de fármacos biológicos, dispõem de consideráveis recursos, particularmente financeiros e temporais. Tendo em vista que se trata de moléculas de grandes dimensões, devido a isso, o processo precisa ser rigorosamente controlado e a matéria-prima consiste em células vivas (Milheiro, 2021).
3.5.1 Imunogenicidade
A imunogenicidade é definida como a capacidade de uma substância desencadear uma resposta ou reação imunológica, como a produção de anticorpos específicos, respostas de células T, ou reações alérgicas e anafiláticas (Brasil, 2010).
As principais preocupações levantadas em relação aos biossimilares são a imunogenicidade, e eficácia, os efeitos adversos ao mudar de um medicamento biológico para um biossimilar e os possíveis efeitos a longo prazo (Mysler et al.,2021). As diferenças específicas entre os processos de fabricação deste medicamento podem resultar em variações na estrutura molecular e, consequentemente, na qualidade, segurança e eficácia dos biossimilares em comparação com seus produtos de referência. Embora tais variações podem incluir alterações tridimensionais e no perfil de glicosilação, consideradas menores, seu impacto potencial na imunogenicidade e nos efeitos colaterais do produto não deve ser subestimado (Biroulet et al., 2021).
Apesar do processo de autorização de biossimilares ser acelerado, os possíveis biossimilares devem comprovar eficácia equivalente, sem imunogenicidade adicional ou efeitos adversos. Em relação à transição entre produtos, estudos mostraram que a mudança entre duas proteínas estruturalmente diferentes que têm um efeito desejado semelhante não está ligada a um risco aumentado de eventos adversos (Kaida et al., 2018).
Em termos de troca entre produtos, a mudança entre duas proteínas estruturalmente distintas que têm um efeito similar não está associada a um risco maior de eventos adversos. Assim, a troca entre proteínas que compartilham uma estrutura quase idêntica também não deve apresentar riscos adicionais (Chun, 2017).
No geral, a maioria das evidências sugere que a mudança de um medicamento de referência para um biossimilar, ou entre biossimilares, não está associada ao aumento da imunogenicidade, a um risco de segurança crescente ou clinicamente significativo, ou a qualquer perda apreciável de eficácia (Kaida et al., 2018). Desta maneira, cabe destacar que, estes produtos biossimilares são essencialmente versões semelhantes do mesmo produto de referência, conduzindo a resultados clínicos semelhantes (Iskit, 2022).
3.5.2 Intercambialidade
A intercambialidade é um termo o qual indica que um medicamento pode ser substituído por outro medicamento sendo comprovadamente equivalente. Para substituir um produto por outro nas farmácias, deve ser demonstrado que esses produtos são intercambiáveis (Iskit, 2022).
Deve-se salientar previamente que os medicamentos biossimilares não devem ser confundidos com medicamentos genéricos, pois enquanto estes últimos são moléculas quimicamente idênticas aos produtos de referência, os biossimilares representam uma abordagem complexa e única na produção de medicamentos biológicos (Mysler et al., 2021).
Desde a aprovação do primeiro medicamento biossimilar de anticorpo monoclonal infliximabe na União Europeia, a European Medicines Agency (EMA) recomenda registrar o número do lote e o nome comercial do medicamento no prontuário do paciente. E, para assegurar um melhor suporte, o cartão de alerta do paciente para infliximabe foi atualizado com a recomendação de que os pacientes também anotem o número do lote e o nome comercial do medicamento (Chun, 2017).
Por não possuir uma diretriz específica referente à diferenciação da nomenclatura entre produtos biológicos novos e suas cópias, quanto à identificação, prescrição, dispensação e monitoramento, no Brasil, não há nenhuma regulamentação que trate da intercambialidade de medicamentos biológicos. Assim, a farmacovigilância é indispensável nesta questão, visto que o monitoramento dos perfis de segurança dos medicamentos é essencial, já que os produtos biológicos possuem uma complexidade e heterogeneidade inerentes. Isso acarreta desafios adicionais, como a observação de reações imunológicas tardias, que tornam mais difícil determinar a relação causal entre o produto e os eventos adversos (Guerra et al., 2022).
3.5.3 Farmacovigilância
A farmacovigilância é fundamental no monitoramento do uso de biossimilares porque permite a detecção e caracterização de reações adversas a medicamentos. Utiliza-se diferentes identificadores para distinguir produtos biológicos, os quais podem incluir o nome comercial, a substância ativa, o fabricante, o número do código nacional de medicamentos – National Drug Code (NDC) e o número do lote (Chun, 2017).
A avaliação comparativa da segurança de biossimilares em relação aos produtos de referência é essencial para garantir a confiança na intercambialidade e segurança do uso desses medicamentos (Schellekens, 2010). O conceito de benefício-risco é indispensável na avaliação da segurança e eficácia de medicamentos, incluindo biossimilares. Ele envolve a análise cuidadosa dos benefícios terapêuticos em relação aos riscos potenciais para os pacientes (EMA, 2017).
As orientações regulamentares variam de acordo com o mercado, por exemplo, na Europa, são fornecidas pelo documento regulamentar intitulado “Boas Práticas de Farmacovigilância para medicamentos biológicos” (Mysler et al., 2021). No Brasil, a ANVISA estabelece a regulamentação por meio da RDC 55/2010 (Resolução da Diretoria Colegiada). Essa resolução define os requisitos e registros para medicamentos biológicos, incluindo os biossimilares (Brasil, 2010).
Outrossim, a RDC nº 55/2010 é uma normatização técnica utilizada pela ANVISA, sendo fundamental para a incorporação de produtos biológicos no país, sem a qual não se poderia permitir o adequado registro de produtos biológicos no mercado nacional. Essa RDC dispõe do procedimento para empresas comprovarem a segurança e eficácia do produto biológico para as indicações propostas, com apresentação de estudos clínicos como por exemplo resultados de ensaios clínicos controlados e comparativos com os medicamentos de referência, além de exigências para a modificação do pós-registro de medicamentos biológicos, estabelecidos no artigo 18 e 19 desta resolução (Brasil, 2010).
Quando comparada a outras regulamentações internacionais sobre biossimilares, verifica-se a necessidade de realizar incrementos e atualizações em sua estrutura, bem como de incluir claramente o termo “biossimilar”, já adotado por outras agências reguladoras (Torres et al., 2017).
O nome próprio de um produto biológico, ou seja, a substância ativa, reflete certas características científicas, como estrutura química e propriedades farmacológicas, enquanto o nome comercial é a marca registrada. Para produtos biológicos licenciados, o Food and Drug Administration (FDA) exige que o nome próprio esteja presente em cada embalagem, facilitando a identificação da substância pelos profissionais de saúde e distinguindo os produtos biológicos. A Denominação Comum de Produtos Biológicos, com sufixos distintivos, é importante para a identificação de produtos específicos em relatórios de eventos adversos e para garantir a precisão na farmacovigilância (Chun, 2017).
Assim como não há regulamentação específica para intercambialidade em nenhum país da América Latina, também não se observa nas normas regulatórias da região uma distinção terminológica entre o medicamento original e seu biossimilar. No Brasil, além do sistema de compras públicas por meio de licitação, que eleva o risco de substituição automática entre medicamentos biológicos e seus biossimilares, as prescrições no âmbito do Sistema Único de Saúde não podem incluir nomes comerciais, o que agrava ainda mais as dificuldades de rastreabilidade (Garcia, 2016).
3.5.4 Caracterização e comparabilidade
O Guia de Comparabilidade de Medicamentos Biológicos foi produzido em 2011 pela ANVISA, com a finalidade de e orientar os fabricantes mediante o desenvolvimento e a avaliação de biossimilares no Brasil, o qual estabelece critérios técnicos necessários para conduzir estudos de comparabilidade entre o produto biológico e o biossimilar, desde a aspectos avaliativos de estudos clínicos, testes laboratoriais, análise de dados e entre outros (Brasil, 2011).
Relacionada aos atributos físico-químicos, essa análise foi inicializada pela agência americana Food and Drug Administration (FDA), a fim de fornecer estudos analíticos relevantes de similaridade dos produtos de referência para com um biossimilar. Na avaliação de propriedades físico-químicas, é realizada a conferência do potencial de detecção em analisar a diferença nos atributos do produto proposto para o produto de referência, verificando-se assim sua heterogeneidade. Por ser a análise de variação natural decorrente das moléculas do biossimilar, essa verificação é importante para analisar sua função e estabilidade por meio da heterogeneidade do medicamento proposto em comparação ao de referência (Sobrafo, 2021).
A análise de impurezas está contida no guia, sendo indispensável no controle e qualidade no desenvolvimento de um biossimilar, a fim de avaliar contaminantes no processo de produção, por exemplo. A cromatografia em coluna e a filtração são opções para remover impurezas indesejadas com a utilização de propriedades bioquímicas (Milheiro, 2021).
A caracterização quanto ao produto farmacêutico acabado preconiza a comparação do produto acabado com o de referência. Essas análises identificam os excipientes utilizados em comparação ao produto de referência, aceitabilidade do tipo, assim como a estabilidade, sendo conduzidos estudos de comparatividade por meio de condições múltiplas de estresse, como temperaturas elevadas, exposição à luz e agitação, os quais podem um tipo de degradação do produto por um tempo determinado, com o propósito de garantir por meio de avaliações e controles adicionais, diferenças dos produtos entre si e na fabricação e armazenamento garantindo o controle e qualidade (Sobrafo, 2021).
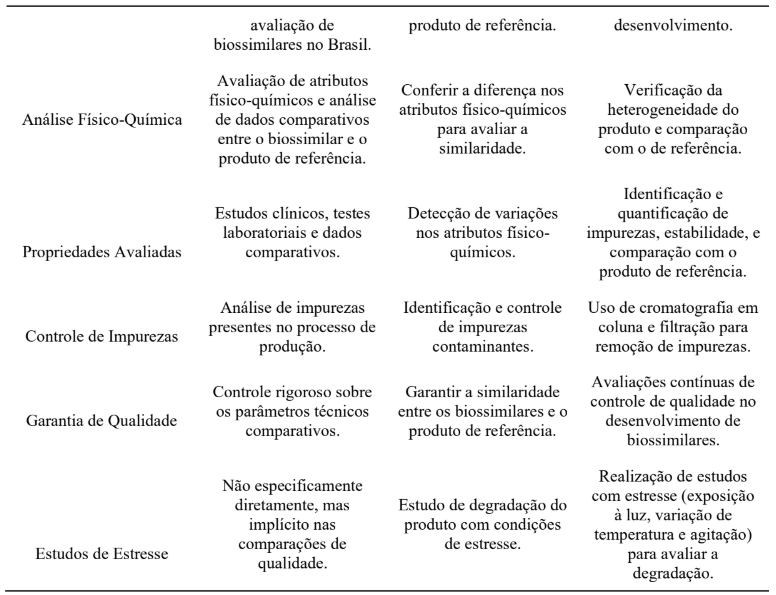
As análises selecionadas por meio de estudos bibliográficos destacam quanto a comparatividade do medicamento biossimilar através da Tabela 1, onde menciona cada verificação de aspectos estabelecidos de critérios técnicos na produção do produto biológico.
Tabela 1: Quadro de análise de comparatividade do produto biossimilar com o produto de referência.

3.6 Biossimilares no tratamento do câncer de mama
A combinação de anticorpos monoclonais com a quimioterapia no tratamento do câncer tem se mostrado uma alternativa aos métodos quimioterápicos tradicionais. Esse enfoque reduz os efeitos adversos, uma vez que os anticorpos monoclonais se ligam a receptores específicos das células tumorais, preservando as células saudáveis (Cardoso et al., 2021).
O primeiro anticorpo monoclonal terapêutico com enfoque no câncer de mama do tipo HER2 positivo foi o medicamento Trastuzumabe (Herceptin®), sendo categorizado como medicamento de referência. A molécula do agente antineoplásico Trastuzumabe é considerada relativamente segura, a qual possui um potencial baixo de imunogenicidade para um anticorpo monoclonal (mAb) (Barbier et al., 2019).
O primeiro anticorpo monoclonal oncológico considerado um biossimilar a ser aprovado no Brasil através da ANVISA em 2017 foi denominado como Zedora®, e a autorização de sua utilização no tratamento trouxe benefícios em destaque aos pacientes do Sistema Único de Saúde (Cardoso et al., 2021).
O medicamento Zedora® foi desenvolvido por meio de engenharia genética, dispondo de um mecanismo de ação complexo. Estudos foram realizados a fim de confirmar que é comparável ao Herceptin® desde suas características físico-químicas, estruturais e biológicas, comprovando a similaridade ao medicamento comparável quanto a sua segurança e eficácia (Zedora®, 2024, p.1).
Recém aprovado pela ANVISA em 2017, o medicamento Herzuma® (CT-P6) é classificado como um biossimilar do trastuzumabe para o tratamento de câncer de mama metastático. Seu mecanismo é semelhante ao do produto de referência, sendo indicado para tumores com superexpressão da proteína HER2, com o intuito de inibir o crescimento exacerbado de células cancerígenas (Brandão Dias et al., 2020).
O tratamento de biossimilares apresentou conforme estudos um resultado melhor em associação a outras terapias antineoplásicas. Quanto à eficácia desses produtos biológicos foram selecionados estudos bibliográficos através da Tabela 2 a fim de demonstrar a eficácia de anticorpo monoclonal biossimilar no tratamento de câncer de mama.
Tabela 2: Quadro de comprovação da eficácia do uso de biossimilares no tratamento do câncer de mama a partir da análise de artigos científicos publicados no período de 2010 a 2017.

De acordo com os estudos de Macedo et al. (2010), existem comprovações quanto à eficácia da utilização de anticorpos monoclonais trastuzumabe como biossimilar em pacientes com câncer de mama. Foi desenvolvido um modelo de Markov, o qual foi criado com base no estudo HERA para analisar a eficácia do trastuzumabe por um período de 1 ano em comparação com o tratamento padrão em pacientes com câncer de mama HER2 positivo em estágios iniciais. Os resultados obtidos demonstraram que o produto biossimilar reduziu o risco cerca de 49% quanto ao retorno da doença após um período em que os sinais e sintomas haviam desaparecido (recidiva), e ao fator metastático um valor próximo a 48%.
4. CONSIDERAÇÕES FINAIS
Por meio da análise feita e da construção da revisão narrativa de literatura, foi possível constatar a clara evidência que os medicamentos biossimilares possuem um perfil de segurança e eficácia, em destaque o anticorpo monoclonal Trastuzumabe no tratamento do câncer de mama inicial ou em metástase.
Ainda assim, vale ressaltar que são necessárias mudanças quanto a intercambialidade do medicamento, com novas regulamentações no Brasil que conciliam com os aspectos de farmacovigilância, a fim de abranger o tratamento no setor público de saúde quanto a esses medicamentos de alto custo.
Na análise de artigos científicos, foram verificadas comprovações quanto ao uso de medicamentos biossimilares no tratamento de câncer, abstendo o perfil imunogênico com base em estudos clínicos quanto à fiscalização e comercialização de produtos biológicos.
REFERÊNCIAS
BARBIER, L. et al. The arrival of biosimilar monoclonal antibodies in oncology: clinical studies for trastuzumab biosimilars. British Journal of Cancer, v. 121, p.199-210, 2019.
BAYER, V. An Overview of Monoclonal Antibodies. Semin Oncol Nurs. 2019;35(5):150927. DOI: 10.1016/j.soncn.2019.08.006. Acesso em: 15 out. 2024.
BERNARDO, W. M.; NOBRE, M. R. C.; JATENE, F. B. A prática clínica baseada em evidências. Parte II: buscando as evidências em fontes de informação. Revista Assoc Med Bras. v. 50, p. 1-9, 2004.
BRANDÃO DIAS, D. Q.; KUDO, C. R. S.; GARCIA, D. M. Impacto dos medicamentos biossimilares utilizados na imunoterapia contra o câncer de mama no Brasil. Brazilian Journal of Natural Sciences, São Paulo, SP, v. 3, n. 1, p. 274-286, mar. 2020.
BRASIL. Ministério da Saúde. Agência de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada – RDC n° 55, de 16 de dezembro de 2010. Dispõe sobre o registro de produtos biológicos novos e produtos biológicos e dá outras providências. Brasília (DF): Diário Oficial da União nº241; 2010. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/anexo/anexo_res0055_16_12_2010.pdf. Acesso em 10 out. 2024.
BRAVO, B. S. et al. Câncer de mama: uma revisão de literatura. Brazilian Journal of Health Review, Curitiba, PR, v. 4, p. 14254-14264, jun. 2021.
BEHL, Akanksha et al. Monoclonal antibodies in breast cancer: A critical appraisa. Critical reviews in Oncology/hematology, v. 183, n. 103915, 23 jan 2023. Disponível em: www.elsevier.com/locate/critrevonc. Acesso em: 15 out. 2024.
BIROULET, L. et al. Troca de biossimilares na doença inflamatória intestinal: da evidência à prática clínica. Especialista Rev Clin Immunol. 2021.
BOYRAZ, B. et al. Trastuzumab emtansine (T-DM1) for HER2-positive breast cancer. Cur. Med. Res. And Oin, v. 29, p. 405-414, 2013. DOI: 10.1185/03007995.2013.775113. Acesso: 29 out. 2024.
BRÜGGEMANN, M. et al. Human antibody production in transgenic animals. Arch Immunol Ther Exp (Warsz). 2015.
BRUM, I. V. et al. Câncer de mama metastático: aspectos clinicopatológicos e sobrevida segundo o sítio de metástase. Medicina (Ribeirão Preto), Juiz de Fora, MG, v. 50, n. 3, p. 158- 168, mai. 2017.
CAMERON, D. et al. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. The Lancet. p. 1195-1205, 2017. Disponível em: https://www.sciencedirect.com/ science/article/pii/S0140673616326162. Acesso: 01 nov. 2024.
CARDOSO, E. S. S. et al. O papel do farmacêutico na discussão sobre a intercambialidade no tratamento de câncer de mama com Trastuzumabe. Universidade Cidade de São Paulo (UNICID), São Paulo, SP, p. 1-12, 2021.
CHUN, N. Y. K. Contribuição para farmacovigilância de biossimilares no Brasil. 2017. Trabalho de Conclusão de Curso de Farmácia Bioquímica – Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, São Paulo, 2017.
CIRQUEIRA, M. B. et al. Subtipos moleculares do câncer de mama. Femina, v. 39, p. 499– 503, 2011.
CONCEIÇÃO, A. B. A. Anticorpos Monoclonais. Orientador: Patrícia Xavier Batista. 2021. Trabalho de Conclusão de Curso (Graduação em Farmácia) – Universidade Federal de São Paulo, Diadema, 2021.
CORDEIRO MLS, et al. Anticorpos monoclonais: implicações terapêuticas no câncer. Revista Saúde e Ciência, 2014; 3(3): 252-262.
COSTA, C. N. M. et al. Biossimilares e Medicamentos Biológicos: Uma nova abordagem farmacêutica no tratamento de doenças graves e crônicas. Revista Ibero-americana de Humanidades, Ciências e Educação, São Paulo, SP, v. 9, n. 10, p. 1825-1834, out. 2023.
DALLEMOLE, D. R. Encapsulação de ditosilato de lapatinibe em nanocápsulas multiparede funcionalizadas com o anticorpo trastuzumabe: avaliação da atividade antitumoral. Orientadora: Adriana Raffin Pohlmann. 2023. Tese (Doutorado em Ciências Farmacêuticas) – Faculdade de Farmácia da Universidade Federal do Rio Grande do Sul, Porto Alegre, 2023.
DELVES, P. J. et al. Roitt – Fundamentos de Imunologia. 13. ed. Rio de Janeiro: Guanabara Koogan, 2018.
EUROPEAN MEDICINES AGENCY. Guideline on Similar Biological Medicinal Products Containing Biotechnology-derived Proteins as Active Substance: Quality Issues. revision 1. 2017. Disponível em:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/01 /WC500180219.pdf. Acesso em: 14 set. 2024.
FDA. Trastuzumab, Genentech Herceptin approval letter. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/appletter/1998/trasgen092598l.pdf. Acesso em: 10 nov. 2024.
FERRARI, Y. A. C. et.al. Internações por neoplasia maligna da mama nas regiões brasileiras no período de 2014 a 2018. Revista de pesquisa: cuidados fundamentais, Rio de Janeiro, RJ, v. 13, p. 711-716, 2021.
FLYN, K. Y. et al. Biosimilars: Review of current applications, obstacles, and their future in medicine. World Journal of Clinical Cases. v. 6, p. 161–166, Aug. 2018. DOI: http:// dx.doi.org/10.12998/ wjcc. Acesso em: 10 ago. 2024.
FREITAS, I. L. et al. Avanços em marcadores tumorais no diagnóstico e tratamento do câncer de mama. Brazilian Journal of Implantology and Health Sciences, v.6, p. 2674-8169, mai. 2024.
GARCIA, R. Os dilemas e desafios na farmacovigilância dos medicamentos biológicos no Brasil. J Assist Farmac Farmacoecon. v. 1, n.2, p. 39-43, set. 2016. DOI:10.22563/2525- 7323. Acesso em: 18 dez. 2024.
GONÇALVES, D. S. et al. Sobrevida global e fatores associados em mulheres com câncer de mama metastático tratadas com trastuzumabe em uma instituição pública de referência. Revista Brasileira de Epidemiologia, Rio de Janeiro, RJ, v. 26, p. 1-11, nov. 2024.
GREENBLATT K, KHADDOUR K. Trastuzumabe. Publicação StatPearls. jan. 2024. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK532246/. Acesso em: 12 out.2024.
GUERRA, L. D. S.; SILVA, E. P.; CARNUT, L. Intercambialidade e aspectos farmacoeconômicos dos medicamentos biossimilares: uma revisão integrativa. Journal of Management & Primary Health Care, São Paulo, SP, v. 15, p. 1-19, dez. 2022.
HONG, S. D. et al. Trastuzumab-Mediated Antibody-Dependent Cell-Mediated Cytotoxicity (ADCC) Enhances Natural Killer Cell Cytotoxicity in HER2-Overexpressing Ovarian Cancer. International Journal of Molecular Sciences, Basel, Switzerland, v. 25, n. 21, p. 1-17, out. 2024. DOI: 10.3390/ijms252111733. Acesso em: 04 nov. 2024.
INSTITUTO NACIONAL DE CÂNCER JOSÉ DE ALENCAR GOMES DA SILVA. Dados e números sobre câncer de mama. Rio de Janeiro: INCA, 2022. Disponível em: https://www.google.com/url?q=https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/docu ment/dados_e_numeros_site_cancer_mama_setembro2022.pdf&sa=D&source=docs&ust=1732 012008084047&usg=AOvVaw2LIWbks5SLZZENZVntg5mX. Acesso: 18 nov. 2024.
ISKIT, A. B. Key concepts in biosimilar medicines: What physicians must know. North Clin Istanb. Ankara, Turkey, p. 86-91, 2022. DOI: 10.14744/nci.2021.84669. Acesso em: 12 ago. 2024.
KURKI, P. et al. Safety, Immunogenicity and Interchangeability of Biosimilar Monoclonal Antibodies and Fusion Proteins: A Regulatory Perspective. v. 81, p. 1881-1896. 2021. DOI: https://doi.org/ 10.1007/s40265-021-01601-2. Acesso em: 31 out. 2024.
LEITE, G. C.; RUHNKE, B. F.; VALEJO, F. A. M. Correlação entre tempo de diagnóstico, tratamento e sobrevida em pacientes com câncer de mama: uma revisão de literatura. Colloquium Vitae, São Paulo, v. 13, n. 1, 2021.
LU, R. M. et al. Development of therapeutic antibodies for the treatment of diseases. Journal of biomedical science. v. 27, jan. 2020, DOI :10.1186/s12929-019-0592-z. Acesso em: 31 out. 2024.
LV, Q. et al. Molecular mechanisms and translational therapies for human epidermal receptor 2 positive breast cancer. International Journal of Molecular Sciences, v. 17, n. 2095, p. 1- 21, 2016.
LUZ, G. R. A.; SANTOS, G. R.; RODRIGUES, J. L. G. A utilização do trastuzumabe na terapia do câncer de mama. Revista Artigos. Com, Salvador, BA, v. 32, p. 1-7, nov. 2021.
MACEDO, A. et al. Custo-Efetictividade de Trastuzumabe no Tratamento de Doentes com Cancro da Mama em Estádios Iniciais em Portugal. Acta Med Port. 2010; 23(3): 475-482. Disponível em:< https://actamedicaportuguesa.com/revista/index. php/amp/article/view/631>. Acesso em: 18 out. 2024.
MAADI, H. et al. Trastuzumab Mechanism of Action; 20 Years of Research to Unravel a Dilemma. Multidisciplinary Digital Publishing – MDPI. Basel, Swiss, v. 13, p. 3540, july. 2021. DOI: https://doi.org/10.3390/ cancers13143540. Acesso em: 31 out. 2024.
MILHEIRO, M. S. A. A. Medicamentos Biossimilares: Desafios e Perspectivas Futuras. 2021. Dissertação (Mestrado em Ciências Farmacêuticas) – Faculdade de Farmácia, Universidade de Lisboa, Lisboa, 2021.
MELO, M. T.; ARAÚJO, M. E. O.; OLIVEIRA, C. A. L. T. M. Tratamento farmacológico e terapêutico da dor total em pacientes com câncer de mama metastático: revisão narrativa sobre a importância da intervenção interdisciplinar. Brazilian Journal Of Pain, Salvador, BA, v. 17, p. 1-9, ago. 2024.
MYSLER, E. et al. Biosimilar‑to‑Biosimilar Switching: What is the Rationale and Current Experience? Drugs. v. 81, p. 1859-1879, nov. 2021. DOI: https://doi.org/ 10.1007/s40265-021- 01610-1. Acesso em: 15 de ago. 2024.
NASCIMENTO, J. L. T.; FERREIRA, L. S. S.; AROUCHE, M. M. Uso de anticorpos monoclonais no tratamento de câncer de mama. Revista de Estudos Multidisciplinares, São Luís, MA, v. 3, n. 3, p. 1-12, dez. 2023.
NASCIMENTO, P. S. et al. Dificuldades enfrentadas por mulheres com câncer de mama: do diagnóstico ao tratamento. Revista Interfaces: Saúde, Humanas e Tecnologia. Ceará, CE, v. 10, n. 2, p. 1336-1345, jul. 2022.
PARK, M. et al. Breast Cancer Metastasis: Mechanisms and Therapeutic Implications. International Journal of Molecular Sciences. Bucheon, Korea, v. 23, p. 2-15, June, 2022. DOI: https://doi.org/ 10.3390/ijms23126806. Acesso em: 22 out. 2024.
REIS, A.P.A; GRADIM, C.V.C. A alopecia no câncer de mama. Revista de enfermagem UFPE on line, v. 12, n. 2, p. 447-55, 2018.
SCHELLEKENS, H. The First Biosimilar Epoetin: But How Similar Is It?.Clin J Am Soc Nephrol, v. 3, p. 174-178, 2008.
SCHUMACHER, D. et al. Current Status: Site-Specific Antibody Drug Conjugates. Journal of clinical immunology. v. 36, p. 100-7. 2016.
SILVA, A. E. R. Cardiotoxicidade associada ao tratamento adjuvante com trastuzumabe em pacientes com carcinoma de mama. 2016. Dissertação (Mestrado em Ciências da Saúde) – Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, 2016.
SOCIEDADE BRASILEIRA DE FARMACÊUTICOS EM ONCOLOGIA (SOBRAFO). Biossimilares. Coordenação: Annemeri Livinalli. 1. ed. São Paulo: Partners Publishers, 2021. p. 62. ISBN 978-65-994964-0-0.
STEWART, A.; AUBREY, P.; BELSEY, J. Addressing the health technology assessment of biosimilar pharmaceuticals. Curr Med Res Opin 2010; 26:2119-26.
SUKHERA, J. Narrative Reviews: Flexible, Rigorous, and Practical. Journal of Graduate Medical Education. v. 14, p. 414-417, Aug. 2022. DOI: 10.4300/JGME-D-22-00480.1. Acesso em: 20 nov. 2024.
SUN, Y. S. et al. Risk factors and preventions of breast cancer. International Journal of Biological Sciences, v. 13, p. 1387–1397, 2017. DOI: https://doi.org/10.7150/ijbs.21635. Acesso em: 10 nov. 2024.
TORRES, P. et al. Consenso brasileiro multi-institucional de pacientes sobre medicamentos biossimilares. v. 9, .n. 1, p. 39-43.J Bras Econ Saúde, 2017.
URBAN, L. A. B. D., et al. Recomendações do colégio Brasileiro de radiologia e diagnóstico por imagem, da sociedade Brasileira de mastologia e da federação Brasileira das associações de ginecologia e obstetrícia para o rastreamento do câncer de mama. Radiologia Brasileira, v. 50, p. 244–249, 2017. DOI: https://doi.org/10.1590/0100-3984.2017-0069. Acesso em: 30 out. 2024.
ZEDORA: pó liofilizado para solução injetável 150mg. Farmacêutico responsável Cintia Delphino de Andrade. São Paulo: Libbs Farmacêutica Ltda. 2023. 1 bula de remédio. Disponível em: <https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=zedora>. Acesso em: 20 out. 2024.
1Discente do curso de Farmácia da Faculdade Madre Thaís, Centro de Ensino Superior, Ilhéus, Bahia. e-mail: nicolle73souza@gmail.com
2Docente do curso de Farmácia da Faculdade Madre Thaís, Centro de Ensino Superior, Ilhéus, Bahia. e-mail: mariana.andrade@faculdadedeilheus.com.br
