IRON DEFICIENCY ANEMIA: PATHOPHYSIOLOGICAL MECHANISMS, DIAGNOSIS, AND THERAPEUTIC APPROACHES
REGISTRO DOI: 10.69849/revistaft/ni10202504092019
Pablo José Passos Teixeira1; Amanda Lana Fonseca2; Julia Paula Fernandes da Silva3; Robert da Silva Teodoro4; Daniel Inácio da Silva5; Marcelo Charles Gonçalves6; Débora Pfeifer7; Eder de Melo Barbosa8; Weliton Marcelo Vieira9; Rafael André Ferreira10; Reinaldo Reis Pimentel11
RESUMO
A Organização Mundial da Saúde (OMS) classifica a anemia por deficiência de ferro (ADF) como a deficiência nutricional mais prevalente no mundo, acometendo cerca de 30% da população global. Embora as causas mais frequentes estejam associadas a perdas sanguíneas, como sangramentos gastrointestinais e menstruação em mulheres, a ingestão inadequada de ferro e a diminuição na sua absorção também contribuem significativamente para o desenvolvimento da ADF. O tratamento adequado da ADF visa a reposição das reservas de ferro e a normalização dos níveis de hemoglobina, o que tem se mostrado eficaz na melhora da qualidade de vida, na redução da morbidade, no aprimoramento do prognóstico de doenças crônicas e na obtenção de melhores desfechos durante a gestação. A deficiência de ferro é frequentemente observada em diversas condições inflamatórias crônicas, como insuficiência cardíaca congestiva, doença renal crônica e doença inflamatória intestinal. Diante disso, este artigo propõe uma visão atualizada sobre o diagnóstico e o manejo da ADF em diferentes contextos clínicos, incluindo pacientes com doenças crônicas, em preparação cirúrgica (pré-operatório) e durante a gravidez. A Organização Mundial da Saúde (OMS) classifica a anemia por deficiência de ferro (ADF) como a deficiência nutricional mais prevalente no mundo, acometendo cerca de 30% da população global. Embora as causas mais frequentes estejam associadas a perdas sanguíneas, como sangramentos gastrointestinais e menstruação em mulheres, a ingestão inadequada de ferro e a diminuição na sua absorção também contribuem significativamente para o desenvolvimento da ADF. O tratamento adequado da ADF visa a reposição das reservas de ferro e a normalização dos níveis de hemoglobina, o que tem se mostrado eficaz na melhora da qualidade de vida, na redução da morbidade, no aprimoramento do prognóstico de doenças crônicas e na obtenção de melhores desfechos durante a gestação.
Palavras-chave: Anemia por deficiência de ferro; Deficiência nutricional; Reposição de ferro; Doenças crônicas; Gravidez; Diagnóstico; Manejo clínico.
ABSTRACT
The World Health Organization (WHO) classifies iron deficiency anemia (IDA) as the most prevalent nutritional deficiency worldwide, affecting approximately 30% of the global population. While the most frequent causes are associated with blood loss, such as gastrointestinal bleeding and menstruation in women, inadequate dietary iron intake and decreased iron absorption also significantly contribute to the development of IDA. Proper treatment of IDA aims to replenish iron stores and normalize hemoglobin levels, which has proven effective in improving quality of life, reducing morbidity, enhancing the prognosis of chronic diseases, and achieving better pregnancy outcomes. Iron deficiency is commonly observed in various chronic inflammatory conditions, including congestive heart failure, chronic kidney disease, and inflammatory bowel disease. In this context, this article provides an updated overview of the diagnosis and management of IDA in different clinical settings, including patients with chronic illnesses, those undergoing surgical preparation (preoperative), and pregnant women. The World Health Organization (WHO) classifies iron deficiency anemia (IDA) as the most prevalent nutritional deficiency worldwide, affecting approximately 30% of the global population. While the most frequent causes are associated with blood loss, such as gastrointestinal bleeding and menstruation in women, inadequate dietary iron intake and decreased iron absorption also significantly contribute to the development of IDA. Proper treatment of IDA aims to replenish iron stores and normalize hemoglobin levels, which has proven effective in improving quality of life, reducing morbidity, enhancing the prognosis of chronic diseases, and achieving better pregnancy outcomes.
Keywords: Iron deficiency anemia; Nutritional deficiency; Iron supplementation; Chronic diseases; Pregnancy; Diagnosis; Clinical management.
1 INTRODUÇÃO
A Organização Mundial da Saúde (OMS) reconheceu a anemia por deficiência de ferro (ADF) como a deficiência nutricional mais comum no mundo, afetando 30% da população [1]. Embora a ADF seja mais prevalente em crianças e mulheres, homens adultos também são suscetíveis, dependendo de seu status socioeconômico e condições de saúde [2].
Embora as causas mais comuns da ADF sejam o sangramento gastrointestinal (GI) e a menstruação nas mulheres, a redução na ingestão e absorção de ferro na dieta também são causas responsáveis [3].
O ferro é necessário para várias funções celulares, incluindo, mas não se limitando a, processos enzimáticos, síntese de DNA, transporte de oxigênio e geração de energia mitocondrial [4, 5]. Assim, os sintomas da ADF podem variar em uma ampla gama. Falta de ar, fadiga, palpitações, taquicardia e angina podem resultar da redução nos níveis de oxigênio no sangue. Essa hipoxemia resultante pode, posteriormente, causar uma diminuição compensatória no fluxo sanguíneo intestinal, levando a distúrbios de motilidade, má absorção, náusea, perda de peso e dor abdominal.
A hipoxia central pode causar dores de cabeça, vertigem e letargia, assim como prejuízo cognitivo, com vários estudos mostrando uma melhoria nas funções cognitivas após a normalização da anemia [6–9]. É bem conhecido que a ADF afeta significativamente a qualidade de vida (QoL), com evidências recentes demonstrando que o tratamento da ADF melhora a QoL, independentemente da causa subjacente da anemia [8, 10].
Nesta revisão, discutiremos a fisiopatologia, o diagnóstico, o tratamento e as complicações no manejo da ADF. Os critérios investigativos para a ADF estão além do escopo deste artigo e foram amplamente descritos nas diretrizes recentes da Sociedade Britânica de Gastroenterologia [11].
2 FISIOPATOLOGIA
O ferro é um elemento essencial e é controlado principalmente pela ingestão dietética, absorção intestinal e reciclagem do ferro [12]. O ferro dietético pode ser encontrado em duas formas: ferro heme e ferro não heme. O ferro heme é facilmente absorvido e provém da hemoglobina (Hb) e mioglobina, na forma de carne animal, aves e peixes. O ferro não heme é encontrado principalmente em alimentos de origem vegetal, mas não é tão facilmente absorvido. Compostos como fitato, oxalato, polifenóis e tanino, que são encontrados nas plantas, diminuem a absorção do ferro não heme, assim como alguns medicamentos, como os inibidores da bomba de prótons [13, 14]. O ácido ascórbico, o citrato e o ácido gástrico, por outro lado, facilitam a absorção de ferro [15]. Em uma dieta saudável, aproximadamente 5–15mg de ferro elementar e 1–5mg de ferro heme são ingeridos diariamente, embora apenas 1–2mg sejam, de fato, absorvidos no intestino, predominantemente no duodeno e jejuno proximal [16]. Para mais detalhes sobre os caminhos de absorção do ferro, consulte a figura 1.
3 AVALIAÇÃO E DIAGNÓSTICO
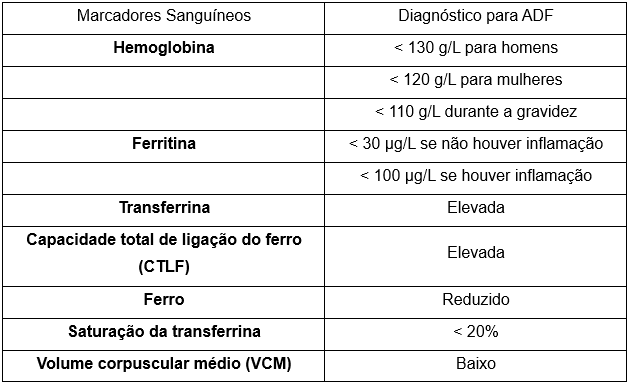
A OMS define a anemia como níveis de hemoglobina (Hb) no sangue abaixo de 130g/L em homens e 120g/L em mulheres [1]. Na deficiência isolada de ferro, a ferritina sérica (molécula de armazenamento do ferro) deve ser inferior a 30ug/L [17]. No entanto, a ferritina é uma proteína da fase aguda e pode estar aumentada na presença de inflamação [18]. Assim, se houver evidência de inflamação concomitante, como aumento da proteína C reativa, uma ferritina inferior a 100ug/L é indicativa de ADF. [19] A transferrina, transportadora de ferro, geralmente está elevada; no entanto, é uma proteína negativa da fase aguda e, portanto, pode estar normal ou reduzida em estados inflamatórios crônicos [20]. Os níveis de ferro sérico e a saturação da transferrina (TSAT) estarão reduzidos, com TSAT inferior a 20% sendo necessário para o diagnóstico de ADF [17]. Consulte a tabela 1 para a divisão dos critérios diagnósticos da ADF. É crucial observar que a deficiência de ferro não deve ser excluída na presença de uma Hb normal, pois uma quantidade significativa de ferro deve ser perdida antes que os níveis de Hb comecem a cair. Assim, uma baixa Hb corpuscular média com Hb normal ou um aumento na largura de distribuição das células vermelhas indica deficiência leve de ferro sem anemia [21].
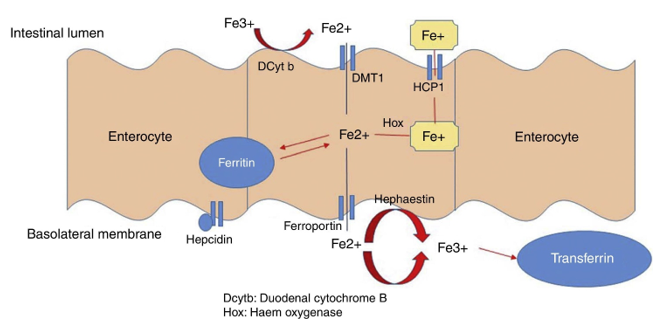
Figura 1: O caminho de absorção do ferro. O ferro férrico (Fe3+), insolúvel, é reduzido para o ferro ferroso (Fe2+), que é transportado pela enzima citocromo B duodenal (DcytB). O transportador de metal divalente 1 (DMT1) importa o Fe2+ através da superfície apical e para dentro da célula, onde pode ser armazenado como ferritina ou exportado para a circulação através da ferroportina. Antes de sair do enterócito, o Fe2+ deve ser oxidado de volta para Fe3+ pela hefastina ou ceruloplasmina. A proteína transportadora de heme (HCP1) transporta o ferro heme diretamente para o enterócito. Uma vez dentro do enterócito, o ferro heme pode ser liberado no plasma via o exportador de heme FLVCR1 ou ser convertido de volta para Fe2+ pela enzima heme oxigenase (HO). O receptor de ferroportina então libera Fe2+ para o plasma. A hepcidina, um hormônio peptídico hepático, controla a ferroportina, o único exportador de ferro, promovendo sua endocitose. A produção e circulação de hepcidina são reguladas pela concentração de ferro no plasma e pelas reservas de ferro. A hepcidina aumenta na presença de inflamação, o que promove a degradação da ferroportina e, consequentemente, prejudica a exportação de ferro celular para o plasma. Adaptado de Barragán-Ibañez, G., et al., (2015) [84,86, 87].
Tabela 1: Critérios Diagnósticos para Anemia por Deficiência de Ferro (ADF)
4 MANEJO
Pacientes com ADF devem ser tratados com o objetivo de repor as reservas de ferro e devolver os níveis de hemoglobina (Hb) ao normal. Isso tem mostrado melhorar a qualidade de vida (QoL), a morbidade, o prognóstico em doenças crônicas e os resultados na gravidez [22]. A reposição de ferro pode ocorrer por três vias: ferro oral, ferro parenteral e transfusão de células vermelhas concentradas. Cada via tem seus benefícios e limitações, que serão discutidos a seguir com maior detalhamento.
4.1 Formulações convencionais de ferro oral
A Sociedade Britânica de Gastroenterologia recomenda preparações de ferro ferroso, especificamente o sulfato ferroso, como terapia de primeira linha para reposição de ferro, pois são baratas, possuem boa biodisponibilidade, estão disponíveis em várias formulações e demonstraram repor as reservas de ferro e corrigir a anemia de forma eficaz [11]. No entanto, também existem muitas limitações em seu uso, sendo a mais comum a frequência e a gravidade dos efeitos colaterais. Uma revisão sistemática demonstrou que os efeitos colaterais gastrointestinais (GI) foram os mais problemáticos, com a constipação sendo a queixa mais frequente, seguida de náuseas e diarreia [23]. Isso terá um efeito consequente na adesão do paciente, provavelmente levando à interrupção do tratamento e, portanto, ao tratamento inadequado [24].
A dosagem apropriada das preparações de ferro ferroso também é uma questão controversa entre os clínicos. Para repor adequadamente as reservas de ferro, o tratamento terapêutico da ADF inicialmente exigia 200mg de sulfato ferroso 2–3 vezes ao dia, a fim de aumentar a Hb em 20g/L ao longo de um período de 4 semanas, com tratamento continuando por 3 meses [25]. No entanto, a dose diária de ferro elementar não deve ser superior a 100mg/dia [26], pois o corpo pode absorver apenas 10–20mg de ferro por dia [26]. Deve-se observar que 200mg de sulfato ferroso são equivalentes a 65mg de ferro elementar [27].
Um estudo recente comparou regimes de dosagem de ferro oral em mulheres com anemia leve, com doses divididas ao longo do dia, dose única diária e doses alternadas a cada dois dias. Os resultados demonstraram superioridade com a dosagem alternada a cada dois dias, com uma absorção fracionada de ferro 33% maior ao longo de 14 doses [28]. Além disso, um estudo randomizado com pacientes idosos com ADF que receberam 15mg, 50mg ou 150mg de ferro elementar por dia mostrou que, após 2 meses, o aumento médio de Hb foi o mesmo em todos os grupos (1,4g/dL); no entanto, os efeitos adversos foram significativamente maiores com doses mais altas [29]. Portanto, uma visão em evolução sugere que uma dose única diária (40–60mg) ou uma dose alternada ligeiramente mais alta (80–100mg) é o regime de dosagem preferido, a fim de reduzir os efeitos colaterais e otimizar a proporção de ferro elementar absorvido [28–30].
O feredetato de sódio é um composto solúvel em água de EDTA com maior biodisponibilidade do que as preparações de sais de ferro ferroso. No Reino Unido, está disponível como uma preparação líquida (Sytron); no entanto, também está disponível em forma de comprimidos (Ecofer, não licenciado atualmente no Reino Unido), muitas vezes em combinação com B12 e folato [31]. Em um estudo sobre o tratamento da ADF em mulheres grávidas, o feredetato de sódio aumentou a Hb em 1,28g/dL após 1 mês de tratamento e 2,11g/dL após 2 meses de tratamento. Isso foi em comparação com o grupo de mulheres que recebeu sulfato ferroso, onde a Hb média aumentou 1g/dL após 1 mês e 1,58g/dL após 2 meses. Além de um aumento significativamente maior na Hb, foram observados significativamente menos efeitos colaterais com o feredetato de sódio em comparação ao sulfato ferroso [32]. Este estudo também destacou a maior biodisponibilidade do feredetato de sódio, já que este grupo recebeu um comprimido de 231mg uma vez ao dia por 2 meses (equivalente a 33mg de ferro elementar) em comparação ao grupo do sulfato ferroso, que recebeu comprimidos de 200mg duas vezes ao dia por 2 meses (equivalente a 60mg de ferro elementar).
4.2 Formulações orais inovadoras de ferro
O maltol férrico, uma preparação inovadora, é uma formulação oral de ferro não salino composta por ferro férrico estável complexo com um derivado de açúcar, o tri-maltol. Está licenciado na União Europeia e nos EUA, sendo vendido sob os nomes comerciais Feraccru e Accrufer, respectivamente. Quando absorvido, o ligante maltol permanece complexo ao ferro, o que reduz a formação de ferro livre e facilita o transporte do ferro através do enterócito [33]. Isso aumenta a biodisponibilidade do ferro, de modo que doses menores de ferro elementar são necessárias para tratar a ADF em comparação com as preparações de ferro ferroso [34]. Além disso, o maltol férrico tem mostrado ter menor impacto sobre o microbioma intestinal [35]. Estudos sobre o uso de maltol férrico foram limitados a pacientes com doença inflamatória intestinal (DII), com resultados demonstrando melhora nos níveis de Hb após 12 semanas, com níveis sustentados de Hb normal até 64 semanas quando comparado ao placebo [36, 37]. No entanto, quando comparado com o maltose férrico intravenoso, o maltol férrico mostrou ser inferior e não atingiu o objetivo primário de aumento da Hb em 2g/L ou normalização da Hb em 12 semanas (85% contra 68%, respectivamente) [38].
Finalmente, o ferro sucrossomal é um inovador transportador de ferro oral, no qual o pirofosfato férrico está dentro de uma membrana de bicamada fosfolipídica, formando o “ferro sucrossomal”, criando um complexo resistente ao ácido gástrico, que pode ser transportado para a mucosa intestinal onde é absorvido sem que o ferro livre interaja com a parede intestinal [39, 40]. Esta estrutura única protege o ferro do ambiente ácido no estômago, aumenta a absorção epitelial intestinal e garante alta biodisponibilidade, enquanto reduz o risco de possíveis efeitos adversos gastrointestinais [39]. Apesar de doses mais baixas de ferro elementar, essa preparação oral mais recente de ferro (30–60mg/dia) também demonstrou maior eficácia em aumentar as concentrações de Hb e ferritina em comparação com o sulfato ferroso (105–210mg/dia), com um aumento médio da Hb de 2,7g/dL e 1,4g/dL, respectivamente, ao longo de um tratamento de 12 semanas [39]. Estudos recentes demonstraram que o ferro sucrossomal não é inferior ao ferro parenteral em pacientes com anemia secundária a doença celíaca, câncer, cirurgia bariátrica e doença renal crônica (DRC) [41–43]. Em um estudo que avaliou pacientes com ADF resultante de sangramentos gastrointestinais ou ginecológicos benignos que anteriormente não haviam respondido ou não toleravam sulfato ferroso, os pacientes foram randomizados para receber uma dose alta de ferro sucrossomal ou gluconato ferroso intravenoso. Os resultados demonstraram que os pacientes eram comparáveis na linha de base, e o aumento da Hb não foi significativamente diferente entre os dois grupos, com o número de semanas necessárias para alcançar um valor alvo de Hb de 12g/dL sendo de quatro no grupo do ferro sucrossomal e 3,5 no grupo do gluconato ferroso [44].
4.3 Ferro intravenoso
Uma alternativa à suplementação oral de ferro é a administração parenteral. O ferro intravenoso é a via de administração preferida em alguns pacientes e é cada vez mais favorecido devido à sua correção rápida da Hb, menos efeitos colaterais e um perfil de segurança aprimorado. A principal vantagem do ferro intravenoso é que ele contorna a absorção no trato gastrointestinal, evitando assim agravamentos adicionais na mucosa e inflamação, além de produzir menos efeitos colaterais [45]. Os clínicos também não precisam se preocupar com a adesão dos pacientes à medicação.
Existem uma variedade de preparações de ferro intravenoso, e a escolha do agente depende de múltiplos fatores, incluindo considerações de custo, preferências do paciente e do médico, e disponibilidade do produto. É importante observar que os estudos clínicos das várias formulações seguem protocolos diferentes, e até o momento, não existem grandes estudos comparativos entre essas formulações que comparem a eficácia e o perfil de segurança.
Preparações mais antigas de ferro intravenoso, como o ferro dextrano de alto peso molecular (Dexferrum), foram descontinuadas devido aos seus perfis de segurança desfavoráveis, com incidência relativamente alta de anafilaxia [46]. No entanto, os compostos de dextrano de baixo peso molecular, como o Cosmofer, ainda estão em uso e demonstraram ser eficazes, com uma incidência muito menor de reações anafilactoides [47]. Embora não tenha havido um estudo comparando as diferentes preparações, uma meta-análise sobre a taxa geral de anafilaxia com dextrano intravenoso foi de 0,61% [48], o que é significativamente maior do que com as preparações intravenosas mais recentes, que não contêm dextrano [49].
O derisomaltose férrica (Monofer) é uma alternativa de preparação intravenosa de ferro, frequentemente preferida ao Cosmofer devido ao seu tempo de infusão mais curto, otimizando o uso de unidades de infusão médica e o tempo de enfermagem, uma vez que esses medicamentos são frequentemente administrados em procedimentos ambulatoriais. O Monofer também é preferido por alguns médicos, pois pode ser administrado como uma única infusão, em vez de duas infusões. O carboximaltose férrica (Ferinject) é uma preparação amplamente utilizada no Reino Unido. Pode ser administrado com segurança em uma dose única de 1000mg em 15 minutos; no entanto, duas infusões podem ser necessárias em alguns pacientes, dependendo de seu peso e níveis de Hb. Por fim, o óxido férrico sacarosado (Venofer) é administrado por uma injeção lenta de 100–200mg, 2–3 vezes por semana [50]. Mostrou-se eficaz, embora um estudo comparativo tenha mostrado que o Ferinject foi superior. Neste estudo, o Ferinject foi associado a uma taxa maior de alcance de um aumento de 2g/dL na concentração de Hb em comparação ao ferro sucrossomal, com um risco relativo de 1,65 [51]. Embora o Venofer tenha sido extensivamente estudado, a principal desvantagem do seu uso é a necessidade de múltiplas infusões, o que pode não ser tão aceitável para os pacientes e também dificultar o atendimento em serviços de saúde sobrecarregados.
4.4 Transfusão de glóbulos vermelhos
É recomendado que as transfusões sejam reservadas para pacientes com anemia grave, instabilidade hemodinâmica e/ou com comorbidades associadas [26]. No entanto, embora a anemia grave seja definida como Hb <7g/dL, muitos desses pacientes podem estar hemodinamicamente estáveis e apresentar uma anemia crônica, permanecendo assintomáticos. Embora uma unidade de sangue contenha aproximadamente 200mg de ferro [22], é muito provável que esses pacientes necessitem de suplementação adicional de ferro para repor adequadamente suas reservas de ferro, especialmente se a causa de sua anemia for crônica e não facilmente tratável, como, por exemplo, em casos de câncer avançado ou doenças hematológicas.
Os clínicos, corretamente, são relutantes em transfundir pacientes desnecessariamente, pois isso está associado a riscos significativos. Esses riscos incluem o aumento da mortalidade com transfusões liberais no contexto de sangramentos gastrointestinais superiores [52]. Também há um aumento na incidência de reações relacionadas à transfusão. Isso inclui o risco de Lesão Pulmonar Aguda Relacionada à Transfusão, que é uma das reações mais graves, com uma incidência de aproximadamente 1 em 5000 transfusões [53]. Além disso, ainda existe um pequeno risco de transmissão de infecções, tanto virais quanto bacterianas [54–56].
5 CONSIDERAÇÕES A SEREM CONSIDEREDAS DURANTE O MANEJO
5.1 Comorbidades
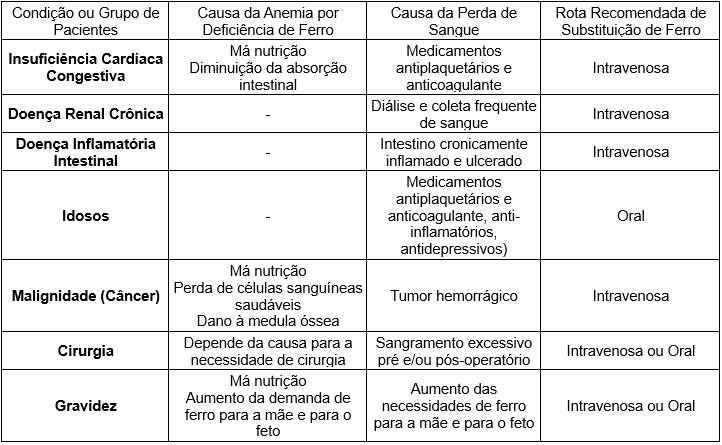
A deficiência de ferro e anemia (DFA) ocorre em muitas condições inflamatórias crônicas, incluindo insuficiência cardíaca congestiva (ICC), doença renal crônica (DRC) e doença inflamatória intestinal (DII) (Tabela 2). Para complicar ainda mais, sintomas como fadiga são comumente observados nessas condições, o que pode imitar e ser confundido com os sintomas da DFA. Consequentemente, o manejo da DFA pode muitas vezes ser negligenciado. A DFA não tratada pode ter consequências ainda mais graves nessas condições, causando uma exacerbação da doença subjacente [6].
Tabela 2: Lista de condições comuns e grupos de pacientes com maior risco de desenvolver anemia por deficiência de ferro
5.2 Insuficiência cardíaca congestiva (ICC)
Na ICC, a deficiência de ferro e anemia (DFA) é uma das comorbidades mais prevalentes [57] e pode ser resultado de múltiplos fatores, incluindo redução do apetite, aumento das perdas sanguíneas gastrointestinais devido ao uso de medicamentos antiplaquetários ou anticoagulantes, e diminuição da absorção gastrointestinal devido ao edema [58].
A dose mediana de ferro necessária para repor adequadamente as reservas de ferro em pacientes com insuficiência cardíaca congestiva (ICC) e deficiência de ferro e anemia (DFA) é de 1000mg [59]. Se os pacientes recebessem sulfato ferroso, a preparação oral de primeira linha, a biodisponibilidade seria de apenas 10% no melhor cenário [60]. Assim, os pacientes precisariam de no mínimo 50 dias com uma dose de 200mg/dia para corrigir o déficit de ferro. Realisticamente, considerando doses perdidas ou não adesão ao tratamento, pode levar até 6 meses para repor adequadamente as reservas de ferro [58]. Portanto, o ferro intravenoso deve ser considerado como primeira linha para o tratamento da deficiência de ferro na ICC. Os estudos Ferinject Assessment in Patients with Iron Deficiency and Heart Failure (FAIR-HF) e Ferric Carboxymaltose Evaluation on Performance in Patients with Iron Deficiency in Combination with Chronic Heart Failure (CONFIRM-HF) demonstraram o benefício do carboximaltose férrica em comparação com o placebo na correção da ADF, melhorando a capacidade de exercício, a função cardíaca, a gravidade dos sintomas e a qualidade de vida [61].
5.3 Doença renal crônica (DRC)
As causas da deficiência de ferro e anemia (DFA) na DRC são semelhantes às da insuficiência cardíaca congestiva (ICC), nomeadamente, redução da absorção de ferro gastrointestinal, má nutrição e perda sanguínea causada por diálise e amostras frequentes de sangue. Uma recente meta-análise e revisão sistemática demonstraram que o ferro intravenoso é mais eficaz do que o ferro oral no tratamento da DFA na DRC, independentemente da necessidade de diálise [6][62]. As diretrizes de prática clínica do Kidney Disease: Improving Global Outcomes (KDIGO) também recomendam o ferro intravenoso como tratamento de primeira linha para pacientes com DRC estágio 5 [63]. No entanto, o citrato férrico pode ser uma alternativa oral, com um estudo recente envolvendo 203 pacientes que tomaram 1g três vezes ao dia, mostrando menores taxas de hospitalização e menor incidência de morte, diálise ou transplante [64].
Apesar das evidências fornecidas para as preparações intravenosas, o ferro oral continua sendo a terapia de primeira linha para muitos clínicos e pacientes, pois é facilmente disponível, barato e evita a necessidade de acesso intravenoso, o que pode causar danos aos vasos sanguíneos que podem ser necessários no futuro para acesso vascular crítico [65]. Além disso, há preocupações em relação aos potenciais efeitos colaterais com o ferro intravenoso, incluindo anafilaxia, hipersensibilidade, suscetibilidade a infecções, eventos cardiovasculares, hipofosfatemia e sobrecarga de ferro [66]. Embora a eritropoetina humana (EPO) e os agentes estimuladores de eritropoiese (ESA) estejam em uso há décadas, eles estão associados ao agravamento da hipertensão, convulsões e formação de coágulos no acesso à diálise [67][68]. Além disso, os ESA não mostraram reduzir os desfechos adversos associados à anemia, incluindo taxa de mortalidade, hospitalizações e progressão da doença renal [69].
5.4 Doença inflamatória intestinal (DII)
A deficiência de ferro e anemia (DFA) tem sido reconhecida como uma das manifestações extraintestinais mais comuns da DII [20]. A absorção gastrointestinal (GI) de ferro é prejudicada devido à inflamação crônica do intestino, perdas sanguíneas crônicas, ressecção intestinal e má nutrição [6]. O aprimoramento do status do ferro por meio do tratamento com ferro intravenoso levou a uma melhoria significativa na qualidade de vida (QoL) dos pacientes com DII [10].
Os efeitos adversos do ferro oral são bem reconhecidos, mas têm consequências ainda mais graves em pacientes com DII. A absorção do ferro pelo trato gastrointestinal é limitada (em média 10%–20% da quantidade ingerida), e o ferro não absorvido é exposto à superfície ulcerada do intestino, o que pode causar mais danos à mucosa, além de alterações na microbiota intestinal [70]. Embora ainda não tenha sido estabelecido se o ferro oral agrava a inflamação da DII além dos modelos animais, o impacto potencial é uma preocupação significativa.
As diretrizes da European Crohn’s and Colitis Organisation (ECCO) recomendam o uso de ferro intravenoso como terapia de primeira linha em pacientes com doença ativa, anemia grave (Hb <100 g/L), aqueles que são previamente intolerantes ao ferro oral e pacientes que necessitam de tratamento concomitante com eritropoetina (EPO) [26]. No entanto, há lugar tanto para o ferro oral quanto para o intravenoso em pacientes com DII, conforme detalhado na Figura 2.
5.5 Neoplasia
A deficiência de ferro e anemia (DFA) está associada a múltiplos tipos de câncer, incluindo os do trato gastrointestinal (colo, pâncreas, esôfago, estômago), pulmão, geniturinário (cervical, próstata, testicular), mama e hematológicos (linfoma, leucemia, mieloma) [71]. Em pacientes com câncer, a deficiência de ferro está associada à fadiga e fraqueza, independentemente da presença de anemia [66].
A deficiência de ferro pode ocorrer frequentemente devido à anemia induzida por quimioterapia e à anemia da doença crônica [66]. As transfusões de sangue, a terapia com agentes estimulantes da eritropoiese (ESA) e o ferro intravenoso são as opções de tratamento para DFA em pacientes com câncer. O objetivo é melhorar a qualidade de vida (QoL) e reduzir a dependência das transfusões de sangue, que frequentemente estão associadas a complicações multiorgânicas adicionais. Os efeitos benéficos dos ESAs são limitados, e tanto a Agência Europeia de Medicamentos quanto a Administração de Alimentos e Medicamentos dos EUA (FDA) recomendaram restringir seu uso a pacientes com anemia sintomática e aqueles que estão se submetendo a quimioterapia específica [72].
Um consenso entre especialistas em câncer sugere que o ferro intravenoso deve ser utilizado em vez da suplementação oral, devido à eficácia reduzida e à pobre tolerância e adesão no caso do ferro oral [72]. Isso é corroborado por uma meta-análise de 11 estudos randomizados, onde o ferro intravenoso teve uma resposta hematopoiética melhorada na anemia induzida por quimioterapia, sem preocupações de segurança, e uma redução geral na necessidade de transfusões de sangue, em comparação com o ferro oral [73].
5.6 População Idosa
Outra população de alto risco é a dos idosos, onde a prevalência da deficiência de ferro aumenta rapidamente com a idade devido à redução da ingestão oral, absorção prejudicada e perdas excessivas [74].
Uma meta-análise de dados de ensaios mostra que o tratamento da deficiência de ferro com ferro oral e intravenoso reduz a necessidade de transfusões de sangue e aumenta os níveis de Hb, mas não impacta significativamente a mortalidade [68]. A suplementação oral é recomendada para o tratamento da deficiência de ferro e anemia ferropriva (IDA) nesta população, e doses mais baixas de ferro oral podem ser eficazes e melhor toleradas entre os pacientes idosos. Para aqueles cujo tratamento oral não foi eficaz, o tratamento intravenoso deve ser considerado para evitar efeitos adversos e tratar a anemia de forma eficaz. No entanto, adaptações potenciais da terapia oral também devem ser consideradas, como formulações líquidas ou redução da frequência da dose [74].
5.7 Deficiência de Ferro e Anemia Ferropriva (IDA) em Cirurgia
Há um crescente corpo de evidências que foca no impacto da deficiência de ferro na morbidade e mortalidade no período perioperatório. Diretrizes nacionais recentemente publicadas recomendam que a deficiência de ferro seja identificada e tratada antes e após a cirurgia [75], seja por meio de suplementação oral ou intravenosa de ferro. O ferro intravenoso é recomendado para aqueles que não conseguem tolerar o ferro oral, para pacientes com deficiência funcional de ferro e para aqueles com procedimentos cirúrgicos próximos ao momento em que a IDA foi diagnosticada [75]. Mais pesquisas são necessárias para avaliar o impacto do momento da reposição de ferro antes da cirurgia.
5.8 Anemia na Gravidez
A anemia na gravidez é definida como um nível de Hb <110g/L com níveis de ferritina <100μg/L [11]. A perda total de ferro durante a gravidez é de aproximadamente 1000mg, e, portanto, a recomendação de ingestão diária de ferro durante a gestação é de 27mg, comparado aos 8mg para a população adulta não grávida [76]. A dose usual recomendada de ferro elementar é de 80mg, equivalente a 250mg de comprimidos de sulfato ferroso [76]. O uso de ferro oral de forma intermitente tem mostrado ser eficaz tanto quanto a dose diária de ferro para aumentar os níveis de Hb, além de estar associado a uma menor incidência de efeitos adversos [77]. No entanto, uma meta-análise demonstrou que o ferro intravenoso sacarose de ferro melhorou os níveis de Hb (diferença média de 7,17g/L) e os níveis de ferritina sérica (diferença média de 49,66ug/L), enquanto o ferric carboxymaltose melhorou os níveis de Hb (diferença média de 8,52g/L), quando comparado ao sulfato ferroso oral [78]. Além disso, os efeitos colaterais foram menos comuns com as formulações parenterais, mas incluíram dor local, irritação na pele e, raramente, reações alérgicas.
5.9 Efeitos Adversos
Como discutido anteriormente, os efeitos adversos comuns do ferro oral são bem conhecidos tanto pelos profissionais de saúde quanto pelos pacientes. Os efeitos adversos potenciais do ferro intravenoso têm sido mais recentemente divulgados, à medida que se tornam mais pesquisados e compreendidos. A rara reação adversa de hipersensibilidade já é conhecida há algum tempo e tem levado ao estabelecimento de protocolos especializados e treinamento para os profissionais de saúde que administram ferro intravenoso de rotina.
Hipofosfatemia é um efeito adverso cada vez mais reconhecido do ferro intravenoso. O risco de hipofosfatemia persistente e osteomalácia pode ser maior com o ferric carboxymaltose do que com outras preparações de ferro intravenoso. Um mecanismo chave é que os carboidratos presentes no ferric carboxymaltose inibem a degradação do fator de crescimento fibroblástico 23, resultando em maior perda renal de fosfato [79]. A reposição de fosfato é uma estratégia de manejo ineficaz devido a esse mecanismo, pois qualquer fosfato reposto é perdido por meio do aumento da excreção renal [80]. Embora a significância clínica ainda não seja completamente compreendida, espera-se que tenha um efeito mais significativo nos pacientes que necessitam de doses mais altas, cursos repetidos e que estão em maior risco de desequilíbrios eletrolíticos devido à desnutrição [79].
Outro efeito adverso menos reconhecido é a extravasamento de ferro intravenoso, que pode causar descoloração da pele em forma de tatuagem, duradoura, seguida de irritação e dor no local da injeção. Embora esse efeito adverso seja considerado raro (ocorrendo em cerca de 1,6% dos casos), a mancha na pele pode durar vários meses após a infusão inicial, apesar de intervenções farmacológicas para resolver a reação [81, 82]. Embora o extravasamento de ferro intravenoso não seja esperado para causar danos, os efeitos duradouros da mancha na pele podem ter um impacto psicológico e social negativo nos pacientes, tornando imperativo que os profissionais de saúde estejam cientes desse fenômeno. Os pacientes devem ser informados sobre esse potencial efeito adverso antes da administração de ferro intravenoso.
5.10 Implicações de Custo
É fundamental considerar tanto os impactos econômicos da deficiência de ferro para o sistema de saúde quanto os custos relativos dos diferentes tipos de tratamento ao avaliar o manejo da ADF. O tratamento oral com sais férricos padrão é geralmente a opção mais acessível, apresentando administração prática e custo reduzido. Por outro lado, as preparações intravenosas de ferro tendem a ser mais onerosas, não apenas pelo valor dos medicamentos, mas também pelos recursos necessários, como infraestrutura hospitalar e internações.
Contudo, o maior impacto econômico está relacionado aos casos de ADF não tratados, que frequentemente resultam em hospitalizações de emergência e necessidade de transfusões sanguíneas, elevando substancialmente os gastos com cuidados intensivos e desfechos adversos.
Uma revisão do manejo da ADF realizada na Inglaterra entre 2012 e 2018 evidenciou que os custos com admissões hospitalares de emergência foram expressivos. Em contraste, os atendimentos ambulatoriais apresentaram um custo total semelhante, embora tenham abrangido um número significativamente maior de pacientes. Esses dados indicam a necessidade de uma estratégia nacional para padronizar e facilitar o acesso à administração eletiva do ferro intravenoso, com o objetivo de prevenir internações de emergência mais dispendiosas.
Para pacientes que não toleram a suplementação oral padrão, o ferric maltol surge como uma alternativa viável, apresentando menor custo em comparação ao tratamento intravenoso e menor incidência de efeitos adversos. Ainda assim, são necessários mais estudos que comparem diretamente essa formulação com outras opções terapêuticas disponíveis.
5.11 Olhando para o Futuro: Desenvolvimento e Redesenho de Serviços
A Anemia por Deficiência de Ferro (ADF) é o distúrbio nutricional mais comum no mundo e está associada a diversos estados comórbidos, apresentando implicações significativas na qualidade de vida. Apesar das diretrizes nacionais para o manejo da ADF, ainda persiste uma ampla variabilidade nas práticas adotadas, não apenas entre os hospitais do Serviço Nacional de Saúde (NHS), mas também entre diferentes profissionais e departamentos clínicos.
A decisão entre as terapias orais e intravenosas de ferro depende de múltiplos fatores, como o objetivo terapêutico, a resposta a tratamentos anteriores, a preferência do paciente, o custo envolvido e a facilidade de acesso aos centros de infusão.
A implementação de um protocolo padronizado, fundamentado em evidências científicas, pode reduzir significativamente essa variabilidade assistencial, ao mesmo tempo que contribui para um manejo mais custo-efetivo da ADF dentro das redes integradas de cuidados em saúde. Essa abordagem não apenas promove um tratamento mais uniforme e eficiente, como também favorece melhores desfechos clínicos, ao reduzir internações de emergência e intervenções menos eficazes.
O desenvolvimento de serviços e a reformulação das estratégias de manejo devem considerar a necessidade de flexibilidade para atender às especificidades de cada paciente, sem comprometer a qualidade e a eficiência do atendimento prestado. Ademais, é essencial incorporar os avanços científicos relativos a novos tratamentos, como o ferric maltol e as diversas formulações de ferro intravenoso, garantindo o acesso e o uso apropriado das opções terapêuticas mais eficazes e bem toleradas.
6 DISCUSSÃO
A anemia por deficiência de ferro (ADF) representa um desafio de saúde pública de ampla magnitude, afetando uma parcela significativa da população global, especialmente em grupos vulneráveis como mulheres, gestantes, crianças, idosos e pacientes com doenças crônicas. Apesar do conhecimento acumulado sobre sua fisiopatologia, diagnóstico e tratamento, ainda persistem lacunas importantes na abordagem clínica, tanto no contexto hospitalar quanto ambulatorial.
As diretrizes clínicas destacam a importância de um diagnóstico precoce da ADF, com base em parâmetros laboratoriais como hemoglobina, ferritina, saturação de transferrina e ferro sérico. No entanto, a interpretação desses marcadores ainda é dificultada por estados inflamatórios crônicos, que mascaram a real deficiência de ferro. Essa complexidade diagnóstica reforça a necessidade de uma abordagem integrada e individualizada, especialmente em pacientes com doenças como insuficiência cardíaca, doença renal crônica, doença inflamatória intestinal e neoplasias.
No que se refere ao tratamento, observa-se uma evolução significativa nas opções terapêuticas, com destaque para a transição de preparações orais convencionais para formulações inovadoras, como o ferro sucrossomal e o maltol férrico, que demonstram melhor tolerância e eficácia em populações específicas. O ferro intravenoso, embora mais custoso e dependente de estrutura hospitalar, mostra-se indispensável em situações de má absorção, intolerância oral ou necessidade de reposição rápida.
Por outro lado, a decisão terapêutica ainda é influenciada por fatores logísticos, econômicos e de acesso ao serviço de saúde. Como apontado por estudos revisados, o manejo inadequado ou tardio da ADF acarreta custos substanciais ao sistema de saúde, seja pelo aumento nas admissões de emergência, uso de transfusões sanguíneas ou impacto na qualidade de vida dos pacientes.
Outro ponto crítico é a ausência de protocolos padronizados e amplamente implementados, o que gera variações importantes entre instituições e profissionais. A adoção de estratégias baseadas em evidências, aliadas à educação contínua das equipes de saúde, é essencial para garantir uma conduta mais uniforme, eficaz e custo-efetiva.
Ademais, o artigo destaca a relevância de considerar as particularidades de grupos específicos, como gestantes e idosos, na escolha do tipo de reposição de ferro. A flexibilidade na conduta terapêutica, aliada a uma vigilância contínua quanto a efeitos adversos — especialmente com o ferro intravenoso — é fundamental para promover um cuidado seguro e centrado no paciente.
Em suma, a anemia ferropriva, apesar de amplamente estudada, continua exigindo atenção multidisciplinar. Os avanços terapêuticos, quando integrados a protocolos assistenciais padronizados e à valorização do diagnóstico precoce, oferecem perspectivas promissoras na mitigação de seus impactos clínicos, sociais e econômicos.
7 CONSIDERAÇÕES FINAIS
A anemia por deficiência de ferro (ADF) permanece como uma condição altamente prevalente e de grande relevância clínica e epidemiológica. Apesar dos avanços no entendimento de seus mecanismos fisiopatológicos, diagnóstico e tratamento, ainda são observadas importantes lacunas na conduta clínica, especialmente no que diz respeito ao diagnóstico precoce, escolha adequada da terapia e acompanhamento dos pacientes.
A incorporação de abordagens individualizadas, baseadas em evidências, é fundamental para garantir que os pacientes recebam o tratamento mais eficaz e seguro, levando em conta fatores como comorbidades, tolerabilidade aos medicamentos, custo e acesso aos serviços de saúde. A reposição oral de ferro continua sendo a primeira linha para a maioria dos casos, mas formulações mais modernas e o uso racional do ferro intravenoso demonstram ser indispensáveis em contextos específicos, contribuindo para melhor adesão ao tratamento e desfechos clínicos mais favoráveis.
A padronização dos protocolos de manejo da ADF, associada à capacitação contínua dos profissionais de saúde, é essencial para reduzir a variabilidade das práticas clínicas e promover um cuidado mais equânime e eficiente. Além disso, estratégias públicas de saúde que facilitem o acesso a métodos diagnósticos e terapêuticos são cruciais para a prevenção de complicações graves e para a melhoria da qualidade de vida dos pacientes afetados.
Portanto, o enfrentamento da anemia ferropriva exige uma atuação integrada entre profissionais da saúde, gestores e pesquisadores, com o compromisso de transformar o conhecimento científico em intervenções práticas, acessíveis e sustentáveis no cuidado aos pacientes.
REFERÊNCIAS
1. WORLD HEALTH ORGANISATION. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Vitamin and Mineral Nutrition Information System, 2011. Disponível em: https://www.who.int/vmnis/indicators/haemoglobin.pdf.
2. BATHLA, S.; ARORA, S. Prevalence and approaches to manage iron deficiency anemia (IDA). Critical Reviews in Food Science and Nutrition, 2021: 1–14.
3. SHOKRGOZAR, N.; GOLAFSHAN, H. A. Molecular perspective of iron uptake, related diseases, and treatments. Blood Research, v. 54, p. 10–16, 2019.
4. LOPEZ, A.; CACOUB, P.; MACDOUGALL, I. C. et al. Iron deficiency anaemia. The Lancet, v. 387, p. 907–916, 2016.
5. CRIELAARD, B. J.; LAMMERS, T.; RIVELLA, S. Targeting iron metabolism in drug discovery and delivery. Nature Reviews Drug Discovery, v. 16, p. 400–423, 2017.
6. CAPPELLINI, M. D.; COMIN-COLET, J.; DE FRANCISCO, A. et al. Iron deficiency across chronic inflammatory conditions: international expert opinion on definition, diagnosis, and management. American Journal of Hematology, v. 92, p. 1068–1078, 2017.
7. ÇEKIÇ, C.; İPEK, S.; ASLAN, F. et al. The effect of intravenous iron treatment on quality of life in inflammatory bowel disease patients with nonanemic iron deficiency. Gastroenterology Research and Practice, 2015: p. 582163.
8. GARCÍA-LÓPEZ, S.; BOCOS, J. M.; GISBERT, J. P. et al. High-Dose intravenous treatment in iron deficiency anaemia in inflammatory bowel disease: early efficacy and impact on quality of life. Blood Transfusion, v. 14, p. 199–205, 2016.
9. ANDRO, M.; LE SQUERE, P.; ESTIVIN, S. et al. Anaemia and cognitive performances in the elderly: a systematic review. European Journal of Neurology, v. 20, p. 1234–1240, 2013.
10. GISBERT, J. P.; BERMEJO, F.; PAJARES, R. et al. Oral and intravenous iron treatment in inflammatory bowel disease: hematological response and quality of life improvement. Inflammatory Bowel Diseases, v. 15, p. 1485–1491, 2009.
11. SNOOK, J.; BHALA, N.; BEALES, I. L. P. et al. British Society of Gastroenterology guidelines for the management of iron deficiency anaemia in adults. Gut, v. 70, p. 2030–2051, 2021.
12. SHAH, Y.; PATEL, D.; KHAN, N. Iron deficiency anemia in IBD: an overlooked comorbidity. Expert Review of Gastroenterology & Hepatology, v. 15, p. 771–781, 2021.
13. HALLBERG, L.; ROSSANDER, L.; SKÅNBERG, A. B. Phytates and the inhibitory effect of bran on iron absorption in man. American Journal of Clinical Nutrition, v. 45, p. 988–996, 1987.
14. DISLER, P. B.; LYNCH, S. R.; CHARLTON, R. W. et al. The effect of tea on iron absorption. Gut, v. 16, p. 193–200, 1975.
15. GULEC, S.; ANDERSON, G. J.; COLLINS, J. F. Mechanistic and regulatory aspects of intestinal iron absorption. American Journal of Physiology – Gastrointestinal and Liver Physiology, v. 307, p. G397–409, 2014.
16. MONSEN, E. R.; HALLBERG, L.; LAYRISSE, M. et al. Estimation of available dietary iron. American Journal of Clinical Nutrition, v. 31, p. 134–141, 1978.
17. STEIN, J.; DIGNASS, A. U. Management of iron deficiency anemia in inflammatory bowel disease – a practical approach. Annals of Gastroenterology, v. 26, p. 104–113, 2013.
18. DE SILVA, A. D.; MYLONAKI, M.; RAMPTON, D. S. Oral iron therapy in inflammatory bowel disease: usage, tolerance, and efficacy. Inflammatory Bowel Diseases, v. 9, p. 316–320, 2003.
19. WEISS, G. Anemia of chronic disorders: new diagnostic tools and new treatment strategies. Seminars in Hematology, v. 52, p. 313–320, 2015.
20. JIMENEZ, K. M.; GASCHE, C. Management of iron deficiency anaemia in inflammatory bowel disease. Acta Haematologica, v. 142, p. 30–36, 2019.
21. REINISCH, W.; STAUN, M.; BHANDARI, S. et al. State of the iron: how to diagnose and efficiently treat iron deficiency anemia in inflammatory bowel disease. Journal of Crohn’s and Colitis, v. 7, p. 429–440, 2013.
22. CAMASCHELLA, C. Iron deficiency. Blood, v. 133, p. 30–39, 2019.
23. TOLKIEN, Z.; STECHER, L.; MANDER, A. P. et al. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PLoS ONE, v. 10, e0117383, 2015.
24. PASRICHA, S.-R.; TYE-DIN, J.; MUCKENTHALER, M. U. et al. Iron deficiency. The Lancet, v. 397, p. 233–248, 2021.
25. SUMMARY OF PRODUCT CHARACTERISTICS (SMPC): ferrous sulfate tablets 200mg, 2020. Disponível em: https://www.medicines.org.uk/emc/product/4231/smpc#gref.
26. DIGNASS, A. U.; GASCHE, C.; BETTENWORTH, D. et al. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases. Journal of Crohn’s and Colitis, v. 9, p. 211–222, 2015.
27. COMPENDIUM, E.M. Summary of product characteristics (SMPC): ferrous sulfate tablets 200mg. Disponível em: https://www.medicines.org.uk/emc/product/4231/smpc#gref.
28. STOFFEL, N. U.; ZEDER, C.; BRITTENHAM, G. M. et al. Iron absorption from supplements is greater with alternate day than with consecutive day dosing in iron-deficient anemic women. Haematologica, v. 105, p. 1232–1239, 2020.
29. RIMON, E.; KAGANSKY, N.; KAGANSKY, M. et al. Are we giving too much iron? Low-dose iron therapy is effective in octogenarians. American Journal of Medicine, v. 118, p. 1142–1147, 2005.
30. MORETTI, D.; GOEDE, J. S.; ZEDER, C. et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood, v. 126, p. 1981–1989, 2015.
31. FORMULARY, B. N. Sodium Feredetat. Disponível em: https://www.nice.org.uk/bnf-uk-only.
32. REVANKAR, V. M.; GARG, A.; GARG, A. et al. Efficacy of sodium feredetate versus ferrous sulfate in iron deficiency anemia in pregnant women. International Journal of Reproduction, Contraception, Obstetrics and Gynecology, v. 6, p. 1978, 2017.
33. BARRAND, M. A.; CALLINGHAM, B. A.; DOBBIN, P. et al. Dissociation of a ferric maltol complex and its subsequent metabolism during absorption across the small intestine of the rat. British Journal of Pharmacology, v. 102, p. 723–729, 1991.
34. CANCELO-HIDALGO, M. J.; CASTELO-BRANCO, C.; PALACIOS, S. et al. Tolerability of different oral iron supplements: a systematic review. Current Medical Research and Opinion, v. 29, p. 291–303, 2013.
35. PEREIRA, D. I. A.; BRUGGRABER, S. F. A.; FARIA, N. et al. Nanoparticulate iron(III) oxo-hydroxide delivers safe iron that is well absorbed and utilised in humans. Nanomedicine, v. 10, p. 1877–1886, 2014.
36. SCHMIDT, C.; AHMAD, T.; TULASSAY, Z. et al. Ferric maltol therapy for iron deficiency anaemia in patients with inflammatory bowel disease: long-term extension data from a phase 3 study. Alimentary Pharmacology & Therapeutics, v. 44, p. 259–270, 2016.
37. GASCHE, C.; AHMAD, T.; TULASSAY, Z. et al. Ferric maltol is effective in correcting iron deficiency anaemia in patients with inflammatory bowel disease: results from a phase-3 clinical trial program. Inflammatory Bowel Diseases, v. 21, p. 579–588, 2015.
38. HOWALDT, S. et al. Long-term effectiveness of oral ferric maltol vs intravenous ferric carboxymaltose for the treatment of iron-deficiency anemia in patients with inflammatory bowel disease: a randomized controlled noninferiority trial. Inflammatory Bowel Diseases, 2021.
39. BASTIDA, G.; HERRERA-DE GUISE, C.; ALGABA, A. et al. Sucrosomial iron supplementation for the treatment of iron deficiency anemia in inflammatory bowel disease patients refractory to oral iron treatment. Nutrients, v. 13, 2021. doi:10.3390/nu13061770. [Epub ahead of print: 22 May 2021].
40. GÓMEZ-RAMÍREZ, S.; BRILLI, E.; TARANTINO, G. et al. Sucrosomial® iron: a new generation iron for improving oral supplementation. Pharmaceuticals, v. 11, p. 97, 2018.
41. MAFODDA, A.; GIUFFRIDA, D.; PRESTIFILIPPO, A. et al. Oral sucrosomial iron versus intravenous iron in anemic cancer patients without iron deficiency receiving darbepoetin alfa: a pilot study. Supportive Care in Cancer, v. 25, p. 2779–2786, 2017.
42. ELLI, L.; FERRETTI, F.; BRANCHI, F. et al. Sucrosomial iron supplementation in anemic patients with celiac disease not tolerating oral ferrous sulfate: a prospective study. Nutrients, v. 10, p. 330, 2018.
43. CIUDIN, A.; SIMÓ-SERVAT, O.; BALIBREA, J. M. et al. Response to oral sucrosomial iron supplementation in patients undergoing bariatric surgery. The BARI-FER study. Endocrinología, Diabetes y Nutrición, v. 65, p. 17–20, 2018.
44. GIORDANO, G.; NAPOLITANO, M.; DI BATTISTA, V. et al. Oral high-dose sucrosomial iron vs intravenous iron in sideropenic anemia patients intolerant/refractory to iron sulfate: a multicentric randomized study. Annals of Hematology, v. 100, p. 2173–2179, 2021.
45. LEE, T. W.; KOLBER, M. R.; FEDORAK, R. N. et al. Iron replacement therapy in inflammatory bowel disease patients with iron deficiency anemia: a systematic review and meta-analysis. Journal of Crohn’s and Colitis, v. 6, p. 267–275, 2012.
46. RODGERS, G. M.; AUERBACH, M.; CELLA, D. et al. High-molecular weight iron dextran: a wolf in sheep’s clothing? Journal of the American Society of Nephrology, v. 19, p. 833–834, 2008.
47. WYSOWSKI, D. K.; SWARTZ, L.; BORDERS-HEMPHILL, B. V. et al. Use of parenteral iron products and serious anaphylactic-type reactions. American Journal of Hematology, v. 85, p. 650–654, 2010.
48. MICHAEL, B.; COYNE, D. W.; FISHBANE, S. et al. Sodium ferric gluconate complex in hemodialysis patients: adverse reactions compared to placebo and iron dextran. Kidney International, v. 61, p. 1830–1839, 2002.
49. WANG, C.; GRAHAM, D. J.; KANE, R. C. et al. Comparative risk of anaphylactic reactions associated with intravenous iron products. JAMA, v. 314, p. 2062–2068, 2015.
50. JOINT UNITED KINGDOM (UK) BLOOD TRANSFUSION AND TISSUE TRANSPLANTATION SERVICES PROFESSIONAL ADVISORY COMMITTEE. Parenteral iron, 2014. Disponível em: https://www.transfusionguidelines.org/transfusion-handbook/6-alternatives-and-adjuncts-to-bloodtransfusion/6-4-parenteral-iron.
51. EVSTATIEV, R.; MARTEAU, P.; IQBAL, T. et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology, v. 141, e1–2:846–853, 2011.
52. VILLANUEVA, C.; COLOMO, A.; BOSCH, A. et al. Transfusion strategies for acute upper gastrointestinal bleeding. New England Journal of Medicine, v. 368, p. 11–21, 2013.
53. BUX, J. Transfusion-related acute lung injury (TRALI): a serious adverse event of blood transfusion. Vox Sanguinis, v. 89, p. 1–10, 2005.
54. BIHL, F.; CASTELLI, D.; MARINCOLA, F. et al. Transfusion-transmitted infections. Journal of Translational Medicine, v. 5, p. 25, 2007.
55. GUINET, F.; CARNIEL, E.; LECLERCQ, A. Transfusion-transmitted Yersinia enterocolitica sepsis. Clinical Infectious Diseases, v. 53, p. 583–591, 2011.
56. KOPKO, P. M.; HOLLAND, P. V. Mechanisms of severe transfusion reactions. Transfusion Clinique et Biologique, v. 8, p. 278–281, 2001.
57. KLIP, I. T.; COMIN-COLET, J.; VOORS, A. A. et al. Iron deficiency in chronic heart failure: an international pooled analysis. American Heart Journal, v. 165, p. 575–582, 2013.
58. MCDONAGH, T.; MACDOUGALL, I. C. Iron therapy for the treatment of iron deficiency in chronic heart failure: intravenous or oral? European Journal of Heart Failure, v. 17, p. 248–262, 2015.
59. FILIPPATOS, G.; FARMAKIS, D.; COLET, J. C. et al. Intravenous ferric carboxymaltose in iron-deficient chronic heart failure patients with and without anaemia: a subanalysis of the FAIR-HF trial. European Journal of Heart Failure, v. 15, p. 1267–1276, 2013.
60. NIELSEN, P.; KONGI, R.; BUGGISCH, P. et al. Bioavailability of oral iron drugs as judged by a 59Fe-whole-body counting technique in patients with iron deficiency anaemia. Therapeutic efficacy of iron(II)-glycine sulfate. Arzneimittelforschung, v. 55, p. 376–381, 2005.
61. PONIKOWSKI, P.; VAN VELDHUISEN, D. J.; COMIN-COLET, J. et al. Rationale and design of the CONFIRM-HF study: a double-blind, randomized, placebo-controlled study to assess the effects of intravenous ferric carboxymaltose on functional capacity in patients with chronic heart failure and iron deficiency. ESC Heart Failure, v. 1, p. 52–58, 2014.
62. SHEPSHELOVICH, D.; ROZEN-ZVI, B.; AVNI, T. et al. Intravenous versus oral iron supplementation for the treatment of anemia in CKD: an updated systematic review and meta-analysis. American Journal of Kidney Diseases, v. 68, p. 677–690, 2016.
63. LOCATELLI, F.; NISSENSON, A. R.; BARRETT, B. J. et al. Clinical practice guidelines for anemia in chronic kidney disease: problems and solutions. A position statement from kidney disease: improving global outcomes (KDIGO). Kidney International, v. 74, p. 1237–1240, 2008.
64. BLOCK, G. A.; BLOCK, M. S.; SMITS, G. et al. A pilot randomized trial of ferric citrate coordination complex for the treatment of advanced CKD. Journal of the American Society of Nephrology, v. 30, p. 1495–1504, 2019.
65. GUTIÉRREZ, O. M. Treatment of iron deficiency anemia in CKD and end-stage kidney disease. Kidney International Reports, v. 6, p. 2261–2269, 2021.
66. KASSIANIDES, X.; HAZARA, A. M.; BHANDARI, S. Improving the safety of intravenous iron treatments for patients with chronic kidney disease. Expert Opinion on Drug Safety, v. 20, p. 23–35, 2021.
67. ESCHBACH, J. W.; EGRIE, J. C.; DOWNING, M. R. et al. Correction of the anemia of end-stage renal disease with recombinant human erythropoietin. Results of a combined phase I and II clinical trial. New England Journal of Medicine, v. 316, p. 73–78, 1987.
68. WINEARLS, C. G.; OLIVER, D. O.; PIPPARD, M. J. et al. Effect of human erythropoietin derived from recombinant DNA on the anaemia of patients maintained by chronic haemodialysis. The Lancet, v. 2, p. 1175–1178, 1986.
69. KDOQI, NATIONAL KIDNEY FOUNDATION. KDOQI clinical practice guidelines and clinical practice recommendations for anemia in chronic kidney disease. American Journal of Kidney Diseases, v. 47, Suppl. 3, p. S11–S145, 2006.
70. KULNIGG, S.; GASCHE, C. Systematic review: managing anaemia in Crohn’s disease. Alimentary Pharmacology & Therapeutics, v. 24, p. 1507–1523, 2006.
71. NAOUM, F. A. Iron deficiency in cancer patients. Revista Brasileira de Hematologia e Hemoterapia, v. 38, p. 325–330, 2016.
72. AAPRO, M.; ÖSTERBORG, A.; GASCÓN, P. et al. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v. iron. Annals of Oncology, v. 23, p. 1954–1962, 2012.
73. GAFTER-GVILI, A.; ROZEN-ZVI, B.; VIDAL, L. et al. Intravenous iron supplementation for the treatment of chemotherapy-induced anaemia – systematic review and meta-analysis of randomised controlled trials. Acta Oncologica, v. 52, p. 18–29, 2013.
74. BURTON, J. K.; YATES, L. C.; WHYTE, L. et al. New horizons in iron deficiency anaemia in older adults. Age and Ageing, v. 49, p. 309–318, 2020.
75. NATIONAL INSTITUTE OF CLINICAL EXCELLENCE (NICE). Perioperative care in adults (NICE guidance no 180), 2020. Disponível em: https://www.nice.org.uk/guidance/ng180.
76. KHALAFALLAH, A. A.; DENNIS, A. E. Iron deficiency anaemia in pregnancy and postpartum: pathophysiology and effect of oral versus intravenous iron therapy. Journal of Pregnancy, v. 2012, p. 1–10, 2012.
77. PENA-ROSAS, J. P. et al. Intermittent oral iron supplementation during pregnancy. Cochrane Database of Systematic Reviews, 2015;10:CD009997.
78. ROGOZIŃSKA, E.; DARU, J.; NICOLAIDES, M. et al. Iron preparations for women of reproductive age with iron deficiency anaemia in pregnancy (FRIDA): a systematic review and network meta-analysis. The Lancet Haematology, v. 8, p. e503–e512, 2021.
79. MEDICINES AND HEALTHCARE PRODUCTS REGULATORY AGENCY (MHRA). Ferric carboxymaltose: risk of symptomatic hypophosphataemia leading to osteomalacia and fractures, 2020. Disponível em: https://www.gov.uk/drug-safety-update/ferric-carboxymaltose-ferinject-risk-of-symptomatic-hypophosphataemia-leading-to-osteomalacia-and-fractures.
80. WOLF, M.; KOCH, T. A.; BREGMAN, D. B. Effects of iron deficiency anemia and its treatment on fibroblast growth factor 23 and phosphate homeostasis in women. Journal of Bone and Mineral Research, v. 28, p. 1793–1803, 2013.
81. CROWLEY, C. M.; MCMAHON, G.; DESMOND, J. et al. Skin staining following intravenous iron infusion. BMJ Case Reports, v. 12, 2019. doi:10.1136/bcr2018-229113.
82. HARRIS, R. E.; GARRICK, V.; CURTIS, L. et al. Skin staining due to intravenous iron extravasation in a teenager with Crohn’s disease. Archives of Disease in Childhood, v. 105, p. 362, 2020.
83. BROOKES, M. J.; FARR, A.; PHILLIPS, C. J. et al. Management of iron deficiency anaemia in secondary care across England between 2012 and 2018: a real-world analysis of hospital episode statistics. Frontline Gastroenterology, v. 12, p. 363–369, 2021.
84. KUMAR, A.; BROOKES, M. J. Iron therapy in inflammatory bowel disease. Nutrients, v. 12, p. 3478, 2020.
85. SOUTH EAST LONDON IBD PATHWAY DEVELOPMENT GROUP. Iron deficiency treatment pathway for patients with IBD (pathway 5), 2019. Disponível em: https://selondonccg.nhs.uk/wp-content/uploads/dlm_uploads/2021/09/IBD-pathways-with-Fe-deficiency-pathway-June-2019-FINAL.pdf.
86. LANE, D. J. R.; BAE, D.-H.; MERLOT, A. M.; SAHNI, S.; RICHARDSON, D. R. Duodenal cytochrome b (DCYTB) in iron metabolism: an update on function and regulation. Nutrients, v. 7, n. 4, p. 2274–2296, 2015. Disponível em: https://doi.org/10.3390/nu7042274.
87. BARRAGÁN-IBAÑEZ, G.; SANTOYO-SÁNCHEZ, A.; RAMOS-PEÑAFIEL, C. O. Iron deficiency anaemia / Anemia por deficiencia de hierro. Revista Hematología, Hematology, Transfusion and Cell Therapy, [S.l.], v. 16, n. 4, p. 189–195, 2015. Disponível em: https://doi.org/10.1016/j.hgmx.2015.06.008. Acesso em: 6 abr. 2025.
1Discente do Curso Superior de Enfermagem, FACULDADE ISEIB DE BETIM (FISBE)
2Discente do Curso Superior de Farmácia, Centro Universitário Santa Rita, Conselheiro Lafaiete – MG
3Biomédica, Centro Universitário Santa Rita, Conselheiro Lafaiete – MG
4Discente do Curso Superior de Biomedicina, Centro Universitário UNA, Conselheiro Lafaiete – MG
5Psicólogo, Hospital João XXIII (FHEMIG), Belo Horizonte – MG
6Enfermeiro, Prefeitura Municipal de Belo Horizonte – MG
7Discente do Curso Superior de Biomedicina, Centro Universitário Leonardo da Vinci, Indaial – SC
8Discente do Curso Superior de Farmácia, Centro Universitário Leonardo da Vinci, Indaial – SC
9Enfermeiro, Centro Universitário Santa Rita, Conselheiro Lafaiete – MG
10Biomédico, Hospital João XXIII (FHEMIG), Belo Horizonte – MG
11Biólogo, Secretaria Municipal de Educação (SEMED), Morrinhos – GO
